
Reakcje w roztworach
wodnych
mgr inż. Joanna Sławna
„Corpora non agunt nisi
soluta”
Ciała mogą reagować tylko w
roztworach
„Corpora non agunt nisi
soluta”
Ciała mogą reagować tylko w
roztworach

Substancje możemy
podzielić na:
elektrolity – wodne roztwory tych
substancji przewodzą prąd
elektryczny (kwasy, zasady, sole)
nieelektrolity – ich wodne
roztwory nie przewodzą prądu
elektrycznego (cukier, alkohole)

Teoria dysocjacji
elektrolitycznej
Założenia:
1. Podczas rozpuszczania w wodzie niektórych
substancji następuje ich samorzutny rozpad
na jony dodatnie (kationy) i ujemne (aniony)
2. Powstające kationy i aniony mają wpływ na
właściwości chemiczne roztworu
3. Nie wszystkie substancje w jednakowym
stopniu rozpadają się na jony
dysocjacja – samorzutny rozpad
na jony
Kwasy, zasady i sole wg
Arrheniusa
kwasy to substancje, które
dysocjują na kationy wodorowe i
aniony reszt kwasowych
zasady to substancje, które
dysocjują na kationy metali i
aniony wodorotlenowe
sole to substancje, które
dysocjują na kationy metali i
aniony reszt kwasowych
x
O
H
x
R
xH
R
H
2
nOH
M
OH
Me
n
O
H
n
2
)
(
n
m
O
H
m
n
mR
nM
R
M
2

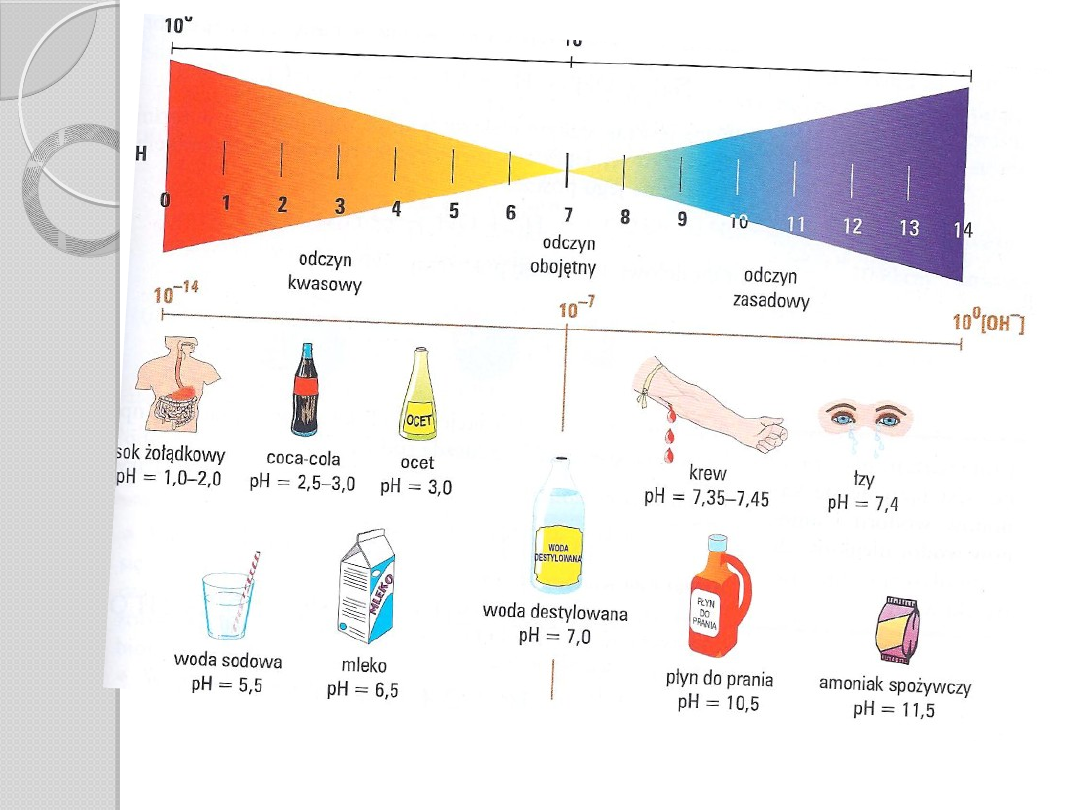
Odczyn roztworów
wodnych
roztwory kwasów mają odczyn
kwaśny wywołany obecnością jonów
H+
roztwory wodorotlenków (zasady)
moją odczyn zasadowy wywołany
obecnością jonów OH-
gdy stężenie jonów H+ i OH- są
równe odczyn roztworu jest obojętny
miarą kwasowości i zasadowości jest
pH roztworu
H
pH
log

Reakcje zobojętniania
reakcje kwasów z zasadami
łączenie kationów wodoru i
anionów wodorotlenowych w
niezdysocjowane cząsteczki wody
Zadanie:
1.
Napisz równania reakcji zobojętniania kwasu
fosforowego (V) zasadą sodową, kwasu siarkowego
(VI) zasadą wapniową, kwasu solnego zasadą
potasową. Podaj nazwy soli powstających w tych
reakcjach.
O
H
OH
H
2

Powinieneś:
umieć napisać równania
procesów dysocjacji kwasów,
zasad i soli
umieć nazwać powstające jony
umieć za pomocą równań reakcji
przedstawić przebieg dowolnej
reakcji zobojętniania
Document Outline
- Slide 1
- Substancje możemy podzielić na:
- Teoria dysocjacji elektrolitycznej
- Kwasy, zasady i sole wg Arrheniusa
- Odczyn roztworów wodnych
- Slide 6
- Reakcje zobojętniania
- Powinieneś:
Wyszukiwarka
Podobne podstrony:
1 5 1 Reakcje w roztworach wodnych
reakcje w roztworach wodnych, Studia, I rok, I rok, I semestr, Chemia I
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
Reakcje w roztworach wodnych, chemia
1 5 2 Reakcje w roztworach wodnych +Odpowiedzi
Arkusz WSiP Reakcje w roztworach wodnych
reakcje w roztworach wodnych
1 5 2 Reakcje w roztworach wodnych +Odpowiedzi
1 5 1 Reakcje w roztworach wodnych
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
reakcje chemicznew roztworach wodnych zadania
reakcje chemicznew roztworach wodnych, Matura Chemia Rozszerzona, Podręczniki, Notatki
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
więcej podobnych podstron