
„Jak przebiega reakcja metali i
ich tlenków z wodą.”
Patrycja Radomska
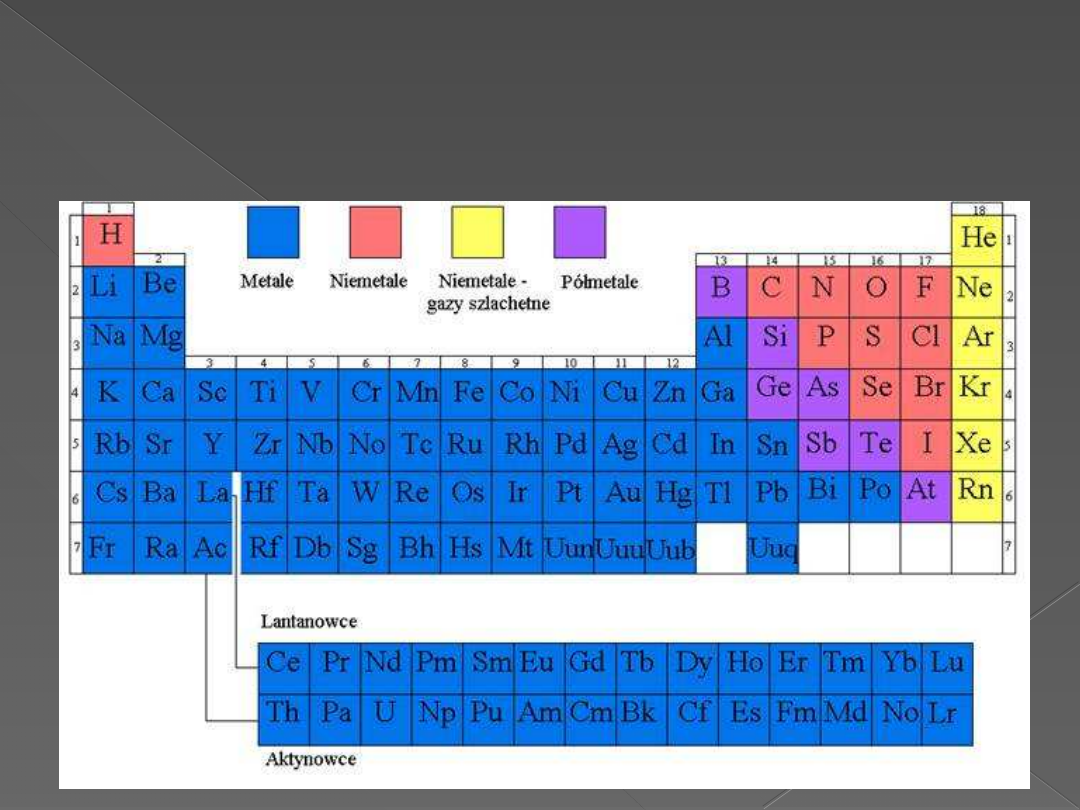
Rozmieszczenie metali i
niemetali w układzie okresowym.
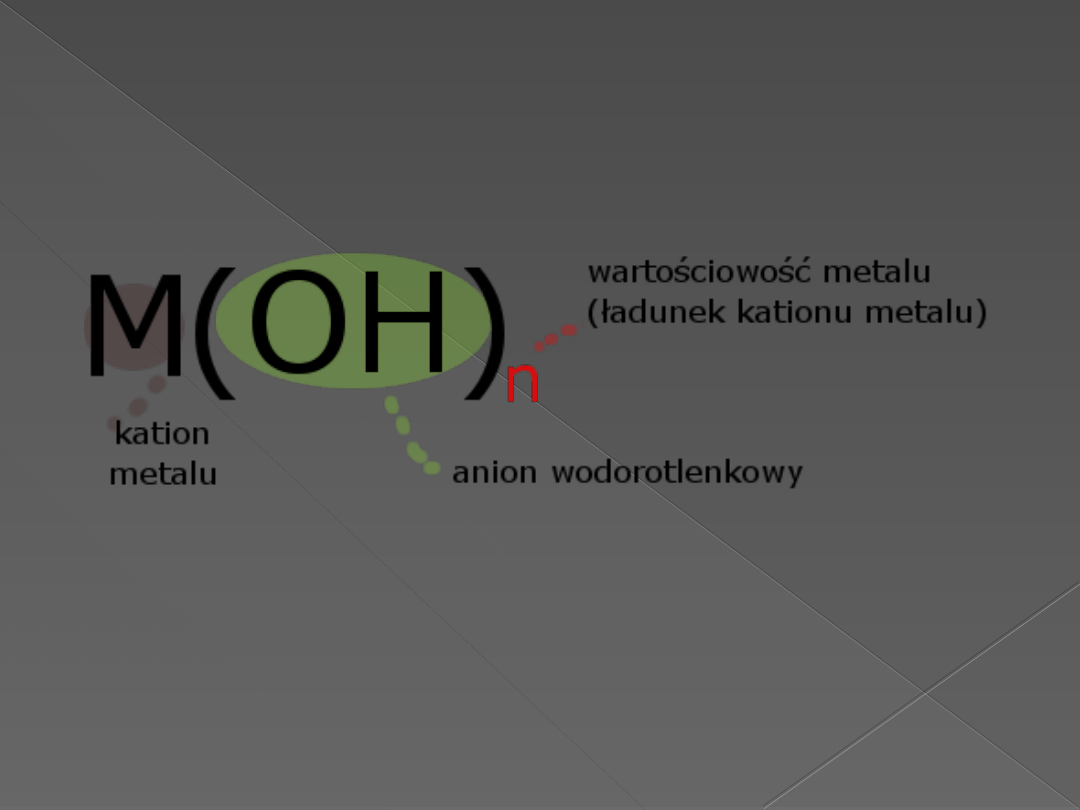
Wodorotlenki – wzór ogólny
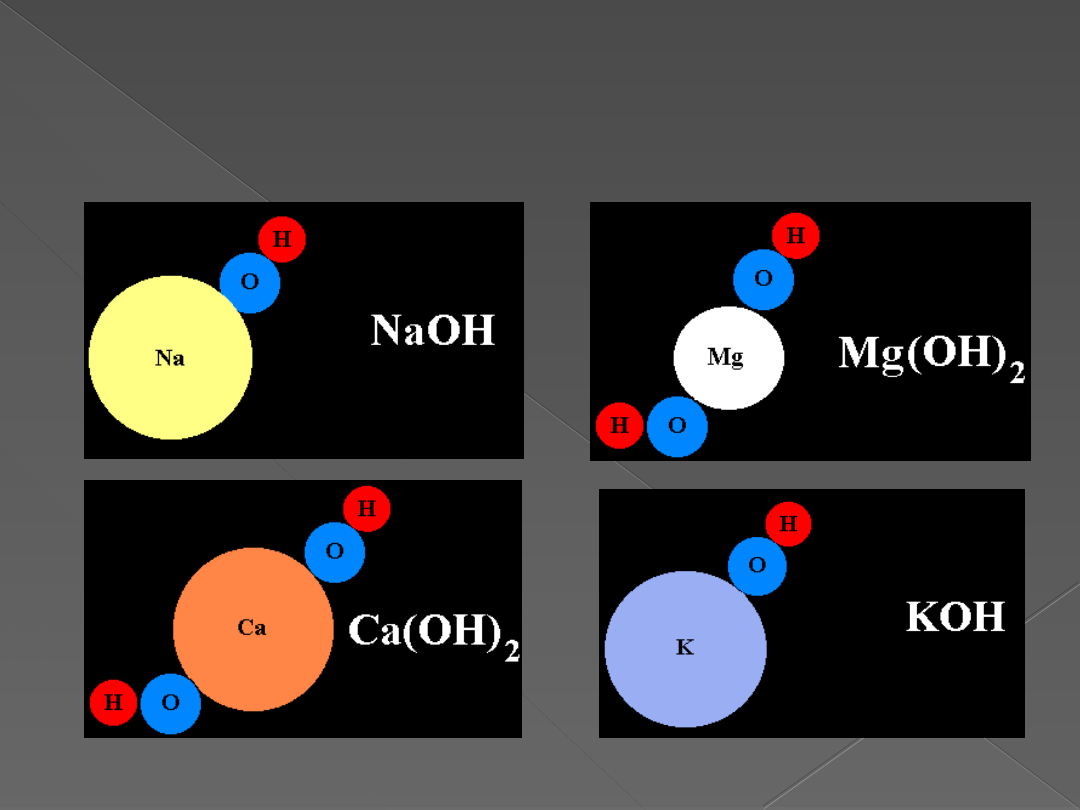
Przykładowe wodorotlenki 1 i
2 grupy układu okresowego.

Wskaźnik- związek chemiczny, który
posiada zdolność zmiany barwy w
roztworze wodnym o różnym odczynie
Roztwór kwasowy: bezbarwna
Roztwór obojętny: bezbarwna
Roztwór zasadowy:
malinowa
Barwy wskaźników -
fenoloftaleina

Barwy wskaźników - oranż
metylowy
Roztwór kwasowy:
czerwona
Roztwór obojętny:
żółta
Roztwór zasadowy:
pomarańczowa

Barwy wskaźników – papierki
uniwersalne
Roztwór kwasowy:
czerwona
Roztwór obojętny:
żółta
Roztwór zasadowy:
zielononiebieska
BHP
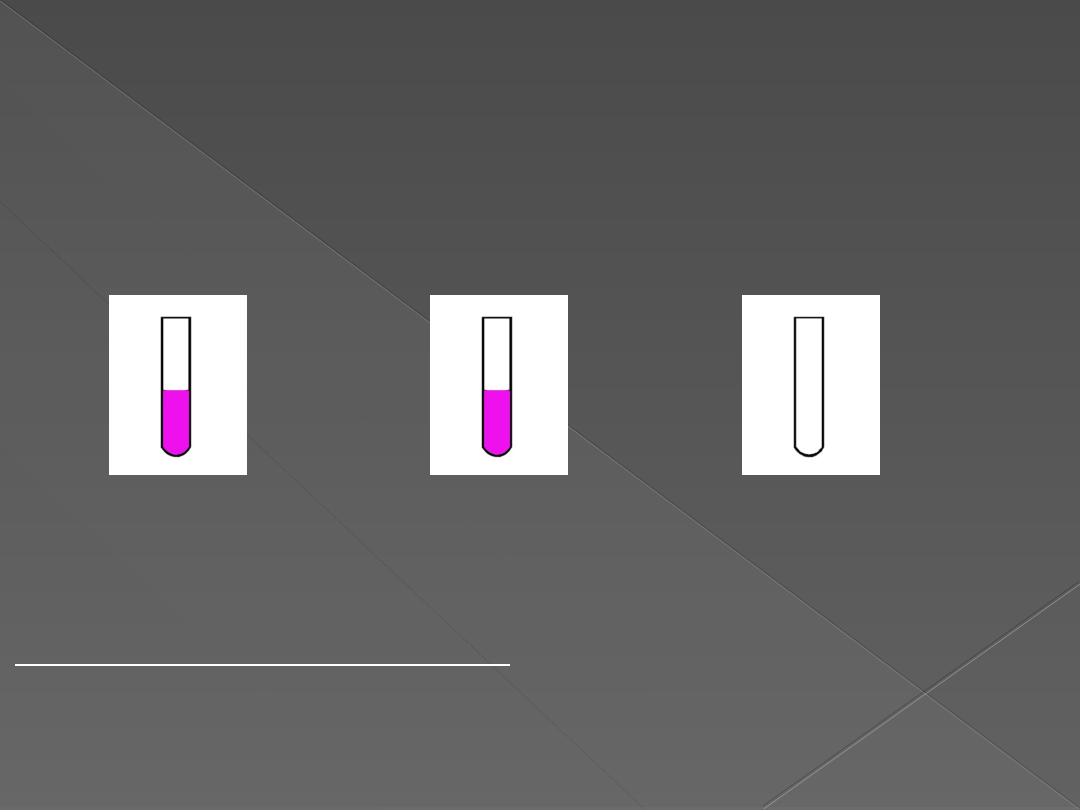
DOŚWIADCZENIE 1
„Badanie zachowania się tlenku magnezu,
tlenku wapnia i tlenku żelaza (III) wobec wody”
MgO CaO Fe
2
O
3
H
2
O + fenoloftaleina
Opis wykonywanego doświadczenia:
Do trzech probówek wlej około 5cm
3
wody destylowanej i kilka kropel
fenoloftaleiny, a następnie wsyp kolejno: do pierwszej probówki niewielka
ilość tlenku magnezu, do drugiej probówki tlenku wapnia i do trzeciej
probówki tlenku żelaza (III). Zawartość probówek wymieszaj bagietką.

Obserwacje:
Wskaźnik zmienił barwę na malinową w probówce I, gdzie
umieszczony został tlenek magnezu i w probówce II, gdzie
umieszczony został tlenek wapnia
W probówce III, gdzie znajdował się tlenek żelaza (III)
wskaźnik nie zmienił zabarwienia.
Wnioski:
Tlenek magnezu i tlenek wapnia reagują z wodą. Powstały
nowe substancje.
Tlenek żelaza (III) nie reaguje z wodą. : Substancje, które
powstały to wodorotlenek magnezu i wodorotlenek wapnia,
które mają odczyn zasadowy.

Ogólny schemat reakcji 1 metody
otrzymywania wodorotlenków
metali aktywnych
Tlenek metali aktywnych + woda wodorotlenek metalu
aktywnego
Równania reakcji z przeprowadzonych doświadczeń:
1
2
3 Fe
2
O
3
+ H
2
O X
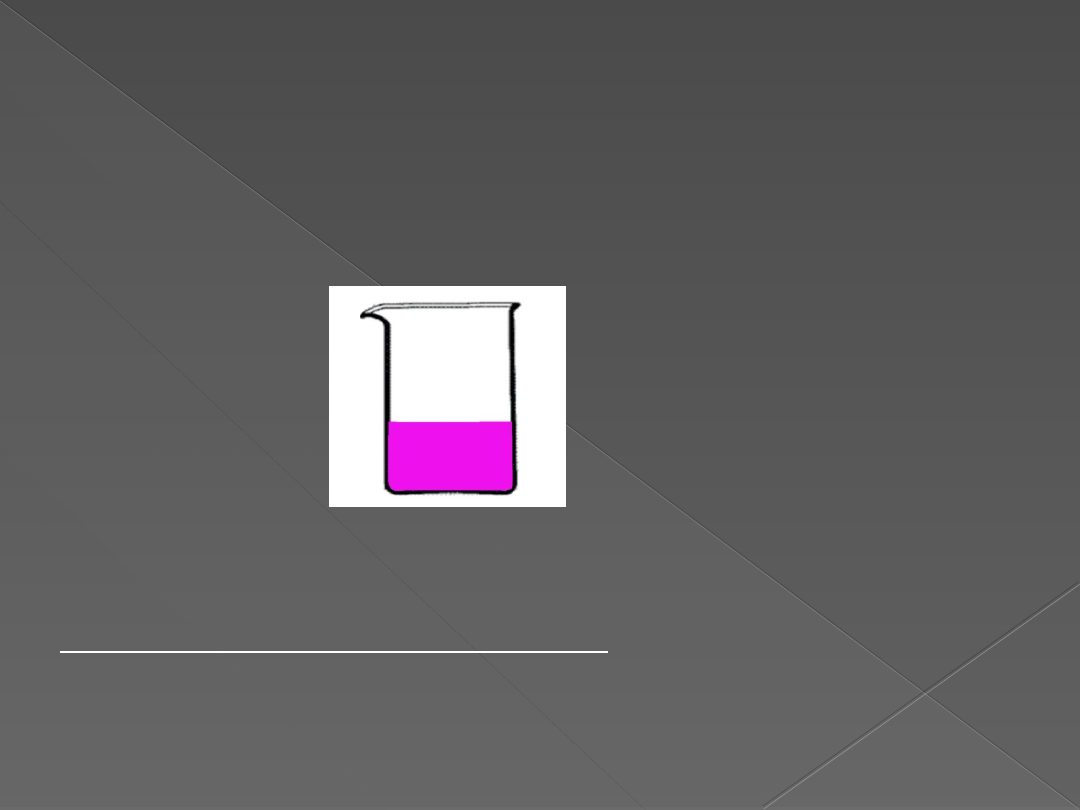
DOŚWIADCZENIE 2
„Badanie zachowanie się sodu, magnezu i miedzi
wobec wody w obecności fenoloftaleiny”
Na
I
H
2
O + fenoloftaleina
Opis wykonywanego doświadczenia:
Do zlewki wlewamy wodę i kilka kropel fenoloftaleiny, a
następnie wrzucamy przygotowaną małą grudkę sodu. Do
zlewki zbliżamy zapalone łuczywko.
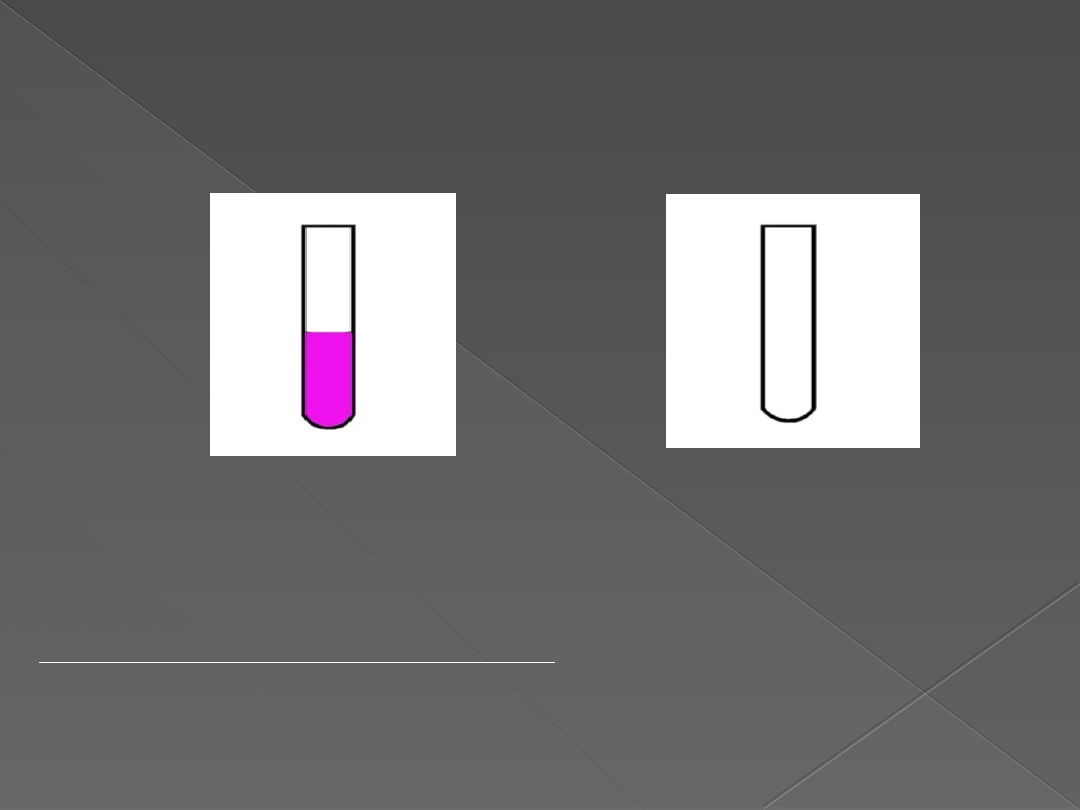
Mg Cu
II III
H
2
O + fenoloftaleina
Opis wykonywanego doświadczenia:
Do dwóch probówek wlewamy wodę i kilka kropel fenoloftaleiny, a następnie
dodajemy kolejno magnez i miedź. Probówkę z magnezem podgrzewamy.
Do wylotu probówek zbliżamy zapałkę.

Obserwacje:
Wskaźnik – fenoloftaleina dodany do roztworów w I
zlewce i II probówce zmienił barwę na malinową. W III
probówce brak zmiany barwy wskaźnika. Reakcja w
zlewce przebiegała gwałtownie. Wydzielał się gaz.
Wydzielający się gaz zapalił się z gwizdem. Po ogrzaniu
probówki II barwa wskaźnika jest bardziej intensywna.
Wnioski:
Sód i magnez reagują z wodą. Miedź nie reaguje z wodą.
Sód jest pierwiastkiem aktywniejszym od magnezu,
reakcja zachodzi gwałtownie. Magnez reaguje z wodą po
ogrzaniu. Powstają nowe substancje o charakterze
zasadowym- wodorotlenek sodu i wodorotlenek
magnezu. Gaz który się wydziela to wodór.

Ogólny schemat reakcji 2 metody
otrzymywania wodorotlenków
metali aktywnych
Metal aktywny + woda wodorotlenek metalu aktywnego +
wodór
Równania reakcji z przeprowadzonych doświadczeń:
1. 2 Na + H
2
O 2NaOH + H
2
2. Mg + 2H
2
O Mg(OH)
2
+ H
2
3. Cu + H
2
O X

Metody otrzymywania
wodorotlenków metali aktywnych
Tlenek metali aktywnych + woda wodorotlenek metalu
aktywnego
Metal aktywny + woda wodorotlenek metalu aktywnego
+ wodór
Document Outline
- Slide 1
- Rozmieszczenie metali i niemetali w układzie okresowym.
- Wodorotlenki – wzór ogólny
- Przykładowe wodorotlenki 1 i 2 grupy układu okresowego.
- Slide 5
- Barwy wskaźników - oranż metylowy
- Barwy wskaźników – papierki uniwersalne
- BHP
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Metody otrzymywania wodorotlenków metali aktywnych
Wyszukiwarka
Podobne podstrony:
Związki chemiczne produkty reakcji tlenków z wodą
Jak w prosty sposób zapisać przebieg reakcji chemicznych
10 REAKCJE METALI Z WODĄ, KWASAMI, ZASADAMI
Związki chemiczne produkty reakcji tlenków z wodą
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak kupowac nieruchomosci ponizej ich wartosci rynkowej(1)
jak kupowac nieruchomosci ponizej ich wartosci rynkowej
reakcje metali z kwasami wniosek zadanie domowe
1 Metody identyfikacji metali i ich stopówid 10322
Jak przebiega proces trwałej ondulacji na gorąco i trwałej ondulacji parowej, fryzjerstwo
7 Jak przebiega rozwój człowieka w procesie ontogenetycznym
Jak w przedszkolu zapoznać dzieci z ich prawami i obowiązkami
Tropem kanapki czyli jak przebiega proces trawienia w ludzkim organizmie
Jak kupować nieruchomosci poniżej ich wartości rynkowej
4 Stopy metali i ich struktura1 (PPTminimizer) 2
jak kupowac nieruchomosci ponizej ich wartosci rynkowej
więcej podobnych podstron