
Alkohole
Chemia organiczna

Alkohole
Właściwości fizyczne i chemiczne
Otrzymywanie alkoholi
Główne alkohole i ich zastosowanie
Klasyfikacja alkoholi
Menu

Alkohole
Związki organiczne, które zawierają jedną
lub
więcej
grup
hydroksylowych
przyłączonych do nasyconych atomów
węgla.
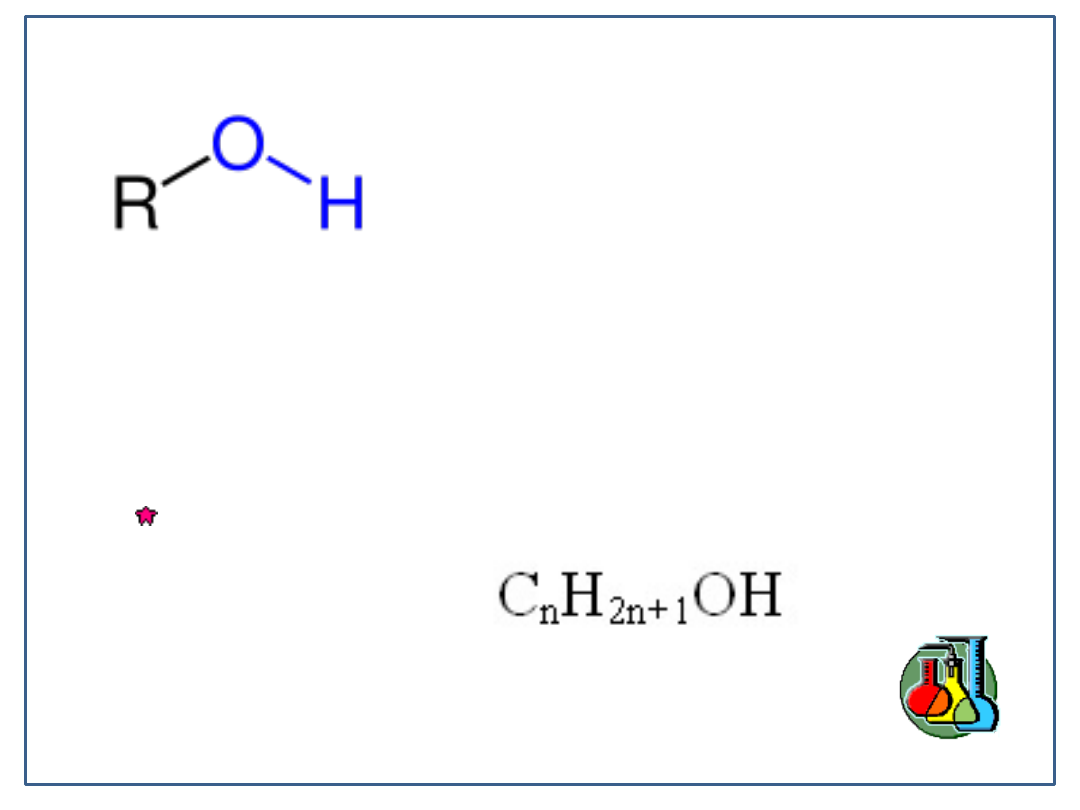
Wzór ogólny alkoholi, gdzie R to
grupa węglowodorowa, a –OH to
grupa hydroksylowa.
Najprostsze alkohole zawierają jedną grupę hydroksylową w
cząsteczce. Nazywają się alkoholami monohydroksylowymi
(alkanole).
Ich wzór ogólny to:
Nazwy alkoholi tworzy się
poprzez dodanie końcówki
-ol z odpowiednim lokantem
do nazwy macierzystego
związku.
Węglowodór
Alkohol
Metan
Metanol
Etan
Etanol
Propan
Propanol
Butan
Butanol

Właściwości fizyczne i chemiczne
Alkohole
:
To ciecze, które reagują z kwasami,
Mają odczyn obojętny, dlatego nie ulegają dysocjacji jonowej,
Rozpuszczają się w wodzie.
Niższe alkohole (np. metanol, etanol) mają niskie temperatury
wrzenia i dużą lotność.

Właściwości chemiczne alkoholi to:
Reakcja alkoholi z sodem
Reakcja z chlorowcowodorami
Eliminacja wody
Reakcja glicerolu z HNO
3
– reakcja estryfikacji
(powstaje nitrogliceryna)
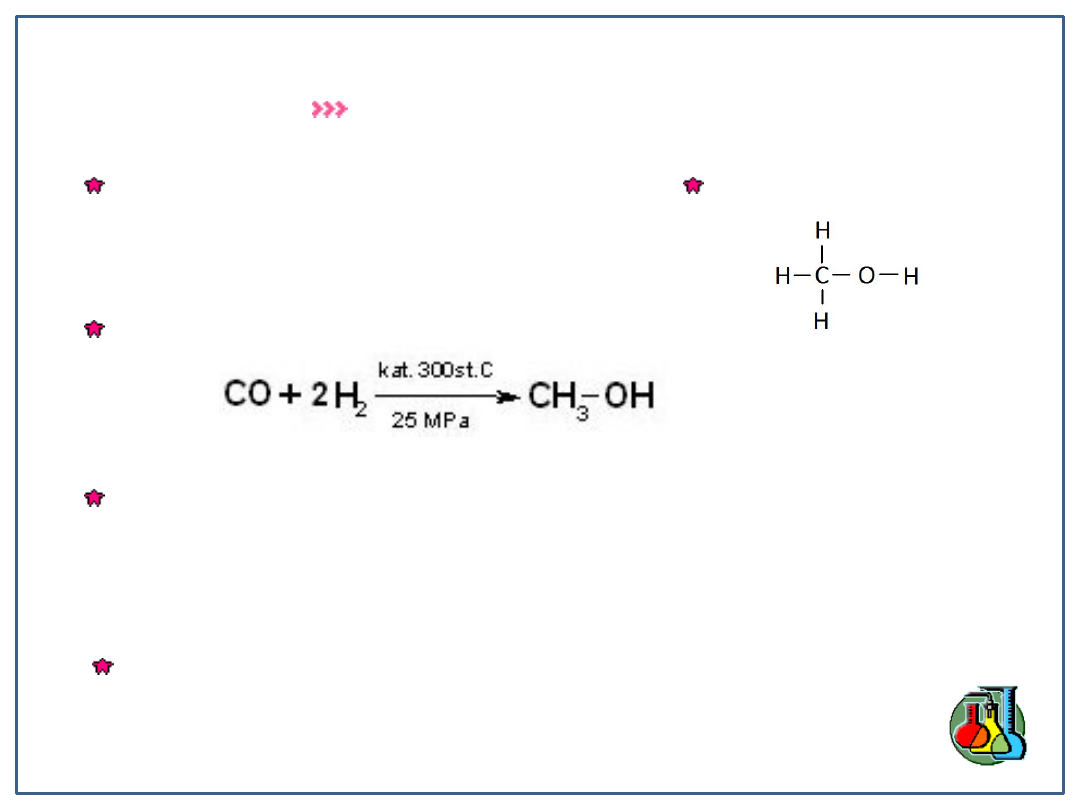
Otrzymywanie alkoholi
Hydroliza odpowiednich chlorowcopochodnych alkanów
CH
3
-Cl + H
2
O CH
3
-OH + HCl
Reakcja chlorowcopochodnych z zasadą
CH
3
-Cl + NaCH CH
3
-OH + NaCl
Reakcja wody z alkenem
C=C + H
2
O H-C-C-OH
Fermentacja alkoholowa
C
6
H
12
O
6
2C
2
H
5
OH + 2CO
2
H H
H
H
H
H
H
H
drożdże
H
2
O
metanol
metanol
chlorometan
chlorometan

Główne alkohole
i ich zastosowanie
Do najbardziej znanych alkoholi zaliczamy:
Metanol – pierwszy człon szeregu homologicznego alkoholi
Etanol – drugi człon szeregu homologicznego alkoholi
Gliceryna – najprostszy alkohol
Metanol
Wzór sumaryczny:
CH
3
OH
Wzór strukturalny:
Otrzymywanie:
Właściwości: Bezbarwna ciecz o charakterystycznym ostrym
zapachu i smaku, silnie trująca, spala się jasnym
płomieniem, dobrze rozpuszczalna w wodzie,
reaguje z kwasami oraz metalami.
Zastosowanie: Rozpuszczalnik w syntezie organicznej;
stosowany również w przemyśle
farmaceutycznym, chemicznym oraz jako
paliwo.
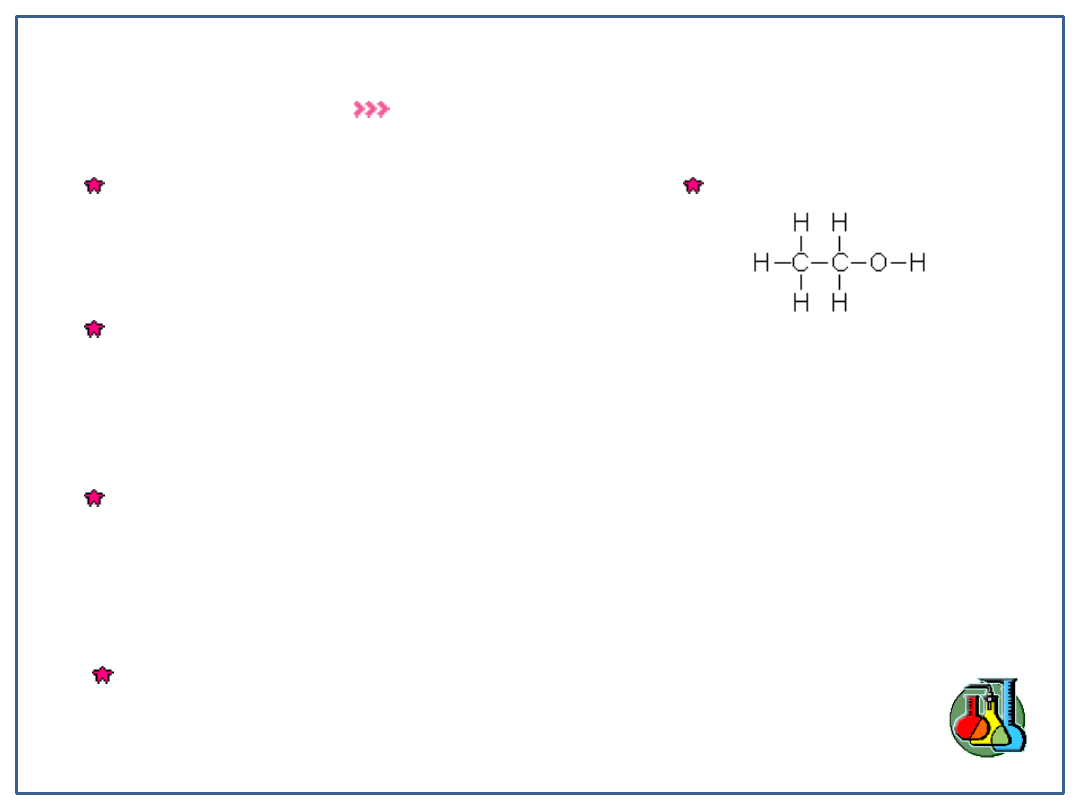
Etanol
Wzór sumaryczny:
C
2
H
5
OH
Wzór strukturalny:
Otrzymywanie: Wytwarzany w procesie
fermentacji alkoholowej.
Podstawowe surowce: buraki
cukrowe, ziemniaki, pszenica.
Właściwości: Bezbarwna, lotna ciecz o charakterystycznym
zapachu i ostrym smaku; spala się
jasnoniebieskim płomieniem, dobrze miesza
się z wodą, ścina białko jajka.
Zastosowanie: Służy do produkcji leków, zapachów do
ciast, kosmetyków, środków odkażających.

Gliceryna
Wzór sumaryczny:
C
3
H
5
(OH)
3
Wzór strukturalny:
Otrzymywanie: Ogrzewanie nasion roślin
oleistych z rozpuszczalnikiem.
Właściwości: Bezbarwna, gęsta, nietoksyczna ciecz o
słodkim smaku; spala się jasnożółtym
kopcącym płomieniem, miesza się z wodą,
ma właściwości higroskopijne.
Zastosowanie: W przemyśle farmaceutycznym,
spożywczym, kosmetycznym, skórzanym;
Do produkcji materiałów wybuchowych,
barwników, płynów hamulcowych, kremów.

Klasyfikacja alkoholi
Alkohole dzielimy na:
Monohydroksylowe (jednowodorotlenowe):
Alkanole, np. metanol, etanol
Alkenole, np. alkohol allilowy
Alkinole, np. alkohol propargilowy
Alkohole cykliczne, np. cykloheksanol
Alkohole aromatyczne, np. alkohol benzylowy
Polihydroksylowe (wielowodorotlenowe):
Diole
Cukrol


Za uwagę dziękują:
Justyna Czajka i Ela Duda
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
prezentacja na chemie
Prezentacja na chemię
Prezentacja na seminarium
internetoholizm prezentacja na slajdach
Bezrobocie prezentacja na WOS
Prezentacja na muzyke
Pozagałkowe zapalenie nerwu wzrokowego prezentacja na zajęcia
prezentacja na zajecia z etyki
wstepna prezentacja na zywienie
B Prezentacja na obrone mgr
Traktat św. Grzegorza z Nyssy, prezentacje, WSZYSTKIE PREZENTACJE, OAZA, Prezentacje cd, Prezentacje
na chemieeee
ściąga na chemie [Jasiorski]
Prezentacja na systemy polityczne zaj 1
credo, prezentacje, WSZYSTKIE PREZENTACJE, OAZA, Prezentacje cd, Prezentacje, Prezentacje na OND III
Zagrozenia czasu pokoju, 3 # SZKOŁA - prezentacje na lekcje, EDUKACJA DLA BEZPIECZEŃSTWA, zagrożenia
zabawy integtracyjne, 3 # SZKOŁA - prezentacje na lekcje, wdżwr
badziew na chemie
ROMANTYZM prezentacja na maturę ustną - język polski, MATURA USTNA JEZYK POLSKI
więcej podobnych podstron