Katalizatory i
adsorbenty
Katalizatory i
adsorbenty
Uzupełnienie (przypomnienie) wiedzy

Kataliza
to zjawisko polegające na zwiększeniu
szybkości reakcji chemicznej lub też skierowaniu jej
do wybranego produktu w obecności niewielkich
ilości substancji zwanej
katalizatorem
.
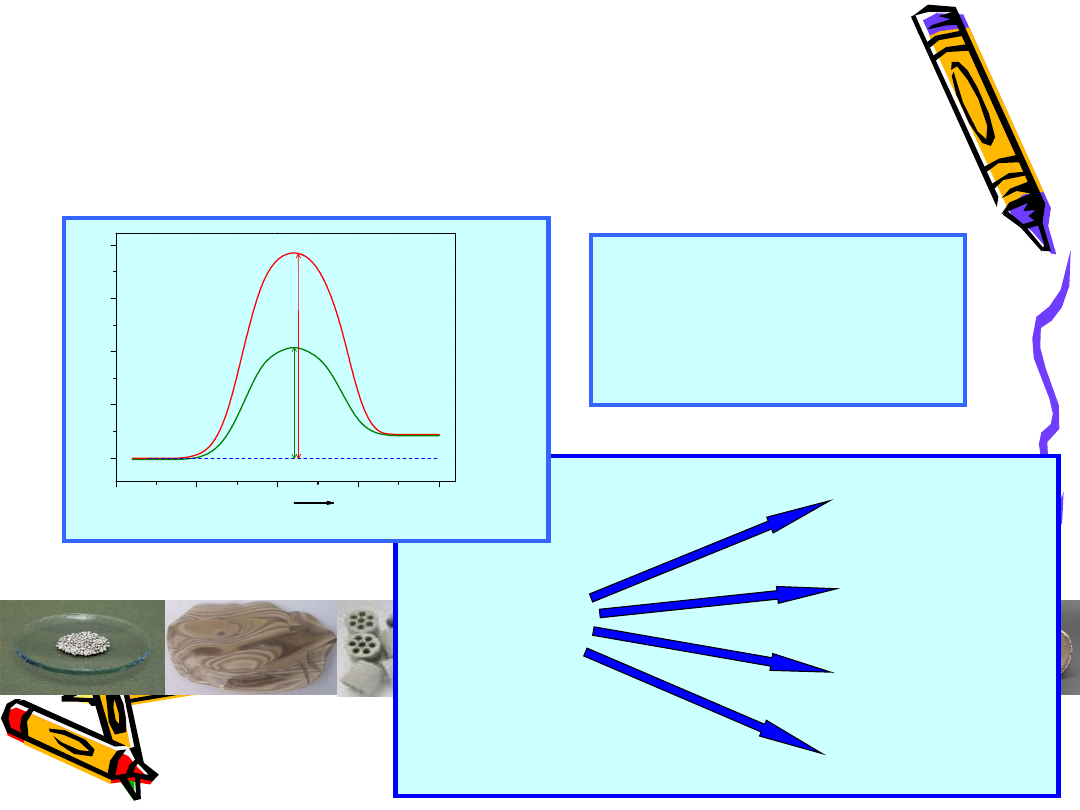
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
N
2
NO
2
NH
3
+ O
2
N
2
O
NO
+ H
2
O
N
2
NO
2
NH
3
+ O
2
N
2
O
NO
+ H
2
O
Kataliza, katalizator
Produkty
E
n
e
rg
ia
Reakcja
Substraty
2 SO
2
+ O
2
= 2 SO
3
bez katalizatora – ΔE = 251 kJ/mol
z katalizatorem - ΔE
k
=
63 kJ/mol
R
k
/R = 5.13* 10
12
(!!!)
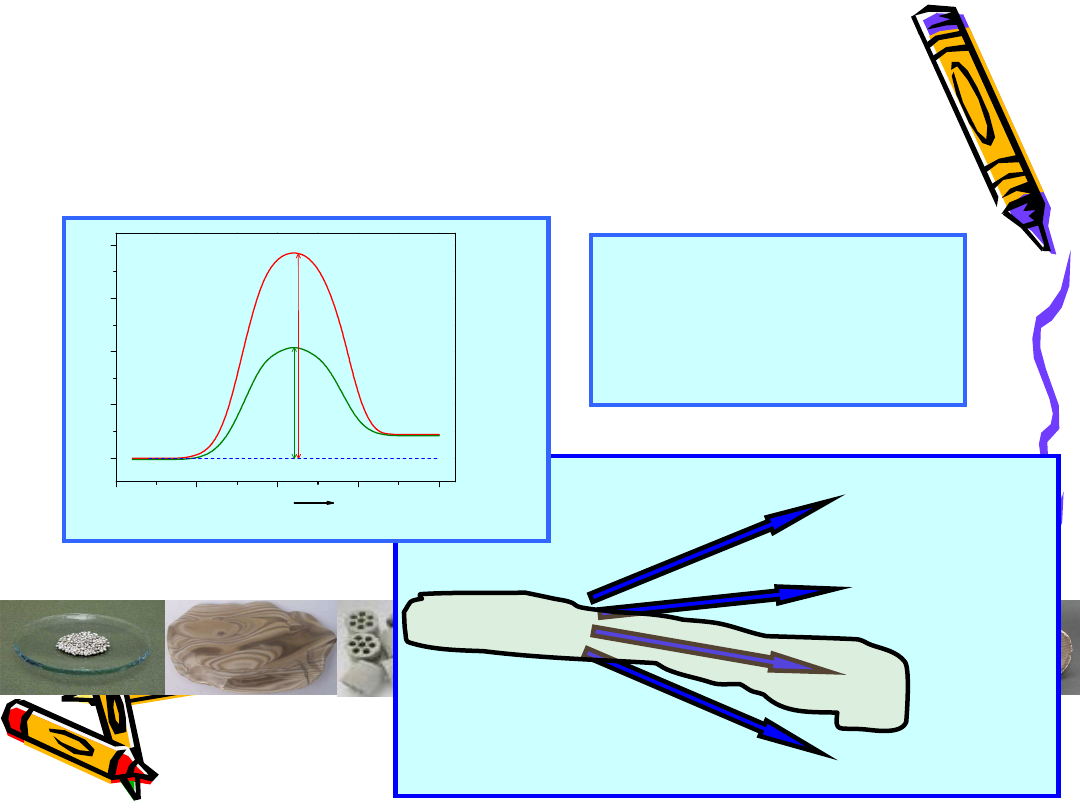
Katalizator: Pt-Rh

Aktywność katalizatora:
a
kat
= r
kat
– r
Miarą aktywności jest zwykle konwersja (stopień
przereagowania):
- konwersja ułamkowa (0÷1):
- konwersja procentowa (0-100%):
Selektywność:
%
100
c
c
S
n
1
i
i
j
j
0
0
c
c
c
%
100
c
c
c
0
0

Kataliza homogeniczna
• Katalizator i reagenty znajdują się w tej samej fazie
:
- gaz-gaz,
- ciecz-ciecz,
- ciało stałe-ciało stałe.
Przykład:
2SO
2
+ O
2
2SO
3
katalizator:
NO
(gaz-gaz)
• Problem: musimy rozdzielić po reakcji katalizator i produkty
(nieprzereagowane substraty) – to jest dodatkowy koszt.
Kataliza heterogeniczna
• Katalizator
i
reagenty
znajdują się w odrębnych fazach:
-
gaz
-
ciecz
,
-
gaz
-
ciało stałe
,
-
ciecz
-
gaz
,
-
ciecz
-
ciało stałe
,
-
ciało stałe
-
gaz,
(kataliza kontaktowa)
-
ciało stałe
-
ciecz,
Przykład:
4NH
3
+ 5O
2
4NO + 6H
2
O
katalizator:
Pt-Rh
(kataliza
kontaktowa)
•
Zaleta nie ma problemu z oddzieleniem katalizatora i produktów reakcji
(nieprzereagowanych substratów).

Katalizatory nośnikowe
Faza aktywna:
Metale; tlenki, siarczki metali
Nośnik:
SiO
2
(np. mezoporowata krzemionka)
Al
2
O
3
(-, -)
TiO
2
ZrO
2
MgO
ZnO
Zeolity
etc.
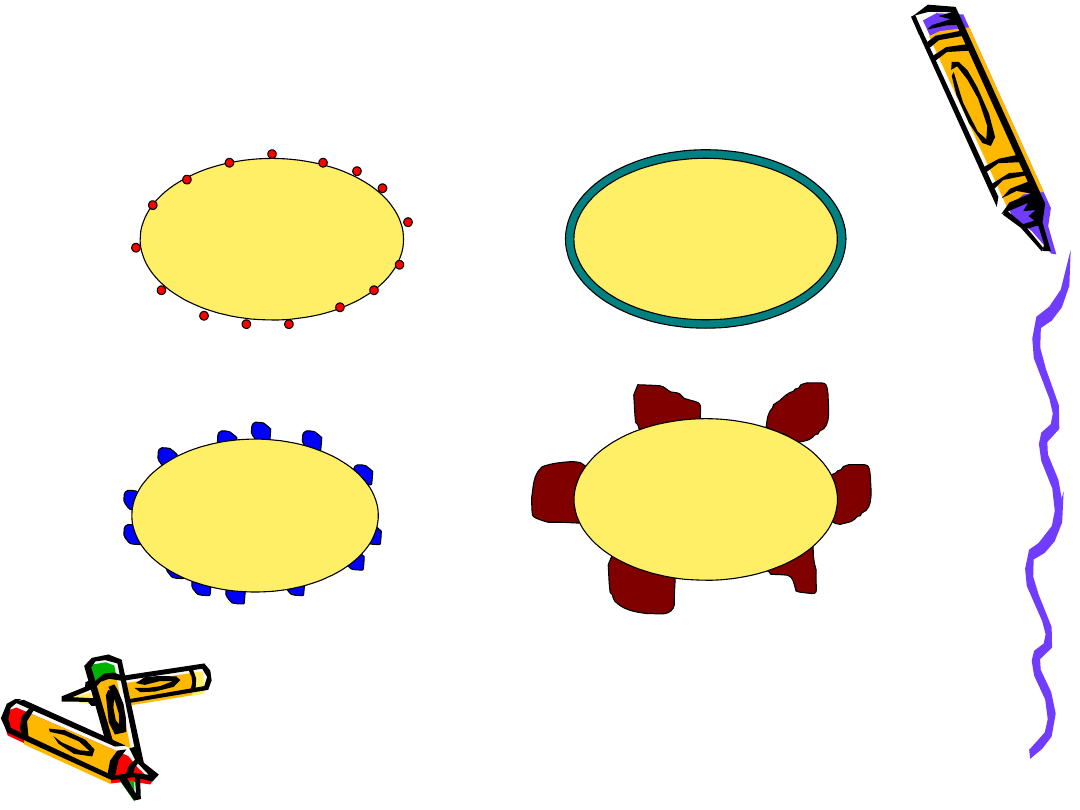
Katalizatory nośnikowe
-faza aktywna
izolowane jony lub atomy
warstwa (monowarstwa)
klastery metalu, tlenku metalu
dwie fazy w kontakcie

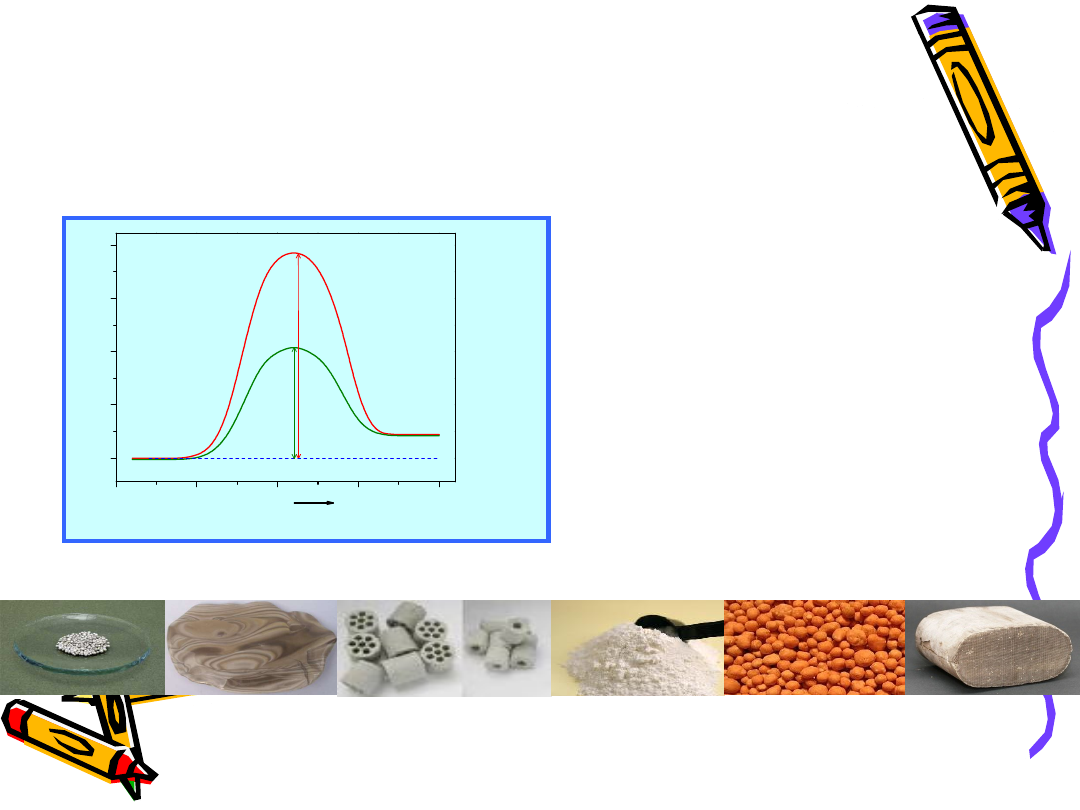
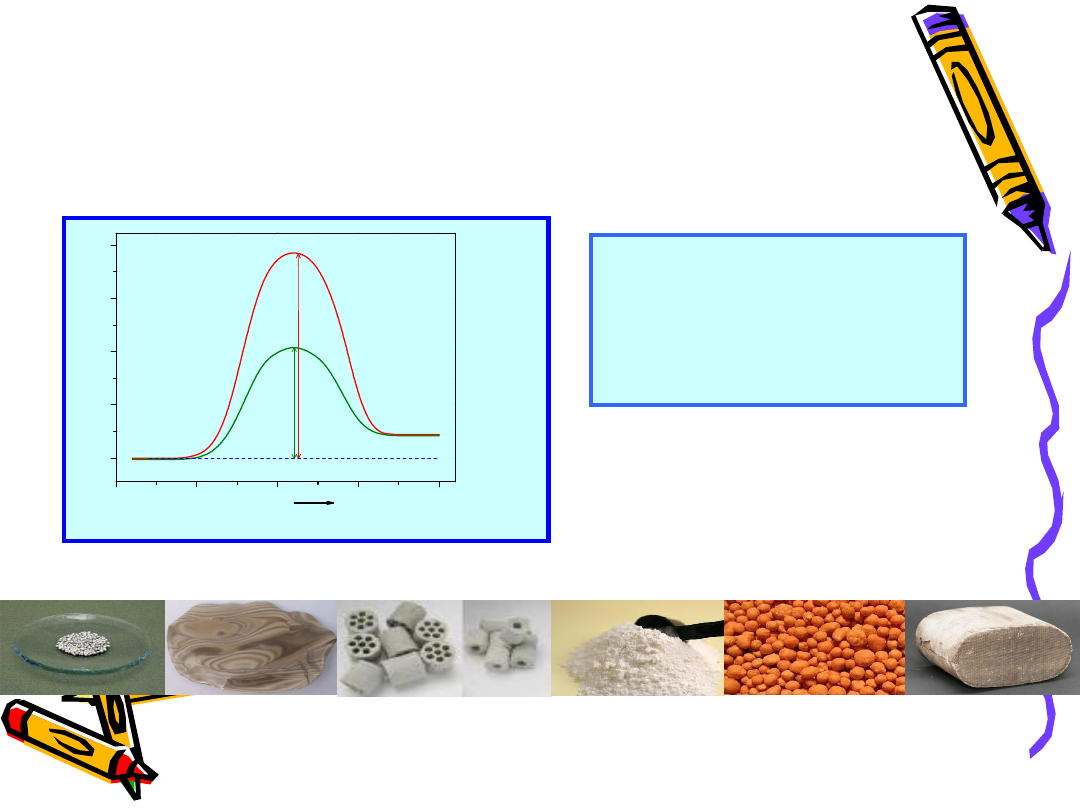
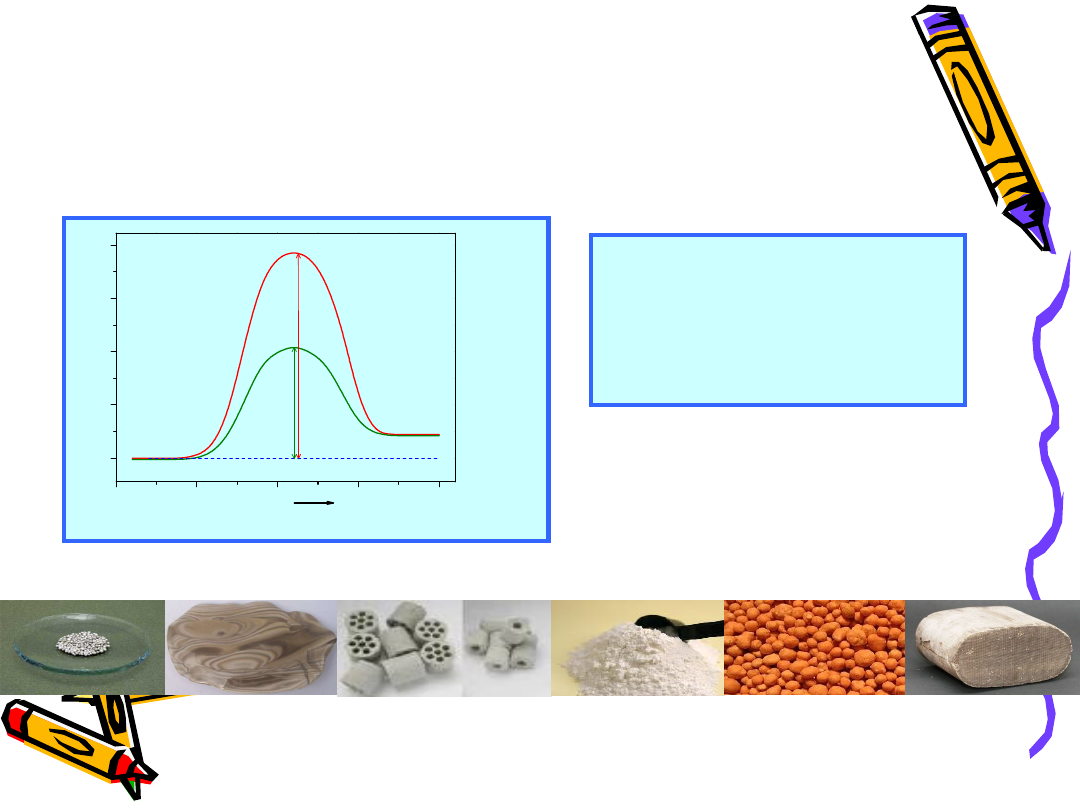
Formy katalizatorów kontaktowtch
•
Granulki
•
Kształtki
•
Monolity

Adsorpcja
• Adsorpcja
—
to proces wiązania się cząsteczek,
atomów lub jonów na powierzchni lub granicy faz
fizycznych, powodujący lokalne zmiany stężenia
.
• Adsorpcji
nie należy mylić z
absorpcją
, która jest
procesem wnikania do wnętrza fazy.
• Proces przeciwny do adsorpcji to
desorpcja
.

Adsorpcja i absorpcja
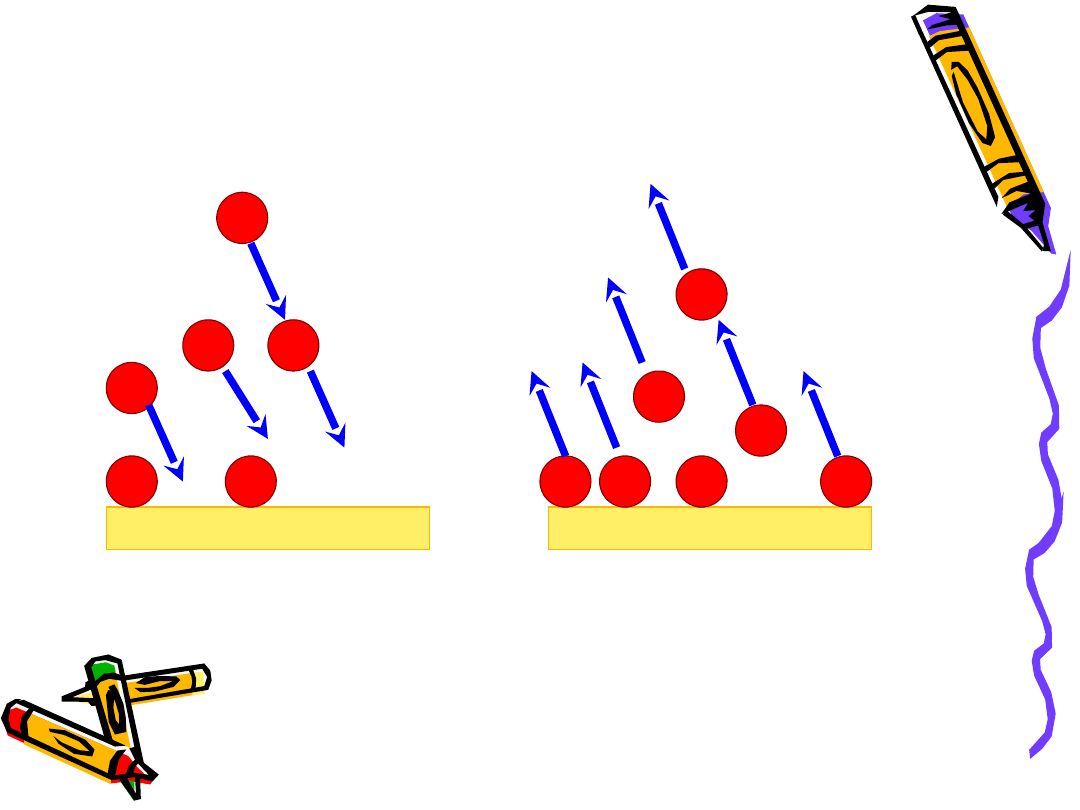
Adsorpcja i desorpcja
Adsorpcja
Desorpcja
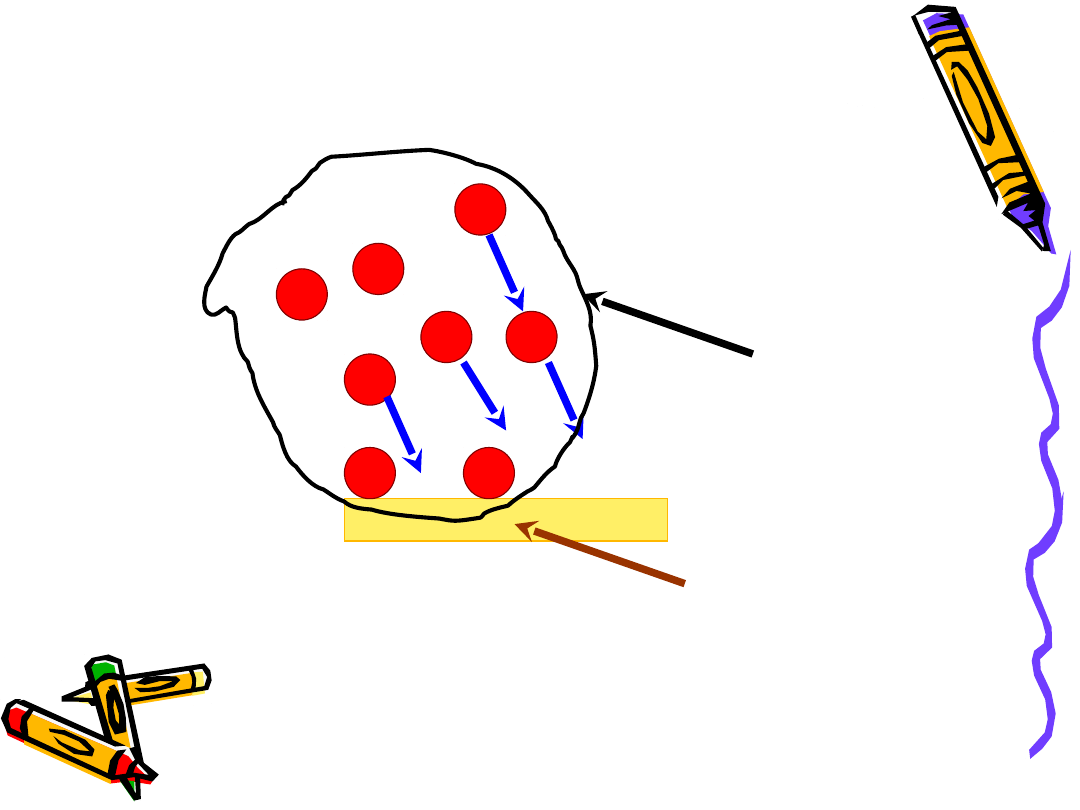
Adsorbent - Adsorbat
Adsorbent
Adsorbat
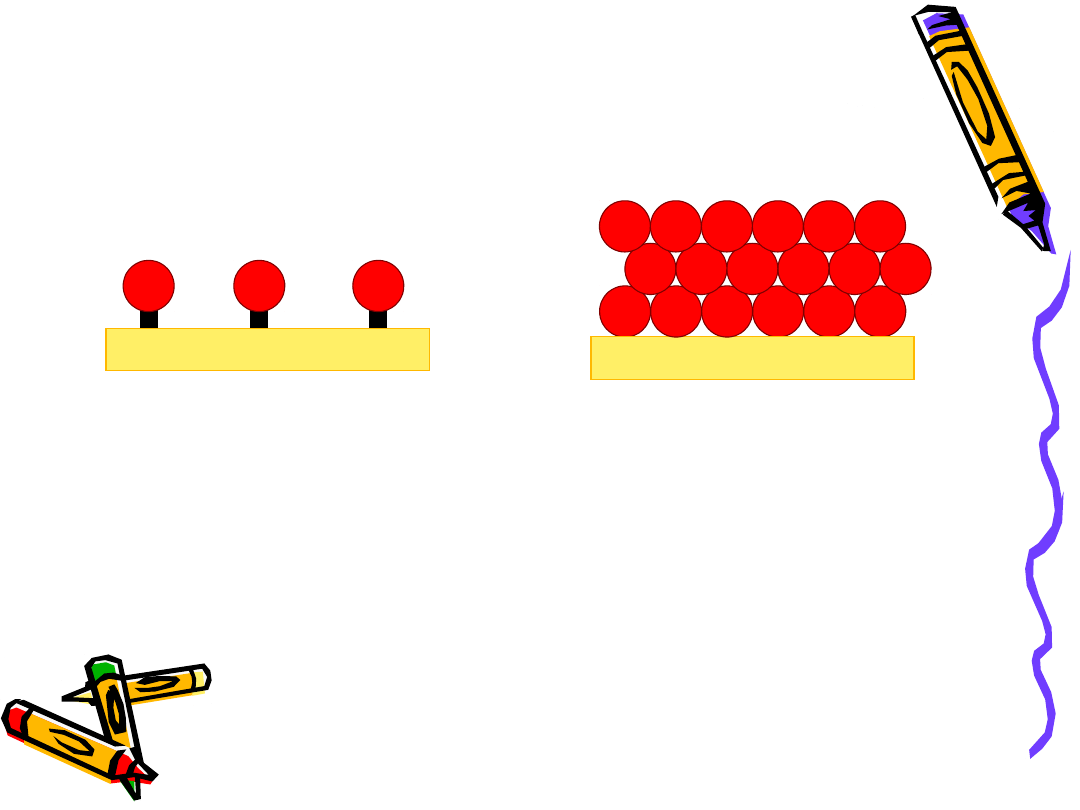
Adsorpcja fizyczna – Adsorpcja chemiczna
Adsorpcja chemiczna –
wiązanie chemiczne pomiędzy
adsorbentem a adsorbatem
Adsorpcja fizyczna –
adsorbat wiążę się z adsorbatem
za pomocą sił Van der Wallsa
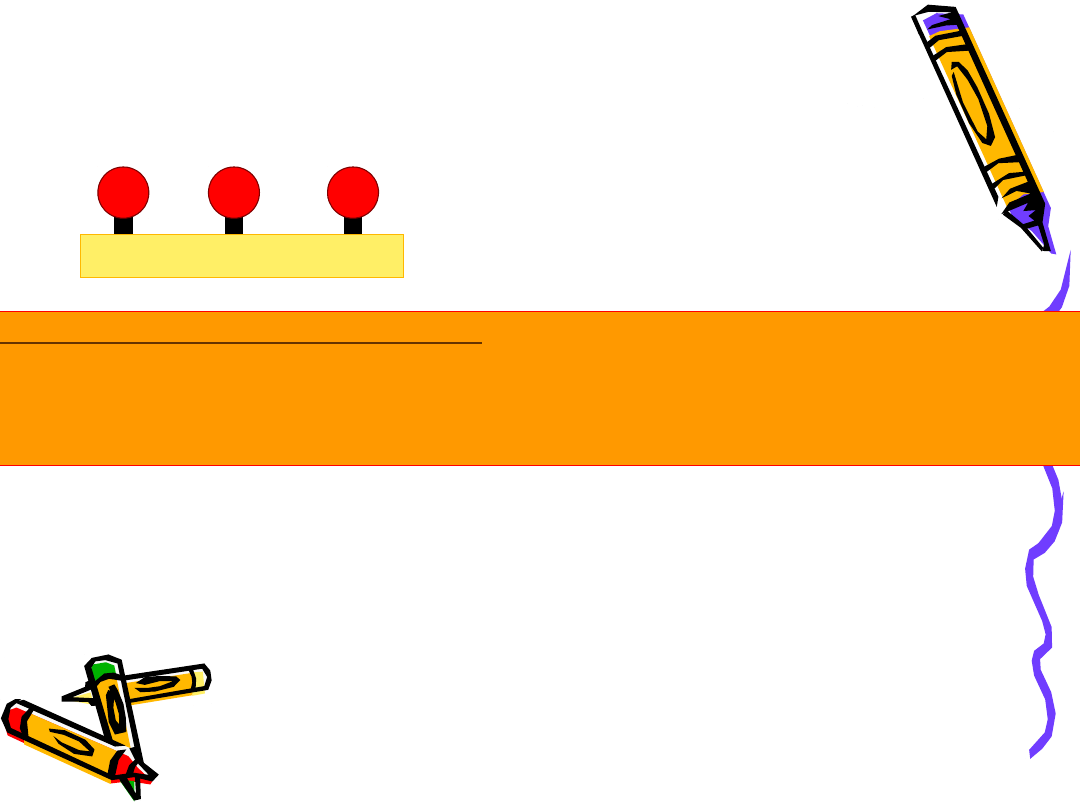
Adsorpcja fizyczna
Adsorpcja chemiczna (chemisorpcja):
- Zwykle stosunkowo duże ciepło sorpcji;
- Duża „siła wiążąca” cząsteczek zaadsorbowanych bo tworzy się wiązanie chemiczne
- Sorpcja zlokalizowana (jednowarstwowa);
Adsorpcja fizyczna
Adsorpcja fizyczna (fizysorpcja):
- Małe ciepło sorpcji;
- Mała „siła wiążąca” cząsteczek zaadsorbowanych bo nie tworzy się
wiązanie chemiczne (tylko siły Van der Wallsa)
- Sorpcja zdelokalizowana (wielowarstwowa);
Oddzaływania Van der Wallsa:
- Oddziaływania Dipol-Dipol;
- Oddziaływania Dipol-Dipol
indukowany;
- Oddziaływania Dyspersyjne.

Adsorbenty
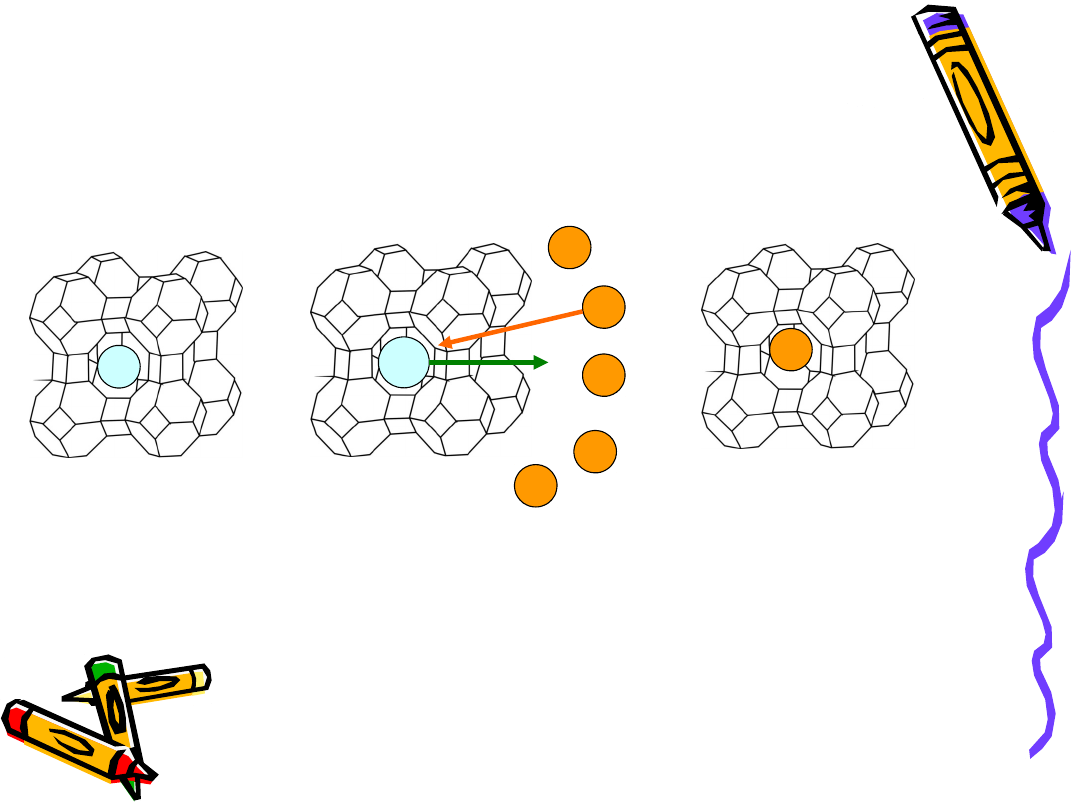
Wymiana jonowa - zeolity
Na
+
Na
+
Ag
+
Ag
+
Ag
+
Ag
+
Ag
+
Ag
+
Zeolit A
forma sodowa
Zeolit A
Po sorpcji
Document Outline
- Slide 1
- Slide 2
- Kataliza, katalizator
- Kataliza, katalizator
- Kataliza, katalizator
- Kataliza, katalizator
- Kataliza, katalizator
- Slide 8
- Kataliza homogeniczna
- Kataliza heterogeniczna
- Katalizatory nośnikowe
- Katalizatory nośnikowe -faza aktywna
- Formy katalizatorów kontaktowtch
- Adsorpcja
- Adsorpcja i absorpcja
- Adsorpcja i desorpcja
- Adsorbent - Adsorbat
- Adsorpcja fizyczna – Adsorpcja chemiczna
- Adsorpcja fizyczna
- Adsorpcja fizyczna
- Adsorbenty
- Wymiana jonowa - zeolity
Wyszukiwarka
Podobne podstrony:
kataliza adsorpcja OS
oś Katalizatory
adsorpcja zestaw ziolo, sem 1, Kataliza (magdapliki), EGZ
Adsorpcja Grzybek zaliczenie 2009 BoocaTM, sem 1, Kataliza (magdapliki), EGZ
gi do adsorpcji, sem 1, Kataliza (magdapliki), EGZ
oś Katalizatory
S Majka II Oś
Mobile OS Security
Wykład 3 Określenie danych wyjściowych do projektowania OŚ
więcej podobnych podstron