
Możliwości, które daje zastosowanie kultur in vitro:
1. Produkcja sadzonek lub podkładek bez względu na porę roku.
2. Gromadzenie i przechowywanie roślin wolnych od patogenów i całkowicie izolowanych
przed wtórną infekcją wirusami, bakteriami, mikoplzamami, grzybami i nicieniami.
3. Przechowywanie długoterminowe materiału.
4. Ułatwiony transport i międzynarodowa wymiana materiału sadzonkowego.
5. Otrzymywanie roślin wyrównanych, przez selekcję pojedynczych egzemplarzy z
gatunków rozmnażanych do tej pory wyłącznie generatywnie.
6. Reprodukcja roślin, których nasiona są bardzo drogie, wolno kiełkujące lub mają
szczególnie niską siłę kiełkowania.
7. Skracanie prac cyklu hodowlanego (do 3-4 lat) nad otrzymywaniem nowych odmian.
8. Otrzymanie odmian o wyższym poziomie ploidalności przez działanie kolchicyną na
hodowle tkanek.
9. Zachowanie linii męskojałowych i utrzymanie wsobnych linii pochodnych mieszańców
F1.
10.Wykorzystywanie kultur in vitro specyficznych roślin do produkcji wtórnych
metabolitów (np. kwas abscysynowy, kauczuk, kofeina, kamfora, atropina, opium,
barwnik...).mających zastosowanie np. w farmakologii (bioreaktory).
11. Uzyskiwanie haploidów metodą kultur izolowanych pylników lub mikrospor.
12. Kultury izolowanych protoplastów i ich fuzje w celu uzyskania mieszańców.
13. Kultury niedojrzałych zarodów w celu ich ratowania w przypadku, gdy bielmo nasion,
z których pochodzą jest słabo wykształcone lub wcale go nie ma.
14.Wytważanie sztucznych nasion.

Zagadnienie hodowli organów i tkanek roślinnych in vitro
sformułowane zostało po raz pierwszy przez Haberlandta
(1902)
.
Sukces metod kultur in vitro jest związany ze zjawiskiem
TOTIPOTENCJI, które polega na nieograniczonych zdolnościach
komórek roślinnych do dzielenia się i odtwarzania całego
organizmu. Wiele komórek somatycznych, nieraz znacznie
zróżnicowanych może podjąć rozwój embrionalny i dać początek
zarodkowi. Wynika stąd, że genotyp zróżnicowanych komórek nie
podlega trwałemu zablokowaniu i może być uaktywniony,
podobnie jak genotyp zygot.

Co wpływa na wyzwolenie
totipotencji?
1.
Odłączenie
komórek somatycznych od korelacyjnego wpływu
innych komórek (odcięcie fragmentu pędu, wyizolowanie
pojedynczych komórek czy też protoplastów).
2. Bogate składniki odżywcze i substancje wzrostowe,
regulatory
wzrostu
.
3.
Gatunek
, z którego pochodzą eksplantaty wyjściowe - w
komórkach somatycznych znajduje się PEŁNA informacja
genetyczna, ale nie jest ona w jednakowej mierze
wykorzystywana w każdym eksplantacie roślinnym, blokada
genów działa z niejednakową intensywnością u różnych grup
roślin.
4.
Wiek, kondycja i turgor tkanki, rodzaj organu, jego fizjologia i
wiek ontogenetyczny oraz sezon
, w którym pobiera się materiał
wyjściowy do kultur.
Z a r o d k i s o m a t y c z n e :
1 . N i e
w y k a z u j ą
w a z i k u l a r n e g o
p o ł ą c z e n i a
z
t k a n k ą
m a c i e r z y s t ą w o b r ę b i e , k t ó r e j r e g e n e r u j ą .
2 . P o s i a d a j ą p r o s t ą , d w u b i e g u n o w ą s t r u k t u r ę z w y o d r ę b n i o n ą
o s i ą k o r z e ń - p ę d .
3 .
P o w s t a j ą w s k u t e k p o d z i a ł ó w m i t o t y c z n y c h
, z p o j e d y n c z y c h
k o m ó r e k
i n i c j a l n y c h ,
k t ó r e
c h a r a k t e r y z u j ą
s i ę
g ę s t ą
c y t o p l a z m ą ,
d u ż y m
j ą d r e m ,
p l a s t y d a m i
z a w i e r a j ą c y m i
z i a r n a s k r o b i o r a z l i c z n y m i r y b o s o m a m i i s f e r o s o m a m i .

Rozmnażanie klonalne w kulturach in
vitro:
1.Powstawanie
zarodków somatycznych
w hodowlach komórek,
tkanek i organów.
2.Różnicowanie
pąków przybyszowych
w hodowlach tkanki
kalusowej.
3.Różnicowanie pąków przybyszowych bez pośrednictwa tkanki
kalusowej.
4.Rozwój (pobudzenie)
pąków bocznych
w hodowlach wierzchołków
pędów.
5.Rozwój pąków bocznych (kątowych, pachwinowych) w
hodowlach fragmentów pędów i innych organów.
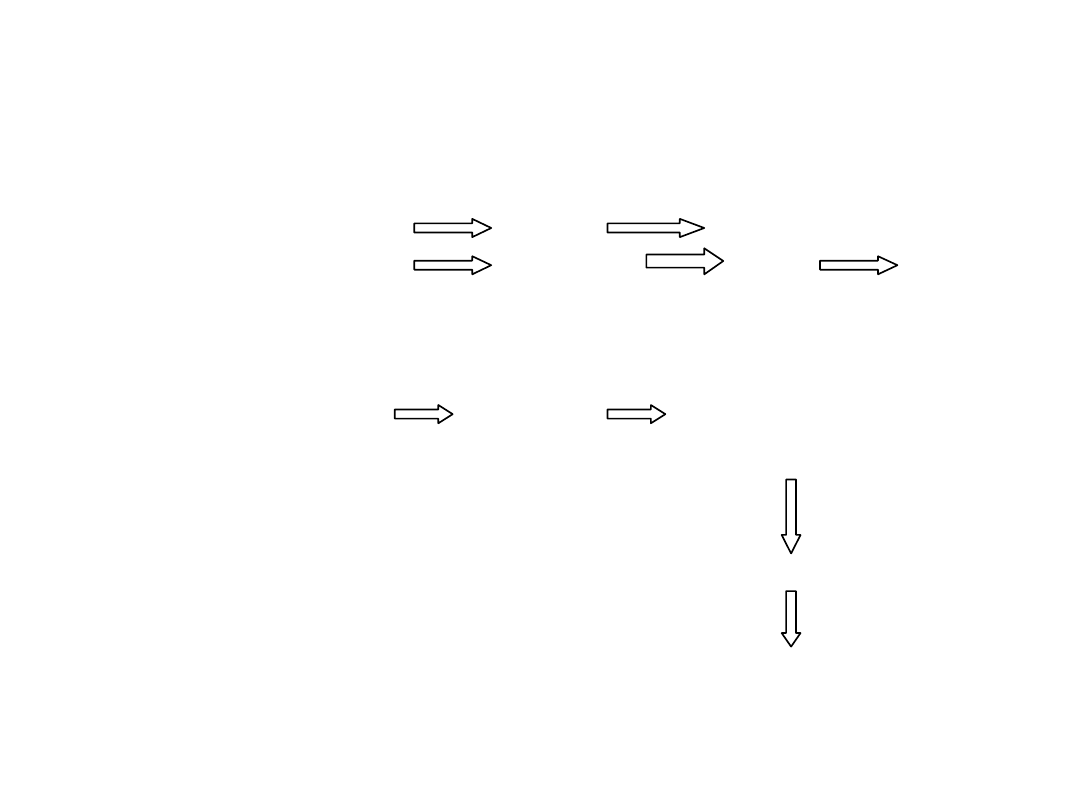
ORGANOGENEZA:
1. Bezpośrednia
Pierwotny eksplantat organ roślina
Pierwotny eksplantat embrioidy organ roślina
2. Pośrednia
Pierwotny eksplantat
KALUS
embrioidy, zawiązki
korzeni i/lub pędy
organ
roślina

Kalus
1. Mozaika komórek
kompetentnych
(totipotentnych) i
niekompetentnych
(nietotipotentnych). Komórki kompetentne kalusa
pochodzą z eksplantatu, albo kompetencja ta zostaje wyzwolona w
eksplantacie przez warunki hodowli.
2.
Niejednorodna histologicznie tkanka
(tkanka składająca się z
komórek miękiszowych o różnym stopniu wakuolizacji oraz komórek
merystematycznych tworzących mniej lub bardziej ukształtowane
centra).
3.
Bardzo dynamiczny układ
, w którym procesom odróżnicowania się
komórek miękiszowych towarzyszą procesy ich różnicowania
polegające na wzroście objętości, aż do komórek olbrzymich. Często
występują elementy zdrewniałe.
4. Tkanka powstająca w miejscu zranienia rośliny mająca na celu
zabliźnienie rany. Często ma charakter tk. twórczej regeneracyjnej.
Przy szczepieniu drzew kalus umożliwia zrastanie się zraza z
podkładka

Regulatory wzrostu
Wprowadzenie do pożywki regulatorów wzrostu z grupy auksyn i
cytokinin stymuluje
odróżnicowanie
się
nieuszkodzonych komórek,
które pozostały w miejscu zranienia eksplantatu wyjściowego. Na
pewien okres podejmują one funkcję komórek merystematycznych
i dzieląc się intensywnie tworzą luźną tkankę o charakterze
parenchymatycznym, zwaną kalusem.
Specyficzne działanie substancji wzrostowych w trakcie powstania
tkanki kalusowej polega na przyspieszeniu podziałów
komórkowych, stymulacji wydłużania się komórek przez
rozluźnienie struktury ściany i ułatwienie przenikania wody, a w
późniejszym okresie na uaktywnianiu procesów różnicowania i
organogenezy.

ONTOGENEZA - (rozwój) zmiany, którym
podlega, np. roślina lub jej część w ciągu życia.
Gdy zmiany dotyczą formy (na poziomie
organu lub komórki) mówimy o morfogenezie,
gdy dotyczą tkanek to jest to histogeneza a z
kolei, gdy dotyczą komórek to nazywamy je
różnicowaniem.

Auksyny
1. Regulatory wzrostu podziałowego i wydłużeniowego.
2. Niezbędne do podziałów komórkowych.
3. Inicjują korzenie boczne i przybyszowe.
4. Determinują różnicowanie się elementów trachealnych.
5. Hamują wzrost pąków bocznych – dominacja wierzchołkowa.
Cytokininy
1. Regulacja podziałów komórkowych i cytodyferencjacji.
2. Inicjacja organogenezy.
3. Syntetyzowane w merystemach, zwłaszcza w korzeniu.
4. Znoszą dominację wierzchołkową.
Gibeleryny
1. Wpływ na podziały i cytodyferencjację.
2. Regulacja wzrostu podziałowego najwyraźniejsza w podwierzchołkowym
merystemie łodygi.
3. Powstawanie długopędów przez wydłużanie międzywęźli.
4. Prawie w ogóle nie działają na wzrost w merystemach pędów i korzeniach
wierzchołkowych.
5.
Indukują fazę generatywną w wierzchołku pędu u roślin długiego dnia.

Auksyny:
2,4-D - kwas 2,4-dwuchlorofenoksyoctowy- syntetyczna auksyna o najsilniejszym
działaniu. Indukuje szybką proliferację komórek kalusa i największy przyrost tkanki
kalusowej, zwłaszcza pod wpływem kinetyny, zeatyny lub BAP dodanych w niewielkim
stężeniach.
2,4,5-T - kwas 2,4,5-trójchlorofenoksyoctowy- syntetyczna auksyna o aktywności niższej
niż 2,4-D.
IAA - kwas indolilo-3-octowy - naturalna auksyna o najlepiej poznanym działaniu.
Indukuje szybki wzrost tk. kalusowej. IAA jest łatwo rozkładany przez tkanki roślinne pod
wpływem oksydazy IAA, a także pod wpływem światła. Powoduje ukorzenienie pędów.
NAA - kwas naftylo-1-octowy – syntetyczna auksyna, silnie stymulująca powstawanie i
wielkość przyrostów tk. kalusowej. Szczególnie korzystny wpływ na wzrost kalusa oraz na
jego późniejszą zdolność do różnicowania się i organogenezy wywiera współdziałanie NAA
z cytokininą np. BAP. Powoduje ukorzenienie pędów.
IBA - kwas indolilo-3-masłowy -
syntetyczna
auksyna rzadziej stosowana do indukowania
wzrostu tkanki kalusowej, częściej w pobudzaniu tkanki kalusowej do organogenezy.
Powoduje ukorzenienie pędów.
Dicamba - kwas 2- metoksy-3,6-dichlorobenzoesowy – syntetyczna auksyna
Picloram - kwas 4-amino-3,5,6-trichloropikolinowy – syntetyczna auksyna

Cytokininy:
BAP- BA - benzyloadenina - 6-benzyloaminopuryna – syntetyczna cytokinina, pochodna adeniny. Jest
lipofilna, dzięki czemu przenika biernie w głąb tkanek. Nawet w niewielkim stężeniu zachowuje długo
aktywność. W porównaniu z KIN stymuluje większe przyrosty masy komórkowej. Stymuluje powstanie
pąków hamując równocześnie ich ukorzenienie się.
KIN - kinetyna – 6-furfuryloaminopuryna – FAP - syntetyczna cytokinina, stymuluje podziały
komórkowe i aktywację kwasów nukleinowych. Jest szczególnie czynna w obecności auksyn, a
zwłaszcza IAA. Silnie stymuluje organogenezę w tkance kalusowej. Pobudza tkanki dojrzałe do
odróżnicowywania się. Indukcja pąków przybyszowych.
2iP - IPA - DMAA - DMAAP - 6(γ,γ-dimetyloallilo) aminopuryna – naturalna cytokinina, silnie
stymulująca regeneracje pąków przybyszowych.
Zea - Zeatyna - 6-(4-hydroksy-3-metylobutylo-trans-2-enylo)aminopuryna – naturalna cytokinina
(najaktywniejsza jest forma trans). Izolowana z niedojrzałych ziarniaków Zea mays. Aktywnością
znacznie przewyższa kinetynę. Zalecana przy indukcji organogenezy.
PGA - (6-benzyloamnio)-9-(2-tetrahydropiranylo)H-puryna – tetrahydropiranylobenzyloadenina –
syntetyczna cytokinina o aktywności niższej niż BA.
TDZ - thidiazuron
Gibereliny:
GA
3
- kwas giberelinowy
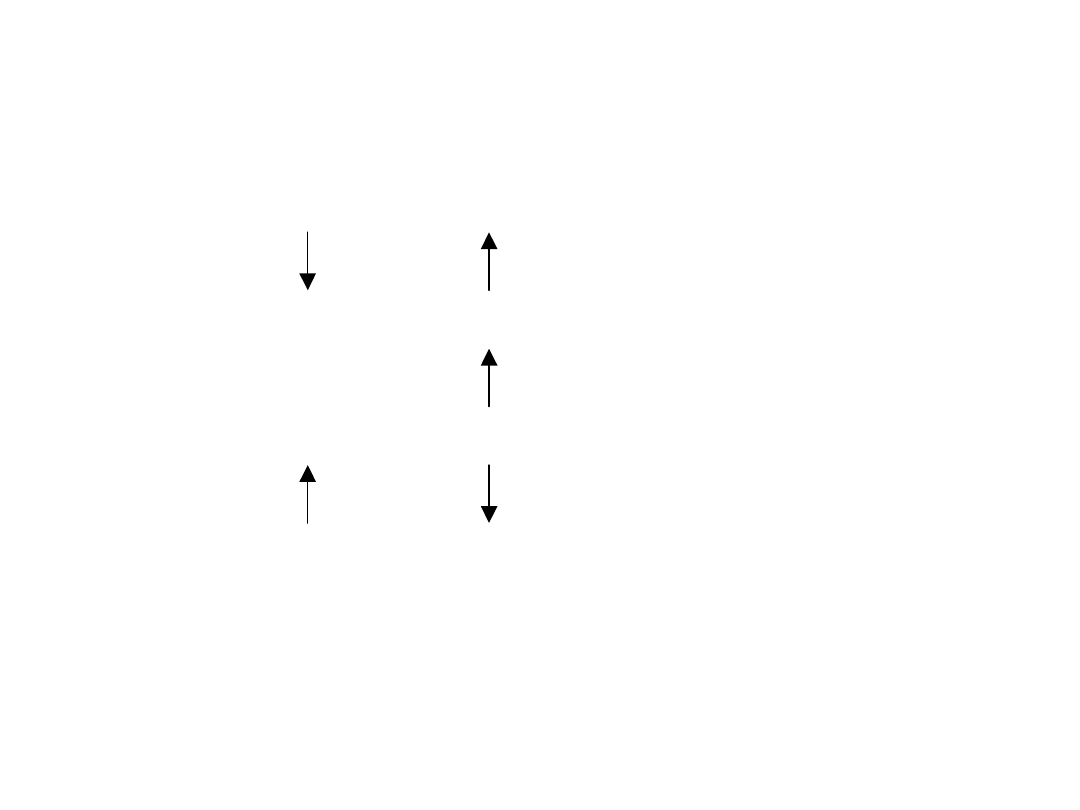
ZASADY WSPÓŁDZIAŁANIA AUKSYN I CYTOKININ:
Cytokininy auksyny kalusowanie
Cytokininy śr. auksyny liczne wierzchołki korzeni
Cytokininy auksyny liczne pędy

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
cwiczenie 2 biotechnologia
Cwiczenie 5, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CWICZENIE9, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA, chemia fizyczna
moje cwiczenie, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
grafik ćwiczeń z biotechnologii 2010-2011, Biotechnologia, laborki
grafik ćwiczeń z biotechnologii 2010 2011,12 grup
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
ćwiczenia 5-6 Składka na ubezpieczenie wypadkowe, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, ZARZĄDZANIE BE
I kolokwium Mikrobiologia 1-4, Biotechnologia, Mikrobiologia, ćwiczenia
ĆWICZENIE NR 2A, Biotechnologia, Fizyka, Labolatorium
Rozkład ćwiczeń z chemii organicznej dla studentów I roku biotechnologii, chemia, organiczna
cwiczenie 3, Współczesne trendy w biotechnologii żywności
Ćwiczenie 11, I semestr biotech, genetyka
cw 5 - przyklad, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
cw ogolem, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
więcej podobnych podstron