
Wykłady z chemii
dla studentów Wydziału Inżynierii Lądowej i Geodezji
Wojskowej Akademii Technicznej
Prowadzący:
Dr hab. inż. Andrzej Sadkowski, profesor W.A.T.
Wydział Nowych Technologii i Chemii.
ansad@ichf.edu.pl
Wykład 2.
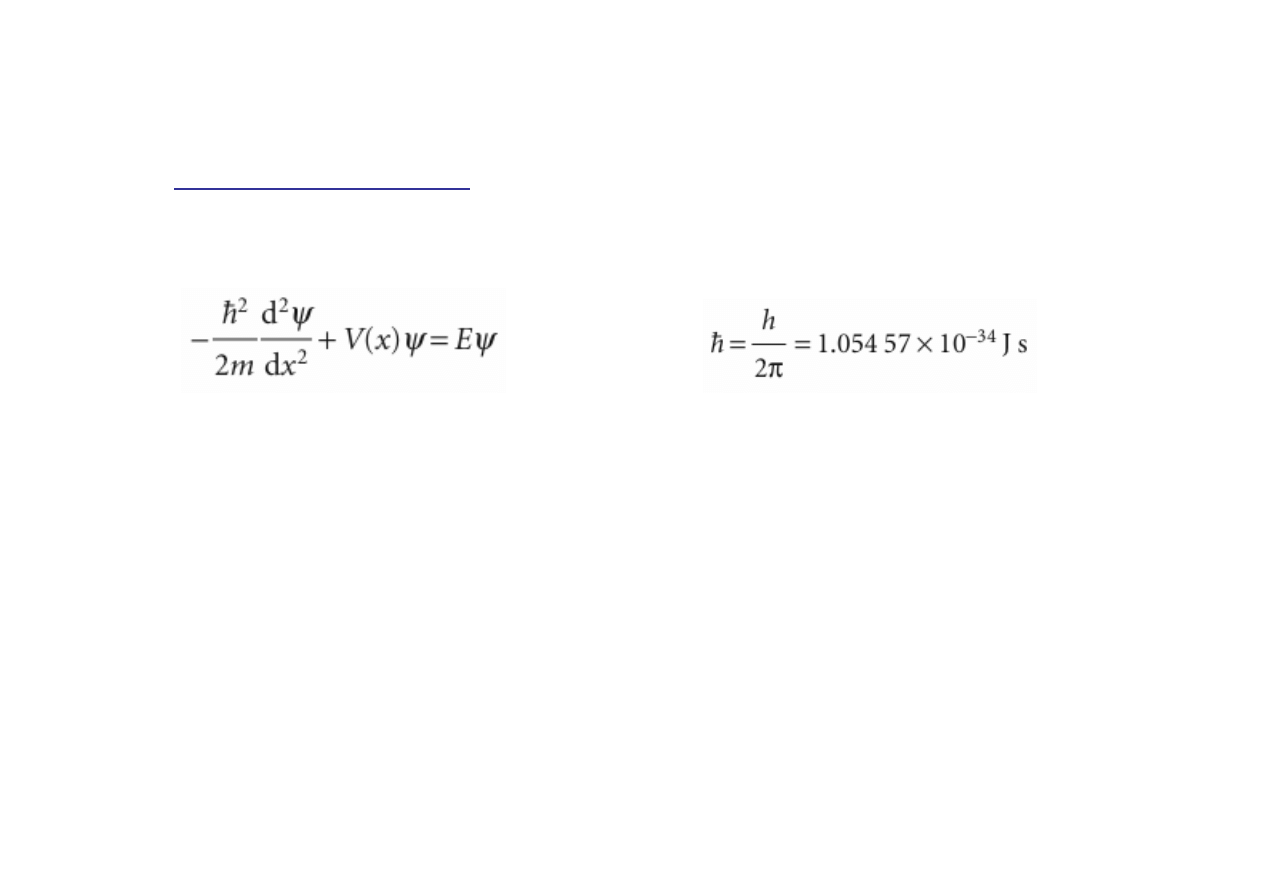
2
Równanie Schroedingera.
Funkcja falowa ψ(x,y,z) której kwadrat określa prawdopodobieństwo
znalezienia się elektronu w danym miejscu (tu zapisana jako funkcja tylko
współrzędnej x)
@
Ψ
H
x
,
y
,
z
LD
2
=
P
H
x
,
y
,
z
L
V(x,y,z) energia potencjalna; E – energia całkowita (kwantowana!)
Kwadrat funkcji falowej w danym miejscu wyznacza
prawdopodobieństwo znalezienia się tam elektronu.
m
- masa
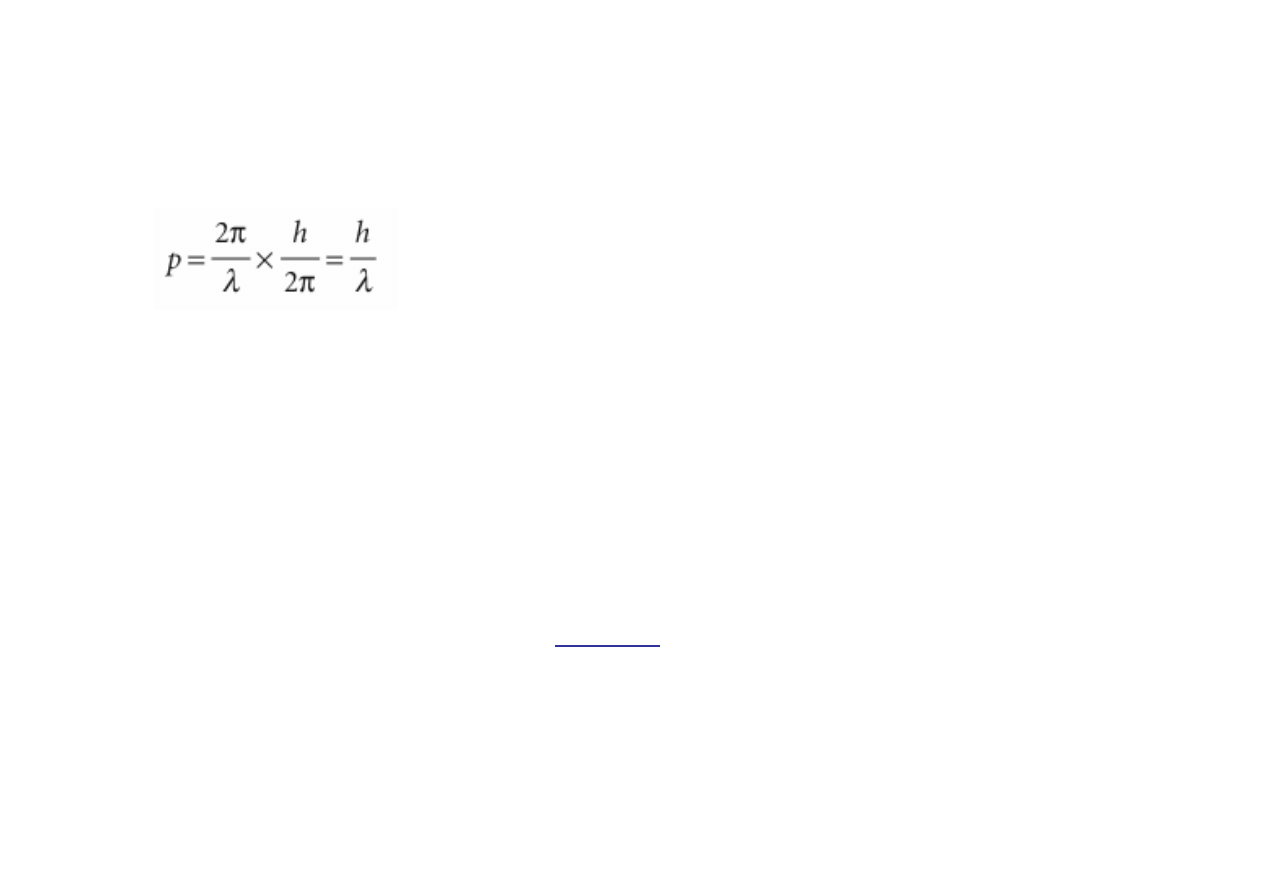
3
Falowo-korpuskularny charakter materii i energii wyraża wzór de Broglie’a:
p – pęd cząstki; λ – długość fali = c/ν ; ν - częstotliwość,
c – prędkośc fali świetlnej = 2,998 108 m s
-1
;
E = h ν;
kwantowane jest więc E i ν.
Równanie Schroedingera jest równaniem różniczkowym II rzędu. Jego
rozwiązanie wyznacza tzw. funkcje własne (postaci funkcji falowej) i
wartości własne (wartości energii dla których istnieje rozwiązanie).
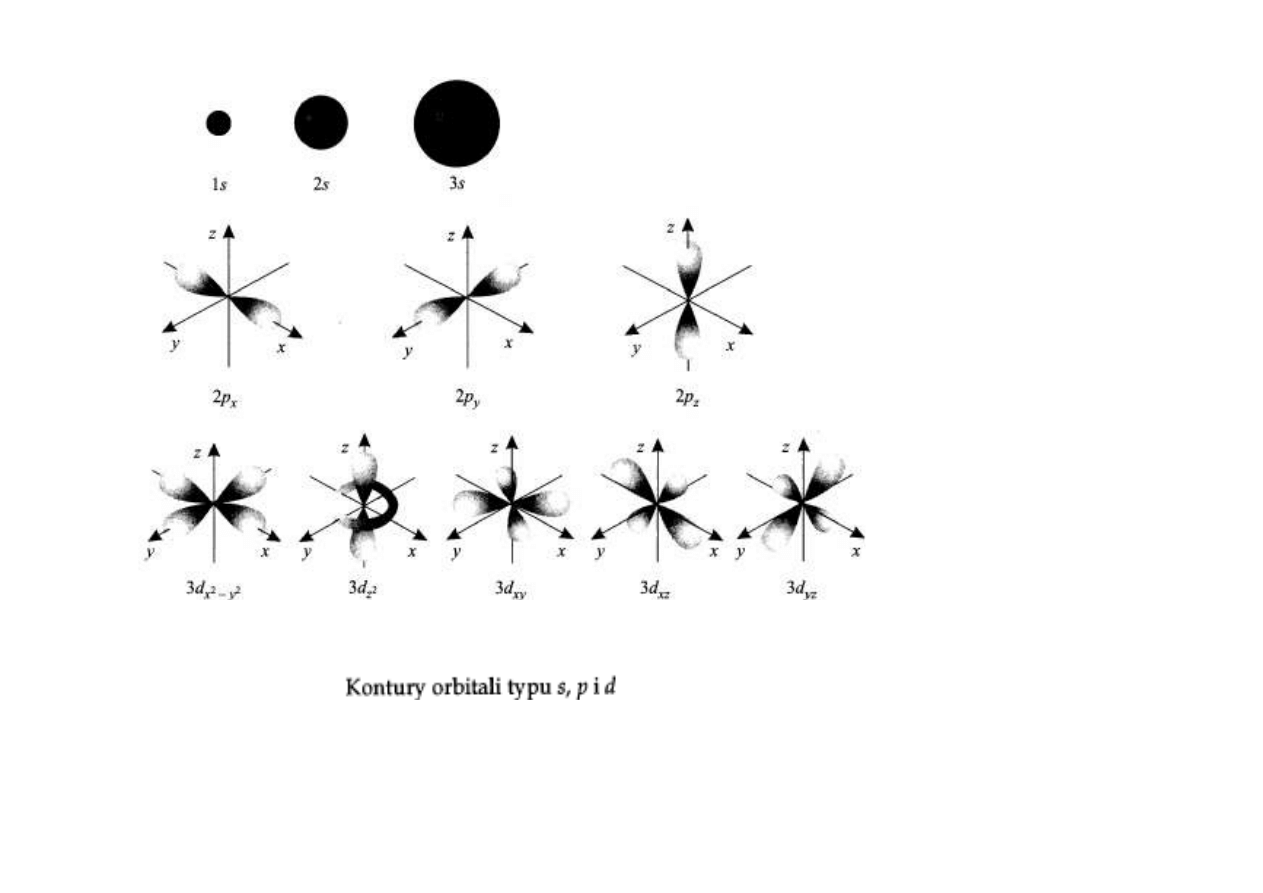
Rozwiązania równania Schroedingera dla elektronów w atomach i
cząsteczkach wyznaczają postać przestrzenną prawdopodobieństwa
znalezienia się elektronu – tzw. orbitale.
Rozwiązania te istnieją tylko dla określonych wartości tzw. liczb
kwantowych określających różne wartości energii elektronu (poziomy
energetyczne)

4
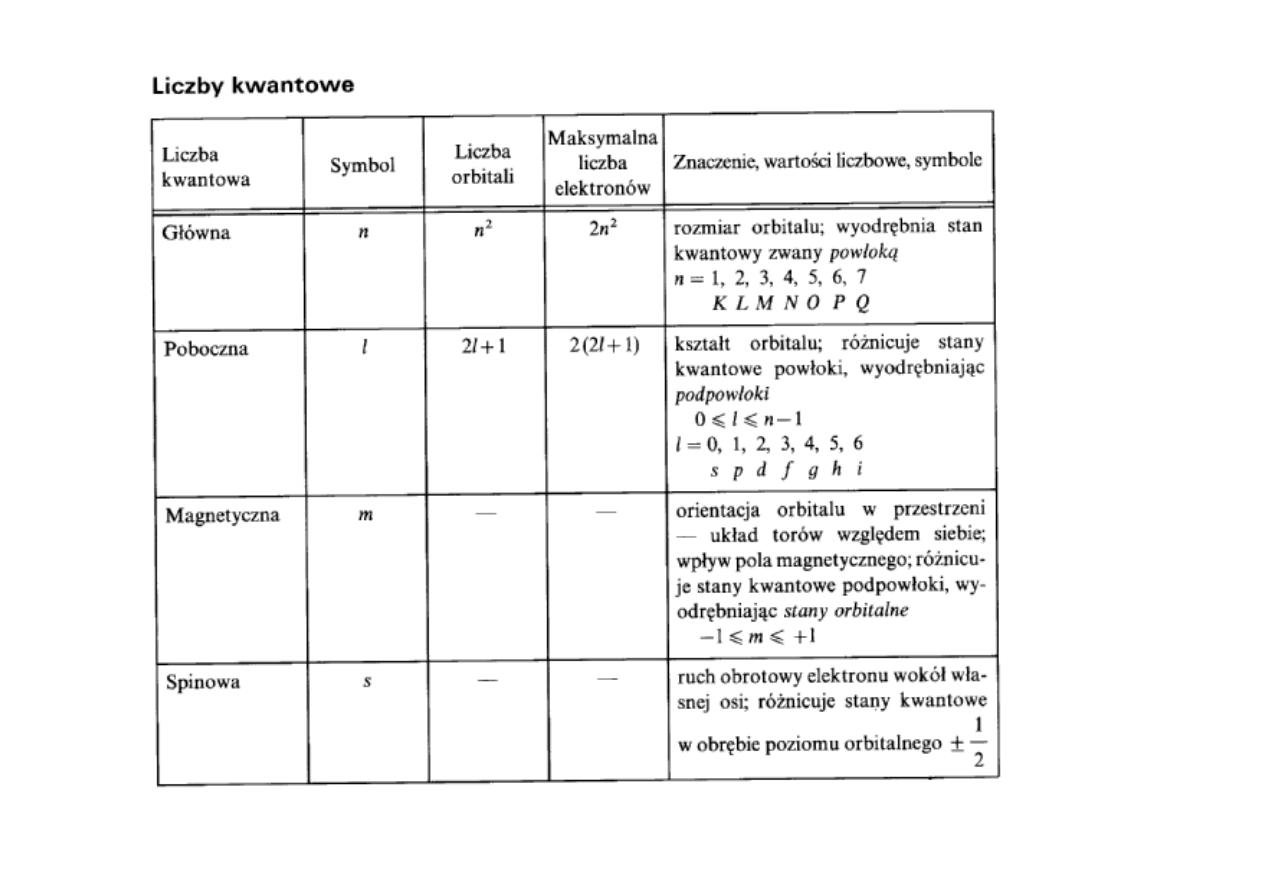
Zakaz Pauliego: w jednym atomie nie mogą istnieć dwa elektrony o
takich samych wartościach czterech liczb kwantowych.
Dlatego elektrony po kolei przyjmują różne liczby kwantowe.
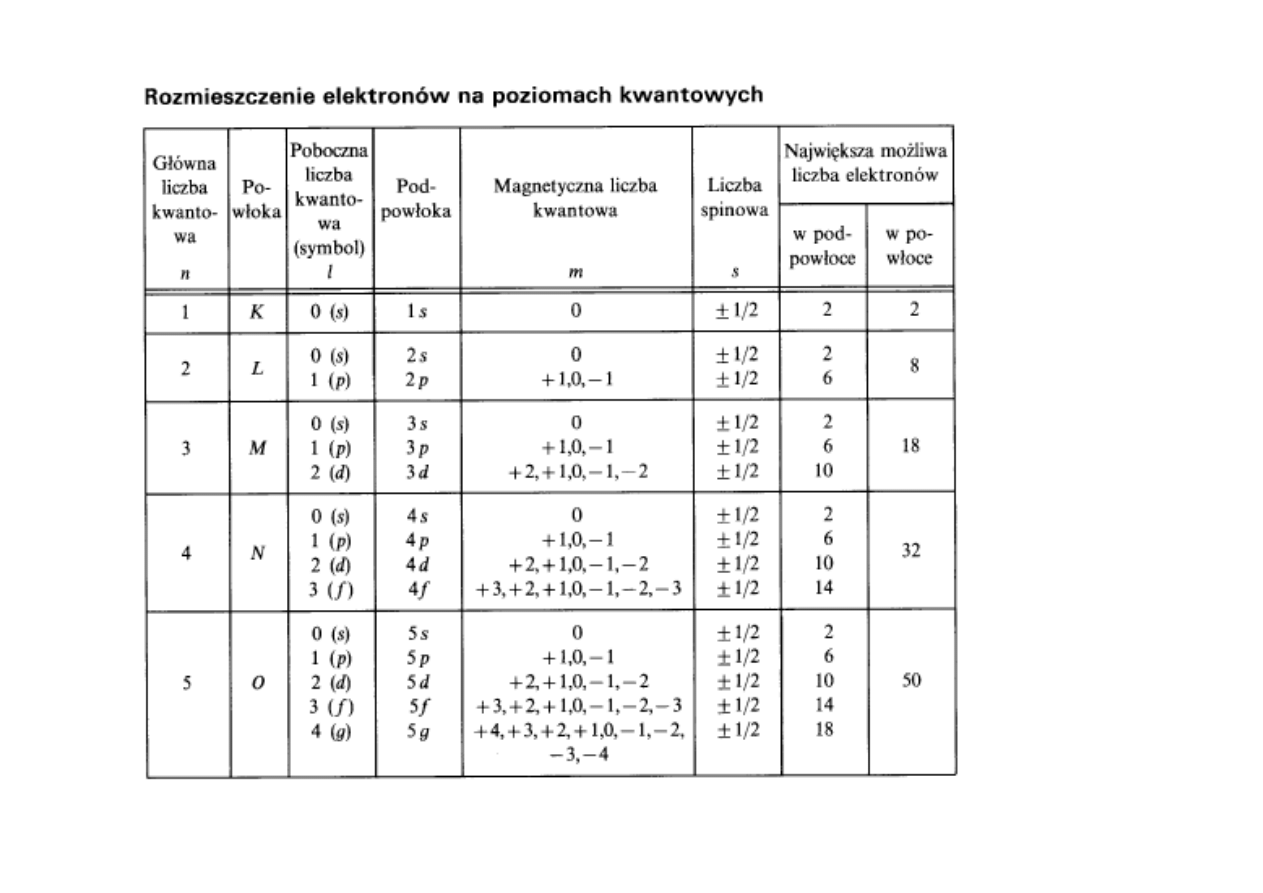
Stan energetyczny elektronu opisują 4 liczby kwantowe:
n
– główna liczba kwantowa (K, L, M, N....)
l
– poboczna (orbitalna) liczba kwantowa: (s, p, d, f,.....)
m
– magnetyczna liczba kwantowa
s
– liczba spinowa
Główna liczba kwantowa n wyznacza główne poziomy energetyczne (powłoki).
W atomie wodoru jest to kwantowanie energii jedynego elektronu
oddziałującego elektrostatycznie z jądrem.
Dla danej wartości głównej liczby kwantowej n poboczna liczba
kwantowa l może przybierać tylko wartości: 0, 1, ...(n-1)

5
Magnetyczna orbitalna liczba kwantowa m i spinowa l.k. s różnicują się
energetycznie tylko w obecności pola magnetycznego i dlatego odgrywają
mniejszą rolę.
Dopuszczalne wartości m dla danej liczby orbitalnej l: -l, -l+1, -l+2,...0,...l-2, l-1, l.
Dopuszczalne wartości s: -1/2 , +1/2.
ü
liczba orbitali dla powłoki n
In[1]:=
‚
i
=
1
n
H
2
H
n
−
i
L +
1
L êê
Simplify
Out[1]=
n
2
Liczbę orbitali wyznaczają główna i orbitalne liczby kwantowe (n, l). Poniższe
obliczenie (program obliczeniowy Mathematica) pokazuje, ze dla głównej liczby n
możliwe jest n
2
orbitali :
6
7
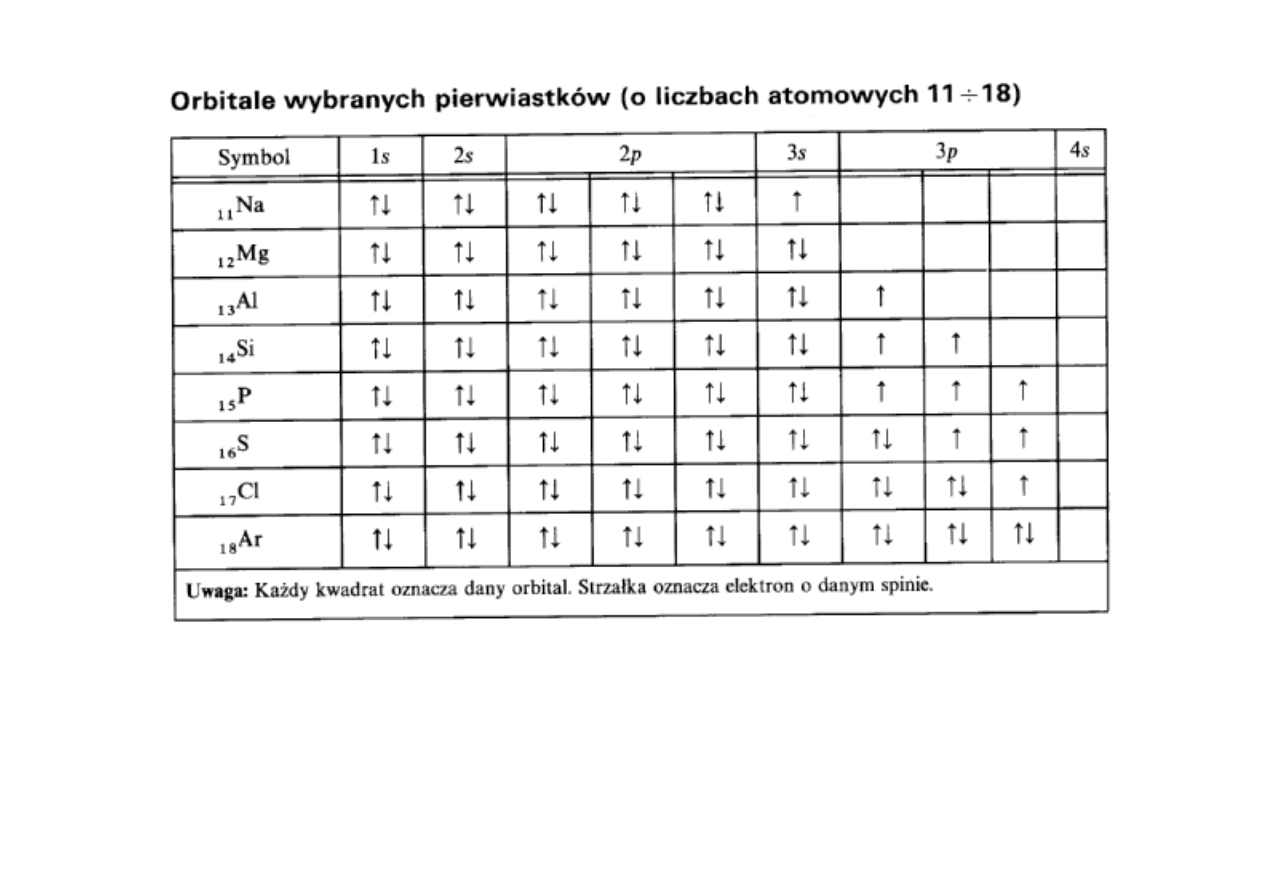
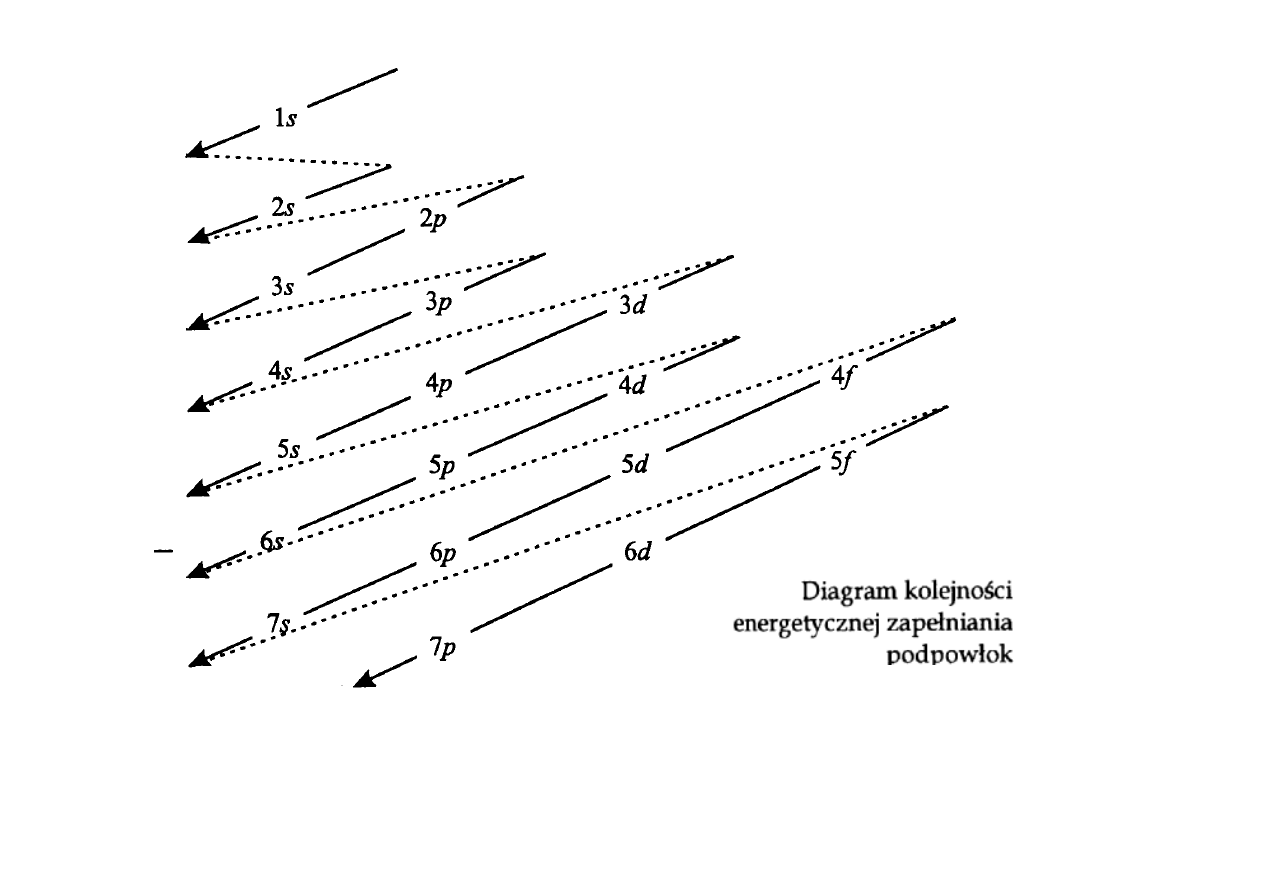
Rozbudowa orbitali począwszy od
13
Al ilustruje tzw. regułę Hunda: liczba
elektronów o równoległych (niesparowanych) spinach w najbardziej
prawdopodobnych i trwałych konfiguracjach powinna być możliwie największa.
8
9
10
11
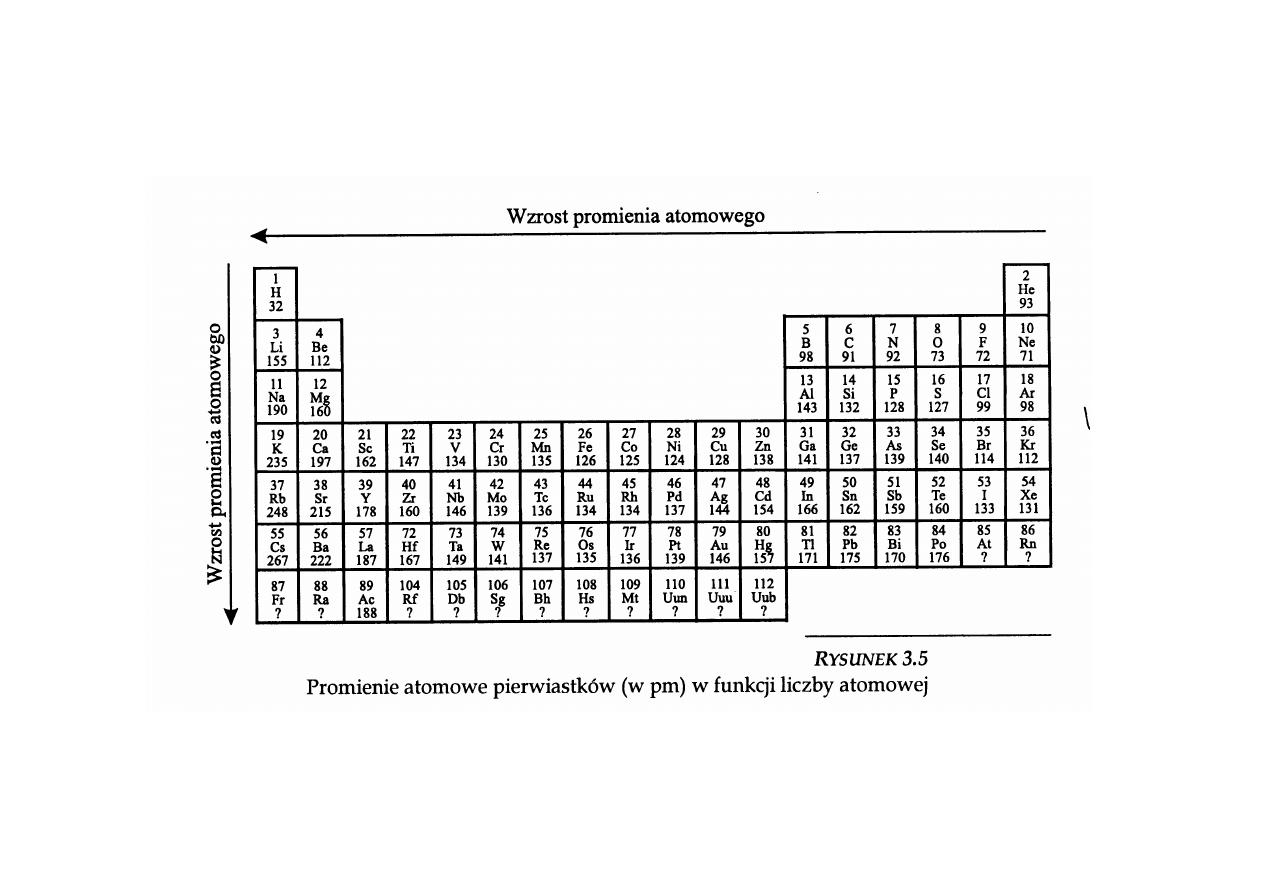
Porównanie rozmiarów atomów:
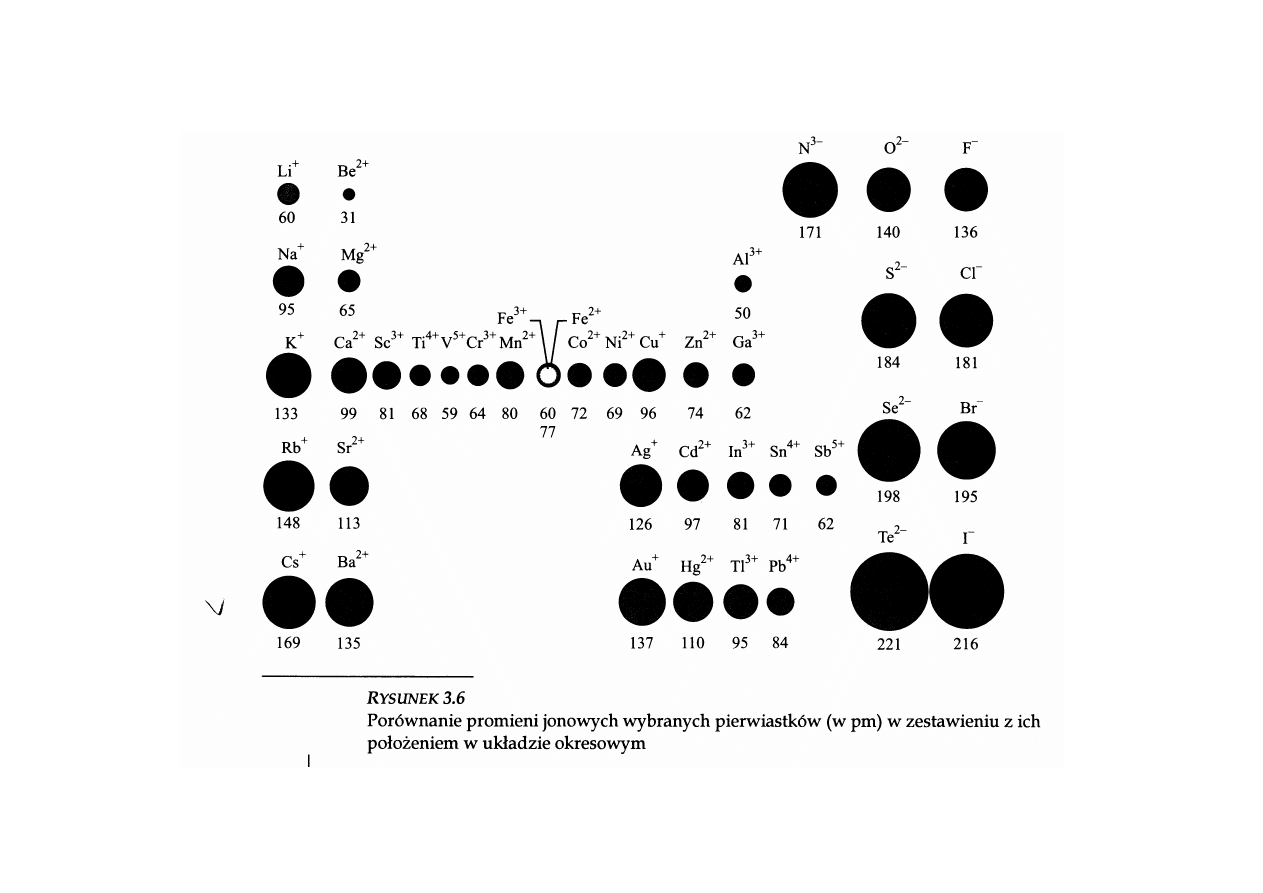
12

13
Energia jonizacji
E
j
(pierwszej, drugiej itd....):
Energia potrzebna do odłączenia elektronu od atomu w stanie
gazowym w próżni (poza zasięgiem oddziaływań z innymi atomami):
A
+
E
j
K
+
+
e
−
A
+
e
−
A
−
+
E
p
Powinowactwo elektronowe
E
p
energia uwalniana w wyniku
przyłączenia elektronu (warunki j.w.):
Elektroujemność (L. Pauling):
E
u
=
E
j
+
E
p
E
u
3
Li
=
1
Dla ustalenia skali L. Pauling
przyjął:
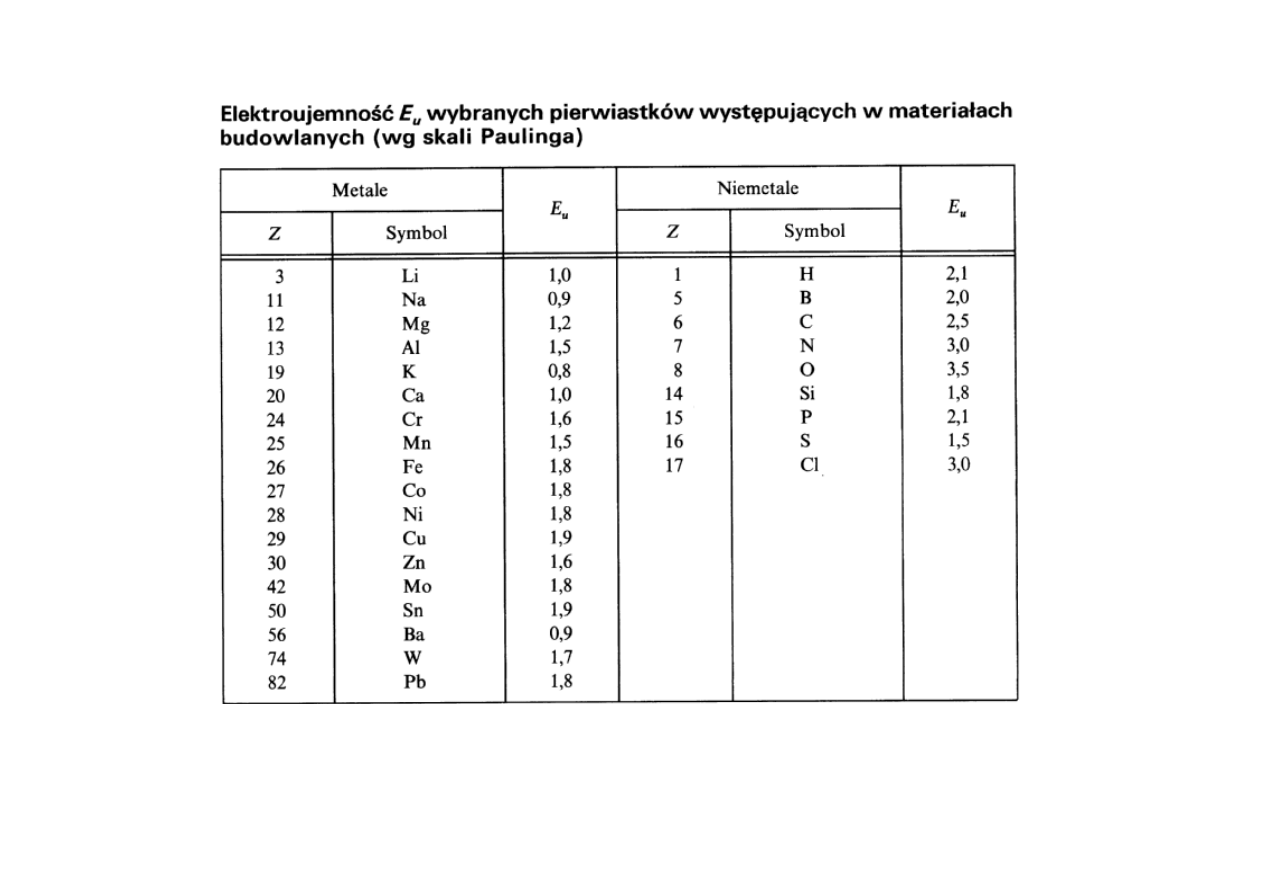
14
Wartość E
u
= 1,9 wyznacza umowną granicę między metalami (E
u
małe) i
niemetalami (E
u
duże)
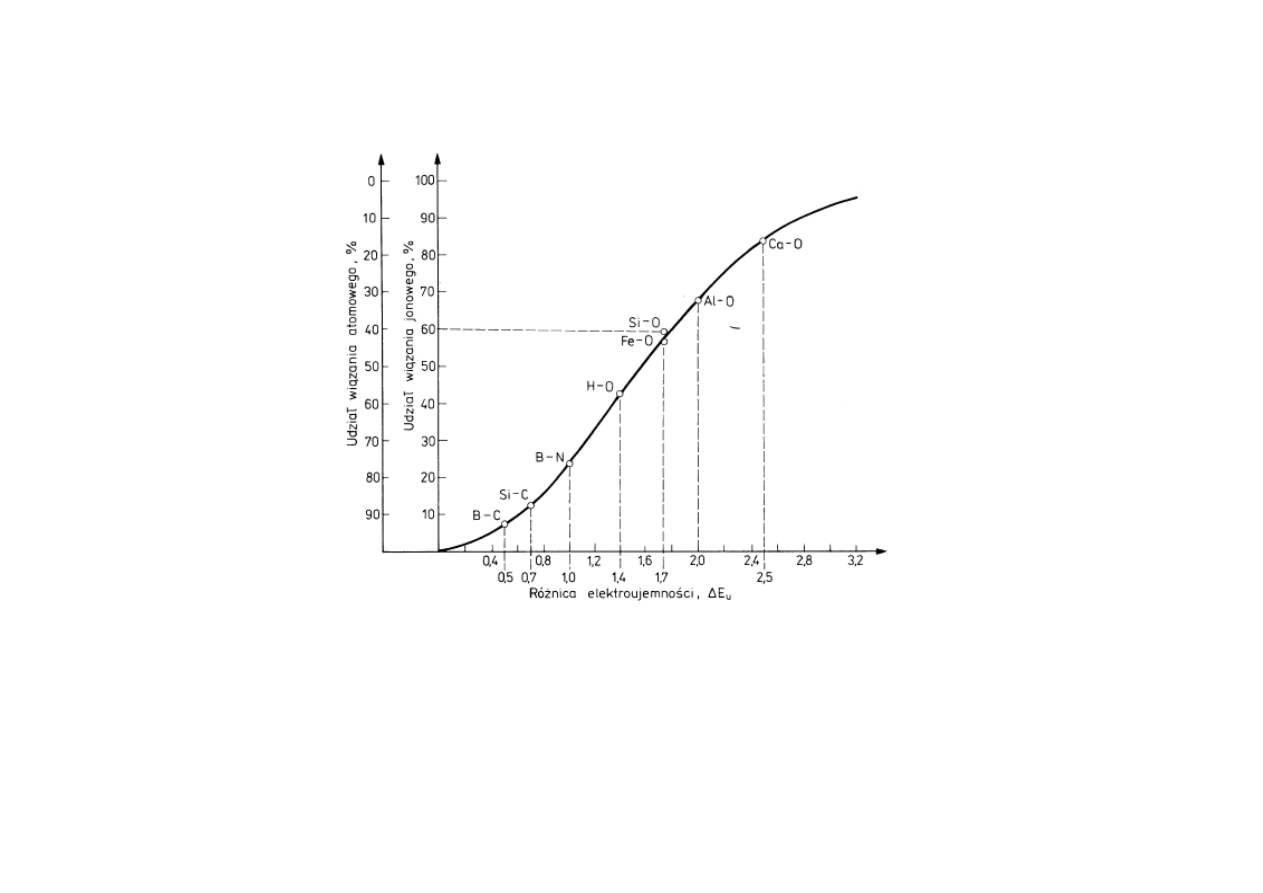
15
Udziały wiązania jonowego i kowalencyjnego (atomowego) w
zależności od różnicy E
u
.
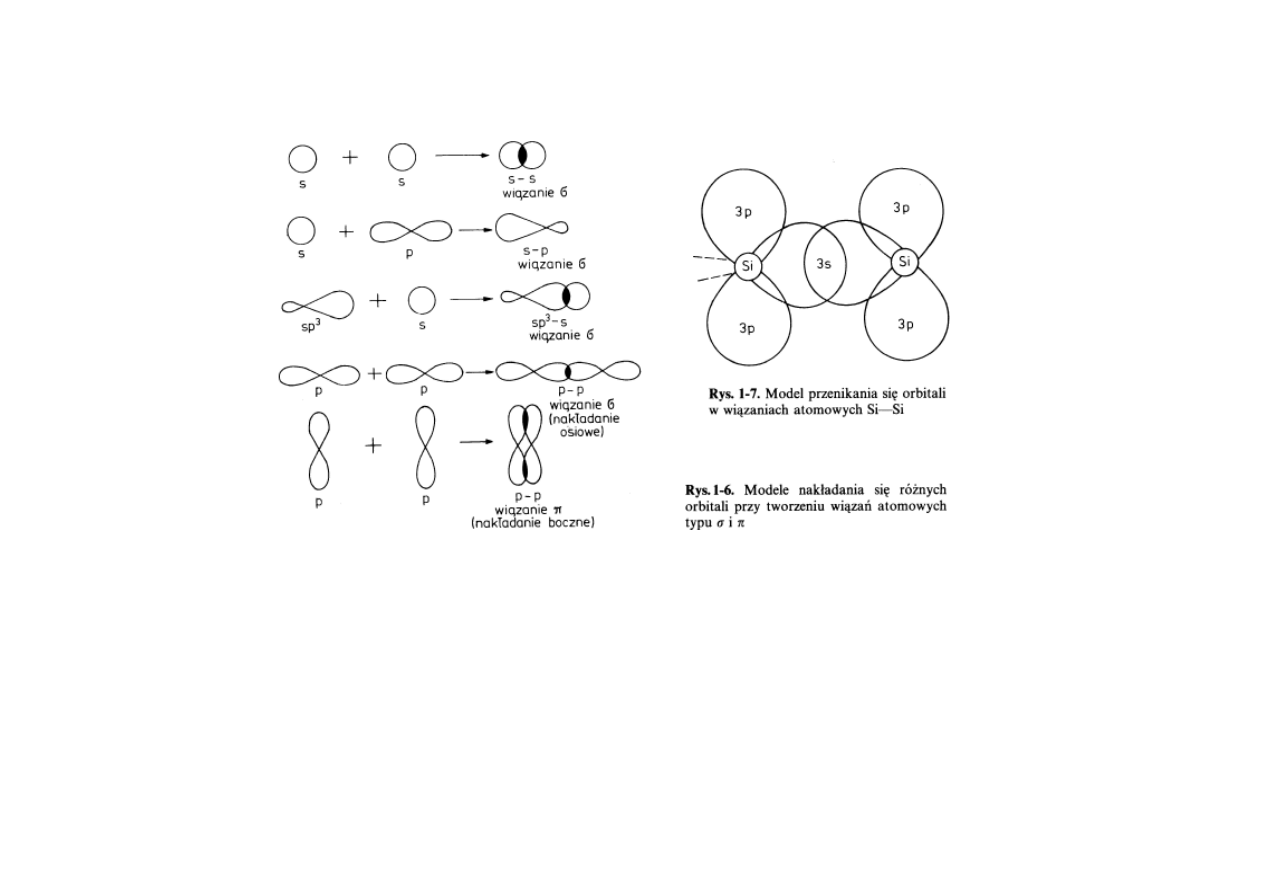
16
Wiązania kowalencyjne sigma (σ) i pi (π).
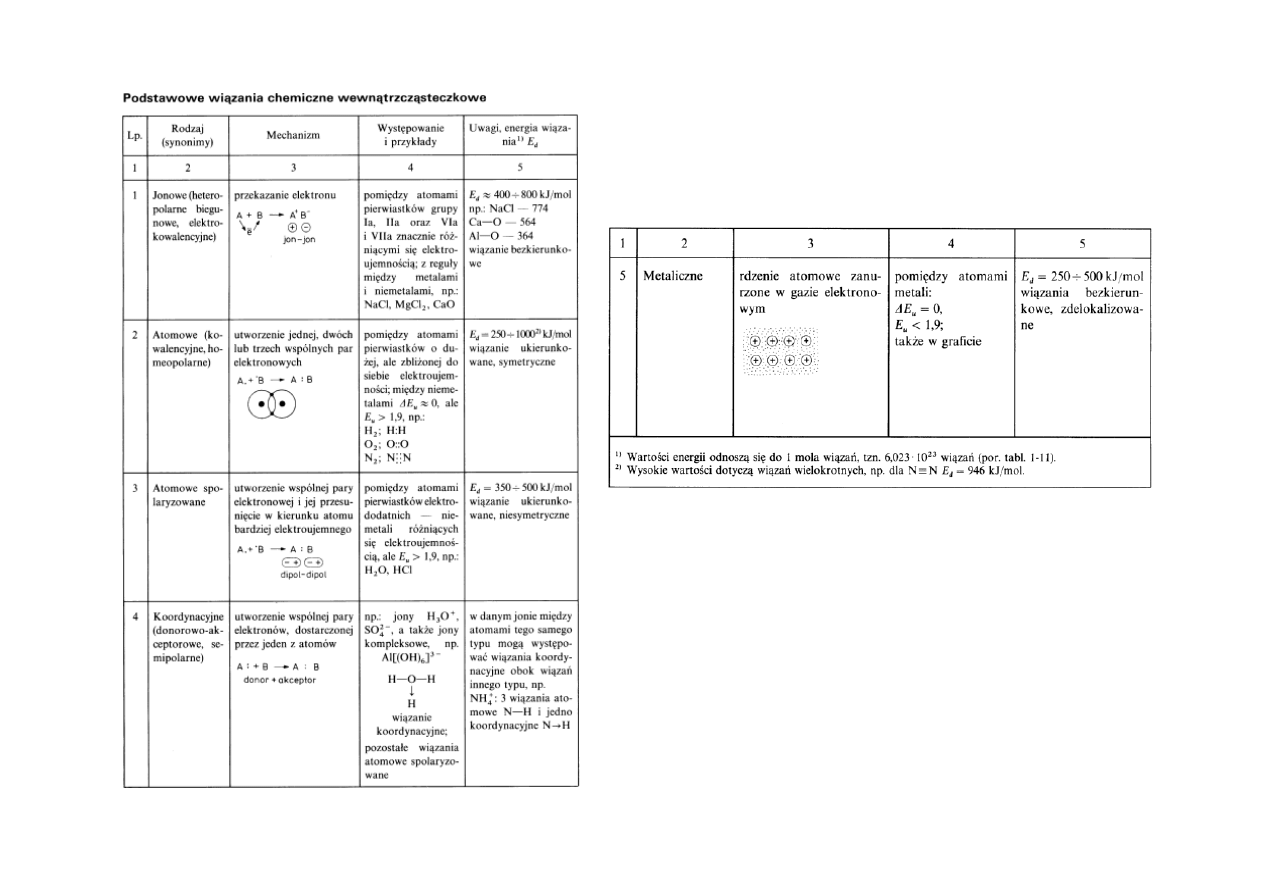
17
18
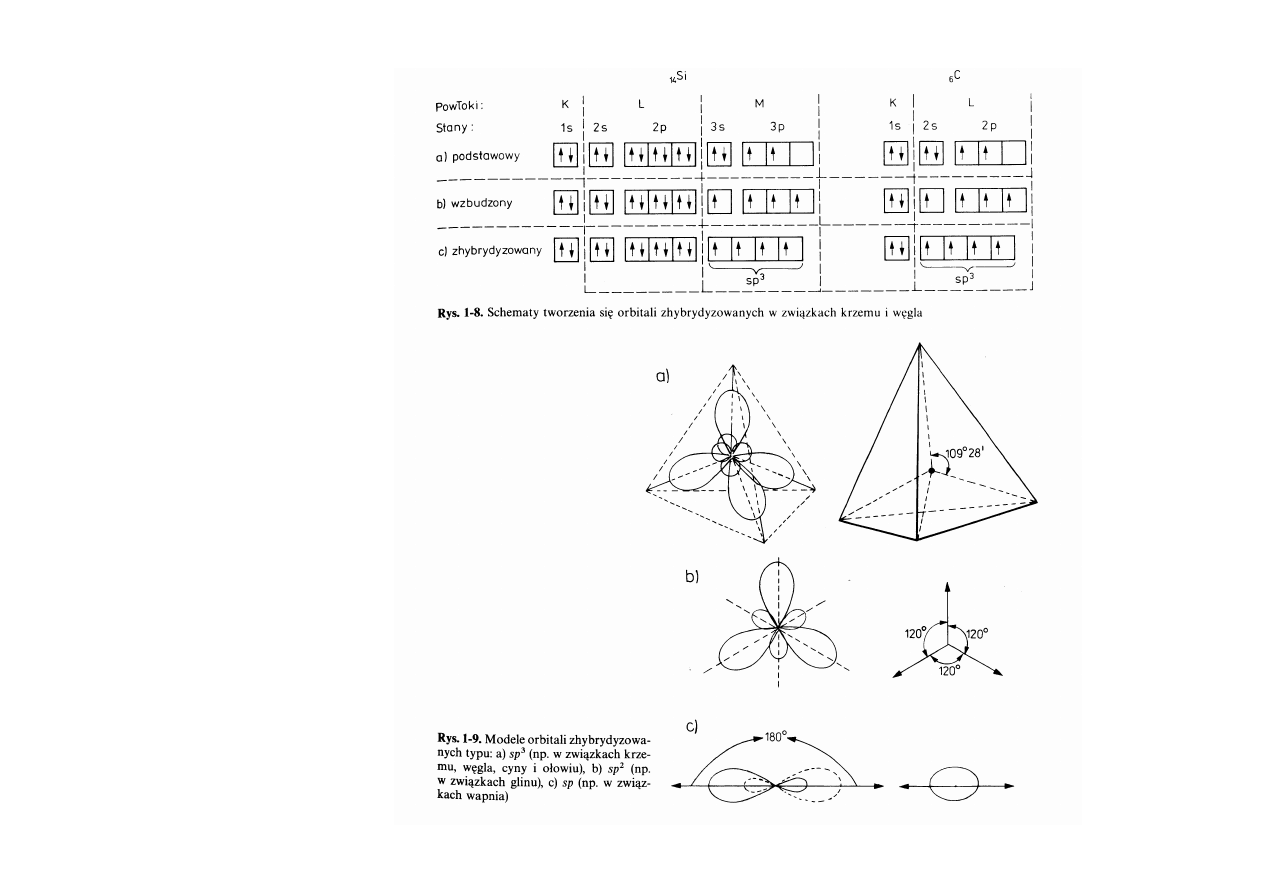
Hybrydyzacja
orbitali:
19
Wyszukiwarka
Podobne podstrony:
NO2 POM OSCYLOSKOPOWE, MIERNIC2, POMIARY OSCYLOSKOPOWE
No2
NO2 POM OSCYLOSKOPOWE, MR2 OPR, LABORATORIUM PODSTAW MIERNICTWA
Ćw.3.NO2- (2009-2010)
Spektrofotometria ?danie stężenia NO2
op7 no2 maz6
BASICS OF ENVIRONMENTAL CHEMISTRY lab no2
Zubitski suita no2
Kokorin suita dziecieca no2
KONSPEKT LEKCJI Z PILKI NO2
Chopin Valse Op64 No2 violin piano score
Liszt S268 Zwei Vortragsstuecke No2 Trauerode typeset
Rachmaninov op02 no2 Oriental Dance (vcl pno parts)
Dohnanyi (arr) Zwei Walzer von J Strauss No2 Du und Du
op6 no2 maz2
Poulenc Intermezzo No2
chopin nocturne op9 no2
MAPS Vol11 No2 Working with Difficult Psychedelic Experiences
MAPS Vol11 No2 Time
więcej podobnych podstron