ĆWICZENIE A-1
Wyznaczanie izotermy adsorpcji dla układu ciecz - ciało stałe
1.Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie izotermy adsorpcji Freundlicha kwasu octowego na węglu aktywnym.
Zadanie sprowadza się do wyznaczenia doświadczalnego współczynnika k i 1/n w równaniu Freundlicha dla konkretnego węgla aktywnego. Należy ustalić zależność ilości zaadsorbowanego kwasu na jednostkę masy w zależności od stężenia tego kwasu
2. Wykonanie ćwiczenia.
Odczynniki i aparatura:
Roztwór kwasu octowego (CH3COOH) o stężeniu C=0,5 mol/dm3.
Roztwór wodorotlenku sodowego (NaOH) o stężęniu C=0,1 mol/dm3.
Fenoloftaleina-wskaźnik.
Węgiel aktywny.
Zestaw do miareczkowania.
Wstrząsarka laboratoryjna.
Szkło laboratoryjne:
4 kolbki miarowe o pojemności 100 cm3
4 kolbki stożkowe ze szlifowanym korkiem,
4 kolbki stożkowe do sączenia,
lejki, pipety, bagietki,
8)Sączki z bibuły o średniej szybkości filtracji.
W kolbach miarowych o pojemności 100 cm3 sporządziłam cztery roztwory kwasu octowego o następujących stężeniach: 0,3; 0,20; 0,10; 0,05 mol/dm3 każdego(korzystając z roztworu kwasu octowego o stężeniu 0,5 mol/dm3). Otrzymane roztwory dokładnie mianowałam roztworem wodorotlenku sodowego o stężeniu 0,1 mol/dm3 wobec fenoloftaleiny jako wskaźnika. W tym celu
odmierzyłam 10 cm3 (pipetą miarową ) roztworu kwasu octowego o danym stężeniu do suchej kolby stożkowej i miareczkowałam dwukrotnie. Analogicznie wykonałam miareczkowanie pozostałych roztworów kwasu octowego.
Korzystając z wagi technicznej a następnie analitycznej dokładnie odważyłam na folii aluminiowej cztery odważki węgla (po około 2 g każda. Następnie odważki węgla wsypałam kolejno do czterech kolbek ze szlifem. Później do tych kolbek dodałam po 50 cm3 (odmierzyłam pipetą) każdego z przygotowanych roztworów kwasu octowego. Kolbki zamknęłam szczelnie korkiem i zawartość była wstrząsana przez 10 min na wstrząsarce. Otrzymane zawiesiny przesączyłam, z każdego przesączu pobrałam do miareczkowania próbki o objętości 10 cm3, celem oznaczenia stężenia równowagowego kwasu octowego (niezaadsorbowanego).
3. Tabela z wynikami i wykres:
Co [mol/dm3] |
Crów [mmol/dm3] |
M [g] |
X [mg] |
LOG [mg/g]
|
LOG Crów [mmol/dm3] |
0,302 |
0,243 |
1,8771 |
177,0 |
1,974 |
2,386 |
0,202 |
0,150 |
1,7416 |
156,0 |
1,952 |
2,176 |
0,101 |
0,068
|
1,6494 |
99,0 |
1,778 |
1,832 |
0,050 |
0,031 |
1,5793 |
57,0 |
1,557 |
1,491 |
Miareczkowanie 1[cm3] |
Miareczkowanie 2 [cm3] |
24,4 |
24,3 |
14,9 |
15,0 |
6,6 |
6,8 |
3,2 |
3,1 |
4. Opracowanie wyników:
![]()
• Obliczam objętość wyjściową kwasu octowego:
![]()
![]()
![]()
![]()
• Stężenia roztworów przed adsorpcją: • Stężenia roztworów po adsorpcji:
C0 = 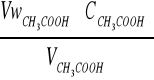
[mol/dm3] Crów =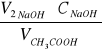
[mol/dm3]
( ![]()
)
C0 1 =![]()
Crów1 = ![]()
(243 mmol/dm3)
C02 = ![]()
Crów2 = ![]()
(150 mmol/dm3)
C03 = ![]()
` Crów3 = ![]()
(68 mmol/dm3)
C04 = ![]()
Crów4 = ![]()
(31 mmol/dm3)
• Masa próbek węgla:
M1 = 3,7062 - 1,8291 = 1,8771 g
M2 = 3,7662 - 2,0246 = 1,7416 g
M3 = 3,7300 - 2,0806 = 1,6494 g
M4 = 3,7154 - 2,1361 = 1,5793 g
• Ilość zaadsorbowanej substancji obliczam ze wzoru:
![]()
[mg]
X - liczba miligramów zaadsorbowanego kwasu octowego na węglu aktywnym.
Vkw - objętość kwasu zużyta do adsorpcji (0,05dm3)
60 - MCH![]()
COOH
![]()
![]()
![]()
![]()
![]()
• Obliczam logarytm postaci:
log![]()
![]()
Log![]()
Log![]()
Log![]()
Log![]()
![]()
=![]()
• Obliczam logarytm ze stężenia równowagowego:
Log 243 = 2,386
Log 150 = 2,176
Log 68 = 1,832
Log 31 =1,491
[logCrów] = [mmol/dm3]
• Po zlogarytmowaniu równanie Freundlicha przyjęło postać:
log![]()
= log k + ![]()
log C
• Z wykresu odczytuję wartości
tg α = ![]()
log k =1,475
α = 26o
tg 260 =0,4877
![]()
= 0,4877
• Po podstawieniu odczytanych z wykresu wartości równanie izotermy Freundlicha dla badanego układu przyjmuje postać:
log![]()
= ![]()
5.Wnioski:
W wyniku przeprowadzonego doświadczenia wyznaczyłam izotermę adsorpcji Freundlicha kwasu octowego na węglu aktywnym.
Na podstawie sporządzonego wykresu określiłam wartość współczynników k i 1/n których wartość podałam w postaci logarytmicznej.
Znając wartości tych współczynników napisałam równanie izotermy Freundlicha .
Błędy w przeprowadzonym doświadczeniu mogły wyniknąć z:
błędu odczytania ilości zużytego NaOH podczas miareczkowania
niedokładnego zważenia węgla aktywnego
zaokrągleń w obliczeniach.
Wyszukiwarka
Podobne podstrony:
Elektroenegetyka TABELKI I WYKRESY DO DRUKOWANIA
kryteria do zadania cwiczeniowego
metody sciaga do drukowania
Wstęp do Socjologi Ćwiczenia, ćwiczenie 4 0 10 2013
KOLOROWE pajace FIGUROWE mogące służyć do pokazywanych ćwiczeń ruchowych(1)
CwiczeniaKartograficzneGR3, WSKAZÓWKI I DANE DO WYKONANIA ĆWICZEŃ KARTOGRAFICZNYCH:
Ekologia zwierząt - zagadnienia - Kopia, Zagadnienia (ptaki) dla I roku Biologii, potrzebne do zalic
Word grafika 3-do zrobienia, Ćwiczenie: Wbudowana grafika - 2
Polaryzacja leków używanych do jonoforezy, Ćwiczenia, Fizykoterapia
do drukowania
wstęp do filozofii ćwiczenia 8
Socjologia Durkheima - na podstawie J. Szackiego, Studia SOCJOLOGIA - UŚ, WSTĘP DO SOCJOLOGII - ćwic
DO DRUKOWANIA
Cw 15 Wytyczne do przygotowania cwiczenia 15
Język norweski od A do Z gramatyka, ćwiczenia, tablice odmian
Cw 15, Wytyczne do przygotowania cwiczenia 15
3 materialy do tego cwiczenia i Nieznany (2)
więcej podobnych podstron