
1
Tytanowce
Grupa 4 (Grupa IV B)
tytan –
Ti
tanum
cyrkon –
Z
i
r
conium
hafn -
H
a
f
nium
Tytanowce,
wła
ś
ciwo
ś
ci ogólne
Stopnie utlenienia
:
•Najtrwalszy stopie
ń
utlenienia +IV,
⇒
energia oderwania 4
elektronów – du
ż
a,
⇒
po uwspólnieniu elektronów
s
2
i
d
2
z
innymi atomami powstaj
ą
cz
ą
steczki kowalencyjne o budowie
tetraedrycznej (np. bezwodny TiCl
4
);
•Tlenki MO
2
uwa
ż
ane za jonowe, jednak s
ą
nierozpuszczalne,
jony M
4+
nie wyst
ę
puj
ą
w roztworze
•Konfiguracja M(IV+) -
d
0
⇒
zwi
ą
zki diamagnetyczne, z reguły
białe lub bezbarwne
Promie
ń
Konfiguracja
elektronowa
Stopnie
utlenienia Kowalen-
cyjny [A]
jonowy
M
4+
[A]
t
t
[
o
C]
Zawarto
ść
w
skorupie
ziemskiej
[ppm]
EU
Ti
[Ar]3d
2
4s
2
(II) III
IV
1,32
0,68
1668
4400
1,5
Zr
[Kr]4d
2
5s
2
(II) (III)
IV
1,45
0,80
1852
220
1,4
Hf [Xe]4f
1 4
5d
2
6s
2
(III)
IV
1,44
0,80
2222
4,5
1,3
Tytanowce,
wła
ś
ciwo
ś
ci ogólne
Stopnie utlenienia
:
•Zwi
ą
zki na stopniu
utlenienia +III
s
ą
reduktorami (Ti
3+
> Sn
2+
);
do
ść
trwałe, istniej
ą
w stanie stałym i w roztworze
•Konfiguracja M(III+) -
d
1
⇒
zwi
ą
zki paramagnetyczne
(1,73MB), zabarwione (mo
ż
liwe jedno przej
ś
cie eletronowe d -
d
⇒
pasmo zakresie widzialnym
⇒
purpurowe zabarwienie
wszystkich zwi
ą
zków Ti(III));
•Zwi
ą
zki na stopniu
utlenienia +II
s
ą
bardzo nietrwałe i s
ą
silnymi reduktorami
⇒
nieliczne wyst
ę
puj
ą
tylko w stanie
stałym;
•Ni
ż
sze stopnie utlenienia (0, -I, -II)
wyst
ę
puj
ą
w kompleksach
dipirydylowych tytanu;
•Zwi
ą
zki na ni
ż
szych stopniach utlenienia wykazuja tendencj
ę
do dysproporcjonowania:
2TiCl
3
→
TiCl
4
+ TiCl
2
2TiCl
2
→
TiCl
4
+ Ti
Tytanowce,
wła
ś
ciwo
ś
ci ogólne
Rozmiary atomów
:
•Promie
ń
kowalencyjny i jonowy wzrastaj
ą
normalnie przy
przej
ś
ciu od Ti do Zr, ale przy przej
ś
ciu od Zr do Hf – zupełny
brak wzrostu (kontrakcja lantanowcowa);
•Prawie identyczne rozmiary atomów Zr i Hf oraz podobna
struktura elektronowa
⇒
niemal jednakowe ich wła
ś
ciwo
ś
ci
chemiczne
⇒
niezwykła trudno
ść
rozdzielenia
Tytanowce,
wyst
ę
powanie
Wa
ż
niejsze rudy
Pierwiastek
Zawarto
ść
w skorupie
ziemskiej
[ppm]
nazwa
skład
rutyl
TiO
2
Ti
4400
ilmenit
FeTiO
3
cyrkon
ZrSiO
4
Zr
220
baddeleit
ZrO
2
Hf
4,5
*
*
nie tworzy własnych minerałów, wyst
ę
puje w
rudach cyrkonu
Tytan,
otrzymywanie
ilmenit (FeTiO
3
)
H
2
SO
4
r-r FeSO
4
+
Fe
2
(SO
4
)
2
+ TiOSO
4
r-r FeSO
4
+ TiOSO
4
wiórki Fe
r-r TiOSO
4
krystalizacja
gotowanie z nadmiarem wody
odparowanie
FeSO
4
⋅
7H
2
O
pra
ż
enie
TiO
2
aq.
Ti surowy
TiO
2
ogrzewanie
C + Cl
2
TiCl
4
Mg, argon
Metoda Krolla
Metoda ICI
Na, argon
2
Tytan,
otrzymywanie
1400
o
C
I
2
(50 – 250
o
C)
TiI
4
Ti surowy
metoda van Arkela
drut wolframowy
Ti
wysokiej
czysto
ś
ci
Ti surowy
TiCl
3
, K
2
[TiF
6
]
elektroliza
stapianie z NaCl i KCl
Tytan,
wła
ś
ciwo
ś
ci
Fizyczne:
•Metal bardzo twardy, trudno topliwy;
•Dobry przewodnik ciepła i elektryczno
ś
ci;
•Odporno
ść
na korozj
ę
wi
ę
ksza od stali nierdzewnej (znacznie
l
ż
ejszy od stali) („cudowny metal”)
Chemiczne:
•Metal niereaktywny (pasywny) w niskich temperaturach (pokrywa si
ę
cienk
ą
nieprzepuszczalna warstw
ą
tlenkow
ą
);
•W temp. pokojowej nie ulega działaniu ani kwasów, ani alkaliów
•Na gor
ą
co powoli roztwarza si
ę
w st. HCl (Ti
3+
) i w HNO
3
(TiO
2
.nH
2
O);
•Najlepiej rozpuszcza si
ę
w HF (Ti + 6HF
→
H
2
[TiF
6
]
+ 2H
2
)
•W podwy
ż
szonych temperaturach (>600
o
C) jest bardzo reaktywny:
w bezpo
ś
redniej reakcji daje TiO
2
, TiX
4
, mi
ę
dzyw
ę
złowe azotki i
w
ę
gliki, sproszkowany absorbuje wodór tworz
ą
c zwi
ą
zek o składzie
granicznym TiH
2
(własno
ś
ci ró
ż
ne od wodorków jonowych)
Tytanowce,
zastosowanie
Ti - silniki odrzutowe, turbiny gazowe
Ti - w przemy
ś
le lotniczym, okr
ę
towym i chemicznym
Ti, Zr - dodatki stopowe do stali
Zr – getter w lampach pró
ż
niowych
Zr – materiał osłonowy elementów paliwowych w
reaktorach j
ą
drowych (wolny od Hf)
TiO
2
stosowany w du
ż
ych ilo
ś
ciach jako biały pigment
do farb i
ś
rodek zm
ę
tniajacy w ceramice (jest 10x
skuteczniejszy od bieli ołowianej i nietoksyczny);
TiO
2
– jako dodatek do papieru,
ś
rodek do matowania i
wybielania nylonu
ZrO
2
– materiał na ogniotrwałe tygle i wykładziny pieców
(t
t
= 2700
o
C)
Tytanowce,
zwi
ą
zki
Stopie
ń
utlenienia +IV
Bardzo trwałe jonowe dwutlenki MO
2
, nierozpuszczalne w wodzie, nielotne,
po wypra
ż
eniu ogniotrwałe.
TiCl
4
+ H
2
O
→
TiOCl
2
→
TiO
2
.nH
2
O (Ti(OH)
4
nie jest znany)
Zasadowo
ść
: TiO
2
(amfoteryczny) < ZrO
2
<HfO
2
TiOSO
4
←
←
←
←
(st. H
2
SO
4
)
←
←
←
←
TiO
2
.nH
2
O
→
→
→
→
(st. NaOH)
→
→
→
→
Na
2
TiO
3
.nH
2
O
TiO
2
+ Na
2
CO
3
(NaOH) stapianie
→
→
→
→
Na
2
TiO
3
(bezwodny
tytanian
)
CaTiO
3
– perowskit, Fe
II
TiO
3
– ilmenit,
BaTiO
3
(silne wła
ś
ciwo
ś
ci ferroelektryczne)
ZrO
2
+ CaO
→
→
→
→
CaO.ZrO
2
)
(nie CaZrO
3
)
Nie istniej
ą
w wodzie jony Ti
4+
(zbyt du
ż
y potencjał jonowy), a powstaj
ą
sole
zasadowe. Jon tytanylowy wyst
ę
puje w postaci spolimeryzowanych
ła
ń
cuchów (TiO
2+
)
n
W roztworze nie wyst
ę
puj
ą
jony Zr
4+
, a jon cyrkonylowy ZrO
2+
polimeryzuje.
Najwa
ż
niejszy zwi
ą
zek cyrkonylowy - ZrOCl
2
(tlenochlorek cyrkonu) zawiera
jon [Zr
4
(OH)
8
(H
2
O)
16
]
8+
Zr(SO
4
)
2
⋅⋅⋅⋅
2H
2
O
⇔
⇔
⇔
⇔
H
2
[ZrO(S O
4
)
2
]
⋅⋅⋅⋅
3H
2
O; ZrO(NO
3
)
2
⋅⋅⋅⋅
2H
2
O
r-r Ti(IV )
→
→
→
→
(H
2
O
2
)
→
→
→
→
r-r pomara
ń
czowy
⇒
kolorymetryczne oznaczanie Ti
Tytanowce,
zwi
ą
zki
Stopie
ń
utlenienia +IV
Halogenki MX
4
TiCl
4
+ 4HBr
→
TiBr
4
+ 4HCl
Wszystkie ulegaj
ą
hydrolizie (fluorki s
ą
najtrwalsze). Hydroliza TiCl
4
jest
całkowita, hydroliza ZrCl
4
przebiega do trwałego tlenochlork u.
MX
4
- akceptory elektronów ró
ż
nych donorów
⇒
kompleksy
TiF
4
+ 2HF (st.)
→
→
→
→
[TiF
6
]
2-
trwały
TiCl
4
+ 2HCl (st.)
→
→
→
→
[TiCl
6
]
2-
nietrwały
(inne ligandy: fosfiny R
3
P, arsyny R
3
As, etery R
2
O, pirydyna, amoniak)
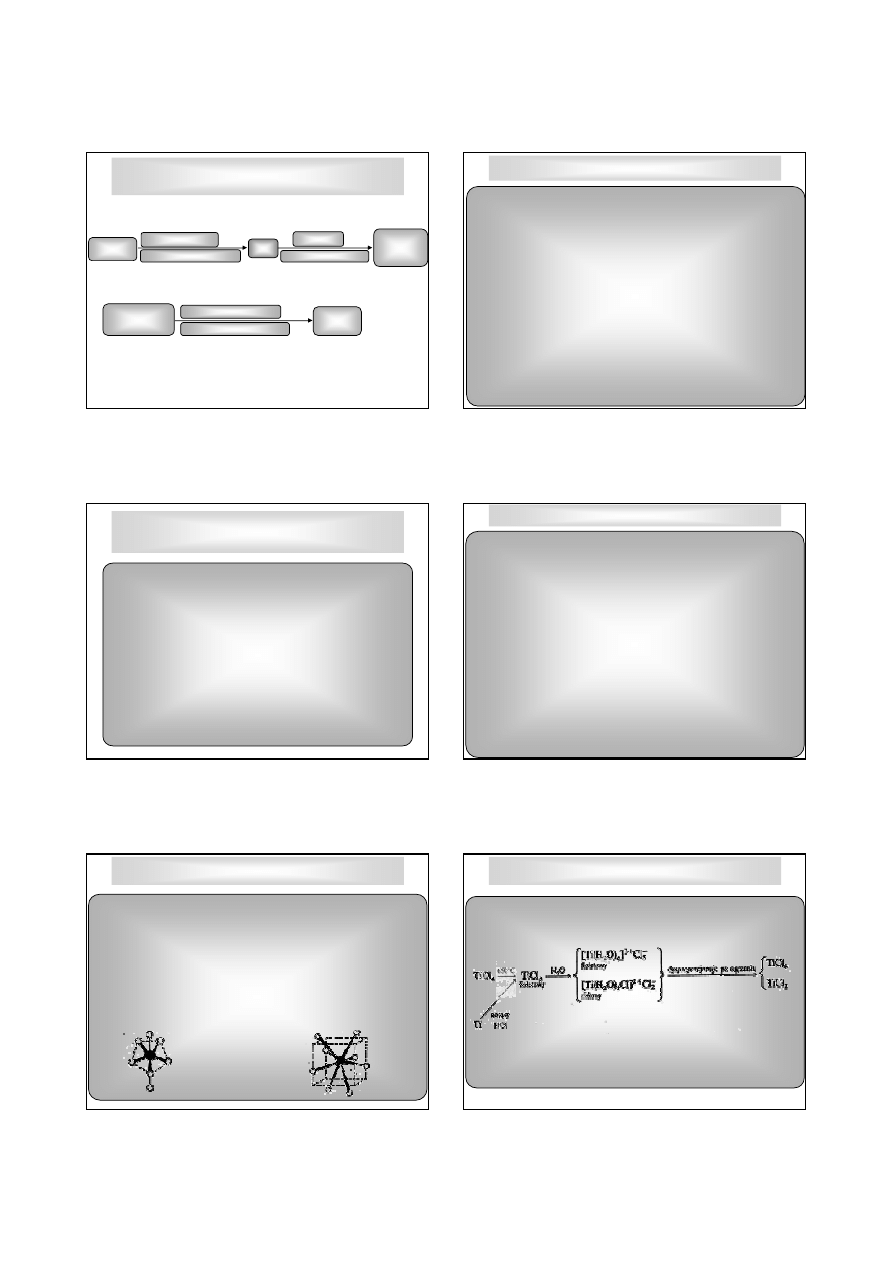
Kompleksy oktaedryczne np. [TiF
6
]
2-
, ale tak
ż
e o LK = 7 (bipiramida
pentagonalna np. Na
3
[ZrF
7
], Na
3
[HfF
7
], o LK = 8 (bisfenoid) Na
4
[Zr(Hf)F
8
]
Tytanowce,
zwi
ą
zki
Stopie
ń
utlenienia +III
Konfiguracja d
1
⇒
zwi
ą
zki paramagnetyczne,barwne;
Ti(III) bardziej zasadowy, nieroz puszczalny w nadmiarze alk aliów
[TiF
6
]
3-
, [TiBr
2
(dpy)
2
]
+
[Ti Br
4
(dpy)]
-
Zr(III) i Hf(III) s
ą
nietrwałe w wodzie i istniej
ą
tylko w stanie stałym

3
Tytanowce,
zwi
ą
zki metaloorganiczne
Al(Et)
3
+ TiCl
4
→
→
→
→
brunatna substancja (katalizator Zieglera-Natty)
Aktywny jest powstaj
ą
cy in situ Ti
III
Szereg met aloorganicznych zwi
ą
zków Ti
II
ma zdolno
ść
wi
ą
zania gazowego
N
2
z utworzeniem NH
3
Wyszukiwarka
Podobne podstrony:
02-Przybycie Tytanów, J. Kaczmarski - teksty i akordy
Tytanowce, chemia
Mity Greckie (powstanie świata, tytanomachia i gigantomachia)
Dobry?ch cynkowo tytanowy
Tajemniczy tytanowy złom spadł z nieba nad Syberią, PAMIĘTNIK
Pokrycia tytanowo cynkowe, Nauka, Budownictwo, Dachy
Żółcień tytanowa
Kości z pianki tytanowej, Kości z pianki tytanowej
24 Opisać różnice w budowie i działaniu sondy lambda cyrkonowej i tytanowej
Risen 3 Wladcy Tytanow poradnik do gry
Tytanowe kostki
więcej podobnych podstron