
1
ĆWICZENIE 5
Wykrywanie grup funkcyjnych w związkach organicznych
I. Reakcje charakterystyczne odróżniające węglowodory alifatyczne
nasycone od nienasyconych
1. Próba przyłączenia (addycji) bromu
Węglowodory nienasycone oraz ich pochodne odbarwiają roztwór bromu wskutek reakcji
przyłączania.
H
H
H
H
Br
Br
H
H
H
H
Br
Br
+
Wykonanie:
Do około 0,5 ml badanej substancji dodawać kroplami 1% roztwór bromu w kwasie
octowym, starannie mieszając zawartość probówki. W obecności wiązań wielokrotnych w
badanym związku pomarańczowa barwa bromu szybko znika, aż do momentu wysycenia
wszystkich wiązań wielokrotnych.
2. Próba z nadmanganianem potasowym KMnO
4
wg Lehmana
W obecności związków zawierających wiązania nienasycone następuje odbarwienie
roztworu KMnO
4
, w wyniku redukcji manganu(VII) do manganu(IV). W miarę postępu reakcji
środowisko staje się alkaliczne (powstaje wodorotlenek potasu) i w mieszaninie reakcyjnej może
pojawić się brunatny osad ditlenku manganu.
KOH
MnO
2
KMnO
4
O
H
2
C
C
C
C
OH OH
2
2
2
3
+
+ 4
+ 3
+
KOH
MnO
2
KMnO
4
O
H
2
1
R
1
COOH
2
2
2
+
+
+
+
R
C
C
R
RCOOH +
2
Wykonanie:
Do około 1ml badanej substancji dodawać kroplami 0,1% roztwór KMnO
4
w acetonie. Po
dodaniu każdej kropli roztwór starannie wymieszać i odczekać do zniknięcia różowego
zabarwienia dodanego KMnO
4
. Ilość odbarwionego roztworu oraz szybkość jego odbarwienia
zależy od ilości wiązań wielokrotnych w cząsteczce badanego związku.

2
II. Badanie właściwości chemicznych alkoholi i fenoli
1. Próba Lucasa
Alkohole I, II i III-rzędowe zachowują się różnie w reakcji z odczynnikiem Lucasa (roztwór
bezwodnego chlorku cynku w stężonym kwasie solnym).
Alkohole I-rzędowe, niższe od heksylowych (C
6
), nie reagują z tym odczynnikiem, dając
roztwór klarowny, co najwyżej lekko ściemniały.
W obecności alkoholi II-rzędowych następuje zmętnienie roztworu, a po 1-1,5 godz.
rozdzielenie się warstw.
W obecności alkoholi III-rzędowych roztwór mętnieje i szybko wytwarzają się dwie
warstwy.
ZnCl
2
2
(R )H
C
O H
R
R
+ H C l
(R )H
C
R
R
C l + H O
Wykonanie:
(wykonać pod dygestorium 1 próbę na grupę)
Do 3 suchych probówek z korkiem szlifowym, zawierających po 0,5 ml kolejno: alkohol
I-rzędowy, alkohol II-rzędowy i alkohoI III-rzędowy dodać po 5 ml odczynnika Lucasa (bezwodny
ZnCl
2
w stężonym HCl). Probówki zakorkować, wstrząsnąć przez chwilę, po czym odstawić i
zaobserwować po jakim czasie utworzy się zmętnienie i rozdzielenie warstw, wyciągnąć
wnioski.
2. Próba z siarczanem rtęci(II) na alkohole III-rzędowe wg Deniges`a
Reakcję tą dają tylko alkohole III-rzędowe, z których po dehydratacji powstają węglowodory
nienasycone. Powstałe alkeny reagują z HgSO
4
tworząc osady o barwach od żółtej do
czerwonej. Alkohole II-rzędowe dają w tych warunkach tylko zmętnienie, a I-rzędowe jedynie
opalescencję, gdyż szybkość powstawania z nich alkenów jest minimalna.
Wykonanie:
Do około 1 ml odczynnika Deniges`a (roztwór siarczanu(VI) rtęci(II) - w rozcieńczonym
kwasie siarkowym(VI)) dodać 0,5 ml roztworu alkoholu III-rzędowego i ogrzewać próbę we
wrzącej łaźni wodnej, aż do pojawienia się osadu o barwie żółtej. W czasie dalszego
ogrzewania barwa żółta znika
.
3. Próba estryfikacji
Ester metylowy kwasu salicylowego otrzymuje się przez ogrzewanie alkoholu metylowego z
kwasem salicylowym w obecności stężonego kwasu siarkowego(VI) jako katalizatora, a
zarazem środka wiążącego powstającą w reakcji wodę.

3
OH
C
O
HO
CH
3
H
+
OH
C
O
O
CH
3
H
2
O
OH
+
+
kwas salicylowy
salicylan metylu
Wykonanie:
Do około 1 ml metanolu dodać szczyptę kwasu salicylowego i około 1 ml stężonego kwasu
siarkowego(VI). Po wymieszaniu próbę ogrzewać we wrzącej łaźni wodnej. Po kilku minutach
ogrzewania pojawia się charakterystyczna, żywiczna woń estru metylowego kwasu
salicylowego
.
4. Próba jodoformowa Liebena
Spośród alkoholi I-rzędowych reakcji jodowania w opisanych warunkach ulega jedynie alkohol
etylowy. Reakcję tę dają natomiast metyloketony (aceton). Sumaryczny zapis reakcji jest
następujący:
C H
3
C H
2
O H
I
2
N a O H
H C O O N a
N a I
O
H
2
C H I
3
+
+ 6
+
+
+ 5
jo d o fo rm
5
4
Wykonanie:
Do około 0,5 ml roztworu etanolu dodać 1ml roztworu jodu w jodku potasu (płyn Lugola − I
2
w
KI). Następnie powoli kroplami dodawać 2M wodny roztwór NaOH, aż do zmiany brunatnej
barwy jodu na żółtą. Po wymieszaniu i lekkim ogrzaniu próby w łaźni wodnej, pojawia się
charakterystyczny zapach, a następnie żółty osad jodoformu - CHI
3
.
5. Reakcja z chlorkiem żelaza(III)
Chlorek żelaza(III) daje z fenolami i ich pochodnymi, posiadającymi wolną grupę
hydroksylową związki o zabarwieniu fioletowym, fioletowo-niebieskim, niebieskim, zielonym,
rzadziej czerwonym. Przebieg reakcji zależy od budowy fenolu i obecności w jego cząsteczce w
pozycji orto grupy kompleksotwórczej (aldehydowa, ketonowa, karboksylowa, hydroksylowa lub
sulfonowa). Fenole, które nie mają takiej grupy kompleksotwórczej w pozycji orto, reagują z
FeCl
3
tylko w środowisku wodnym, z utworzeniem soli żelazowych o nietrwałym zabarwieniu.
Fenole mające w pozycji orto grupę kompleksotwórczą dają z FeCl
3
typowe związki chelatowe o
trwałym zabarwieniu.
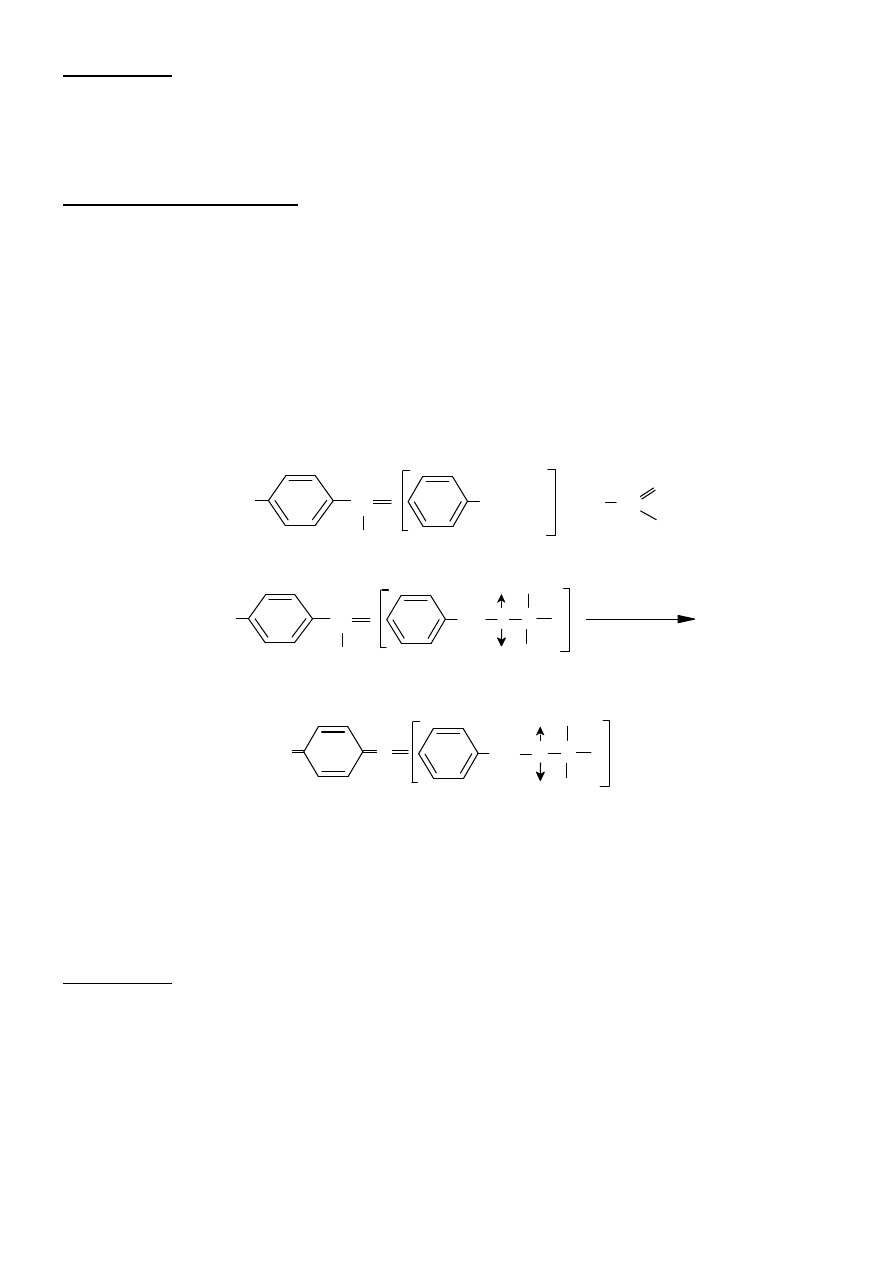
4
Wykonanie:
Do około 1 ml wodnego roztworu fenolu dodać 1 kroplę roztworu FeCl
3.
Powstaje fioletowe
zabarwienie, które znika po zakwaszeniu 1M H
2
SO
4
.
III. Aldehydy i ketony
1. Próba z fuksyną na aldehydy – reakcja Schiffa
Fuksyna jest czerwonym barwnikiem, który pod wpływem ditlenku siarki przechodzi w
bezbarwny kwas bis-N-aminosulfinowy, tzw. odczynnik Schiffa. Związek ten reaguje z dwiema
cząsteczkami aldehydu dając nietrwały produkt przyłączenia, który traci kwas siarkowy(IV) i
powstaje fioletowo-purpurowy barwnik chinoidowy zgodnie z reakcją:
2
SO
3
H
NHSO
2
H
2
H N
C
+ 2R
C
O
H
2
SO
3
H
NH S
O
O
C
OH
H
R
2
_
H
2
SO
3
H N
C
HN
C
NH
S
O
O
C
OH
H
R
2
Podobnie reagują 2-deoksycukry (np. 2-deoksyryboza), natomiast inne cukry posiadające grupę
hydroksylową przy węglu sąsiadującym z grupą aldehydową lub ketonową nie przywracają
barwy odbarwionej fuksynie.
Wykonanie:
Do dwóch probówek odmierzyć po około 2 ml roztworu aldehydu mrówkowego
(formaldehydu) i roztworu glukozy, dodać 3-4 krople odczynnika Schiffa i lekko wymieszać. Po
upływie kilku minut roztwór aldehydu mrówkowego zabarwia się na kolor purpurowo-fioletowy,
natomiast roztwór glukozy pozostaje bezbarwny.

5
2. Próby redukcyjne na aldehydy
Aldehydy, w odróżnieniu od ketonów, łatwo utleniają się do kwasów, działają zatem
redukująco. Utlenianie jest możliwe, gdy w mieszaninie reakcyjnej znajdują się akceptory
elektronów. Najczęściej stosowanymi do utleniana grupy aldehydowej akceptorami elektronów
są jony metali ciężkich: Cu
2+
(próby: Fehlinga, Trommera, Hainesa, Benedicta), Bi
3+
(próba
Nylandera) i Ag
+
(próba Tollensa).
2a) Próba Fehlinga
W próbie Fehlinga po zmieszaniu odczynników Fehling I (CuSO
4
×5H
2
O w rozcieńczonym
H
2
SO
4
) i Fehling II (roztwór winianu sodowo-potasowego i NaOH) powstaje zasadowy roztwór
kompleksu miedzi z winianem, co zapobiega wytrącaniu się osadu Cu(OH)
2
i maskowaniu
końcowego
produktu
reakcji - czerwonego osadu Cu
2
O.
Dodany aldehyd ulega utlenieniu oddając elektrony, których akceptorem jest
dwuwartościowa miedź. Kompleks miedzi z winianem po ogrzaniu rozpada się i powstaje
czerwony osad tlenku miedzi(I).
C
2
H
4
O
2
(COO)
2
NaK
CuSO
4
NaOH
-
Na
2
SO
4
2
+
2
+
2
+ 6H
2
O
4
H
C
2
H
4
O
2
(COO)
2
O
C
Cu
2+
H
2
O
2
x
x
+
R
3
OH
C
2
H
4
O
2
(COO)
2
NaK
O
C
H
2
O
Cu
2
O
R
+
ogrzanie
2
+
+
2
Wykonanie:
Zmieszać po 1 ml roztworów Fehling I i II, ogrzać do wrzenia aby sprawdzić czy nie
wystąpi redukcja własna odczynnika. Następnie dodać kilka kropli roztworu aldehydu
mrówkowego i ponownie ogrzać. Pojawia się osad o barwie pomarańczowej lub czerwonej,
zależnie od stanu rozproszenia powstającego tlenku miedzi(I).
2c) Próba Tollensa (próba lustra srebrowego) — 1 próba na salę
Odczynnik Tollensa stanowi roztwór wodorotlenku diaminasrebra, który przygotowuje się
bezpośrednio przed użyciem w czystej, dokładnie odtłuszczonej probówce.
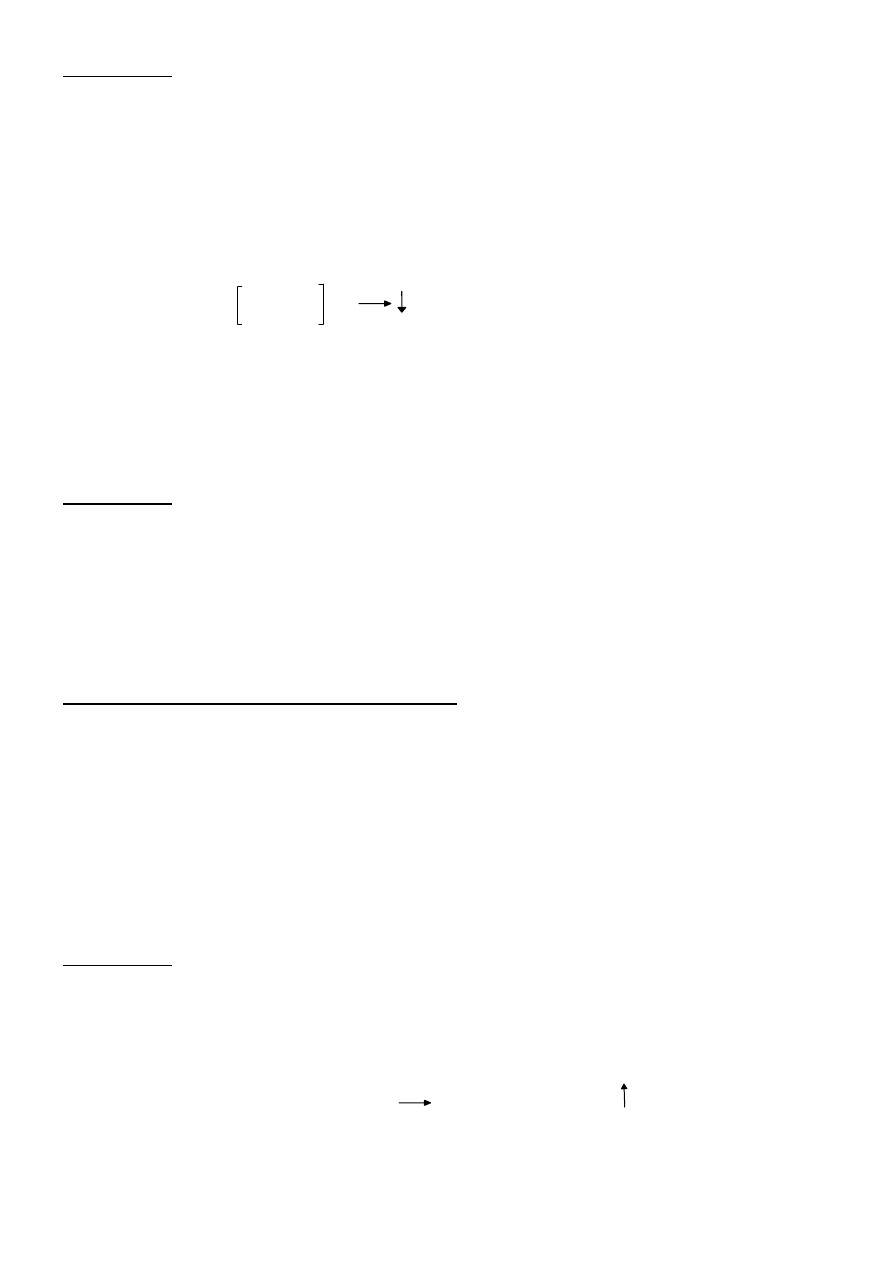
6
Wykonanie:
Do dokładnie odtłuszczonej probówki odmierzyć 1 ml 0,1 M roztworu AgNO
3
i wkraplać
ostrożnie 2 M roztwór amoniaku NH
3
∙H
2
O. Najpierw powstaje zmętnienie i osad AgOH, który po
dodaniu dalszych kropli roztworu amoniaku rozpuszcza się wskutek powstania związku
kompleksowego [Ag(NH
3
)
2
]OH. Do przyrządzonego w ten sposób odczynnika dodać 8 kropli
glukozy, zmieszać i ogrzewać na wrzącej łaźni wodnej lub w płomieniu palnika. Po pewnym
czasie na ściankach probówki wydziela się metaliczne srebro w postaci lustra.
glukoza
H
2
O
Ag(NH
3
)
2
OH
Ag
kwas glukonowy
NH
3
+
+
+
2
4
+
2
2
3c) Próba Legala na metyloketony
Metyloketony reagują z nitroprusydkiem sodu dając barwne produkty. Przebieg reakcji
nie jest znany.
Wykonanie:
Mały kryształek nitroprusydku sodu rozpuścić w około 2 ml wodnego roztworu acetonu i
dodać kilka kropli 2M roztworu NaOH. Roztwór staje się brunatno-czerwony, lecz po pewnym
czasie (ok. 10 min.) barwa jaśnieje. Po zakwaszeniu 2M CH
3
COOH, barwa roztworu ponownie
staje się intensywnie czerwona.
IV. Reakcje na kwasy karboksylowe
Kwasy karboksylowe w porównaniu z kwasami mineralnymi są kwasami słabymi, ale
mocniejszymi od kwasu węglowego.
Swoistość reakcji, w których biorą udział kwasy karboksylowe zależy albo od rodnika
organicznego, z którym połączona jest grupa karboksylowa albo od obecności w cząsteczce
drugiej, innej grupy funkcyjnej.
1. Wypieranie CO
2
z wodorowęglanu sodu
Wykonanie:
Do około 1 ml roztworu kwasu organicznego dodać około 1 ml 5% roztworu NaHCO
3
.
Wymieszać zawartość probówki. Obserwować wydzielanie się pęcherzyków CO
2.
RCOOH
NaHCO
3
RCOONa
O
H
2
CO
2
+
+
+

7
2. Próba na kwas mrówkowy
Kwas mrówkowy dzięki obecności jednocześnie grupy aldehydowej i karboksylowej posiada
właściwości redukcyjne, charakterystyczne dla aldehydów i właściwości charakterystyczne dla
kwasów karboksylowych.
C
H
O
OH
HgCl
2
Hg
2
Cl
2
CO
2
HCl
+ 2
+
+ 2
sublimat
kalomel
Wykonanie:
Do około 1 ml roztworu kwasu mrówkowego dodać kilka kropli 5% roztworu sublimatu
(HgCl
2
) i ogrzewać we wrzącej łaźni wodnej do pojawienia się białego osadu kalomelu (Hg
2
Cl
2
).
3. Próba na kwas mlekowy
Kwas mlekowy (2-hydroksypropanowy) podobnie jak i inne 2-hydroksykwasy zmienia
barwę odczynnika Uffelmanna na kolor żółto-zielony.
Wykonanie:
Sporządzić odczynnik Uffelmanna dodając do około 2 ml 1% wodnego roztworu fenolu 2
krople roztworu FeCl
3
(1 roztwór na salę).
Do około 1 ml roztworu
kwasu mlekowego dodać kilka
kropli przygotowanego odczynnika. Kwas mlekowy zmienia fioletową barwę odczynnika na
barwę jasno żółto-zieloną.
4. Próba na kwas salicylowy
Wykonanie:
Kilka kryształków kwasu salicylowego rozpuścić w 1 ml wody i dodać 1 kroplę roztworu
FeCl
3.
Podobnie jak w roztworze fenoli występuje fioletowe zabarwienie.
5. Przyłączanie chlorowca do nienasyconych kwasów tłuszczowych
Jod (lub inne chlorowce) łatwo przyłącza się w miejscu podwójnego wiązania, w wyniku
czego brunatny roztwór jodu odbarwia się na skutek powstania bezbarwnego związku z
organicznie związanym jodem.
C
H
C
H
I
2
C
H
C
H
I
I
+
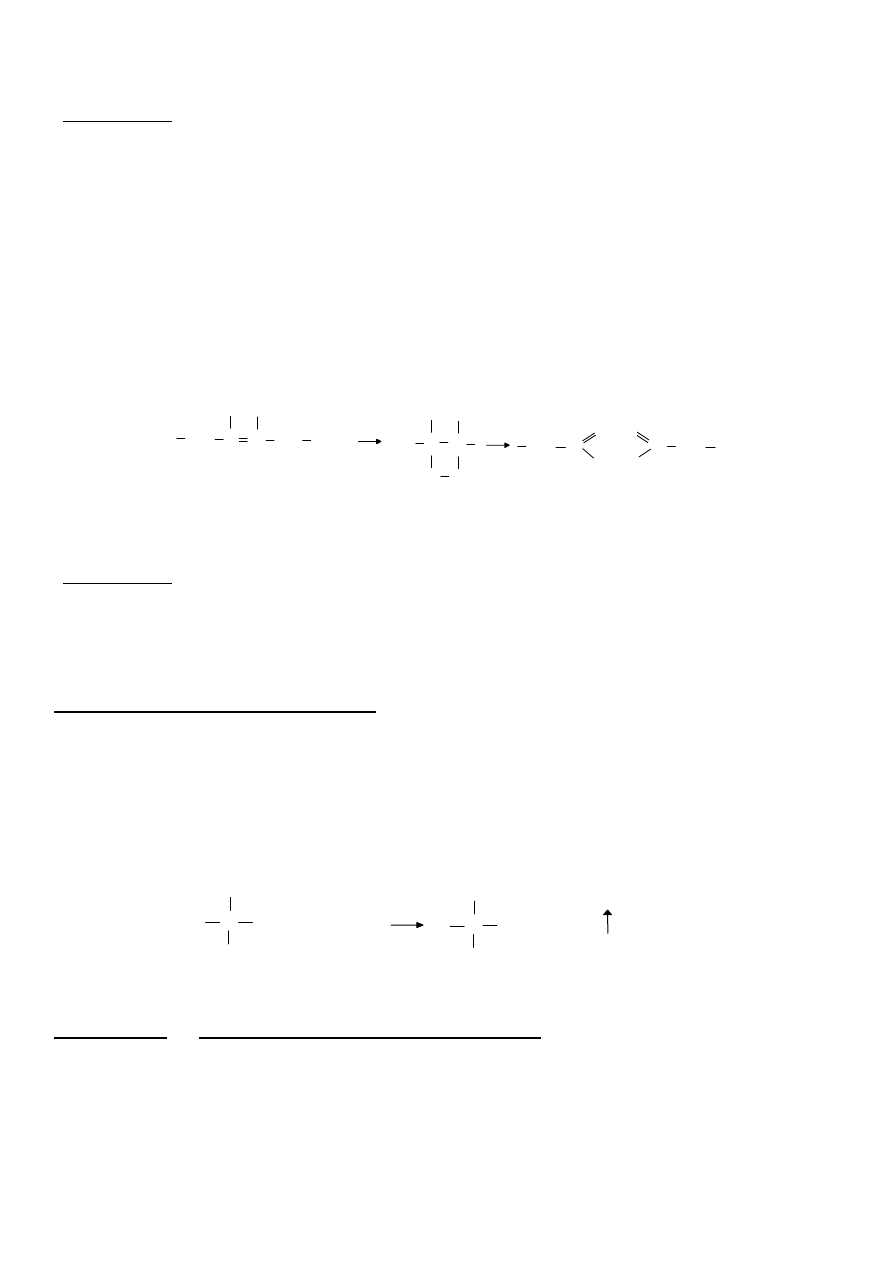
8
Wykonanie:
Do 3 kropli oliwy dodawać kroplami odczynnik Hűbla (roztwór jodu i chlorku rtęci(II) w
alkoholu). Płyn odbarwia się po pewnym czasie w temperaturze pokojowej lub natychmiast po
ogrzaniu.
6. Utlenianie wiązań podwójnych w nienasyconych kwasach tłuszczowych
Wiązania podwójne łatwo ulegają utlenieniu pod wpływem tlenu z utleniaczy, a także,
chociaż znacznie wolniej, pod wpływem tlenu atmosferycznego. Cząsteczka kwasu
tłuszczowego, w miejscu podwójnego wiązania, ulega rozbiciu na 2 cząsteczki zawierające
grupy aldehydowe.
C
H
C
H
CH
2
CH
2
O
2
C
H
C
H
CH
2
O
O
CH
2
C
CH
2
C
+
H
O
+
O
H
Reakcja ta zachodzi podczas jełczenia tłuszczów, a gromadzące się aldehydy nadają im przykry
smak i zapach.
Wykonanie:
Rozpuścić kilka kropli oliwy w 1 ml roztworu Na
2
CO
3
. Dodawać kroplami roztwór KMnO
4
,
następuje odbarwienie nadmanganianu.
V. Badanie właściwości amin
1. Reakcja z kwasem azotowym(III)
Aminokwasy, jako I-rzędowe aminy alifatyczne, pod wpływem kwasu azotowego(III)
tworzą alkoholokwas, wodę i azot, który wydziela się z roztworu.
R
NH
2
COOH
C
H
HNO
2
R
COOH
C
H
OH
N
2
2
O
+
+
+ H
Wykonanie
:
(przeprowadzać pod dygestorium)
Rozpuścić szczyptę azotanu(III) sodu w około 1 ml 1M H
2
SO
4
. Z roztworu wydzielają się
pęcherzyki gazu (tlenki azotu). Po chwili, gdy ustanie wydzielanie się pęcherzyków, dodać kilka
kropli roztworu aminokwasu - glicyny. Roztwór zamieszać i obserwować wydzielanie się
pęcherzyków azotu.
Wyszukiwarka
Podobne podstrony:
Immunologia-PLAN ĆWICZEŃ V lekarski zimowy 2012-2013, IMMUNOLOGIA KLINICZNA
Język polski 4. Ortografia. Zasady i ćwiczenia, fragment (strona 39)
01 Rozklad cwiczen Lekarskiid 2921
PB TEST CWICZENIA 2009 STRONA
01 Rozklad cwiczen Lekarski
Ćwiczenia lekarska
Immunologia-PLAN ĆWICZEŃ V lekarski zimowy 2012-2013 tabelka, IMMUNOLOGIA KLINICZNA
Język polski 4. Ortografia. Zasady i ćwiczenia -fragment (strona 19)
mikrobiologia cwiczenia lekarski 13
Język polski 4 Ortografia Zasady i ćwiczenia fragment (strona 29)
03 Karta cwiczen Lekarskiid 439 Nieznany (2)
Język polski 4 Ortografia Zasady i ćwiczenia fragment (strona 39)
Język polski 4 Ortografia Zasady i ćwiczenia fragment (strona 19)
03 Karta cwiczen Lekarski
ćwiczenie 3 lekarski
więcej podobnych podstron