1
ĆWICZENIE 3
Analiza miareczkowa
mocnych i słabych elektrolitów
Alkacymetria
jest metodą opartą na reakcji zobojętniania jonów hydroniowych jonami
wodorotlenowymi lub odwrotnie
.
H
3
O
OH
O
H
2
+
+
_
2
Metody alkacymetryczne służą do oznaczania zawartości kwasów miareczkowanych
zasadami – a l k a l i m e t r i a i do oznaczania zawartości zasad przez miareczkowanie kwasami
− a c y d y m e t r i a.
Oprócz oznaczania kwasów i zasad, metodami alkacymetrycznymi można oznaczać również
sole słabych kwasów i mocnych zasad oraz sole słabych zasad i mocnych kwasów. Sole te w
roztworze wodnym ulegają hydrolizie i powstają odpowiednio jony OH¯ lub H
3
O
+
. Dla określenia
punktu równoważnikowego reakcji w alkacymetrii stosuje się wskaźniki (indykatory pH). W praktyce
używane są najczęściej: oranż metylowy, czerwień metylowa, błękit bromotymolowy, fenoloftaleina
.
Część praktyczna
1. Barwa wskaźników w środowisku kwaśnym i zasadowym
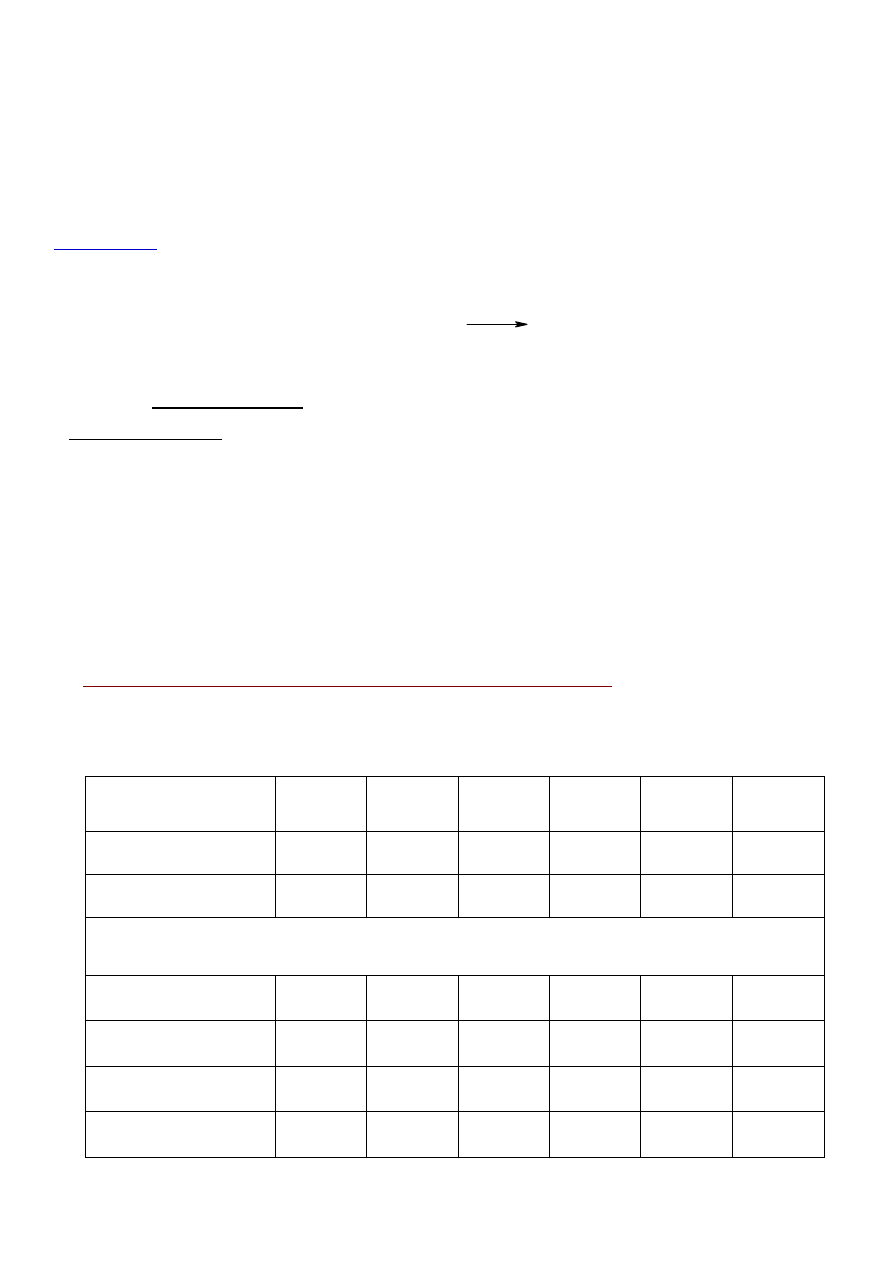
Do sześciu probówek dodaj odczynniki wg tabeli. Zanotuj barwy roztworów i wyciągnij wnioski.
Numer probówki
1
2
3
4
5
6
1 M HCl
1 ml
1 ml
1 ml
1 M NaOH
1 ml
1 ml
1 ml
liczba kropli
oranż metylowy
2
2
czerwień metylowa
2
2
fenoloftaleina
2
2
barwa roztworu
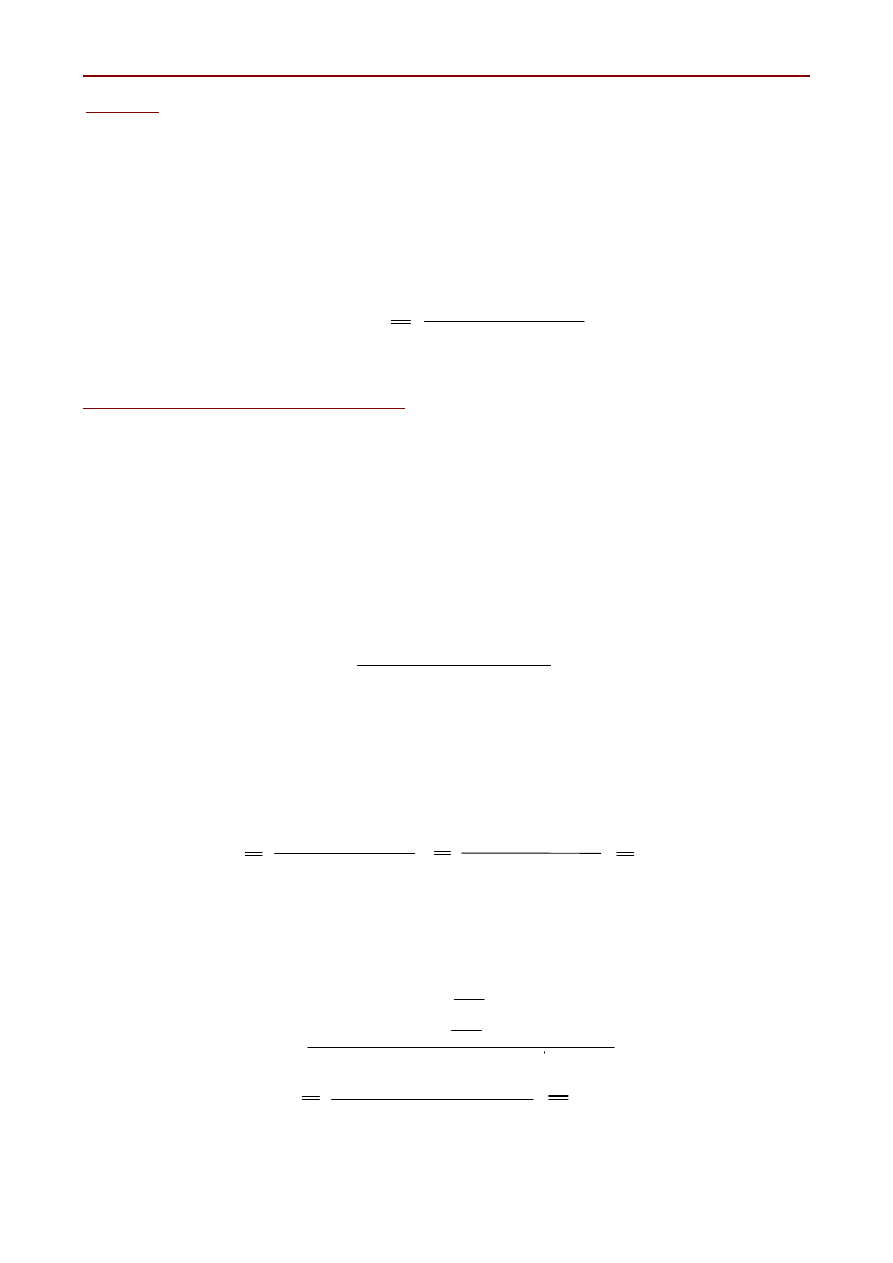
2
2. Nastawianie miana roztworu wodorotlenku sodu na mianowany roztwór kwasu
solnego
Do kolby stożkowej odmierzyć dokładnie pipetą miarową 10 ml mianowanego roztworu HCl,
dodać 3 krople oranżu metylowego i miareczkować ~ 0,1M roztworem NaOH do barwy przejściowej
(cebulkowej). Miareczkowanie powtórzyć trzy razy, obliczyć średnią wyników i zastosować do
obliczenia stężenia molowego NaOH wg wzoru:
M
M
X
V
V
NaOH
NaOH
Cl
H
Cl
H
3. Oznaczanie ilości HCl w roztworze
Badaną próbę przenieść ilościowo do kolby miarowej na 100 ml i uzupełnić wodą
destylowaną do kreski. Starannie wymieszać. Przenieść dokładnie 10 ml tego roztworu do kolby
stożkowej, dodać 2 – 3 krople oranżu metylowego i miareczkować mianowanym roztworem NaOH
do zmiany barwy oranżu metylowego na kolor cebulkowy. Miareczkowanie powtórzyć 2 – 3 razy.
Uzyskane wyniki nie powinny różnić się więcej niż o 0,2 ml. Z wyników, które spełniają podany
warunek obliczyć średnią arytmetyczna. Obliczyć ile g HCl znajduje się w badanej próbie.
Przykład obliczeń:
Na zmiareczkowanie 10 ml roztworu HCl zużyto 7,2 ml 0,102 M NaOH (średnia z trzech
miareczkowań). Obliczyć ile g HCl znajduje się w 100 ml roztworu.
a) Należy obliczyć stężenie molowe roztworu HCl
M
NaOH
M
X
V
V
NaOH
X
Cl
H
Cl
H
0,102 M
7,2ml
10ml
0,073 M
b)
Znając stężenie molowe roztworu obliczamy ile g chlorowodoru HCl znajduje się w 100 ml
badanego roztworu
36,5g HCl
100ml 0,073M
X
100ml 0,073M 36,5g
x
x
1000ml 1M
x
0,266g
1000ml 1M
X

3
4. Oznaczanie ilości kwasu octowego w roztworze
Alkalimetryczne oznaczanie CH
3
COOH za pomocą mianowanego roztworu NaOH jest
przykładem miareczkowania słabego kwasu mocną zasadą
CH
3
COOH
NaOH
CH
3
COONa
O
H
2
+
+
CH
3
COONa, jako produkt reakcji ulega hydrolizie nadając roztworowi odczyn zasadowy w punkcie
równoważnikowym. Jako wskaźnika używamy zatem fenoloftaleiny, która przechodzi w postać
barwną w środowisku alkalicznym (pH powyżej 8,2).
Wykonanie:
Oznaczanie ilościowe CH
3
COOH przeprowadzić w analogiczny sposób jak HCl z tą różnicą,
że jako wskaźnika należy użyć fenoloftaleiny. Miareczkować do pojawienia się trwałej barwy
malinowej. Obliczyć ile g CH
3
COOH znajduje się w 100 ml badanego roztworu.
Zadania rachunkowe
1. Ile ml stężonego H
2
SO
4
98% (w/w) o gęstości 1,8 g/cm
3
należy odmierzyć, aby sporządzić 5
litrów 1 M roztworu ? Masa molowa H
2
SO
4
= 98 g/mol
2. Z 250 g 10% roztworu odparowano 50 g wody. Obliczyć stężenie procentowe otrzymanego
roztworu.
3. Ile milimoli K
2
SO
4
znajduje się w 500 g 17,4% roztworu tej soli?
4. Stężenie glukozy we krwi wynosi 100 mg/100 ml. Wyrazić to stężenie w milimolach/litr.
5. Podaj w milimolach /litr stężenie kationu sodowego, jeżeli w 100 ml surowicy krwi znajduje się
350 mg Na
+
.
6. Do jakiej objętości należy rozcieńczyć 25 ml 6 M roztworu H
2
SO
4
, aby otrzymać 0,5 M
roztwór?
7. Obliczyć stężenie molowe roztworu NaOH, jeśli wiadomo, że na zmiareczkowanie 10 ml
0,105 M roztworu HCl zużyto 9,6 ml tej zasady.
8. Ile trzeba ml 0,1M NaOH na zobojętnienie 10 ml roztworu HCl zawierającego 500 milimoli
chlorowodoru w 1 litrze roztworu?
9. Do 25 ml 0,2 M roztworu HCl dodano 75 ml 0,5 M roztworu HCl. Obliczyć stężenie molowe
otrzymanego roztworu.

4
10. Odważkę 286,2 mg Na
2
CO
3
rozpuszczono w wodzie. Otrzymany roztwór zmiareczkowano
wobec oranżu metylowego kwasem solnym, którego zużyto 45 ml. Obliczyć stężenie molowe
roztworu HCl. Masa molowa Na
2
CO
3
= 106 g/mol.
11. Obliczyć, ile g chlorowodoru znajduje się w 100 ml roztworu wiedząc, że na zmiareczkowanie
10 ml tego kwasu zużyto 11,2 ml 0,101 M NaOH?
12. Na zobojętnienie 40 ml roztworu zawierającego w litrze 12 g zasady jednowodorotlenowej
zużyto 48 ml 0,25 M roztworu HCl. Obliczyć masę cząsteczkową zasady.
13. Ile ml 0,1 M roztworu H
2
SO
4
potrzeba na zobojętnienie 20 milimoli KOH?
14. Ile ml 0,05 M HCl należy zużyć na miareczkowanie 10 ml 0,4% roztworu (w/v) NaOH?
15. Jaka jest stężenie molowe roztworu HCl, jeśli na 20 ml tego roztworu zużyto 10 ml 0,4%
roztworu (w/v) NaOH?
16. Do ilu ml należy rozcieńczyć 100 ml 2M MgSO
4
, aby otrzymać 0,1M roztwór?
17. Obliczyć, ile ml wody należy dodać do 20% (w/v) roztw. NaOH aby przygotować 2 l 0,5 M
roztworu.
18. Na zmiareczkowanie 25 ml KOH zużyto 5 ml 0,05 M HCl. Jaka jest stężenie molowe roztworu
KOH?
19. Ile ml gazowego HCl (mierzone w warunkach normalnych) należy zużyć na zobojętnienie 20
ml 0,1 M Mg(OH)
2
?
20. Oblicz rozpuszczalność PbI
2
i stężenie każdego z jonów tej soli w temperaturze 20
o
C w
roztworze nasyconym. K
so
= 1
.
10
-8
.
21. Rozpuszczalność BaSO
4
wynosi 1,0
.
10
-5
mmol /ml. Oblicz iloczyn rozpuszczalności tej soli.
22. Oblicz, jaka jest rozpuszczalność BaSO
4
wyrażona w mg/ 100 ml roztworu. K
so
= 1
.
10
-10
.
23. Czy strąci się osad, jeżeli zmieszamy 200 ml 0,1 M roztworu Ca(NO
3
)
2
i 300 ml 0,1M K
2
SO
4
?
K
so
= 3
.
10
-5
.
Wyszukiwarka
Podobne podstrony:
Immunologia-PLAN ĆWICZEŃ V lekarski zimowy 2012-2013, IMMUNOLOGIA KLINICZNA
01 Rozklad cwiczen Lekarskiid 2921
01 Rozklad cwiczen Lekarski
Ćwiczenia lekarska
Immunologia-PLAN ĆWICZEŃ V lekarski zimowy 2012-2013 tabelka, IMMUNOLOGIA KLINICZNA
mikrobiologia cwiczenia lekarski 13
03 Karta cwiczen Lekarskiid 439 Nieznany (2)
03 Karta cwiczen Lekarski
cwiczenie 5 lekarski strona
parazytologia lekarska przewodnik do ćwiczeń UM Poznań
dusznica bolesna stabilna - ktostam - 4 rok - am bydgoszcz, IV rok Lekarski CM UMK, Kardiologia, Ćwi
Wady serca - rozwodowska - 4 rok - am bydgoszcz, IV rok Lekarski CM UMK, Kardiologia, Ćwiczenia, Pre
k1, IV rok Lekarski CM UMK, Farmakologia, Farmakologia, cwiczenia, dr Wiciński, II koło, farmakologi
PATOMORFOLOGIA I KOLO, IV rok Lekarski CM UMK, Patomorfologia, patomorfologia, ćwiczenia, semestr
program cwiczenia 2008 2009 lekarski[1]
Ćwiczenia semestr VI, Lekarski GUMed, III rok, INTERNA, PLAN WYKŁADÓW I ĆWICZEŃ 2011
Stymulatory, IV rok Lekarski CM UMK, Kardiologia, Ćwiczenia, Prezentacje
Leczenie przeciwkrzepliwe przeciwwskazania ze Szczeklika, IV rok Lekarski CM UMK, Kardiologia, Ćwicz
więcej podobnych podstron