
TEORIA SILNIKÓW PRZEPŁYWOWYCH
TEORIA SILNIKÓW PRZEPŁYWOWYCH
Repetytorium z termodynamiki i
mechaniki płynów
Dr inż. Robert Jakubowski

Gaz doskonały
• Gaz hipotetyczny, którego drobiny nie przyciągają się
wzajemnie, są nieskończenie małe i sztywne (nie
występują drgania wewnątrz drobin). Cechuje się on
stałymi wartościami wielkości opisujących jego
właściwości
p
v
c
k
c
=
, ,
p
v
c c k idem
=
Równanie Clapeyrona
pv RT
=
p
v
R c
c
=
−
R [J/(kgK)]– indywidualna stała gazowa – zależy od skaładu gazu
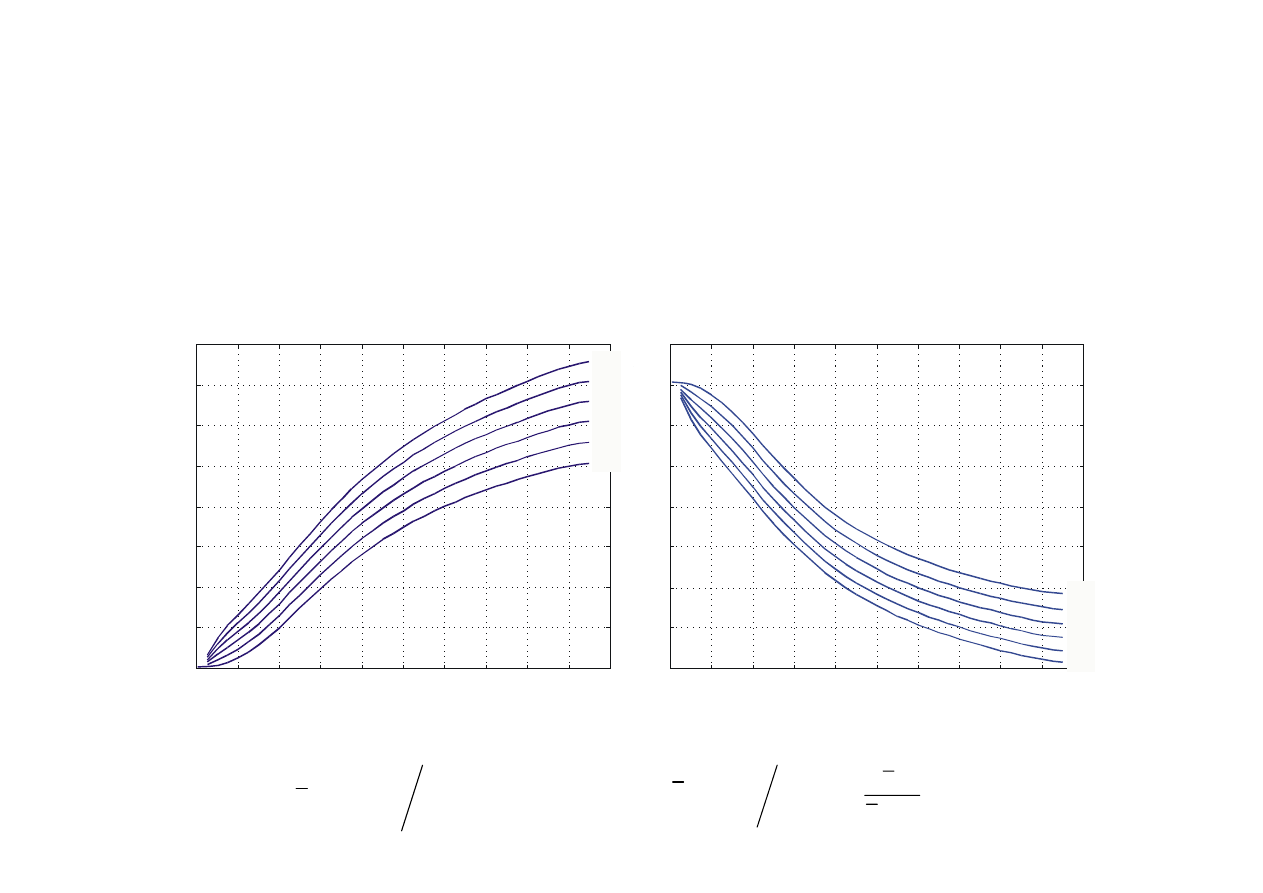
Gaz półdoskonały
• Gaz w którym uwzględnia się drgania drobin. Wielkości
opisujące właściwości gazu zależą od temperatury
, ,
( )
p
v
c c k
f T
=
200
400
600
800
1000
1200 1400
1600 1800
2200
1000
1050
1100
1150
1200
1250
1300
1400
T [K]
c
P
[J/kgK]
0,05
0,04
0,03
0,02
0,01
0,00
200
400
600
800
1000
1200
1400 1600
1800
2200
1.26
1.28
1.3
1.32
1.34
1.36
1.38
1.4
1.42
k
T [K]
0,00
0,01
0,02
0,03
0,04
0,05
Zależność pojemności cieplnej c
p
oraz wykładnika izentropy k dla spalin powstałych ze spala-nia paliwa o uśrednionym składzie chemicznym
C
12
H
23,5
od temperatury dla różnych wartości względ-nego zużycia paliwa
τ
pal
(dla powietrza
τ
pal
=0)
(
)
2
1
2
1
T
p
p
T
c
k
kdT
T
T
c
R
=
−
=
−
∫
(
)
2
1
2
1
T
p
p
T
c
c dT
T
T
=
−
∫

Gaz rzeczywisty
• W gazach rzeczywistych oprócz temperatury uwzględnia
się wpływ ściśliwości na właściwości gazów
Równanie stanu gazu
pv zRT
=
z – współczynnik ściśliwości gazu
„Niemal wszystkie gazy występujące w technicznych urządzeniach cieplnych
można traktować jako gaz doskonały i półdoskonały. Wyjątek stanowią gazy
pod wysokim ciśnieniem i pary. Na właściwości tych czynników wyraźnie
wpływa objętość właściwa drobin i ich wzajemne przyciąganie. Dlatego
czynniki te należy traktować jak gaz rzeczywisty.”
J. Szargut TERMODYNAMIKA
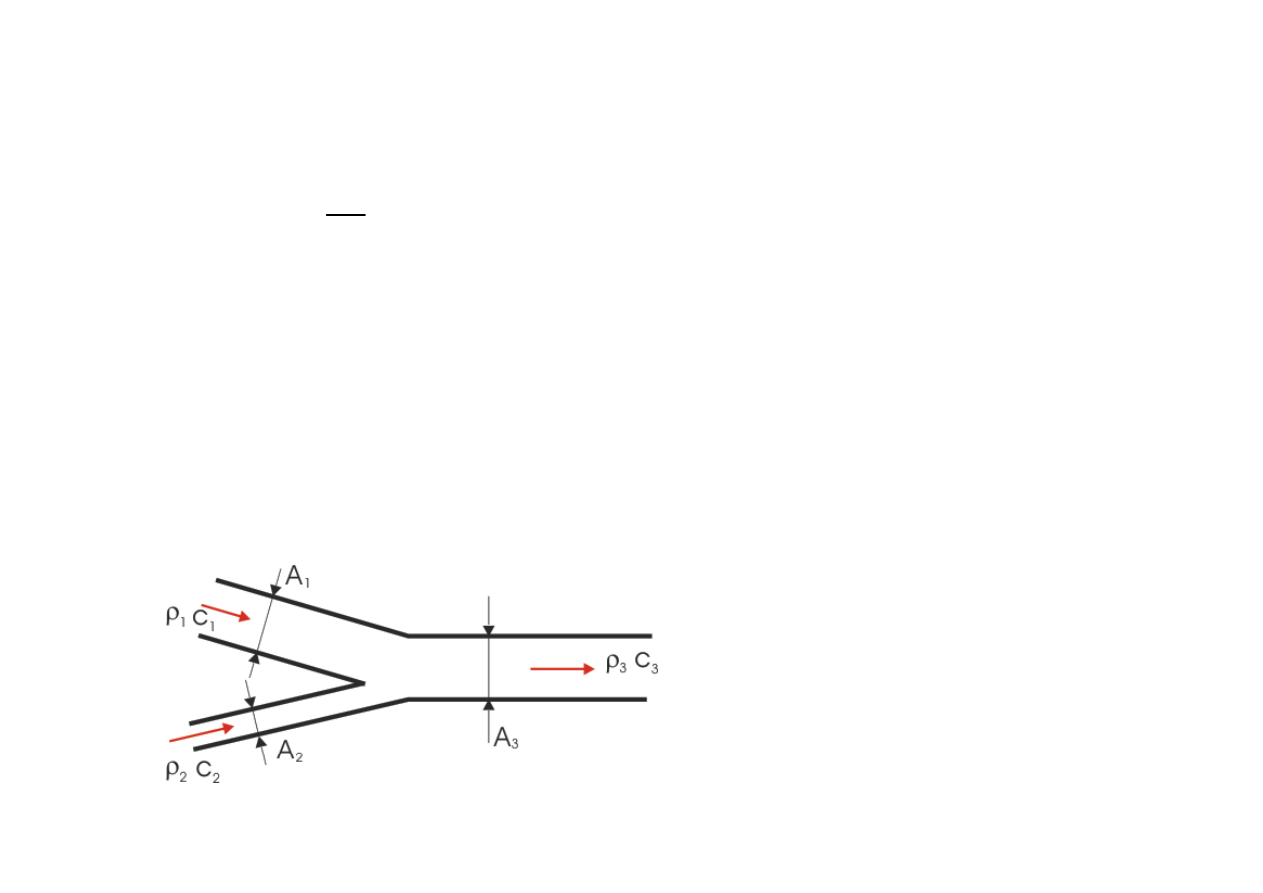
Równanie ciągłości
dm
m
Ac
dt
ρ
=
=
- wydatek masowy
[
/ ]
m kg s
W przepływie ustalonym wydatek masowy przepływu w każdym przekroju
jest stały:
1
2
3
...
m
m
m
=
=
=
Równanie bilansu masy
1 1 1
2
2 2
3 3 3
A c
A c
A c
ρ
ρ
ρ
+
=
1
2
3
m
m
m
+
=
Równanie bilansu energii
(dla wyodrębnionego układu)
D
O
U
E
E
E
=
+ ∆
U
K
P
E
E
E
U
=
+
+
- energia właściwa
/
e E m
=
I Zasada Termodynamiki
dop
Q
L
U
= + ∆
Wykres Sankey’a
Układy otwarte
Funkcja Gibbsa (entalpia)
I U
pV
i u pv
= +
= +
Przedstawione ujęcie entalpii jest
możliwe dla małych prędkości
przepływu
(c<40 m/s)
, inaczej:
2
2
2
(
1 2
)
1 2
1 2
r
C
C
E
m gh
c
i
stąd
I
I
mc
mgh
i
i
c
gh
=
+
+
= +
+
= +
+
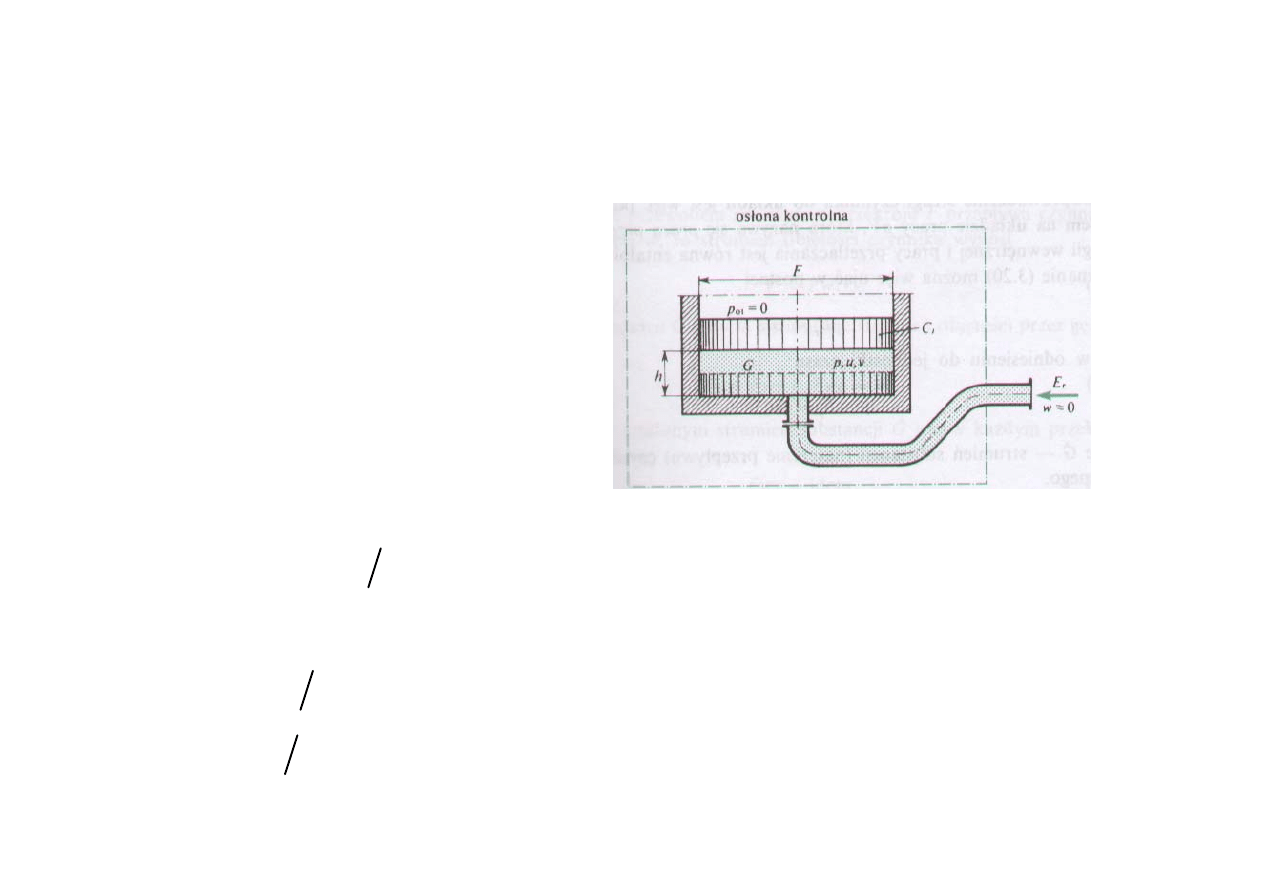
Model do wyjaśnienia energii strugi czynnika
r
t
t
E
U C h
gdzie
C h
pFh
pV
= +
=
=

Praca, praca techniczna
L
t
L
p
p
p
v
v
v
1
1
1
2
2
2
2
1 2
1
dL
pdV
L
pdV
−
=
=
∫
0
0,
0
0,
dV
dL
dV
dL
> ⇒
>
< ⇒
<
2
1 2
1
t
t
dL
Vdp
L
Vdp
−
= −
= −
∫
0
0,
0
0,
t
dp
dL
dp
dL
> ⇒
<
< ⇒
>
dop
dop
t
Q
U L
U
pdV
Q
I L
I
Vdp
= ∆ + = ∆ +
= ∆ +
= ∆ −
∫
∫
I Zasada Termodynamiki
Entropia
Funkcja wprowadzona przez Clausiusa
dU
pdV
dS
T
dI Vdp
dS
T
+
=
−
=
dQ
dS
T
=
⇒
2
2
2
1
1
1
2
2
2
1
1
1
2
2
2
1
1
1
ln
ln
ln
ln
ln
ln
v
p
v
p
T
v
s
s
c
R
T
v
T
p
s
s
c
R
T
p
p
v
s
s
c
c
p
v
− =
+
− =
−
− =
+
Charakterystyczne przemiany gazów
PRZEMIANA IZOTERMICZNA T=idem
pv RT
pv idem
=
⇒
=
1 1
2 2
p v
p v
=
1
2
2
1
p p
v v
=
p
v
T
T
T
T
T
T
1
1
2
2
3
3
>
>
T
s
1 2
1 2
2
1
1
1 2
1 1
1 1
1
2
2
ln
ln
ln
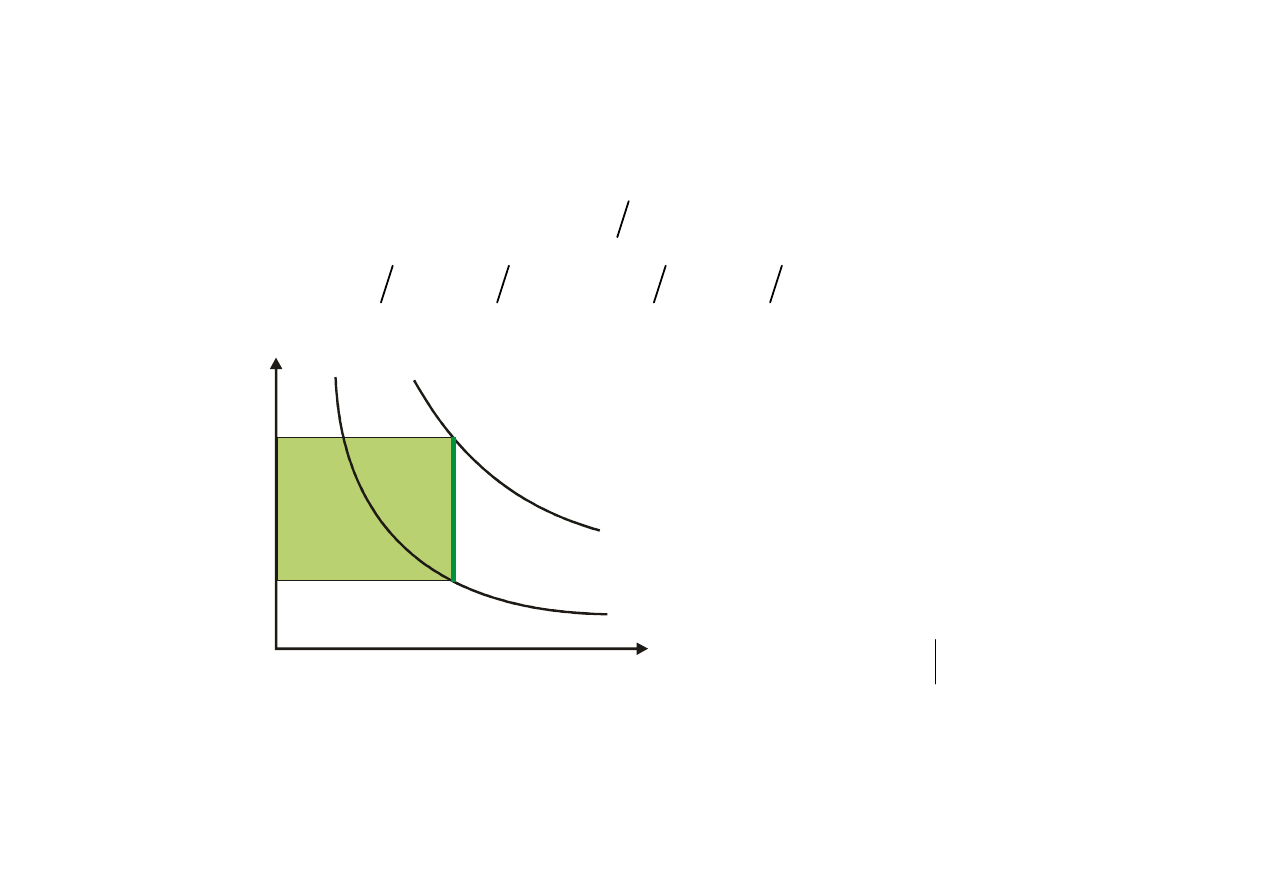
t
Q
L
L
V
p
p
L
p V
p V
mRT
V
p
p
−
−
−
=
=
=
=
=
Charakterystyczne przemiany gazów
PRZEMIANA IZOCHORYCZNA V=idem
pv RT
p T idem
=
⇒
=
1
1
2
2
p T
p T
=
1
2
1
2
p p
T T
=
p
v
T
T
1
2
1
2
L
t
1 2
1
2
0
(
)
t
L
L
V p
p
−
=
=
−
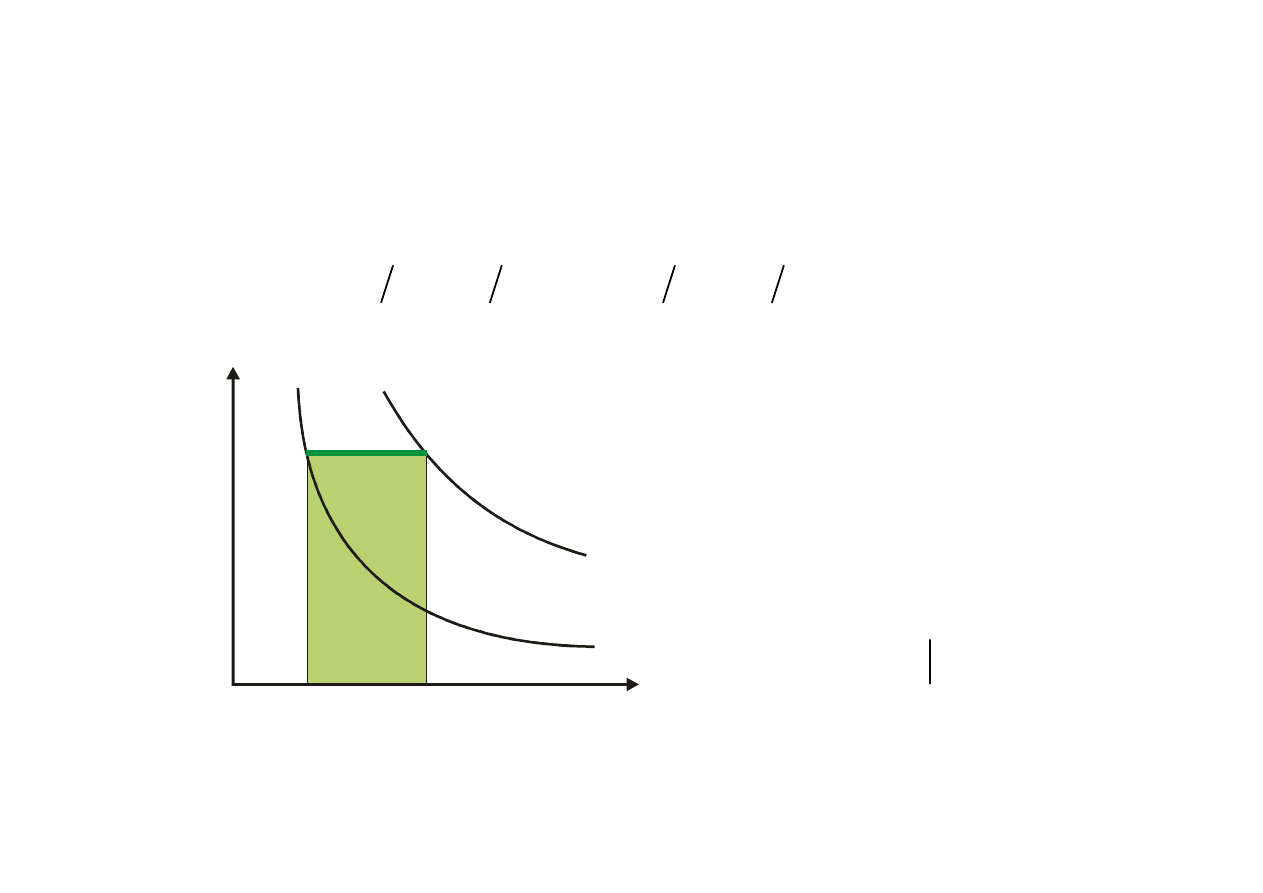
Ciepło pobrane przez czynnik
z I ZT przy L=0
(
)
2
1
1 2
2
1
T
v T
Q
U
mc
T
T
−
= ∆ =
−
Charakterystyczne przemiany gazów
PRZEMIANA IZOBARYCZNA p=idem
/
pv RT
v T idem
=
⇒
=
1
1
2
2
v T
v T
=
1
2
1
2
v v
T T
=
p
v
T
T
1
2
1
2
L
1-2
1 2
2
1
0
(
)
t
L
L
p V
V
−
=
=
−
Ciepło pobrane przez czynnik
z I ZT przy L
t
=0
(
)
2
1
1 2
2
1
T
p T
Q
I
mc
T
T
−
= ∆ =
−
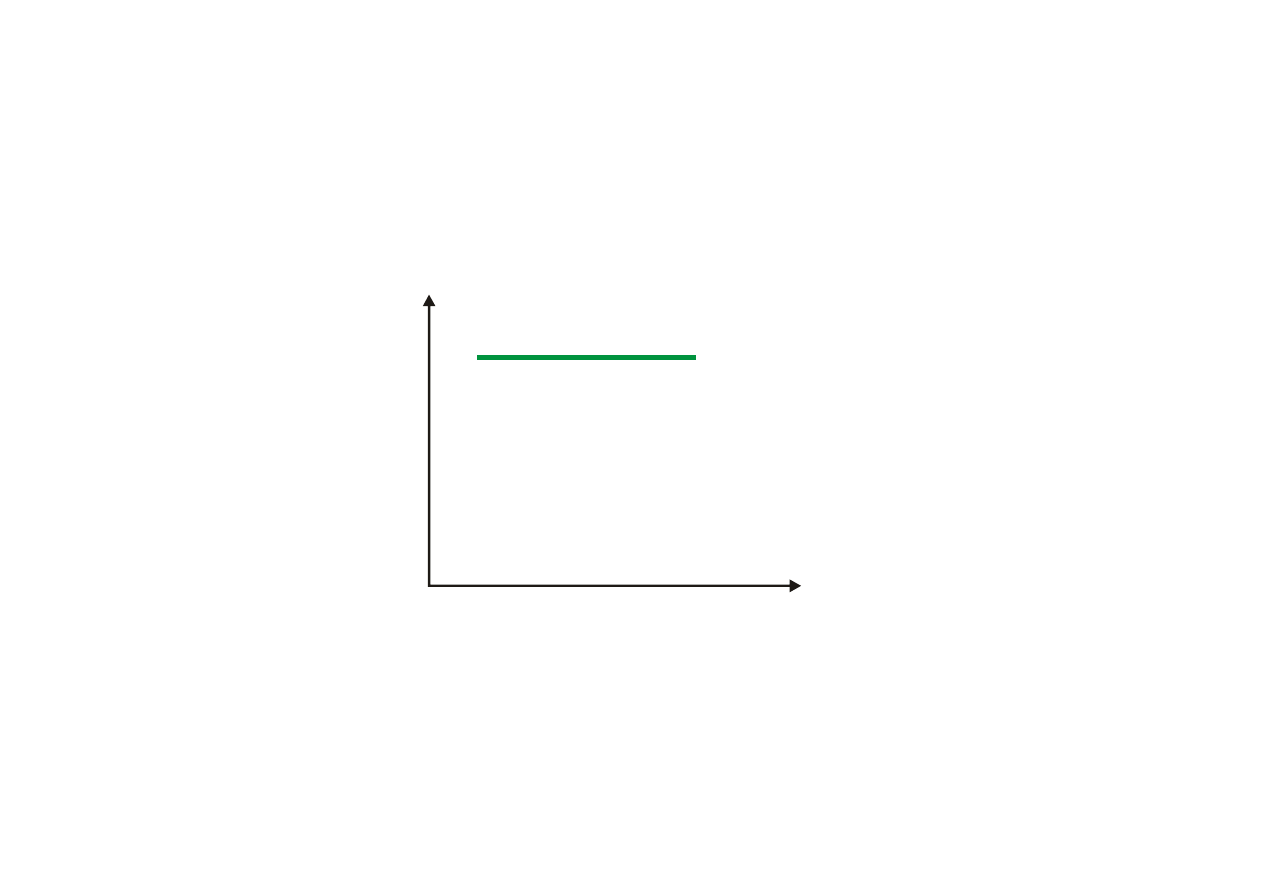
Charakterystyczne przemiany gazów
PRZEMIANA IZENTALPOWA I=idem
(
)
1 2
2
1
t
p
Q
L
c T
T
−
=
=
−
i
s
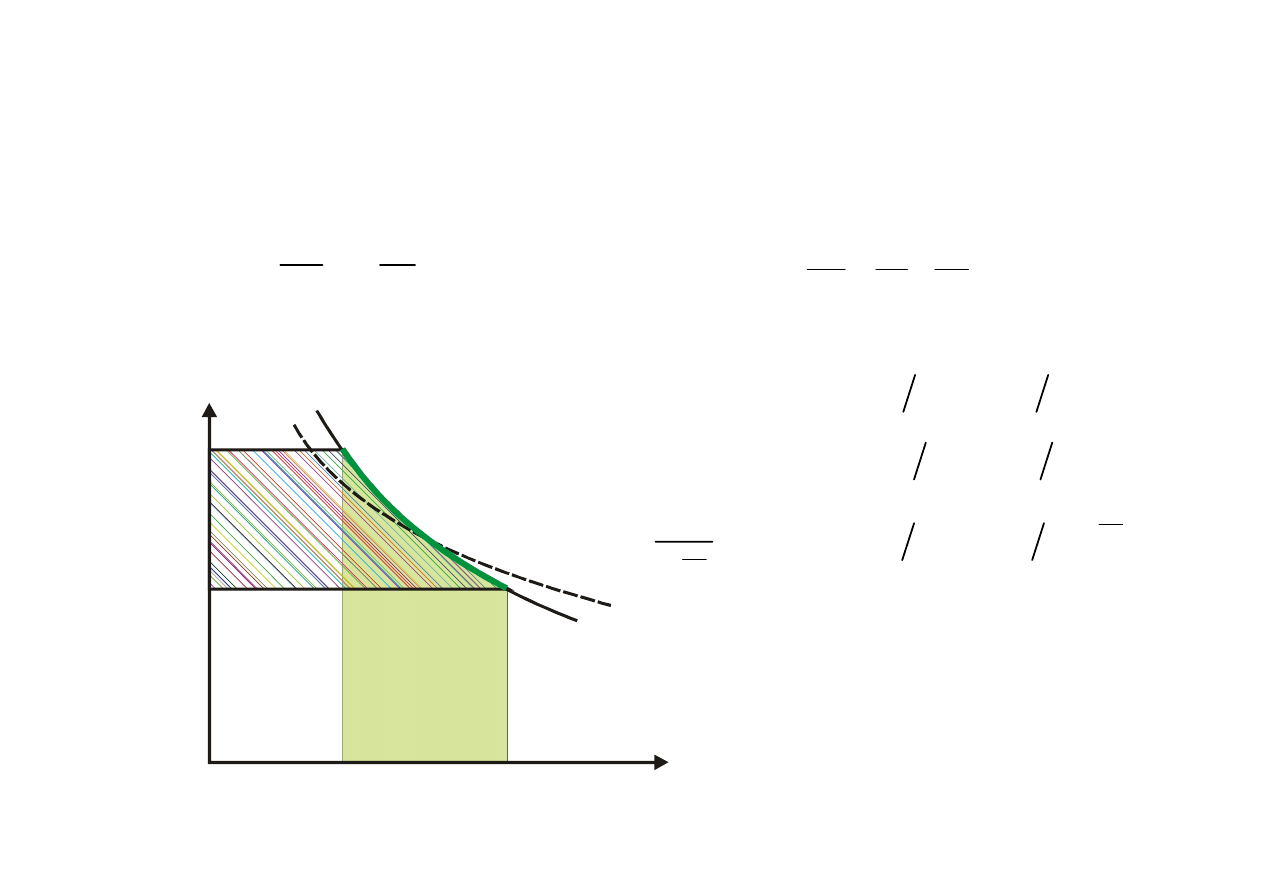
Charakterystyczne przemiany gazów
PRZEMIANA IZENTROPOWA s=idem
Równanie różniczkowe izentropy
Równanie Clapeyrona po zróżniczkowaniu
0
v
dT
dv
c
R
T
v
+
=
( )
ln
ln
ln
k
k
v
p C
v p
idem
+
= ⇒
=
(
)
1 2
1 2
1
2
1
2
1 2
0
(
)
v
t
p
t
Q
L
U
mc T T
L
I
mc T T
L
kL
−
−
−
=
= −∆ ⇒
−
= −∆ =
−
=
dT
dv dp
T
v
p
=
+
p
v
T
T=idem
s=idem
1
1
2
L
L
1-2
t
(
)
(
)
(
)
1
1
1
2
2
1
1
1
1
2
2
1
1
2
1
2
k
k
k
k
k
k
k
k
v p idem
p p
v v
Tv
idem
T T
v v
T
idem
T T
p p
p
−
−
−
−
=
⇔
=
=
⇔
=
=
⇔
=
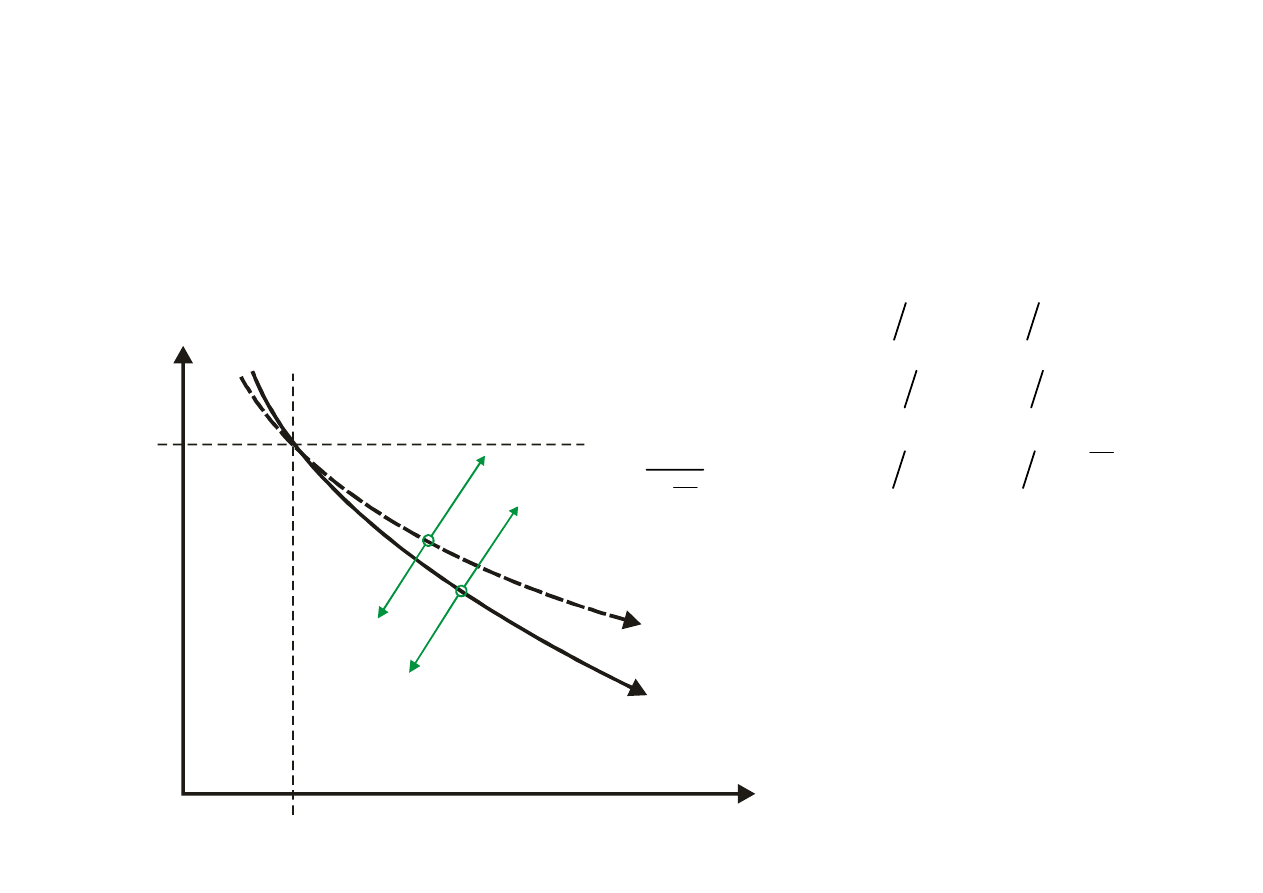
Charakterystyczne przemiany gazów
PRZEMIANA POLITROPOWA
n
pv
idem
=
(
)
(
)
(
)
1
1
1
2
2
1
1
1
1
2
2
1
1
2
1
2
n
n
n
n
n
n
n
n
v p idem
p p
v v
Tv
idem
T T
v v
T
idem
T T
p p
p
−
−
−
−
=
⇔
=
=
⇔
=
=
⇔
=
p
v
T
T=idem
s=idem
1
d
v=
0,
n=ni
e
sk
, c
=
c
v
dp=0, n=0, c=c
p
dQ=
0, n=
k
dT=0, n
=1
dQ
>0
dQ
<0
dT
<0
dT
>0
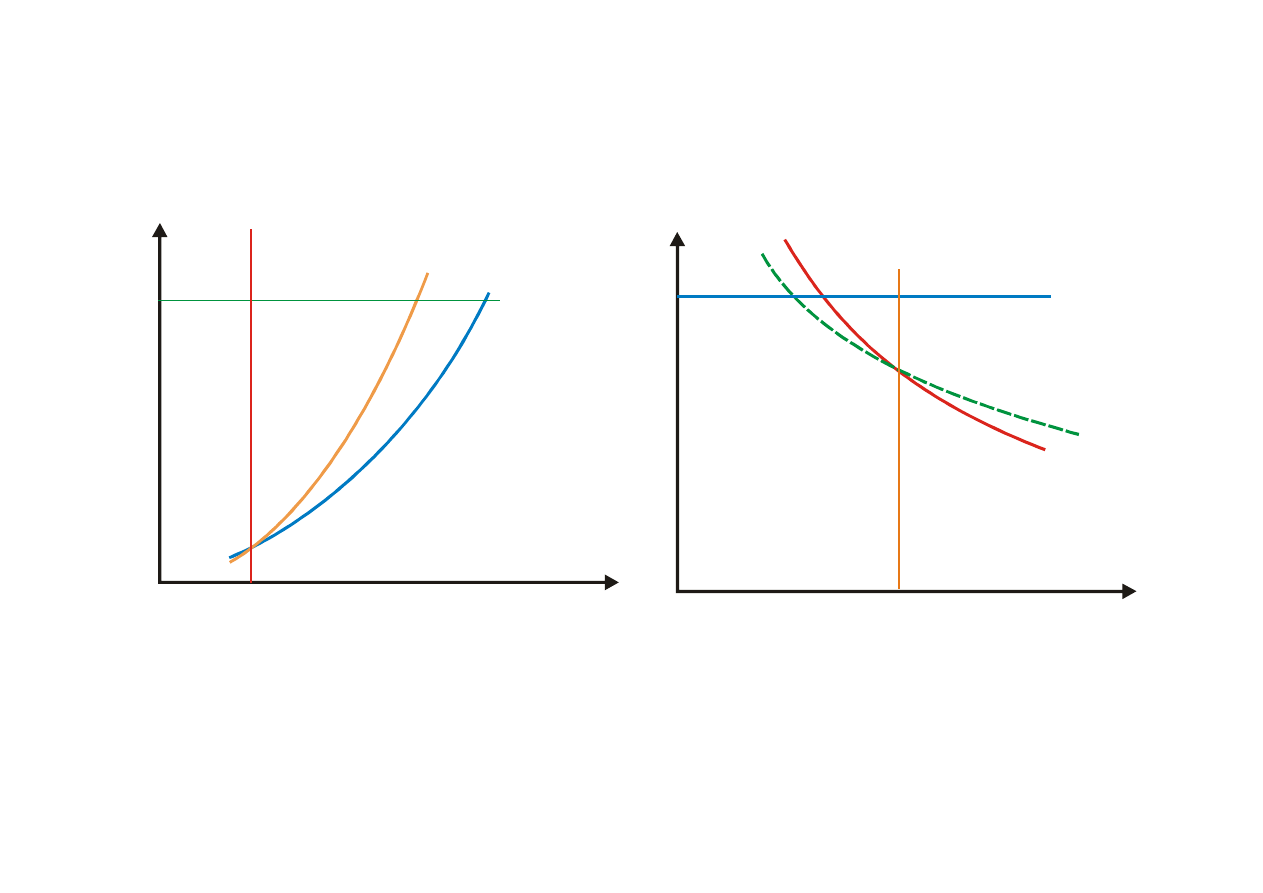
Zobrazowanie przemian na wykresie i-s
i
s
ds
=0
,
di =0
dp
=
0
dv
=
0
p
v
dT=0
ds=0
dp=0
dv
=
0
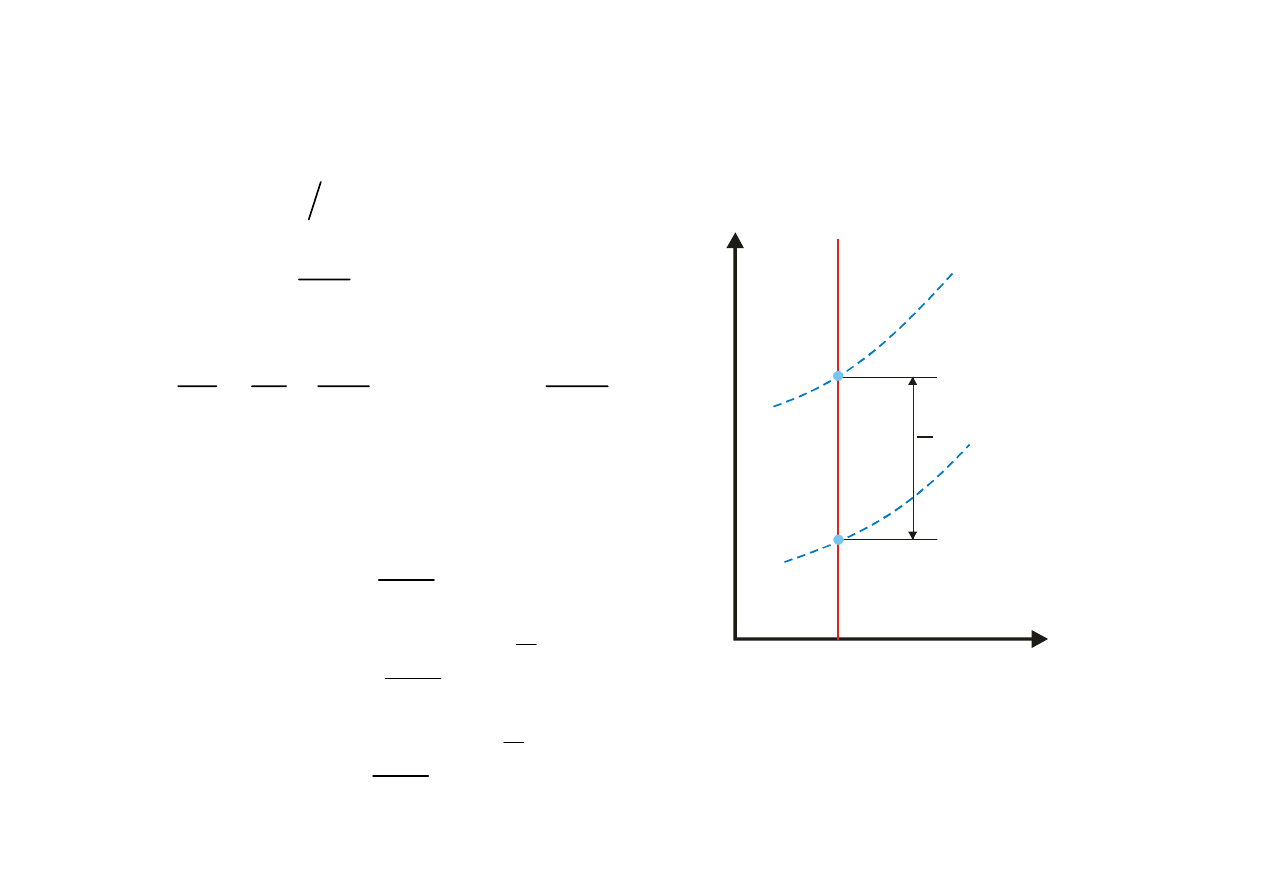
Równanie przepływu izentropowego
i
s
ds
=0
1
1*
*
c
2
2
1
1
1
p
p
*
2
1
1
2
*
1
1
*
2
2
*
1
1
1
1
1
*
1
1
2
2
2
2
p
p
p
i
i
c
c
T
T
c
p
p
c
c
p
p
c
c
ρ
ρ
ρ
= +
= +
=
+
⇒
=
+
Dla przepływów ściśliwych
1
1
1
*
2
1
1
*
2
1
1
*
2
1
1
1
1
2
1
1
2
1
1
2
k
k
k
k
T
T
Ma
k
p
p
Ma
k
v
v
Ma
−
−
−
=
+
−
=
+
−
=
+
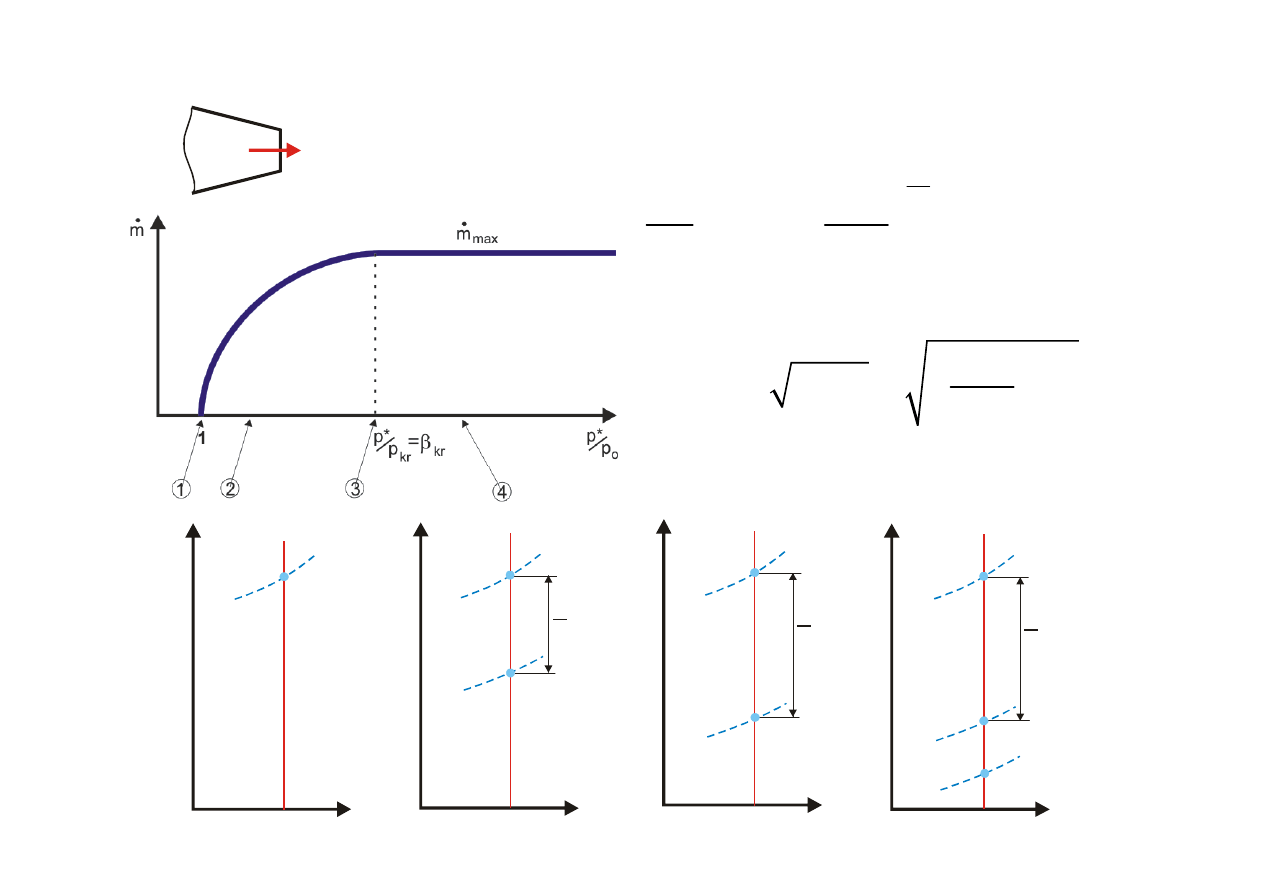
Maksymalny wydatek przepływu
p*
p
c
o
1
*
*
1
2
1, 4
1,893
2
1
k
k
kr
kr
kr
kr
kr
kr
kr
kr
p
k
p
k
k
c
a
kRT
RT
k
m
Ac
β
β
ρ
−
+
=
=
=
⇒
≈
= =
=
+
=
i
s
*
c
2
2
kr
kr
0
p
p
=p
i
s
*
c
2
2
0
p
p
i
s
*
0
p =p
s
*
c
2
2
kr
kr
0
p
p
p
i
4)
1)
2)
3)
Równania dla przepływu krytycznego
1
Ma
=
1
1
1
2
*
*
*
*
*
,
:
2
2
1
2
1
2
1
2
k
k
k
a
i
i
gdzie a
kRT
i
i
k
T
T
k
p
p
k
v
v
−
−
= +
−
= +
+
=
+
=
+
=
Parametry statyczne
przepływającego czynnika
noszą nazwę parametrów
krytycznych
kr
p
p
⇔
prędkość dźwięku
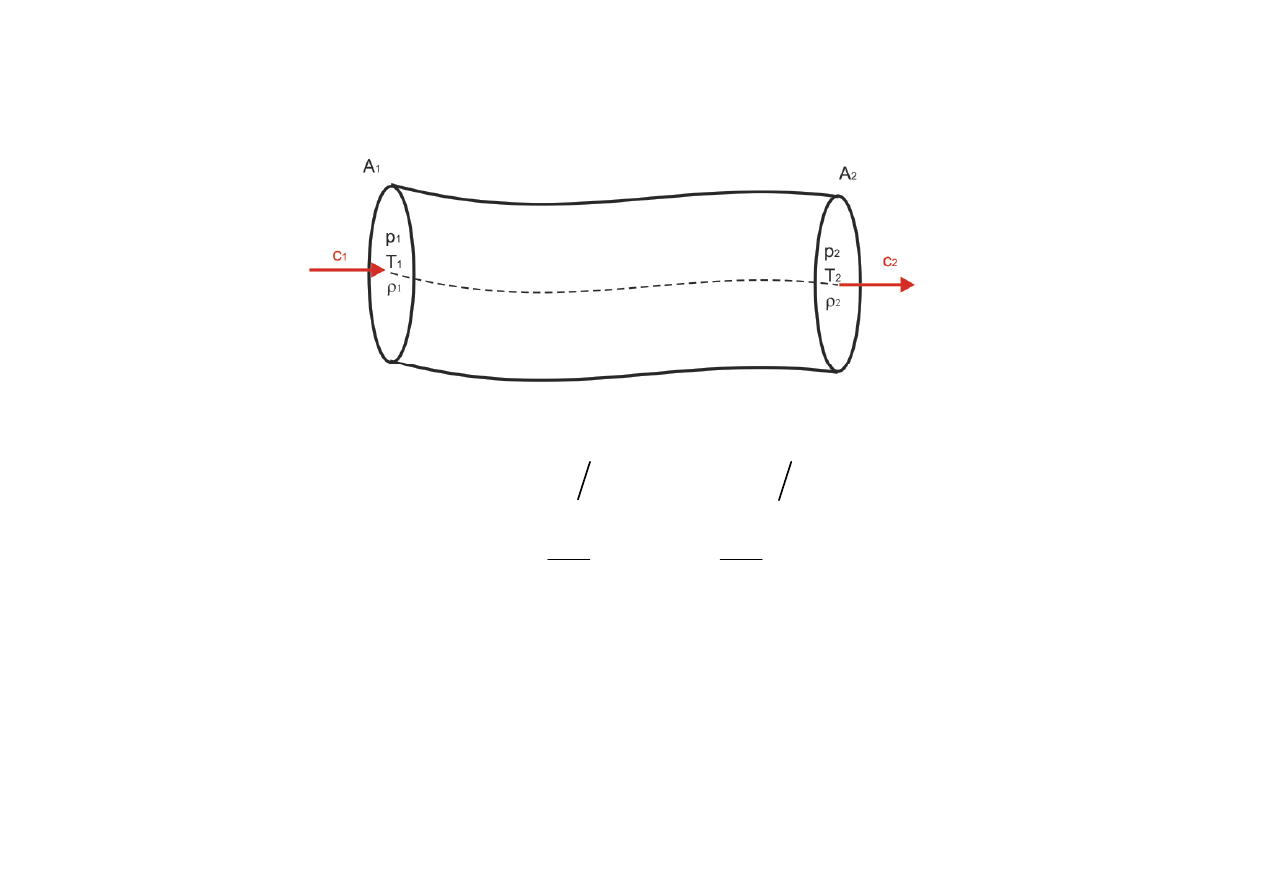
Przepływ ustalony przez kanał bez wymiany ciepła
Z I zasady termodynamiki:
*
2
2
*
2
1
1
2
2
2
2
2
i
i
c
i
i
c
= +
= = +
*
*
*
1
2
i
idem
i
i
=
⇔ =
2
2
*
*
1
2
1
1
2
2
2
2
p
p
c
c
T
T
T
T
c
c
= +
=
=
+
Przepływ ze stratami:
*
*
1
2
p
p
>
σ
gdzie
- współczynnik strat ciśnienia
*
*
2
1
p
p
σ
=
Z równania ciągłości:
1
2
m
m
=
1 1 1
2
2 2
A c
A c
ρ
ρ
=
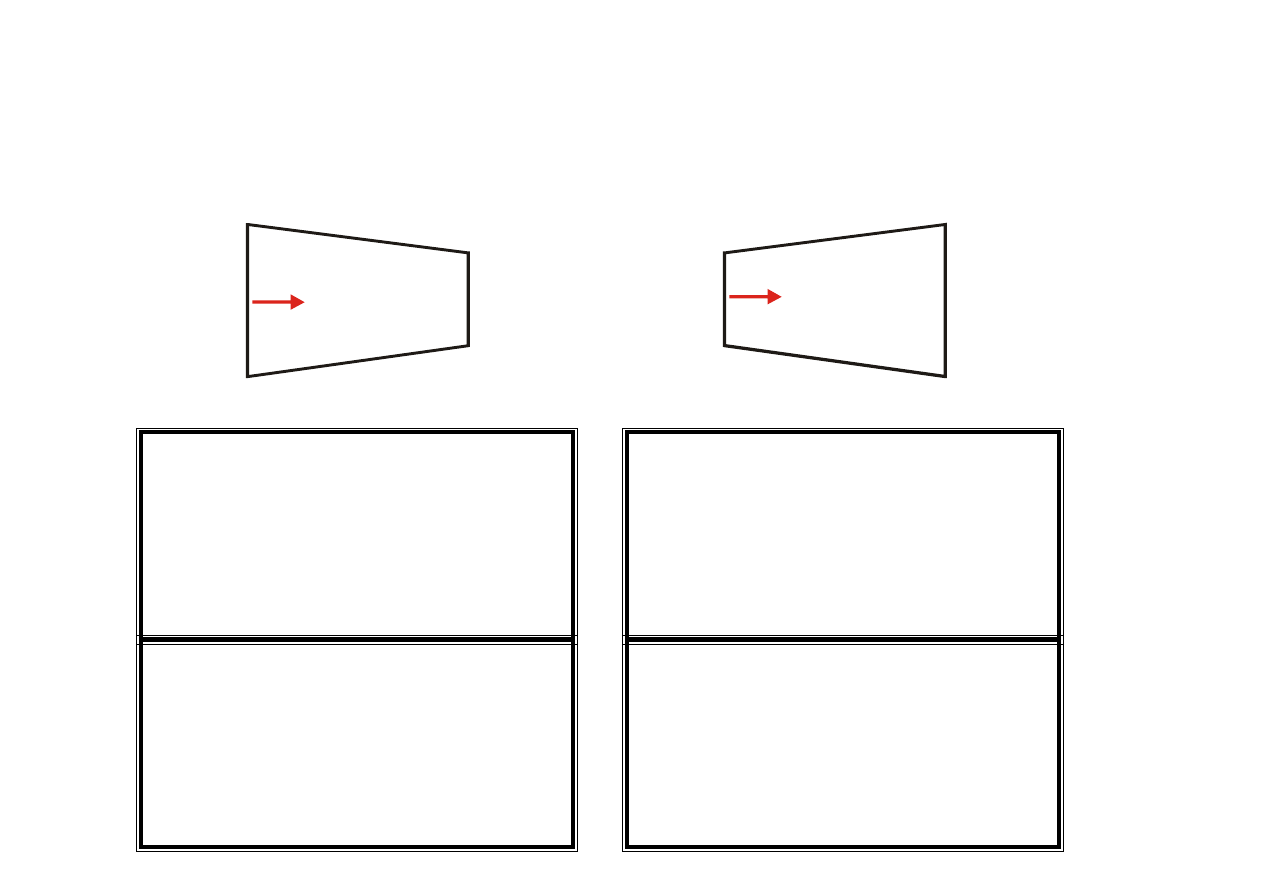
Przepływ przez kanał o zmiennym polu przekroju
KANAŁ ZBIEŻNY
KANAŁ ROZBIEŻNY
dA>0
c
dA<0
c
Gdy c<a, Ma<1
dc>0, dp<0, d
ρ<0, dT<0
D Y S Z A
Gdy c<a, Ma<1
dc<0, dp>0, d
ρ>0, dT>0
D Y F U Z O R
Gdy c>a, Ma>1
dc<0, dp>0, d
ρ>0, dT>0
D Y F U Z O R
dc>0, dp<0, d
ρ<0, dT<0
D Y S Z A
Gdy c>a, Ma>1
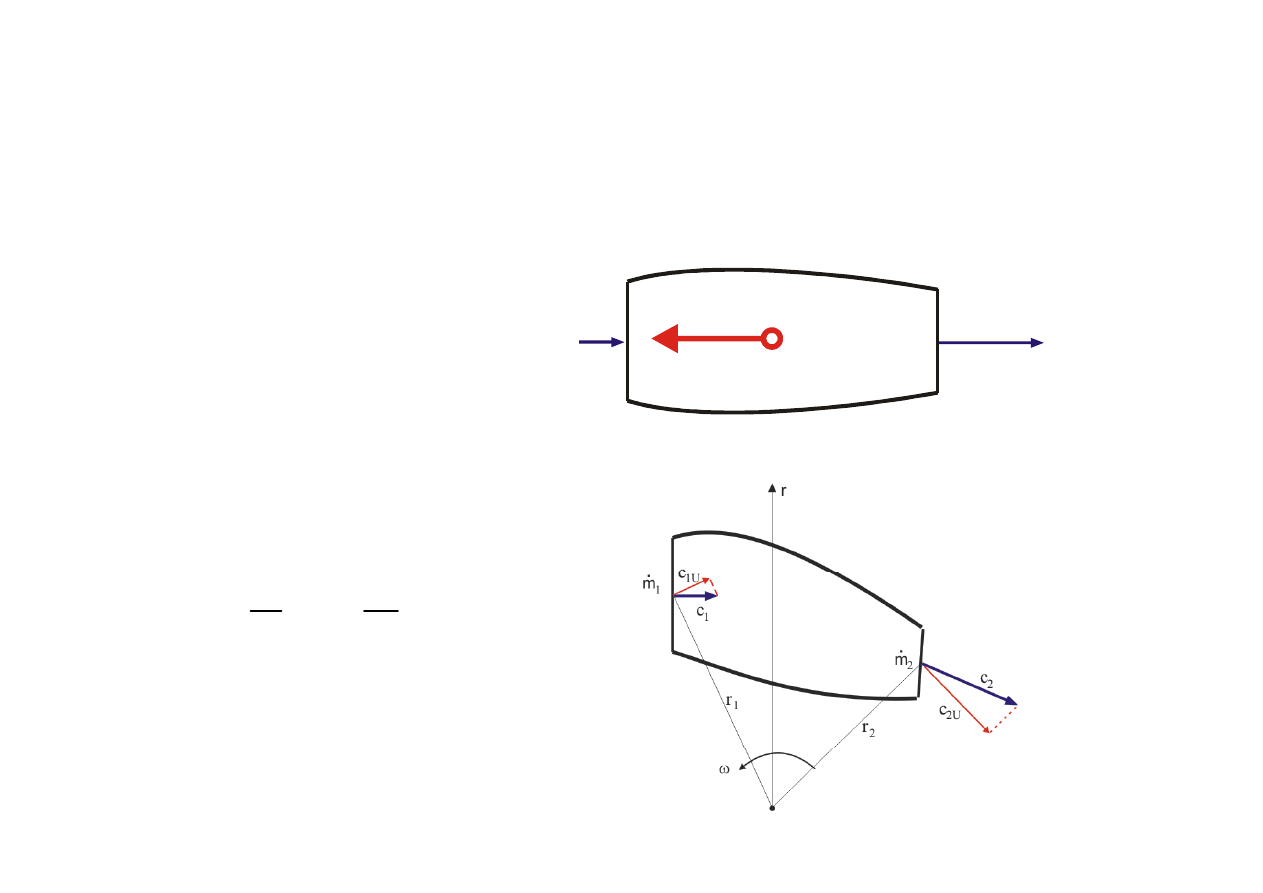
Równanie pędu i momentu pędu (równania Eulera)
Równanie pędu
c
c
1
2
1
2
m
m
.
.
F
2
2
1 1
F m C
m C
=
−
Równanie momentu pędu
2
2U 2
1 1U 1
M m C r
m C r
=
−
u
l
P
M
m
= =
ω
ω
gdzie PRACA UNOSZENIA
u
2
2U
1 1U
l
u C
u C
=
−
u
r
= ω
- prędkość unoszenia
Document Outline
- Repetytorium z termodynamiki i mechaniki p³ynów
- Gaz doskona³y
- Gaz pó³doskona³y
- Gaz rzeczywisty
- Równanie ci¹g³oœci
- Równanie bilansu energii(dla wyodrêbnionego uk³adu)
- Uk³ady otwarte
- Praca, praca techniczna
- Entropia
- Charakterystyczne przemiany gazówPRZEMIANA IZOTERMICZNA T=idem
- Charakterystyczne przemiany gazówPRZEMIANA IZOCHORYCZNA V=idem
- Charakterystyczne przemiany gazówPRZEMIANA IZOBARYCZNA p=idem
- Charakterystyczne przemiany gazówPRZEMIANA IZENTALPOWA I=idem
- Charakterystyczne przemiany gazówPRZEMIANA IZENTROPOWA s=idem
- Charakterystyczne przemiany gazówPRZEMIANA POLITROPOWA
- Zobrazowanie przemian na wykresie i-s
- Równanie przep³ywu izentropowego
- Maksymalny wydatek przep³ywu
- Równania dla przep³ywu krytycznego
- Przep³yw ustalony przez kana³ bez wymiany ciep³a
- Przep³yw przez kana³ o zmiennym polu przekroju
- Równanie pêdu i momentu pêdu (równania Eulera)
Wyszukiwarka
Podobne podstrony:
17 kinetyczna teoria gazów i termodynamika II
rach zarzadcza, Uklad kalkulacyjny - teoria, przypomnienie
Liberacki - Obieg Otto, Obiegi termodynamiczne silników spalinowych tłokowych
sciaganaterme2, Sprężarkowe pompy ciepła realizują obieg termodynamiczny (obieg Lindego), będący odw
Kinetyczna teoria gazów i termodynamika I
16 - Termodynamika - Teoria, Termodynamika 1
16 kinetyczna teoria gazów i termodynamika I
Termodynamika teoria 1 49
Liberacki - Obieg Diesla, Obiegi termodynamiczne silników spalinowych tłokowych
Teoria literatury 2, Symbol, alegoria, przypowie˙˙ - obja˙nienie poj˙˙, przyk˙ady:
Kinetyczna teoria gazów i termodynamika II
OBIEGI TERMODYNAMICZNE W SILNIKACH SPALINOWYCH, OBIEGI TERMODYNAMICZNE W SILNIKACH SPALINOWYCH
Temat nr 1 - Teoria procesu roboczego, Silniki okretowe
17 kinetyczna teoria gazów i termodynamika II
więcej podobnych podstron