Z. Kąkol-Notatki do Wykładu z Fizyki
16-1
Wykład 16
16. Kinetyczna teoria gazów i termodynamika I
16.1 Prawo gazów doskonałych
Gaz doskonały:
•
objętość cząsteczek gazu jest o wiele mniejsza niż objętość zajmowana przez gaz,
•
zasięg sił działających między dwoma cząstkami jest o wiele mniejszy niż średnia
odległość międzycząsteczkowa.
W wyprowadzeniu prawa gazów doskonałych będziemy traktować cząsteczki gazu jako
N małych, twardych kulek zamkniętych w pudełku o objętości V. Kulki są twarde tzn.
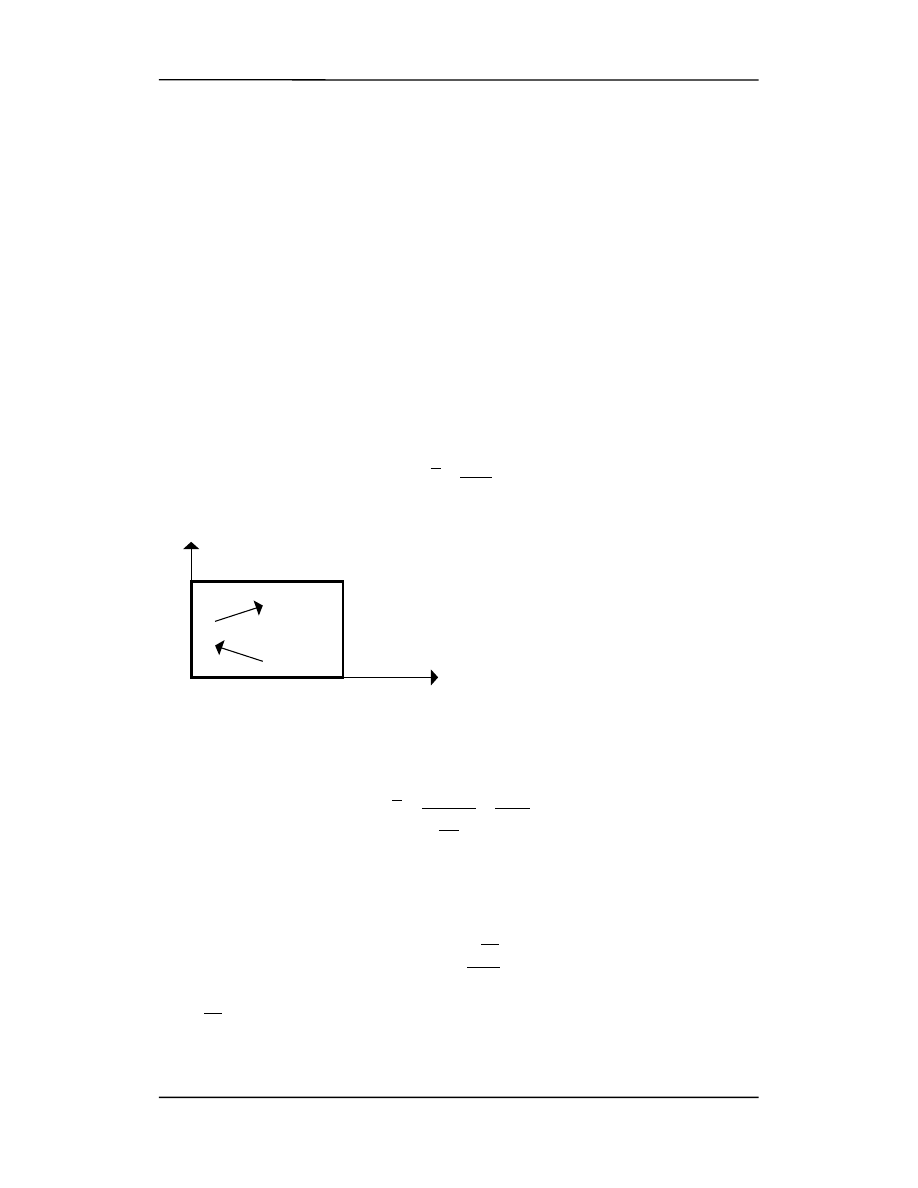
będą zderzały się sprężyście ze ściankami naczynia. Rozważmy jedną cząsteczkę, która
zderza się z lewą ścianką naczynia (rysunek). Średnia siła jaką cząsteczka wywiera na
ściankę w czasie
∆
t wynosi
t
p
F
x
d
d
=
Zmiana pędu spowodowana zderzeniem ze
ścianką wynosi
∆
p
x
= mv
x
- ( - mv
x
) = 2mv
x
Ponieważ czas pomiędzy kolejnymi zderze-
niami z tą ścianką wynosi
∆
t = 2l/v
x
gdzie l jest odległością między ściankami, to
l
m
l
m
F
x
x
x
2
2
)
2
(
v
v
v
=
=
jest średnią siłą działającą na ściankę (na jedną cząstkę).
Dla N cząstek całkowita siła wynosi
l
m
N
F
x
2
v
=
gdzie
2
x
v
jest to
2
x
v
uśrednione po wszystkich cząsteczkach (średnia kwadratu). Dzieląc
obie strony równania przez pole powierzchni ścianki S otrzymujemy ciśnienie
x
y
-v
x
v
x
Z. Kąkol-Notatki do Wykładu z Fizyki
16-2
V
m
N
Sl
m
N
P
x
x
2
2
v
v
=
=
czyli
2
x
Nm
pV
v
=
(16.1)
Jak widać iloczyn pV jest stały tak długo jak długo jest stała energia kinetyczna cząstek
(prawo Boyle'a - Mariotta).
Zauważmy, że
2
2
2
2
z
y
x
v
v
v
v
+
+
=
Ponadto, ponieważ cząstki zderzają się w taki sam sposób ze wszystkimi sześcioma
ściankami naczynia więc
2
2
2
z
y
x
v
v
v
=
=
więc
3
,
3
2
2
2
2
v
v
v
v
=
=
x
x
czyli
Teraz otrzymujemy równanie wyrażone przez v a nie przez v
x
3
2
v
Nm
pV
=
(16.2)
Ponieważ Nm = M (masa gazu), oraz M/V =
ρ więc równanie powyższe można przepi-
sać w postaci
ρ
ρ
p
p
kw
sr
3
,
3
2
.
.
2
=
=
=
v
v
v
czyli
(16.3)
16.2 Temperatura
Zdefiniujmy temperaturę bezwzględną jako wielkość wprost proporcjonalną do
średniej energii kinetycznej cząstek
2
3
2
2
v
m
k
T
=
(16.4)
gdzie k jest stałą Boltzmana k = 1.38·10
-23
J/K.
Eliminując
2
v
z równań (16.2) i (16.4) otrzymujemy
pV = NkT

Z. Kąkol-Notatki do Wykładu z Fizyki
16-3
lub
pV = nRT
(16.5)
gdzie n jest liczbą moli (R = kN
AV
). Przypomnijmy, że stała Avogadra N
Av
= 6.023·10
23
1/mol, określa liczbę cząsteczek w jednym molu.
Wyrażenie (16.5) przedstawia
równanie stanu gazu doskonałego
.
Równanie stanu gazu doskonałego zostało sformułowane w XIX w. przez Clapeyro-
na na podstawie trzech praw empirycznych odkrytych wcześniej przez innych badaczy:
•
Prawo Boyle'a-Mariotte'a stwierdza, że w stałej temperaturze iloczyn ciśnienia i ob-
jętości danej masy gazu jest stały pV = const.
•
Prawo Charlesa mówi, że przy stałej objętości gazu stosunek ciśnienia i temperatury
danej masy gazu jest stały p/T = const.
•
Prawo Gay-Lussaca stwierdza, że dla stałego ciśnienia stosunek objętości do tempe-
ratury danej masy gazu jest stały V/T = const.
16.2.1 Termometry
Aby zmierzyć temperaturę trzeba wyznaczyć energię kinetyczną cząsteczek gazu co jest
bardzo trudne. Ale możemy się posłużyć równaniem stanu gazu doskonałego. Łatwo
jest zmierzyć iloczyn pV np. dla układu o stałym ciśnieniu.
16.3 Ekwipartycja energii
16.3.1 Zerowa zasada termodynamiki
Jeżeli dwa ciała o różnych temperaturach zetkniemy ze sobą (i odizolujemy od in-
nych) to po dostatecznie długim czasie ich temperatury wyrównają się. Powiemy, że te
ciała są w
równowadze termicznej
ze sobą.
Jeżeli ciała 1 i 2 są w równowadze termicznej i ciała 2 i 3 są w równowadze termicznej
to ciała 1 i 3 są w tej samej równowadze termicznej
.
To jest zerowa zasada termodynamiki. Z zasad dynamiki Newtona można pokazać, że
średnie energie kinetyczne ruchu postępowego (na cząsteczkę) dla dwu kontaktujących
się gazów są równe.
16.3.2 Ekwipartycja energii
Wiemy już, że w równowadze termodynamicznej energie kinetyczne ruchu postę-
powego wszystkich cząsteczek są równe. Ale co z ruchem obrotowym i drganiami? Czy
cząsteczka może gromadzić energię w innej postaci niż energia ruchu postępowego?
Jeżeli tylko cząstka nie ma kształtu kuli (1 atomowa) a ma pewną strukturę wewnętrzną
to może wirować i drgać. Np. dwuatomowa w kształcie hantli zacznie się obracać po
zderzeniu. Na podstawie mechaniki statystycznej można pokazać, że
gdy liczba punk-
tów materialnych jest bardzo duża i obowiązuje mechanika Newtonowska to dostępna
energia rozkłada się w równych porcjach na wszystkie niezależne sposoby, w jakie czą-
steczka może ją absorbować
. Każdy z tych sposobów absorpcji energii nazywa się
stop-
niem swobody
i jest równy liczbie niezależnych współrzędnych potrzebnych do określe-
nie położenia ciała w przestrzeni.

Z. Kąkol-Notatki do Wykładu z Fizyki
16-4
Innymi słowy:
średnia energia kinetyczna na każdy stopień swobody jest taka sama dla
wszystkich cząsteczek
. Ten wynik nazywamy zasadą
ekwipartycji energii
.
Średnia energia kinetyczna ruchu postępowego (z równania definiującego T) wynosi
kT
m
2
3
2
1
2
=
v
Odpowiada to trzem stopniom swobody (współrzędne x, y, z). Stąd
średnia energia na
stopień swobody wynosi
(1/2)kT
na cząsteczkę (zależy tylko od T).
Dla cząstek obracających się potrzeba 3 dodatkowych współrzędnych do opisania ruchu
(obrót względem trzech osi) więc mamy dodatkowe 3 stopnie swobody.
O ile dla N cząsteczek nie obracających się całkowita energia (wewnętrzna) U będzie
energią kinetyczną ruchu postępowego U = 3/2(NkT) to dla cząstek, które mogą obracać
się swobodnie we wszystkich kierunkach (wieloatomowe)
U = (3/2)(NkT) + (3/2)(NkT) = 3NkT
Natomiast dla cząstki dwuatomowej (gładkiej)
U = 3/2(NkT) + (2/2)(NkT) = (5/2)(NkT)
bo nie ma obrotu wokół osi hantli.
Zwróćmy uwagę, że mówimy tu o energii "ukrytej" (wewnętrznej) cząstek a nie o ener-
gii makroskopowej (związanej z ruchem masy). O tej energii mówiliśmy przy zasadzie
zachowania energii (energia indywidualnych cząstek nie zawarta w energii kinetycznej
czy potencjalnej ciała jako całości). Energię wewnętrzną oznacza się zazwyczaj przez U
i takie oznaczenie będziemy dalej stosować.
16.4 Pierwsza zasada termodynamiki
To jest po prostu inna wersja zasady zachowania energii, w której mamy rozdzieloną
energię ciała na część makroskopową i mikroskopową. Makroskopowa to energia ruchu
masy (energia mechaniczna). Mikroskopowa to "ukryta" energia cząstek (energia we-
wnętrzna).
Gdy dwa układy (ciała) o różnych temperaturach zetkniemy ze sobą to ciepło
∆
Q
przepływa z ciała cieplejszego do chłodniejszego. Zgodnie z zasadą zachowania energii,
ciepło pobrane przez układ musi być równe wzrostowi energii wewnętrznej układu plus
pracy wykonanej przez układ nad otoczeniem zewnętrznym czyli
∆
Q =
∆
U +
∆
W
(16.6a)
To jest sformułowanie
I zasady termodynamiki
.
Zasada ta pracuje "w obie strony" tzn., gdy nad układem zostanie wykonana praca to
układ może oddawać ciepło. To równanie bardzo często przybiera postać
dU = dQ – dW
(16.6b)
Z. Kąkol-Notatki do Wykładu z Fizyki
16-5
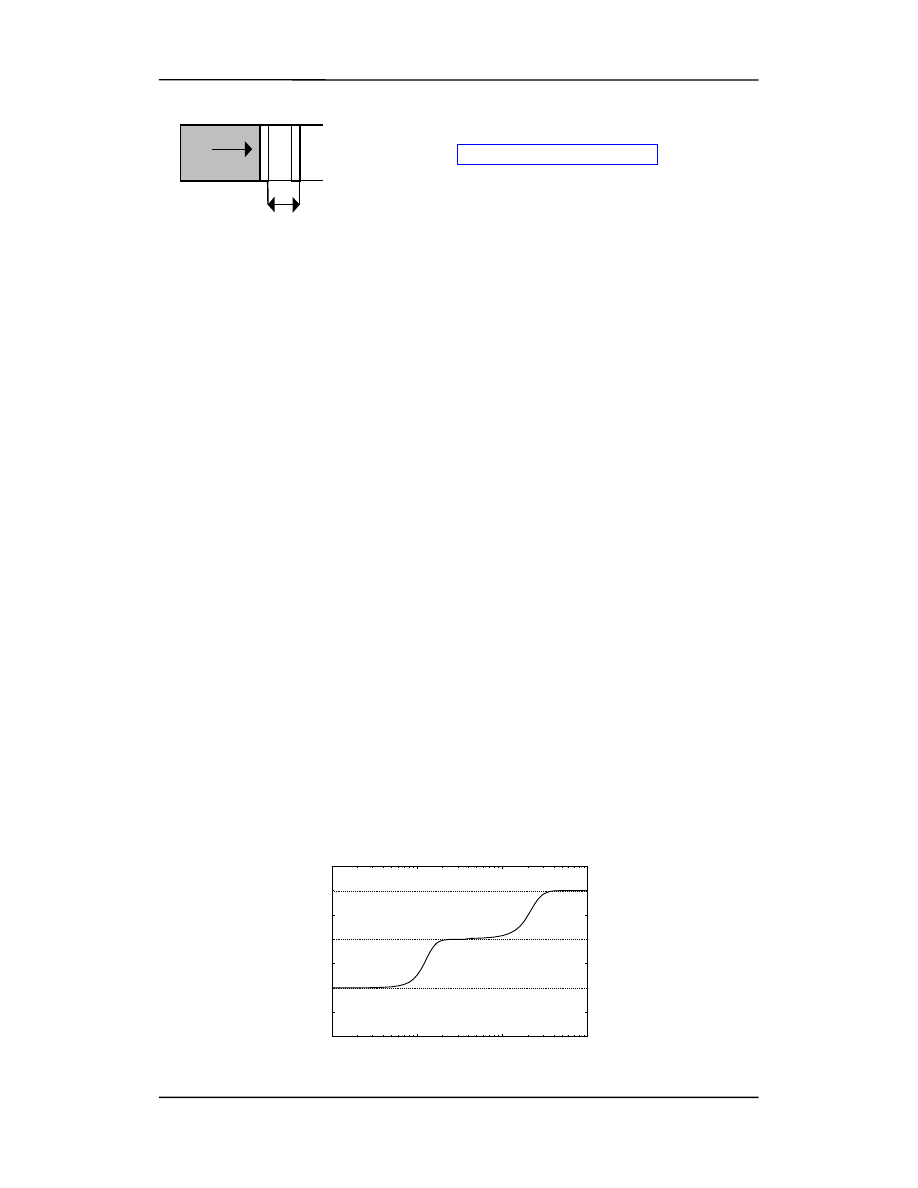
Jeżeli rozpatrujemy układ jak na rysunku obok to
dW = Fdl = (F/S)(Sdl) = pdV
(16.7)
i wtedy
dU = dQ – pdV
16.5 Ciepło właściwe
Ciepło właściwe definiujemy jako
dQ/dT
na gram lub mol substancji
(ciepło wago-
we lub molowe).
16.5.1 Ciepło właściwe przy stałej objętości
Ponieważ dV = 0 więc dU = dQ a stąd
c
v
= dQ/dT = dU/dT
Dla gazu jednoatomowego (dla jednego mola) U = (3/2)N
AV
kT = (3/2)RT.
Zatem
c
v
= (3/2)R
Dla cząsteczki dwuatomowej spodziewamy się więc
c
v
= (5/2)R
a dla wieloatomowej
c
v
= 3R
Niedoskonałością modelu opartego na mechanice klasycznej jest to, że przewiduje cie-
pło właściwe niezależne od temperatury, a badania pokazują, że jest to prawdziwe tylko
dla gazów jednoatomowych. Dla pozostałych c
v
rośnie z temperaturą.
Na rysunku poniżej przedstawiono c
V
dla wodoru (H
2
) w funkcji temperatury (w skali
logarytmicznej).
F
V
dl
S
10
100
1000
10000
2
4
6
8
(3/2) R
(5/2) R
(7/2) R
C
v
c
a
l/m
o
l K
Temperatra (K)

Z. Kąkol-Notatki do Wykładu z Fizyki
16-6
W temperaturach niższych od 100 K, c
v
= (3/2)R co wskazuje, że w tak niskich tempe-
raturach nie ma rotacyjnych stopni swobody. Rotacja staje się możliwa dopiero w tem-
peraturach wyższych (c
v
= (5/2)R). Ale w temperaturach powyżej 2000 K, c
v
osiąga
wartość (7/2)R.
Wytłumaczenie tych zjawisk nie jest możliwe na gruncie mechaniki klasycznej. Dopie-
ro mechanika kwantowa daje wyjaśnienie tych zmian. Gdyby cząstka miała moment
pędu to musiał by on być równy co najmniej L
min
= h/2
π
≈
10
-34
kg m
2
s
-1
(analogia do
modelu Bohra atomu wodoru). Energia kinetyczna ruchu obrotowego dana jest wyraże-
niem
I
L
I
E
rot
2
2
2
2
=
=
ω
Dla cząsteczki H
2
m=1.67·10
-27
kg a R
≈
5·10
-11
m, więc I = 2mR
2
≈
8.3·10
-48
kg m
2
.
Ponieważ na jeden stopień swobody przypada energia kT/2 więc
kT/2 = L
2
/2I
czyli
T = L
2
/kI
Stąd dla L
min
otrzymujemy T
min
≈
90 K.
Dla niższych temperatur energia jest za mała aby wzbudzić rotacje co wymaga pewnej
minimalnej energii. Podobnie jest dla ruchu drgającego, który także jest skwantowany.
E
drg,min
= hv. Dla typowej cząsteczkowej częstotliwości drgań 10
14
Hz (zakres widzial-
ny) otrzymujemy energię drgań
≈
6·10
-20
J co odpowiada temperaturze około 4000 K.
Tak więc z zasady ekwipartycji energii wynika, że w tak wysokich temperaturach śred-
nia energia drgań E
drg
= kT/2. Oprócz energii kinetycznej tego ruchu istnieje jeszcze je-
go energia potencjalna. Zatem średnia energia wewnętrzna na cząsteczkę wynosi
U = E
śr,kin,post
+ E
śr,kin,rot
+ E
śr,kin,drg
+ E
śr,pot,drg
U = (3/2)kT + (2/2)kT + (1/2)kT + (1/2)kT = (7/2)kT
Dla 1 mola
U = (7/2)RT więc c
v
= (7/2)R
16.5.2 Ciepło właściwe przy stałym ciśnieniu
Z I zasady termodynamiki mamy
dQ = dU + pdV
Ponieważ U zależy tylko od T więc mamy dU = c
v
dT więc
dQ = c
v
dT + pdV

Z. Kąkol-Notatki do Wykładu z Fizyki
16-7
Dla gazu doskonałego (1 mola) dV = RdT/p, więc
dQ = c
v
dT + RdT
skąd
dQ/dT = c
v
+ R
Ostatecznie więc
c
p
= c
v
+ R
Molowe ciepła właściwe różnych rodzajów gazów doskonałych (teoretyczne) są zesta-
wione w tabeli poniżej.
Typ gazu
c
v
c
p
c
p
/c
v
Jednoatomowy
Dwuatomowy + rotacja
Dwuatomowy + rotacja + drgania
Wieloatomowy + rotacja (bez drgań)
(3/2)R
(5/2)R
(7/2)R
(6/2)R
(5/2)R
(7/2)R
(9/2)R
(8/2)R
5/3
7/5
9/7
4/3
16.6 Rozprężanie izotermiczne
Działanie silnika opiera się o rozprężanie zapalonej mieszanki gazowej.
Zwykle dwa przypadki
•
rozprężanie izotermiczne
•
rozprężanie adiabatyczne
Przy rozprężaniu izotermicznym trzeba utrzymywać stałą temperaturę ścian cylindra,
czyli tłok musi poruszać się wolno, żeby gaz mógł pozostawać w równowadze termicz-
nej ze ściankami cylindra.
Ponieważ T = const. więc dU = 0, a stąd dQ = dW
=
=
=
=
∆
=
∆
∫
∫
∫
1
2
1
ln
d
d
d
2
2
1
2
1
V
V
NkT
v V
V
NkT
V
V
NkT
V
p
W
Q
V
V
V
V
V
(16.8)
16.7 Rozprężanie adiabatyczne
Zwykle w silnikach tłok porusza się bardzo szybko więc nie ma dość czasu na prze-
pływ ciepła pomiędzy gazem a ścianami cylindra. Wtedy dQ = 0 i otrzymujemy
dU + pdV = 0
Możemy to przepisać w postaci
c
v
dT + pdV = 0
na 1 mol.
Z równania stanu gazu doskonałego otrzymujemy różniczkując
pdV + Vdp = RdT
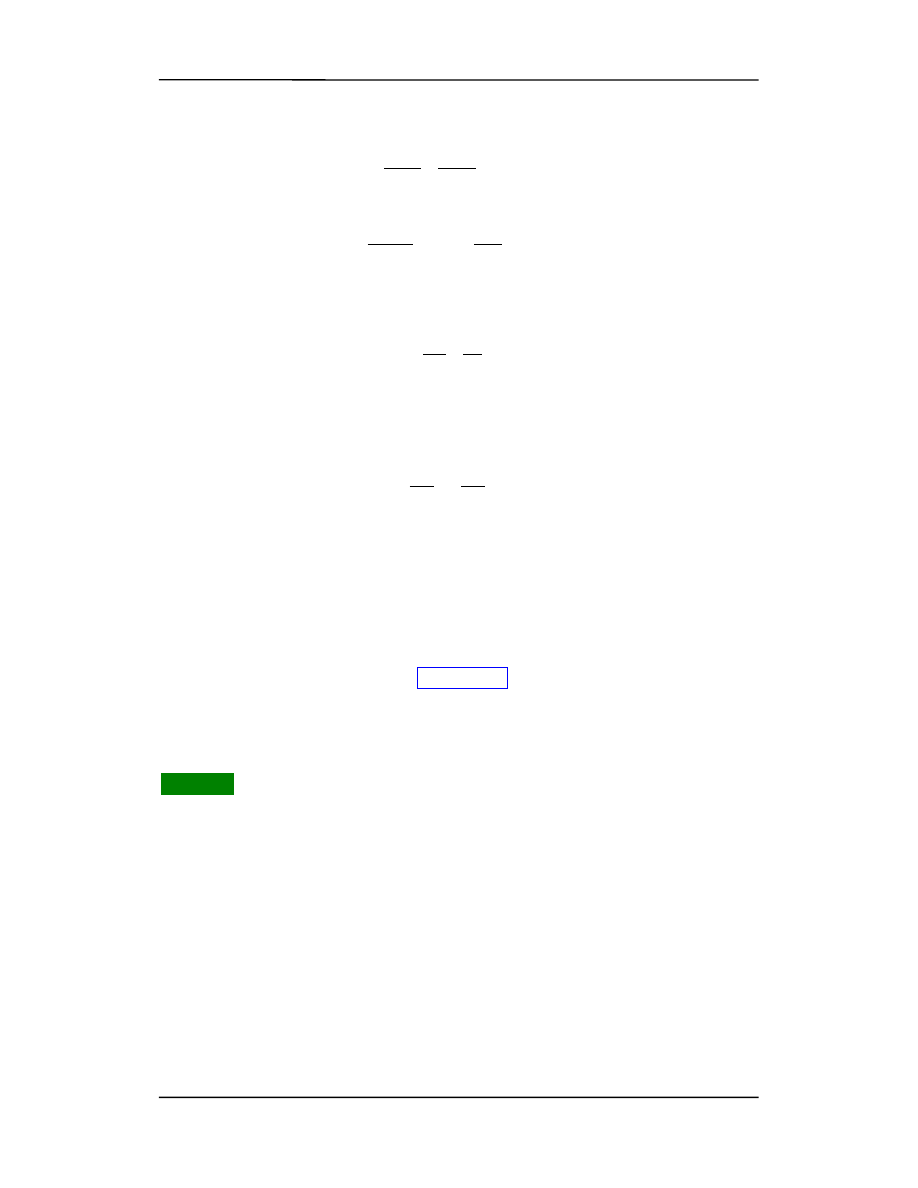
Z. Kąkol-Notatki do Wykładu z Fizyki
16-8
Stąd obliczmy dT i wstawiamy do poprzedniego równania
0
d
d
0
d
d
d
=
+
+
=
+
+
p
R
V
c
V
p
R
R
c
V
p
R
p
V
R
V
p
c
v
v
v
Zastępujemy teraz c
v
+ R = c
p
i otrzymujemy
0
d
d
=
+
p
p
V
V
γ
gdzie
γ = c
p
/c
v
.
Całkując to równanie otrzymamy
.
const
ln
ln
0
d
d
=
+
=
+
∫
∫
p
V
p
p
V
V
γ
γ
gdzie const. oznacza stałą całkowania.
Mamy więc
ln(pV
γ
) = const.
czyli
pV
γ
= const.
(16.9)
co można zapisać:
p
1
V
1
γ
= p
2
V
2
γ
Przykład 1
Silnik benzynowy ma stopień sprężu 9 tzn. V
2
/V
1
= 9. Jaki jest stosunek temperatury
gazów wydechowych do temperatury spalania?
p
1
V
1
γ
= p
2
V
2
γ
więc p
2
/p
1
= (V
1
γ
/V
2
γ
)
Dla gazu doskonałego
p
2
/p
1
= (V
1
T
2
)/(V
2
T
1
)
Porównują te równania otrzymujemy
T
2
/T
1
= (V
1
/V
2
)
γ-1
Powietrze jest głównie dwuatomowe więc
γ = 1.4. Stąd otrzymujemy T
2
/T
1
= 0.415
Wyszukiwarka
Podobne podstrony:
16 Kinetyczna teoria gazów i termodynamika I
17 kinetyczna teoria gazów i termodynamika II
Kinetyczna teoria gazów i termodynamika I
Kinetyczna teoria gazów i termodynamika II
17 kinetyczna teoria gazów i termodynamika II
17 Kinetyczna teoria gazów i termodynamika II
Sprawozdania, KINETYCZNA TEORIA GAZÓW, KINETYCZNA TEORIA GAZÓW
Kinetyczna teoria gazów 2
zestaw 13 kinetyczna teoria gazów, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
Kinetyczna teoria gazów
17 kinetyczna teoria gazów
więcej podobnych podstron