Elementy kinetycznej teorii
gazów i termodynamiki
Dział V
ZSZ
Bartosz Jabłonecki
Podstawowe założenia teorii kinetyczno-
molekularnej budowy ciał.
Wszystkie ciała zbudowane są z
cząsteczek (molekuł).
Cząsteczki pozostają w
bezustannym, chaotycznym ruchu,
zwanym ruchem cieplnym.
ZSZ
Bartosz Jabłonecki
Podstawowe założenia teorii kinetyczno-
molekularnej budowy ciał.
Model gazu doskonałego:
ilość molekuł, z których składa się gaz
jest bardzo duża
odległości między cząsteczkami są
bardzo duże w porównaniu z ich
rozmiarami, cząstki traktujemy jako
bezwymiarowe punkty
cząsteczki poza zderzeniami nie
oddziałują ze sobą
ZSZ
Bartosz Jabłonecki
Podstawowe założenia teorii kinetyczno-
molekularnej budowy ciał.
cząsteczki znajdują się w ciągłym
chaotycznym ruchu, jednak od
zderzenia do zderzenia poruszają się
ruchem jednostajnym prostoliniowym
średnia energia kinetyczna wszystkich
cząsteczek jest proporcjonalna do
temperatury gazu
ZSZ
Bartosz Jabłonecki
Podstawowe założenia teorii kinetyczno-
molekularnej budowy ciał.
Doświadczenia potwierdzające
słuszność podstawowych założeń
teorii kinetyczno-molekularnej
budowy ciał:
dyfuzja,
parowanie,
ruchy Browna.
ZSZ
Bartosz Jabłonecki
Mikroskopowy obraz gazu.
Analiza przykładowego gazu
- 1cm
3
tlenu, ciśnienie normalne i temp.
0
o
C
liczba cząsteczek
0000000000
2700000000
10
27
18
N
ZSZ
Bartosz Jabłonecki
Mikroskopowy obraz gazu.
Analiza przykładowego gazu
- 1cm
3
tlenu, ciśnienie normalne i temp.
0
o
C
masa jednej cząsteczki
g
g
m
0053
0000000000
0000000000
,
0
10
53
24
ZSZ
Bartosz Jabłonecki
Mikroskopowy obraz gazu.
Analiza przykładowego gazu
- 1cm
3
tlenu, ciśnienie normalne i temp.
0
o
C
szybkości cząsteczek
s
m
v
s
m
v
s
m
v
śr
425
2500
100
max
min
ZSZ
Bartosz Jabłonecki
Mikroskopowy obraz gazu.
Analiza przykładowego gazu
- 1cm
3
tlenu, ciśnienie normalne i temp.
0
o
C
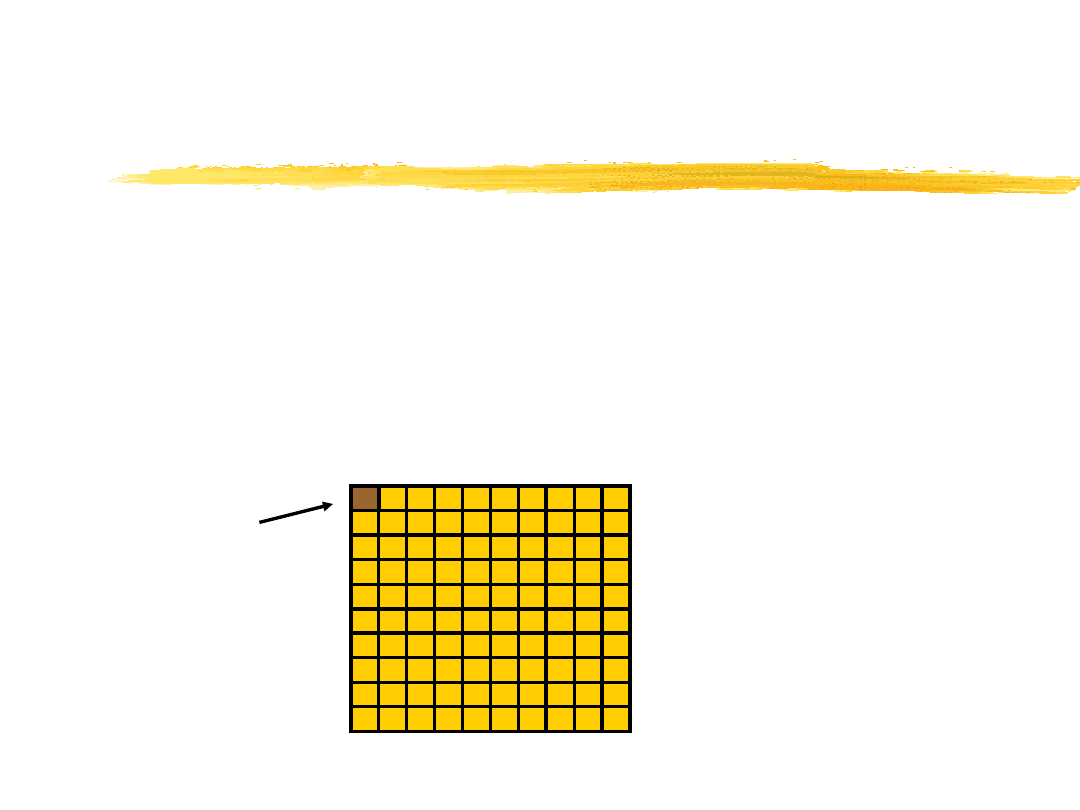
cząsteczki zajmują tylko
1
/
100
przestrzeni
1
/
100
ZSZ
Bartosz Jabłonecki
Mikroskopowy obraz gazu.
Analiza przykładowego gazu
- 1cm
3
tlenu, ciśnienie normalne i temp.
0
o
C
cząsteczka zderza się w czasie 1s
4000000000
4
razy
miliardy
ZSZ
Bartosz Jabłonecki
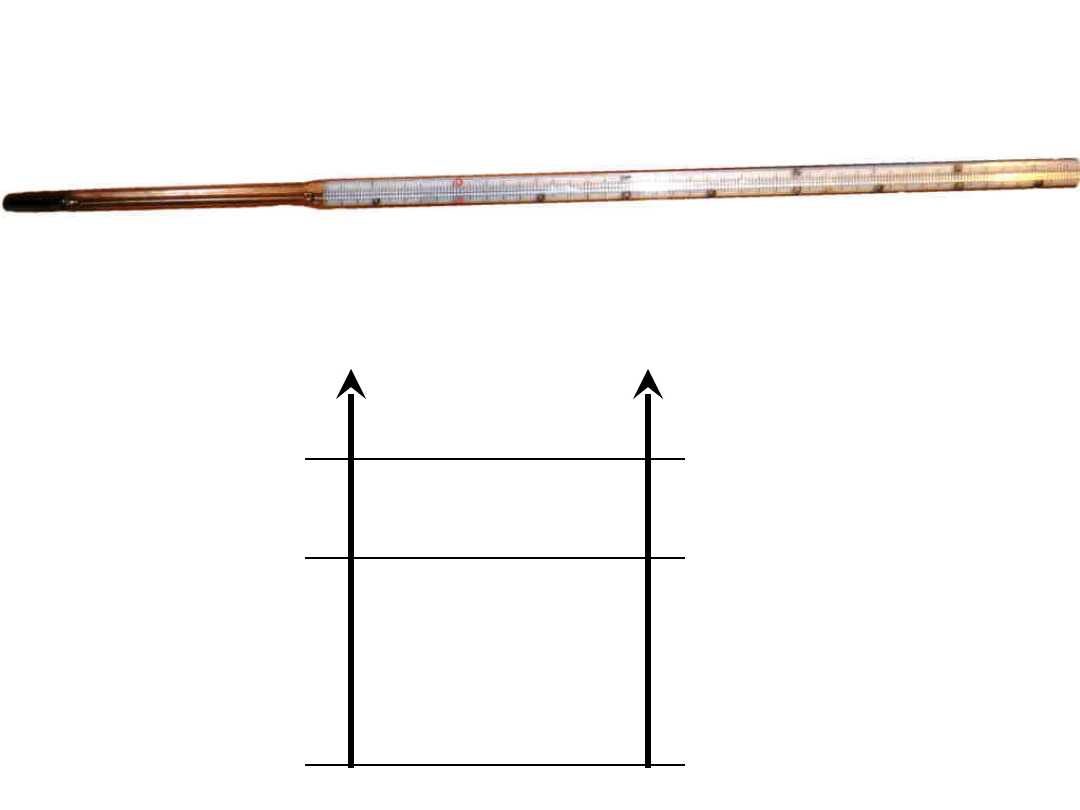
Temperatura.
Temperaturę można wyrażać w skali
Celsjusza i w skali Kelwina.
10
0
0
-
273
37
3
27
3
0
t[
o
C]
T[K]
zero
absolutne
wrzenie
wody
topnienie
lodu

ZSZ
Bartosz Jabłonecki
Temperatura.
Każda cząsteczka gazu posiada pewną
energię kinetyczną, a ponieważ te
energie są różne, wprowadzamy średnią
energię kinetyczną, przypadająca na
jedną cząsteczkę.
gdzie n to liczba cząsteczek
n
E
E
E
E
ost
k
k
k
ksr
.
2
1
ZSZ
Bartosz Jabłonecki
Temperatura.
Między średnią energią kinetyczną
cząsteczek gazu a temperaturą gazu
występuje zależność
proporcjonalności.
T
E
ksr
~
ZSZ
Bartosz Jabłonecki
Temperatura - zadania.
Zad. 1. Wyraź w skali Kelwina
temperaturę:
36,6
o
C,
15
o
C,
100
o
C,
53
o
C,
-20
o
C.
ZSZ
Bartosz Jabłonecki
Temperatura - zadania.
Zad. 2. Wyraź w skali Celsjusza
temperaturę:
10K,
273K,
383K,
253K,
203K.
ZSZ
Bartosz Jabłonecki
Energia wewnętrzna.
Energią wewnętrzną U ciała
nazywamy sumę wszystkich
rodzajów energii wszystkich
cząsteczek tego ciała.
n
E
E
E
U
2
1
ZSZ
Bartosz Jabłonecki
Energia wewnętrzna.
Energia wewnętrzna gazu
doskonałego jest sumą energii
kinetycznych wszystkich N
cząsteczek tego gazu.
ksr
razy
n
ksr
ksr
ksr
kn
k
k
E
N
U
E
E
E
U
E
E
E
U
2
1
ZSZ
Bartosz Jabłonecki
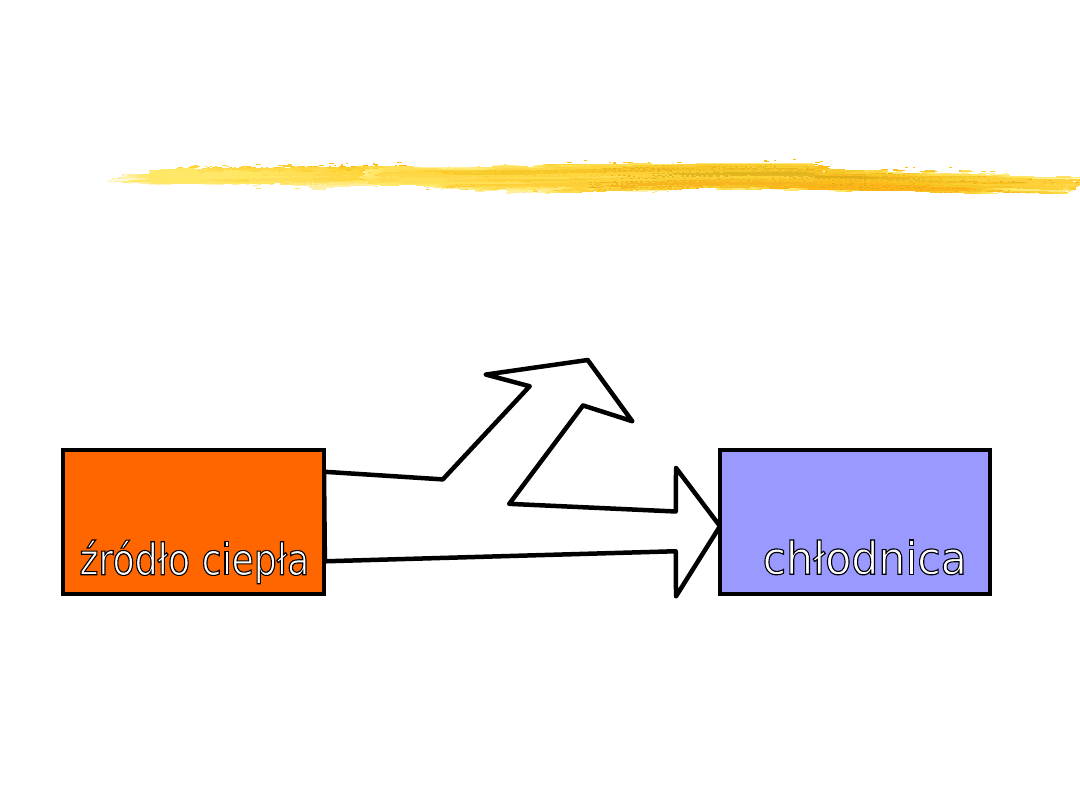
Ciepło - proces wymiany
energii wewnętrznej.
Ciepło Q przekazywane przez układ
o temperaturze wyższej ciału
o temperaturze niższej
jest równe zmianie energii
wewnętrznej tego ciała.
T
1
T
2
Ciepło
Q
2
1
T
T

ZSZ
Bartosz Jabłonecki
Pierwsza zasada
termodynamiki.
Przyrost energii wewnętrznej gazu
może nastąpić w wyniku:
wykonanej nad nim pracy,
dostarczonego do niego ciepła.

ZSZ
Bartosz Jabłonecki
Pierwsza zasada
termodynamiki.
I zasada termodynamiki
Przyrost energii wewnętrznej ciała
jest równy sumie dostarczonego
ciału ciepła Q i wykonanej nad nim
pracy W.
W
Q
U
U
ZSZ
Bartosz Jabłonecki
Pierwsza zasada
termodynamiki.
Zad. 1. Sprężając gaz w cylindrze,
wykonano nad nim pracę 2000J. O ile
wzrosła energia wewnętrzna gazu,
jeżeli podczas sprężania gaz oddał
do otoczenia ciepło równe 500J.
ZSZ
Bartosz Jabłonecki
Pierwsza zasada
termodynamiki.
Zad. 2. Gaz ogrzano dostarczając mu
ciepła w ilości 50kJ a jego
początkowa energia wewnętrzna
wynosiła 20kJ. Wyznacz jego energię
wewnętrzną wiedząc, że wykonał on
pracę równą 30kJ.
ZSZ
Bartosz Jabłonecki
Silnik cieplny.
Schemat silnika cieplnego
2
1
Q
W
Q
W
2
Q
1
Q
1
T
2
T
2
1
T
T

ZSZ
Bartosz Jabłonecki
Silnik cieplny.
Sprawność silnika cieplnego:
gdzie (-eta) - symbol sprawności,
W - praca wykonana, Q - ciepło pobrane
%
100
1
Q
W
ZSZ
Bartosz Jabłonecki
Silnik cieplny.
pamiętając, że:
to sprawność silnika cieplnego
możemy wyrazić za pomocą wzoru:
2
1
2
1
Q
Q
W
Q
W
Q
%
100
1
2
1
Q
Q
Q

ZSZ
Bartosz Jabłonecki
Silnik cieplny.
Idealny silnik cieplny Carnota
(pracuje bez strat energii):
2
2
1
1
T
Q
T
Q
%
100
1
2
1
T
T
T
ZSZ
Bartosz Jabłonecki
Silnik cieplny.
Czy istnieje silnik cieplny pracujący
ze 100% sprawnością?
%
100
1
2
1
T
T
T
K
T
0
2
temperatura
zera
bezwzględnego
czyli -273
o
C
ZSZ
Bartosz Jabłonecki
Silnik cieplny - zadania.
Zad. 1. Oblicz sprawność silnika
cieplnego wiedząc, że w jednym
cyklu źródło ciepła oddało ciepło w
ilości 600J i wykonał on pracę 200J.
ZSZ
Bartosz Jabłonecki
Silnik cieplny - zadania.
Zad. 2. Oblicz sprawność silnika
cieplnego pracującego między
temperaturami 600
o
C, a 100
o
C.
(Pamiętaj o zamianie jednostek na
podstawowe.)
ZSZ
Bartosz Jabłonecki
Rzeczywiste silniki cieplne
Ze względu na rodzaj zastosowanego
czynnika roboczego rozróżniamy
silniki cieplne:
parowe,
spalinowe.
ZSZ
Bartosz Jabłonecki
Rzeczywiste silniki cieplne
Ze względu na budowę rozróżniamy
silniki:
tłokowe,
wirowe,
odrzutowe.
ZSZ
Bartosz Jabłonecki
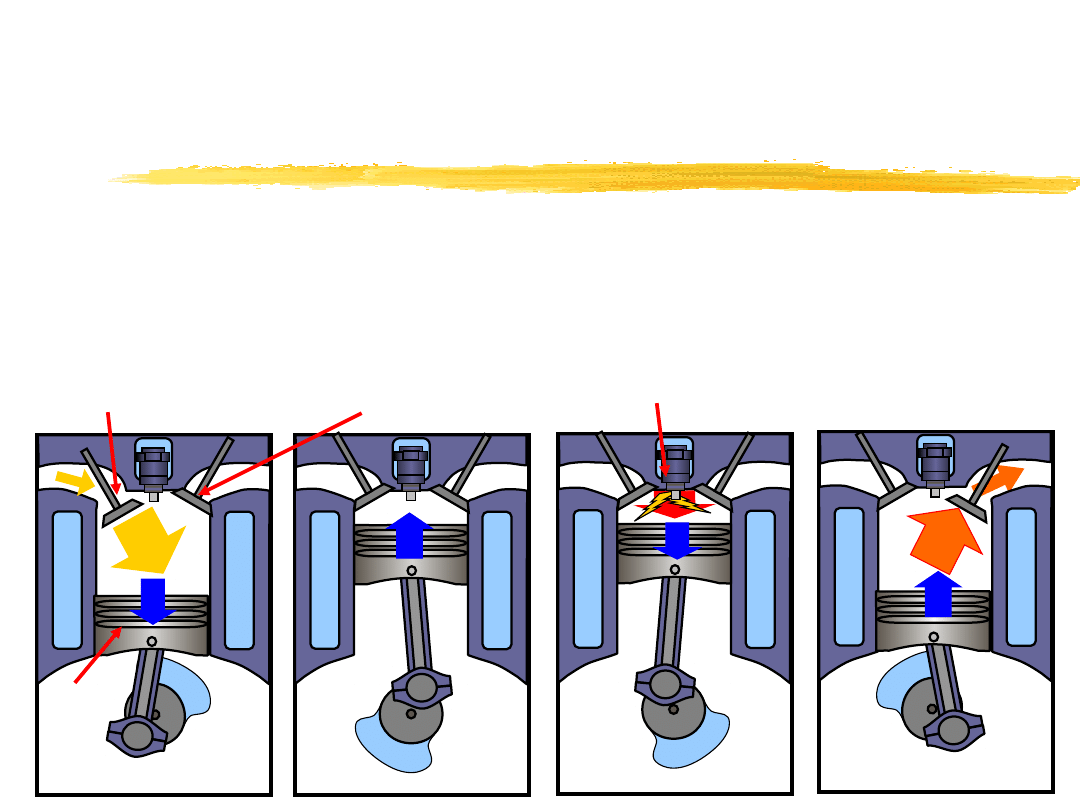
Rzeczywiste silniki cieplne
Zasada działania silnika spalinowego
czterosuwowego z zapłonem iskrowym.
spalani
e
wydec
h
spręża
nie
ssani
e
zawór ssący zawór wydechowy
tłok
iskra
ZSZ
Bartosz Jabłonecki
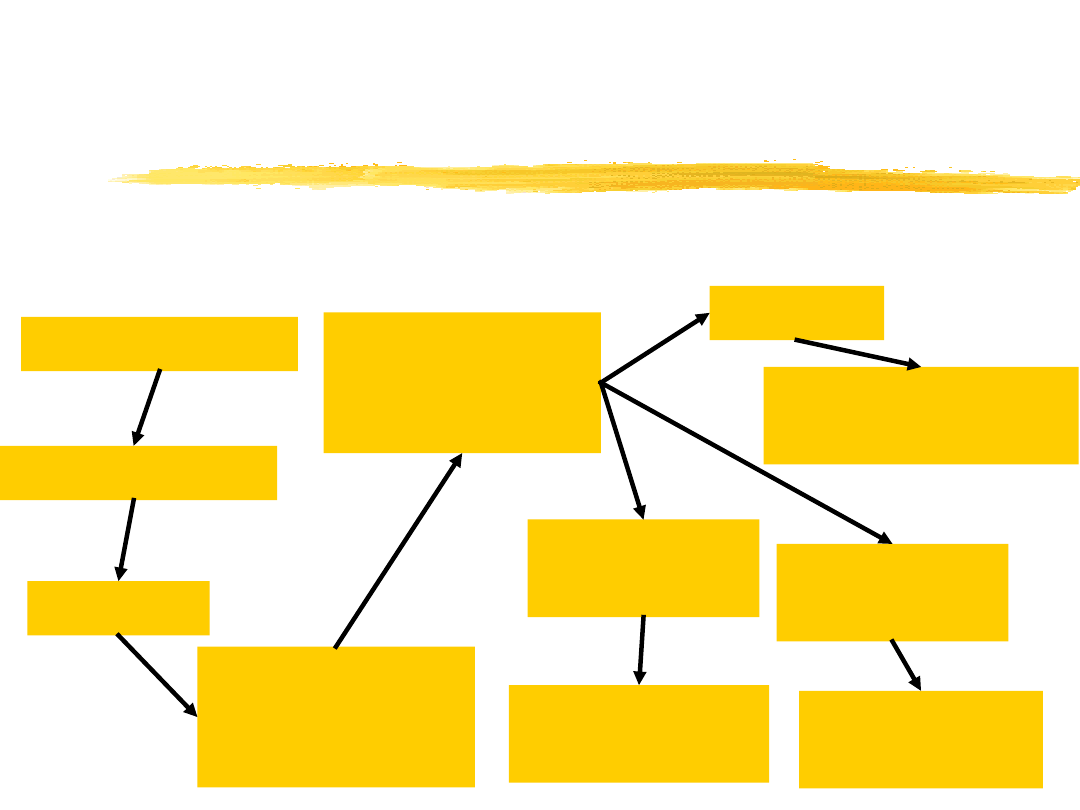
Zasada zachowania energii
całkowitej.
Przykład przemian energii
zapora wodna
turbina wodna
prądnica
transformator
podnoszący
napięcie
transformator
obniżający
napięcie
silnik
elektryczny
energia
mechaniczna
grzejnik
elektryczny
energia
wewnętrzna
żarówka
energia
promieniowania
ZSZ
Bartosz Jabłonecki
Zasada zachowania energii
całkowitej.
Cały zasób energii, suma wszystkich
rodzajów energii u układzie
izolowanym (nie wymieniającym
energii z otoczeniem) pozostaje
niezmieniona - jest stała.
KONIEC
Bibliografia
R.Rozenbajgier i E. Misiaszek
Fizyka z astronomią dla zasadniczej szkoły zawodowej
Kraków 2003, ZamKor
www.fizyka.iss.com.pl
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
17 kinetyczna teoria gazów i termodynamika II
Sprawozdania, KINETYCZNA TEORIA GAZÓW, KINETYCZNA TEORIA GAZÓW
Kinetyczna teoria gazów i termodynamika I
16 kinetyczna teoria gazów i termodynamika I
Kinetyczna teoria gazów 2
Kinetyczna teoria gazów i termodynamika II
zestaw 13 kinetyczna teoria gazów, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
17 kinetyczna teoria gazów
10 Kinetyczna teoria gazow (2)
17 kinetyczna teoria gazów i termodynamika II
17 kinetyczna teoria gazów
16 Kinetyczna teoria gazów i termodynamika I
17 Kinetyczna teoria gazów i termodynamika II
więcej podobnych podstron