10. Kinetyczna teoria gazów.
Wybór i opracowanie zadań od 10.1do 10.6 - Bogusław Kusz.
Więcej zadań z tej tematyki znajdziesz w II części skryptu.
10.1.
Funkcję rozkładu prędkości cząsteczek gazu doskonałego można zapisać w formie:
kT
mV
e
CV
V
f
2
2
2
)
(
−
=
gdzie C jest pewną stałą a m jest masą cząsteczki. Jest to jednocześnie
rozkład prawdopodobieństwa znalezienia w gazie o temperaturze T cząstek o prędkości V.
Wyprowadź wzór oraz oblicz najbardziej prawdopodobną prędkość wodoru i tlenu jeśli
T=300K,
µ
H2
=2g/mol=2·10
-3
kg/mol i
µ
O2
=32g/mol=32·10
-3
kg/mol
, R=8,31 J/(kg mol).
Naszkicuj wykres f(V) obu gazów.
10.2.
Funkcję rozkładu prędkości cząsteczek gazu doskonałego można zapisać w formie:
kT
mV
e
DV
V
f
2
2
2
)
(
−
=
gdzie D jest pewną stałą a m jest masą cząsteczki. Jest to jednocześnie
rozkład prawdopodobieństwa znalezienia w gazie o temperaturze T cząstek o prędkości V.
Wyprowadź wzór oraz oblicz najbardziej prawdopodobną prędkość cząstek azotu gdy
temperatura gazu wynosi T
1
=300K i T
2
=900K
. Naszkicuj wykres f(V) gazu w obu
temperaturach.
µ
N2
=28g/mol=28·10
-3
kg/mol, R=8,31 J/(kg mol).
10.3.
Ocenić ciśnienie i koncentrację powietrza na wysokości: a/ 0m npm, b/ 2499m npm, c/
4807m npm, d/ 8850m npm. Założyć, że przyspieszenie ziemskie i temperatura powietrza nie
zależą od wysokości przy czym g=9.81m/s
2
i t
p
=7
0
C.
10.4.*
Czy na Mount Evereście można zagotować jajko na twardo ? Założenia:
1/ ścinanie białka zachodzi w temperaturze t=60-72
0
C ,
2/ związek temperatury wrzenia wody z ciśnieniem powietrza przy powierzchni wody jest
następujący:
x
x
T
T
p
p
A
1
1
ln
1
0
0
−
=
gdzie: p
0
=9,81·10
4
Pa, T
0
=373K, A=4950 K, a T
x
jest temperaturą wrzenia wody pod
ciśnieniem p
x
, przyspieszenie ziemskie i temperatura powietrza nie zależą od wysokości przy
czym g=9.81m/s
2
i t
p
=7
0
C.
10.5.
Na jakiej wysokości ciśnienie powietrza spada do połowy swej wartości przy powierzchni
morza ? Założyć, że przyspieszenie ziemskie i temperatura powietrza nie zależą od
wysokości. Dane: g=9.81m/s
2
, t
p
=10
0
C, ciśnienie p
0
=1000hPa.
10.6.**
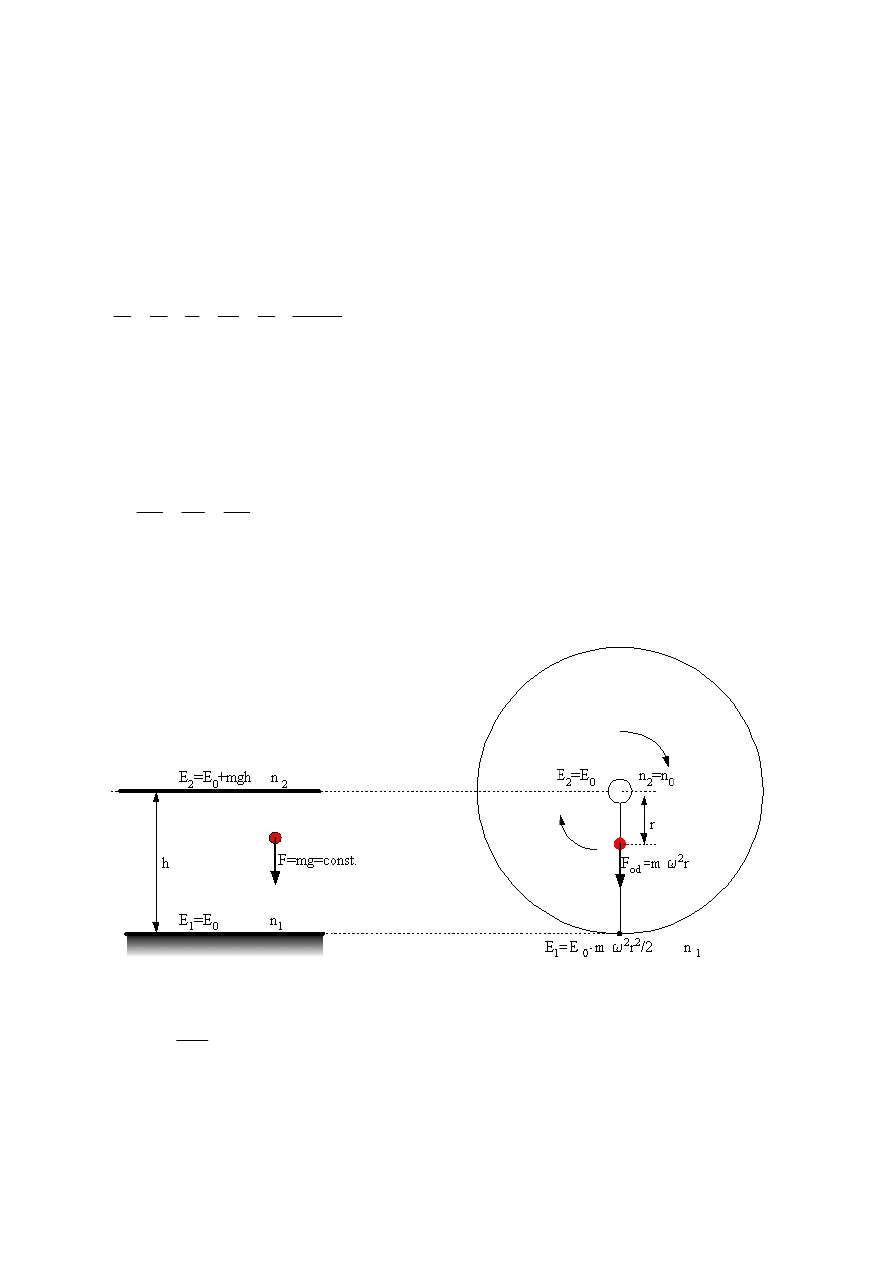
W wirówce o promieniu R=1m obracającej się z prędkością obrotową ω=3000obr/min.
znajdują się pary fluorku uranu UF
3
.Określ jak zmienia się koncentracja tego gazu w
zależności od odległości od osi obrotu. Porównaj koncentracje w przypadku gdy mamy do
czynienia z mieszaniną
235
UF
3
i
238
UF
3
. Założenia:
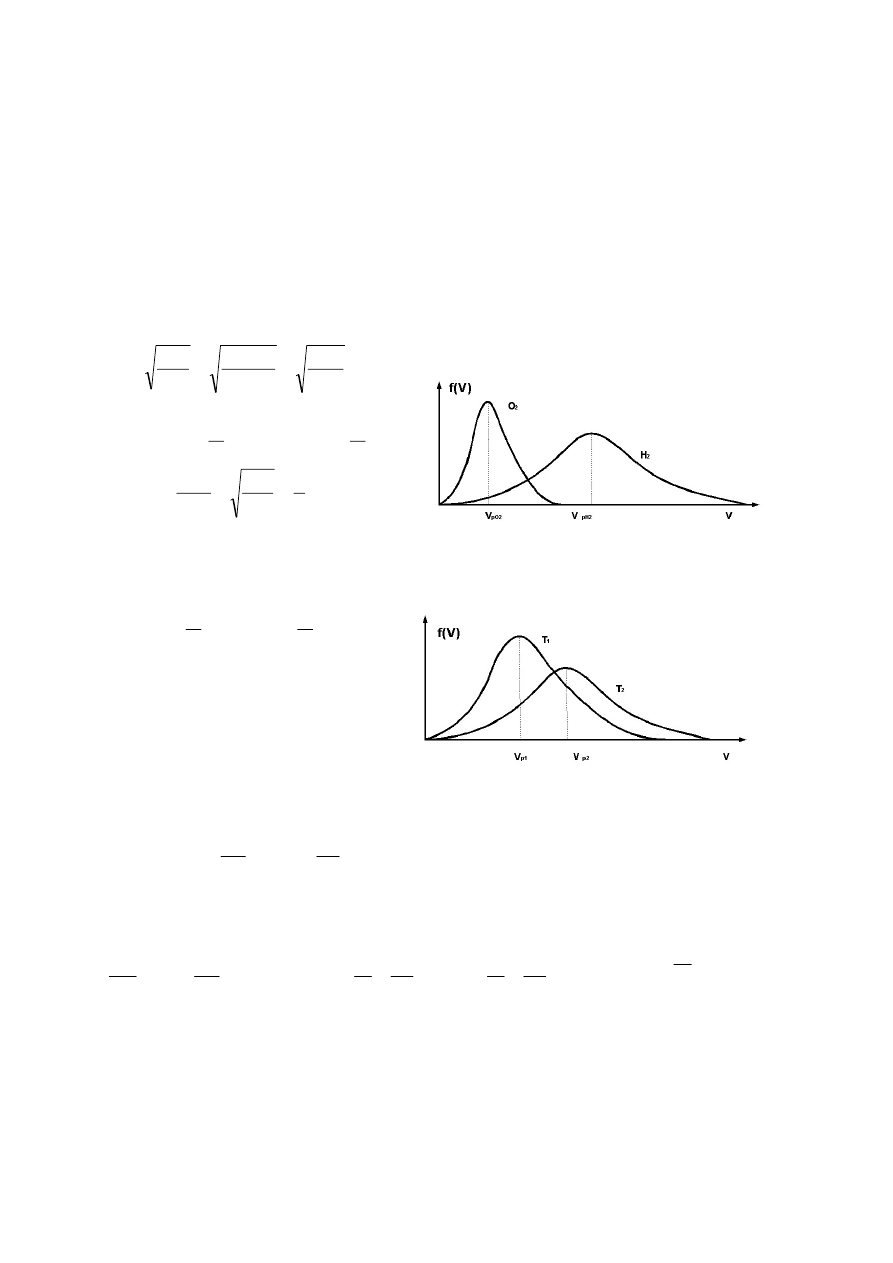
1/ wlot gazu o temperaturze T=400K i ciśnieniu normalnym jest na osi wirówki,
2/ iloraz koncentracji wynosi: η
0
= n
235
/n
238
=0.007 oraz µ
235
=292g/mol, µ
238
=295g/mol,
3/ wirówka jest obracającym się wokół pionowej osi cienkim walcem (wpływ siły ciężkości
można zaniedbać).
10.Rozwiązania:
10.1.R
.
Problem sprowadza się do znalezienia maksimum funkcji f(V) czyli przyrównaniu jej
pochodnej do zera. Taka procedura prowadzi do wyniku:
µ
µ
RT
kT
N
m
kT
V
A
p
2
2
2
=
=
=
.
Dla gazów z zadania:
.
4
1
1579
73
,
394
2
2
2
2
2
2
=
=
=
=
O
H
pH
pO
pH
pO
V
V
oraz
s
m
V
i
s
m
V
µ
µ
10.2.R
.
.
730
422
2
1
s
m
V
s
m
V
pT
pT
=
=
10.3.R.
Przy takich założeniach można zastosować tzw. wzór barometryczny (patrz 10.4.R):
,
)
(
0
0
RT
gh
kT
mgh
e
p
e
p
h
p
µ
−
−
=
=
gdzie: p(h) jest ciśnieniem gazu o temperaturze T na
wysokości h względem poziomu odniesienia na którym panuje ciśnienie p
0
, m- masa
molekuły gazu, µ-masa molowa gazu.
Związek między ciśnieniem i koncentracją η jest następujący:
RT
gh
A
e
czyli
kT
p
V
N
i
kT
p
V
N
Nk
R
N
N
nR
T
pV
µ
η
η
η
η
−
=
=
=
=
=
⇒
=
=
=
0
0
0
.
Dla powietrza możemy przyjąć:
µ
=28,8g, p
0
=1000 hPa.
Wyniki obliczeń:
a/ p(0)=p
0
=1000 hPa, η
0
=2,6 ·10
25
m
-3
,
b/ p(2499m)=0,74p
0
, η(2499m)=0,74η
0
,
c/ p(4807m)=0,55p
0
, η(4807m)=0,55 η
0
,
d/ p(8850m)=0,33p
0
, η(8846m)=0,33 η
0
.
Jak widać z powyższych wyników taternicy na Rysach odczuwają lekki brak powietrza,
alpiniści na Mount Blanc (4807m) muszą głębiej oddychać a himalaiści na Mount Evereście
(8850m) mają bardzo duże problemy z oddychaniem.
10.4.R.
Ciśnienie na Mount Evereście w podanych warunkach wynosi p
x
=0,33p
0
(patrz zadanie 10.3)
więc woda w tym miejscu będzie wrzała w temperaturze
C
K
T
czyli
A
T
p
p
A
T
T
x
x
x
0
0
0
0
72
345
33
.
0
ln
1
ln
1
1
1
=
=
−
=
−
=
.
Wniosek: porównując temperatury krzepnięcia białka i temperaturę wrzenia wody można
sądzić, że na Mont Evereście prawdopodobnie można ugotować jajko na miękko. Ponieważ
przyjęliśmy w naszych obliczeniach parę założeń a temperatury niewiele się różnią więc nie
można wykluczyć, że w pewnych warunkach uda się przygotować jajko na twardo.
10.5.R.
km
g
RT
p
p
g
RT
h
h
77
,
5
2
ln
ln
0
=
=
=
µ
µ
.
10.6.R.
Można znaleźć związek między równaniem Boltzmanna, wzorem barometrycznym i
rozkładem koncentracji gazu w wirówce.
W ogólnym przypadku równanie Boltzmanna jest następujące:
kT
E
E
e
n
n
1
2
1
2
−
−
=
gdzie n
1
i n
2
koncentracje cząstek o energii E
1
i E
2
w temperaturze T.
Także w przypadku gdy cząstkami są cząsteczki powietrza ich koncentracja zależy od ich
całkowitej energii. Na wysokości h cząstki mają energię wyższą o wielkość mgh co wynika ze
stałości siły ciężkości mg. Biorąc to pod uwagę otrzymujemy wzór barometryczny:
kT
mgh
kT
E
mgh
E
kT
E
E
e
n
e
n
e
n
n
−
−
+
−
−
−
=
=
=
1
1
1
2
0
0
1
2
.
W wirówce obracającej się wokół pionowej osi na stałej wysokości koncentracja cząstek gazu
znajdującego się w bębnie zależy od prędkości obrotowej ω i od odległości od osi obrotu r.
Wynika to z działania siły odśrodkowej F
od
=mω
2
r . Porównując energię potencjalną w polu
siły odśrodkowej cząstek blisko osi E
0
z cząstkami znajdującymi się w odległości r E
r
od osi
stwierdzimy, że :
.
2
)
0
(
)
(
2
2
0
2
0
od
r
r
F
F
gdzie
r
m
dr
r
m
dr
F
E
r
E
−
=
−
=
−
=
=
−
∫
∫
ω
ω
Dlatego podstawiając do równania Boltzmanna
E
1
=E
0
- mω
2
r
2
/2 oraz E
2
= E
0
,
otrzymamy zależność koncentracji cząstek gazu w funkcji odległości od osi obrotu:
.
2
0
2
)
2
/
(
1
0
2
2
2
2
2
2
2
0
0
1
2
kT
r
m
r
kT
r
m
r
kT
r
m
E
E
r
kT
E
E
e
n
n
czyli
e
n
e
n
e
n
n
n
ω
ω
ω
=
=
=
=
=
−
−
−
−
−
−
Przy ścianie bocznej wirówki (r=R
w
) koncentracja drobin
238
UF
3
jest
=
=
=
RT
R
kT
R
m
Rw
w
w
e
e
n
n
2
2
0
2
2
2
2
µω
ω
1,11 razy większa od koncentracji przy osi.
Porównując koncentracje różnych izotopów uranu w tej wirówce mamy:
RT
R
R
R
R
RT
R
R
RT
R
R
w
w
w
e
n
n
czyli
e
n
n
oraz
e
n
n
2
)
(
0
238
235
2
238
0
238
2
235
0
235
2
2
238
235
2
2
238
2
2
235
ω
µ
µ
ω
µ
ω
µ
η
η
−
−
−
=
=
=
=
.
997
,
0
0
⋅
=
η
η
R
Powyższy wynik mówi, że stosunek koncentracji izotopów ulega zmianie w wirówce. Mimo,
że zmiana jest stosunkowo niewielka to układ kaskadowo połączonych wirówek może służyć
do rozdzielenia gazów, których masy niewiele się różnią.
Wyszukiwarka
Podobne podstrony:
17 kinetyczna teoria gazów i termodynamika II
Sprawozdania, KINETYCZNA TEORIA GAZÓW, KINETYCZNA TEORIA GAZÓW
Kinetyczna teoria gazów i termodynamika I
16 kinetyczna teoria gazów i termodynamika I
Kinetyczna teoria gazów 2
Kinetyczna teoria gazów i termodynamika II
zestaw 13 kinetyczna teoria gazów, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
Kinetyczna teoria gazów
17 kinetyczna teoria gazów
17 kinetyczna teoria gazów i termodynamika II
17 kinetyczna teoria gazów
16 Kinetyczna teoria gazów i termodynamika I
17 Kinetyczna teoria gazów i termodynamika II
więcej podobnych podstron