
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
Projekt „Przygotowanie i realizacja kierunku inżynieria biomedyczna – studia międzywydziałowe”
współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
SKRYPT DO LABORATORIUM
CHEMIA
ĆWICZENIE L8: Kataliza w syntezie związków
organicznych
autor:
dr hab. inż. Anna Skwierawska
Gdaosk, 2010

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
2
CHEMIA, Anna Skwierawska
1. Wymagania wstępne
Znajomośd podstawowych pojęd z zakresu katalizy ze szczególnym uwzględnieniem katalizatorów
heterogenicznych, homogenicznych oraz katalizatorów przeniesienia międzyfazowego i katalizy
enzymatycznej. Budowa katalizatorów heterogenicznych. Katalizatory przemysłowe. Umiejętnośd
zapisu reakcji katalitycznych (diagram energetyczny).
Cele dwiczenia:
Zapoznanie studentów z katalizatorami stosowanymi w laboratorium i w przemyśle.
Spodziewane efekty kształcenia - umiejętności i kompetencje:
Umiejętnośd wyciągania wniosków z porównania reakcji prowadzonych bez katalizatora i z
katalizatorem. Określanie cech katalizatorów homogenicznych i heterogenicznych. Zapamiętanie
przykładów katalizatorów używanych w przemyśle.
Metody dydaktyczne:
Praktyczna realizacja zadao teoretycznie opisanych w instrukcji.
Zasady oceniania/warunek zaliczenia dwiczenia
Warunkiem zaliczenia dwiczenia jest poprawnośd i dokładnośd wykonania dwiczenia oraz właściwa
interpretacja wyników.
Wykaz literatury podstawowej do dwiczenia:
1. B. Grzybowska-Świerkosz „Elementy katalizy heterogenicznej”, PWN, 1993
2. F. Pruchnik „Kataliza homogeniczna”, PWN, 1993
3. P.W. Atkins „Chemia fizyczna”, , PWN, 2001
2. Przebieg dwiczenia
L.p. Zadanie
1.
Wprowadzenie prowadzącego, informacja o warunkach bezpieczeostwa, przydzielenie
określonych zadao podgrupom studentów
2.
Realizacja zadao zgodnie z instrukcją do dwiczenia i podanymi uszczegółowieniami
3.
Sprawdzenie uzyskanych wyników i dyskusja
UWAGI!
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
3
CHEMIA, Anna Skwierawska
3. Wprowadzenie do dwiczenia
Częśd teoretyczna
Termin kataliza został wprowadzony przez Berzeliusa w 1836. Słowo kataliza (grec.) w tłumaczeniu
dosłownym oznacza rozprężenie lub rozłożenie.
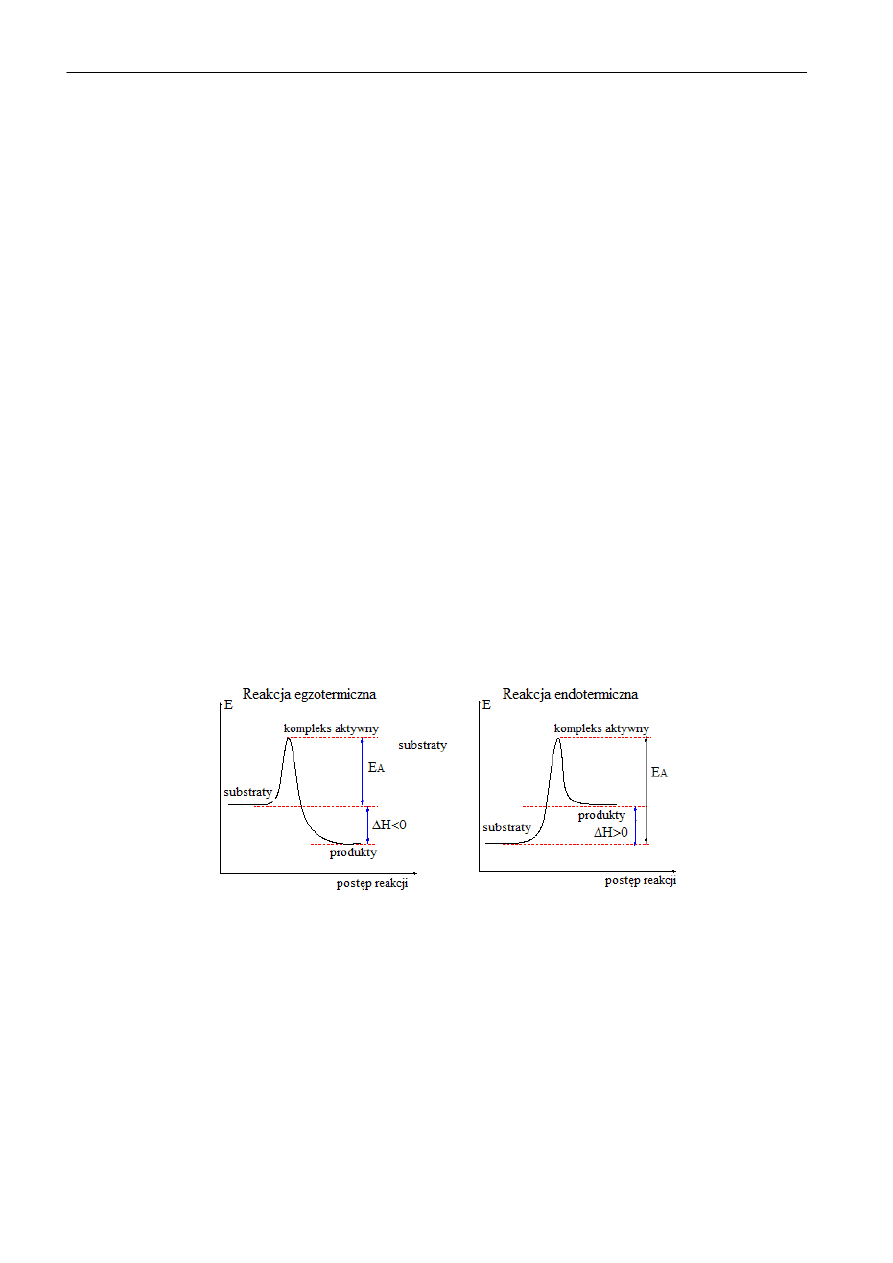
Energia aktywacji
Zgodnie z teorią stanu przejściowego (kompleksu aktywnego) substraty przed przejściem w produkty
tworzą kompleks aktywny, w którym nastąpiły już częściowe przegrupowania, zmiana energii
poszczególnych wiązao oraz powstanie zalążków nowych. Kompleks aktywny charakteryzuje się
wyższą energia wewnętrzna niż suma substratów czy suma produktów. Zatem substraty, zanim
osiągną stan produktów muszą uzyskad energię wewnętrzną odpowiadającą kompleksowi
aktywnemu, bez względu na to czy po zakooczeniu reakcji energia produktów będzie wyższa (reakcja
endotermiczna) czy niższa (reakcja egzotermiczna) od substratów. Reakcję zachodzącą pomiędzy
dwoma substratami A i B możemy zapisad:
A + B → *AB+ * → AB
A i B - substraty
[AB] * - kompleks aktywny
AB - produkt
Rys. 1. Diagram energetyczny reakcji chemicznej
Dla reakcji zachodzącej pomiędzy dwoma substratami "bariera energetyczna" na drodze od substratu
do produktu jest najczęściej głównym wyznacznikiem szybkości reakcji, całkowicie ją niekiedy
uniemożliwiając. Aby ułatwid pokonanie bariery energetycznej związanej z energia aktywacji możemy
albo dostarczyd do środowiska reakcji więcej energii (np. ogrzewanie) albo zastosowad substancję,
która łatwo reaguje z substratem (mała energia aktywacji) a powstały związek łatwo przechodzi w
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
4
CHEMIA, Anna Skwierawska
produkt koocowy (także niska energia aktywacji). Substancję, która w ten sposób ułatwia przejście od
substratów do produktów nazywamy katalizatorem.
Katalizatorem danej reakcji nazywamy substancję, która wprowadzona do układu reagującego
zwiększa szybkośd tej reakcji a sama nie ulega przemianom chemicznym w ostatecznym wyniku
reakcji.
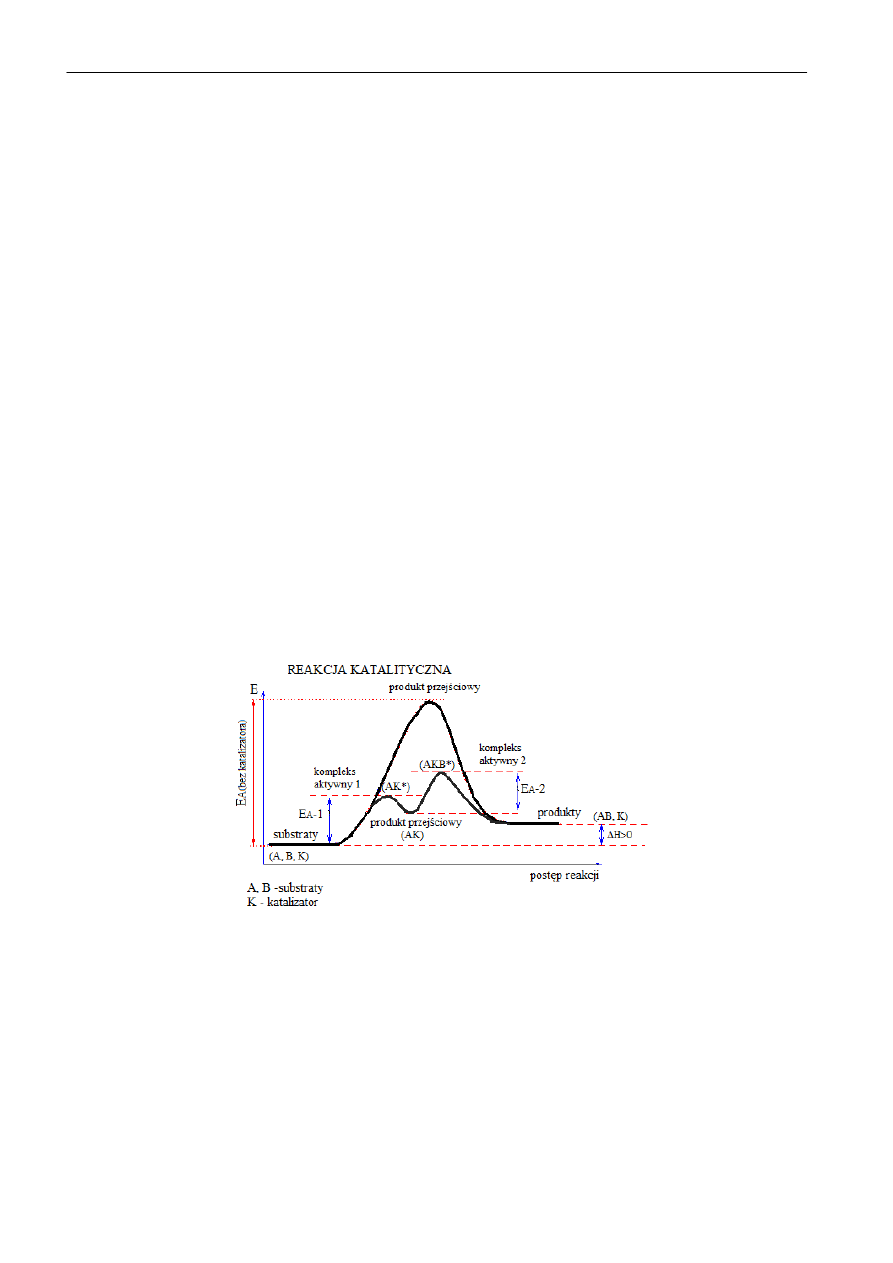
Kataliza
Działanie katalizatora polega na "zamianie" jednej dużej energii aktywacji (bez katalizatora) na dwie,
lub więcej, mniejszych energii aktywacji. Innymi słowy droga od substratów do produktów zostaje
zamieniona na ciąg reakcji elementarnych z udziałem katalizatora, o niskich energiach aktywacji
poszczególnych etapów (rys. 2.). Cały proces przebiegający przez produkty pośrednie, angażujące
katalizator, kooczy się produktem pożądanym i odtworzeniem katalizatora, tak, że w efekcie całego
procesu katalizator nie zużywa się. Rozważając reakcję pomiędzy substratami A i B wobec katalizatora
można zapisad:
A + K → *AK+* → AK
AK + B → *AKB+* → AB + K
Rys. 2 Wpływ katalizatora na energię aktywacji
Czasami, gdy reakcja biegnie zbyt burzliwie, stosuje się "ujemne" katalizatory, inhibitory, które maja za
zadanie zwolnid przebieg gwałtownej reakcji, aby łatwiej było sterowad jej przebiegiem.
Można wyróżnid trzy główne typy katalizy:
1.
Homogeniczna, gdy reagenty i katalizator znajdują się w tej samej fazie skupienia.
2.
Heterogeniczna, gdy reagenty i katalizator są w różnych fazach skupienia.
3.
Enzymatyczna, gdy funkcje katalizatora pełnią enzymy.

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
5
CHEMIA, Anna Skwierawska
Enzymy są to duże złożone cząstki organiczne, które nie są układem homogenicznym ani
heterogenicznym, lecz czymś pośrednim. Enzymy ze względu na budowę chemiczną należą do białek
prostych lub złożonych. Enzymy będące białkami złożonymi są zbudowane z grupy czynnej (tzw.
prostetycznej) zwanej koenzymem i białka prostego, zwanego apoenzymem, które łącznie tworzą
holoenzym. Składnik białkowy nie zawsze ma znaną budowę, ale koenzymy najczęściej są zbudowane
z nukleotydów pirydynowych i flawinowych (flawoproteiny), witamin lub grup hemowych.
Można również dokonad bardziej szczegółowego podziału ze względu na rodzaj katalizatora na
przykład: katalizatory kształtoselektywne, katalizatory asymetryczne, fotokatalizatory czy katalizatory
przeniesienia międzyfazowego.
Kataliza heterogeniczna
Jeśli katalizator stanowi odrębną fazę w układzie reagującym to katalizowana reakcja przebiega na
granicy faz i wówczas mamy do czynienia z katalizą niejednorodną (heterogeniczną, wielofazową).
Najczęściej katalizator jest wtedy ciałem stałym, reakcja zaś przebiega pomiędzy substancjami
gazowymi lub ciekłymi. Przykłady reakcji przedstawiono w tabeli.
Substraty
Stan skupienia
substratów
Katalizator
Stan skupienia
katalizatora
Produkt
Buten, tlen
Etylen, tlen
Benzen, wodór
Olej
roślinny,
wodór
Gazy
Gazy
Ciecz, gaz
Ciecz, gaz
Wanad
Srebro
Pallad
Nikiel
Ciało stałe
Ciało stałe
Ciało stałe
Ciało stałe
Bezwodnik
maleinowy
Tlenek etylenu
Cykloheksan
Stałe tłuszcze
Omawiając katalizatory należy wspomnied o takich pojęciach jak:
1.
aktywnośd
2.
selektywnośd
3.
centra aktywne
4.
promotory
5.
trucizny katalizatorów
Aktywnośd katalizatora A
k
określa się, jako różnicę między szybkościami reakcji chemicznej
zachodzącej w obecności katalizatora, v
k
, i bez niego, v
h
:
A
k
= v
k
- v
h

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
6
CHEMIA, Anna Skwierawska
Szybkośd reakcji bez katalizatora jest na ogół znikomo mała w porównaniu z reakcją katalizowaną,
dlatego często w obliczeniach można ją pominąd. Aktywnośd katalizatora ma sens tylko w odniesieniu
do układu katalizator-reagenty stosowanych w danej reakcji np: aktywnośd katalizatora tlenku
wanadu w reakcji utlenienia benzenu do bezwodnika maleinowego, lub aktywnośd katalizatora
niklowego w reakcji uwodornienia kwasów tłuszczowych.
Im bardziej katalizator przyspiesza określoną reakcję danego substratu tym jest on bardziej
selektywny. Selektywny katalizator przyspieszając przebieg reakcji tylko w jednym kierunku pozwala
otrzymad produkt o dużej czystości, przy małym zużyciu surowców.
Selektywnośd katalizatora Si definiuje się, jako stosunek ilości cpi jednego z kilku możliwych
produktów (Pi) reakcji do całkowitej ilości produktów Scpi:
X ==> P1 + P2 + P3 + ...+Pi
W praktyce selektywnośd katalizatora wynosi 70-90%. Jedynie enzymy zapewniają 100%
selektywnośd.
Zdecydowana większośd najważniejszych procesów prowadzona jest w obecności katalizatorów
stałych tzw. kontaktów, głównie ze względu na łatwośd oddzielenia katalizatora od mieszaniny
reakcyjnej. W procesie katalizy heterogenicznej można wyróżnid następujące etapy:
1.
dyfuzja reagujących cząsteczek z wnętrza np. fazy gazowej do powierzchni zewnętrznej
katalizatora;
2.
dyfuzja reagentów w porach ziaren katalizatora do jego powierzchni wewnętrznej;
3.
adsorpcja reagentów na powierzchni katalizatora;
4.
reakcja chemiczna na powierzchni katalizatora;
5.
desorpcja produktów reakcji z powierzchni katalizatora;
6.
dyfuzja produktów w porach ziaren katalizatora;
7.
dyfuzja produktów reakcji od powierzchni katalizatora do strumienia gazu.
Szybkośd ogólna heterogenicznego procesu katalitycznego określana jest względnymi szybkościami
poszczególnych stadiów i jest ograniczona poprzez stadium najwolniejsze.
Katalizatory heterogeniczne stanowią jedno- lub wielofazowe układy ciał stałych o zróżnicowanym
składzie chemicznym. Formowane są w postaci nieregularnych lub o określonych kształtach ziaren i ze
względu na możliwośd zapewnienia jak największego kontaktu z reagentami preparuje się je by miały
one jak największą powierzchnię właściwą. Otrzymuje się to poprzez wytworzenie porowatej

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
7
CHEMIA, Anna Skwierawska
struktury ziarna. Jako, że powierzchnia ścian porów jest nawet kilkaset razy większa od powierzchni
zewnętrznej ziaren, reakcja biegnie przede wszystkim wewnątrz ziaren katalizatora.
Do katalizatora w trakcie wytwarzania dodaje się różne substancje zwane promotorami. Promotory
mają na celu zwiększenia selektywności i aktywności kontaktu. Często aktywny składnik katalizatora
osadza się na składniku nieaktywnym, aby zwiększyd powierzchnię kontaktu lub ułatwid
odprowadzenie ciepła wytworzonego w czasie reakcji. Taki nieaktywny składnik nazywa się
nośnikiem.
Podczas katalizy heterogenicznej reakcja przyśpieszana jest poprzez tworzenie na powierzchni
katalizatora przejściowego kompleksu aktywnego z reagentami. Fragmenty katalizatora wykazujące
aktywnośd katalityczną noszą nazwę centrów aktywnych. Niektóre związki chemiczne tworzą trwałe
połączenia z centrami aktywnymi katalizatora, są to tak zwane trucizny katalizatora. W takim
przypadku aktywnośd katalizatora ulega obniżeniu. W przypadku katalizatorów metalicznych
szczególnie reaktywnymi truciznami są związki siarki np. siarkowodór. Zatrucie może byd odwracalne i
nieodwracalne. Oprócz zatrucia aktywnośd katalizatorów może maled z powodu zmniejszenia
powierzchni właściwej lub odkładaniem się substancji na powierzchni katalizatora.
Kataliza homogeniczna
Katalizator może stanowid jeden ze składników jednorodnej fazy (gazowej lub ciekłej), w której
zachodzi reakcja - mówimy wówczas o katalizie homogenicznej, jednorodnej, jednofazowej.
Niewątpliwą zaletą stosowania katalizatorów homogenicznych jest prowadzenie reakcji w układzie
jednorodnym. Reakcja przebiega w całej masie a więc bardziej efektywnie niż w przypadku
katalizatorów heterogenicznych, gdzie proces realizowany jest na granicy faz. Przykładami
katalizatorów homogenicznych są: karbonylki metali, chlorek glinu, niektóre tlenki, zasady i kwasy.
Wadą reakcji prowadzonych wobec homogenicznych katalizatorów jest ich selektywna izolacja z
mieszaniny poreakcyjnej.
Przykłady katalizatorów
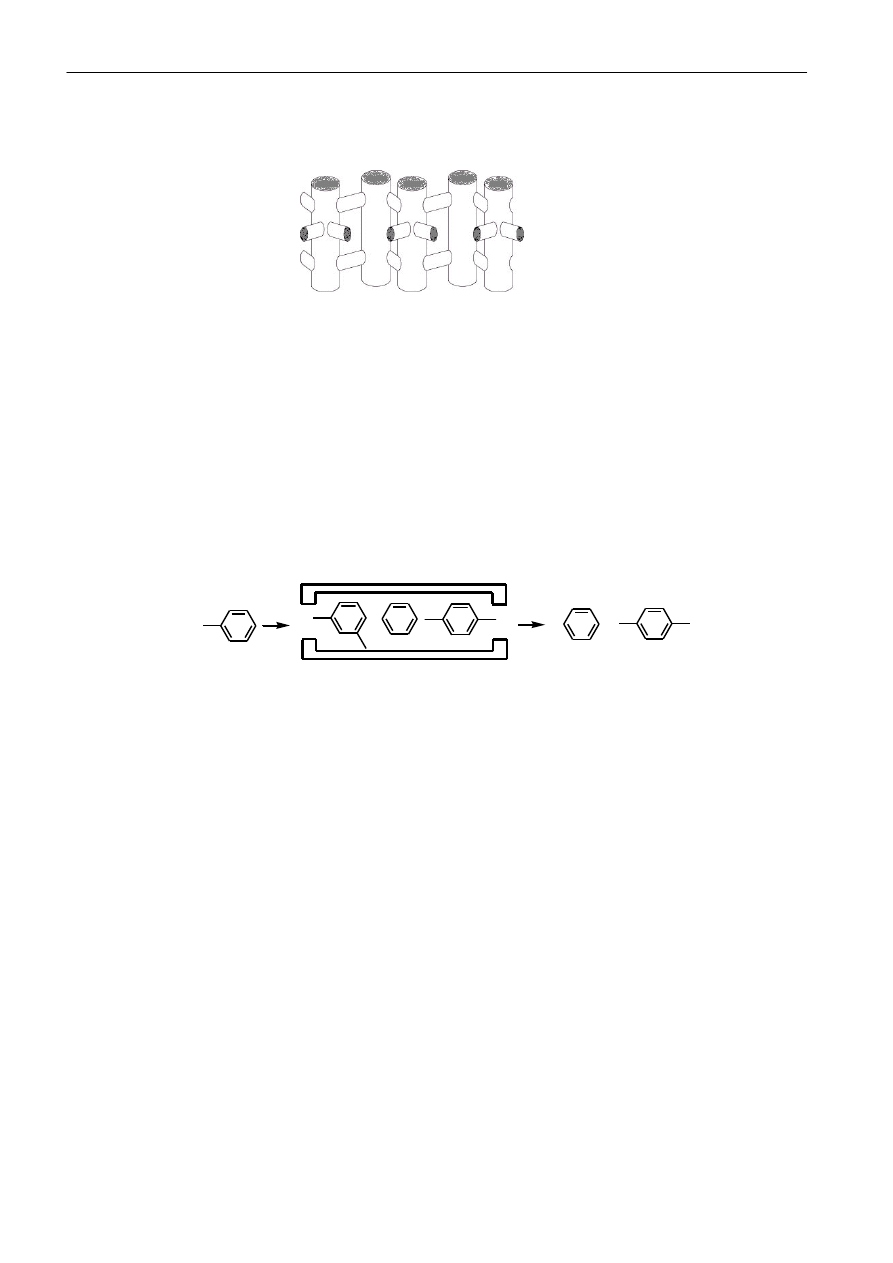
Katalizatory kształtoselektywne są związkami, których rozmiar wnęk wewnętrznych determinuje
powstawanie danego produktu. Do tej grupy katalizatorów należą zeolit ZSM-5, którego budowę
przedstawiono na rysunku 3. Katalizator ten charakteryzuje się dużą powierzchnia właściwą. Reakcje
zachodzą we wnętrzu kanalików.
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
8
CHEMIA, Anna Skwierawska
+
Rys. 3. Budowa przestrzenna katalizatora ZSM-5
Na kolejnym rysunku (rys. 4) przedstawiono jeden z procesów realizowanych przy udziale katalizatora
ZSM-5. Substratem reakcji jest toluen, natomiast produktem jest mieszanina benzenu i 1, 4-
dimetylobenzenu. W reakcji w stopniu zasadniczym ograniczone jest powstawanie 1,2-
dimetylobenzenu i 1,3-dimetylobenzenu. Natomiast, jeśli powstaną to ze względu na przestrzenną
budowę pozostają we wnętrzu katalizatora.
Rys. 4. Reakcja otrzymywania benzenu i 1, 4-dimetylobenzenu z toluenu z wykorzystaniem
katalizatora kształtoselektywnego ZSM-5
Katalizatory asymetryczne – są to na ogół kompleksy metali, posiadające ligandy o określonej
konfiguracji absolutnej. Enancjomery są to związki będące swoimi lustrzanymi odbiciami, tak jak
dłonie, czy stopy. Katalizator asymetryczny zdolny jest jedynie do oddziaływania z jednym typem
enancjomeru, gdyż tylko wówczas następuje idealne dopasowanie, tak jak podczas powitania, gdy
każda z osób używa prawej ręki. W przypadku drugiego enancjomeru brak jest dopasowania, tak
samo, gdy podamy rękę prawą osobie leworęcznej. Ten typ katalizatorów jest niezwykle cenny w
przypadku produkcji leków i środków zapachowych.
Fotokatalizatory – są to związki zdolne do adsorbowania kwantu energii, która następnie
wykorzystywana jest w reakcji. Przykładem tego typu katalizatora jest tlenek tytanu(IV).
Fotokatalityczne właściwości tlenku tytanu wykorzystywane są między innymi w ochronie środowiska
podczas fotochemicznego rozkładu związków organicznych w ściekach.
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
9
CHEMIA, Anna Skwierawska
KMnO
4
CH
2
Cl
2
CH
2
Cl
2
O
O
O
O
O
O
+
H
2
O
H
2
O
O
O
O
O
O
O
K
+
MnO
4
-
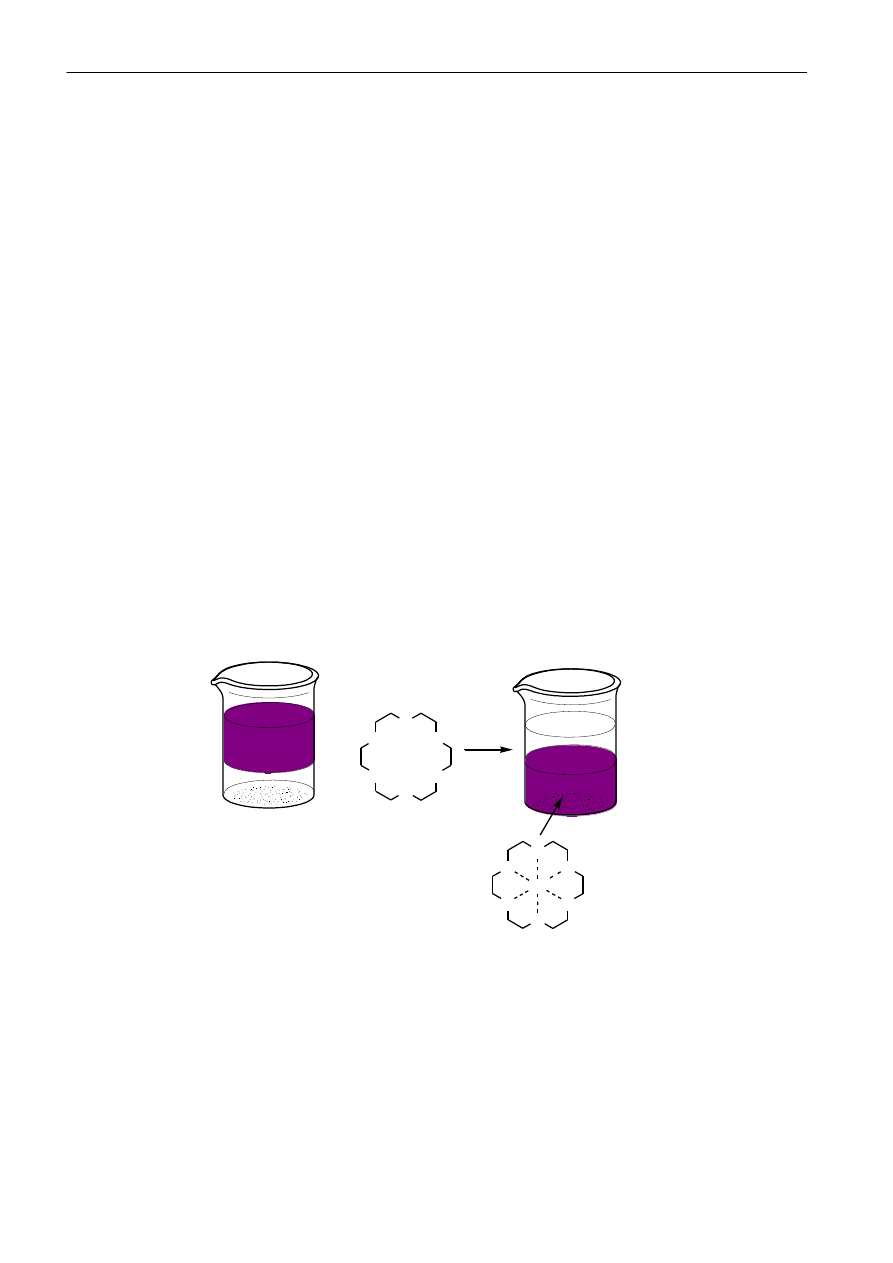
Kataliza przeniesienia międzyfazowego (PTC, ang. Phase Transfer Catalysis) - technika ta polega na
prowadzeniu reakcji w układzie dwufazowym: ciecz-ciecz, lub ciało stałe-ciecz, w której odpowiednie
katalizatory poprzez tworzenie lipofilowej pary jonowej zapewniają transport jednego z reagentów z
fazy wodnej lub stałej do fazy organicznej. Reakcje chemiczne zachodzące pomiędzy reagentami
znajdującymi się w dwóch niemieszających się fazach są często hamowane z powodu braku kontaktu.
Zasada działania PTC polega na ciągłym generowaniu par jonowych składających się z reagującego
anionu organicznego lub nieorganicznego oraz lipofilowego kationu, takiego jak amoniowy,
fosfoniowy lub kationu metalu alkalicznego skompleksowanego eterem koronowym.
Rysunek 5 ilustruje zasadę działania PTC na przykładzie 18-korony-6. W zlewce po lewej stronie
znajdują się dwie wzajemnie niemieszające się ciecze: woda z rozpuszczonym nadmanganianem(VII)
potasu (KMnO
4
) -warstwa górna o fioletowej barwie; oraz dolna warstwa chlorku metylenu(CH
2
Cl
2
).
Nadmanganian potasu jest nie rozpuszczalny w chlorku metylenu. Następnie do zlewki dodano 18-
korony-6, całośd wymieszano. 18-Korona-6 jest związkiem, który wybiórczo oddziałuje z kationami
potasu tworząc bardzo trwały kompleks, który jest rozpuszczalny w chlorku metylenu. W ten sposób
18-korony-6 umożliwia prowadzenie reakcji chemicznych w rozpuszczalnikach niepolarnych. Na
przykład można utleniad alkeny przy pomocy nadmanganianu(VII) potasu w środowisku benzenu czy
chlorku metylenu.
Rys 5. Zasada działania katalizatora przeniesienia międzyfazowego.
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
10
CHEMIA, Anna Skwierawska
OH
CH
3
Ćwiczenia
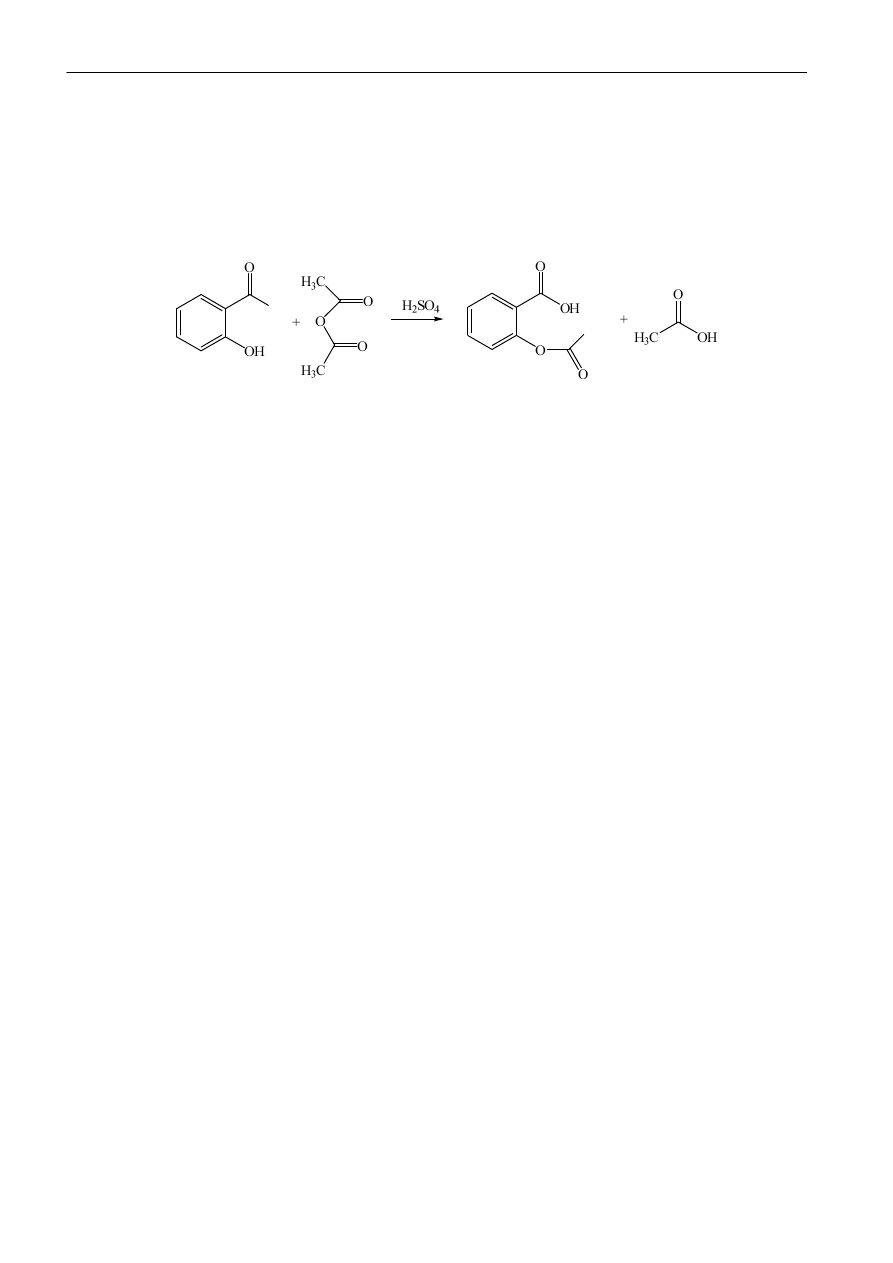
Zadanie 1 - otrzymywanie kwasu acetylosalicylowego
Aparatura i odczynniki
Kolba okrągłodenna 50 mL, lejek Buchnera, kolba ssawkowa, mieszadło magnetyczne, chłodnica,
szpatułka, kapilary, komora chromatograficzna, fiolki, sączki
Kwas salicylowy, bezwodnik octowy, kwas siarkowy(VI) stężony, woda destylowana
Wykonanie dwiczenia
1.
Naważyd 2,5 g kwasu salicylowego i ilościowo przenieśd do kolby stożkowej o pojemności 50
mL. Następnie dodad 3,7 mL bezwodnika octowego i 0,5 mL stężonego kwasu siarkowego(VI).
Kolbę umieścid w łaźni olejowej i ogrzewad w temperaturze 60 °C intensywnie mieszając, aż do
pojawienia się kryształów produktu. Reakcja zachodzi bardzo szybko, na ogół w ciągu kilku
minut. Kolbę wyjąd z łaźni olejowej i pozostawid do ochłodzenia w łaźni lodowej. Następnie
dodad 40 mL wody destylowanej dobrze mieszając. Odsączyd wydzielony kwas
acetylosalicylowy na lejku Büchnera.
2.
W analogiczny sposób wykonad dwiczenie, ale bez dodatku kwasu siarkowego(VI).
Analiza produktów reakcji: Za pomocą szpatułki przenieśd niewielką ilośd kwasu salicylowego i
krystalicznych produktów reakcji do fiolek. Dodad około 1 mL metanolu. Następnie wykonad
chromatografię cienkowarstwową w układzie 10:1 (chloroform:metanol). Obejrzed płytki
chromatograficzne pod lampą UV (λ =256 nm). Na podstawie chromatografii określid wpływ
katalizatora kwasu siarkowego(VI).

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
11
CHEMIA, Anna Skwierawska
S
N
Me
2
N
N
+
Me
2
Cl
-
S
N
Me
2
N
N
+
Me
2
Cl
-
Zadanie 2 – Zasada działania katalizatora przeniesienia międzyfazowego
Aparatura i odczynniki
Błękit metylenowy, woda destylowana, chlorek metylenu, dodecylosulfonian sodu
Szpatułka, rozdzielacz, bagietka, cylindry miarowe
Wykonanie dwiczenia
Do rozdzielacza wlad 50 mL wody destylowanej, a następnie wsypad niewielka ilośd błękitu
metylenowego. Mieszad do rozpuszczenia. Dodad 50 mL chlorku metylenu. Całośd wytrząsad.
Poczekad na rozdzielenie faz i dodad kilka kropli dodecylosulfonianu sodu. Ponownie zawartośd
rozdzielacza wytrząsnąd. Poczekad na rozdzielenie faz. W oparciu o poczynione obserwacje opisad
przebieg reakcji. Narysowad strukturę powstających produktów.
Wyszukiwarka
Podobne podstrony:
IB P 1 CHEM LAB CW8 Kataliza
IB P 1 CHEM LAB CW10 Rozdzielanie substancji
IB P 1 CHEM LAB CW7 Kinetyka
IB P 1 CHEM LAB CW9 Ekstrakcja
IB P 1 CHEM LAB CW7 Kinetyka
IB P 1 CHEM LAB CW10 Rozdzielanie substancji
IB P 1 CHEM LAB CW9 Ekstrakcja
Inz chem LAB, sprawozdanie-2831
Fizyka lab.cw8(1), Politechnika Wrocławska - Materiały, fizyka 2, paczka 1, fizyka-lab
lab ćw8, mechanika, BIEM- POMOCE, laborki z fizy
Ćw. 8, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), CW8
sprawkomoje 8 do dokończenia, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), CW8
Ćw. 8moje, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), CW8
IB K 4 BFIZ LAB CW1
Inz chem LAB, sprawozdanie-2831KK
Inz chem LAB, całość-drugie-kolokwium-z-inz-chem1
IB K 4 BFIZ LAB CW1
chem instrukcja spraozdania lab
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron