
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
Projekt „Przygotowanie i realizacja kierunku inżynieria biomedyczna – studia międzywydziałowe”
współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
SKRYPT DO LABORATORIUM
CHEMIA
ĆWICZENIE L7: Kinetyka reakcji chemicznych
autor:
dr hab. inż. Anna Skwierawska
Gdaosk, 2010

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
2
CHEMIA, Anna Skwierawska
1. Wymagania wstępne
Znajomośd takich pojęd jak: rząd reakcji, reakcje pierwszorzędowe, drugorzędowe; reakcje pseudo-
pierwszorzędowe i reakcje zerowego rzędu. Znajomośd podstawowych równao kinetycznych oraz
wpływu parametrów na szybkośd reakcji. Dodatkowo umiejętnośd ważenia, pipetowania,
miareczkowania, obliczania stężenia procentowego i molowego.
Cele dwiczenia:
Zapoznanie studentów z doborem metod do określenia rzędu reakcji i wyznaczania stałych
kinetycznych.
Spodziewane efekty kształcenia - umiejętności i kompetencje:
Umiejętne posługiwanie się szkłem laboratoryjnym, zapoznanie się z obsługą konduktometru.
Dokonywanie dokładnych pomiarów.
Metody dydaktyczne:
Praktyczna realizacja zadao teoretycznie opisanych w instrukcji.
Zasady oceniania/warunek zaliczenia dwiczenia
Warunkiem zaliczenia dwiczenia jest sporządzenie sprawozdania. W sprawozdaniu należy umieścid:
krótki opis wykonanych dwiczeo, otrzymane wyniki w postaci uzupełnionych tabel; sporządzid
wykresy zależności ln λ (1/c) w funkcji czasu (w przypadku gdy punkty pomiarowe nie wyznaczają
równania prostej, należy je wyznaczyd metodą najmniejszych kwadratów); obliczyd wartośd stałych
szybkości reakcji oraz okresy połowicznej przemiany nanosząc punkty doświadczalne oraz wnioski.
Wykaz literatury podstawowej do dwiczenia:
1. Skrypt do wykładu
2. Red. E. Luboch, M. Bocheoska, J.F. Biernat „Chemia ogólna. Dwiczenia laboratoryjne” Wyd. PG
2003 – rozdział 16.
3. A. Molski „Wprowadzenie do kinetyki chemicznej” WNT, 2001
P. W. Atkins „ Chemia Fizyczna” PWN, 2001
2. Przebieg dwiczenia
L.p. Zadanie
1.
Wprowadzenie prowadzącego, informacja o warunkach bezpieczeostwa, przydzielenie
określonych zadao podgrupom studentów
2.
Realizacja zadao zgodnie z instrukcją do dwiczenia i podanymi uszczegółowieniami
3.
Sprawdzenie uzyskanych wyników i dyskusja
UWAGI!

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
3
CHEMIA, Anna Skwierawska
3. Wprowadzenie do dwiczenia
Podstawy teoretyczne
Jedną z najbardziej użytecznych spośród metod fizykochemicznych stosowanych w celu poznania
mechanizmów reakcji, jest pomiar szybkości reakcji.
Szybkośd reakcji, czyli liczba moli substratów, które reagują w jednostce czasu jest proporcjonalna do
iloczynu stężeo substancji reagujących i niezależny od stężeo substancji obecnych, prócz substratów tj.
produkty reakcji i rozpuszczalniki. Zakłada się, że szybkośd reakcji jest proporcjonalna do liczby
zderzeo substratów w jednostce czasu. Częstośd zderzeo jest z kolei proporcjonalna do iloczynu
stężeo. Stężenia substancji reagujących maleją stale podczas reakcji, z tego powodu do opisu używa
się pochodnej –dc/dt. Przez c oznacza się stężenie *mol/l+, wybranej substancji reagującej w czasie t [s,
min, godz.], mierzonym od początku reakcji. Znak minus wskazuje spadek stężenia, substancji
reagujących. Jeśli w reakcji bierze udział tylko jedna substancja, szybkośd reakcja wyrażona jest
równaniem (1):
kc
dt
dc
(1)
Na podstawie danych doświadczalnych można stwierdzid, że parametrami wpływającymi na szybkośd
reakcji chemicznej są: temperatura, stężenie, w przypadku gazów również ciśnienie oraz obecnośd
katalizatorów.
Stała proporcjonalności k nazywa się stałą szybkości. Stała szybkości równa jest jedności, gdy stężenia
wszystkich substancji reagujących są równe jedności. Stała szybkości nie zależy od stężenia i jest
wielkością charakterystyczną dla reakcji w danych warunkach.
Rząd reakcji. Wyróżniamy reakcje I rzędu, II rzędu itd., w zależności od liczby mnożników stężenia,
występujących w równaniu szybkości reakcji. Równanie kinetyczne (1), jest równaniem I rzędu.
Odpowiada ono reakcji jednocząsteczkowej, którą można przedstawid następującym równaniem
chemicznym (2):
S
1
→ P
1
+ P
2
+ … (2)
Stężenie c z równania (1) odnosi się do substratu S
1
, więc można przyjąd c = [S
1
]
Dla reakcji dwucząsteczkowej (3):
S
1
+ S
2
→ P
1
+ P
2
+ … (3)
Równanie kinetyczne II rzędu (4):
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
4
CHEMIA, Anna Skwierawska
t [s, min., godz.]
ln
c
B
A (x
1
, y
1
)
B (x
2
, y
2
)
A
y
x
tg
k
2
1
0
0
2
ln
kt
c
c
k
t
2
ln
2
1
]
][
[
]
[
]
[
2
1
2
1
S
S
k
dt
S
d
dt
S
d
(4)
W reakcjach dwucząsteczkowych tego typu szybkośd zmiany stężenia substratu S
1
jest równa
szybkości zmiany stężenia S
2
, wynika to z zapisu równania (3), według którego 1 mol S
1
reaguje z
jednym molem S
2
. Jeśli w reakcji dwucząsteczkowej stężenia substratów S
1
i S
2
są równe, lub gdy
reagują ze sobą dwie identyczne cząsteczki, wówczas wzór (4) przyjmuje postad:
2
kc
dt
dc
(5)
Przedstawione równania po scałkowaniu można wykorzystad do oznaczania rzędu reakcji i tak dla
reakcji I.
kc
dt
dc
v
,
t
c
c
dt
k
c
dc
0
0
kt
c
c
0
ln
ln
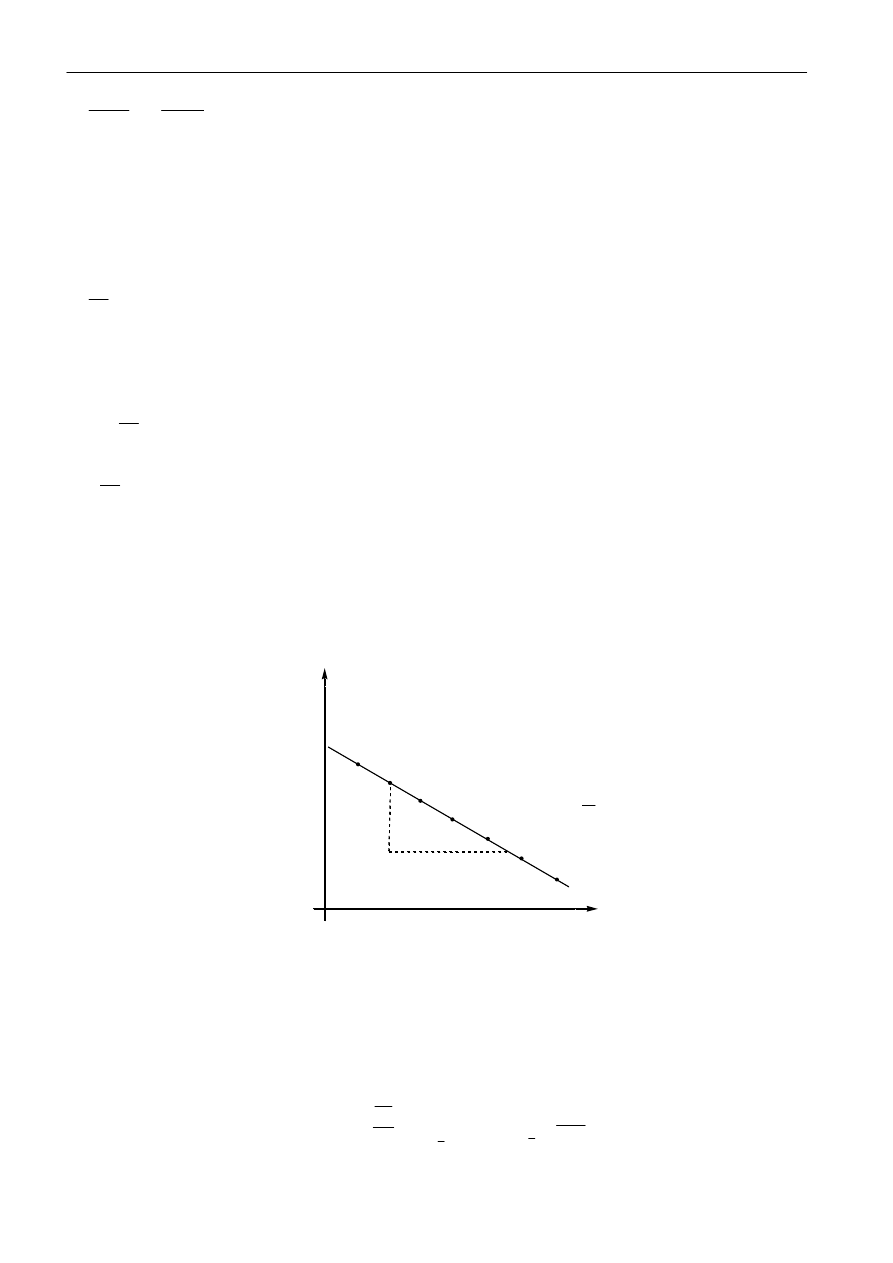
Jeśli analizowana reakcja jest reakcją pierwszorzędową, to wykreślając wykres, lnc, jako funkcja czasu
otrzymuje się linię prostą. Nachylenie tej prostej równe jest wartości liczbowej stałej szybkości reakcji
k.
Znając stałą k, można wyliczyd inny bardzo ważny parametr kinetyczny, jakim jest okres połowicznej
przemiany. Okres połowicznej przemiany (okres półtrwania) - to czas, w którym stężenie substratu
zmniejsza się o połowę. Tak, więc podstawiając

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
5
CHEMIA, Anna Skwierawska
0
2
1
c
c
k
t
2
ln
2
1
t
c
c
dt
k
c
dc
0
2
0
Znajomośd kinetyki reakcji oraz wynikającego stąd okresu połowicznej przemiany jest niezwykle
ważna w medycynie, gdzie w oparciu o farmakokinetykę bada się właściwości terapeutyczne danych
leków jak również rozkład trucizn, związków radioaktywnych.
Przykład:
Obliczenie okresu półtrwania dla eliminacji metylku rtęci z organizmu człowieka. Na podstawie
oznaczenia poziomu metylu rtęci u osób uratowanych z zatrucia fungicydem stwierdzono, że średni
czas wydalania wynosi 1,75% całkowitej dawki w czasie jednego dnia. Przeprowadzone badania
wskazują, że rozkład metylku ołowiu jest reakcją I rzędu. Jaka jest wartośd czasu półtrwania
wyznaczona przez tą obserwację?
Rozwiązanie:
kt
c
c
0
ln
ln
gdzie:
c
stężenie w danym czasie t (mg/L)
t
czas (w godzinach)
c
0
stężenie początkowe (mg/L), więc:
t
1/2
= - ln(0.5) / (0.0175 dziennie) = 39.6 dni
Reakcje rzędu II
Jak już wspomniano wcześniej, do tego typu zaliczamy reakcje, których szybkośd jest proporcjonalna
do kwadratu stężenia jednego ze substratów lub do iloczynu stężeo obu substratów. Jeśli początkowe
stężenia obu reagentów są równe, wówczas oba przypadki można opisad jednakowym równaniem
kinetycznym i jak poprzednio scałkowad w danych granicach (równania 4 i 5).

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
6
CHEMIA, Anna Skwierawska
kt
c
c
0
1
1
Otrzymana zależnośd jest funkcją odwrotności stężenia względem czasu. Jeśli więc doświadczalnie
wyznaczona zależnośd 1/c od czasu jest linią prostą, to badana reakcja jest rzędu drugiego. W tym
przypadku nachylenie prostej pozwala na wyznaczenie stałej szybkości reakcji.
Opracowanie wyników
Bardzo często otrzymane wyniki nie tworzą linii prostej. Na ogół jest to spowodowane
niedokładnością wykonywanych pomiarów, lub błędami przypadkowymi. W takiej sytuacji należy
dokonad jak najlepszego dopasowania linii prostej do punktów pomiarowych, na przykład metodą
najmniejszych kwadratów. Metoda ta pozwala na wykorzystanie wszystkich punktów pomiarowych i
obliczenie szacunkowych odchyleo prawdziwej wartości k od uzyskanej, jako średnia pomiarów.
Poniżej przedstawiono wzory pozwalające na wyznaczenie parametrów prostej jak również
oszacowanie błędów.
b
ax
y
2
2
)
(
i
i
i
i
i
x
x
n
y
y
x
n
a
)
(
1
i
i
x
a
y
n
b
Gdzie:
x
i
, y
i
wartości doświadczalne
n
liczba wykonanych pomiarów
Błędy wyznaczonych wartości a i b określone są wzorami:
2
2
2
)
(
)[
2
(
]
[
i
i
i
i
i
i
a
x
x
n
n
y
b
y
x
a
y
n
S
n
x
S
S
i
a
a
2
2
Metoda najmniejszych kwadratów należy do najpopularniejszych i z tego powodu wiele programów
komputerowych służących do opracowania wyników jest w nią standardowo wyposażonych, na
przykład Excel.
Wart podkreślenia jest fakt, że w równaniach kinetycznych stężenie może byd zastąpione dowolną
wielkością doo proporcjonalną, nawet, jeśli stała proporcjonalności jest nieznana. Na przykład można

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
7
CHEMIA, Anna Skwierawska
użyd liczby mililitrów roztworu zużytego do miareczkowania substancji reagujących, kąta skręcania
płaszczyzny polaryzacji światła spolaryzowanego, ciśnienia dla reakcji gazowych, przewodnictwa, pH
itp.
Reakcje pseudo jednocząsteczkowe
Istnieją pewne reakcje o kinetyce I rzędu, mimo że badania chemiczne reakcji wskazują na przebieg
dwucząsteczkowy. Klasycznym przykładem takich reakcji jest hydroliza, alkoholiza itp. Jako przykład
można podad kwaśną hydrolizę sacharozy na glukozę i fruktozę.
C
12
H
22
O
11
+ H
2
O → C
6
H
12
O
6
+ C
6
H
12
O
6
Reakcja przebiega w rozcieoczonym roztworze wodnym bez kłopotu można oznaczyd analitycznie
zmiany stężenia sacharozy, lecz nie wody, gdyż stężenie wody zmienia się nieznacznie.
Reakcje zerowego rzędu
Do tej grupy należą reakcje, których szybkośd nie zależy od stężenia reagentów. Tego typu reakcje są
dośd rzadkie. Przykładami mogą byd reakcje biegnące na granicy faz lub niektóre zachodzące w
organizmach żywych. Tu można wspomnied o reakcji eliminacji alkoholu z organizmu ludzkiego.
Przykład:
Eliminacja etanolu. Metabolizm etanolu jest reakcją zerowego rzędu (tzn. wydalanie jest stałe i
niezależne od stężenia). Jeśli normalny człowiek jest zdolny do metabolizowania 10 ml etanolu na
godzinę, to jak długo będzie trwało wydalanie sześciu puszek piwa o zawartości alkoholu 4,5%?
Rozwiązanie:
t = stosunek dawki całkowitej do szybkości eliminacji
= (6 piw)x(500mL/piwo)x(4,5% alkoholu) / (10 ml/godz)
= 13,5 godziny

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
8
CHEMIA, Anna Skwierawska
Ćwiczenia
Zadanie 1 – Hydroliza chlorku tert-butylu
Hydrolizę chlorku tert-butylu w środowisku wodno-alkoholowym można opisad równaniem
C
4
H
9
Cl + 2H
2
O → C
4
H
9
OH + Cl
-
+ H
3
O
+
Produktami hydrolizy są alkohol tert-butylowy i chlorowodór. Jest to przykład reakcji pseudo-
pierwszego rzędu. Jej szybkośd zależy od stężenia chlorku tert-butylu. Ponieważ bezpośredni pomiar
zmian stężenia substratu jest trudny, dokonuje się pomiaru wielkości proporcjonalnej do stężenia w
tym przypadku przewodnictwa roztworu. Zmiany przewodnictwa roztworu zależą od stężenia
zdysocjowanego na jony chlorowodoru.
Aparatura i odczynniki
Zlewka 100 mL, cylinder miarowy 100 mL, pipeta 1mL
Mieszadło magnetyczne, dipol magnetyczny, konduktometr, elektroda konduktometryczna, stoper
Mieszanina woda-etanol (3:2), chlorek tert-butylu
Wykonanie dwiczenia
Do zlewki o pojemności 100 mL odmierzyd cylindrem 80 mL mieszaniny woda-etanol (3:2). Do zlewki
włożyd dipol magnetyczny. Zlewkę ustawid na płytce mieszadła magnetycznego. Ustawid obroty
mieszadła tak by roztwór był intensywnie mieszany i zanurzyd elektrodę konduktometru w roztworze.
Sposób obsługi konduktometru poda osoba prowadząca dwiczenie. Włączyd mieszanie. Zmierzyd
przewodnictwo roztworu λ
0
. Za pomocą suchej pipety dodad 0,3 mL chlorku tert-butylu i odczytad
czas t
0
. W odstępach dwuminutowych dokonad 10 odczytów przewodnictwa roztworu. Następnie
wyłączyd konduktometr, ale nie mieszadło i ostatni odczyt przewodnictwa λ
∞
wykonad po upływie 60
minut.
1. Uzupełnid tabelę pomiarów
2. Sporządzid wykres zależności ln(λ
∞
- λ
t
) w funkcji czasu. W przypadku, gdy punkty pomiarowe
nie wyznaczają prostej, należy wyznaczyd równanie prostej korzystając z metody najmniejszych
kwadratów.
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
9
CHEMIA, Anna Skwierawska
O
OCH
3
+ OH
-
C
O
O
+ CH
3
OH
k
O
OCH
3
+ OH
-
C
O
-
OCH
3
+ CH
3
OH
OH
wolno
szybko
C
O
-
O
3. Wyznaczyd stałą szybkości reakcji korzystając z danych pomiarowych i metodą graficzną. W
przypadku, gdy równanie prostej wyznaczono w oparciu o metodę najmniejszych kwadratów
do obliczeo stałej szybkości reakcji korzysta się z danych teoretycznych.
4. Obliczyd okres połowicznej przemiany.
t [min]
λ
t
[mS]
λ
∞
- λ
t
ln(λ
∞
- λ
t
)
0
2
4
6
8
10
12
14
16
18
20
60
λ
0
λ
∞
Zadanie 2 – zasadowa hydroliza benzoesanu metylu
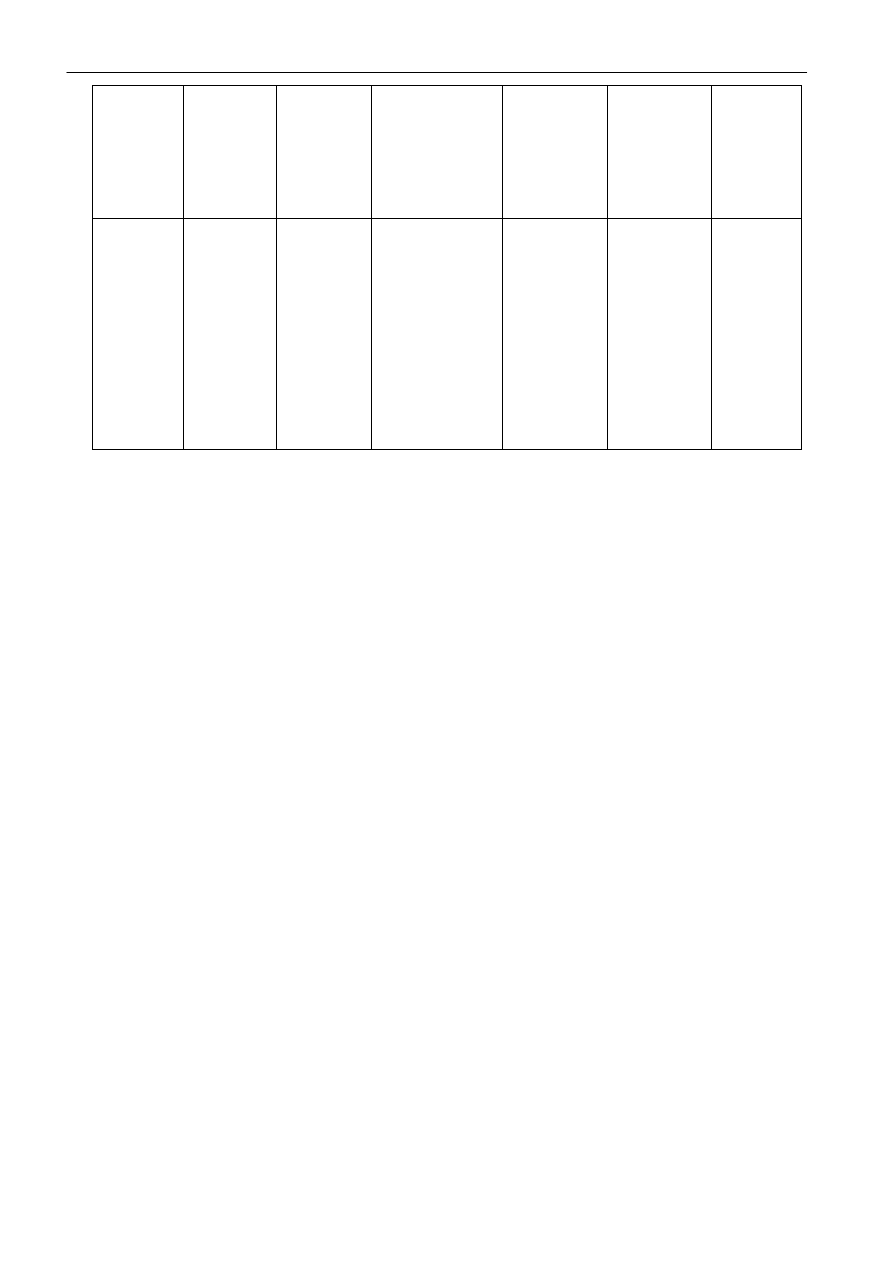
Zasadowa hydroliza estrów jest reakcją nieodwracalną. W przypadku benzoesanu metylu reakcję
można przedstawid poniższym równaniem.
Najpowolniejszym etapem warunkującym szybkośd reakcji jest atak jonów OH
-
na cząsteczkę estru:

Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
10
CHEMIA, Anna Skwierawska
Z tego wynika, że szybkośd hydrolizy estru jest proporcjonalna do iloczynu stężeo estru i jonów OH
-
, a
więc jest to przykład reakcji drugorzędowej.
Aparatura i odczynniki
Kolba stożkowa 125 mL, kolby stożkowe 50 mL, cylinder miarowy 100 mL, cylinder miarowy 50 mL,
pipeta 2 mL, pipety miarowe 5 mL, biureta,
Mieszadło magnetyczne, dipol magnetyczny, termometr, łaźnia lodowa
Benzoesan metylu, aceton, 0,1 M HCl, 0,25 M NaOH, 0,01 M NaOH, fenoloftaleina
Do kolby stożkowej o pojemności 125 mL odmierzyd za pomocą cylindra miarowego 60 mL acetonu i
za pomocą pipety 1,25 ml benzoesanu metylu (0,01 mol). Do kolby włożyd dipol magnetyczny. Kolbę
umieścid w łaźni lodowej na płytce mieszadła magnetycznego. Włączyd mieszanie. Jednocześnie do
kolby stożkowej o pojemności 50 mL odmierzyd za pomocą cylindra miarowego 40 mL 0,25 M
roztworu NaOH (0,01 mol). Roztwory oziębid do temperatury 5 °C. Reakcję rozpoczynany przez
dodanie roztworu wodorotlenku do estru. Notujemy czas rozpoczęcia reakcji z dokładnością do 1
sekundy. W określonych odstępach czasu (patrz tabela) pobieramy pipetą miarową 5 mL próbki i
przenosimy natychmiast do oddzielnych, oznaczonych kolb, zawierających po 5 mL dokładnie
odmierzonego pipetą miarową 0,1 M HCl. Do każdej z kolb dodajemy 3 krople fenoloftaleiny i
miareczkujemy 0,01 M NaOH aż do trwałego różowego zabarwienia wskaźnika. Zapisujemy czas
reakcji każdej próbki (czas pobrania próbki) i objętośd zużytego 0,01 M roztworu NaOH.
1. Uzupełnid tabelę pomiarów
2. Sporządzid wykres zależności 1/c
estru
w funkcji czasu. W przypadku, gdy punkty pomiarowe nie
wyznaczają prostej, należy wyznaczyd równanie prostej korzystając z metody najmniejszych
kwadratów.
3. Wyznaczyd stałą szybkości reakcji korzystając z danych pomiarowych i metodą graficzną. W
przypadku, gdy równanie prostej wyznaczono w oparciu o metodę najmniejszych kwadratów
do obliczeo stałej szybkości reakcji korzysta się z danych teoretycznych.
Politechnika Gdaoska, międzywydziałowy kierunek „INŻYNIERIA BIOMEDYCZNA”
11
CHEMIA, Anna Skwierawska
Numer
próbki
Czas
pobrania
[s]
Objętośd
0,01 M
NaOH
[mL]
Liczba mmoli
kwasu
benzoesowego
*
Liczba
mmoli
benzoesanu
metylu
*
Stężenie
benzoesanu
metylu
[mol/L]
1/c
estru
1
2
3
4
5
6
60
120
300
600
1200
1800
(*) po przereagowaniu x% estru w roztworze znajduje się 0,01(x/100) moli jonów benzoesanowych i
pozostaje 0,01[1-(x/100)+ moli estru i jonów OH
-
. Po dodaniu 10 mL 0,1 M HCl powstaje 0,01[1-
(x/100)] moli wody plus 0,01(x/100) moli kwasu benzoesowego.
Wyszukiwarka
Podobne podstrony:
IB P 1 CHEM LAB CW7 Kinetyka
IB P 1 CHEM LAB CW10 Rozdzielanie substancji
IB P 1 CHEM LAB CW9 Ekstrakcja
IB P 1 CHEM LAB CW8 Kataliza
IB P 1 CHEM LAB CW8 Kataliza
IB P 1 CHEM LAB CW10 Rozdzielanie substancji
IB P 1 CHEM LAB CW9 Ekstrakcja
Inz chem LAB, sprawozdanie-2831
cw7teor, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), cw7
chi-kwadrat, Studia, WEiTI-Informatyka, FKS, lab, cw7, data
IB K 4 BFIZ LAB CW1
Inz chem LAB, sprawozdanie-2831KK
Inz chem LAB, całość-drugie-kolokwium-z-inz-chem1
IB K 4 BFIZ LAB CW1
kinetyka roztwarznia miedzi lab 1
chem instrukcja spraozdania lab
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
chem instrukcja spraozdania lab
więcej podobnych podstron