
1
2. PRAKTYCZA REALIZACJA PRZEMIAY ADIABATYCZEJ
2.1 Wprowadzenie
Przemiana jest adiabatyczna, jeśli dla każdych dwóch stanów l, 2 leżących na tej prze-
mianie Q
1-2
= 0. Z tej definicji wynika, że aby zrealizować wyżej wymieniony proces, np.
ekspansję gazu w cylindrze z ruchomym tłokiem, to cylinder i tłok muszą być wykonane
z materiału będącego doskonałym izolatorem cieplnym.
Analogicznie, jeśli opróżnia się zbiornik napełniony wcześniej gazem (powietrzem)
przez otwarcie zaworu, to aby stan gazu w zbiorniku zmieniał się według adiabaty, ściany
zbiornika muszą być idealnie izolowane termicznie. Ponieważ nie ma doskonałej izolacji,
więc w praktyce możemy co najwyżej zrealizować adiabatę w przybliżeniu. Miarą tego przy-
bliżenia jest wskaźnik:
1
2
2
1
U
U
Q
Y
z
−
=
−
(1)
gdzie:
Q
z
l-2
- całkowita ilość ciepła (dodatnia lub ujemna) dostarczona do gazu w czasie ∆τ,
U
2
– U
1
- całkowita zmiana energii wewnętrznej gazu przy przejściu od stanu 1 do stanu 2.
Jeśli Y = O, to oznacza, że zrealizowano adiabatę. W przeciwnym wypadku
w zależności od konkretnej wartości tego wskaźnika można mówić o adiabacie zrealizowanej
z dokładnością wynikającą z wartości Y.
Dla konkretnego procesu oszacowanie stopnia przybliżenia adiabaty wymaga więc
pomiaru wielkości występujących we wzorze (l). Nie jest to zadanie łatwe.
Problem w sposób istotny upraszcza się, jeśli należy zrealizować adiabatę dla gazu
spełniającego równanie Clapeyrona oraz warunek c
v
= const.
Wtedy bowiem adiabata jest politropą tzn. jej równanie w układzie współrzędnych
(p - υ) ma postać:
p υ
k
= idem
(2)
Wykładnik “k” (wykładnik adiabaty) jest związany z wielkościami c
v
i c
p
równaniem:
k = c
p
/ c
v
(3)
W układzie logarytmicznym równanie to przekształca się w prostą.
2.2 Cel doświadczenia
Celem doświadczenia jest:
• sprawdzić, czy adiabata gazu doskonałego jest politropą,
• sprawdzić, że dekompresja zbiornika ze sprężonym powietrzem jest procesem
(w przybliżeniu) adiabatycznym,
• oszacować dokładność realizacji adiabaty.

2
2.3 Opis doświadczenia.
1. Zbiorniki A i B o stałej objętości V należy napełnić powietrzem aż do uzyskania
nadciśnień odpowiednio ∆p
A1i
oraz
∆p
B1i
(np. wskazanych w arkuszu pomiarowym) w celu
uzyskania relacji:
p
A1i
> p
B1i
≥ p
o
(4)
gdzie p
o
– ciśnienie otoczenia,
p
A1i
= p
o
+ ∆p
A1i
oraz p
B1i
= p
o
+ ∆p
B1i
.
Temperatura gazu w zbiornikach ma być, po zakończeniu pompowania (należy pompować
powoli, a po napompowaniu odczekać aż ciśnienie w zbiorniku się ustabilizuje), równa
temperaturze otoczenia t
o
tzn.:
t
A1i
= t
B1i
= t
o
(5)
2. Należy na okres (około) 1 sekundy otworzyć zawór łączący zbiorniki A i B. Następuje
szybki przepływ powietrza, który kończy się gdy wyrównają się ciśnienia tzn.:
p
A2i
= p
B2i
= p
mi
> p
o
(6)
Temperatury osiągają wtedy wartości:
t
A2i
< t
o
, t
B2i
> t
o
(7)
7
3
Uwaga:
Ciśnienia p
m
nie mierzy się
ponieważ dla gazu doskonałego może być obliczone z wzoru:
2
1
1
B
A
m
p
p
p
+
=
Wyprowadzenie wzoru:
W przedziale czasu od otwarcia zaworu do jego zamknięcia nie jest wykonywana praca
zewnętrzna, a dopływy ciepła są znikome z powodu dużej szybkości procesu. Dlatego
można przyjąć że całkowita energia wewnętrzna układu nie zmienia się (w fazie
wyrównywania temperatur już tak nie jest ! )
Dla gazu doskonałego energia wewnętrzna dana jest wzorem:
0
1
U
k
pV
U
+
−
=
Wobec tego warunek stałości energii dla układu wyraża równanie:
1
1
1
1
2
2
1
1
−
+
−
=
−
+
−
k
V
p
k
V
p
k
V
p
k
V
p
B
A
B
A
Podstawiając p
A2
= p
B2
= p
m
otrzymuje się szukany wzór.
3. Po zamknięciu zaworu i należy odczekać aż temperatura powietrza w zbiornikach
ponownie osiągnie wartość
t
A3i
= t
B3i
= t
o
(8)
Wówczas można odczytać ciśnienia ∆p
A3i
i wyliczyć wartość p
A3i
:
p
A3i
> p
B3i
> p
o
(9)
Opisane wyżej czynności należy powtórzyć dla kilku różnych ciśnień p
Bi
i tej samej wartości
początkowej ciśnienia p
Ai
.
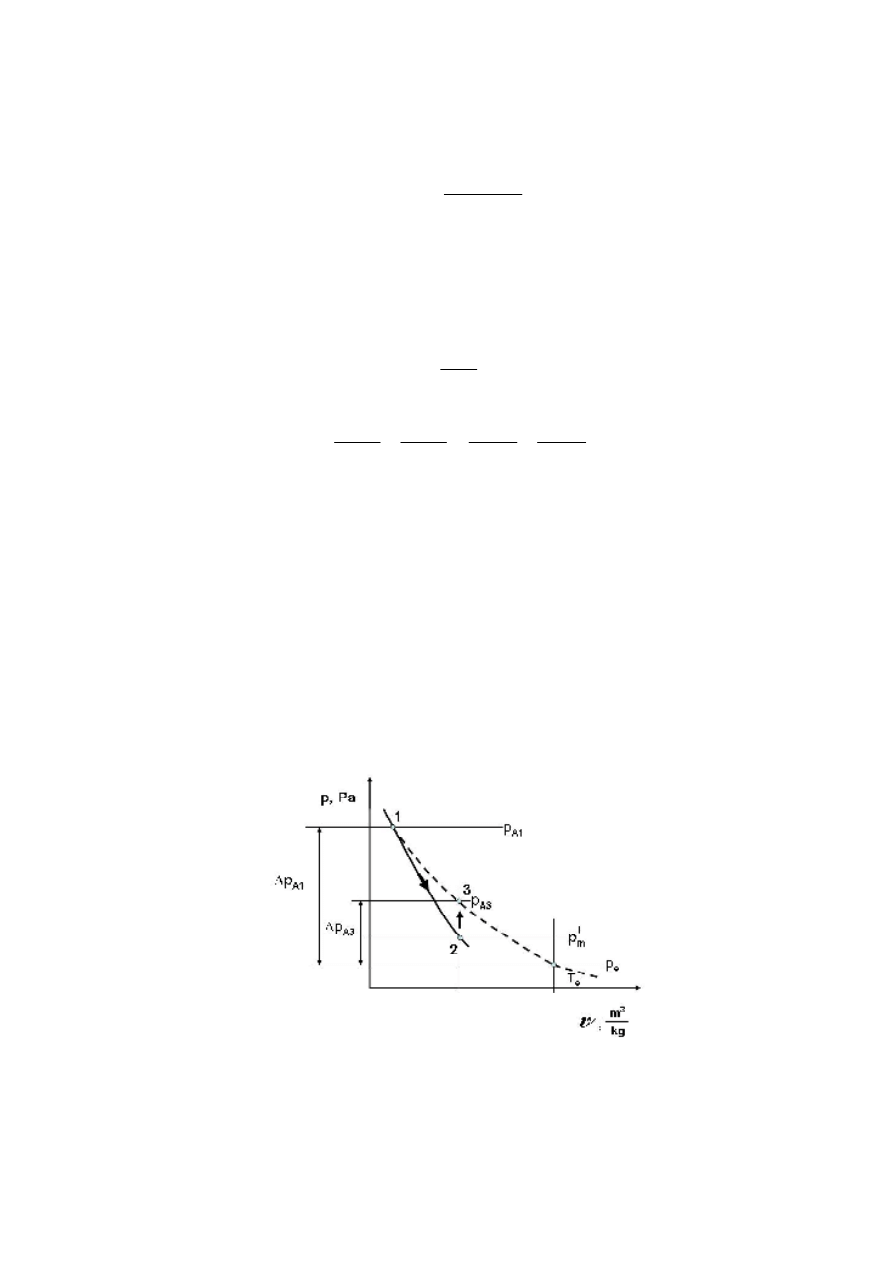
Rys. 2 Tak wygląda proces dekompresji w zbiorniku A przedstawiony w układzie (p - υ)
Obowiązują następujące zależności:
T
2
< T
o
mi
i
A
p
p
=
2
(i = 1, 2, ....,5)
T
3
= T
o
m
i
A
p
p
〉
3
4
0
0
0
RT
p
=
υ
(R = 0,287 kJ/kg K)
2
1
1
i
B
i
A
mi
p
p
p
+
=
p
A1i
= p
o
+ (
∆
p )
A1i
i
B
i
B
p
p
p
1
0
1
)
(∆
+
=
1
1
)
(
)
(
A
i
A
p
p
∆
=
∆
- stałe np. 800 mm H
2
0 ( to jest ważne aby być stale na tej samej
politropie).
i
B
p
1
)
(∆
- 0, 150, 300, 450, 600, mm H
2
0
2
)
(
)
(
1
1
i
B
o
A
o
mi
p
p
p
p
p
∆
+
+
∆
+
=
lub
2
)
(
)
(
1
1
i
B
A
o
mi
p
p
p
p
∆
+
∆
+
=
i
A
o
i
A
p
p
p
3
3
)
(∆
+
=
Stany gazu „1”, „2” leżą na politropie, wobec tego spełniają równanie p υ
w
= idem:
mi
w
i
A
i
A
w
A
A
p
p
p
=
=
2
2
1
1
υ
υ
υ
w
stąd:
w
A
i
A
i
A
A
p
p
=
1
2
2
1
υ
υ
Stany gazów „1” i „3” leżą na izotermie T = T
o
wobec tego spełniają równanie:
=
1
1
A
A
p
υ
i
A
i
A
p
3
3
υ
Ponieważ
i
A
i
A
2
3
υ
υ
=
to
=
1
1
A
A
p
υ
i
A
i
A
p
2
3
υ
i
i
A
p
A
p
A
i
A
3
1
1
2
=
υ
υ
i ostatecznie:
w
i
A
A
i
A
A
p
p
p
p
=
3
1
2
1
lub
w
i
A
A
i
A
A
p
p
p
p
=
3
1
3
1
Logarytmując otrzymuje się:
i
A
A
mi
A
p
p
w
p
p
3
1
1
ln
ln
=
co można zapisać w postaci:
i
i
w
ξ
η
=
5
2.4 Opracowanie wyników.
1. Wyniki pomiarów umieścić w tabeli
Tabela wyników pomiarów
1
)
(
A
p
∆
800 mm H
2
0
ustalić
i
B
p
1
)
(∆
0
150
300
450
600
ustalić
i
A
p
3
)
(∆
mierzyć
mi
p
wyliczyć
1
A
p
wyliczyć
i
A
p
3
wyliczyć
2. Obliczyć :
mi
A
i
P
P
1
ln
=
η
i
i
A
A
i
P
P
3
1
ln
=
ξ
3. Obliczone wartości
ηηηη
i
i
ξξξξ
i
wstawić do tabeli
i
B
p
1
)
(∆
0
150
300
450
600
η
i
ξ
i
i przedstawić na wykresie
ηηηη
= f(
ξξξξ
).
4. Wyznaczyć tzw. linię trendu w postaci
ξ
η
w
=
+ u (wielomianu pierwszego stopnia).
5. Wyznaczyć postać analityczną linii trendu (równanie) oraz współczynnik determinacji
R
2
.
Tak wyznaczona wartość „w” jest przybliżeniem wykładnika „k” adiabaty gazu
doskonałego.
6. Wyznaczyć wskaźnik dokładności oszacowania Y oraz błąd względny pomiaru b
(wyznaczonej wartości w w stosunku do oczekiwanej wartości k).
Oszacowanie dokładności odwzorowania adiabaty
We wstępie podano że można dokładność tego oszacowania określić wskaźnikiem:
1
2
2
1
1
2
2
1
u
u
q
U
U
Q
Y
z
z
−
=
−
=
−
−
Ponieważ w ≠ k i w = idem ( bo zrealizowana przemiana jest politropą ), to ciepło tej
przemiany
Q
w1-2
= m c
w
(T
2
– T
1
)
oraz

6
1
−
−
=
w
R
c
c
w
σ
Ponieważ U
2
– U
1
= m c
v
(T
2
– T
1
)
Podstawiając w/w zależności do „Y” otrzymuje się:
1
−
−
=
w
k
w
Y
Dla powietrza k = 1,4
Wyznaczenie błędu względnego pomiaru:
,%
100
k
k
w
b
−
=
7
wzór tabel
Ćw. 2 Praktyczna realizacja przemiany adiabatycznej
data: ................................. godz.: ....................................
Układ pomiarowy 1:
Tabela wyników pomiarów
p
o
, hPa/p
o
, mm H
2
O
/
1
)
(
A
p
∆
800 mm H
2
0
ustalić
i
B
p
1
)
(∆
0
150
300
450
600
ustalić
i
A
p
3
)
(∆
mierzyć
mi
p
wyliczyć
1
A
p
wyliczyć
i
A
p
3
wyliczyć
Dane do wykresu - obliczone wartości η
i
i ξ
i
:
i
B
p
1
)
(∆
0
150
300
450
600
η
i
ξ
i
Układ pomiarowy 2:
Tabela wyników pomiarów
p
o
, hPa/p
o
, mm H
2
O
/
1
)
(
A
p
∆
800 mm H
2
0
ustalić
i
B
p
1
)
(∆
0
150
300
450
600
ustalić
i
A
p
3
)
(∆
mierzyć
mi
p
wyliczyć
1
A
p
wyliczyć
i
A
p
3
wyliczyć
Dane do wykresu - obliczone wartości η
i
i ξ
i
:
i
B
p
1
)
(∆
0
150
300
450
600
η
i
ξ
i
Wyszukiwarka
Podobne podstrony:
Farmakologia cw2 s
cw2
cw2 3
cw2 7
Instr monma ćw2
cw2 tip 2012 13
2012 cw2 katy Mid 27683
SK-cw2 4h MODEMY opis przebiegu zaj dla studenta, Sieci Komputerowe
korespondencja polecenia, Weterynaria Lublin, INFORMATYKA, cw3, cw2
sciaga egz cw2, Studia, UTP Ochrona środowiska, I rok, Semestr II, Ekologia
Wykonanie próbek z zapraw?mentowych cw2
opto cw2
cw2
sem IV TWiS lab inne cw2 AnetaSzot
Cw2 t id 123178 Nieznany
lab ćw2 poliuretany i poliamidy
LA cw2 id 257339 Nieznany
więcej podobnych podstron