
1. Entropia - termodynamiczna funkcja stanu określająca
kierunek przebiegu procesów samorzutnych w układzie
odosobnionym. Entropia jest miarą stopnia
nieuporządkowania układu. 𝑑𝑆 =
𝑑𝑄
𝑇
2. Układ Termodynamiczny - rodzaj układu fizycznego,
czyli zespołu wzajemnie oddziałujących obiektów
makroskopowych, które mogą wymieniać energię i
materię. Układ jest oddzielony od otoczenia
jednoznacznie zdefiniowaną granicą, istniejącą realnie i
dostrzegalnie albo czysto myślową. Jeżeli ilość obiektów
jest stała to układ zamknięty, jeśli przez granicę
przepływają obiekty to otwarty.
3. Parametr termodynamiczny to taki, którego zmiana
jest istotna z punktu widzenia badanego zjawiska
termodynamicznego. Jeżeli wartość parametru nie zależy
od ilości obiektów to taki parametr nazywamy
intensywnym(lokalnym). W przeciwnym razie nazywamy
ekstensywnym(globalnym).
4. Stan układu określamy poprzez wartości wszystkich
parametrów termodynamicznych. Dwa stany są
identyczne, jeżeli wartości wszystkich parametrów
opisujących dany układ w obu stanach są jednakowe.
5. Równowaga termodynamiczna jest to stan, który
ustala się samorzutnie w czasie gdy układ jest
odizolowany od otoczenia i pozostaje niezmieniony w
warunkach braku oddziaływań zewnętrznych.
6. Rodzaje układów równowagi:
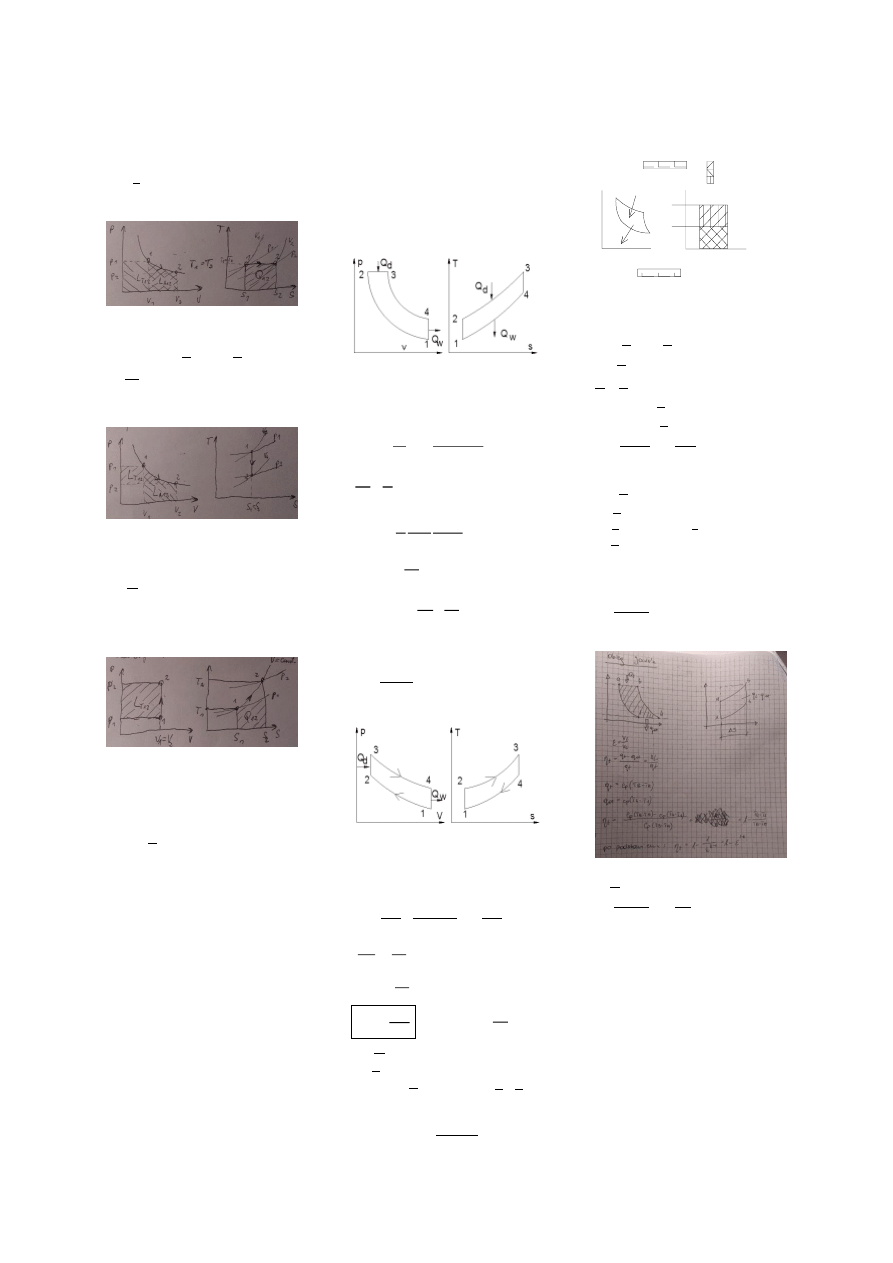
- trwała - skończona zmiana stanu układu powoduje
również skończoną zmianę w stanie otoczenia.
- obojętna - skończona zmiana stanu układu jest możliwa
bez odpowiedniej zmiany stanu otoczenia, przy czym
stan początkowy może być przywrócony przez
nieskończenie małą zmianę stanu otoczenia.
- chwiejna - skończona zmiana stanu układu może zajść
bez odpowiedniej zmiany stanu otoczenia.
-metastabilna - po działaniu bodźca większego od
pewnej wartości granicznej układ zachowuje się jak
układ w stanie równowagi chwiejnej, natomiast po
działaniu bodźca mniejszego jak układ w stanie
równowagi trwałej.
7. "0" zasada termodynamiki:
Jeżeli 2 układy A i B znajdują się w równowadze cieplnej
z trzecim układem C, to są one również w stanie
równowagi cieplnej między sobą.
8. Energia układu to suma energii cząsteczek oraz
energii ich wzajemnego oddziaływania odniesiona do
średniej masy.
Całkowita energia układu term. jest równa sumie
makroskopowej energii kinetycznej, makroskopowej
energii potencjalnej i reszty nazwanej energią
wewnętrzną. Eu=Ek+Ep+U
9. Energia wewnętrzna układu (U) obejmuje energię
wszystkich rodzajów ruchu mikroskopowych składników
układu oraz energię wzajemnego oddziaływania tych
składników. A więc w skład energii wewnętrznej układu
wchodzą:
-en. kinetyczna ruchu postępowego i obrotowego drobin
-en. ruchu drgającego atomów w drobinie
-en. potencjalna wzajemnego oddziaływania drobin
-en. stanów elektronowych
-en. chemiczna związana z możliwością przebudowy
drobin
-en. jądrowa
10. Sposoby doprowadzenia energii:
- przez przepływ ciepła
-przez wykonanie pracy mechanicznej
- za pomocą prądu elektrycznego (energia jest
doprowadzona jeśli w układzie działa silnik lub grzejnik
elektryczny bądź odprowadzana jeśli w układzie działa
generator elektryczny)
- za pomocą strugi czynnika
11. Praca zewnętrzna przemiany jest pracą
makroskopowych sił zewnętrznych i jest związana ze
zmianą stanu układu. Pracę zewnętrzną oddawaną do
otoczenia przez układ przyjęto za dodatnią (dV>0) a
pracę zewnętrzną pobieraną przez układ z otoczenia za
ujemną (dV<0). W szczególnym przypadku praca
zewnętrzna ogranicza się do pracy zmiany objętości, a
wtedy dla przemian odwracalnych ciał prostych mamy:
2
1
2
1
)
(
V
V
dv
V
p
dL
12. Ciepło przemiany składa się z ciepła
doprowadzonego z zewnątrz (ciepło zewnętrzne) oraz
ciepła spowodowanego dyssypacją pracy wewnątrz
układu (ciepło wewn.). Jeżeli 2 układy mające różną
temp. wymieniają miedzy sobą energię bez zmian obj. to
wówczas formą przekazania energii wewn. jest wyłącznie
wymiana ciepła.
13. Czynnik termodynamiczny - medium (gaz, para, ciecz
itp.) biorąca udział w procesach wymiany masy i ciepła
bądź pośredniczącego w procesach przekształcenia
energii cieplnej w pracę mechaniczną lub odwrotnie.
Najczęściej w procesach jako czynnik termodynamiczny
używany jest gaz.
14. Podział gazów (doskonały, rzeczywisty itp.):
- gaz doskonały - posiada stałe ciepło właściwe
(niezależne od temp i ciśn), nie zmienia stanu
skupienia(nie ulega skropleniu) i można go traktować
jako zbiór cząstek stanowiących punkty materialny.
Ściśle podporządkowuje się prawom gazowym.
- gaz półdoskonały - taki sam jak gaz doskonały z tą tylko
różnicą, że jego ciepło właściwe zależy od temp.
- gaz rzeczywisty - nie spełnia podanych wyżej warunków
15. Prawo Boyle'a i Mariotte'a:
Jeżeli temperatura gazu nie ulegnie zmianie to ciśnienie
bezwzględne i objętość właściwa (𝜗 [
𝑚
3
𝑘𝑔
]) lub objętość
gazu (V[𝑚
3
]) są związane zależnością:
𝑝𝜗 = 𝑐𝑜𝑛𝑠𝑡 𝑙𝑢𝑏 𝑝𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑑𝑙𝑎 𝑇 = 𝑐𝑜𝑛𝑠𝑡
16. Prawo Gay'a-Lussac'a:
Jeżeli ciśnienie gazu jest stałe to stosunek objętości
właściwej lub objętości gazu od jego temp. bezwzględnej
jest wielkością stałą określona przez zależności:
𝜗
𝑇
= 𝑐𝑜𝑛𝑠𝑡 𝑙𝑢𝑏
𝑉
𝑇
= 𝑐𝑜𝑛𝑠𝑡 𝑑𝑙𝑎 𝑝 = 𝑐𝑜𝑛𝑠𝑡
𝜌𝑇 = 𝑐𝑜𝑛𝑠𝑡 (𝜌 =
1
𝜗
= [
𝑘𝑔
𝑚
3
])
17. Prawo Charles'a:
Jeżeli objętość właściwa lub objętość gazu są stałe to
iloraz ciśnienia bezwzględnego i temp. bezwzględnej jest
wielkością stałą:
𝑝
𝑇
= 𝑐𝑜𝑛𝑠𝑡 𝑑𝑙𝑎 𝜗 = 𝑐𝑜𝑛𝑠𝑡 𝑙𝑢𝑏 𝑉 = 𝑐𝑜𝑛𝑠𝑡
18. Równanie Clapeyron'a:
(2 → 𝑚) 𝑇 = 𝑐𝑜𝑛𝑠𝑡 𝑝
2
𝑉
2
= 𝑝
𝑚
𝑉
𝑚
(𝑚 → 1)𝑝 = 𝑐𝑜𝑛𝑠𝑡
𝑉
𝑚
𝑇
𝑚
=
𝑉
1
𝑇
1
=> 𝑉
𝑚
= 𝑉
1
𝑇
𝑚
𝑇
1
= 𝑉
1
𝑇
2
𝑇
1
𝑝
𝑚
𝑉
1
𝑇
2
𝑇
1
= 𝑝
2
𝑉
2
𝑝
𝑚
𝑉
1
𝑇
1
=
𝑝
2
𝑉
2
𝑇
2
= 𝑝
𝑚
𝑉
𝑚
𝑇
𝑚
= 𝑐𝑜𝑛𝑠𝑡 = 𝑅
Iloczyn ciśń. bezwzględnego i objętości gazu
podzielonego przez temp. bezwzględną jest równy stałej
gazowej R[J/kg*K], której wartość dla każdego gazu jest
inna.
- dla 1kg gazu: 𝑝𝜗 = 𝑅𝑇
- dla M[kg] gazu:
pV = MRT
- dla 1kmola gazu:
𝑝𝜗
𝜇
= 𝑅̅𝑇
- dla n[kmol] gazu:
𝑝𝑉 = 𝑛𝑅̅𝑇
19. Mieszaniny gazów doskonałych:
- udziały masowe 𝑔
𝑖
=
𝑀
𝑖
𝑀
𝑚
- udziały molowe 𝑟
𝑖
=
𝑛
𝑖
𝑛
𝑚
- udziały objętościowe 𝑧
𝑖
=
𝑉
𝑖
𝑉
𝑚
20. "I" zasada termodynamiki:
1) 1 postać:
Ed=Q1+L1 (en.dostarczona)
Ew=Q2+L2(en.wyprowadzona)
Eu=U2-U1(przyrost en. ukł)
Q - ciepło
L - praca mech
U - en. wewn. układu
Ed=Ew+Eu
Q1+L1=Q2+L2+U2-U1
Q1-Q2=U2-U1+(L2-L2)
ΔQ=ΔU+ΔL
dQ=dU+dL
dL=pd𝜗
dq=du+pd𝝑
-> 1 postać
2) 2 postać:
F=Ap
FΔx=ApΔx=𝜗𝑝
h=u+ 𝑝𝜗 ->entalpia statyczna
(h czasem zaznacza się "i")
dh=du+d(𝑝𝜗)
dh=CvdT+d(RT)=CvdT+RdT=(Cv+R)dT=CpdT
du=dh- d(𝑝𝜗)=dq- pd𝜗 (przyrównanie du do 1 postaci)
dh-pd𝜗-𝜗dp=dq-pd𝜗
dh-𝝑𝒅𝒑=dq
-> 2 postać
3) 3 postać:
𝑐
𝑝
𝑐
𝑣
= 𝑘
𝑐
𝑝
− 𝑐
𝑣
= 𝑅
Z 1) postaci dq=du+pd𝜗
p𝜗=RT => 𝑇 =
𝑝𝜗
𝑅
;
dT=
𝑑(𝑝𝜗)
𝑅
du=CvdT=Cv
𝑑(𝑝𝜗)
𝑅
=
𝐶𝑣
𝑅
𝑑(𝑝𝜗)=
𝐶𝑣
𝑐
𝑝
−𝑐
𝑣
𝑑(𝑝𝜗)=
1
𝑘−1
𝑑(𝑝𝜗)
dq=
1
𝑘−1
𝑑(𝑝𝜗)+ pd𝜗=
1
𝑘−1
[(𝜗𝑑𝑝 + 𝑝𝑑𝜗 ) + (𝑘 −
1)𝑝𝑑𝜗]=
𝟏
𝒌−𝟏
(𝒌𝒑𝒅𝝑 + 𝝑𝒅𝒑) -> 3 postać
21. Przemiana politropowa charakteryzuje się tym, że
ciepło właściwe podczas przemiany jest stałe:
c=
𝑑𝑞
𝑑𝑇
=const
p
1
V
1
n
=p
2
V
2
n
𝑇
1
𝑝
1
1−𝑛
𝑛
= 𝑇
2
𝑝
2
1−𝑛
𝑛
𝑛 =
𝐶 − 𝐶𝑝
𝐶 − 𝐶𝑣
→ 𝑤𝑦𝑘ł𝑎𝑑𝑛𝑖𝑘 𝑝𝑜𝑙𝑖𝑡𝑟𝑜𝑝𝑦
C =
𝐶𝑣(𝑛 − 𝑘)
𝑛 − 1
→ 𝑐𝑖𝑒𝑝ł𝑜 𝑤ł𝑎ś𝑐𝑖𝑤𝑒
Q=M*C*(T2-T1)
U=M*Cv*(T2-T1)
I=M*Cp*(T2-T1)
La=
𝑅
1−𝑚
(T2-T1)
Lt=m*La=
𝑚𝑅
1−𝑚
(T2-T1)
S=c*ln(
𝑇2
𝑇1
)
22. Przemiana izobaryczna:
n=0
c=k*cv = cp
U
12
= M Cv (T
2
– T
1
)
Q
12
= M Cp (T
2
– T
1
)
La
12
= M p (V
2
– V
1
) = M R (T
2
– T
1
)
Lt
12
= 0
S=Cp ln
T2
T1
23. Przemiana izotermiczna:
n = 1
c = niesk.
U
12
= 0
Q
12
= La
12
= Lt
12
= MRT
𝑉2
𝑉1
= M R T
ln
p2
p1
S
12
=
𝑄12
𝑇
I
12
= 0
24. Przemiana izentropowa:
n = k
c = 0
U
12
= M Cv (T
2
– T
1
)
Q
12
= 0
La
12
=
𝑀𝑅
1−𝑘
(T
2
– T
1
) = -U
12
Lt
12
= k La
12
= -k U
12
= -I
12
I
12
= M Cp (T
2
– T
1
)
S
12
= 0
25. Przemiana izochoryczna:
n = ∞
C = Cv
U
12
= Q
12
= M Cv (T
2
– T
1
)
La
12
= 0
Lt
12
= M (-v) (p
2
– p
1
)
I
12
= M Cp (T
2
– T
1
)
S
12
= M Cv ln
𝑇2
𝑇1
26. Sposoby przekazywania ciepła:
- przewodzenie ciepła – przenoszenie ciepła w obrębie
danego ciała od jednych drobin do drugich lub przez
dyfuzję
- konwekcja – (unoszenie ciepła) ciepło płynie z
cząsteczkami płynu od ściany przegrody do rdzenia
strumienia lub odwrotnie
- promieniowanie – ciepło przenosi się od jednego ciała
do drugiego w postaci energii promienistej (za
pośrednictwem fal elektromagnet)
27. II Zasada termodynamiki
-wg Plancka: Jest rzeczą niemożliwą skonstr. takiego
silnika (maszyny działającej periodycznie), którego
działanie polegało by na podnoszeniu ciężarów i
równoczesnym ochładzaniu jednego źródła ciepła. Silnik
taki nosi nazwę perpetum mobile II rodzaju.
- wg Clausjusa: ciepło nie może przejść samorzutnie od
ciała o temp niższej do ciała o temp wyższej. Aby
spowodować taki przepływ ciepła musimy zastosować
lewo bieżną maszynę cieplną i wkładać do niej energię z
zewnątrz, tzn. wywoływać zmiany w innych ciałach.
- wg Schmidta: nie można całkowicie odwrócić
przemiany, w której występuje tarcie. Pracę w całości
można zmienić na ciepło przez tarcie, jednak z tego
ciepła nie można w całości odzyskać pracy.
- wg Ostwalda: perpetum mobile II rodzaju jest
niemożliwe
28. Obieg termodynamiczny - cykl przemian po przejściu
których stan końcowy czynnika jest identyczny ze
stanem początkowym. Obrazem geometrycznym obiegu
jest linia zamknięta. Obieg jest odwracalny jesli składa
się z przemian odwracalnych.
29. Obieg Diesla
Sprawność techniczna
)
(
)
(
1
1
2
3
1
4
T
T
c
T
T
c
q
q
p
v
d
w
tD
1
c
c
p
v
1
1
1
1
1
1
tD
kompresja
2
1
V
V
;
st. obciążenia
2
3
2
3
T
T
V
V
Qd = M Cp (T3-T2)
Qod = M Cv (T1-T4)
𝜂
𝑡
=
𝑄𝑑−|𝑄𝑜|
𝑄𝑑
30. Obieg Otto
L
o
= Q
d
- Q
w
;
d
w
d
w
d
w
w
to
Q
Q
1
Q
Q
Q
Q
L
1
1
2
d
w
)
V
V
(
)
Q
Q
(
;
1
1
2
to
)
V
V
(
1
1
to
1
1
9
5
;
2
1
V
V
𝜀
𝑠
=
𝑉1
𝑉2
− 𝑠𝑡. 𝑠𝑝𝑟𝑒𝑧
𝜀
𝑟
=
𝑉4
𝑉3
-st rozpr.
𝜀
𝑠
= 𝜀
𝑟
;
𝛼 =
𝑝3
𝑝2
– st wzr cisnienia ;
𝑇1
𝑇4
=
𝑇2
𝑇3
;
Qd = M Cp (T3-T2)
Qod = M Cv (T1-T4)
𝜂
𝑡
=
𝑄𝑑 − |𝑄𝑜|
𝑄𝑑
31. Obieg Carnota
1-2 izotermiczna ekspansja następuje pobór ciepła
2-3 izentropowa ekspansja
3-4 kompresja izotermiczna następuje oddanie ciepła
4-1 kompresja izentropowa
𝜀
𝑠
=
𝑉1
𝑉2
; 𝜀
𝑟
=
𝑉4
𝑉3
; 𝜀
𝑠
= 𝜀
𝑟
𝛼 =
𝑝3
𝑝2
– st wzr cisnienia ;
𝑉1
𝑉2
=
𝑉4
𝑉3
;
Qd = M R T
2
𝑙𝑛
𝑉3
𝑉2
;
Qod = M R T
1
𝑙𝑛
𝑉1
𝑉4
;
𝜂
𝑡
=
𝑄𝑑−|𝑄𝑜|
𝑄𝑑
=1 −
𝑇𝑚𝑖𝑛
𝑇𝑚𝑎𝑥
32. Obieg Sabathe
𝜀
𝑠
=
𝑉1
𝑉2
− 𝑠𝑡. 𝑠𝑝𝑟𝑒𝑧
:;
𝜀
𝑟
=
𝑉5
𝑉4
-st rozpr. ;
𝜑 =
𝑉4
𝑉3
𝑠𝑡 𝑤𝑧𝑟 𝑜𝑏𝑗𝑒𝑡𝑜𝑠𝑐𝑖 =
𝜀
𝑠
𝜀
𝑟
;
𝛼 =
𝑝3
𝑝2
𝑠𝑡 𝑤𝑧𝑟 𝑐𝑖𝑠𝑛𝑖𝑒𝑛𝑖𝑎 ;
Q
d
= Q dv + Q dp
Q dv = M Cv (T3-T2)
Q dp = M Cv (T4-T3)
Q
od
= M Cv (T1-T5),
𝜂
𝑡
=
𝑄𝑑 − |𝑄𝑜|
𝑄𝑑
33. Obieg Joule:
𝜀 =
𝑉1
V2
𝜂
𝑡
=
𝑄𝑑 − |𝑄𝑜|
𝑄𝑑
= 1 −
1
𝜀
𝑘−1
= 1 − 𝜀
1−𝑘
Qd = Cp (T3-T2)
Qod = Cp (T4-T1)
1-2 sprężanie izentro.
2-3spalanie p=cons
3-4 rozpr. izentropo.
4-1 wydech izochora,
1-2 sprężanie izentro.
2-3 izochora (spal. wyb.)
3-4 rozpr. izentropo.
4-1 wydech (izochoryczne oddaw. ciepła)
3
T
2
- i d e
m
V
S
T
1
=
i d e
m
T
1
2
3
4
Q
d
Q
w
L
o
b
p
1
Q
d
4
Q
w
2

34. Spręż graniczny
W miarę wzrostu ciśnienia sprężania p2, wydatek
sprężarki maleje (zmniejsza się odcinek 4 -1). Przy
sprężaniu do ciśnienia p2max, odpowiadającego
sprężowi granicznemu, sprężanie i rozprężanie odbywa
się według politropy
1-2, a wydatek sprężarki wynosi zero.
35. Przestrzeń szkodliwa sprężarki
Straty wydatku sprężarki powodowane są przede
wszystkim ciśnieniem przestrzeni szkodliwej Vsz.
Istnienie tej obj. powoduje, że obj. Vs=Vsz po
zakończeniu suwu wytłaczania jest wypełniona gazem o
ciśnieniu p2 i przy ponownym ruchu tłoka obj. ta ulega
rozprężeniu powrotnemu do ciśnienia zasysania. Na
skutek tego tłok nie zassie całej obj. Vs a obj. Vsz+Vs-V4
36. Sprężarka tłokowa:
Zadaniem sprężarek tłokowych jest dostarczenie
sprężonego powietrza. Przy ssanym ruchu tłoka przez
zawory do cylindra napływa gaz lub powietrze o
ciśnieniu p1. Proces BC - tłok spręża zawarty w cylindrze
czynnik, aż do osiągnięcia p2 w końcowej fazie C->p2
następuje wytłaczanie czynnika z cylindra.
37. Silnik czterosuwowy
1. Entropia
2. Układ Termodynamiczny
3. Parametr termodynamiczny
4. Stan układu
5. Równowaga termodynamiczna
6. Rodzaje układów równowagi
7. "0" zasada termodynamiki
8. Energia układu
9. Energia wewnętrzna układu
10. Sposoby doprowadzenia energii
11. Praca zewnętrzna przemiany
12. Ciepło przemiany
13. Czynnik termodynamiczny
14. Podział gazów (doskonały, rzeczywisty itp)
15. Prawo Boyle'a i Mariotte'a
16. Prawo Gay'a-Lussac'a
17. Prawo Charles'a
18. Równanie Clapeyron'a
19. Mieszaniny gazów doskonałych
20. "I" zasada termodynamiki
21. Przemiana politropowa
22. Przemiana izobaryczna
23. Przemiana izotermiczna
24. Przemiana izentropowa
25. Przemiana izochoryczna
26. Sposoby przekazywania ciepła
27. II Zasada termodynamiki
28. Obieg termodynamiczny
29. Obieg Diesla
30. Obieg Otto
31. Obieg Carnota
32. Obieg Sabathe
33. Obieg Joule
34. Spręż graniczny
35. Przestrzeń szkodliwa sprężarki
36. Sprężarka tłokowa
Wyszukiwarka
Podobne podstrony:
terma temp sc
terma sc, 1
Terma III, Termodynamika III sc, PRACA MAKSYMALNA I EGZERGIA:
terma temp sc
TERMA SC
160 SC DS400 C VW GOLF V A 05 XX
39 SC DS300 R BMW 5 A 00 XX
CHEMIA SÄ„DOWA WYKĹAD 6
Domino 700 SC
150 SC DS400 C PEUGEOT 307 A 05 XX
et sc wzorzec
125 SC DS300 R TOYOTA AVENSIS A 03 XX
Efficient VLSI architectures for the biorthogonal wavelet transform by filter bank and lifting sc
Czę¶ć ogólna PC wykład 2 podmioty
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
żołądek ść 4, II rok, II rok CM UMK, Giełdy, 2 rok, histologia
więcej podobnych podstron