*** VII Wojewódzki Konkurs
„Duety Chemiczne”
*** 11.01.2006 r. *** I etap ***
Katowice 11.01.2006 r.
VII Wojewódzki Konkurs
„DUETY CHEMICZNE”
I etap
ZADANIE I.
TEST (20 punktów)
1.
W czterech probówkach znajduj si sole sodu: siarczek, siarczan(IV), chlorek i w glan.
Po dodaniu do wszystkich probówek jednakowych ilo ci kwasu solnego zaobserwowano:
-
w probówce I – brak reakcji
-
w probówce II – wydzielił si bezbarwny, bezwonny gaz
-
w probówce III – wydzielił si bezbarwny gaz o nieprzyjemnym zapachu
-
w probówce IV – wydzielił si bezbarwny, dusz cy gaz
W probówkach znajdowały si odpowiednio sole:
probówka I
probówka II
probówka III
probówka IV
a)
NaCl
Na
2
SO
3
Na
2
S
Na
2
CO
3
,
b)
Na
2
CO
3
NaCl
Na
2
SO
3
Na
2
S,
c)
NaCl
Na
2
CO
3
Na
2
S
Na
2
SO
3
,
d)
Na
2
SO
3
Na
2
CO
3
NaCl
Na
2
S.
2.
Wska bł dny zapis ilustruj cy jonowe równanie reakcji:
a) 3X
2+
+ 2Y
3-
X
3
Y
2
,
b) 2X
+
+ Y
2-
X
2
Y ,
c) X
2+
+ 2Y
-
XY
2
,
d) 2X
2+
+ 3Y
3-
X
2
Y
3
.
3.
Która z ni ej wymienionych czynno ci nie doprowadzi do zmiany nienasyconego roztworu
chlorku sodu w nasycony?
a) odparowanie rozpuszczalnika,
b) dodanie substancji rozpuszczonej,
c) podwy szenie temperatury roztworu,
d) obni enie temperatury roztworu.
4.
Dobierz odpowiedni zestaw współczynników stechiometrycznych, aby uzgodni poni sze
równanie reakcji:
... N
2
O
5
... NO
2
+ ... O
2
a) 2, 4, 1,
b) 2, 2, 3,
c) 3, 6, 3,
d) 1, 2, 1.
5.
Której, spo ród ni ej wymienionych metod nie mo na zastosowa do otrzymania
azotanu(V) potasu?
a) wodorotlenek + kwas,
b) tlenek niemetalu + wodorotlenek,
c) tlenek metalu + tlenek niemetalu,
d) tlenek niemetalu + kwas.
6.
Przeprowadzono eksperyment, polegaj cy na umieszczeniu niewielkich kawałków metali
w roztworach soli. Wyniki eksperymentu przedstawiono w tabeli:
elazo
ołów
cyna
cynk
siarczan(VI)
elaza(II)
brak reakcji
brak reakcji
brak reakcji
osadza si
elazo
azotan(V) ołowiu(II) osadza si ołów
brak reakcji
osadza si ołów osadza si ołów
chlorek cyny(II)
osadza si cyna
brak reakcji
brak reakcji
osadza si cyna
siarczan(VI) cynku
brak reakcji
brak reakcji
brak reakcji
brak reakcji
Na podstawie informacji zawartych w tabeli uszereguj metale według wzrastaj cej
aktywno ci:
a) Fe, Pb, Sn, Zn,
b) Pb, Sn, Fe, Zn, c) Zn, Sn, Pb, Fe,
d) Sn, Zn, Fe, Pb.
7.
Spo ród ni ej wymienionych jonów wybierz grup zawieraj c wył cznie jony
jednowarto ciowe:
a) kation amonowy, anion siarczkowy, anion azotanowy(V),
b) anion wodorow glanowy, anion chlorkowy, kation wapnia,
c) kation potasu, anion wodorotlenkowy, anion wodorosiarczanowy(IV),
d) anion fluorkowy, kation magnezu, kation glinu.

*** VII Wojewódzki Konkurs
„Duety Chemiczne”
*** 11.01.2006 r. *** I etap ***
1.
2.
3.
4.
8.
Po zalaniu umieszczonych w probówce kilku drucików miedzianych st onym kwasem
azotowym(V) z probówki zacz ł wydobywa si brunatny gaz. Był to:
a) azot ,
b) amoniak,
c) tlenek azotu(IV),
d) wodór.
9.
W przedstawionym na rysunku zestawie do destylacji nasadka destylacyjna oznaczona
jest numerem:
a) 1,
b) 2,
c) 3,
d) 4.
10.
Otwieraj c butelk z gazowanym napojem cz sto mamy do czynienia ze zjawiskiem
desaturacji, które polega na:
a) wydzieleniu si gazu z roztworu nasyconego na skutek obni enia ci nienia po otwarciu
butelki,
b) reakcji rozpuszczonych w napoju gazów ze składnikami powietrza,
c) zmniejszeniu si rozpuszczalno ci gazów w napoju na skutek obni enia temperatury,
d) reakcji rozpuszczonych w napoju gazów ze składnikami tego napoju.
11.
pH jest wielko ci charakteryzuj c odczyn roztworu. Im wy sze pH roztworu, tym:
a) wy sze st enie jonów H
+
w roztworze,
b) wy sze st enie jonów OH
-
w roztworze,
c) wi ksza ilo zdysocjowanych cz steczek wody w roztworze,
d) lepszym jest on elektrolitem.
12.
Która z ni ej przedstawionych cz stek jest cz steczk homoj drow ?
a) C,
b) HI,
c) S
8
,
d) KAl(SO
4
)
2
·12H
2
O.
13.
Liczba atomowa Z danego pierwiastka jest taka sama jak jego:
a) masa atomowa,
b) liczba masowa,
c) liczba porz dkowa w układzie okresowym pierwiastków,
d) masa molowa.
14.
Zgodnie z tzw. reguł helowca atomy pierwiastków ł cz si w cz steczki zwi zków
chemicznych w ten sposób, aby uzyska konfiguracj elektronow najbli szego helowca,
czyli dublet lub oktet walencyjny. Je li nast puje to przez uwspólnienie elektronów mamy do
czynienia z wi zaniem:
a) jonowym,
b) kowalencyjnym,
c) donorowo-akceptorowym,
d) wodorowym.
15.
Jak ma si promie prostego anionu w stosunku do promienia atomu?
a) promie anionu jest zazwyczaj wi kszy od promienia atomu,
b) promie anionu jest zazwyczaj mniejszy od promienia atomu,
c) jest to zale ne od rodzaju pierwiastka,
d) promie anionu jest taki sam jak promie atomu.
16.
Po zmieszaniu roztworu substancji A z roztworem substancji B powstał zwi zek C,
a temperatura roztworu wzrosła o 17
0
C. Mo na wi c wnioskowa , e zaszła reakcja:
a) endoenergetyczna,
b) egzoenergetyczna,
c) utleniania-redukcji,
d) zoboj tniania.
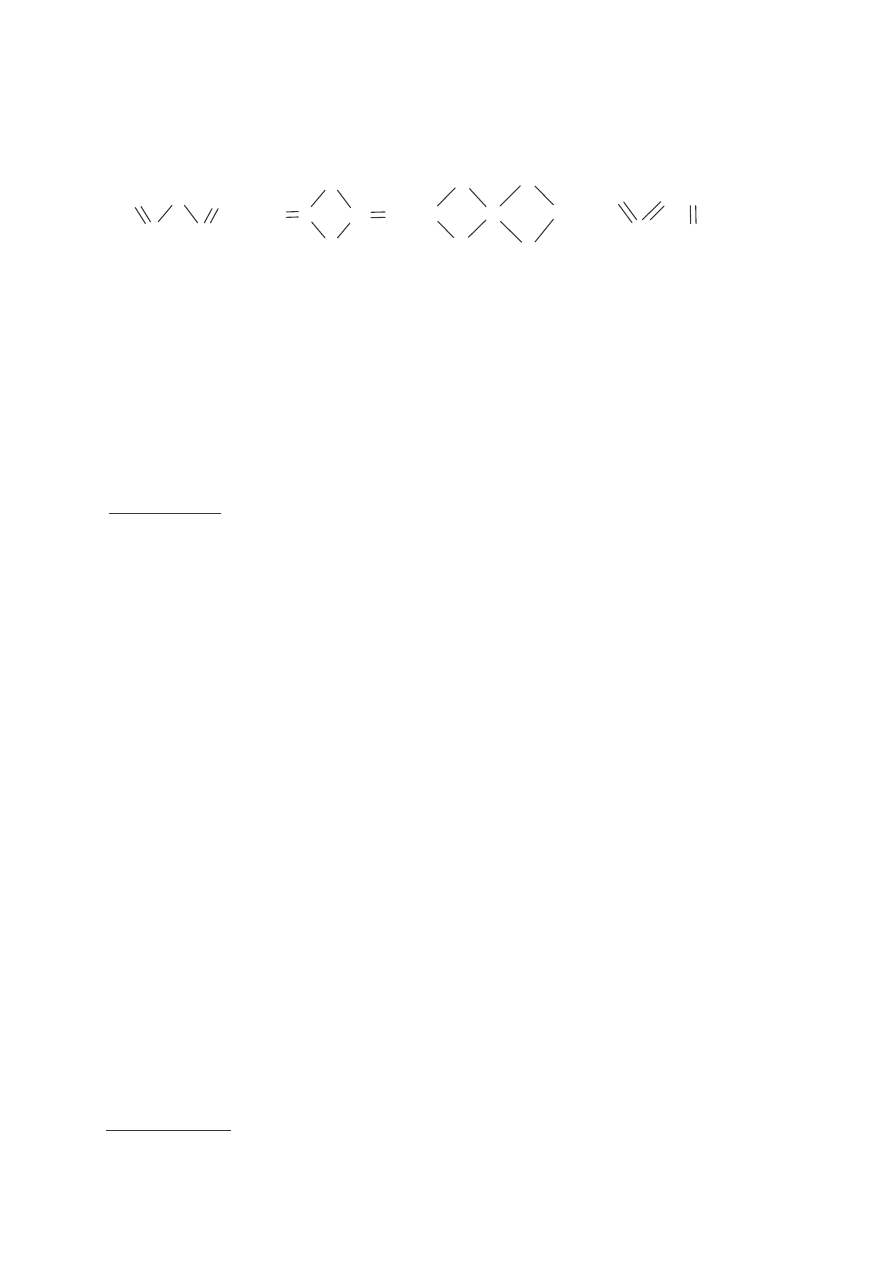
*** VII Wojewódzki Konkurs
„Duety Chemiczne”
*** 11.01.2006 r. *** I etap ***
17.
„Minia” to zwyczajowa nazwa tlenku ołowiu(II) ołowiu(IV) stosowanego do pokrywania
przedmiotów elaznych w celu zabezpieczenia ich przed korozj . Wzór kreskowy minii
przedstawia rysunek:
a)
b)
c)
d)
Pb
O
O
Pb
O
Pb
O
Pb
O
O
O
Pb
O
O
Pb
O
Pb
O
O
Pb
O
O
Pb
18.
Uczniowie na lekcji chemii przygotowywali „wizytówki” pierwiastków, zawieraj ce
informacje o charakterystycznych cechach wybranych pierwiastków. Ola napisała: „Jest
to ółty niemetal. Nie rozpuszcza si w wodzie. Pali si niebieskim płomieniem.” Była
to wizytówka:
a) siarki,
b) fosforu,
c) jodu,
d) bromu.
19.
Wska prawdziwe zdanie dotycz ce budowy cz steczki wody:
a) cz steczka wody ma budow liniow ,
b) k t mi dzy wi zaniami w cz steczce wody wynosi ok. 90
0
,
c) k t mi dzy wi zaniami w cz steczce wody wynosi ok. 105
0
,
d) k t mi dzy wi zaniami w cz steczce wody wynosi ok. 120
0
.
20.
Jak wielko mo na obliczy przy pomocy przedstawionego poni ej wzoru?
?
%
100
=
⋅
⋅
−
−
ru
r
ru
r
p
V
d
C
gdzie: C
p
– st enie procentowe roztworu
d
r-ru
– g sto roztworu
V
r-ru
– obj to roztworu
a) obj to substancji rozpuszczonej,
b) g sto substancji rozpuszczonej,
c) mas roztworu,
d) mas substancji rozpuszczonej.
ZADANIE II.
PARY (5 punktów)
Podane s pary wyrazów, przy czym w drugiej parze brakuje jednego słowa. Wybierz 5
brakuj cych słów spo ród ni ej podanych i wstaw w odpowiednie miejsce, tak, by obie pary
stanowiły analogie.
drzewo - sosna
w giel - .......................
woda wapienna - CO
2
roz arzone łuczywko - .......................
aaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaa
zupa - ły ka
roztwór - .......................
gor ce - zimne
synteza - .......................
jamnik - wy eł
mosi dz - .......................
Brakuj ce słowa:
pierwiastek, tlen, tlenek siarki, grafit, analiza, cynk, pipeta, ł czenie, zlewka, br z.

*** VII Wojewódzki Konkurs
„Duety Chemiczne”
*** 11.01.2006 r. *** I etap ***
ZADANIE III.
OBLICZENIA (20 punktów)
1.
W jakim stosunku obj to ciowym nale y zmiesza roztwór wodorotlenku litu (LiOH)
o st eniu 1 mol/dm
3
z roztworem kwasu siarkowego(VI) o st eniu 2 mol/dm
3
, aby
otrzymany roztwór miał odczyn oboj tny?
a) 1:2,
b) 1:1,
c) 2:1,
d) 4:1.
2.
W wodnym roztworze kwasu borowego (H
3
BO
3
) stosunek liczby cz steczek kwasu
do liczby cz steczek wody wynosi 1:10. Oblicz jakie jest st enie procentowe tego roztworu.
a) ok. 9,1%,
b) ok. 25,6%,
c) ok. 34,4%,
d) ok. 77,5%.
3.
Rozpuszczalno chlorku amonu w temp. 50
0
C wynosi 50g/100g H
2
O. Jaka minimalna
ilo chlorku amonu musi by rozpuszczona w wodzie, aby powstały 24 gramy roztworu
nasyconego w tej temperaturze?
a) 4g,
b) 8g,
c) 12g,
d) 16g.
4.
Fullereny, jedna z odmian alotropowych w gla nazywane s niekiedy futbolanami, gdy
budowa ich cz steczek przypomina piłk futbolow . Okre l, z ilu atomów w gla składa si
cz steczka fullerenu o masie cz steczkowej 720u.
a) 100,
b) 80,
c) 60,
d) 40.
5.
Ucze , korzystaj c z ró nych ródeł informacji, wypisał g sto ci czterech substancji:
substancja A: g sto = 12g/cm
3
substancja B: g sto = 0,8kg/m
3
substancja C: g sto = 440mg/ml
substancja D: g sto = 600g/dm
3
Po ujednoliceniu jednostek, ucze doszedł do wniosku, e najwi ksz g sto
ma substancja:
a) A,
b) B,
c) C,
d) D.
6.
Atmosfera na Marsie ma skład (w % masowych): 95% dwutlenku w gla, 3% azotu, poni ej
1% tlenu i poni ej 2% innych gazów (głównie pary wodnej). Zakładaj c, e azot wyst puje
w postaci cz steczek dwuatomowych, okre l ile moli azotu zawarte jest w 1 kilogramie
mieszaniny gazów stanowi cych atmosfer na Marsie.
a) ok. 0,1 mola,
b) ok. 1,1 mola,
c)ok. 2,1 mola,
d)ok. 3 mole.
7.
W pewnym tlenku azotu procentowa zawarto tlenu w cz steczce wynosi ok.36,4%.
Tlenkiem tym jest:
a) N
2
O
5
,
b) N
2
O
3
,
c) NO
2
,
d) N
2
O.
8.
Ile gramów H
2
O
2
uległo rozkładowi je li wydzieliło si 22,4 dm
3
tlenu?
a) 17g,
b) 34g,
c) 68g,
d) 136g.
9.
W wie o wyci ni tym soku z cytryny jest ok. 6% kwasu cytrynowego. Oblicz jakie b dzie
st enie tego kwasu w roztworze otrzymanym po zmieszaniu 50g soku z 50g wody.
a) 3%,
b) 6%,
c) 12%,
d) 50%.
10.
Jaka b dzie masa stałego produktu powstałego po całkowitym wypra eniu 100g CaCO
3
?
a) 10g,
b)40g,
c) 56g,
d) 100g.
MASY ATOMOWE [u]:
H –1, Li – 7, B – 11, C – 12, N – 14, O – 16, S – 32, Cl – 35,5, Ca – 40.
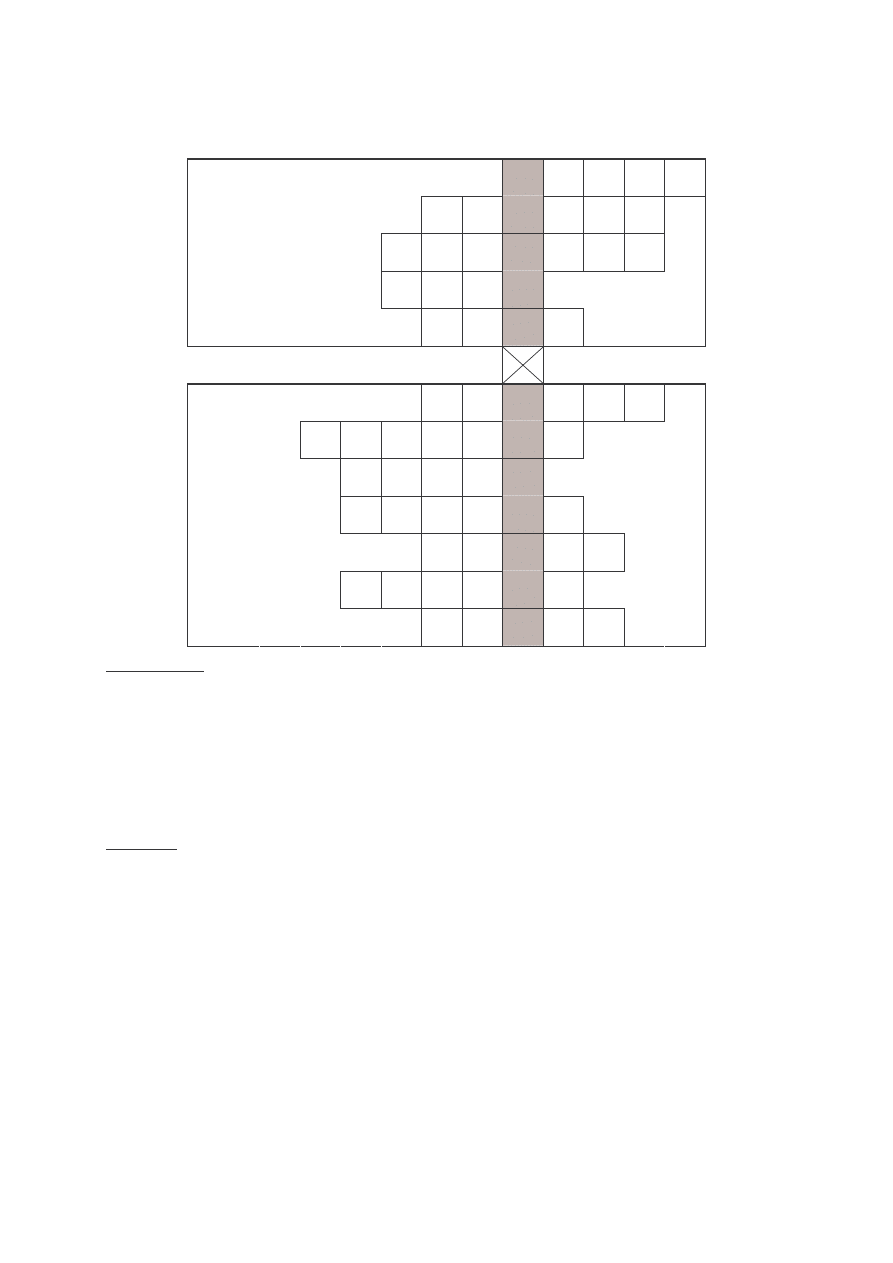
*** VII Wojewódzki Konkurs
„Duety Chemiczne”
*** 11.01.2006 r. *** I etap ***
ZADANIE IV.
KRZY ÓWKA CHEMICZNA (14 punktów)
Rozwi krzy ówk , litery z wyszczególnionych pól utworz hasło. Podaj nazw
systematyczn oraz wzór sumaryczny zwi zku, którego nazw zwyczajow podaje hasło.
1
2
3
4
N
IE
M
E
TA
LE
5
6
7
8
9
10
11
M
E
TA
LE
12
NIEMETALE:
1.
Najl ejszy niemetal.
2.
Niemetal nale cy do 16 grupy układu okresowego pierwiastków, wyst puje w postaci
kilku odmian alotropowych, m.in. w odmianie rombowej i jednosko nej.
3.
Jeden z gazów szlachetnych odkryty przez W. Ramsaya i M.W.Traversa w 1898r. Nazwa
tego pierwiastka pochodzi od greckiego „kryptos” – skryty.
4.
Jeden z gazów szlachetnych stosowany głównie do napełniania arówek oraz lamp
jarzeniowych daj cych czerwone wiatło. Jego nazwa pochodzi od greckiego „neos” – nowy.
5.
Jedyny niemetal, który w warunkach normalnych jest ciecz .
METALE:
6.
Srebrzystobiały metal, pal cy si charakterystycznym o lepiaj cym płomieniem. Wchodzi
w skład chlorofilu – zielonego barwnika ro lin.
7.
Ciemnoszary metal stosowany jako włókno arzeniowe w arówkach elektrycznych. Jego
w glik o wzorze WC ma twardo zbli on do diamentu.
8.
Bardzo aktywny, mi kki metal. Z wod reaguje gwałtowniej ni sód. Jego łaci ska nazwa
to „kalium”.
9.
Do najwa niejszych rud tego metalu nale : magnetyt, hematyt i piryt.
10.
Metal szlachetny, o małej aktywno ci chemicznej. Roztwarza si w wodzie królewskiej.
Stosowany w jubilerstwie.
11.
Metal, le cy w drugiej grupie układu okresowego pierwiastków. Jego zwi zki stosowane
s do wyrobu ogni sztucznych i rakiet sygnalizacyjnych, gdy barwi płomie na intensywny
czerwony kolor.
12.
Metal b d cy bardzo dobrym przewodnikiem elektryczno ci – znalazł zastosowanie
do produkcji przewodów elektrycznych. Ma charakterystyczn pomara czow barw .
Wyszukiwarka
Podobne podstrony:
3 etap 2006 solutions
Etap rejonowy 2006 2007 arkusz
Etap wojewódzki 2006 2007
Łamigłówki liczbowe 2006 - 2007- Etap II, ĆWICZENIA OGÓLNOUSPRAWNIAJĄ, Matematyka, Łamigłówki liczbo
Etap szkolny 2005-2006, GEOGRAFIA, olimpiada woj. podlaskie
Etap wojewódzki 2006 2007 klucz
Etap rejonowy 2006 2007 klucz
Etap rejonowy 2006 2007 klucz
Etap szkolny 2006 2007
Etap wojewódzki 2005-2006, GEOGRAFIA, olimpiada- woj. małopolskie
Etap rejonowy 2006 2007
Olimpiada o Polsce i swiecie wspolczesnym etap okregowy 2006, Wiedza o społeczeństwie
Czerwiec 2006 Technik Ochrony Środowiska - Etap Praktyczny
Etap rejonowy 2006 2007 arkusz
Etap rejonowy 2005-2006, GEOGRAFIA, olimpiada woj. podlaskie
ETAP PISEMNY CZERWIEC 2006
9 BUUE PB Etap II 2006 PRZETWARZANIE 2007 III 01
Olimpiada Wiedzy o Polsce i Swiecie Wspolczesnym etap szkolny 2006, Wiedza o społeczeństwie
Lamigłówki liczbowe 2006 - 2007- Etap I, ĆWICZENIA OGÓLNOUSPRAWNIAJĄ, Matematyka, Łamigłówki liczbo
więcej podobnych podstron