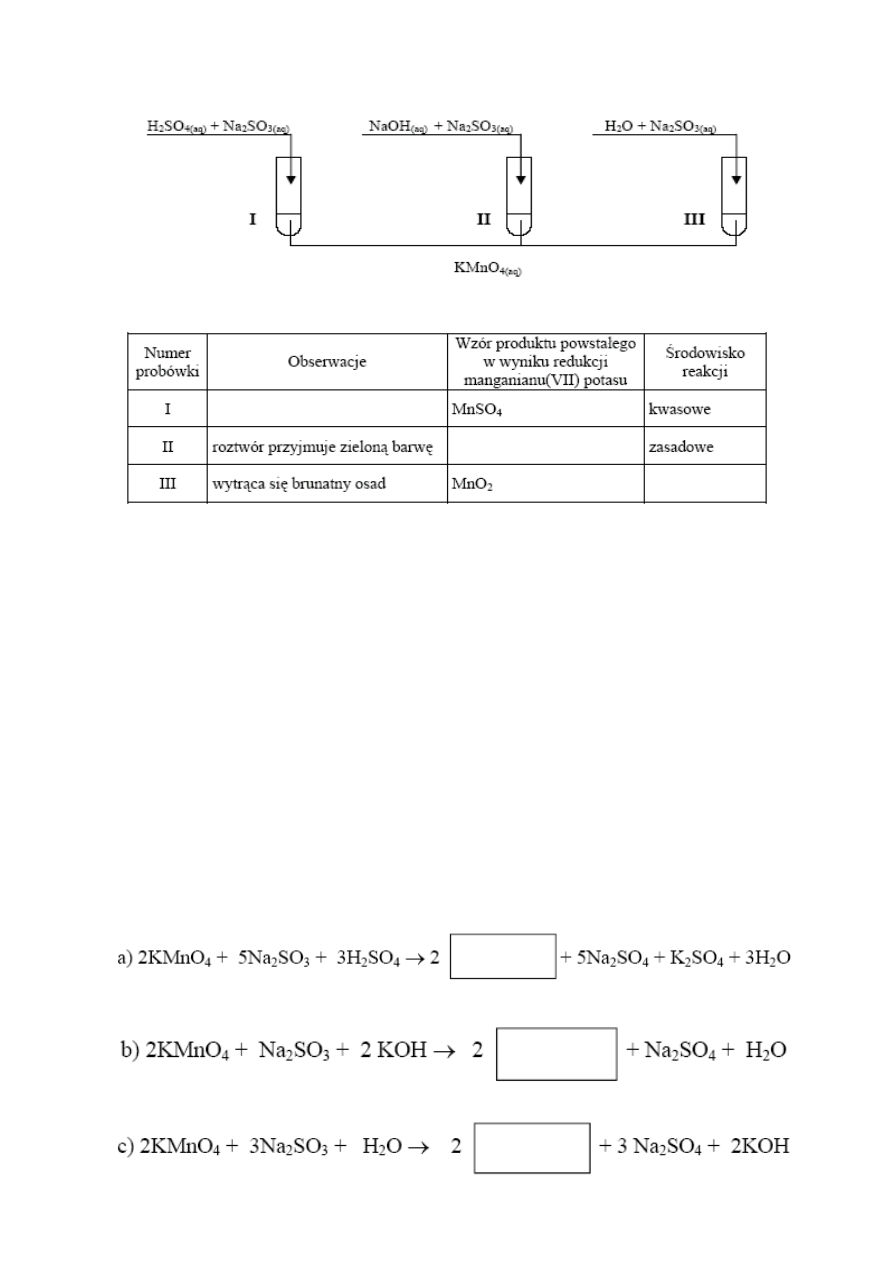
Zad: 1
Na VII stopniu utlenienia mangan tworzy manganiany (VII), które mają silne właściwości utleniające.
Manganiany (VII), w zależności od środowiska, redukują się do związków manganu (II), manganu (IV) lub
manganu (VI).
Przeprowadzono doświadczenie przedstawione na poniższym schemacie
Uzupełnij poniższą tabelę, wpisując w puste miejsca obserwacje dokonane podczas tego doświadczenia,
wzór produktu powstałego w wyniku redukcji manganianu (VII) potasu lub środowisko reakcji.
Zad: 2
W laboratorium przeprowadzono następujące doświadczenie: Do zlewki zawierającej kilka cm
3
bezbarwnej
cieczy dodano kilka cm
3
wodnego roztworu KMnO
4
, a następnie kilka cm
3
wodnego roztworu Na
2
SO
3
.
Zaobserwowano odbarwienie powstałego roztworu.
Napisz, czy znajdująca się w zlewce przed rozpoczęciem doświadczenia bezbarwna ciecz to była
woda, wodny roztwór kwasu, czy roztwór zasady.
Uzasadnij swoją odpowiedź, pisząc równanie reakcji w formie skróconej jonowej.
Współczynniki uzgodnij metodą bilansu elektronowego.
Zad: 3 Przeprowadzono trzy reakcje manganianu(VII) potasu z siarc
zanem(IV) sodu odpowiednio w środowisku
kwaśnym, zasadowym i obojętnym. Uzupełnij poniższe równania, podając wzór związku manganu, który powstał w
tej reakcji. Podaj obserwacje, jakie towarzyszyły każdej z reakcji.

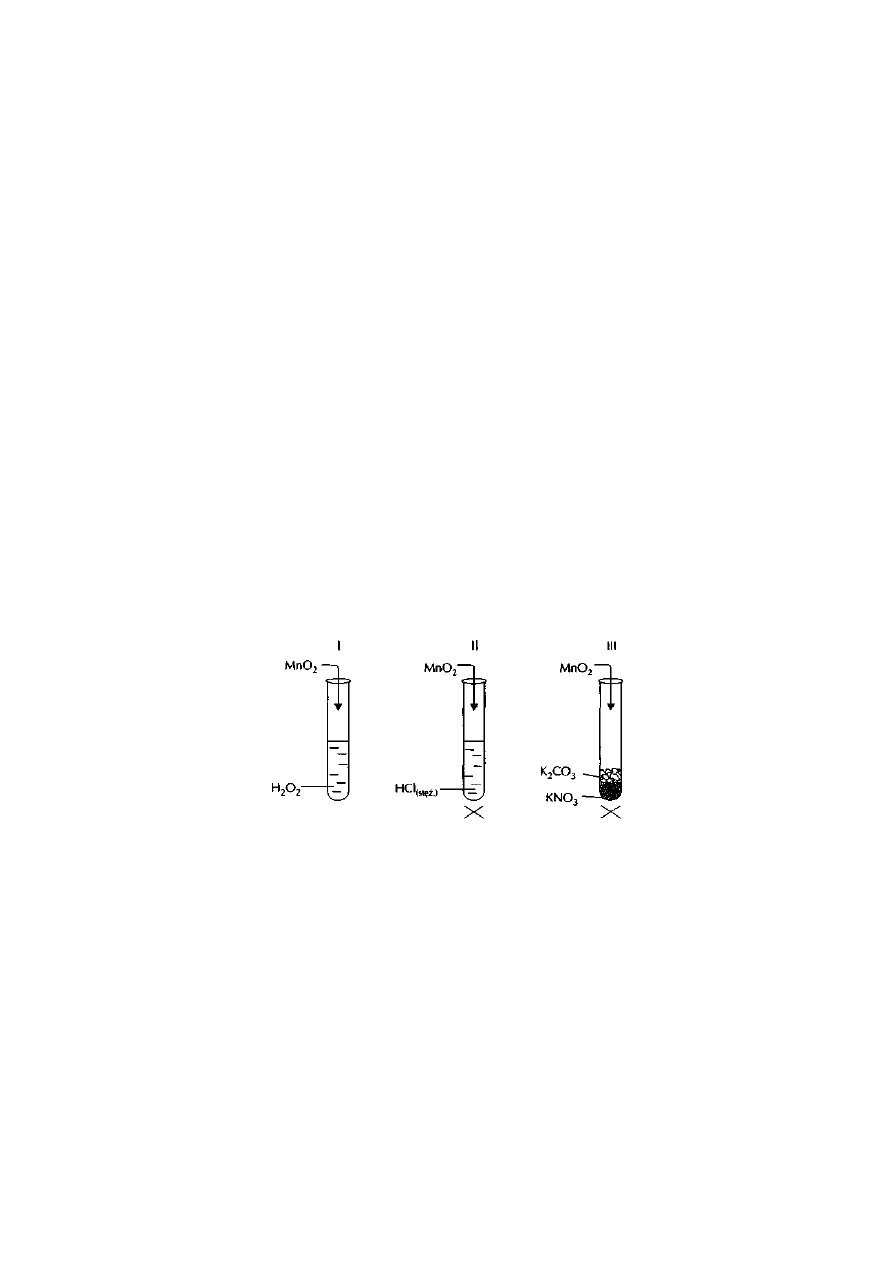
Zad: 4 Przeprowadzon
o doświadczenie według poniższego schematu, stosując roztwory wymienionych substancji:
Zaobserwowano, że bezpośrednio po wykonaniu doświadczenia powstał biały osad, który po chwili zaczął
przyjmować brunatne zabarwienie.
Zapisz wnioski wynikające z podanych obserwacji.
Zapisz odpowiednie równania reakcji w formie cząsteczkowej.
Informacja do zadania 5.
Chlor można otrzymać działając kwasem solnym na tlenek manganu(IV). W reakcji tej oprócz chloru
powstaje chlorek manganu(II) oraz woda.
Zad: 5
Napisz równanie opisanej reakcji chemicznej. Dobierz współczynniki metodą bilansu elektronowego.
Zad: 6
Posługując się niżej narysowanym zestawem uczeń otrzymywał w laboratorium chlor. Podpisz substancje
chemiczne
, których użył w doświadczeniu.
Metodą równań połówkowych uzgodnij równanie reakcji:
wskaż utleniacz:
wskaż reduktor:
zmiana barwy towarzysząca reakcji: „w trakcie reakcji ...................... roztwór ....................................... „
Zad: 7
Równaniami reakcji wykaż charakter chemiczny MnO
2
.
Zad: 8 Podczas dodawania roztworu Na
2
SO
3
do wodnego roztworu KMnO
4
następuje:
a) zmętnienie wskutek wydzielania wolnej siarki,
b) odbarwienie w rezultacie powstawania Mn
2+
,
c) wytrącanie brunatnego osadu,
d) zabarwienie roztworu na kolor zielony,
e) zmia
na pH roztworu z obojętnego na zasadowy.
Zad: 9
Uzgodnij metodą bilansu elektronowego utlenienie alkoholu etylowego do odpowiedniego kwasu za
pomocą manganianu (VII) potasu w środowisku obojętnym. Wskaż utleniacz i reduktor oraz opisz objawy reakcji
chemicznej:
Informacja do zadań 11 i 12
Na schematycznym rysunku przedstawiono wykonane na lekcji doświadczenie:
Zad: 11
Określ rolę tlenku manganu(IV) w tych reakcjach:
utleniacz ..........
reduktor ...........
katalizator ........
Zad: 12
Ułóż, równania reakcji, które zaszły w poszczególnych probówkach:
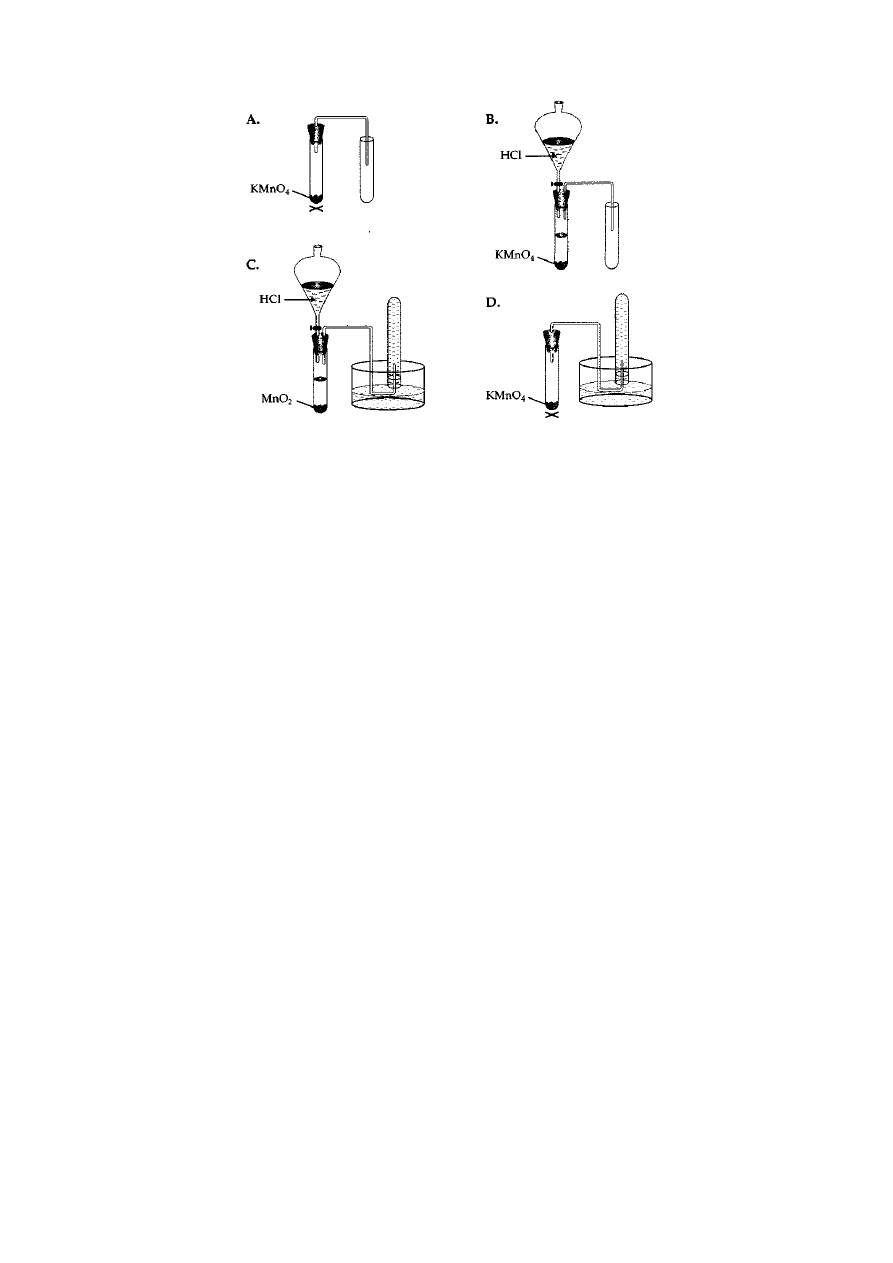
Zad: 13
Wskaż rysunek prawidłowo ilustrujący zestaw, który można wykorzystać w pracowni chemicznej do
otrzymywania i zbierania tlenu?
Zad: 14
Podczas pewnego doświadczenia barwa roztworu manganianu(VII) potasu ulega zmianie z
różowofioletowej na zieloną. Na tej podstawie można stwierdzić, że:
a. mangan uległ redukcji z VII na VI stopień utlenienia,
b. mangan ule
gł utlenieniu z VII na VI stopień utlenienia,
c. mangan uległ redukcji z VII na IV stopień utlenienia,
d. niemożliwa jest zmiana barwy z fioletowej na zieloną.
Zad: 17 Wybierz met
ody służące do laboratoryjnego otrzymywania tlenu:
A. skraplanie powietrza,
B. termiczny rozkład manganianu(VII) potasu,
C. reakcja sodu z wodą.
D. Dwie odpowiedzi są poprawne.
Zad: 18
Do probówki, zawierającej roztwór manganianu(VII) potasu, wprowadzono heksen. Roztwór odbarwił
się, a w probówce pojawił się brunatny osad. Na podstawie doświadczenia wnioskujesz, że:
A) nastąpiła redukcja jonów MnO
4
do Mn
2+
B) nastąpiło utlenienie jonów MnO
4
do MnO
2
C) nastąpiła redukcja jonów MnO
4
do MnO
2
D) nastąpiła redukcja jonów MnO
4
do MnO
4
2
.
Wyszukiwarka
Podobne podstrony:
10Promieniotwórczość zadania do lekcji nr 2
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
07 5 Prawa elektrolizy zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 3
05 4 Iloczyn rozpuszczalności zadania do lekcji nr 1
więcej podobnych podstron