Zadanie 1.
Do srebrzenia przedmiotów metalowych stosuje się proces elektrolizy. W celu pokrycia stalowego klucza
warstwą srebra należy go podłączyć do odpowiedniego bieguna elektrolizera, podczas gdy do drugiego bieguna
przyłączona jest elektroda platynowa. Elektrolizer zawiera roztwór AgNO
3
.
Oblicz czas elektrolizy, jeżeli po przepuszczeniu prądu o natężeniu 2A na kluczu osadziła się warstwa
srebra o masie 1 grama.
Zadanie: 2
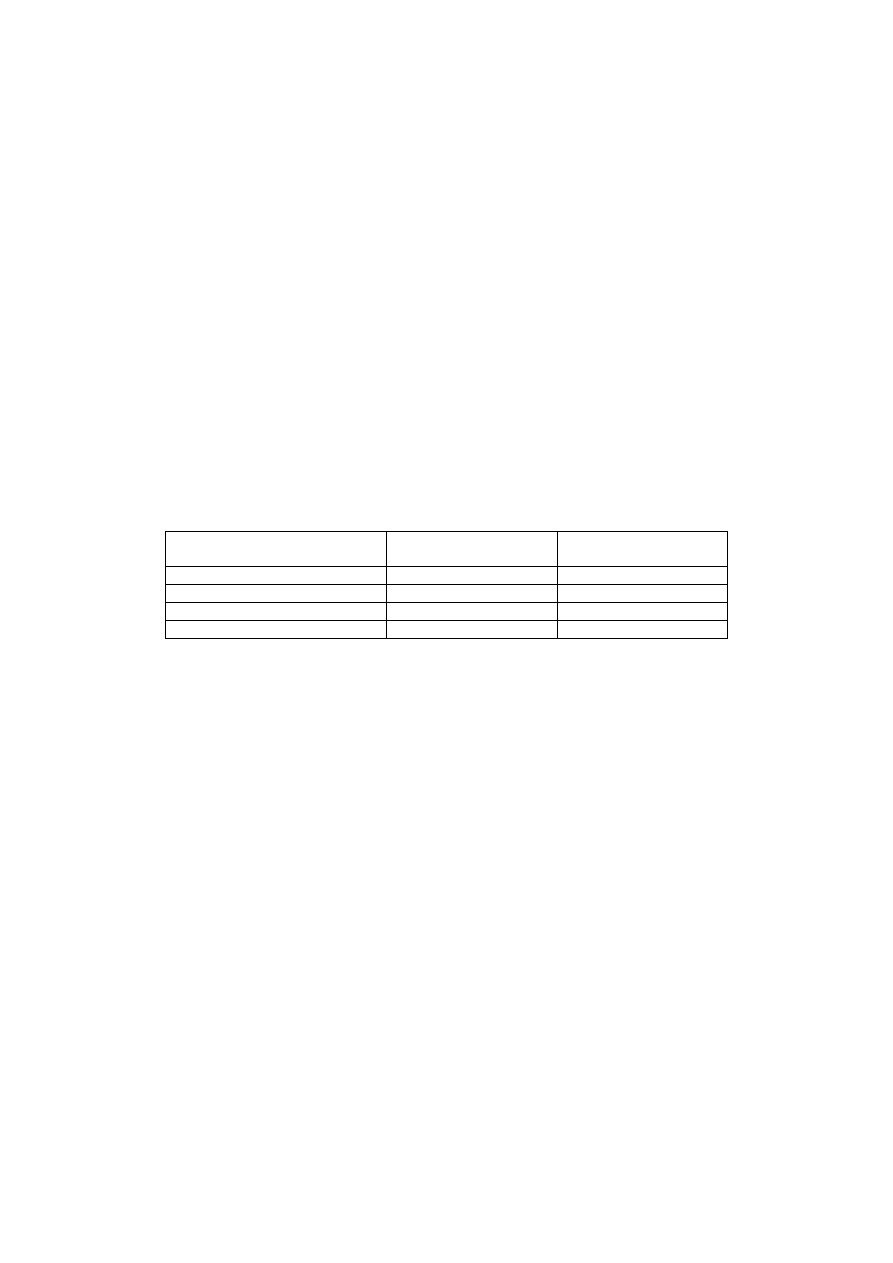
Wiedząc, że przez roztwory podanych niżej substancji przepłynął ładunek 2F określ rodzaj i ilość moli
produktów elektrodowych
Substancja chemiczna
Ilość i rodzaj produktu
katodowego
Ilość i rodzaj produktu
anodowego
r-r wodny chlorku miedzi (II)
r-r wodny kwasu azotowego (V)
r-r wodny siarczanu (VI) potasu
stopiony wodorek sodu
Zadanie 3.
Prąd o natężeniu 2 A przepuszczono przez roztwór azotanu(V) srebra(l), aby przedmiot metalowy pokryć
warstwą srebra o masie 2,7 g. Oblicz czas potrzebny do posrebrzenia przedmiotu.

Zadanie 4.
Określ wielkość ładunku (w faradajach), jaki powinien przepłynąć przez wodny roztwór zawierający 2 mole
FeCI
3
i 2,5 mola FeCI
2
, aby całe żelazo uległo redukcji.
Zadanie 5.
Podczas elektrolizy stopionego chlorku miedzi(II) na katodzie wydzieliło się 32,75 g miedzi. Chlor, który w
tym samym czasie wydzielił się na anodzie w warunkach normalnych, zajmuje objętość:
A.22,4dm
3
B. 11,2 dm
3
C. 33,6 dm
3
D.44,8dm
3
Zadanie 6.
W trzech elektrolizerach znajdują się kolejno roztwory: ZnCl
2
, Na
2
SO
4
, CuSO
4
. Elektrolizery te połączone
są szeregowo, a płynący przez nie prąd stały wywiązuje w drugim elektrolizerze 0,5 g wodoru. Ile gramów Zn i Cu
wydzieli się w pozostałych elektrolizerach?
Zadanie 7.
Przez wodny roztwór AgNO
3
przepuszczono prąd elektryczny. W ciągu 10 minut na katodzie wydzieliło się
3 g Ag. Jakie było natężenie prądu elektrycznego?

Zadanie 8.
Do rozcieńczonego roztworu AgNO
3
włożono płytkę miedzianą o masie 2,5 g. Po pewnym czasie płytkę
wyjęto z roztworu, oczyszczono z osadu srebra, a następnie zważono. Masa płytki wynosiła 1,7 g. Ile gramów
srebra wydzieliło się w tej reakcji?
Zadanie 9.
Podczas elektrolizy wodnego roztworu CuSO
4
na katodzie wydzieliło się 3,2 g miedzi. Jaki gaz wydzielił się
na anodzie i jaką zajął objętość w warunkach normalnych?
Wyszukiwarka
Podobne podstrony:
07 4 FOLIA Prawa elektrolizy zadania do lekcji nr 1
05 4 FOLIA Procesy elektrolizy zadania do lekcji nr 1
01 3 Zachowanie metali w roztworach elektrolitów zadania do lekcji nr 2
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
05 5 Procesy elektrolizy zadania do lekcji nr 2
07 4 Chrom i jego związki zadania do lekcji nr 2
5Konfiguracja elektronowa atomów zadania do lekcji nr 2
07 4 Folia Reguła przekory zadania do lekcji nr 1
6Konfiguracja elektronowa atomów zadania do lekcji nr 3
4Konfiguracja elektronowa atomów zadania do lekcji nr 1
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
więcej podobnych podstron