
Zadanie: 1
Do niebieskiego, wodnego roztworu soli miedzi wrzucono żelazny gwóźdź i odstawiono na pewien czas.
Opisz zmiany zachodzące w wyglądzie:
roztworu
żelaznego gwoździa
Zadanie 2.
Przeprowadzono następujące doświadczenie:
Wyjaśnij przebieg tego doświadczenia.
Zadanie: 3
Zadanie: 4
Zadanie 5.
Wybierz zdanie prawdziwe.
A.
Sód (Na) reaguje z wodą.
B. W reakcji srebra (Ag) z ZnCl
2
wydzieli się cynk (Zn).
C.
Złoto (Au) jest bardziej aktywne chemicznie niż potas (K).
D.
W reakcji złota (Au) z kwasem siarkowym(VI) wydzieli się wodór.
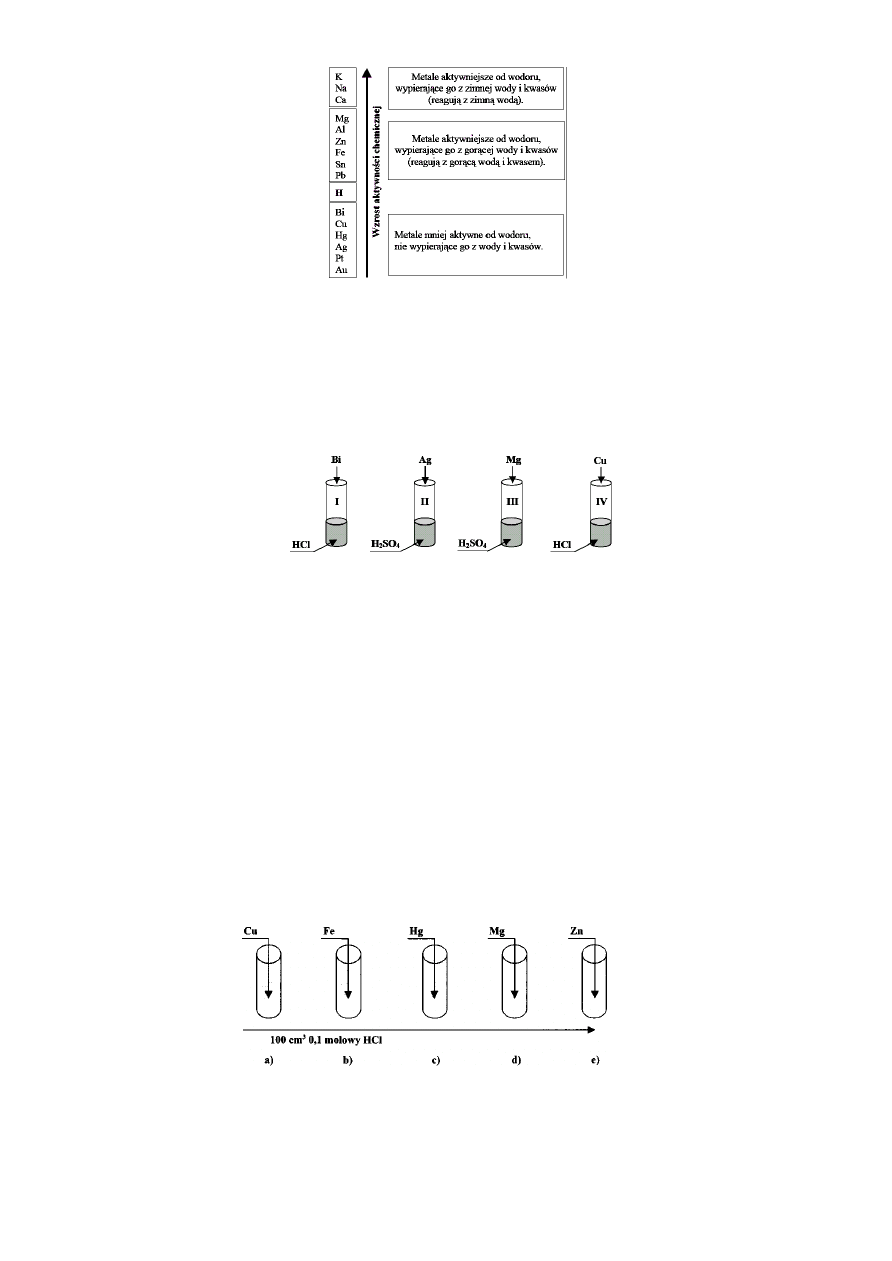
Zadanie 6.
Przeprowadzono doświadczenia przedstawione na poniższym rysunku.
W której probówce jednym z produktów reakcji jest wodór?
A.
I
B. II
C. III D. IV
Zadanie 7.
Masz do dyspozycji: blaszkę cynkową, blaszkę miedzianą, roztwór siarczanu(VI) miedzi(II), roztwór
siarczanu(VI) cynku.
Zaproponuj doświadczenie, w którym porównasz aktywność miedzi i cynku. W tym celu:
a) przedstaw schematyczny rysunek doświadczenia,
b) opisz przewidywane obserwacje,
c) napisz, w formie jonowej, równanie(-a) zachodzącej(-ych) reakcji,
d) sformułuj wniosek wynikający z tego doświadczenia.
Zadanie 8.
Do pięciu probówek zawierających jednakowe ilości kwasu solnego wrzucono po 0,01 mola metali.
W których probówkach zaobserwowano wydzielanie gazu:
Gaz wydzielał się w probówce(kach): .................
Ogólne jonowe równanie metalu (Me) z kwasem nie posiadającym własności utleniających ma
postać: ......................................................
w reakcji(ach) użyto:
a) nadmiar kwasu solnego,
b) niedomiar kwasu solnego,
c) reagenty zmieszano w stosunku stechiometrycznym

Zadanie 9.
Na szybkość korozji konstrukcji metalowych zasadniczy wpływ ma charakter roztworu elektrolitu.
W związku z tym najszybciej będzie korodował wyrób metalowy, jeśli elektrolit będzie zawierał:
a) utleniacz w środowisku kwaśnym w podwyższonej temperaturze,
b) reduktor w środowisku kwaśnym w podwyższonej temperaturze,
c) utleniacz w środowisku zasadowym w niskiej temperaturze,
d) reduktor w środowisku zasadowym w podwyższonej temperaturze.
Zadanie 10.
Podcz
as działania kwasem solnym na 10 gramów stopu żelaza z miedzią wydzieliło się w przeliczeniu na warunki
normalne 2,24 dm
3
odpowiedniego gazu. Oblicz zawartość procentową miedzi w stopie.
Zadanie 11.
Stopione metale reagują ze sobą tworząc związki chemiczne, jak np. CuZn
3
, Ca
3
Sb
2
.
Te związki nazywane są:
a)
roztworami stałymi,
b) związkami międzymetalicznymi,
c) połączeniami wewnątrzsieciowymi,
d) stopami.
Zadanie 12.
Uzgodn
ij równania reakcji lub zaznacz, że nie biegną:
a) ....Zn + ...Bi
3+
b) ....Mn
2+
+ Ag
c) ....Cr + ....Cu
2+
d) ….Ni
2+
+ ….Al
Dla podanych form jonowych zaproponuj formy cząsteczkowe.
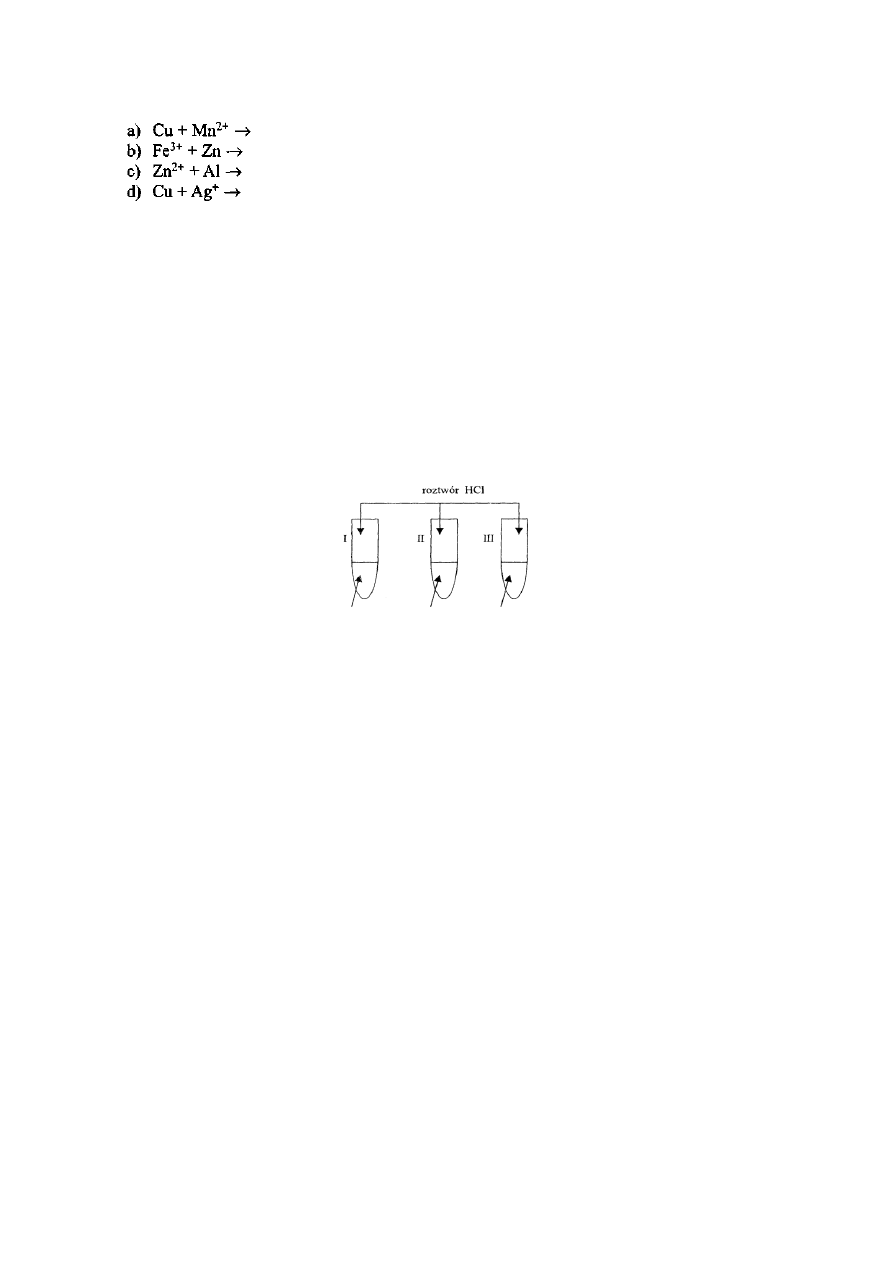
Zadanie 13.
Uzgodnij równania reakcji lub zaznacz, że reakcja nie zachodzi:
Dla reakcji, które zachodzą zaproponuj odpowiednią formę cząsteczkową:
Zadanie: 14
Zapisz w formie cząsteczkowej odpowiednie równania reakcji chemicznych lub zaznacz, że reakcja nie
zachodzi:
Al Cu Zn
Zadanie: 15
W roztworze siarczanu(VI) miedzi(II) zanurzono gwóźdź żelazny o masie 5g.
Po pewnym czasie gwóźdź wyjęto, opłukano i osuszono. Jego masa wynosiła 4,44g.
Zapisz równanie reakcji w formie jonowej skróconej:
Oblicz ile gramów miedzi wydzieliło się na gwoździu:
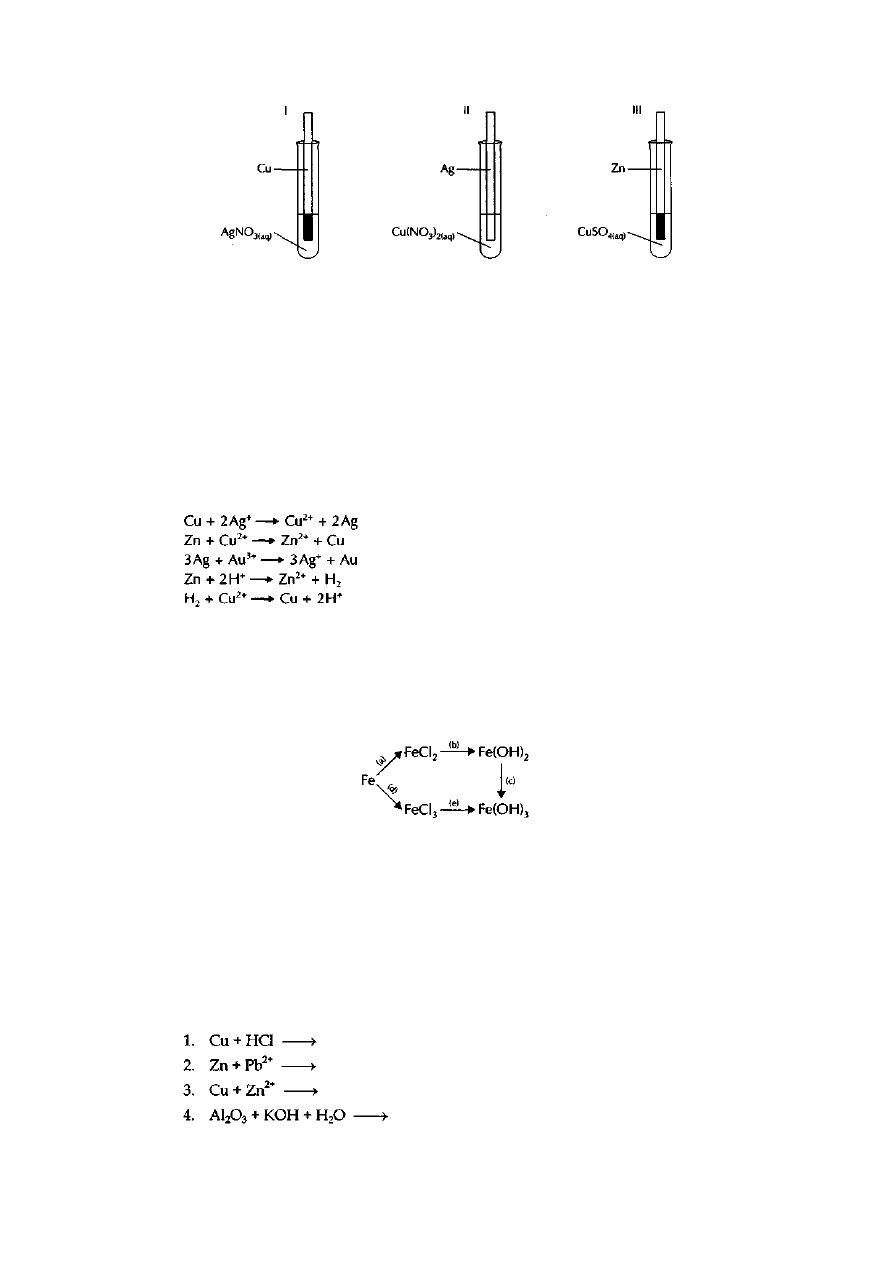
Zadanie 16.
Przeprowadzono doświadczenie przedstawione za pomocą rysunku:
Podaj obserwacje, sformułuj wniosek dotyczący porównania reaktywności użytych metali
ułóż równania odpowiednich reakcji w formie jonowej.
Zadanie 17.
Wykorzystując podane równania reakcji redoks uszereguj pierwiastki według malejącej reaktywności.
Zadanie 18.
Ułóż równania reakcji (w formie cząsteczkowej) przedstawionych za pomocą schematu:
Zadanie 19.
Do podanych poniżej substratów dopisz produkty reakcji lub zaznacz, że przemiana nie zachodzi.

Zadanie 20.
Zaprojektuj doświadczenie, w którym wykażesz, który metal jest bardziej aktywny: cynk czy nikiel.
W tym celu narysuj schematyczny rysunek doświadczenia, napisz obserwacje oraz sformułuj wniosek.
Zadanie 21.
Zaproponuj dwie metalowe powłoki ochronne na wyrób stalowy (podaj ich symbole chemiczne), które
nawet po uszkodzeniu tworzą korzystne dla żelaza mikroogniwa.
Zadanie 22.
Stalowy przedmiot narażany na zarysowanie i znajdujący się w warunkach sprzyjających korozji najlepiej
chronić przed zniszczeniem, nakładając powłokę z...
A. Zn.
B. Cu.
C. Ni.
D. Sn.
Zadanie 23.
Przeprowadzono dwa doświadczenia:
I doświadczenie.
Do probówki z roztworem azotanu(V) srebra wrzucono drut miedziany.
II doświadczenie.
Do probówki z roztworem siarczanu(VI) miedzi(II) wrzucono kawałek srebra.
Następnie zapisano obserwacje z przeprowadzonych doświadczeń:
Obserwacje z doświadczenia I:
Drut miedziany w roztworze AgNO
3
pok
rył się szarym nalotem, a roztwór zabarwił się na kolor niebieski.
Obserwacje z doświadczenia II:
Srebro umieszczone w roztworze soli miedzi nie zmieniło się. Nie widać objawów reakcji.
Wytłumacz zachowanie metali (Cu i Ag) wobec roztworów soli innych metali na przykładzie przeprowadzonego
doświadczenia i napisz odpowiednie równanie reakcji.
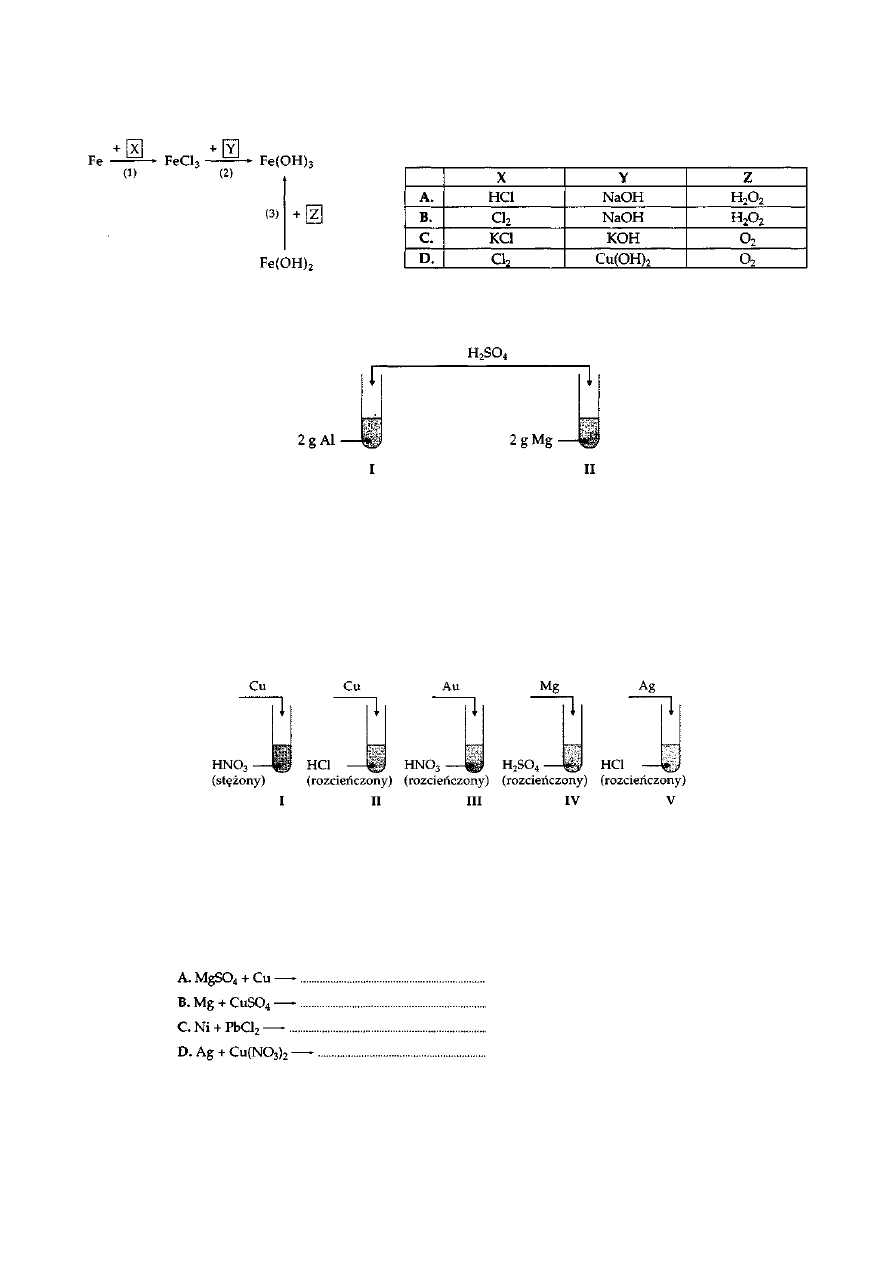
Zadanie 24.
Wskaż, których substancji należy użyć do reakcji, aby otrzymać produkty zaznaczone na poniższym
chemografie.
Zadanie 25.
Przeprowadzono doświadczenie przedstawione na schemacie:
Do obu probówek wsypano Mg i Al o jednakowym stopniu rozdrobnienia, a następnie dodano H
2
SO
4
o tym
samym stężeniu.
Napisz, czy szybkość reakcji będzie w obu probówkach jednakowa? Odpowiedź uzasadnij.
Oblicz objętości wodoru wydzielonego w probówce I i w probówce II podczas opisanego
doświadczenia.
Zadanie 26.
Poniżej w formie schematów przedstawiono kilka doświadczeń:
W której probówce nie zajdzie reakcja?
A. III, IV, V
B. II, IV, V C. I, II, III D. II, III, V
Zadanie 27.
Poniżej podano niedokończone schematy reakcji chemicznych. Na podstawie szeregu elektrochemicznego
metali napisz równania reakcji lub zaznacz, że reakcja nie zachodzi.
Wyszukiwarka
Podobne podstrony:
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
07 5 Prawa elektrolizy zadania do lekcji nr 2
05 4 FOLIA Procesy elektrolizy zadania do lekcji nr 1
07 4 FOLIA Prawa elektrolizy zadania do lekcji nr 1
05 5 Procesy elektrolizy zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
01 4 Reakcje egzo i endoenergetyczne zadania do lekcji nr 1
5Konfiguracja elektronowa atomów zadania do lekcji nr 2
01 3 Stopień i stała dysocjacji prawo rozcieńczeń Ostwalda zadania do lekcji nr 2
05 7 Stężenie procentowe roztworów zadania do lekcji nr 3
05 7 Stężenie procentowe roztworów zadania do lekcji nr 4
01 3 Stopnie utlenienia zadania do lekcji nr 1
10 5 Stężenie molowe roztworów zadania do lekcji nr 2
6Konfiguracja elektronowa atomów zadania do lekcji nr 3
05 7 Stężenie procentowe roztworów zadania do lekcji nr 5
4Konfiguracja elektronowa atomów zadania do lekcji nr 1
06 4 Mangan i jego związki zadania do lekcji nr 2
więcej podobnych podstron