
Zad: 1
Oblicz wartość pH dla 0,001 molowego roztworu HCl
Zad: 2
Oblicz stężenie jonów wodorowych jeżeli wartość pH wynosi 5
Zad: 3
Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H
2
SO
4
Zad: 4
Wartość pH roztworu wynosi 12. Oblicz jakie jest stężenie:
a) jonów wodorowych
b) jonów wodorotlenowych
Zad: 5
Oblicz stężenie niezdysocjowanego kwasu octowego w wodnym roztworze o stężeniu 0,1
mol/dm
3
,
jeśli pH tego roztworu wynosi 3.
Zad: 6 Do 200g 5% NaOH dodano 500cm
3
0,5 molowego roztworu kwasu solnego.
Jaki jest odczyn otrzymanego roztworu.
Odpowiedź uzasadnij odpowiednimi obliczeniami.
Zadanie 7
Określ odczyn roztworów dla podanych niżej wartości pH.
a) pH = 4 odczyn .......................................................................
b) pH = 9 odczyn .......................................................................
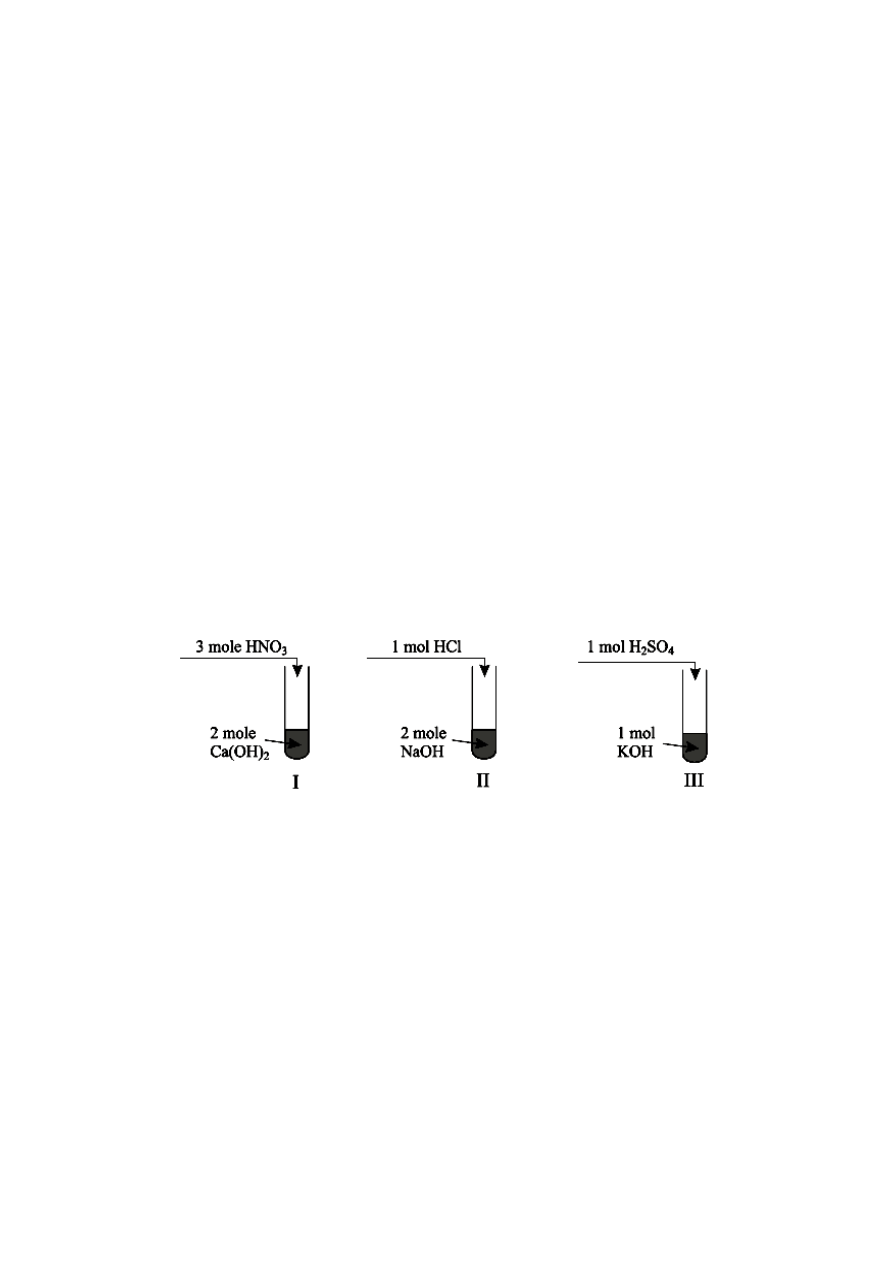
Zadanie 8
Wykonano doświadczenie, podczas którego do roztworów zawierających wodorotlenki
metali dodano roztwory różnych kwasów.
Określ odczyn każdego z otrzymanych roztworów, jeżeli ilości użytych reagentów były takie, jak
podano na powyższym rysunku. Odpowiedź uzasadnij słownie.

Zadanie 9
Oblicz jaką objętość 0,2 molowego roztworu NaOH należy dodać do 10cm
3
0,2 molowego
roztworu HCl, aby doprowadzić do końcowego pH = 3.
Zadanie 10 (1 pkt)
Stężenie jonów wodorowych w osoczu krwi jest wielkością stałą i wynosi [H+] 10
-7,4
mol/dm
3
.
Jaki jest odczyn osocza krwi.
Zadanie 11 (2 pkt.)
Oblicz stężenie molowe jonów H
+
w roztworze HF o stężeniu 0,1 mol/dm
3
i stopniu d
ysocjacji α = 10%.
Jakie pH ma ten roztwór?
Zadanie 12. (2 pkt)
Podaj wartość pH i pOH roztworu NaOH o stężeniu 0,001 mol/dm
3
w temperaturze 25
o
C, jeśli
stopień dysocjacji α = 100%.

Zadanie 13. ( 4 pkt)
Przygotowano roztwór kwasu azotowego(V) o stężeniu 0,01mol/dm
3
.
1. Oblicz stężenie jonów azotanowych(V) w roztworze.
2. Oblicz pH tego roztworu.
3. Określ, czy w celu zwiększenia pH badanego roztworu, należy do niego dodać pastylkę NaOH,
czy parę kropli stężonego HNO
3
. Odpowiedź uzasadnij.
Zadanie: 14 (3 pkt.)
Oblicz pH 0,005 molowego roztworu wodorotlenku wapnia
Zadanie: 15 ( 1 pkt.)
Wskaż jaką substancję i w jakiej ilości należy dodać do 1dm
3
1 molowego roztworu wodorotlenku
baru aby pH na końcu wynosiło 7.
a) 1dm
3
1,5 molowego kwasu solnego
b) 0,5 dm
3
2 molowego kwasu azotowego(V)
c) 0,5 dm
3
1 molowego kwasu azotowego (V)
d) 2 dm
3
1 molowego kwasu solnego

Zadanie: 16 (4 pkt.)
Oblicz pH roztworu otrzymanego po zmieszaniu 0,5dm
3
roztworu kwasu solnego o pH 3 z 1 dm
3
roztworu tego kwasu o pH równym 5.
Informacja do zadania 17. i 18.
W poniższej tabeli podano wartości oraz ocenę pH opadów deszczowych
W pewnym regionie Polski pobrano próbkę wody deszczowej i przeprowadzono jej analizę.
Stwierdzono, że stężenie obecnych w niej jonów wodorowych wynosi 0,00001 mol·dm
–3
.
Zadanie 17. (2 pkt)
Określ pH badanej wody. Korzystając z informacji przedstawionych w tabeli, podaj jego ocenę.
Wartość pH:
Ocena pH:
Zadanie 18. (1 pkt)
Oceń, jak zmieni się pH wody deszczowej w badanym regionie po zainstalowaniu urządzeń do
odsiarczania gazów kominowych w elektrociepłowni, w której jako paliwa używano węgla kamiennego.
Zadanie 19. (3 pkt)
W temperaturze 25ºC zmierzono pH wodnego roztworu słabego jednoprotonowego kwasu o
stężeniu 0,1 mol·dm
–3
. Wynosiło ono 4. Oblicz stałą dysocjacji tego kwasu w temperaturze 25ºC.

Zadanie 20. (6 pkt)
Do 19,44 grama wody dodano 0,56 grama KOH. Oblicz stężenie procentowe otrzymanego
roztworu:
pH tak otrzymanego roztworu wynosi (gęstość roztworu przyjmij za równą 1 g/cm
3
):
Zadanie 21. (4 pkt)
Zmieszano 1 dm
3
roztworu HCl o pH = 4 i 2 dm
3
roztworu KOH o pH = 12.
Jakie będzie pH roztworu otrzymanego po zmieszaniu? Odpowiedź uzasadnij.

Zadanie 22. (3 pkt)
Do 4 dm
3
wody wprowadzono gazowy chlorowodór o objętości 0,112 dm
3
, w przeliczeniu na
warunki normalne. Oblicz pH otrzymanego roztworu. W obliczeniach pomiń zmianę objętości roztworu
spo
wodowaną mieszaniem się tych substancji.
Zadanie 23. (3 pkt)
Oblicz pH roztworu amoniaku o stężeniu 0,05 mol/dm
3
, jeżeli stała dysocjacji zasadowej tego
związku wynosi K
b
= 1,8
10
5
.
Zadanie 24. (1 pkt)
Roztwór wodny NaOH ma stężenie 1•10
3
mol/dm
3
. Wskaż pH tego
roztworu.
A. 1,
B. 3,
C. 10,
D. 11.
Zadanie 25. (3 pkt.)
Woda chemicznie czysta ma
odczyn obojętny.
Podaj i uzasadnij,
jak zmienia się jej pH (rośnie, maleje) po wprowadzeniu do niej:
a) HBr,
b) NaH,
c) CuCI
2
.
Zadanie 26. (3 pkt.)
Benzenol dysocjuje zgodnie z równaniem:
a jego stała dysocjacji kwasowej wynosi K= 10
10
.
Oblicz
pH wodnego roztworu benzenolu o stężeniu 0,01 mol/dm
3
.
Zadanie 27. (1 pkt)
Badana próbka gleby wykazała odczyn zasadowy o pH = 10.
Określ stężenie jonów wodorotlenkowych w tej glebie.
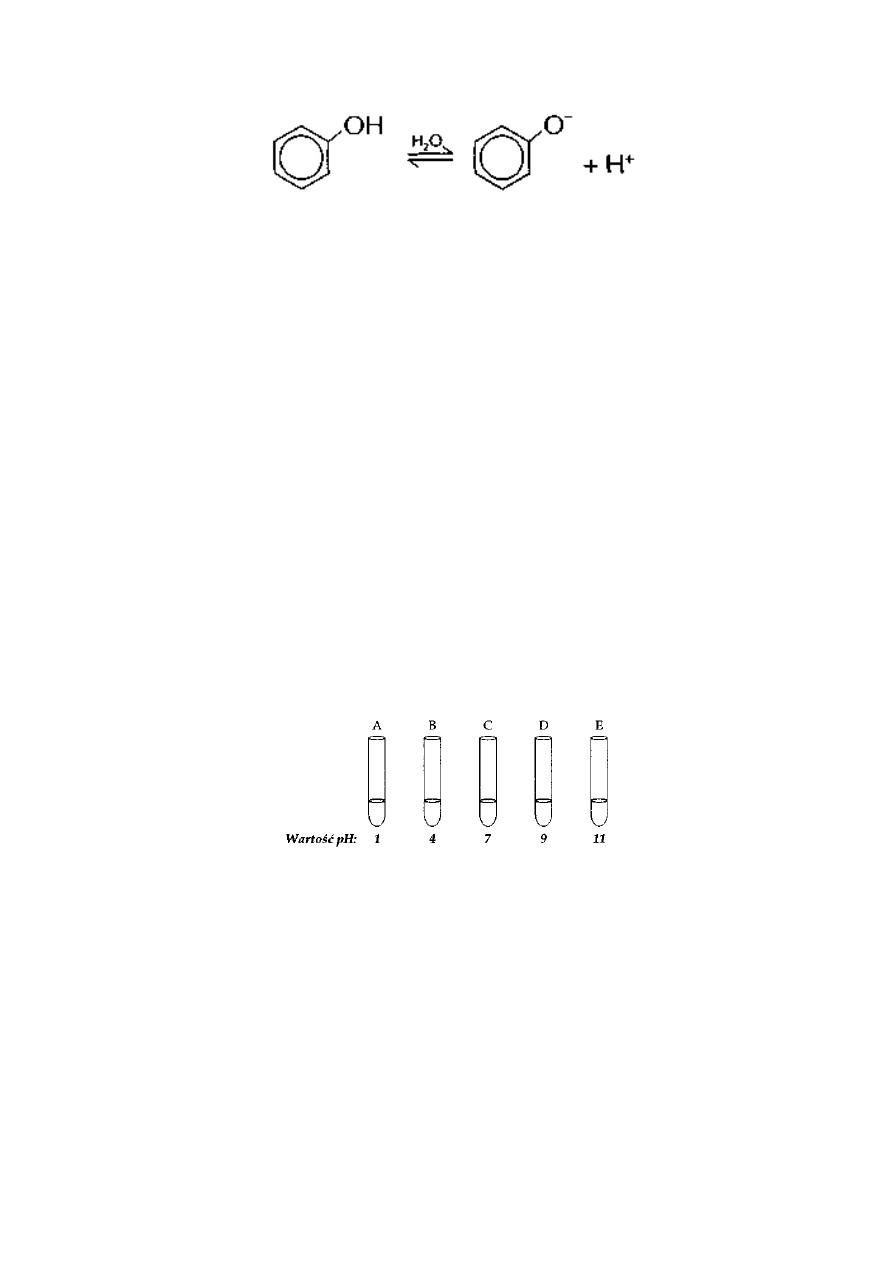
Zadanie 28. (2 pkt)
Określono pH pięciu roztworów. Roztwory te umieszczono w pięciu probówkach od A do E.
Wartości pH podano na rysunku.
Następnie w każdej probówce umieszczono papierek wskaźnikowy.
Zapisz obserwacje dla probówek B i E.
Zadanie 29. (4 pkt)
Oblicz pH roztworu kwasu azotowego (III) - HNO
2
o stężeniu 0,5 mol/dm
3
, jeżeli wiadomo, że
stała dysocjacji tego elektrolitu wynosi 2
10
4
.

Zadanie 30. (1 pkt)
Badania wykazały, że zawartość tlenku węgla(IV) w roztworze glebowym ma wpływ na odczyn
tego roztworu. Dane zestawiono w poniższej tabeli.
Jeśli zawartość CO
2
wynosi 0,5 mg/dm
3
to odczyn roztworu gleby jest...
A. lekko kwaśny.
B. silnie kwaśny.
C. obojętny.
D. zasadowy.
Zadanie 31. (4 pkt)
Zmieszano 100 cm
3
roztworu kwasu solnego o pH = 4 i 50 cm
3
roztworu wodorotlenku sodu o pH = 11.
Ust
al odczyn powstałego roztworu.
Zadanie 32. (2 pkt)
Napisz, jaki odczyn mają wodne roztwory substancji, jeśli na etykietach przytwierdzonych do
butelek z tymi substancjami widnieją napisy:
1. pH = 3
2. pH = 11
3. [H
+
] = [OH
-
]
4. [H
+
]<[OH
]
Zadanie 33. (3 pkt)
Do sześciu probówek zawierających wodę wprowadzono przedstawione na poniższych rysunkach
substancje: Następnie zbadano odczyn w każdej z probówek.
Napisz, w których probówkach (podaj ich numery) stwierdzono odczyn kwasowy, w których
obojętny, a w których zasadowy.

Zadanie 34. (2 pkt)
Oblicz, ile wynosi pH 0,01-molowego roztworu HCl.
Zadanie 35. (4 pkt)
Oblicz, ile gramów HNO
3
potrzeba do zobojętnienia mieszaniny zawierającej 5 g NaOH i 2 g
Ca(OH)
2
.
Zadanie 36. (3 pkt)
Oblicz pH roztwo
ru kwasu HX o stężeniu 0,05 mol/dm
3
, którego stała dysocjacji wynosi K
D
= 10
6
.

Zadanie 37. (1 pkt)
Sporządzono wodny roztwór amoniaku o stężeniu 0,0001 mol/dm
3
i stwierdzono, że pH tego
roztworu wynosi 8. Stężenie jonów OH
w tym roztworze wynosi:
A. 10
6
mol/dm
3
B. 10
4
mol/dm
3
C. 10
2
mol/dm
3
D. 1 mol/dm
3
Zadanie 38. (1 pkt)
Przyjmując, że kwas bromowodorowy jest całkowicie zdysocjowany, oblicz pH 0,001-molowego
roztworu tego kwasu.
A. 3
B. 2 C. 1 D. 11
Zadanie 39. (2 pkt)
Odczyn roztworu ma duże znaczenie w procesach fizjologicznych, rolnictwie itp. Można go
określić stosując skalę pH. Poniżej podano przykładowe roztwory różnych substancji i ich wartości pH.
Określ odczyny tych roztworów:
a) płyn do prania pH = 10,5 odczyn ................................................................................
b) mleko pH = 4,5 odczyn ...............................................................................................
c) ocet pH = 3 odczyn .....................................................................................................
d) piwo pH = 4,5 odczyn .................................................................................................
Zadanie 40. (5 pkt)
Do kolby zawierającej niewielką ilość wody wsypano 6,2 g Na
2
O. Po całkowitym roztworzeniu
tlenku dodano wody, uzyskując 0,5 dm
3
roztworu. W otrzymanym roz
tworze doświadczalnie wyznaczono
stężenie jonów wodorotlenkowych, które wynosi 0,38 mol/dm
3
.
a) Obli
cz stopień dysocjacji
tego roztworu.
b) Oblicz pH tego roztworu
Zadanie 41. (1 pkt)
W trzech probówkach umieszczono ten sam roztwór NaOH, a następnie do każdej z nich dodano
2 krople wskaźnika. Która odpowiedź prawidłowo podaje barwy tych wskaźników?

Zadanie 42. (4 pkt)
Oblicz, ile dm
3
3-molowego roztworu CH
3
COOH potrzeba do całkowitego zobojętnienia
mieszaniny zawierającej 0,5 mola KOH i 12,04 • 10
23
cząsteczek Ca(OH)
2
.
Zadanie: 1

Zadanie: 2
Zadanie: 3
Wyszukiwarka
Podobne podstrony:
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
01 3 FOLIA Zachowanie metali w roztworach wodnych elektrolitów zadania do lekcji nr 1
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 3
01 3 Zachowanie metali w roztworach elektrolitów zadania do lekcji nr 2
05 7 Stężenie procentowe roztworów zadania do lekcji nr 3
05 7 Stężenie procentowe roztworów zadania do lekcji nr 4
02 5 Rozpuszczalność zadania do lekcji nr 1
10 5 Stężenie molowe roztworów zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 4
05 7 Stężenie procentowe roztworów zadania do lekcji nr 5
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
więcej podobnych podstron