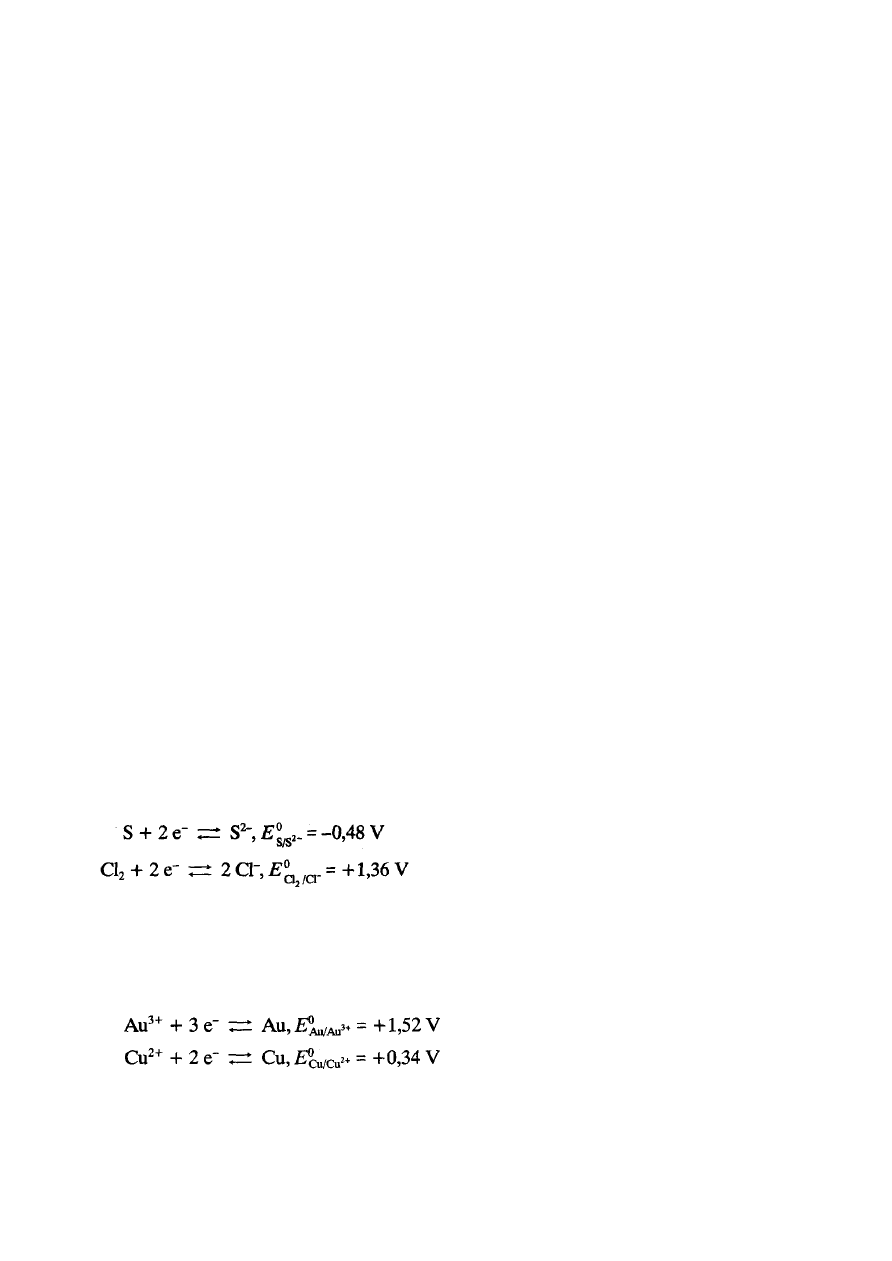
1.
Określ, w których wypadkach zajdą reakcje chemiczne, jeżeli blaszki cynkowe zanurzymy do roztworów soli:
1. Pb(NO
3
)
2
2. AgNO
3
3. MgSO
4
4. Al
2
(SO
4
)
3
5. HgCl
2
6. CuSO
4
Napisz równania jonowe dla poszczególnych reakcji:
2.
Czy Hg może wypierać Zn z roztworów jego soli ?
3.
Czy Ni może wypierać Sn z roztworów jej soli ?
4.
Napisz równania reakcji:
Ag + CuSO
4
Cu + 2AgNO
3
Sn + 2HCl
Ag + HCl
5.
Posługując się standardowymi potencjałami redoks, określ, który z metali jest mocniejszym reduktorem: stront
czy cynk.
E
Sr/Sr2+
=
2,90V
E
Zn/Zn2+
=
0,76V
6.
Posługując się standardowymi potencjałami redoks, określ, co jest mocniejszym utleniaczem: siarka
pierwiastkowa czy chlor pierwiastkowy
7.
Oceń, czy zajdzie reakcja opisywana równaniem:
Au
3+
+ Cu
.....

8.
Oceń, czy zajdzie reakcja opisywana następującym równaniem:
9.
Oceń, czy zajdzie reakcja opisywana równaniem:
J
eżeli:
10.
Oceń, czy zajdzie reakcja opisywana równaniem:
J
eżeli:
11.
W celu zbadania zachowania miedzi i cynku wobec wodnych roztworów soli wybranych metali
przeprowadzono doświadczenia przedstawione na poniższym rysunku.
1 Wykorzystując szereg elektrochemiczny metali, wskaż, w których probówkach badane metale nie
reagowały z roztworami soli i wyjaśnij dlaczego.
2 Napisz w formie jonowej skróconej równania zachodzących reakcji chemicznych.
12.
Korzystając z szeregu napięciowego metali wskaż, którego metalu (cynku czy cyny) należy użyć jako
protektora do ochrony stalowego (żelaznego) rurociągu przed korozją. Wybór krótko uzasadnij
Wyszukiwarka
Podobne podstrony:
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
01 3 Zachowanie metali w roztworach elektrolitów zadania do lekcji nr 2
05 4 FOLIA Procesy elektrolizy zadania do lekcji nr 1
07 4 FOLIA Prawa elektrolizy zadania do lekcji nr 1
07 5 Prawa elektrolizy zadania do lekcji nr 2
01 3 Stopień i stała dysocjacji prawo rozcieńczeń Ostwalda zadania do lekcji nr 2
05 5 Procesy elektrolizy zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
01 4 Reakcje egzo i endoenergetyczne zadania do lekcji nr 1
Folia Amfoteryczność wodorotlenków zadania do lekcji nr 1
5Konfiguracja elektronowa atomów zadania do lekcji nr 2
07 4 Folia Reguła przekory zadania do lekcji nr 1
05 7 Stężenie procentowe roztworów zadania do lekcji nr 3
08 2 FOLIA Właściwości związków azotu i siarki zadania do lekcji nr 1
05 7 Stężenie procentowe roztworów zadania do lekcji nr 4
więcej podobnych podstron