
1.
Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w
środowisku obojętnym
2.
W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B
4C wynosiła 6
[mol/dm
3
▪sek]. Szybkość zaniku substratu A była równa:
a) 6 [mol/dm
3
▪sek].
b) 12 [mol/dm
3
▪sek].
c)
3 [mol/dm
3
▪sek].
d)
12 [mol/dm
3
▪sek].
3. Reakcja: 2NO
2
+ H
2
N
2
O + H
2
O przebiega zgodnie z równaniem kinetycznym: v =k▪[NO]
2
▪[H
2
].
Jeżeli ciśnienie w zbiorniku reakcyjnym zmaleje 3 razy to szybkość tej reakcji:
a) zmaleje 3 razy
b) zmaleje 27 razy
c) wzrośnie 3 razy
d) wzrośnie 81 razy
4.
Jak zmieni się szybkość reakcji: 2 A + B C, przebiegającej zgodnie z równaniem kinetycznym v =
k [A]
2
[B], jeśli zwiększymy dwukrotnie stężenie substancji A i dwukrotnie zmniejszymy stężenie
substancji B?
A)
wzrośnie 8 razy
B) wzrośnie 2 razy
C) zmaleje 2 razy
D) zmaleje 4 razy
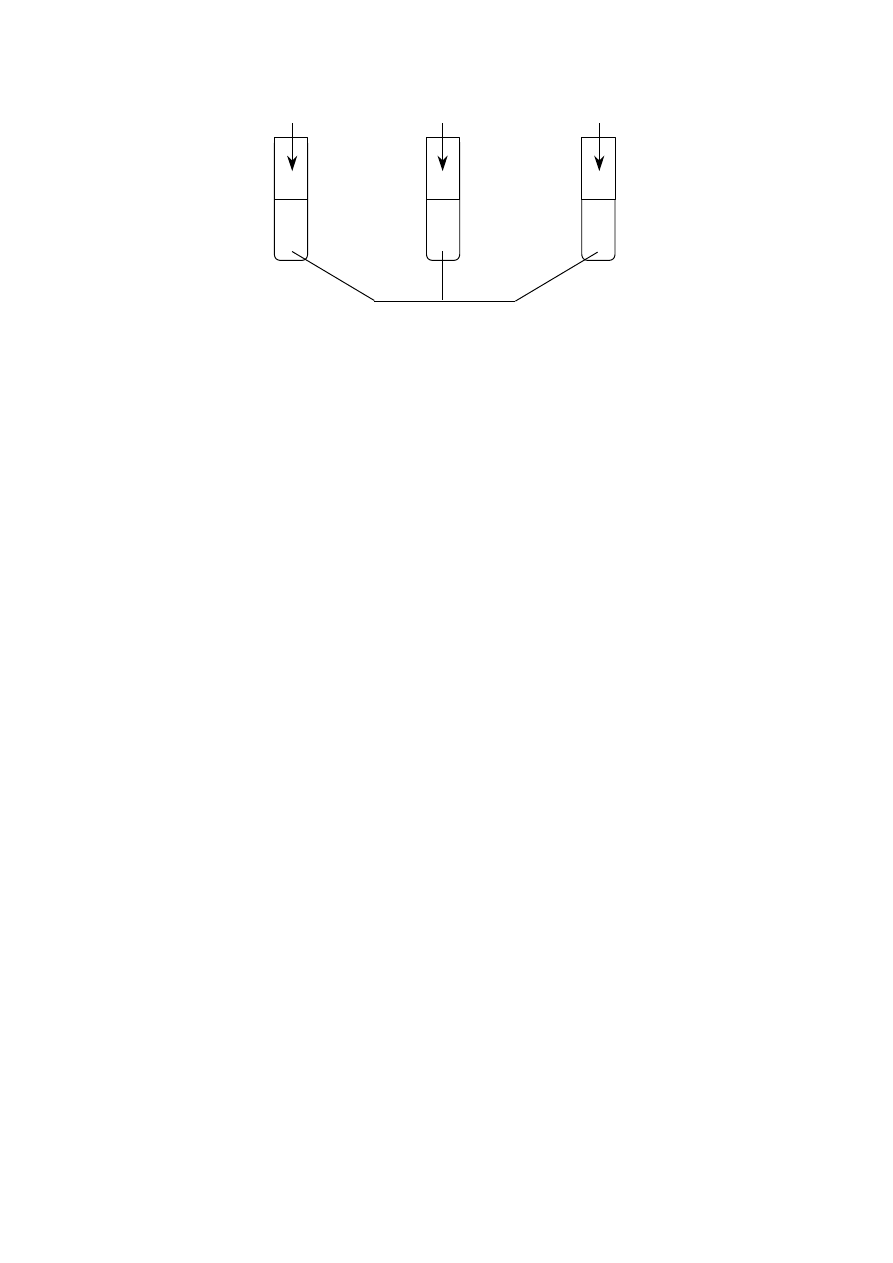
5.
Wykonano następujące doświadczenie:
0,5 g opiłków Mg
0,5 g wstążki Mg
0,5 g opiłków Mg
100 cm
3
0,5-molowego kwasu solnego
I.
II.
III.
W której probówce reakcja przebiegła najszybciej?
A. We wszystkich naczyni
ach reakcja przebiegła z jednakową szybkością.
B. Reakcja przebiegła najszybciej w naczyniu I.
C. Reakcja przebiegła najszybciej w naczyniu II.
D. Reakcja przebiegła najszybciej w naczyniu III.
6. Reakcja chemiczna: A + 3B
AB
3
przebiega według równania kinetycznego v = k[A][B]
3
.
Określ całkowity rząd tej reakcji oraz oblicz jak zmieni się szybkość tej reakcji jeżeli stężenie
substratu A zmniejszy się czterokrotnie i równocześnie stężenie substratu B zwiększymy dwukrotnie
7. Reakcja utleniania tlenku siarki(
IV) przebiega z udziałem katalizatora V
2
O
5
. Entalpia tej reakcji jest
mniejsza od zera. Narysuj wykres zmiany energii spalania tlenku siarki(IV) od biegu reakcji:
bez udziału katalizatora,
z udziałem katalizatora.

8.
Amoniak otrzymuje się w bezpośredniej syntezie z pierwiastków, zgodnie z równaniem
stechiometrycznym:
N
2(g)
+ 3H
2(g)
2NH
3(g),
a jej szybkość określa równanie kinetyczne: v = k[N
2
][H
2
]
3
Oblicz, jak zmieni się szybkość syntezy amoniaku, jeśli stężenie wodoru zwiększymy dwukrotnie.
Odpowiedź uzasadnij odpowiednimi obliczeniami.
9.
Badając wpływ różnych czynników na szybkość reakcji chemicznej przeprowadzono w tych samych
warunkach ciśnienia i temperatury dwa doświadczenia.
Doświadczenie I: Do 10 cm
3
kwasu solnego o stężeniu 20% dodano 1 gram wiórków magnezu.
Doświadczenie II: Do 10 cm
3
kwasu solnego o stężeniu 5% dodano 1 gram wiórków magnezu.
Podaj numer doświadczenia, w którym reakcja przebiegała szybciej i wskaż czynnik, który to
spowodował.
Numer doświadczenia: ........................
Czynnik: ...............................................
10.
Szybkość reakcji
wyraża się równaniem kinetycznym
Oblicz, jak zmieni się szybkość tej reakcji, jeżeli do przeprowadzenia procesu, przy niezmienionej
ilości reagentów, zastosuje się naczynie o trzykrotnie mniejszej objętości.
11.
Reakcja pomiędzy tlenkiem węgla i chlorem zachodzi według równania: CO + Cl
2
COCl
2
Stężenie tlenku węgla wynosi 0,4 mol/dm
3
, a chloru 0,2 mol/dm
3
. Jak zmieni się szybkość tworzenia
COCl
2
jeżeli zwiększy się stężenie chloru do 0,6 mol/dm
3
, a stężenie tlenku węgla do 0,4 mol/dm
3
.

12.
Reakcja biegnie zgodnie z równaniem kinetycznym: v = k • [a]
2
• [b]
1
• [c]
1/2
.
Określ, ile razy wrośnie lub zmaleje szybkość tej reakcji, gdy objętość fazy reakcyjnej zmaleje
dwukrotnie.
13. Pewna
reakcja przebiega zgodnie z równaniem: A + B
2C a jej równanie kinetyczne ma postać:
v = k[A] [B]
3
[C]
2
. Stężenie reagenta B i C zwiększono 3 razy, a stężenie reagenta A zmniejszono 2
razy.
Określ jak zmieni się szybkość reakcji.
14. Ustal, ile razy wzro
śnie szybkość reakcji 2NO + O
2
2NO
2
przebiegającej w stałej temperaturze
zgodnie z równaniem kinetycznym v = k
c
2
NO
c
o2
,
jeśli ciśnienie wzrośnie trzykrotnie.

15.
W układzie zamkniętym zachodzi reakcja: 2NO
(g)
+ O
2(g)
2NO
2(g)
której szybkość opisuje równanie
kinetyczne v=k
c
2
NO
c
O2
. Oblicz,
ile razy zwiększono w układzie ciśnienie, jeśli szybkość reakcji
wzrosła 125 razy przy zachowaniu stałej temperatury.
16.
Oblicz, jak zmieni się szybkość reakcji opisanej poniższym równaniem: 2NO + O
2
2NO
2
przeb
iegającej w stałej temperaturze, według równania kinetycznego: v = k • [NO]
2
[O
2
],
jeśli
dwukrotnie wzrośnie ciśnienie.

17.
Połącz w pary opisy doświadczeń umieszczone w kolumnie I z wynikami tych doświadczeń
znajdującymi się w kolumnie II.
18.
Zaprojektuj doświadczenie, w którym wykażesz, że rozdrobnienie substratów ma wpływ na szybkość
reakcji. W tym celu opisz doświadczenie, napisz przewidywane obserwacje i sformułuj wniosek.
19.
Czynnikiem, który ma wpływ na szybkość reakcji, jest...
A. barwa.
B. zapach.
C. smak.
D. stężenie.
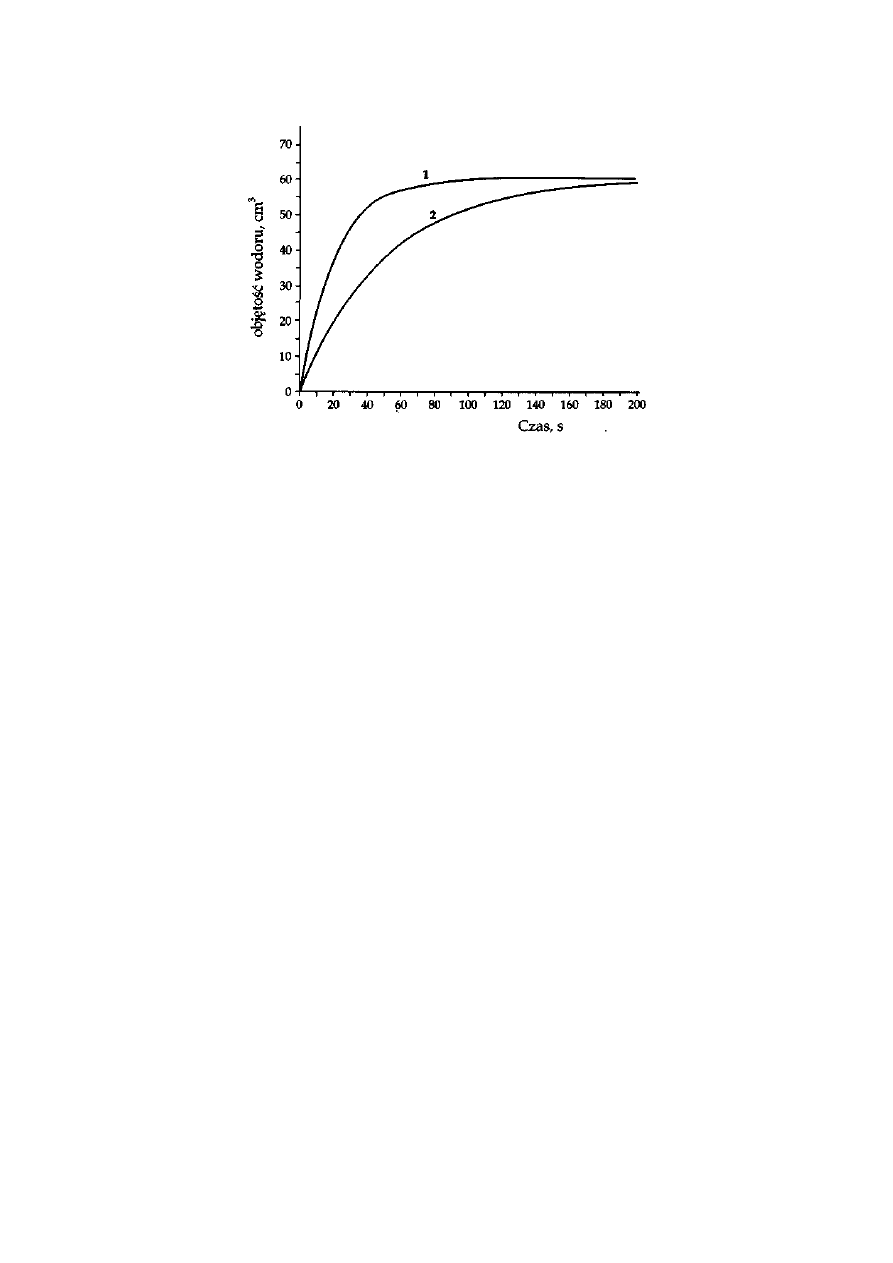
20.
Poniżej przedstawiono wykresy zależności objętości wydzielającego się wodoru od czasu przebiegu
reakcji w roztworach kwasu siarkowego(VI). Dotyczą one reakcji przeprowadzonych dla dwóch
różnych stężeń tego kwasu.
Na podstaw
ie analizy przebiegu krzywych napisz, który z wykresów (1 czy 2) przedstawia
zmianę objętości wydzielającego się wodoru w roztworze kwasu o większym stężeniu
molowym.
21.
Jak zmieni się szybkość reakcji tworzenia amoniaku: 3H
2
+ N
2
2NH
3
, przebiega
jącej wg równania
kinetycznego
v = k[H
2
]
3
• [N
2
]
,jeżeli:
stężenie obu substratów zwiększy się trzykrotnie –
objętość reagujących gazów zmniejszy się dwukrotnie –
ciśnienie zostanie dwukrotnie zwiększone –

22.
Reakcja zachodzi według następującego równania: 2NO + O
2
2NO
2
. Równanie kinetyczne dla tej
reakcji ma postać: v = k[NO]
2
• [O
2
]. Stężenia początkowe wynosiły:
C
NO
= 3 mol/dm
3
, c
O2
= 2
mol/dm
3
. Oblicz, jak zmieni się szybkość powyższej reakcji w stosunku do szybkości początkowej,
jeżeli stężenie NO zmniejszy się o 1 mol/dm
3
.
23. Reakcja 2SO
2
+ O
2
2SO
3
przebiega według równania kinetycznego v = k[SO
2
]
2
[O
2
].
Objętość
układu zwiększono 3-krotnie. Jak zmieni się szybkość tej reakcji?
A. wzrośnie 3 razy B. zmniejszy się 27 razy C. zmniejszy się 3 razy
D. nie zmieni się
24.
Zakładając, że szybkość reakcji chemicznych wzrasta dwukrotnie po ogrzaniu o 10°C, wskaż, jak
zmieni się szybkość pewnej reakcji, jeżeli zostanie ona przeprowadzona w temperaturze o 20°C
niższej.
A. 2 razy zmaleje B. 4 razy zmaleje C. 6 razy zmaleje D. 8 razy zmaleje
25.
Szybkość reakcji chemicznej nie zależy od:
A. katalizatora B. temperatury C. stałej równowagi reakcji D. energii aktywacji
Wyszukiwarka
Podobne podstrony:
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 3
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
01 4 Reakcje egzo i endoenergetyczne zadania do lekcji nr 1
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 1
02 5 Rozpuszczalność zadania do lekcji nr 1
02 5 Rozpuszczalność zadania do lekcji nr 4
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 2
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
07 4 Chrom i jego związki zadania do lekcji nr 2
10Promieniotwórczość zadania do lekcji nr 2
więcej podobnych podstron