Pobrano ze strony www.sqlmedia.pl
Pobrano ze strony www.sqlmedia.pl
dysleksja
MCH-R1A1P-062
EGZAMIN MATURALNY
Z CHEMII
Arkusz II
POZIOM ROZSZERZONY
Czas pracy 120 minut
Instrukcja dla zdaj
ącego
1. Sprawd
Ĩ, czy arkusz egzaminacyjny zawiera 14 stron
(zadania 28 – 56). Ewentualny brak zg
áoĞ przewodniczącemu
zespo
áu nadzorującego egzamin.
2. Rozwi
ązania i odpowiedzi zapisz w miejscu na to
przeznaczonym przy ka
Īdym zadaniu.
3. W rozwi
ązaniach zadaĔ rachunkowych przedstaw tok
rozumowania prowadz
ący do ostatecznego wyniku oraz
pami
Ċtaj o jednostkach.
4. Pisz czytelnie. U
Īywaj dáugopisu/pióra tylko z czarnym
tuszem/atramentem.
5. Nie u
Īywaj korektora, a báĊdne zapisy wyraĨnie przekreĞl.
6. Pami
Ċtaj, Īe zapisy w brudnopisie nie podlegają ocenie.
7. Mo
Īesz korzystaü z karty wybranych tablic chemicznych, linijki
oraz kalkulatora.
8. Wype
ánij tĊ czĊĞü karty odpowiedzi, którą koduje zdający.
Nie wpisuj
Īadnych znaków w czĊĞci przeznaczonej
dla egzaminatora.
9. Na karcie odpowiedzi wpisz swoj
ą datĊ urodzenia i PESEL.
Zamaluj
pola odpowiadaj
ące cyfrom numeru PESEL. BáĊdne
zaznaczenie otocz kó
ákiem
i zaznacz w
áaĞciwe.
ĩyczymy powodzenia!
ARKUSZ II
MAJ
ROK 2006
Za rozwi
ązanie
wszystkich zada
Ĕ
mo
Īna otrzymaü
áącznie
50 punktów
Wype
ánia zdający przed
rozpocz
Ċciem pracy
PESEL ZDAJ
ĄCEGO
KOD
ZDAJ
ĄCEGO
Miejsce
na naklejk
Ċ
z kodem szko
áy
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
2
Zadanie 28. (1 pkt)
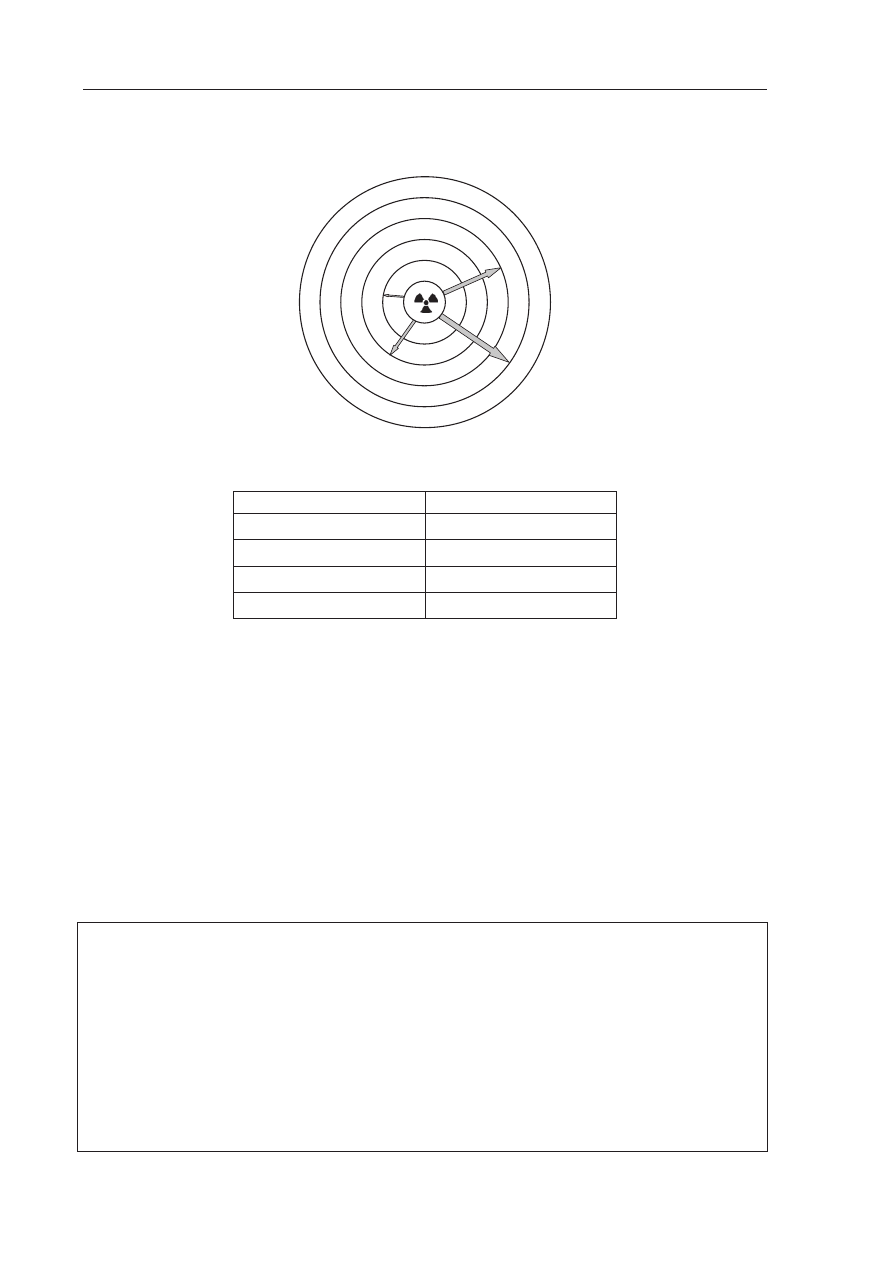
Poni
Īszy schemat przedstawia zdolnoĞü przenikania przez materiĊ róĪnych rodzajów
promieniowania jonizuj
ącego.
O
àÓW
ALUMINIUM
BETON
PAPIER
1
2
3
4
Wype
ánij poniĪszą tabelĊ, wpisując obok numeru ze schematu odpowiadający mu rodzaj
promieniowania (
Į, ȕ lub Ȗ).
Numer ze schematu
Rodzaj promieniowania
1
2
3
neutrony
4
Zadanie 29. (3 pkt)
Promieniotwórczy izotop w
Ċgla C-14 powstaje w górnych warstwach atmosfery i ulega
asymilacji przez ro
Ğliny w postaci tlenku wĊgla(IV). Równowaga, jaka siĊ ustala w procesach
od
Īywiania i oddychania w danym Ğrodowisku sprawia, Īe zawartoĞü wĊgla w organizmach
Īywych jest staáa. W przypadku obumarcia organizmu izotop C-14 przestaje byü uzupeániany
i z up
áywem czasu jego iloĞü w obumaráych szczątkach organizmu ulega zmniejszeniu
na skutek rozpadu promieniotwórczego.
Na podstawie: A. Czerwi
Ĕski, Energia jądrowa i promieniotwórczoĞü, Warszawa 1998
Ustal, wykonuj
ąc obliczenia, ile razy zmalaáa zawartoĞü izotopu wĊgla C-14 w drewnie,
które pochodzi z drzewa obumar
áego przed 11460 laty. Okres póátrwania tego izotopu
w
Ċgla wynosi 5730 lat.
Obliczenia:
Odpowied
Ĩ:
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
3
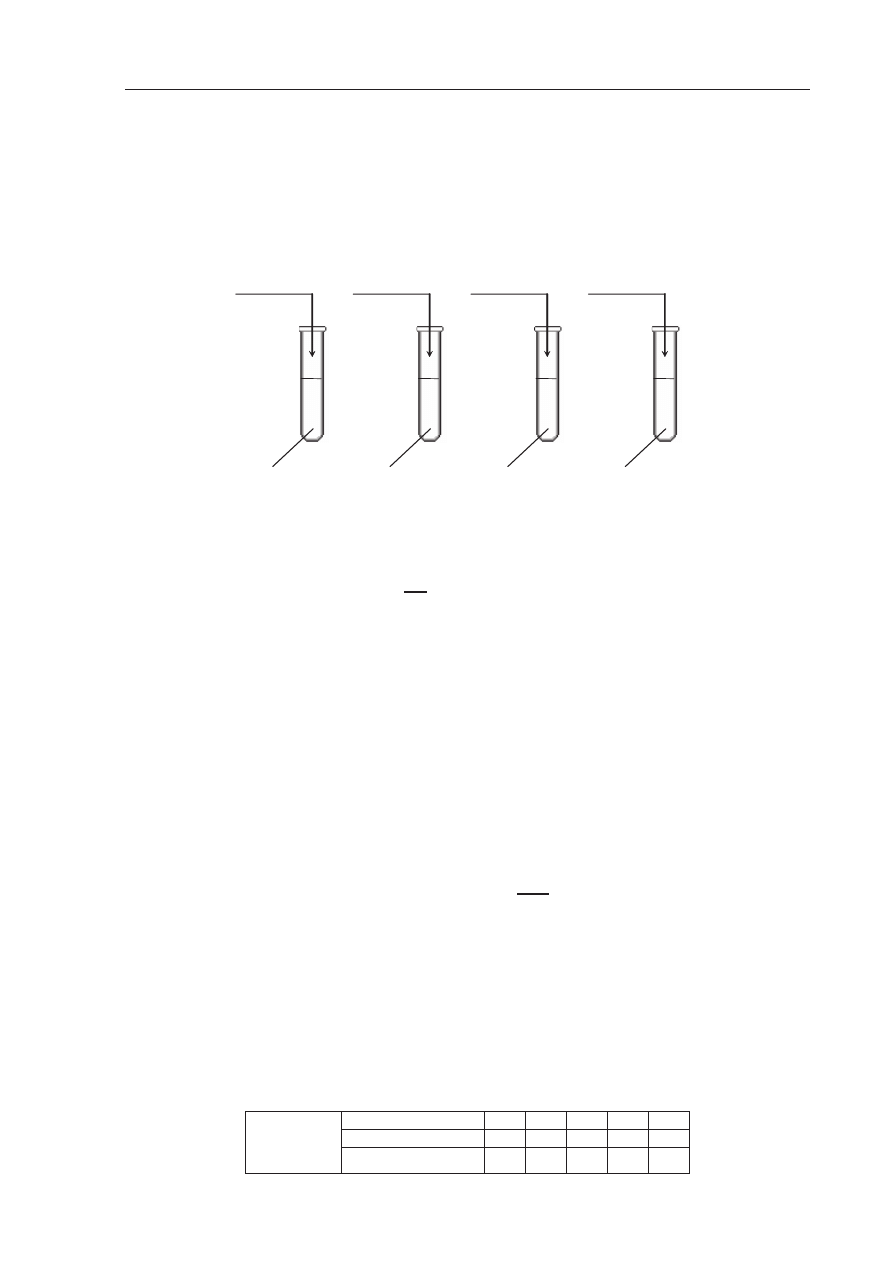
Zadanie 30. (2 pkt)
Do czterech probówek wlano po kilka cm
3
wody destylowanej, a nast
Ċpnie do probówki I
wsypano troch
Ċ chlorku wapnia, do probówki II – kilka krysztaáów sacharozy,
do probówki III wprowadzono troch
Ċ etanolu, a do probówki IV – odrobinĊ biaáka jaja
kurzego. Zawarto
Ğü kaĪdej probówki energicznie wymieszano.
chlorek wapnia
sacharoza
etanol
bia
áko jaja kurzego
woda
I
woda
II
woda
III
woda
IV
a) Podaj numer probówki, w której nie otrzymano roztworu w
áaĞciwego.
.......................................................................................................................................................
b) Nazwij metod
Ċ, za pomocą której moĪna wydzieliü sól znajdującą siĊ w probówce I.
.......................................................................................................................................................
Zadanie 31. (2 pkt)
Poni
Īej przedstawiono wzory sumaryczne dwóch nierozpuszczalnych w wodzie
wodorotlenków chromu.
Cr(OH)
2
Cr(OH)
3
Spo
Ğród podanych wzorów wybierz wzór tego wodorotlenku, który ma charakter
amfoteryczny. Napisz w formie jonowej skróconej dwa równania reakcji, które dowodz
ą
w
áaĞciwoĞci amfoterycznych wybranego wodorotlenku.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Nr zadania
28
29
30.1
30.2
31
Maks. liczba pkt
1
3
1
1
2
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
4
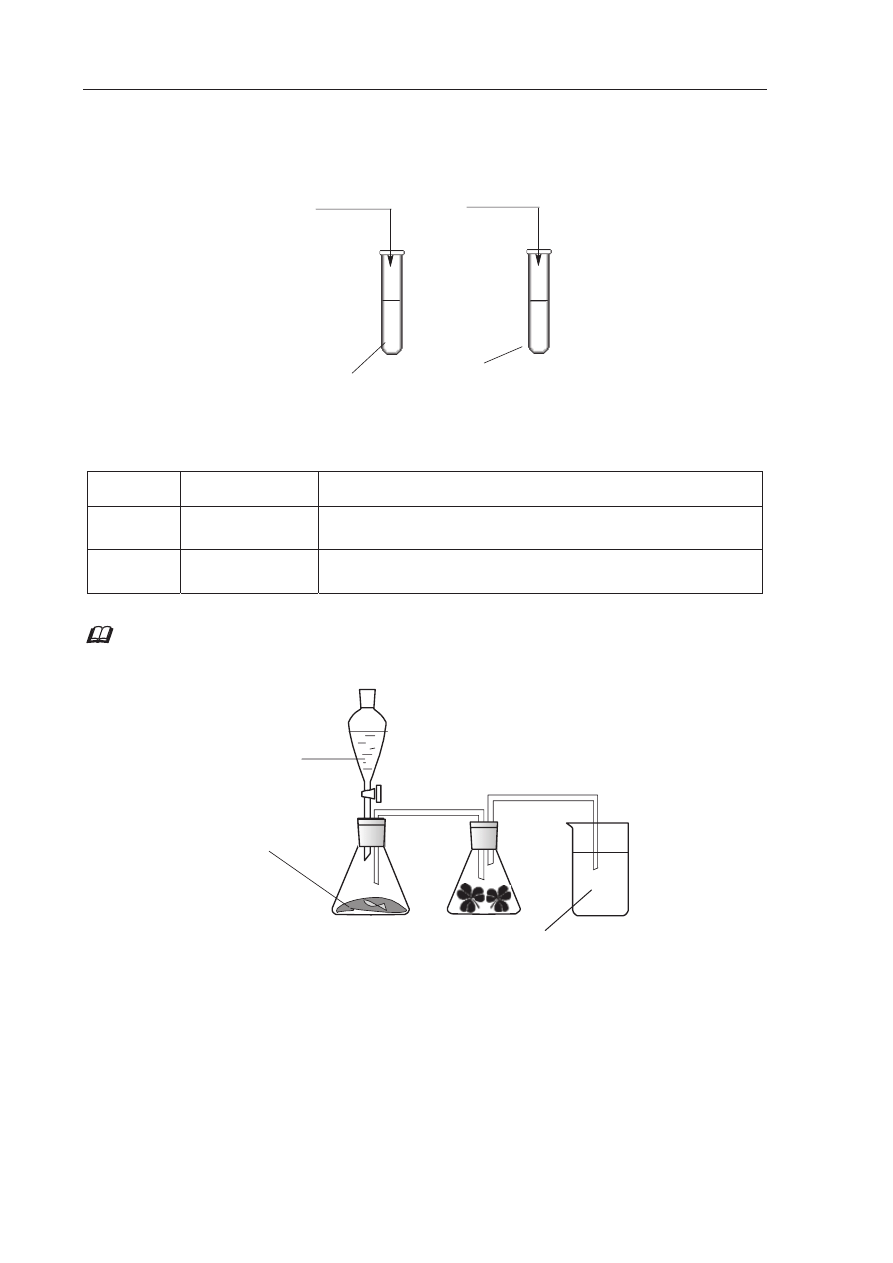
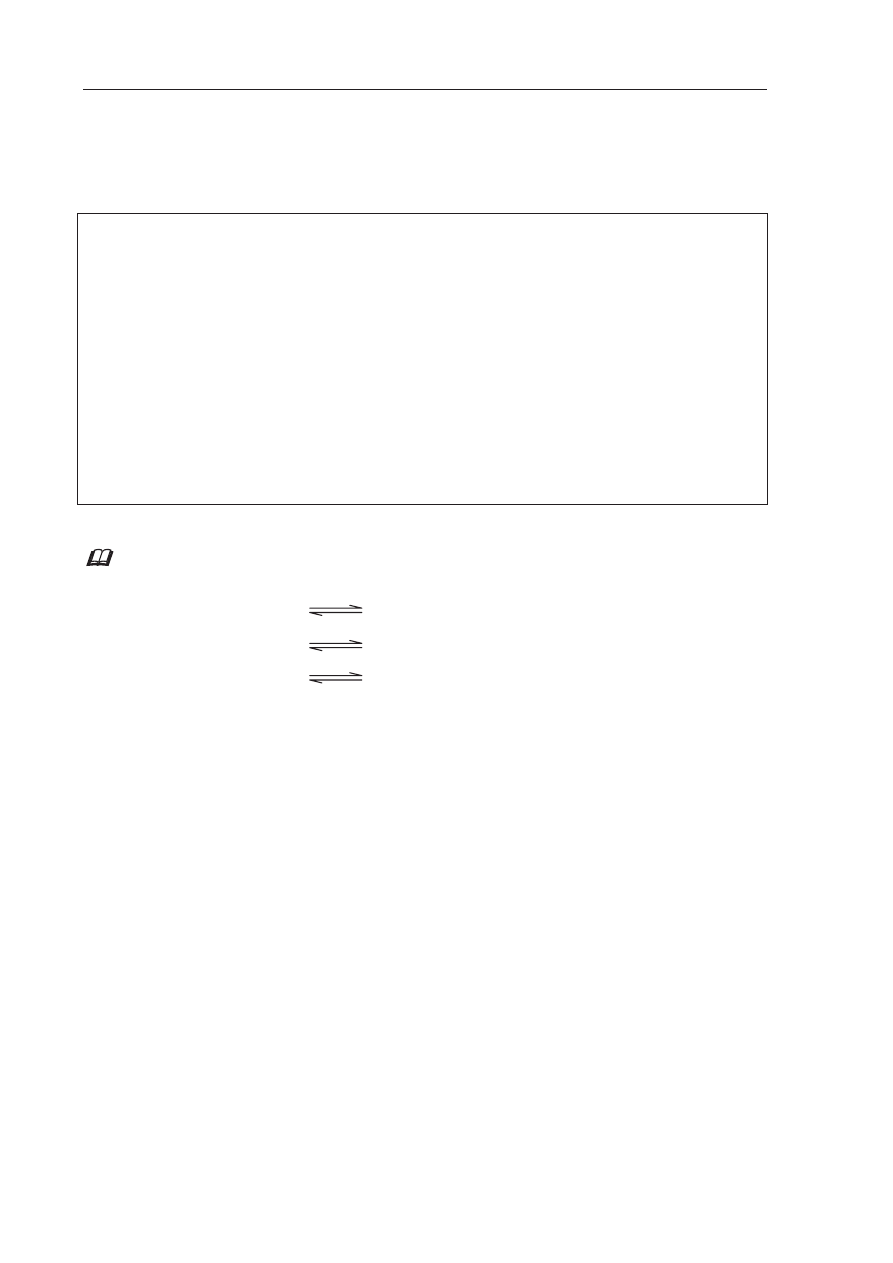
Zadanie 32. (2 pkt)
Przeprowadzono do
Ğwiadczenia, które ilustruje poniĪszy rysunek.
Na
2
S
(s)
H
2
O
I
II
H
2
O
ZnCl
2(s)
Podaj odczyn roztworów otrzymanych w obu probówkach. Odpowied
Ĩ uzasadnij, pisząc
w formie jonowej skróconej równania zachodz
ących reakcji.
probówka odczyn roztworu
równanie reakcji
I
II
Informacja do zadania 33. i 34.
Na poni
Īszym rysunku przedstawiono zestaw do otrzymywania tlenku siarki(IV) i badania
jego wp
áywu na roĞliny.
H
2
SO
4
Na
2
SO
3
NaOH
(aq)
Zadanie 33. (1 pkt)
Napisz w formie cz
ąsteczkowej równanie reakcji zachodzącej podczas otrzymywania
tlenku siarki(IV) przedstawion
ą wyĪej metodą.
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
5
Zadanie 34. (3 pkt)
Oblicz maksymaln
ą objĊtoĞü tlenku siarki(IV), jaka moĪe byü związana przez wodny
roztwór zawieraj
ący 3 mole wodorotlenku sodu w temperaturze 25ºC i pod ciĞnieniem
1013 hPa. Za
áóĪ, Īe produktem reakcji jest sól obojĊtna.
Warto
Ğü staáej gazowej R wynosi
mol
K
dm
hPa
1
,
83
3
.
Obliczenia:
Odpowied
Ĩ:
Informacja do zadania 35. i 36.
W poni
Īszej tabeli podano wartoĞci oraz ocenĊ pH opadów deszczowych.
pH
ocena pH opadów deszczowych
uwagi
poni
Īej 4,0
bardzo mocno obni
Īone
4,1 – 4,5
mocno obni
Īone
kwa
Ğne deszcze
4,6 – 5,0
lekko obni
Īone
5,1 – 6,0
normalne
6,1 – 6,5
lekko podwy
Īszone
Na podstawie: N. W. Skinder, Chemia a ochrona
Ğrodowiska, Warszawa 1995
W pewnym regionie Polski pobrano próbk
Ċ wody deszczowej i przeprowadzono jej analizĊ.
Stwierdzono,
Īe stĊĪenie obecnych w niej jonów wodorowych wynosi 0,00001 mol·dm
–3
.
Zadanie 35. (2 pkt)
Okre
Ğl pH badanej wody. Korzystając z informacji przedstawionych w tabeli, podaj
jego ocen
Ċ.
Warto
Ğü pH: .................................................................................................................................
Ocena pH: ....................................................................................................................................
Zadanie 36. (1 pkt)
Oce
Ĕ, jak zmieni siĊ pH wody deszczowej w badanym regionie po zainstalowaniu
urz
ądzeĔ do odsiarczania gazów kominowych w elektrociepáowni, w której jako paliwa
u
Īywano wĊgla kamiennego.
.......................................................................................................................................................
Nr zadania
32
33
34
35
36
Maks. liczba pkt
2
1
3
2
1
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
6
Zadanie 37. (3 pkt)
W temperaturze 25ºC zmierzono pH wodnego roztworu s
áabego jednoprotonowego kwasu
o st
ĊĪeniu 0,1 mol·dm
–3
. Wynosi
áo ono 4.
Oblicz sta
áą dysocjacji tego kwasu w temperaturze 25ºC.
Obliczenia:
Odpowied
Ĩ:
Informacja do zadania 38. i 39.
Dysocjacja kwasu ortofosforowego(V) przebiega w roztworach wodnych trójstopniowo:
H
3
PO
4
+ H
2
O
H
2
PO
4
-
+ H
3
O
+
K
a1
= 7,1
.
10
-3
H
2
PO
4
-
+ H
2
O
HPO
4
2-
+ H
3
O
+
K
a2
= 6,3
.
10
-8
HPO
4
2-
+ H
2
O
PO
4
3-
+ H
3
O
+
K
a3
= 4,4
.
10
-13
1.
2.
3.
K
a1
,
K
a2
,
K
a3
oznaczaj
ą staáe kolejnych etapów dysocjacji. Podane wartoĞci staáych odnoszą
si
Ċ do temperatury 25ºC.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997
Zadanie 38. (1 pkt)
Napisz wzór jonu, którego st
ĊĪenie w wodnym roztworze H
3
PO
4
jest:
a) najwi
Ċksze ................................................................
b) najmniejsze ..............................................................
Zadanie 39. (1 pkt)
Okre
Ğl, jaką rolĊ wedáug teorii BrĘnsteda peáni jon H
2
PO
4
–
w reakcji opisanej
równaniem 2.
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
7
Zadanie 40. (1 pkt)
W produkcji nawozu fosforowego z trudno rozpuszczalnego w wodzie ortofosforanu(V)
wapnia otrzymuje si
Ċ rozpuszczalny diwodoroortofosforan(V) wapnia.
Napisz w formie cz
ąsteczkowej równanie tej reakcji.
.......................................................................................................................................................
Informacja do zadania 41. i 42.
W silnikach spalinowych – w wysokiej temperaturze – przebiegaj
ą róĪne reakcje uboczne.
Powstaj
ące spaliny w kontakcie z tlenem ulegają dalszym przemianom. Ze wzglĊdu
na szkodliwo
Ğü produktów, do najwaĪniejszych naleĪą procesy:
I. N
2(g)
+ O
2(g)
2NO
(g)
'
o
K
298
H
182,5 kJ
II. 2NO
(g)
+ O
2(g)
2NO
2(g)
'
o
K
298
H
–114,1 kJ
Zadanie 41. (2 pkt)
Okre
Ğl, jak zmieni siĊ (w ukáadzie zamkniĊtym) iloĞü produktu w stosunku do iloĞci
substratów
a) reakcji I, je
Ğli nastąpi wzrost temperatury.
.......................................................................................................................................................
b) reakcji II, je
Ğli nastąpi wzrost ciĞnienia.
.......................................................................................................................................................
Zadanie 42. (2 pkt)
Oblicz standardow
ą entalpiĊ reakcji:
N
2(g)
+ 2O
2(g)
2NO
2(g)
Obliczenia:
Odpowied
Ĩ:
Nr zadania
37
38
39
40
41
42
Maks. liczba pkt
3
1
1
1
2
2
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
8
Zadanie 43. (3 pkt)
Chlor mo
Īna otrzymaü w wyniku reakcji kwasu solnego z manganianem(VII) potasu.
Produktami tej reakcji, oprócz chloru, s
ą: chlorek manganu(II), chlorek potasu i woda.
Napisz w formie cz
ąsteczkowej równanie tej reakcji i dobierz w nim wspóáczynniki
stechiometryczne metod
ą bilansu elektronowego. Zapisz wzory substancji, które peánią
w tej reakcji rol
Ċ utleniacza i reduktora.
Bilans elektronowy:
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zbilansowane równanie reakcji:
.......................................................................................................................................................
.......................................................................................................................................................
Wzór utleniacza: ..............................................................................
Wzór reduktora: ...............................................................................
Zadanie 44. (2 pkt)
Wodny roztwór siarczanu(VI) sodu poddano elektrolizie z u
Īyciem elektrod grafitowych.
Napisz równania reakcji, które przebiega
áy na elektrodach w czasie opisanego procesu.
Równanie reakcji anodowej:
.......................................................................................................................................................
Równanie reakcji katodowej:
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
9
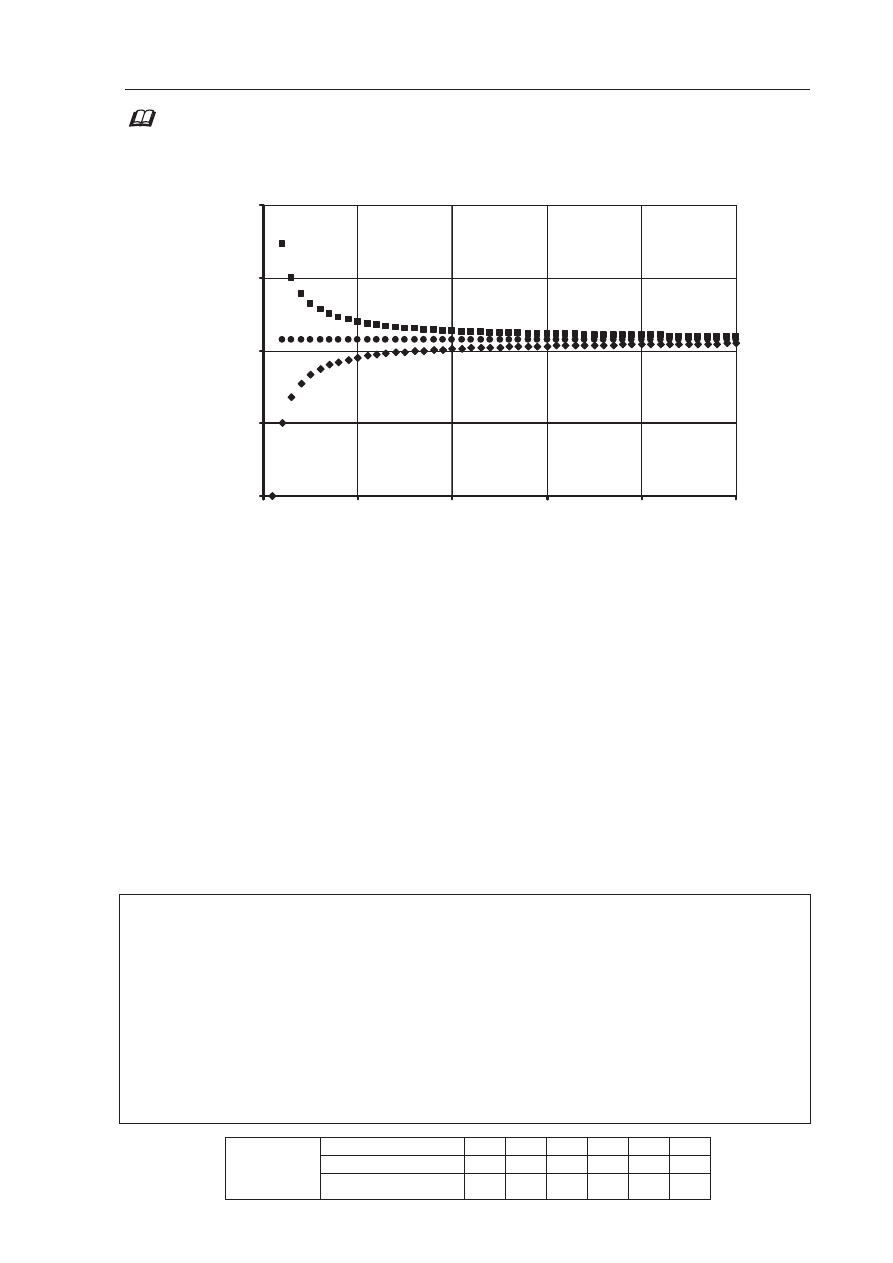
Informacja do zadania 45. i 46.
Poni
Īej przedstawiono zaleĪnoĞü zawartoĞci wĊgla (wyraĪoną w procentach masowych)
w alkanach, alkenach i alkinach od liczby atomów w
Ċgla w cząsteczce.
75,00
80,00
85,00
90,00
95,00
0
10
20
30
40
50
Liczba atomów C
Z
a
w
a
rt
oĞ
ü
p
ro
c
e
n
to
w
a
C
,
%
A
C
B
Zadanie 45. (1 pkt)
Przyporz
ądkuj wykresom A, B i C nazwy szeregów homologicznych wymienionych
w informacji wst
Ċpnej.
Wykres A: .................................................................
Wykres B: .................................................................
Wykres C: .................................................................
Zadanie 46. (1 pkt)
Okre
Ğl, do jakiej wartoĞci procentowej zawartoĞci wĊgla dąĪą krzywe A i C. OdpowiedĨ
uzasadnij obliczeniami.
Obliczenia:
Odpowied
Ĩ:
Nr zadania
43.1
43.2
43.3
44
45
46
Maks. liczba pkt
1
1
1
2
1
1
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
10
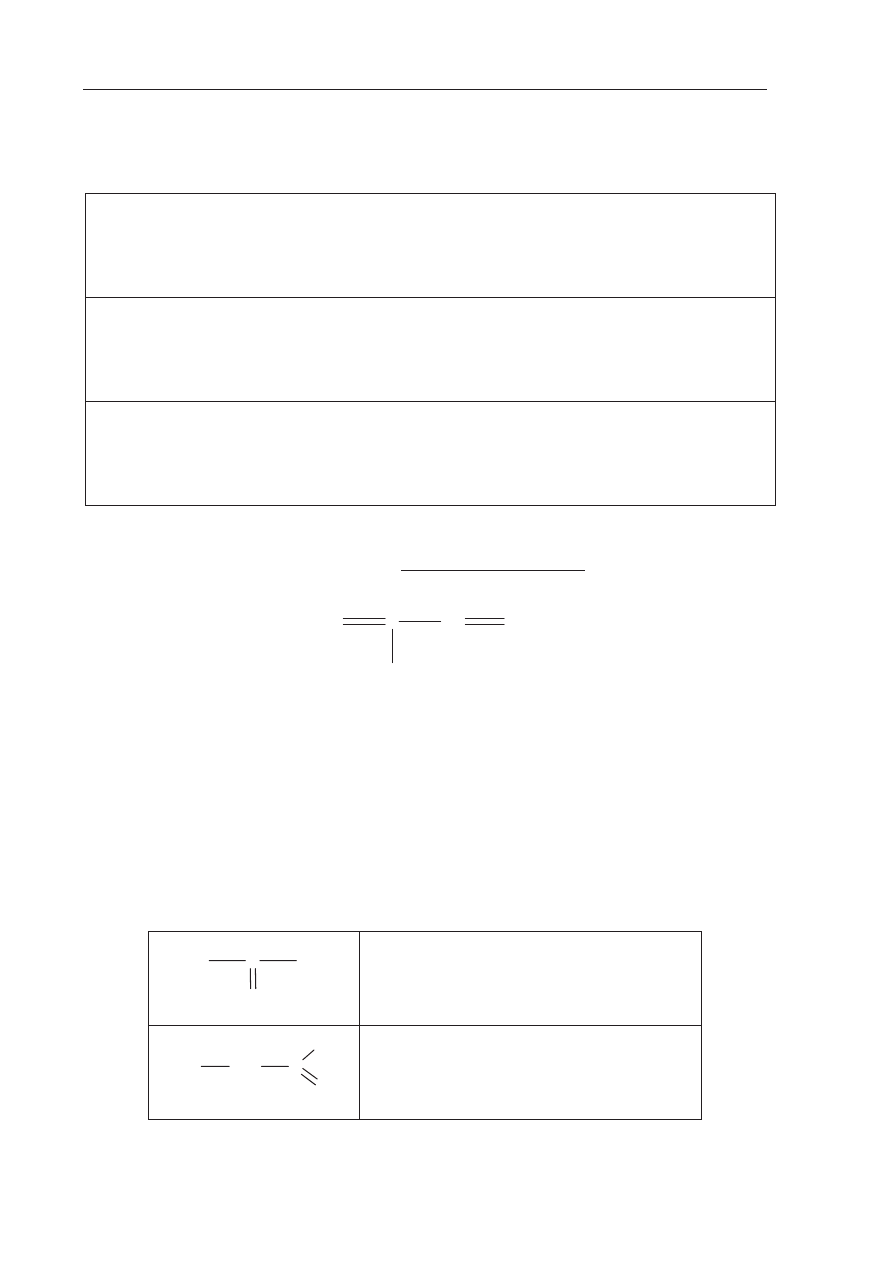
Zadanie 47. (2 pkt)
Napisz wzory pó
ástrukturalne (grupowe) trzech izomerycznych alkinów zawierających
5 atomów w
Ċgla w cząsteczce.
Wzór izomeru I:
Wzór izomeru II:
Wzór izomeru III:
Zadanie 48. (1 pkt)
Okre
Ğl liczbĊ wiązaĔ typu ı i typu ʌ miĊdzy atomami wĊgla w cząsteczce związku
o nast
Ċpującym wzorze:
C
H
2
C
CH
CH
2
CH
3
Liczba wi
ązaĔ typu ı: ..............................................................
Liczba wi
ązaĔ typu ʌ: ..............................................................
Zadanie 49. (2 pkt)
Poni
Īej przedstawiono wzory póástrukturalne (grupowe) dwóch pochodnych propanu.
Podaj wzór pó
ástrukturalny (grupowy) jednego izomeru kaĪdego z tych związków.
H
3
C
C
CH
3
O
Wzór izomeru:
H
3
C
CH
2
C
O
OH
Wzór izomeru:
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
11
Zadanie 50. (2 pkt)
Zwi
ązek A, bĊdący chloropochodną pewnego alkanu, poddano przemianom, które ilustruje
poni
Īszy schemat.
A
B
+ KOH
(aq)
+ CH
3
COOH
CH
3
CH
C
H
3
O
C
CH
3
O
st. H
2
SO
4
a) Podaj nazw
Ċ systematyczną związku A.
.....................................................................................................................................................
b) Napisz, u
Īywając wzorów póástrukturalnych (grupowych), równanie reakcji, której
ulega zwi
ązek B.
Informacja do zadania 51. i 52.
W chemii
ĪywnoĞci waĪnymi reakcjami są reakcje fermentacji. PoniĪej przedstawiono
schematyczny zapis przebiegu fermentacji alkoholowej i fermentacji mlekowej.
fermentacja alkoholowa:
C
6
H
12
O
6
ĺ 2C
2
H
5
OH + 2CO
2
(glukoza)
fermentacja mlekowa:
C
6
H
12
O
6
ĺ 2CH
3
CH(OH)COOH
(glukoza) (kwas mlekowy)
Zadanie 51. (1 pkt)
Uzupe
ánij poniĪszy schemat, tak aby przedstawiaá on wzory pary enancjomerów kwasu
mlekowego.
C
C
Zadanie 52. (2 pkt)
Okre
Ğl, czy etanol moĪe wystĊpowaü w formach enancjomerów. OdpowiedĨ uzasadnij.
.......................................................................................................................................................
.......................................................................................................................................................
Nr zadania
47
48
49
50.1
50.2
51
52
Maks. liczba pkt
2
1
2
1
1
1
2
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
12
Zadanie 53. (3 pkt)
Opisz, w jaki sposób mo
Īna doĞwiadczalnie sprawdziü obecnoĞü skrobi w bulwach
ziemniaków, maj
ąc do dyspozycji wodĊ bromową i wodny roztwór jodku potasu.
Podaj opis s
áowny wykonania doĞwiadczenia oraz obserwacje, dotyczące wykrywania
skrobi w bulwach ziemniaków.
Opis s
áowny wykonania doĞwiadczenia:
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Obserwacje:
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Informacja do zada
Ĕ 54. – 56.
Wodorotlenek sodu jest g
áównym skáadnikiem preparatów do czyszczenia niedroĪnych rur
i syfonów. Na etykiecie jednego z takich preparatów znajduje si
Ċ nastĊpujące ostrzeĪenie:
Nie stosowa
ü do czyszczenia instalacji aluminiowych
.
Zadanie 54. (1 pkt)
Uzasadnij powy
Īsze ostrzeĪenie, zapisując w formie jonowej równanie reakcji
chemicznej, która zasz
áaby po zastosowaniu takiego preparatu do czyszczenia instalacji
aluminiowej. Pami
Ċtaj, Īe jednym z produktów reakcji glinu z zasadą sodową jest
wodór.
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
13
Zadanie 55. (1 pkt)
Wodorotlenek sodu w obecno
Ğci wody reaguje z táuszczem znajdującym siĊ w zatkanych
rurach.
Napisz równanie tej reakcji przyjmuj
ąc, Īe cząsteczki táuszczu zbudowane są wyáącznie
z tristearynianu glicerolu. W zapisie zastosuj pó
ástrukturalne (grupowe) wzory
tristearynianu glicerolu i glicerolu oraz sumaryczne wzory reszt w
Ċglowodorowych
kwasu organicznego.
Zadanie 56. (1 pkt)
Okre
Ğl, jaka wáaĞciwoĞü fizyczna produktów reakcji táuszczu z zasadą sodową jest
podstaw
ą opisanej metody udraĪniania rur.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Nr zadania
53.1
53.2
54
55
56
Maks. liczba pkt
2
1
1
1
1
Wype
ánia
egzaminator!
Uzyskana liczba pkt
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
14
BRUDNOPIS
Pobrano ze strony www.sqlmedia.pl
Wyszukiwarka
Podobne podstrony:
matura 2006 Chemia rozszerzona odpowiedzi
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
2002, matura 2002 Chemia rozszerzona arkusz2
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
próbna matura 2007 Chemia rozszerzona OPERON
matura 2006 Chemia podstawowa
matura 2006 Chemia podstawowa odpowiedzi
próbna matura 2007 Chemia rozszerzona odpOPERON
2003 probna matura styczen 2003 Chemia rozszerzona arkusz2 id 6 (2)
reakcje chemicznew roztworach wodnych, Matura Chemia Rozszerzona, Podręczniki, Notatki
Węglowodory not, Matura Chemia Rozszerzona, Podręczniki, Notatki
2003, próbna matura styczeń 2003 Chemia rozszerzona arkusz2 odpowiedzi
Odpowiedzi próbna matura z jęz włoskiego 2006 poziom rozszerzony, cz II
matura 2006 dwu, a1 model m2006
więcej podobnych podstron