S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
1
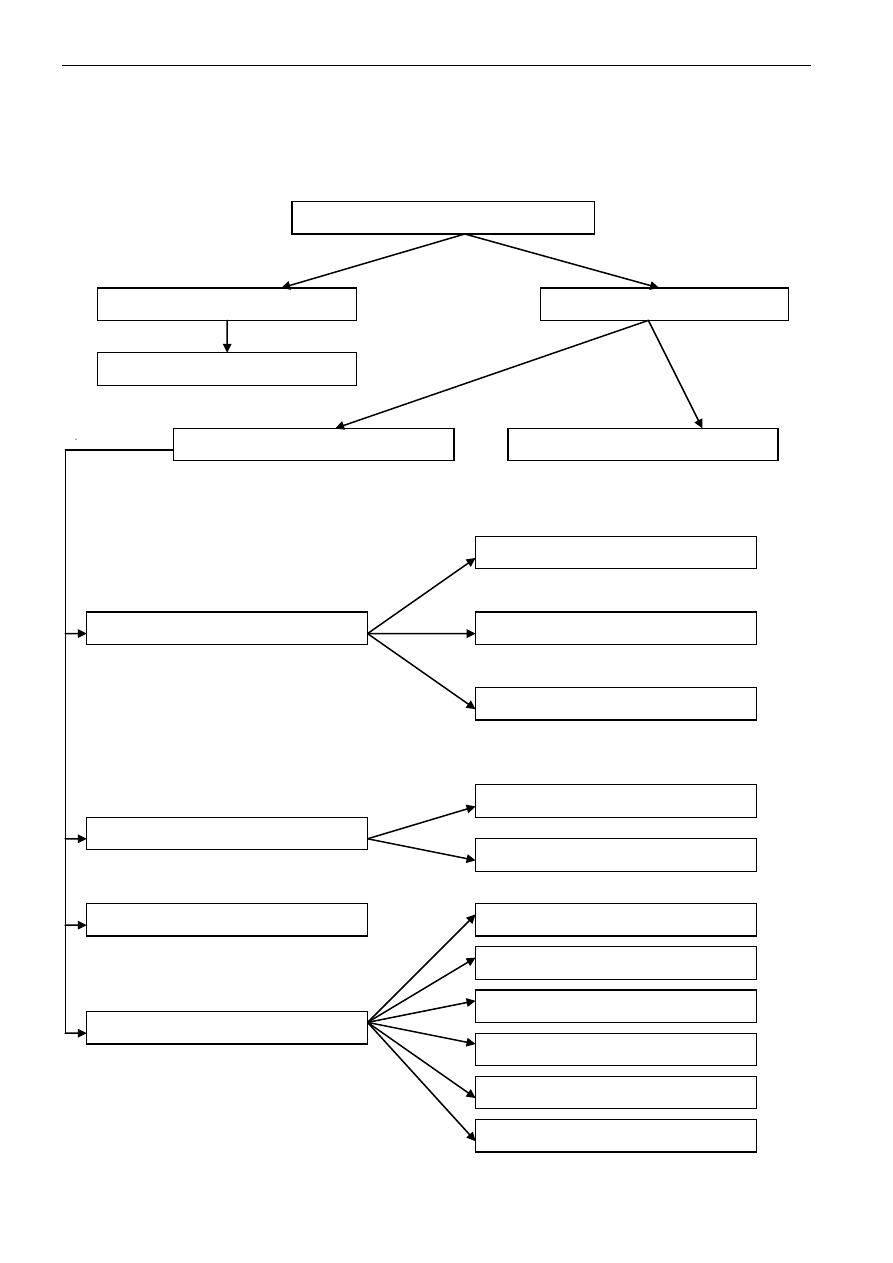
1. Podział substancji chemicznych
Substancje chemiczne, jakie mogą wchodzić w skład analizowanej próbki materii dzielą się na:
SUBSTANCJE CHEMICZNE
SUBSTANCJE PROSTE
SUBSTANCJE ZŁOŻONE
PIERWIASTKI
ZWIĄZKI NIEORGANICZNE
ZWIĄZKI ORGANICZNE
TLENKI
KWASY
SOLE
METALI
PÓŁMETALI
NIEMETALI
BEZTLENOWE
TLENOWE
BEZTLENOWE
TLENOWE
WODOROSOLE
OKSOSOLE
ZASADY
PODWÓJNE
HYDROKSYSOLE

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
2
Substancja chemiczna - jest to forma materii o charakterystycznych właściwościach fizycz-
nych i chemicznych, której mol jej elementów ma ściśle określoną masę.
Wśród substancji chemicznych wyróżnia się: substancje proste i substancje złożone.
Substancje proste - to pierwiastki, które występują w stanie wolnym. Niektóre z pierwiastków
występują w formie kilku odmian. Zjawisko to nazywa się alotropią. Przykładem jest diament i grafit -
odmiany alotropowe węgla. Chociaż składają się one tylko z atomów C, to są różnymi substancjami
prostymi, gdyż mają różne właściwości fizyczne. Znane są pierwiastki, które w stanie trwałym są jed-
noatomowe, np.: He, Ne, Ar, Kr, Xe, Rn. Niektóre pierwiastki występują jako cząsteczki dwuato-
mowe, np.: O
2
, N
2
, H
2
, Cl
2
. Istnieją też pierwiastki poliatomowe, np.: P
4
, S
8
, B
12
.
Znanych jest obecnie 109 pierwiastków. Tylko 88 z nich występuje w przyrodzie, głównie
w związkach chemicznych. Pozostałe to, otrzymywane w wyniku przemian lub reakcji jądrowych, nie-
trwałe radionuklidy.
Substancje złożone - to takie formy materii, które można rozłożyć na substancje proste. Są to
związki chemiczne. Mogą one składać się z dwóch lub większej liczby pierwiastków.
Istnieją substancje złożone, które są zbiorem cząsteczek - związki kowalencyjne oraz substan-
cje, które są zbiorem jonów - związki jonowe.
Związki, które w warunkach standardowych (p = 1013 hPa, T = 298 K) są gazami lub cieczami
oraz substancje złożone z pierwiastków o małej różnicy elektroujemności (ΔE ≤ 1,8) są związkami
kowalencyjnymi (głównie związki organiczne).
Związki jonowe, to głównie sole, np.: NaCl, Na
2
SO
4
, CaCl
2
i niektóre tlenki, np.: Na
2
O, CaO.
Związek ma charakter jonowy wtedy, gdy utworzony jest z pierwiastków o dużej różnicy elektroujem-
ności (ΔE > 1,8).
Każdą substancję chemiczną można, w wyniku odpowiednich reakcji chemicznych, przekształ-
cić w formy jonowe. Nic więc dziwnego, że jedną z najwcześniej poznanych metod identyfikacji sub-
stancji chemicznych była metoda wykorzystująca reakcje jonowe. I właśnie ta metoda analizy - dzisiaj
uznawana za klasyczną - opisana jest w tym skrypcie.
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
3
1.1. Zasady nazewnictwa związków nieorganicznych
Nazwy związków złożonych tylko z dwóch pierwiastków tworzy się bezpośrednio z nazw
tych pierwiastków. Pierwiastek o większej elektroujemności we wzorze umieszcza się na drugim miej-
scu. Nazwy takich związków są dwuwyrazowe. Najpierw wymienia się składnik bardziej elektro-
ujemny (z końcówką: -ek), a następnie składnik o mniejszej elektroujemności.
Przykłady tego typu związków podane są w tabeli 1.
Tabela 1. Nazewnictwo związków dwóch pierwiastków
Wzór związku
Nazwa związku
AlN
Azotek glinu
CaO
Tlenek wapnia
HBr
Bromek wodoru
NaCl
Chlorek sodu
NaH
Wodorek sodu
Jeżeli w skład cząsteczki związku wchodzi więcej niż jeden atom tego samego pierwiastka, to
stosuje się przedrostki liczebnikowe: di-, tri-, tetra-, penta-, itd. Jeżeli ten sam pierwiastek tworzy z
określonym pierwiastkiem więcej niż jeden związek, to po nazwie tego pierwiastka, w nawiasie podaje
się cyfrą rzymską jego stopień utlenienia. Przykłady podane są w tabeli 2.
Tabela 2. Nazewnictwo związków pierwiastka występującego na różnych stopniach utlenienia
Wzór związku
Nazwa związku
FeCl
2
Dichlorek żelaza lub
Chlorek żelaza(II)
FeCl
3
Trichlorek żelaza lub
Chlorek żelaza(III)
Hg
2
Cl
2
Chlorek dirtęci(I)
HgCl
2
Chlorek rtęci(II)
W przypadku binarnych związków niemetali, umieszcza się najpierw symbole pierwiastka,
który zajmuje wcześniejszą pozycję w podanym niżej wykazie:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Przykłady tego typu związków podane są w tabeli 3.
Tabela 3. Nazewnictwo związków niemetali
Wzór związku
Nazwa związku
H
2
S
Siarczek diwodoru
N
2
O
4
Tetratlenek diazotu
NCl
3
Trichlorek azotu
OF
2
Difluorek tlenu
PH
3
Triwodorek fosforu
S
2
Cl
2
Dichlorek disiarki
XeF
2
Difluorek ksenonu
.
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
4
1.1.1. Nazewnictwo tlenków
Przykłady nazw tlenków podane są w tabeli 4.
Tabela 4. Nazewnictwo tlenków
Wzór tlenku
Nazwa tlenku
Al
2
O
3
Tlenek glinu
As
2
O
3
Tlenek arsenu(III)
As
2
O
5
Tlenek arsenu(V)
B
2
O
3
Tlenek boru
BaO
Tlenek baru
BaO
2
Ditlenek baru
CaO
Tlenek wapnia
Cl
2
O
7
Tlenek chloru(VII)
CO
Tlenek węgla
CO
2
Ditlenek węgla
Cr
2
O
3
Tlenek chromu(III)
CrO
3
Tlenek chromu(VI)
Cu
2
O
Tlenek miedzi(I)
Fe
2
O
3
Tlenek żelaza(III)
FeO
Tlenek żelaza(II)
H
2
O
Tlenek wodoru
H
2
O
2
Ditlenek diwodoru (woda utleniona)
MgO
Tlenek magnezu
Mn
2
O
7
Tlenek manganu(VII)
MnO
2
Tlenek manganu(IV)
N
2
O
Tlenek azotu(I)
N
2
O
2
Ditlenek diazotu
N
2
O
4
Tetratlenek diazotu
N
2
O
5
Tlenek azotu(V)
Na
2
O
Tlenek sodu
Na
2
O
2
Ditlenek disodu
NO
Tlenek azotu(II)
NO
2
Tlenek azotu(IV)
P
2
O
5
Tlenek fosforu(V)
PbO
Tlenek ołowiu(II)
PbO
2
Tlenek ołowiu(IV)
Sb
2
O
3
Tlenek antymonu(III)
Sb
2
O
5
Tlenek antymonu(V)
SiO
2
Tlenek krzemu
SnO
2
Tlenek cyny(IV)
SO
2
Tlenek siarki(IV)
SO
3
Tlenek siarki(VI)
TiO
2
Tlenek tytanu(IV)
V
2
O
3
Tlenek wanadu(III)
V
2
O
5
Tlenek wanadu(V)
VO
2
Tlenek wanadu(IV)
ZnO
Tlenek cynku
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
5
1.1.2. Nazewnictwo kwasów
- Nazewnictwo kwasów beztlenowych
Kwasy beztlenowe (kwasy binarne i pseudobinarne) nazywa się tak, jak inne związki binarne.
Przykłady takich kwasów przedstawione są w tabeli 5.
Tabela 5. Nazewnictwo kwasów beztlenowych
Wzór
Nazwa związku
Nazwa kwasu
HF
Fluorek wodoru
Fluorowodorowy
HCl
Chlorek wodoru
Chlorowodorowy (kwas solny)
HBr
Bromek wodoru
Bromowodorowy
HI
Jodek wodoru
Jodowodorowy
H
2
S
Siarczek wodoru
Siarkowodorowy
H
2
Se
Selenek wodoru
Selenowodorowy
H
2
Te
Tellurek wodoru
Tellurowodorowy
HCN
Cyjanek wodoru
Cyjanowodorowy
HN
3
Azydek wodoru
Azotowodorowy
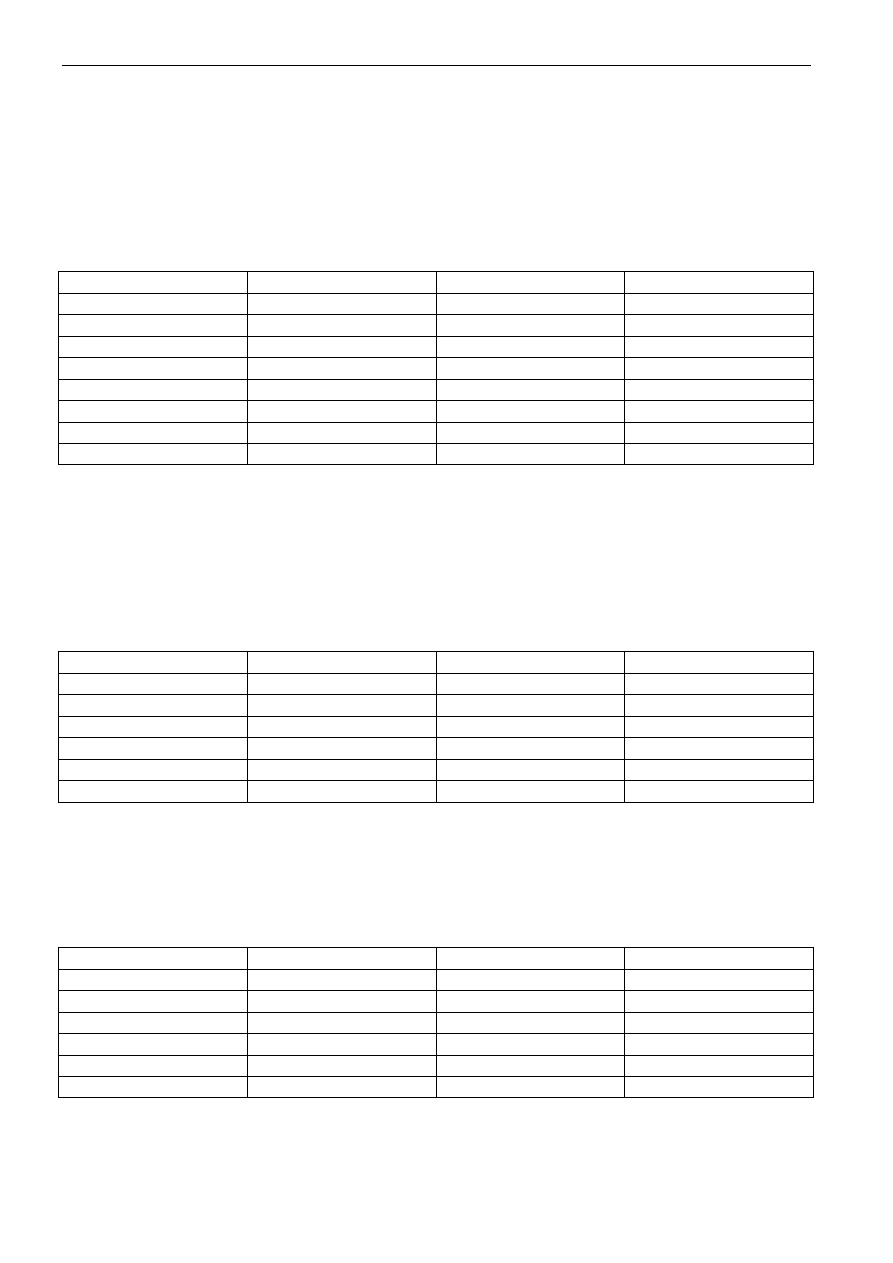
- Nazewnictwo kwasów tlenowych
W nazwach kwasów tlenowych stosuje się końcówkę -owy. Stopień utlenienia atomu central-
nego zaznacza się liczbą rzymską umieszczoną w nawiasie za nazwą kwasu. Przykłady takich kwasów
przedstawione są w tabeli 6.
Tabela 6. Nazewnictwo kwasów tlenowych
Wzór kwasu
Nazwa kwasu
HClO
Chlorowy(I)
HClO
2
Chlorowy(III)
HClO
3
Chlorowy(V)
HClO
4
Chlorowy(VII)
HIO
4
Jodowy(VII)
H
2
SO
3
Siarkowy(IV)
H
2
SO
4
Siarkowy(VI)
H
2
S
2
O
3
Tiosiarkowy(VI)
HNO
2
Azotowy(III)
HNO
3
Azotowy(V)
H
3
PO
4
Ortofosforowy(V)
H
3
AsO
3
Arsenowy(III)
H
3
AsO
4
Arsenowy (V)
H
2
CO
3
Węglowy
H
2
C
2
O
4
Szczawiowy
H
2
SiO
3
Krzemowy
H
2
MnO
4
Manganowy(VI)
HMnO
4
Manganowy(VII)
H
2
CrO
4
Chromowy(VI)
H
2
Cr
2
O
7
Dichromowy(VI)
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
6
1.1.3. Nazewnictwo anionów
- Nazewnictwo anionów jednoatomowych
Nazwy anionów jednoatomowych tworzone są od nazwy pierwiastka z dodaniem końcówki: -ek lub
-ik. Przykłady przestawione są w tabeli 7.
Tabela 7. Nazewnictwo anionów jednoatomowych
Wzór anionu
Nazwa anionu
Wzór anionu
Nazwa anionu
Br
–
Bromek
Sb
3-
Antymonek
Cl
–
Chlorek
As
3–
Arsenek
F
–
Fluorek
P
3–
Fosforek
I
–
Jodek
C
4–
Węglik
N
3–
Azotek
O
2–
Tlenek
S
2–
Siarczek
Si
4–
Krzemek
Se
2–
Selenek
B
3–
Borek
Te
2–
Telurek
H
–
Wodorek
- Nazewnictwo anionów wieloatomowych
Wśród anionów wieloatomowych wyróżnia się:
- Aniony, których nazwy mają końcówkę: -ek. Przykłady przestawione są w tabeli 8.
Tabela 8. Nazewnictwo anionów wieloatomowych
Wzór anionu
Nazwa anionu
Wzór anionu
Nazwa anionu
OH
–
Wodorotlenek
NH
2
–
Amidek
CN
–
Cyjanek
NH
2–
Imidek
S
2
2–
Disiarczek
O
3
–
Ozonek
O
2
2–
Nadtlenek
HF
2
–
Wodorodifluorek
O
2
–
Ponadtlenek
HS
–
Wodorosiarczek
N
3
–
Azydek
HO
2
–
Wodoronadtlenek
- Aniony, których nazwy mają końcówkę: -an.
Nazwy tych anionów składają się z rdzenia nazwy atomu centralnego i końcówki -an. Przykłady prze-
stawione są w tabeli 9.
Tabela 9. Nazewnictwo anionów kwasów tlenowych
Wzór anionu
Nazwa anionu
Wzór anionu
Nazwa anionu
CO
3
2–
Węglan
PO
4
3–
orto-Fosforan(V)
C
2
O
4
2–
Szczawian
AsO
3
3–
Arsenian(III)
CH
3
COO
–
Octan
SO
3
2–
Siarczan(IV)
ClO
4
–
Chloran(VII)
SO
4
2–
Siarczan(VI)
NO
2
–
Azotan(III)
S
2
O
3
2–
Tiosiarczan(VI)
NO
3
–
Azotan(V)
SiO
3
2–
Krzemian
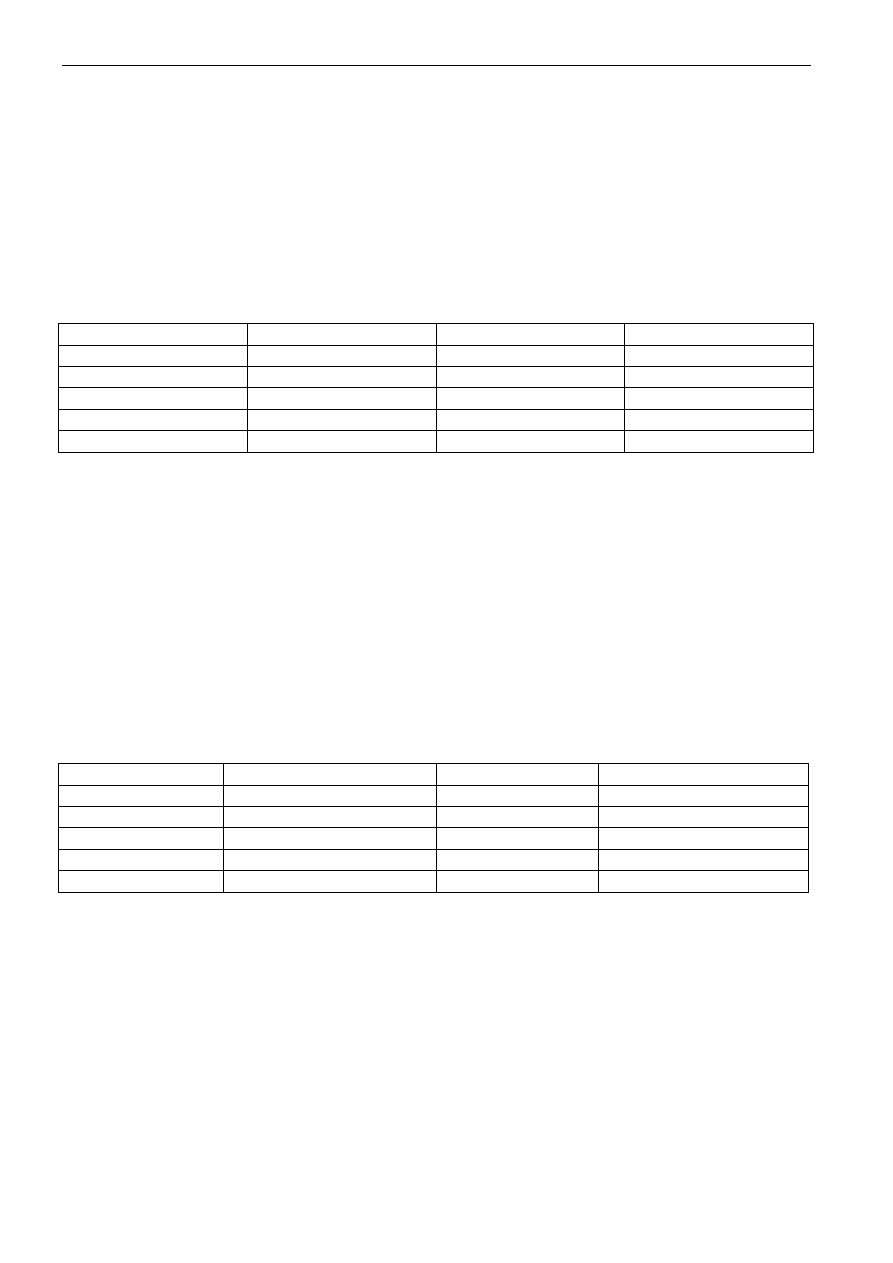
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
7
1.1.4. Nazewnictwo kationów
Nazwy kationów tworzy się od nazw pierwiastków, podając w nawiasie liczbą rzymską stopień
utlenienia (jeśli pierwiastek występuje na kilku różnych stopniach utlenienia). Ładunek elektryczny
kationu zaznacza się liczbą arabską w prawym górnym rogu symbolu, umieszczając znak + po prawej
stronie liczby. Przykłady przestawione są w tabeli 10.
Tabela 10. Nazewnictwo kationów
Wzór kationu
Nazwa kationu
Wzór kationu
Nazwa kationu
Ag
+
Srebra
Fe
2+
Żelaza(II)
Pb
2+
Ołowiu(II)
Fe
3+
Żelaza(III)
Hg
2
2+
Dirtęci(I)
Al
3+
Glinu
Hg
2+
Rtęci(II)
Mn
2+
Manganu(II)
Cu
2+
Miedzi(II)
NH
4
+
Amonu
W roztworach wodnych kationy występują najczęściej w formie jonów kompleksowych, w któ-
rych ligandami mogą być zarówno cząsteczki (np. H
2
O, NH
3
), jak też aniony obecne w roztworze.
Nazewnictwo jonów kompleksowych opisane jest w rozdziale 1.1.8.
1.1.5. Nazewnictwo wodorotlenków
W nazwach wodorotlenków występuje słowo wodorotlenek oraz w drugim przypadku liczby
pojedynczej odpowiednia nazwa kationu. Gdy istnieją dwa lub więcej wodorotlenki tego samego me-
talu, wówczas po nazwie metalu podaje się jego stopień utlenienia, zapisując go cyfrą rzymską w na-
wiasie. Odpowiednie przykłady przedstawione są w tabeli 11.
Tabela 11. Nazewnictwo wodorotlenków
Wzór wodorotlenku
Nazwa wodorotlenku
Wzór wodorotlenku
Nazwa wodorotlenku
Ca(OH)
2
Wodorotlenek wapnia
Fe(OH)
2
Wodorotlenek żelaza(II)
KOH
Wodorotlenek potasu
Fe(OH)
3
Wodorotlenek żelaza(III)
Mg(OH)
2
Wodorotlenek magnezu
Sn(OH)
2
Wodorotlenek cyny(II)
NaOH
Wodorotlenek sodu
Sn(OH)
4
Wodorotlenek cyny(IV)
NH
4
OH
Wodorotlenek amonu
Pb(OH)
2
Wodorotlenek ołowiu(II)
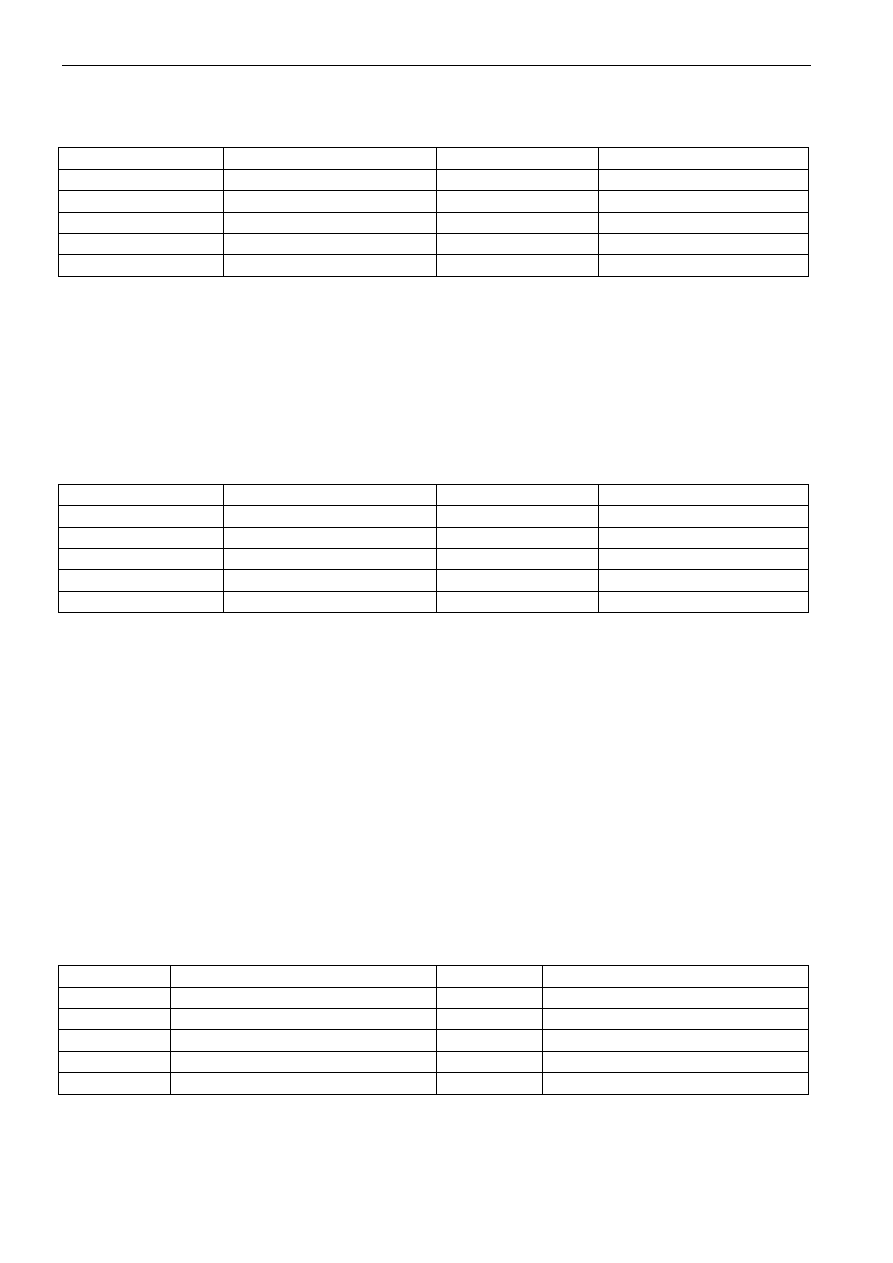
1.1.6. Nazewnictwo soli
- Nazewnictwo soli beztlenowych
Sole beztlenowe składają się z kationu metali i anionu niemetalu. Nazwy tych soli tworzy się
od nazw jonów składowych. Do nazwy anionu dodaje się końcówkę -ek, a następnie podaje się nazwę
kationu w drugim przypadku liczby pojedynczej. Jeśli znane są sole, w których ten sam metal występuje
na różnych stopniach utlenienia, to zapisuje się to liczbą rzymską w nawiasie, po nazwie metalu. Odpo-
wiednie przykłady przedstawione są w tabeli 12.
S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
8
Tabela 12. Nazewnictwo soli beztlenowych
Wzór soli
Nazwa soli
Wzór soli
Nazwa soli
FeCl
2
Chlorek żelaza(II)
Hg
2
Cl
2
Chlorek dirtęci(I)
FeCl
3
Chlorek żelaza(III)
HgCl
2
Chlorek rtęci(II)
SnCl
2
Chlorek cyny(II)
SnS
Siarczek cyny(II)
SnCl
4
Chlorek cyny(IV)
SnS
2
Siarczek cyny(IV)
MnCl
2
Chlorek manganu(II)
As
2
S
3
Siarczek arsenu(III)
- Nazewnictwo soli tlenowych
Nazwy tych soli tworzy się od nazw jonów składowych. Jak widać z przytoczonych przykła-
dów w tabeli 13, najpierw podaje się nazwę anionu (z końcówką -an). Stopień utlenienia zarówno atomu
centralnego anionu, jak też kationu podaje się cyfrą rzymską w nawiasie.
Tabela 13. Nazewnictwo soli tlenowych
Wzór soli
Nazwa soli
Wzór soli
Nazwa soli
NH
4
NO
2
Azotan(III) amonu
FeSO
3
Siarczan(IV) żelaza(II)
NH
4
NO
3
Azotan(V) amonu
Fe
2
(SO
3
)
3
Siarczan(IV) żelaza(III)
Ca
3
(PO
4
)
2
orto-Fosforan(V) wapnia
FeSO
4
Siarczan(VI) żelaza(II)
K
2
CrO
4
Chromian(VI) potasu
Fe
2
(SO
4
)
3
Siarczan(VI) żelaza(III)
K
2
Cr
2
O
7
Dichromian(VI) potasu
KClO
4
Chloran(VII) potasu
- Nazewnictwo wodorosoli
Gdy w cząsteczce wielowodorowego kwasu nie wszystkie atomy wodoru zostaną wymie-
nione na kation metalu, to sole takie noszą nazwę wodorosoli.
Nazwy takich soli tworzy się przez dodania przedrostka wodoro- po czym, bez odstępu po-
daje się nazwę anionu, np.: NaHCO
3
- wodorowęglan sodu. Gdy cząsteczka soli zawiera dwa wodory
kwasowe, to przed słowo „wodoro-” dodaje się liczebnik np.: NaH
2
PO
4
- diwodorofosforan sodu. Nato-
miast w przypadku, gdy w cząsteczce znajduje się więcej anionów, to przed nazwą anionu podaje się
określenie liczebnikowe bis-, tris-, itd. Nazwę całego anionu ujmuje się w nawias, np.:
Ca(H
2
PO
4
)
2
- bis-diwodorofosforan(V) wapnia. Więcej przykładów podano w tabeli 14.
Tabela 14. Nazewnictwo wodorosoli
Wzór soli
Nazwa soli
Wzór soli
Nazwa soli
Ca(HS)
2
Bis-wodorosiarczek wapnia
Al
2
(HPO
4
)
3
Tris-wodorofosforan(V) glinu
MgHPO
4
Wodorofosforan(V) magnezu
Fe
2
(HPO
4
)
3
Tris-wodorofosforan(V) żelaza(III)
Mg(H
2
PO
4
)
2
Bis-diwodorofosforan(V) magnezu Al(H
2
PO
4
)
3
Tris-diwodorofosforan(V) glinu
Ba(HSO
4
)
2
Bis-wodorosiarczan(VI) baru
NaH
2
PO
4
Diwodorofosforan(V) sodu
KHS
Wodorosiarczek potasu
K
2
HPO
4
Wodorofosforan(V) potasu

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
9
- Nazewnictwo hydroksysoli
Gdy w cząsteczce wodorotlenku mającego więcej niż jedną grupę OH
-
w trakcie tworzenia
soli nie wszystkie grupy OH
-
zostaną zastąpione anionem, wówczas sole takie określa się jako hydrok-
sysole.
W nazwach takich soli podawana jest najpierw nazwa anionu pochodzącego od kwasu, a na-
stępnie termin "wodorotlenek" z przedrostkiem określającym liczbę grup OH
–
w cząsteczce soli. Odpo-
wiednie przykłady przedstawione są w tabeli 15.
Tabela 15. Nazewnictwo hydroksysoli
Wzór soli
Nazwa soli
Wzór soli
Nazwa soli
AlCl(OH)
2
Chlorek diwodorotlenek glinu
FeCl(OH)
Chlorek wodorotlenek żelaza(II)
AlCl
2
(OH)
Dichlorek wodorotlenek glinu
FeCl
2
(OH)
Dichlorek wodorotlenek żelaza(III)
MgCl(OH)
Chlorek wodorotlenek magnezu FeCl(OH)
2
Chlorek diwodorotlenek żelaza(III)
- Nazewnictwo oksosoli
Istnieją sole, które w swym składzie maja atomy tlenu nie będące częścią anionu. Sole takie
określa się nazwą oksosoli. Sole takie traktuje się jako połączenie odpowiedniej soli i tlenku. W na-
zwach takich soli podawana jest najpierw nazwa anionu pochodzącego od kwasu, a następnie termin
"tlenek" z przedrostkiem określającym liczbę grup atomów tlenu w cząsteczce soli. We wzorach okso-
soli aniony umieszczane są w porządku alfabetycznym. Odpowiednie przykłady przedstawione są w
tabeli 16.
Tabela 16. Nazewnictwo oksosoli
Wzór soli
Nazwa soli
Wzór soli
Nazwa soli
BiClO
Chlorek tlenek bizmutu(III)
UCl
2
O
2
Dichlorek ditlenek uranu(VI)
VO(SO
4
)
Siarczan(VI) tlenek wanadu(IV)
ZrOS
Siarczek tlenek cyrkonu(IV)
- Nazewnictwo soli podwójnych
Sole podwójne są utworzone przez połączenie ze sobą dwu różny soli. Struktura krystaliczna
tych soli jest inna niż soli składowych. Rozpuszczone w wodzie dysocjują tak, jak gdyby każda sól była
oddzielnie. W zapisie wzorów tych soli najpierw podaje się wszystkie kationy tej soli, a następnie od-
powiedni anion. W nazwie kationy podawane są w porządku alfabetycznym. Nazwy kationów podaje
się po nazwie anionu. Sole te w swej sieci krystalicznej posiadają cząsteczki wody. Liczbę cząsteczek
wody przypadającą na określoną liczbę kationów i anionów tej soli podaje się na początku nazwy tej
soli dodając po znaku mnożenia słowo "hydrat". Odpowiednie przykłady przedstawione są w tabeli 17.
Tabela 17. Nazewnictwo soli podwójnych
Wzór soli
Nazwa soli
Kal(SO
4
)
2
·12 H
2
O
12 · Hydrat siarczanu(VI) glinu i potasu
MgNH
4
PO
4
·6 H
2
O
6 · Hydrat fosforanu(V) amonu i magnezu
(NH
4
)Al(SO
4
)
2
·12 H
2
O
12 · Hydrat siarczanu(VI) amonu i glinu
KCr(SO
4
)
2
·12 H
2
O
12 · Hydrat siarczanu(VI) chromu(III) i potasu

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
10
1.1.7. Nazewnictwo wodorków
Wodorkami nazywa się związki wodoru z innymi pierwiastkami. Najważniejsze wodorki
można podzielić na dwie grupy:
- Wodorki typu soli
- Wodorki kowalencyjne
Wodorki typu soli są związkami jonowymi, w których wodór jest na -I stopniu utlenienia i
występuje jako jon H
–
. Wodorki takie tworzą metale grupy 1 i 2 układu okresowego z wyjątkiem berylu
i magnezu.
W wodorkach kowalencyjnych wodór występuje na I stopniu utlenienia. Połączenia tego typu
tworzy większość pierwiastków grup od 14 do 17 układu okresowego oraz bor z grupy 13.
Nazwy wodorków można tworzyć według ogólnych zasad nazewnictwa, tzn. umieszczać
składnik mniej elektroujemny na pierwszym miejscu. Do nazwy pierwiastka bardziej elektroujemnego
dodaje się końcówkę -ek, a więc np.: NaH - wodorek sodu, HCl - chlorek wodoru.
Nazwy wodorków lotnych z wyjątkiem fluorowców, tlenu i azotu tworzy się dodając do rdze-
nia nazwy pierwiastka końcówkę -an, np.: H
2
S - sulfan.
Uznanymi wyjątkami są:
- Woda zamiast tlenek diwodoru
- Amoniak zamiast azan
- Hydrazyna zamiast diazan.
Dopuszczalne jest także stosowanie następujących nazw:
- H
2
S - siarkowodór
- HCl - chlorowodór
- HBr - bromowodór
- HI - jodowodór
- HF - fluorowodór.
W tabeli 18 podane są nazwy systematyczne najważniejszych wodorków.
Tabela 18. Nazewnictwo wodorków
Wzór wodorku
Nazwa wodorku
Wzór wodorku
Nazwa wodorku
H
2
S
Sulfan (siarkowodór)
SbH
3
Stilban
H
2
S
n
Polisulfan
PbH
4
Plumban
H
2
Se
Selan (selenowodor)
SnH
4
Stannan
H
2
Te
Tellan (tellurowodór)
SiH
4
Silan
HBr
Bromek wodoru (bromowodór)
B
2
H
6
Diboran
NH
3
Azan (amoniak)
N
2
H
4
Diazan (hydrazyna)
PH
3
Fosfan
AsH
3
Arsan
GeH
4
Germanan
BiH
3
Bizmutan
1.1.8. Nazewnictwo związków koordynacyjnych
Związkiem koordynacyjnym nazywa się połączenie zawierające w swym składzie jon kom-
pleksowy. W jonie kompleksowym można wyróżnić:
- A - atom centralny, którym najczęściej jest kation metalu przejściowego (bloku d)
lub atom metalu.
- L - ligand, atom lub grupę atomów o ujemnym ładunku elektrycznym lub elektrycz-
nie obojętną (donory elektronów, kwasy Lewisa). Nazwy najczęściej spotykanych
ligandów podane są w tabeli 19.

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
11
Tabela 19. Nazwy wybranych ligandów
Ligandy anionowe
Wzór ligandu
Nazwa ligandu
NH
2
–
Amido-
F
–
Fluoro-
Cl
–
Chloro-
Br
–
Bromo-
I
–
Jodo-
O
2–
Okso-
O
2
2–
Perokso-
OH
–
Hydrokso-
S
2–
Tio-
S
2
2–
Disulfido-
CN
–
Cyjano-
SCN
–
Tiocyjaniano-
C
2
O
4
2–
Szczawiano-
Ligandy obojętne
H
2
O
Akwa-
NH
3
Amina-
NO
Nitrozyl-
CO
Karbonyl-
Ogólnie wzór jonu kompleksowego można zapisać:
[AL
n
]
x
gdzie:
n - Liczba ligandów w jonie kompleksowym
x - Ładunek elektryczny jonu kompleksowego.
Najczęściej wykorzystywane w analizie chemicznej związki koordynacyjne podane są w ta-
beli 20.
Tabela 20. Nazewnictwo związków koordynacyjnych
Wzór związku
Nazwa związku
[Ag(NH
3
)
2
]Cl
Chlorek diaminasrebra
[Pb(OH)
4
]Cl
2
Dichlorek tetrahydroksoołowiu(II)
[Al(OH)
4
]NO
3
Azotan(V) tetrahydroksoglinu
[Zn(NH
3
)
6
]Cl
2
Dichlorek heksaaminacynku(II)
K
3
[Fe(CN)
6
]
Heksacyjanożelazian(III) potasu
K
4
[Fe(CN)
6
]
Heksacyjanożelazian(II) potasu
Fe
3
[Fe(CN)
6
]
2
Heksacyjanożelazian(III) żelaza(II)
Fe
4
[Fe(CN)
6
]
3
Heksacyjanożelazian(II) żelaza(III)
Co
2
[Fe(CN)
6
]
Heksacyjanożelazian(II) kobaltu(II)
Mn
2
[Fe(CN)
6
]
Heksacyjanożelazian(II) manganu(II)
Zn
2
[Fe(CN)
6
]
Heksacyjanożelazian(II) cynku(II)
K
2
[HgI
4
]
Tetrajodortęcian(II) potasu
[Fe(CO)
5
]
Pentakarbonylżelazo(0)
K
4
[Co(CN)
4
]
Tetracyjanokobaltan(0) potasu
[Co(H
2
O)
2
(NH
3
)
4
]Cl
3
Trichlorek diakwatetraaminakobaltu(III)

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
12
Pytania treningowe
1. Podaj nazwy kwasów:
a) H
3
BO
3
b) H
2
SeO
3
c) H
2
SeO
4
d) HBrO
e) HBrO
2
f) HBrO
3
g) HBrO
4
h) HIO
3
i) HMnO
4
j) HCN
k) HNO
2
l) HNO
3
m) H
2
S
n) H
3
PO
4
o) H
2
MnO
4
p) CH
3
COOH
q) H
2
SO
3
r) H
2
SO
4
2. Napisz wzory kwasów:
a) kwas difosforowy(V)
b) kwas jodowy(I)
c) kwas manganowy(V)
d) kwas siarkowy(IV)
e) kwas siarkowy(VI)
f) kwas azotowy(III)
g) kwas azotowy(V)
h) kwas fosforowy(III)
i) kwas arsenowy(V)
j) kwas węglowy
3. Podaj wzory następujących soli:
a) siarczan(VI) potasu
b) siarczan(IV) wapnia
c) ortofosforan wapnia
d) siarczan(VI) glinu
e) siarczan(IV) żelaza(III)
f) ortofosforan żelaza(II)
g) azotan(III) amonu
h) chlorek amonu
i) bis-diwodorofosforan wapnia
j) diwodorofosforan sodu
k) wodorosiarczek wapnia
l) siarczek arsenu(V)
m) chromian(III) sodu
n) dichromian(VI) potasu
o) dichlorek wodorotlenek glinu
p) chlorek diwodorotlenek glinu
q) chlorek tlenek bizmutu(III)
r) chlorek tlenek wanadu(IV)
s) bis-(wodorowęglan) wapnia
t) chlorek wodorotlenek magnezu

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
21
4. Nazwij następujące związki koordynacyjne:
a) K
4
[Mn(CN)
6
]
b) K
3
[Mn(CN)
6
]
c) K
5
[Mn(CN)
6
]
d) [CrCl
2
(H
2
O)
4
]Cl
e) [CrCl(H
2
O)
5
]Cl
2
f) [Co(H
2
O)(NH
3
)
5
]Cl
3
g) [CoCl(NH
3
)
5
]Cl
2
h) [Co(NH
3
)
6
]Cl
3
i) [CoCl(H
2
O)(NH
3
)
4
]Cl
2
j) K
3
[Fe(CN)
6
]
k) K
3
[FeF
6
]
l) [PtCl
2
(NH
3
)
2
]
m) [Cu(NH
3
)
4
]SO
4
n) [Cu(H
2
O)
2
(NH
3
)
2
]SO
4
o) (NH
4
)
2
[PtCl
6
]
p) [Ag(NH
3
)
2
]OH
q) K[Ag(CN)
2
]
r) Na
3
[Ag(S
2
O
3
)
2
]
s) [Co(NO
3
)
3
(NH
3
)
3
]
t) Na
2
[Fe(CN)
5
NO]
u) K
4
[Co(CN)
4
]
v) K
2
[Ni(CN)
4
]

S. A. Stępniak – Reakcje i obliczenia w analizie chemicznej
22
5. Napisz wzory następujących związków:
a) Heksacyjanożelazian(III) żelaza(II)
b) Heksacyjanożelazian(II) żelaza(III)
c) Tetrahydroksyglinian sodu
d) Dichlorek pentaakwahydroksoglinu
e) Siarczan(VI) tetraakwamiedzi(II)
f) Siarczan(VI) diakwadiaminamiedzi(II)
g) Chlorek tetraaminadichlorokobaltu(III)
h) Pentacyjanokobaltan(II) potasu
i) Tetracyjanoniklan(II) potasu
j) Dicyjanomiedzian(I) potasu
k) Heksachloroplatynian(IV) amonu
l) Heksacyjanomanganian(III) potasu
Wyszukiwarka
Podobne podstrony:
Nazewnictwo i met otrz zw nieorganicznych
cw 8, 9 zatr zw nieorg
definicje i klasyfikacja zw nieorganicznych
chem nazewnictwo, Nazewnictwo związków organicznych - przykłady
Elementy systematyki związków nieorganicznych Nazewnictwo związków nieorganicznych
nazewnioctwo zw chemicznych id Nieznany
Nazewnictwo związków nieorganicznych rok I
GRUPA A I B AMFOTERYCZNOSC ZW NIEORGANICZNYCH PR
Nazewnictwo związków nieorganicznych
GRUPA A I B OTRZYMYWANIE I WŁAŚCIWOSCI ZW NIEORG pr
cw 8, 9 zatr zw nieorg
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Wzory, Wzor-28 Przykl. ozn. podm. zw. z nier. SP, gm., pow 31 03 03, Zał
Wzory, Wzor-28 Przykl. ozn. podm. zw. z nier. SP, gm., pow 31 03 03, Zał
06042013 Projekt Geodezja przyklad zw
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
więcej podobnych podstron