G
RUPA A
:
O
TRZYMYWANIE I WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH
(
ZAKRES ROZSZERZONY
)
N
UMER W DZIENNIKU
______
PUNKTY
_______
/
32
P
.
K
LASA
______
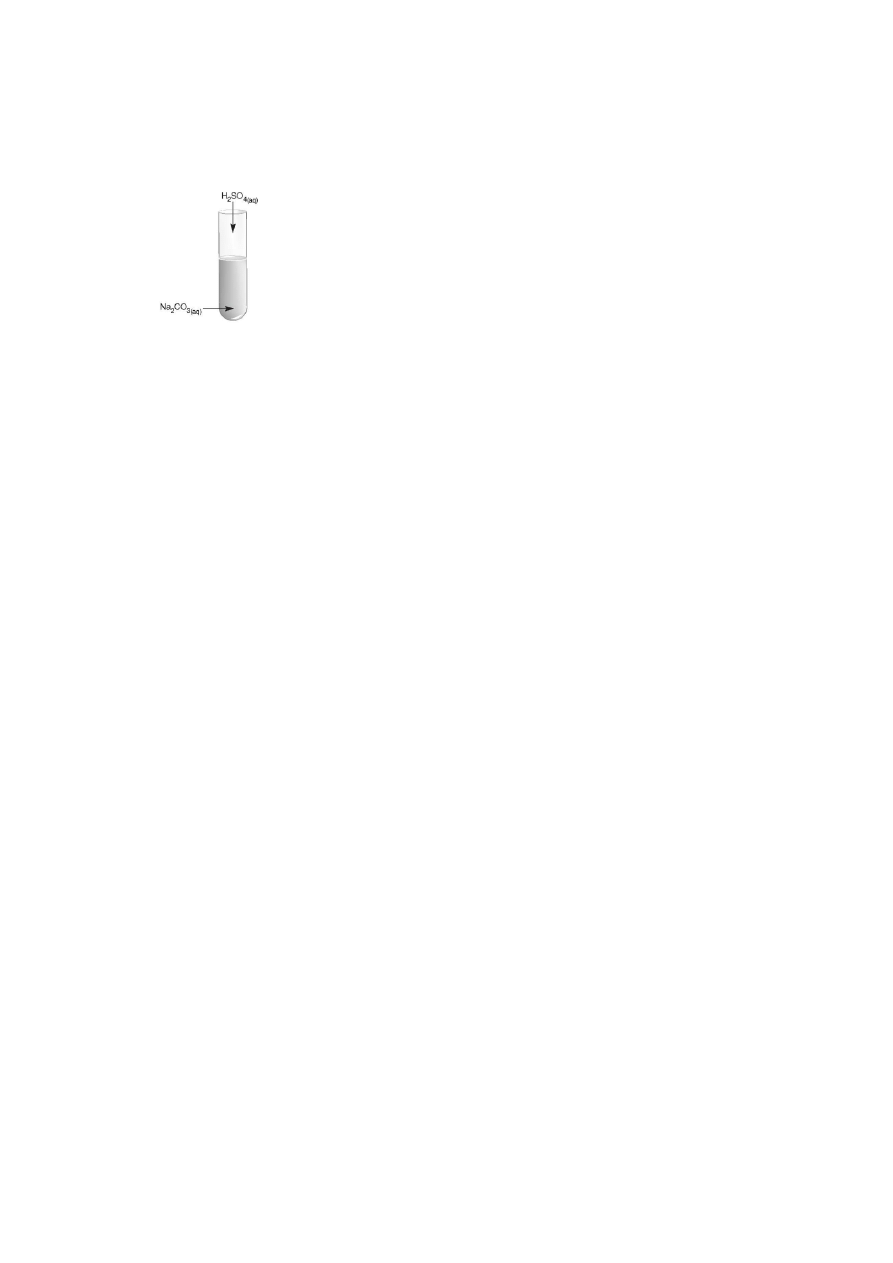
1. (3p.) Przeprowadzono następujące doświadczenie:
Jakie dwie właściwości kwasu zbadano w tym doświadczeniu?
Zapisz równanie reakcji chemicznej.
właściwości:..................................................................................................
........................................................................................................................
reakcja: .........................................................................................................
2. (2p.) Do zlewki zawierającej stężony kwas azotowy(V) wrzucono blaszkę miedzianą.
Zapisz, co zaobserwowano i napisz równanie reakcji, która zaszła.
obserwacje: ..................................................................................................................................
reakcja: .........................................................................................................................................
3. (2p.) Wyjaśnij, dlaczego od efektu doświadczenia zależy kolejność dodawania do
siebie roztworów: wodorotlenku sodu i azotanu(V) glinu. Zapisz niezbędne reakcje
i napisz krótkie wyjaśnienie.
......................................................................................................................................................
......................................................................................................................................................
......................................................................................................................................................
.........................................................................................................................................................
4. (2p.) Kreda jest nierozpuszczalna w wodzie. Wyjaśnij, dlaczego rozpuszcza się
w deszczówce. Zaproponuj odpowiednie równanie reakcji chemicznej obrazujący
proces rozpuszczania się kredy zbudowanej z węglanu wapnia.
......................................................................................................................................................
......................................................................................................................................................
.........................................................................................................................................................
5. (3p.) Wychodząc z krzemu, wodorotlenku sodu, kwasu solnego, tlenu oraz wody
otrzymaj kwas metakrzemowy. Zapis podaj w postaci ciągu przemian.
.........................................................................................................................................................
6. (3p.) Zapisz równania reakcji oznaczone w schemacie: 1 – 3.
żelazo
1
chlorek żelaza(II)
2
wodorotlenek żelaza(II)
3
wodorotlenek żelaza(III)
......................................................................................................................................................
......................................................................................................................................................
.........................................................................................................................................................

7. (2p.) Podane tlenki uszereguj pod względem rosnącej kwasowości i napisz równanie
reakcji najbardziej kwasowego tlenku z najbardziej zasadowym.
CO
2
, Na
2
O, SO
3
, SO
2
, MgO
.........................................................................................................................................................
.........................................................................................................................................................
8. (2p.) Mangan tworzy tlenki o wzorach: MnO, Mn
2
O
7
,
MnO
2
,. Podziel owe tlenki ze
względu na charakter chemiczny.
MnO ...................................... Mn
2
O
7
..................................... MnO
2
.....................................
9. (1p.) Krzemowodór zapala się w zetknięciu z powietrzem, tworząc dwutlenek krzemu
i wodę. Napisz równanie reakcji spalania krzemowodoru.
.........................................................................................................................................................
10. (5p.) Przeczytaj tekst i wykonaj polecenia.
Tlenek węgla (II) (czad)– nieorganiczny, toksyczny, związek chemiczny, który
w temperaturze pokojowej jest bezbarwnym, bezwonnym i niedrażniącym gazem. Jest
łatwopalny - na powietrzu pali się niebieskim płomieniem tworząc dwutlenek węgla.
W naturze występuje w gazach kopalnianych. Ma zastosowanie w wielu procesach
przemysłowych. Temperatura wrzenia wynosi: -191,5 °C, a topnienia: -204 °C.
Jest trudno rozpuszczalny w wodzie. Tlenek węgla (II) ma nieco mniejszą gęstość
od powietrza. Ma on właściwości redukujące, co wykorzystywane jest w hutnictwie.
Z zasadami tworzy mrówczany (nie jest jednak bezwodnikiem kwasowym),
a z amoniakiem – formamid (CH
3
NO). Przyłącza on również chlor tworząc fosgen
(COCl
2
).
A) Wypisz trzy właściwości fizyczne tlenku węgla(II).
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
B) Napisz reakcję spalania tlenku węgla(II).
.........................................................................................................................................................
C) Poniższe piktogramy przedstawiają niebezpieczeństwa, które związane są z tlenkiem
węgla (II). Które z wymienionych w tekście właściwości można przypisać poniższym
obrazkom?
........................................................................................................................................
........................................................................................................................................
D) Podkreśl w tekście właściwość chemiczną tlenku węgla (II), którą potwierdza
równanie reakcji:
CO + NaOH → HCOONa
E) Jaki charakter chemiczny ma opisany w tekście związek chemiczny?
.........................................................................................................................................................
11. (1p.) Ile wodorosoli utworzy kwas pirofosforowy H
4
P
2
O
7
? ........................................................
12. (2p.) Podaj po 3 przykłady substancji pisząc odpowiednie wzory lub nazwy.
a) tlenków reagujących z kwasami i wodą:
.............................................., ............................................., .............................................
b) kwasów beztlenowych jednoprotonowych:
.............................................., ............................................., .............................................
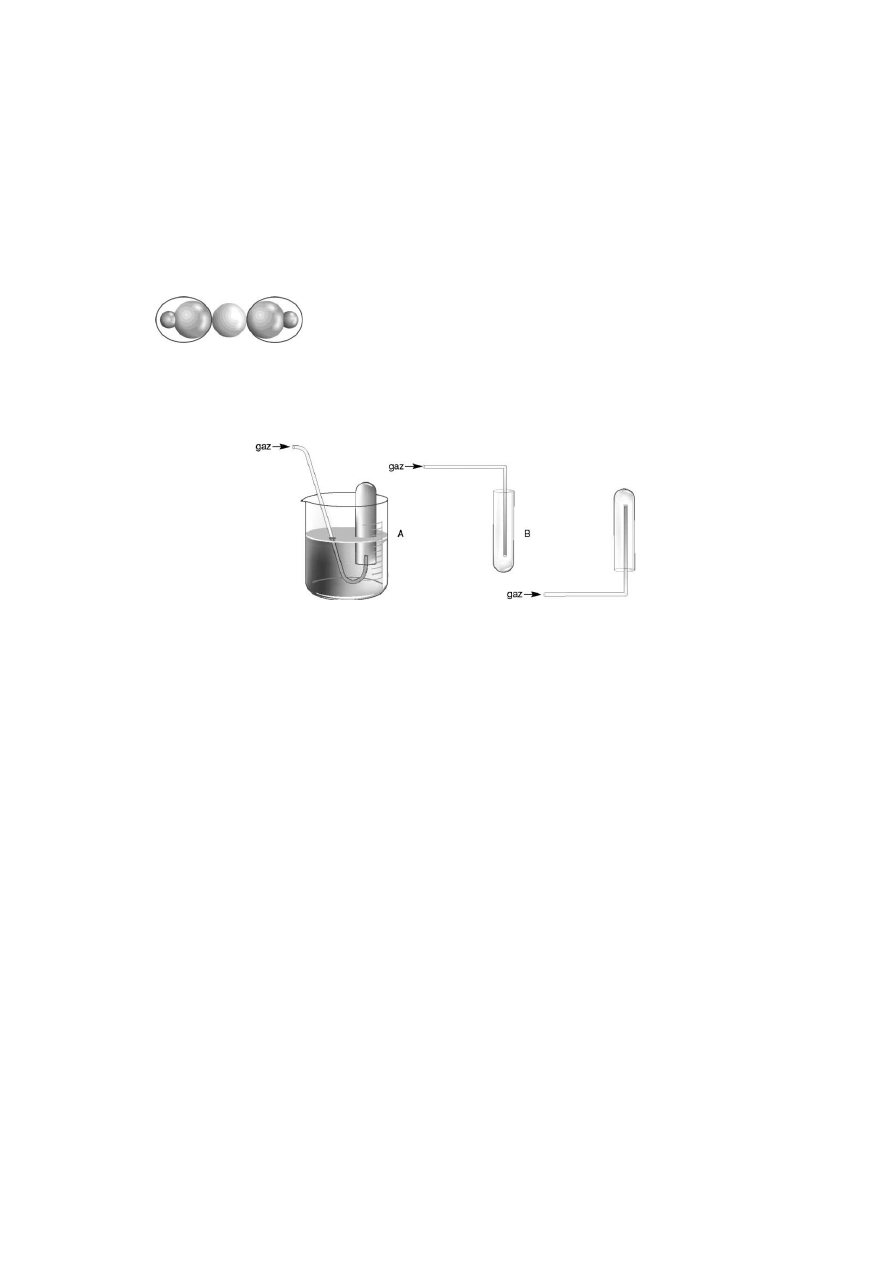
13. (1p.) Poniższy model przedstawia:
a) wodorotlenek cyny(IV);
c) wodorotlenek sodu;
b) wodorotlenek magnezu;
d) wodorotlenek chromu(III).
14. (3p.) Dane są trzy zestawy do zbierania gazów w szkolnej pracowni chemicznej.
Zaznacz, który zestaw można wykorzystać do zbierania amoniaku i wyjaśnij swój wybór.
Wyjaśnij też, dlaczego odrzucasz pozostałe metody.
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
<0;12)=1 <12;17)=2 <17;22)=3 <22;27)=4 <27;32>=5
a) b) c)

G
RUPA B
:
O
TRZYMYWANIE I WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH
(
ZAKRES ROZSZERZONY
)
N
UMER W DZIENNIKU
______
PUNKTY
_______
/
32
P
.
K
LASA
______
1. (2p.) Do klarownego roztworu pewnej soli dodano stechiometryczną ilość kwasu
azotowego(V) i zaobserwowano wytrącenie białego osadu wodorotlenku glinu. Podaj
w jakiej postaci występował glin w badanej soli (kation, czy anion złożony). Napisz
równanie reakcji chemicznej potwierdzającej ten proces.
......................................................................................................................................................
......................................................................................................................................................
2. (2p.) Jedna z soli odpowiedzialna za tworzenie kamienia kotłowego w czajniku to
wodorowęglan wapnia. Jest on rozpuszczalny w wodzie. Co się dzieje z tą solą podczas
gotowania wody w czajniku? Napisz równanie rekcji.
......................................................................................................................................................
......................................................................................................................................................
.........................................................................................................................................................
3. (3p.) Wychodząc z miedzi, wodorotlenku potasu, kwasu azotowego(V) oraz kwasu
solnego otrzymaj kwas tlenek miedzi(II). Zapis podaj w postaci ciągu przemian.
.........................................................................................................................................................
4. (3p.) Poniżej przedstawiono schemat przemian, jakim ulega wodorotlenek manganu(II)
oraz jego otrzymywanie z chlorku manganu(II). Zapisz w formie cząsteczkowej równania
reakcji.
MnCl
2
↓
MnSO
4
← Mn(OH)
2
→ MnO(OH)
2
......................................................................................................................................................
......................................................................................................................................................
.........................................................................................................................................................
5. (2p.) Podane tlenki uszereguj pod względem rosnącej zasadowości i napisz równanie
reakcji najbardziej zasadowego tlenku z najbardziej kwasowym.
K
2
O, SiO
2
, P
4
O
10
, SO
3
, Li
2
O
.........................................................................................................................................................
.........................................................................................................................................................
6. (1p.) Na rysunku przedstawiono model:
a) kwasu azotowego(V);
b) kwasu węglowego;
c) kwasu siarkowego(VI);
d) kwasu ortofosforowego(V).
7. (2p.) Chrom tworzy tlenki o wzorach: Cr
2
O
3
,
CrO, CrO
3
. Podziel owe tlenki ze względu
na charakter chemiczny.
Cr
2
O
3
..................................... CrO
....................................... MnO
3
......................................
8. (5p.) Przeczytaj tekst i wykonaj polecenia.
Chlorek nitrozylu (NOCl) – nieorganiczny związek chemiczny z grupy chlorków
kwasowych (chlorek kwasu azotawego). Jest pomarańczowożółtym, toksycznym
gazem lub ciemnoczerwoną silnie żrącą cieczą. Można go otrzymać przygotowując
wodę królewską, zachodzi wtedy reakcja kwasu solnego z kwasem azotowym(V), w
której powstaje obok chlorku nitrozulu, chlor i woda. Chlorek nitrozylu w wodzie ulega
hydrolizie do kwasu solnego i azotowego(III). Temperatura topnienia wynosi: –62
o
C, a
wrzenia: –5,5
o
C.
A) Zapisz wzór elektronowy opisywanego związku
B) Zapisz trzy właściwości fizyczne chlorku nitrozylu.
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
C) Zapisz równanie reakcji otrzymywania chlorku nitrozylu.
.........................................................................................................................................................
D) Zapisz równanie reakcję chlorku nitrozylu, która zachodzi po rozpuszczeniu
w wodzie.
.........................................................................................................................................................
E) Poniższe lustracje przedstawiają niebezpieczeństwa, które związane są z chlorkiem
nitrozylu. Które z wymienionych w tekście właściwości można przypisać poniższym
obrazkom?
................................................................................................................................
...............................................................................................................................
9. (3p.) Przeprowadzono doświadczenie, które przedstawia schemat:
a) Jak zabarwią się zwilżone papierki uniwersalne przyłożone do wylotów A i B?
A ...............................................................
B ...............................................................
b) Zapisz równanie reakcji zachodzące w naczyniu.
.........................................................................................................................................................
NH
4
Cl
A
B

10. (3p.) Przez naczynie z wodą przepuszczano gazy: NO
2
, oraz N
2
O. Po wykonaniu
doświadczenia okazało się, że jeden z gazów rozpuścił się w wodzie. Który
z wymienionych gazów uległ rozpuszczeniu w wodzie – podaj jego nazwę? Jakiego
indykatora należy użyć w celu zbadania odczynu roztworu i jaką barwę
zaobserwujemy,
W wodzie rozpuścił się: .................................................................................................................
Indykator i barwa: .........................................................................................................................
11. (2p.) Zaproponuj doświadczenie, którego wnioskiem będzie wykazanie, że kwas
metakrzemowy jest słabszym kwasem od kwasu solnego. W tym celu zapisz
odpowiednie równanie reakcji oraz zapisz obserwację.
obserwacje: ..................................................................................................................................
reakcja: .........................................................................................................................................
12. (2p.) Podaj po 3 przykłady substancji pisząc odpowiednie wzory lub nazwy.
a) wodorotlenków tworzących więcej niż jedną hydroksosól
.............................................., ............................................., .............................................
b) kwasów tlenowych wieloprotonwych:
.............................................., ............................................., .............................................
13. (1p.) Metaliczny cynk rozpuszcza się w roztworze wodorotlenku potasu, przy czym
tworzy się cynkanian potasu i wydziela się wodór. Ułóż równanie reakcji.
.........................................................................................................................................................
14. (1p.) Wyjaśnij dlaczego stężony kwas siarkowy (VI) można przewozić w stalowych
cysternach.
.........................................................................................................................................................
.........................................................................................................................................................
<0;12)=1 <12;17)=2 <17;22)=3 <22;27)=4 <27;32>=5
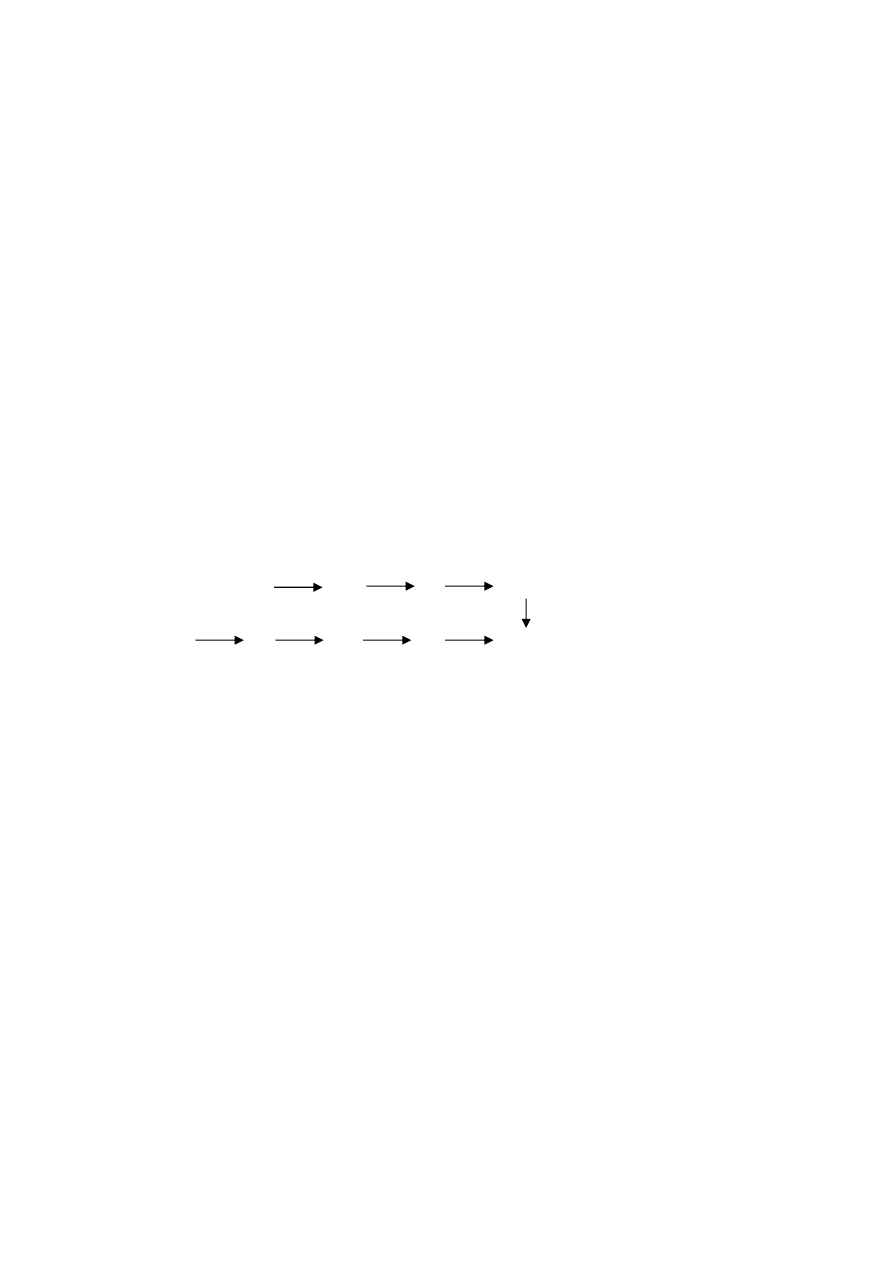
Z
ADANIA DODATKOWE
:
O
TRZYMYWANIE I WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH
(
ZAKRES ROZSZERZONY
)
(O
D
6
P
.
PODWYŻSZONA OCENA O JEDEN STOPIEŃ
)
1. (4p.) Zapisz równania reakcji otrzymywania chromianu potasu wychodząc tylko
z pierwiastków.
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
2. (4p.) Zapisz równania reakcji oznaczone schematem.
O
2
F C
Na A B NaHSO
4
O
2
O
2
F B
S D E C Na
2
SO
4
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
3.
(2p.) Ałuny to podwójne siarczany(VI) metali trój- i jednowartościowych, o ogólnym
wzorze: Me
I2
Me
III2
(SO
4
)
4
·24H
2
O. Podaj wzór ałunu chromowo-potasowego i odpowiedz,
czy czy sól Mohra (disiarczan(VI) diamonu i żelaza(II)) wykazuje izomorficzność z ałunem
chromowo-potasowym? Dlaczego?
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
.........................................................................................................................................................
1 2 3
4
5 6 7 8
Wyszukiwarka
Podobne podstrony:
GRUPA A I B AMFOTERYCZNOSC ZW NIEORGANICZNYCH PR
otrzymywanie i właściwości związków kompleksowych
Nazewnictwo i met otrz zw nieorganicznych
Otrzymywanie i właściwości mydeł sprawozdanie
cw 8, 9 zatr zw nieorg
grupa karbonylowa wlasciwosci(1)
6 Tlenki azotu otrzymywanie, właściwości
definicje i klasyfikacja zw nieorganicznych
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
ISE powtorka z chemii, ISE otrzymywanie i wlasciwosci najwazniejszych kwasow, O
Właściwości związków nieorganicznych, Studia, Chemia, chemia7
estry otrzymywanie i wlasciwosci, biologia, chemia organiczna
OTRZYMYWANIE I WŁAŚCIWOŚCI NANOKOMPOZYTÓW TYPU POLIMER CZĄSTKA MAGNETYCZNA
Metody otrzymywania i właściwości optyczne materiałów z ujemnym współczynnikiem załamania
7 Chem2 Zbiór zadań Załączniki Właściwości zw org Układ
otrzymywanie i właściwości związków kompleksowych
Otrzymywanie i właściwości lanych elastomerów uretanowych
więcej podobnych podstron