
1
P
OLITECHNIKA
P
OZNAŃSKA
I
NSTYTUT
T
ECHNOLOGII
I
I
NŻYNIERII
C
HEMICZNEJ
OTRZYMYWANIE HYDROKSYAPATYTU
1.
Hydroksyapatyt
Jedną z grup minerałów szeroko rozpowszechnionych w przyrodzie są apatyty. Należą
one do grupy fosforanów i są rozpowszechnione we wszystkich typach skał. Minerały
apatytowe stanowią główne źródło fosforu w przyrodzie. Znalazły one zastosowanie
w produkcji nawozów sztucznych, w jubilerstwie oraz w medycynie. Jednym z minerałów
należącym do grupy minerałów apatytowych jest hydroksyapatyt o wzorze Ca
10
(PO
4
)
6
(OH)
2
,
który to stanowi przede wszystkim podstawowy nieorganiczny składnik kości i tkanki zębów.
1.1. Podział hydroksyapatytu
Hydroksyapatyt (HA) ze względu na pochodzenie możemy podzielić na 3 rodzaje:
mineralogiczny, biologiczny i syntetyczny.
1.1.1. Hydroksyapatyt mineralogiczny
Hydroksyapatyt zaliczany jest do grupy minerałów apatytowych. Słowo „apatyt” z
greckiego oznacza „oszustwo”. Nazwa ta została nadana przez Wernera w 1790 roku.
Badacze w tamtym okresie mieli spore trudności w ich rozpoznawaniu i dlatego były mylone
z innymi minerałami np. turmalinem czy oliwin. Apatyty są rozpowszechnione w przyrodzie
jako składniki skał magmowych, osadowych oraz metamorficznych. Występują w Szwajcarii,
Kanadzie, Austrii, Polsce (w Górach Sowich i okolicach Bielsko-Białej). Hydroksyapatyty są
spotykane rzadko. Obecnie spotykane są głównie w USA i Szwajcarii. Jedynym miejscem
gdzie apatyty występowały w dużych ilościach były góry Chybińskie na półwyspie Kola.
Na rys. 1 przedstawiono naturalnie występujący minerał hydroksyapatytu.

2
Rys. 1. Naturalnie występujący minerał HA
1.1.2. Hydroksyapatyt biologiczny
Hydroksyapatyt z grupami CO
3
2-
i jednocześnie mający niedobór wapnia to apatyt
biologiczny. Stosunek molowy Ca/P w apatycie biologicznym wynosi 1,38-1,93.
Hydroksyapatyt biologiczny występuje przede wszystkim w kościach, zębach oraz tkankach
zwapnionych np. kamienie mózgowe, ślinowe, nerkowe, moczowodowe, kamienie nazębne.
W apatytach biologicznych oprócz hydroksyapatytu występują również niewielkie ilości
magnezu, sodu i SiO
2
. W literaturze HA z którego zbudowane są kości określany jest jako
hydroksyapatyt kostny.
1.1.3. Hydroksyapatyt syntetyczny
Hydroksyapatyt stechiometryczny (s-HA) jest ortofosforanem sodu o stosunku
molowym Ca/P równym 1,667. Oprócz s-HA wyróżnia się hydroksyapatyt
niestechiometryczny (ns-HA). Gdy stosunek molowy Ca/P wynosi 1,5-1,667 mówimy o
hydroksyapatycie z niedoborem wapnia. Analogicznie hydroksyapatyt o stosunku Ca/P
większym od 1,667 nazywamy hydroksyapatyt z nadmiarem wapnia. Istnieje również apatyt
węglanowy, który zawiera jony CO
3
2-
. Wyróżnia się 3 rodzaje apatytów węglanowych:
a) typu A jony OH
-
są zastępowane przez jony CO
3
2-
,
b) typu B – jony PO
4
3-
zostają podstawione przez CO
3
2-
,
c) typu AB –zarówno jony OH
-
i PO
4
3-
są zastępowane przez jony CO
3
2-
.
Hydroksyapatyty węglanowe wykazują mniejsze rozmiary kryształów i podwyższoną
rozpuszczalność. Niska krystaliczność powoduje większą reaktywność apatytu, co jest bardzo
przydatne w procesach resorpcji kości. Oprócz wymiany anionów na grupy węglanowe,
można wymienić w małym stopniu jony wapnia na inne pierwiastki np. Mg, Na, K, Cl

3
oraz inne pierwiastki śladowe Sr, Pb, Zn, Cu, Fe. Obecność tych pierwiastków wpływa
na sposób działania enzymów kostnych. Wbudowane substytucyjnie pierwiastki obce
oddziałują na stechiometrię, krystaliczność, odporność chemiczną i fizyczną.
1.2. Hydroksyapatytowe materiały implantacyjne
W technikach implantacyjnych wyróżnia się trzy podstawowe rodzaje wszczepów
przeznaczonych do uzupełniania ubytków kostnych:
a) wszczepy autogenne – tkanka kostna przeniesiona z jednego miejsca na drugie (najczęściej
z talerza biodrowego, kości udowej i piszczelowej),
b) wszczepy allogenne – tkanki pozyskiwane od dawców tego samego gatunku o różnym
genotypie,
c) wszczepy ksenogenne – wszczepy będące odpowiednio przygotowaną tkanką kostną
pochodzącą od dawcy innego gatunku np.: świnia-człowiek.
Przeszczepy autogeniczne związane są z problemem małej powierzchni, która może być
udostępniona do przeszczepu oraz faktem dodatkowych zabiegów. Z przeszczepami
allogenicznymi związane jest natomiast ryzyko odrzucenia nowej kości. Wprowadzenie do
organizmu ludzkiego kości innych ludzi bądź zwierząt również niesie ryzyko groźnych
chorób typu AIDS, żółtaczka, encefalopatie gąbczaste. Z uwagi na powyższe wady
biomateriałów hydroksyapatytowych pochodzenia naturalnego obecnie coraz częściej
wykorzystywane są biomateriały syntetyczne.
Ceramiczne biomateriały hydroksyapatytowe charakteryzują się dużą biozgodnością
oraz zdolnością do tworzenia wiązań chemicznych z tkankami żywymi. Stosowanie materiału
hydroksyapatytowego w postaci litej jest możliwe w produkcji implantów, gdzie nie ponoszą
zbyt dużych naprężeń. Materiał porowaty jest natomiast stopniowo zastępowany przez
regenerującą się kość, podobnie jak przy wszczepieniu tkanki autogennej tkanki gąbczastej.
Hydroksyapatyt w chirurgii kostnej może być stosowany jako: materiał porowaty, składnik
materiału kompozytowego, warstwa na innych podłożach.
1.3. Materiał porowaty
Porowatość ceramiki hydroksyapatytowej stosowanej jako wypełnienie ubytków
kostnych musi być większa niż 55%. Obecność otwartych porów w strukturze HA pozwala na
utworzenie trwałego wiązania implant-kość na skutek wrastania tkanki łącznej i kostnej
wewnątrz porów. Wytrzymałość na rozciąganie i ściskanie porowatego materiału

4
hydroksyapatytowego zależny od całkowitej objętości porów. Jeżeli objętość porów
przekracza 70-80% to wytrzymałość mechaniczna maleje w sposób drastyczny.
1.4. Materiał kompozytowy
Lite materiały hydroksyapatytowe mają ograniczone zastosowanie w chirurgii kostnej
ze względu na słabe właściwości mechaniczne i brak odporności na pęknięcia. Poprzez
wprowadzenie materiału HA do fazy metalicznej, węglowej lub polimerowej można uzyskać
biomateriał o odpowiednich właściwościach pożądanych w chirurgii.
Materiały metalowe charakteryzują się zbyt dużą sztywnością w stosunku
do sztywności kości i ulegają korozji w środowisku biologicznym. W przypadku
zastosowania implantu metalicznego przejmującego całość obciążenia kość łatwiej ulega
resorpcji. Metalem, który jest często stosowany w chirurgii jest tytan, a także jego stopy.
W połączeniu metalu z HA uzyskuje się większą biozgodność oraz trwałe połączenie implant-
kość.
Materiały węglowe znajdują zastosowanie w chirurgii głównie w postaci nanorurek
i włókien. Przy połączeniu włókien węglowych z hydroksyapatytem powstaje materiał
o dobrych właściwościach bioaktywnych. Nanoruki charakteryzują się dużą elastycznością
i sprężystością i mogą być poddawane zmianom kształtów. Dzięki wprowadzeniu
hydroksyapatytu osiąga się trwałe połączenie z kością.
Materiały polimerowe znajdujące zastosowanie w implantologii mają słabe właściwości
mechaniczne. Wytworzenie kompozytu z HA przyczynia się do poprawy właściwości
mechanicznych i biologicznych. Kompozyty polimerowe bioresorbowalne i biostabilne mają
odpowiednie właściwości mechaniczne i biologiczne. W polimerach bioresorbowalnych po
resorpcji faza hydroksyapatytowa może być rusztowaniem dla tkanki łącznej. Z polimerów
bioresorbowalnych w chirurgii kostnej wykorzystuje się głównie kaprolaktamy i polilaktydy.
Natomiast do kompozytów biostabilnych wykorzystywanych w chirurgii kostnej zalicza się
polietylen, polisulfony oraz poli(metakrylan metylu).
1.5. Hydroksyapatytowe materiały powłokowe
Powłoki hydroksyapatytowe wykorzystuje się na różnego rodzaju podłożach przede
wszystkim węglowym i metalowym. Kompozyty węgiel-węgiel charakteryzuje się dużą
biozgodnością i modułem sprężystości. Materiały węglowe cechują się małą aktywnością
biologiczną, którą można podwyższyć przez zastosowanie powłoki hydroksyapatytowej.

5
Do nanoszenia powłoki HA na materiał węglowy stosuje się metodę elektrochemiczną i
napylania plazmowego.
Wśród materiałów metalowych stosowanych w implantologii najczęściej
wykorzystywanym jest tytan. Tytan charakteryzuje się wysoką odporność na korozje i
dobrymi właściwościami biologicznymi. Mankamentem tego metalu jest mała odporność na
ścieranie, możliwość uwalniania składników stopu, co skutkuje stanami zapalnymi i brak
dobrego połączenia z tkanką kostną. Zastosowanie powłoki HA na powierzchni metalu
wydłuża czas użytkowania, polepsza połączenie z tkanką kostną oraz zwiększa odporność na
ścieranie. Nanoszenie powłok hydroksyapatytowch na powierzchnie metalu można
przeprowadzać za pomocą wielu technik m.in. rozpylania termicznego, rozpylania jonowego,
metody laserowej ablacji, metodą zol-żel.
1.2. Struktura hydroksyapatytu
Apatyty stechiometryczne krystalizują w układzie jednoskośnym. Jednoskośny układ
jest rzadkością, ponieważ już minimalne odstępstwo od stechiometryczności powoduje
powstanie struktury heksagonalnej. Parametry komórki sieciowej w układzie jednoskośnym
wynoszą odpowiednio: a=9,4215, b=2a, c=6,8815, γ=120º. Stałe sieciowe dla układu
heksagonalnego w przybliżeniu to
:
a=9,41 , c=6,88 Å.
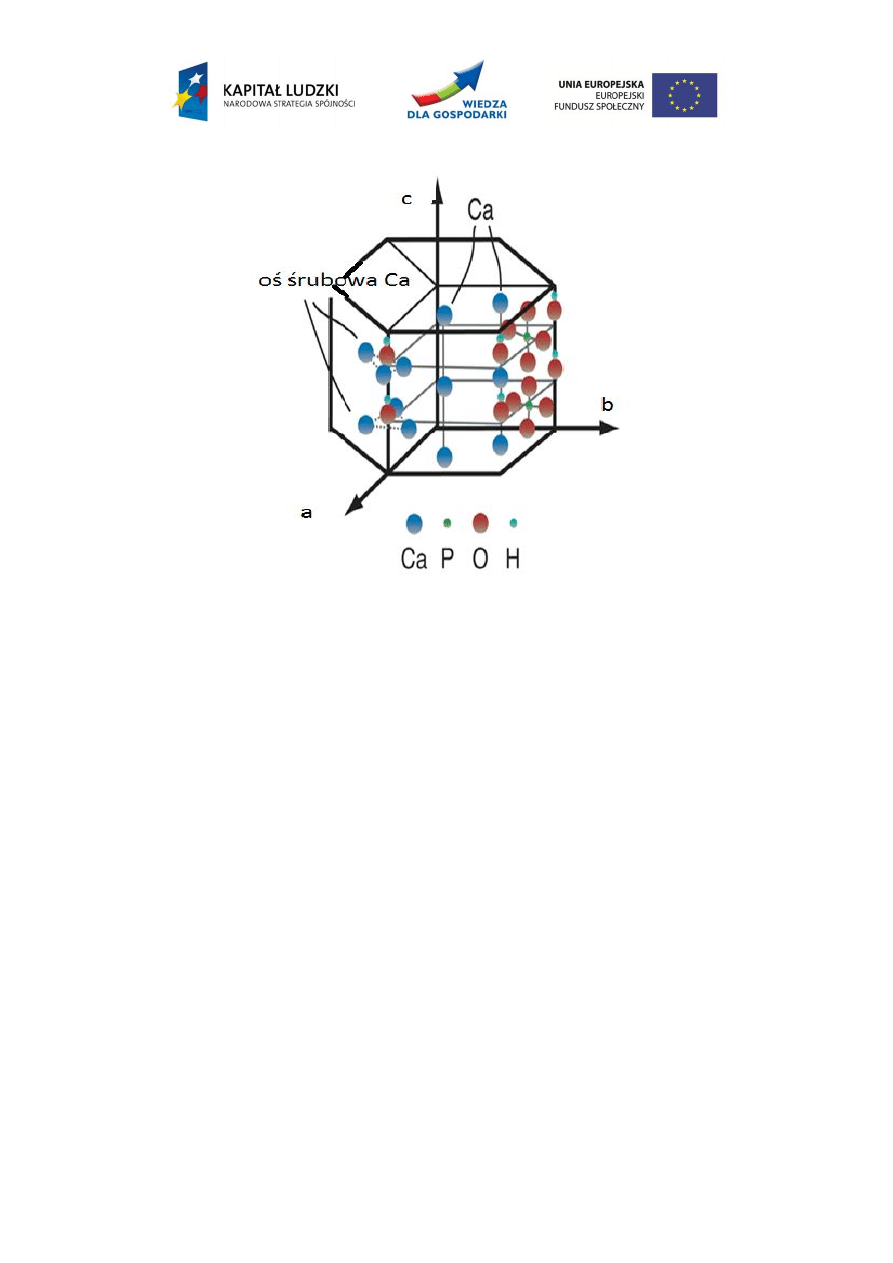
6
Rys. 2. Struktura hydroksyapatytu
W skład komórki elementarnej hydroksyapatytu wchodzą atomy: Ca, P, O, H. Atomy
fosforu wraz z tlenem tworzą grupy fosforanowe, a atomy tlenu z atomami wodoru grupy
hydroksylowe. W komórce elementarnej występują dwa niezależne atomy wapnia. Wapń na
drugim stopniu utlenienia tworzy trójkątne ugrupowania umiejscowione prostopadle do osi c,
wzajemnie przesunięte względem siebie o kąt 60º. Wapń na pierwszym stopniu utlenienia jest
otoczony oktaedrycznie przez 6 atomów tlenu. Atomy wapnia Ca na pierwszym stopniu
utlenienia są umiejscowione w położeniu z=0 i z=0,5.
Zarówno apatyty syntetyczne, biologiczne i stechiometryczne syntezują w układzie
heksagonalnym w grupie P6
3
/m w pozycjach 4 i 6, co pozwala na podstawienie
różnowartościowymi kationami. W strukturze hydroksyapatytu może wystąpić również
zastąpienie anionów innymi anionami, bez zniszczenia struktury komórki elementarnej.
Możliwość wymiany anionów i kationów określana jest na podstawie podobieństwa
wymiarów i ładunków jonów. W tabeli 1 przedstawiono możliwe podstawienia jonów w
strukturze hydroksyapatytu.

7
Tabela 1. Możliwości podstawień jonów w strukturze hydroksyapatytu
Kation podstawiany: Ca
2+
Anion
podstawiany:
PO
4
3-
Anion
podstawiany:
OH
-
Kation
podstawiający
jednowartościowy
Kation
podstawiający
dwuwartościowy
Kation
podstawiający
trójwartościowy
Anion podstawiający
H
3
0
+
Mg
2+
Cr
3+
SO
3
2-
F
-
Na
+
Pb
2+
Fe
3+
CO
3
2-
Cl
-
K
+
Zn
2+
Al
3+
AsO
4
3-
CO
3
2-
Li
+
Cu
2+
VO
3
3-
Br
-
Ag
+
Hg
2+
BO
3
2-
O
2
2-
1.3. Właściwości hydroksyapatytu
Czysty HA bez domieszek charakteryzuje się białą barwą. Jedynie przy poziomie
manganu większym niż 50 ppm niektóre hydroksyapatyty syntetyczne wykazują barwę
niebieską. Kolor niebieski jest tym bardziej intensywny im wyższa jest temperatura spiekania.
Gęstość czystego hydroksyapatytu wynosi 3,156 g/cm
3
. Po obróbce cieplnej gęstość HA
maleje do 3,120 g/cm
3
. Dzieje się tak w skutek utraty wody, która znajduje się w strukturze
hydroksyapatytu.
Proces dehydroksylacji polega na utracie wody bez zmiany struktury hydroksyapatytu.
Dehydroksylacja zachodzi w sposób ciągły, w szerokim zakresie temperatur. Podczas
ogrzewania w środowisku pary wodnej struktura HA nie zmienia się do temperatury około
1100 ºC, natomiast w próżni hydroksyapatyt w temperaturze 850 ºC traci wodę.
Proszki hydroksyapatytu mają zdolność do aglomeracji. Przy stosunku Ca/P=1,5 tworzą
się duże, nieuporządkowane aglomeraty o wielkości sięgającej do 50 µm. Dla HA
stechiometrycznego czyli przy stosunku Ca/P=1,667 rozmiar aglomeratów zmniejsza się do
rzędu 30 µm. Hydroksyapatyt w swojej strukturze posiada pory wielkości nawet rzędu 5 nm.
W związku z tym posiada dobre właściwości sorpcyjne dla kwasów tłuszczowych, lipidów,
a nawet metali ciężkich.
Rozpuszczalność HA jest uzależniona od pH, rodzaju rozpuszczalnika, temperatury,
stosunku Ca/P, obecności innych substancji w roztworze oraz rodzajem podstawienia w sieci
krystalicznej. Hydroksyapatyt słabo rozpuszcza się w wodzie, natomiast roztwór przyjmuje

8
odczyn słabo alkaliczny. Apatyt lepiej niż w wodzie rozpuszcza się w roztworach soli metali,
przy czym najlepiej w solach potasu. Hydroksyapatyt jest nierozpuszczalny w zasadach,
natomiast dobrze rozpuszcza się w kwasach. Biomateriały hydroksyapatytowe w środowisku
biologicznym praktycznie są nierozpuszczalne.
Hydroksyapatyt jest dielektrykiem, przez co nie hamuje sygnałów elektrycznych i nie
ulega nagrzewaniu. Apatyt może ulec rozkładowi termicznemu. Rozkład termiczny
hydroksyapatytu o stosunku molowym Ca/P=1,667 można zaobserwować powyżej
temperatury 1430 ºC. Rozkład termiczny prowadzi do przemiany hydroksyaptytu w postać
tetraoksydofosforanu wapnia (α-TCM) oraz fosforanu czterowapniowego (TTCP). Dla
apatytów niestechiometrycznych temperatura rozkładu jest niższa – spada poniżej 1000 ºC i
prowadzi do powstania różnego rodzaju produktów w zależności od składu wyjściowego
substratu.
Tabela 2. Zestawienie wybranych właściwości fizykochemicznych hydroksyapatytu
Parametr
Wartość
Temperatura wrzenia
3227 ºC
Temperatura topnienia
1570 ºC
Gęstość
3156 kg/m
3
Powierzchnia właściwa
12,5-22,9 m
2
/g
Rozpuszczalność w wodzie i zasadach
Niska
Rozpuszczalność w kwasach
Wysoka
Zdolność wymiany jonowej
Wysoka
Hydroksyapatyt jest materiałem biologicznie aktywnym. Wykazuje dużą biotolerancję,
ponieważ jego skład chemiczny i fazowy jest identyczny ze składem kości ludzkiej. Jednakże
wykazuje słabe właściwości mechaniczne. Jest kruchy oraz pęka pod wpływem większych
obciążeń co ogranicza zakres jego zastosowań jako samodzielnych substancji.
1.4. Zastosowanie hydroksyapatytu
Hydroksyapatyt jest podstawowym składnikiem budulcowym kości, tkanki kostnej oraz
szkliwa zębowego. Ze względu na swoje specyficzne właściwości znajduje szerokie
zastosowanie w medycynie i stomatologii. Jest powszechnie stosowanym materiałem do
wyrobu bioceramiki hydroksyapatytowej.

9
Biomateriały HA są stosowane w postaci materiałów porowatych, powłokowych lub
jako składniki kompozytu. Czysty hydroksyapatyt wykazuje słabe właściwości mechaniczne,
dlatego może być stosowany w miejscu gdzie stopień obciążenia jest znikomy.
Hydroksyapatyt ma zazwyczaj postać proszku, granulek dlatego łatwo go wbudować w
dowolną przestrzeń. Ma to zazwyczaj zastosowanie w rekonstrukcjach stomatologicznych np.
szczękowo-czaszkowych. Hydroksyapatyt w fazie początkowej stanowi rusztowanie, później
sprzyja naturalnemu odbudowaniu kośćca.
Zbyt mała odporność mechaniczna czystego HA powoduje, że coraz częściej w
implantologii stosowane są materiały kompozytowe np. z metalami lub włóknami
węglowymi. Kompozyty z metalami mają zastosowanie w produkcji implantów narażonych
na duże obciążenia np. endoproteza stawowa, wszczepy stomatologiczne.
W stomatologii hydroksyapatyt ma również inne zastosowania niż produkcja
implantów. Naturalny hydroksyapatyt służy jako ścierwo w technice technika służącej do
oczyszczania powierzchni zębów ze złogów nazębnych za pomocą ścierniwa tzw.
airpolshingu. Naturalny HA oczyszcza zęby z osadów, nalotów, kamienia nazębnego.
Stanowi dobry materiał demineralizacyjny, który odbudowuje wzmacnia szkliwo zębowe.
Hydroksyapatyt z powodzeniem stosowany jest również do produkcji past i płynów do
płukania jamy ustnej.
Hydroksyapatyt stosowany jest również jako nośnik leków do kości. Zastosowanie
takiego rozwiązania skutkuje krótszym czasem hospitalizacji i ułatwia powrót pacjentowi do
sprawności fizycznej w krótszym czasie niż w przypadku zastosowania leczenia
chirurgicznego. Zastosowanie preparatów typu chitozan, kolagen czy innych polimerów
wspomaga rekonstrukcję tkanek. W leczeniu osteoporozy zastosowanie kompozytu
nanohydroksyapatyt/chitozan wpływa na skrócenie okresu regeneracji i rekonwalescencji (w
porównaniu z leczeniem czystym chitozanem). Dodatkowo HA w kontakcie z bakteriami
Staphylococcus ureus hamuje powiększenie i podział bakterii.
W ostatnich latach bardzo atrakcyjne stało się domieszkowanie nanohydroksyapatytu za
pomocą lantanowców. Dzięki właściwością luminescencyjnym pierwiastków ziem rzadkich
domieszkowane nanohydroksyapatyty są stosowane jako luminescencyjne biosensory.
Dodatkowe domieszkowanie nonohydroksyapatyt jonami srebra może powodować
polepszenie właściwości przeciwbakteryjnych.
Hydroksyapatyt znajduje ponadto zastosowanie w terapii przeciwnowotworowej.
Magnetyczne cząstki HA z dodatkiem Fe
2+
testowano podczas terapii hipertermalnej.

10
Zaobserwowano zmniejszenie objętości guza na skutek wprowadzenia tego środka. Duży
stopień porowatości sprawia, że hydroksyapatyt znajduje również ma również zastosowanie
przy oczyszczaniu ścieków z metali ciężkich lub do rozdziału substancji. Przydatny jest
również w procesie oczyszczania olei lub alkoholi.
2.
Metody otrzymywania hydroksyapatytu w formie proszków
Do najpopularniejszych metod otrzymywania proszków HA możemy zaliczyć:
metody mokre,
metody suche,
pozostałe (elektrokrystalizacja, liofilizacja, zol-żel).
Metody suche to metody polegające na reakcji substancji w stanie stałym w bardzo
wysokich temperaturach, sięgających nawet 1000 ͦ C. Do substancji proszkowych będących
najczęściej stosowanymi substratami tej metody zalicza się: dwuwodny wodorofosforan
wapnia CaHPO
4
*2H
2
O, węglan wapnia CaCO
3
oraz Ca
2
P
2
O
5
.Wykorzystując tą metodę
otrzymuje się proszki o dużym stopniu krystaliczności, jednakże spiekanie w wysokich
temperaturach obniża reaktywność otrzymywanego materiału.
Do alternatywnych metod otrzymywania proszków HA możemy zaliczyć takie
techniki jak elektrokrystalizacja, liofilizacja, metoda topnikowa oraz metoda zol-żel.
2.1. Metody mokre otrzymywania hydroksyapatytu
Do
najpowszechniej
wykorzystywanych
metod
otrzymywania
proszków
hydroksyapatytu możemy zaliczyć metody mokre. Opierają się one na reakcjach chemicznych
prowadzonych w roztworach wodnych, przy jednoczesnym zachowaniu odpowiedniego pH.
Metody te pozwalają na otrzymywanie materiałów głównie amorficznych, lub o bardzo
niskim stopniu krystaliczności. Substratami tych reakcji są zazwyczaj kwasy i zasady, lub
sole wapniowe i fosforanowe. W tabeli 3 przedstawiono substraty najczęściej
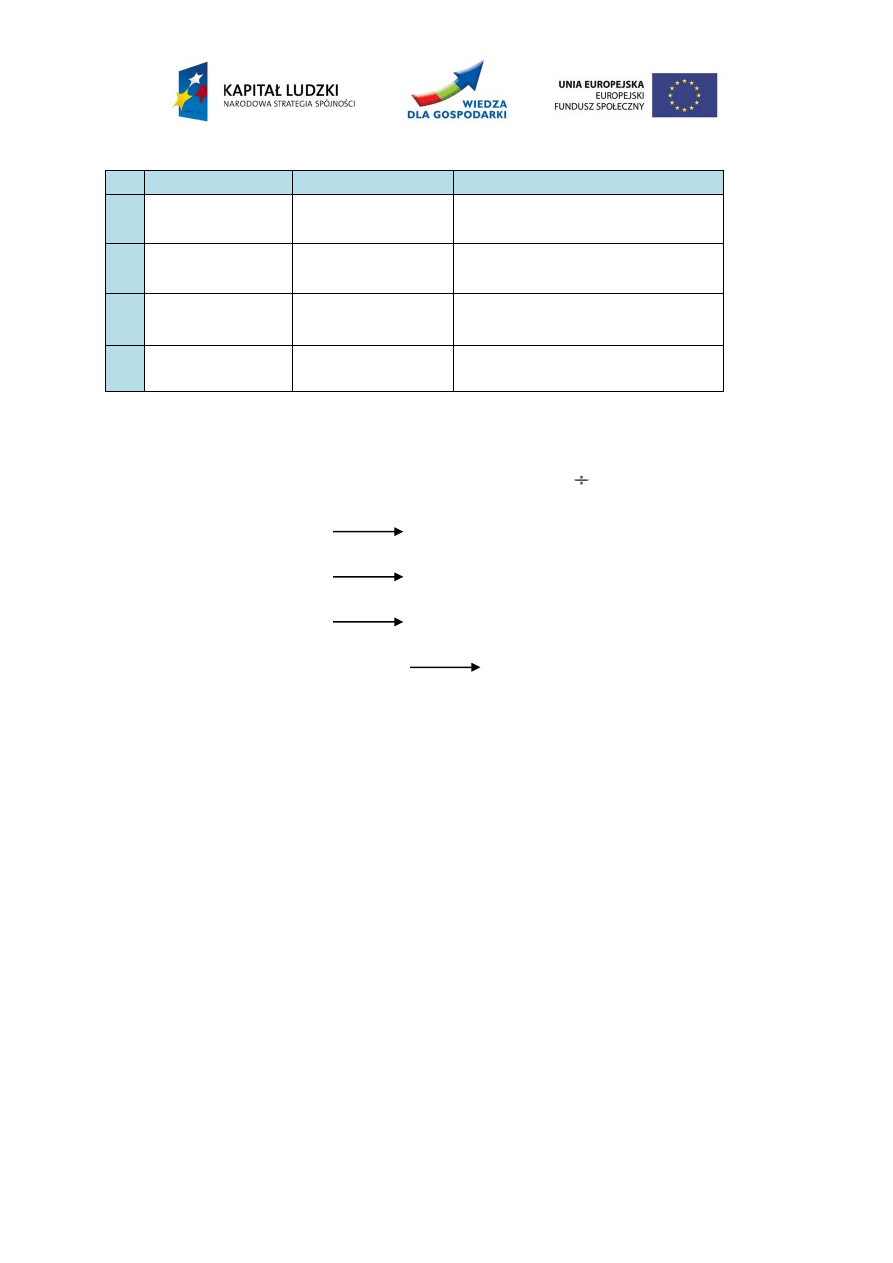
wykorzystywane do syntezy hydroksyapatytu metodami mokrymi.
11
Tabela 3. Substraty wykorzystywane do syntezy hydroksyapatytu metodami mokrymi
L.P.
Substrat 1
Substrat 2
pH roztworu
1
Ca(NO
3
)
2
(NH
4
)
2
HPO
4
pH 8÷12
2
Ca(OH)
2
H
3
PO
4
pH 8
3
CaCl
2
Na
2
HPO
4
4
Ca(NO
3
)
2
(NH
4
)
3
PO
4
pH ≥ 9
Proces otrzymywania hydroksyapatytu z wykorzystaniem substratów zawartych w tabeli 3
przebiega zgodnie z poniższymi równaniami reakcji (równania 1 4):
10Ca(NO
3
)
2
+ 6(NH
4
)
2
HPO
4
Ca
10
(PO
4
)
2
(OH)
2
+ 12NH
4
NO
3
+ 8HNO
3
(1)
10Ca(OH)
2
+ 6H
3
PO
4
Ca
10
(PO
4
)
2
(OH)
2
+ 18H
2
O (2)
10CaCl
2
+ 6Na
2
HPO
4
+ 2H
2
O Ca
10
(PO
4
)
2
(OH)
2
+ 12NaCl + 8HCl (3)
10Ca(NO
3
)
2
+ 6(NH
4
)
3
PO
4
+ 2NH
3
*H
2
O Ca
10
(PO
4
)
2
(OH)
2
+ 20NH
4
NO
3
(4)
W metodach mokrych wśród czynników mających istotny wpływ na właściwości
fizykochemiczne produktu zalicza się :wzajemny stosunek ilościowy reagentów, szybkość z
jaką dozujemy poszczególne roztwory, czystość reagentów, szybkość mieszania roztworu,
pH, temperatura wytrącania, czas i temperaturę dojrzewania osadów oraz atmosfera reakcji.
Operowanie wyżej wymienionymi czynnikami wpływa na strukturę otrzymywanego
materiału, która może przybierać formę kryształów o kształcie płaskich płytek, prętów, igieł
lub równoosiowych kryształów. Niezależnie od użytych substratów proces otrzymywania
hydroksyapatytu metodami mokrymi składa się z kilku operacji jednostkowych:
przygotowanie zawiesin lub roztworów substratu o odpowiednim stężeniu,
dozowanie substratu kroplami w ilości wynikającej ze stechiometrii,
mieszanie roztworu przez określony czas w odpowiednim pH i temperaturze,
filtracja oraz przemywanie wytrąconego osadu,
suszenie produktu.

12
Każdy z wyżej wymienionych procesów jednostkowych ma istotny wpływ na
strukturę otrzymanego produktu. Odpowiedni dobór warunków prowadzenia procesu pozwala
na otrzymywanie produktu różniącego się kształtem i rozmiarem. Stwierdzono, że wraz ze
wzrostem temperatury prowadzenia procesu wzrasta długości i szerokość cząstek
hydroksyapatytu, natomiast maleje skłonność do aglomeryzacji. Analizując wpływ stężenia
substratów, zaobserwowano, że przy małych stężeniach otrzymuje się cząstki kuliste o
niewielkiej średnicy, natomiast jego wzrost prowadzi do zmiany kształtu cząstek na bardziej
nitkowaty. Wysuszony produkt można poddać procesowi kalcynacji w temperaturze
300 1200 ͦC zwiększając stopień krystaliczności powstałego osadu. Zaobserwowano, że
wzrost temperatury kalcynacji powyżej 1000 ͦC powoduje powstawanie w produkcie
dodatkowych faz takich jak tlenek wapnia oraz fosforan trójwapniowy, co jest zjawiskiem
niepożądanym.
Zaletą metod mokrych jest możliwość wprowadzania do struktury hydroksyapatytu
obcych pierwiastków takich jak magnez, sód i potas na zasadzie substytucji, ponieważ
występują one naturalnie w tkance kostnej.
2.2. Otrzymywanie hydroksyapatytu, metoda hydrotermalna
Do metod mokrych otrzymywania hydroksyapatytu w formie proszku możemy
zaliczyć również metody hydrotermalne. Technika ta charakteryzuje się prowadzeniem
procesu w autoklawach w wysokich temperaturach rzędu 120 300 ͦC oraz pod wysokim
ciśnieniem pary wodnej (0,2 8 MPa). Jako surowce wyjściowe zastosowanie znalazły takie
związki jak monetyt CaHPO
4
, bruszyt CaHPO
4
*2H
2
O, aragonit CaCO
3
i inne. Zastosowanie
znajdują również substraty wykorzystywanych w tradycyjnych metodach mokrych. W
metodzie tej istotny wpływ na stechiometrię otrzymanego produktu ma pH środowiska
reakcji. Wzrastające pH powoduje, że stosunek molowy jonów PO
4
3-
/Ca
2+
ulega zwiększeniu.
Metody hydrotermalne pozwalają na wprowadzenie do struktury związku kationów oraz
anionów. Jony wapnia mogą być zastąpione przez takie jony jak Ba
2+
, Pb
2+
, Mg
2+
i wiele
innych. Natomiast grupy fosforanowe, rzadziej hydroksylowe mogą być zastępowane przez
jony węglanowe, krzemianowe. Modyfikacje te są ważnie w celu uzyskania produktu o
specyficznych właściwościach.
13
Ważnym czynnikiem w syntezie hydrotermalnej jest dobór odpowiedniego
rozpuszczalnika. Do najczęściej stosowanych zalicza się wodę, ale używa się także
mieszaniny alkoholu i wody, np. izopropanolu i wody. Zawartość izopropanolu w mieszaninie
istotnie wpływa na właściwości otrzymywanego produktu. Wraz ze wzrostem zawartości
alkoholu w mieszaninie, następuje zwiększenie ilości grup węglanowych w produkcie oraz
spadek jego krystaliczności. Stwierdzono również, że rodzaj rozpuszczalnika wpływa na
morfologię i tendencję do aglomeryzowania cząstek, im więcej alkoholu tym większa
tendencja do tworzenia aglomeratów [30].
CZĘŚĆ DOŚWIADCZALNA
1. Metodyka formowania proszków HA
W procesie otrzymywania hydroksyapatytu użyto dwóch prekursorów CaCl
2
oraz
(NH
4
)
2
PO
4
. Reakcję przeprowadzono w kolbie trójszyjnej okrągłodennej dozując do 200 cm
3
CaCl
2
taką samą objętość (NH
4
)
2
HPO
4
, substrat dozowano za pomocą pompy perystaltycznej
PP1B-05A. Mieszaninę reakcyjną ujednorodniano za pomocą mieszadła z szybkością 1000
obr./min. Regulację pH środowiska reakcji, przeprowadzono dodając porcjami 25% wody
amoniakalnej, utrzymując pH 10. Reakcję przeprowadzono w trzech różnych wariantach
stężenia, temperatury oraz szybkości dozowania wodorofosforanu amonu, w tabeli 4
przedstawiono zestawienie warunków procesowych użytych w badaniach. Po zadozowaniu
całej ilości wodorofosforanu amonu układ ujednorodniano jeszcze przez 30 min.
Tabela 4. Zestawienie warunków procesowych otrzymywania HA
Warianty procesu
1
2
3
Stężenia [mol/dm
3
]
CaCl
2
: (NH
4
)
2
HPO
4
0,5 : 0,3
0,75 : 0,45
1,00 : 0,75
Temperatura [
ͦ
C]
40
60
80
Szybkość dozowania
[cm
3
/min.]
2,4
3,3
4,6

14
Otrzymany osad oddzielono od mieszaniny reakcyjnej poprzez sączenie i przemyto go gorącą
wodą. Suszenie przeprowadzono w suszarce stacjonarnej w temperaturze 105
ͦ
C w czasie
około 15 h.
2. Oznaczanie parametrów fizykochemicznych syntetycznego hydroksyapatytu
Hydroksyapatyt musi odpowiadać określonym normom, które decydują o jej
przydatności w danej technologii. Z tego powodu potrzebna jest dokładna znajomość jego
właściwości fizykochemicznych takich jak: gęstość nasypowa, chłonność wody, ftalanu
dibutylu i oleju parafinowego; wielkość uziarnienia, powierzchnia właściwa; porowatość;
zwilżalność czy potencjał elektrokinetyczny.
2.2. Gęstość nasypowa
Gęstość nasypowa jest pośrednią miarą stopnia rozwinięcia powierzchni ziaren
hydroksyapatytu. Jej wartość określa stopień zagęszczenia luźno nasypanego materiału.
Do cylindra miarowego o określonej wielkości wsypuje się przesianą przez sito badaną
próbkę HA za pomocą lejka, którego dolna krawędź wylotu znajduje się w odległości 50 mm
od górnej krawędzi cylindra do momentu wytworzenia się stożka nad cylindrem. Stożek
wyrównuje się za pomocą pręta lub listewki z górnym brzegiem cylindra.
Gęstość nasypową oblicza się ze wzoru:
3
1
2
n
10
V
G
G
D
gdzie: D
n
– gęstość nasypowa, g/dm
3
,
G
1
– masa cylindra pustego, g,
G
2
– masa cylindra z próbką, g,
V – objętość cylindra, cm
3
.

15
2.3. Chłonność wody oraz oleju parafinowego lub ftalanu dibutylu
Chłonność wody przez powierzchnie HA charakteryzuje stopień aglomeracji i stanowi o
hydrofilowości produktu. Z pomiaru chłonności wody można łatwo określić zmianę stopnia
hydrofilowości jako podstawowego kryterium pozwalającego w łatwy i szybki sposób
zorientować się w zmianach powierzchniowych.
Chłonność ftlanu dibutylu i oleju parafinowego świadczy natomiast o hydrofobowym
charakterze chemicznym powierzchni uzyskanego hydroksyapatytu.
2.4. Chłonność wody
Próbkę HA o masie 0,1 g (1,00 ± 0,05 g) przesianą przez sito i wysuszoną w ciągu 2 h
w temperaturze 100-105°C zadaje się na płytce ceramicznej wodą destylowaną o pH = 7 ± 0,5
z mikrobiurety. Po dodaniu każdych 2-3 kropel wody rozciera się próbkę na jednorodną pastę
za pomocą elastycznej łopatki ze stali nierdzewnej. Dodawanie wody i rozcieranie próbki
prowadzi się do momentu całkowitego zwilżenia próbki. Punkt końcowy oznaczenia ustala
się w tym momencie, gdy nadmiar 1 kropli wody spowoduje wyraźne upłynnienie tworzącej
się pasty.
Chłonność wody oblicza się ze wzoru:
2
w
10
m
V
H
gdzie: H
w
– chłonność wody, cm
3
/100 g,
V – ilość zużytej wody, cm
3
,
m – naważka badanej próbki, g.
2.5. Chłonność oleju parafinowego lub ftalanu dibutylu
Odpowiednio przygotowaną próbkę HA, tak jak do oznaczenia chłonności wody zadaje
się na płytce ceramicznej olejem parafinowym lub ftalanem dibutylu z mikrobiurety. Po
dodaniu 1-3 kropel oleju lub ftalanu rozciera się próbkę na jednorodną pastę za pomocą
łopatki. Olej lub ftalan dodawano do momentu uzyskania spoistej masy podobnej do kitu.
Punkt końcowy oznaczenia ustala się, gdy nadmiar 1 kropli oleju lub ftalanu zmienia
gwałtownie konsystencję pasty, która przywiera do płytki i łopatki.

16
Chłonność oleju lub ftalanu należy obliczyć ze wzoru:
2
o(f)
10
m
V
H
gdzie: H
o(f)
– chłonność oleju lub ftalany, cm
3
/100 g,
V – ilość zużytego oleju parafinowego lub ftalanu dibutylu, cm
3
,
m – naważka badanej próbki, g.
Wyszukiwarka
Podobne podstrony:
Sprawko otrzymywanie hydroksyapatytu
6 Otrzymywanie (4R,5R) – 4, 5 – bis (difenylo hydroksymetylo) 2,2 dimetylodioksolanu (TADDOLu)
Chemia Metody otrzymywania soli; wodorosole i hydroksysole
6.Otrzymywanie (4R,5R) – 4, 5 – bis (difenylo-hydroksymetylo)-2,2-dimetylodioksolanu (TADDOLu)
6 Otrzymywanie (4R,5R) – 4, 5 – bis (difenylo hydroksymetylo) 2,2 dimetylodioksolanu (TADDOLu)
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
31 Metody otrzymywania i pomiaru próżni systematyka, porów
otrzymywanie soku jablkowego(1)
Charakterystyka sprzęgła hydrokinetycznego przy stałej prędkości
otrzymywanie polprzewodnikow
10 Metody otrzymywania sztywnych pianek poliuretanowych
otrzymywanie tlenu i siarki, charakterystyka poszczególnych grup układu okresowego
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
metody otrzymywania plynow 1, Kosmetologia, Chemia
Otrzymywanie mocznika (1cw)
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
GALACTOARABINAN polisacharyd otrzymywany z modrzewia w preparatach pielęgnacyjnych
otrzym 2 aminy w 2
więcej podobnych podstron