
Metody otrzymywania
zwierząt transgenicznych

Na przestrzeni ostatnich 30 lat w naukach
biologicznych i medycznych zwierzęta transgeniczne
stały się niezwykle ważnym i przydatnym narzędziem.
Na początku lat 80 tych ubiegłego wieku podjęto
pierwsze próby otrzymania zwierząt transgenicznych.
Badacze Gordon i Rudle oraz Lacy i Costantini podjęli
się otrzymania myszy transgenicznych

Opanowanie hodowli zarodków poza ustrojem, a
także możliwości ich modyfikacji, oraz możliwości
biologii molekularnej pozwalające na dowolność
konstruowania danego fragmentu DNA pozwoliły na
otrzymanie zwierząt transgenicznych.
Zwierzęta transgeniczne posiadają w swoim
genomie, egzogenny DNA.
Co dało możliwość otrzymania
zwierząt transgenicznych?

Metody otrzymywania zwierząt
transgenicznych
Dzisiaj naukowcy dysponują cztema podstawowymi
metodami:
•Mikroiniekcja DNA
•Transfer genu przy pomocy wektorów wirusowych
•Modyfikacja pierwotnych komórek macierzystych.
•Transplantacja jąder komórkowych.
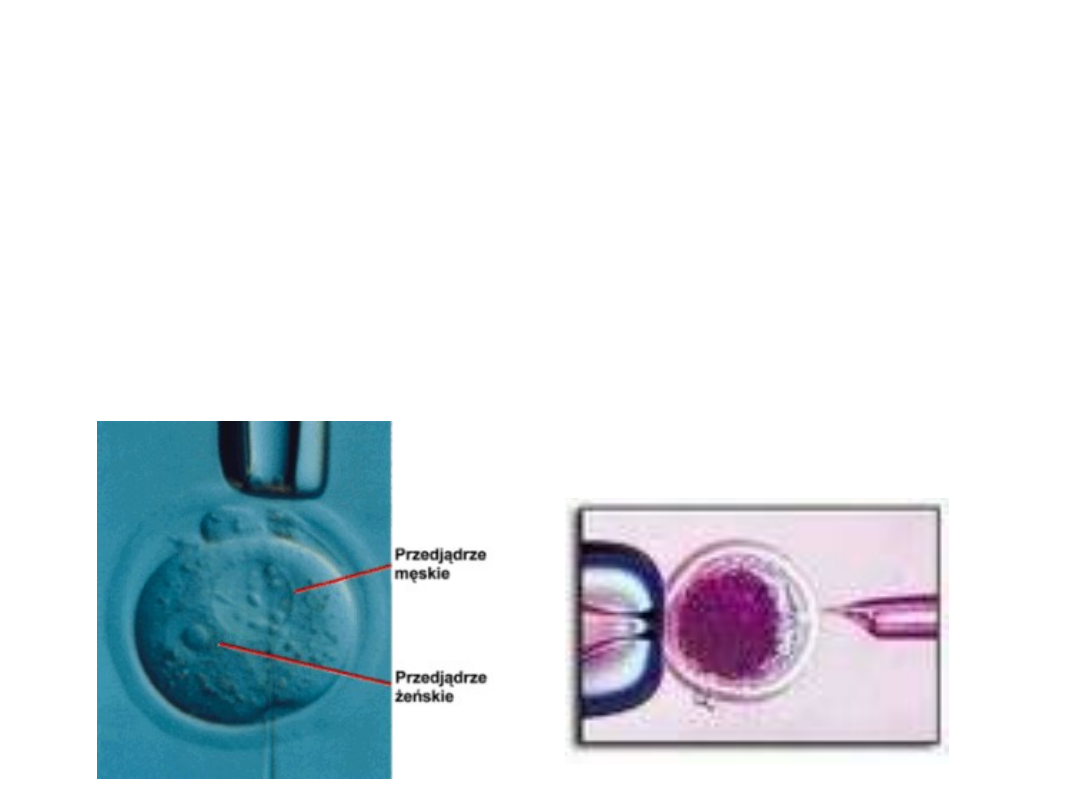
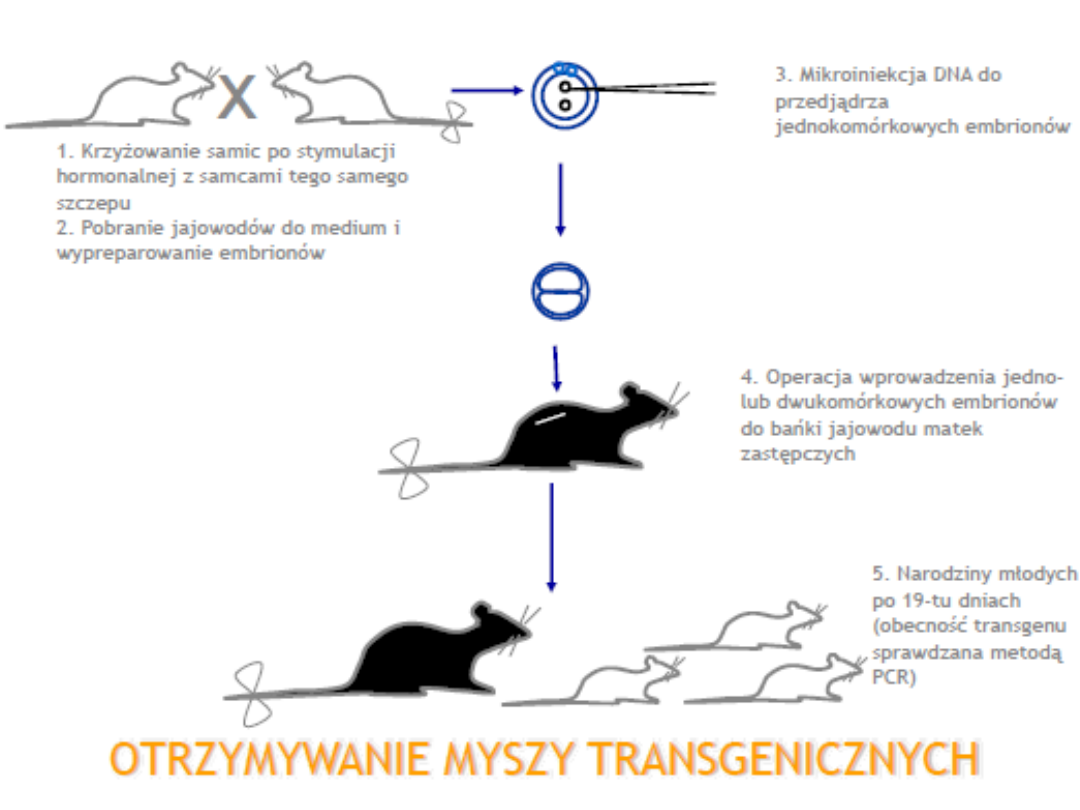
Mikroiniekcja DNA
Metoda ta wykorzystuje mikroiniekcję DNA do
przedjądrza jednokomórkowej zygoty lub zarodka.
Wykonuje
się
to
przy
pomocy
szklanej
mikrochirurgicznej pipety.
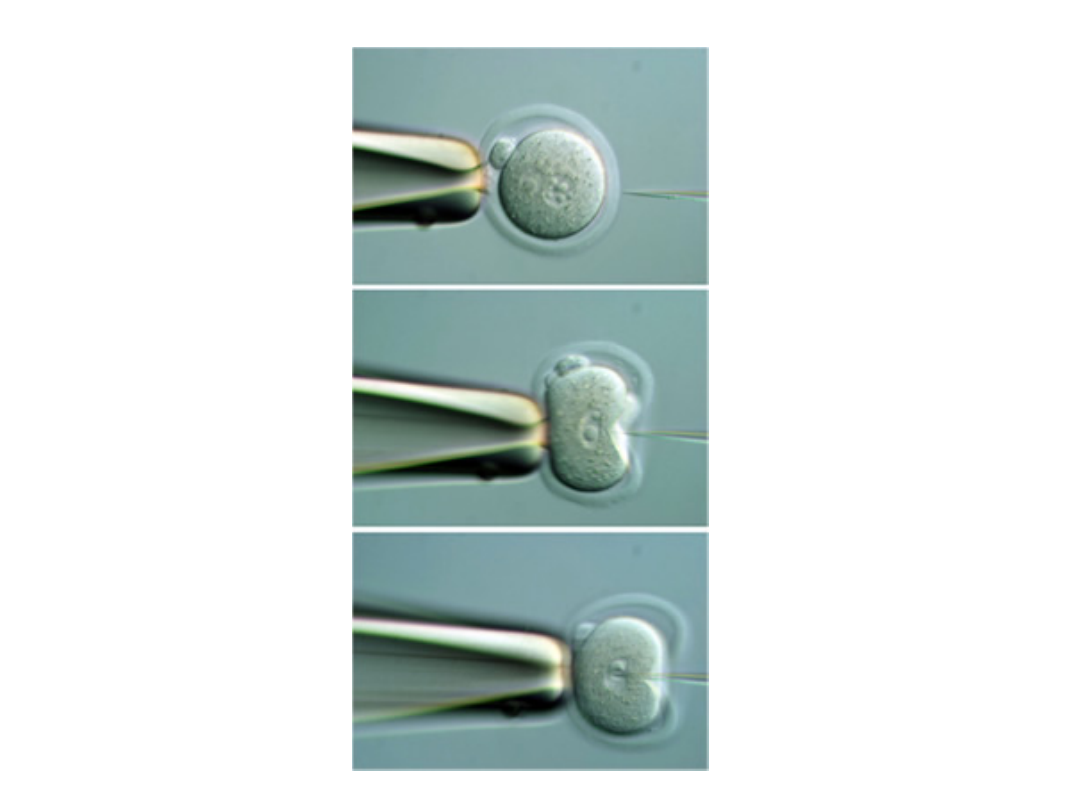

DNA w postaci roztworu jest wstrzykiwany do
wybranego przedjądrza i dalej hodowany in vitro do
stadium dwukomórkowego. Zarodki które przeżyją
mikroiniekcję, a jest ich zwykle około 50 %
implantowane są w macicy matek zastępczych.
Otrzymany w ten sposób organizm transgeniczny
może mieć wcześniej wprowadzony gen we
wszystkich komórkach lub być tak zwaną chimerą,
czyli organizmem, którego komórki nie są
jednakowe pod względem genomu.

W praktyce oznacza to, że nie we wszystkich
komórkach jest obecny transgen. Jest to spowodowane
faktem, że integracja transgenu do genomu zaszła po
pierwszym podziale komórkowym. Wówczas tylko
jedna z komórek potomnych będzie posiadała
transgen. Powyższy fakt ma olbrzymie znaczenie w
przypadku
zamiaru
wyprowadzenia
linii
transgenicznej, bowiem gdy dochodzi do sytuacji, że w
komórkach płciowych transgen będzie nieobecny, to
nie dojdzie do przekazania go następnym pokoleniom.

Zalety metody mikroiniekcji DNA
• można ją stosować przy wielu różnych gatunkach
• nie
ma
ona
ograniczenia
w
rozmiarze
wstrzykiwanego DNA
• brak ograniczenia rozmiaru wstrzykiwanego DNA
• stosunkowo prosta
• szerokie
zastosowanie
w
tworzeniu
transgenicznych zwierząt

Wady metody mikroiniekcji
DNA
• Brak możliwości dokładnego kontrolowania objętości
wstrzykiwanego roztworu DNA
• nie ma możliwości wyboru lokalizacji takiej integracji
wstrzykniętego transgenu z genomem gospodarza
• Efektywność metody nie jest zadowalająca (1/200 u
królików, świń i owiec, u myszy 15 x częściej)
• wymaga użycia kosztownej aparatury
(mikromanipulatory, mikroskop odwrócony)
• Wymaga dużych umiejętnośći operatorów.
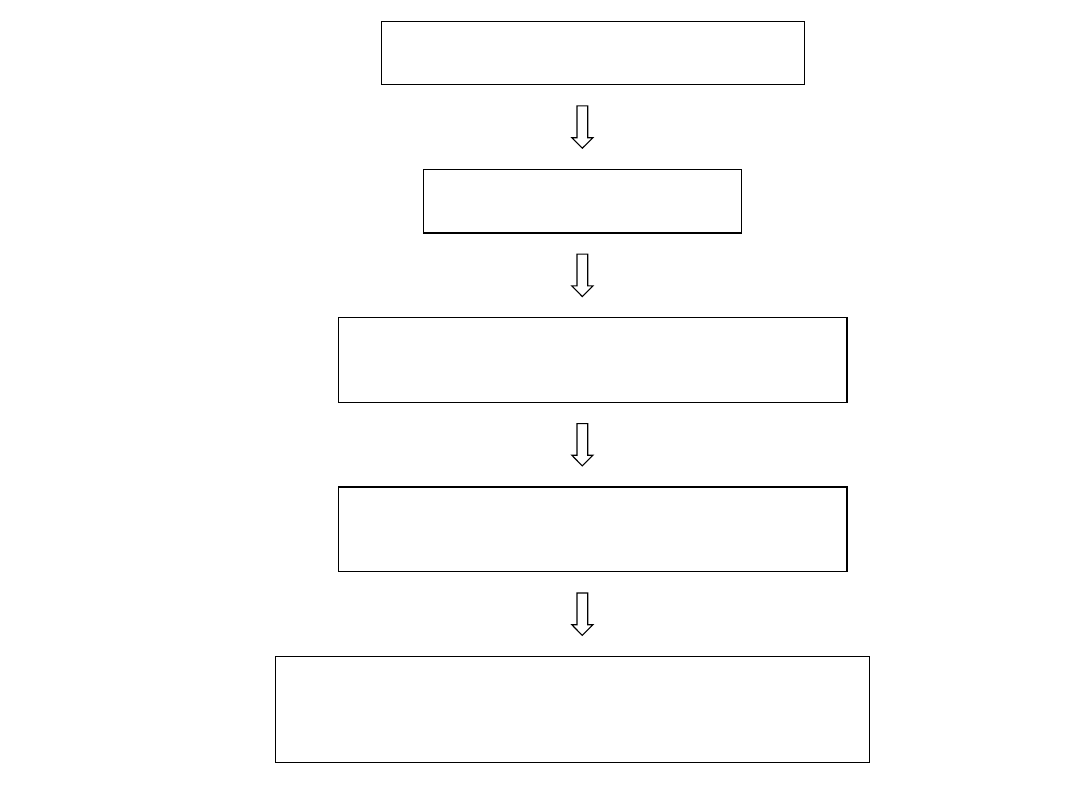
Samice poddane
superewolucji
Pobranie zygot od
samic
Mikroiniekcja DNA do jednego
z przedjądrzy zygoty
Implantacja embrionów u matki
zastępczej
Otrzymanie potomstwa z którego około
15% przedstawicieli jest osobnikami
transgenicznymi

Transfer genu przy pomocy
wektora wirusowego
Metoda
ta
jest
stosowana
aby
podnieść
prawdopodobieństwo otrzymania transgenicznego
potomstwa. Wydajność tej metody dochodzi do 80%
transgenicznego potomstwa.
Transfer ten odbywa się przy pomocy retrowirusa, lub
lentiwirusa, który infekuje komórki i w ten sposób
wprowadza gen, który chcemy wprowadzić. Zarówno
lentiwirusy jak i retrowirusy posiadają zdolność
integracji do genomu zainfekowanej komórki.

Wadą tej metody jest to, że ekspresji ulegają także
geny genomu retrowirusa, podczas rozwoju zarodka.
Dlatego trzeba podejmować kroki, aby wyciszyć
ekspresję tych genów. Prawdopodobnie lentiwirusy
stanowiące jedną z klas retrowirusów nie wykazują
tej cechy. Są zdolne do infekcji komórek dzielących
się, jak i komórek nie dzielących się.

Modyfikacja pierwotnych komórek
macierzystych
Ta metoda jest używana najczęściej do
otrzymywania
organizmów
z
wyciszoną
ekspresją danego genu. Niewątpliwą zaletą tej
metody jest to, że pozwala ona na określone,
precyzyjne modyfikowanie miejsca w genomie.

Wykonanie
Początkowo z blastocysty izolowane są komórki ES
(z. ang. embryo stem cells). Są to komórki
niezróżnicowane, posiadające zdolność po wtórnym
prowadzeniu do blastocysty wbudowania się do
tkanek rozwijającego się embrionu

W hodowlach in vitro do wcześniej pobranych
komórek ES wprowadza się geny przy pomocy
najczęściej metody elektroporacji, ale także,
lipofekcji wykorzystującej jako nośniki DNA lipidy
kationowe, oraz metody wapniowej.

Metoda ta polega na wprowadzeniu pożądanej
sekwencji DNA w hodowlach In vitro do komórek
macierzystych. Komórki pnia nie są zróżnicowane i
mają zdolność różnicowania do różnych typów
komórek np. komórek zarodkowych lub komórek
somatycznych. W ten sposób mogą dać początek
nowemu organizmowi. Te komórki są następnie
wprowadzane do zarodka w fazie blastocysty.

Wprowadzany fragment DNA posiada sekwencję genu
selekcyjnego. Jest ona otoczona przez sekwencje
homologiczne do poddawanego modyfikacji genu. Po
wprowadzeniu do komórki w jądrze następuje
rozpoznanie sekwencji otaczających i wymiana
sekwencji genomowej na sekwencję wprowadzaną.
Wprowadzenie
egzogennego
DNA
powoduje
wyłączenie tego genu i prowadzi do otrzymania tzw.
komórki knock-out
.

Obecność genu selekcyjnego i późniejsza jego
ekspresja pozwala na selekcję komórek, w których
zaszła wymiana, środowisku czynnika slekcyjnego.
Wyselekcjonowane
komórki
namnaża
się
w
środowisku czynnik selekcyjnego a następnie
transferuje się do blastocysty, gdzie dochodzi do
połączenia
się
komórek
zmodyfikowanych
i
pierwotnymi
(niemodyfikowanymi)
komórkami
zarodka i stworzenia jednego organizmu.

Otrzymany w ten sposób organizm jest chimerą
posiadającą część komórek zmodyfikowanych i
część niemodyfikowanych. Jeżeli cecha zostanie
przekazana komórkom rozrodczym to dany osobnik
przekaże daną cechę potomnemu pokoleniu, które
będzie heterozygotyczne. Dopiero skrzyżowanie
dwóch heterozygot może prowadzić do otrzymania
homozygotycznego
osobnika
z
całkowicie
wyłączonym
genem
na
obu
chromosomach
homologicznych.

Wadą tej metody jest to że znajduje
ona zastosowanie jedynie u myszy.

Transplantacja jąder komórkowych
Zaletą tej metody jest to, że znajduje zastosowanie
u wielu innych gatunków niż wcześniej opisana.
Metoda ta zwana jest również klonowaniem
somatycznym.
Wykorzystuje
wiele
rodzajów
komórek
somatycznych
mogących
być
wykorzystywanymi do modyfikacji w podobny
sposób co mysie komórki embryo ste cells.

Zmodyfikowaną wcześniej komórkę knock-out
umieszcza się w pobliżu oocytu pozbawionego
wcześniej jądra komórkowego. Następnie w procesie
elektrofuzji wykorzystującego pole elektryczne łączy
się obie komórki i w ten sposób otrzymuje się
zarodek jednokomórkowy. Rozwój takiego zarodka
jest
kierowany
początkowo
przez
składniki
znajdujące się w cytoplazmie oocytu, a nstępnie
funkcję tą pełni jądro komórki somatycznej.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Metody otrzymywania zwierząt transgenicznych, genetyka
10 Metody otrzymywania sztywnych pianek poliuretanowych
10 Metody otrzymywania sztywnych pianek poliuretanowych
10 Metody otrzymywania sztywnych pianek poliuretanowych
10 2 metodyka szkolenia2id 10746 ppt
10 1 metodyka szkolenia1id 10717 ppt
07 Otrzymywanie i metody badania związków koordynacyjnychid 6732 ppt
10 Reprezentacja liczb w systemie komputerowymid 11082 ppt
2 Etyka a badania na zwierz Ľtachid 20330 ppt
10 Relacja wspomagaj cy i wspomaganyid 11081 ppt
31 Metody otrzymywania i pomiaru próżni systematyka, porów
10 RYZYKO PRZĘDZIĘBIORSTWA I JEGO POMIARid 10630 ppt
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
metody otrzymywania plynow 1, Kosmetologia, Chemia
10 Metody molekularne cz 2 Repa
170 Metody otrzymywania dwuwarstw lipidowych i pomiar ich grubosci
09 Praktyczne metody otrzymywania polimerówid 7774
10. Metody oceny sposobu żywienia, licencjat(1)
więcej podobnych podstron