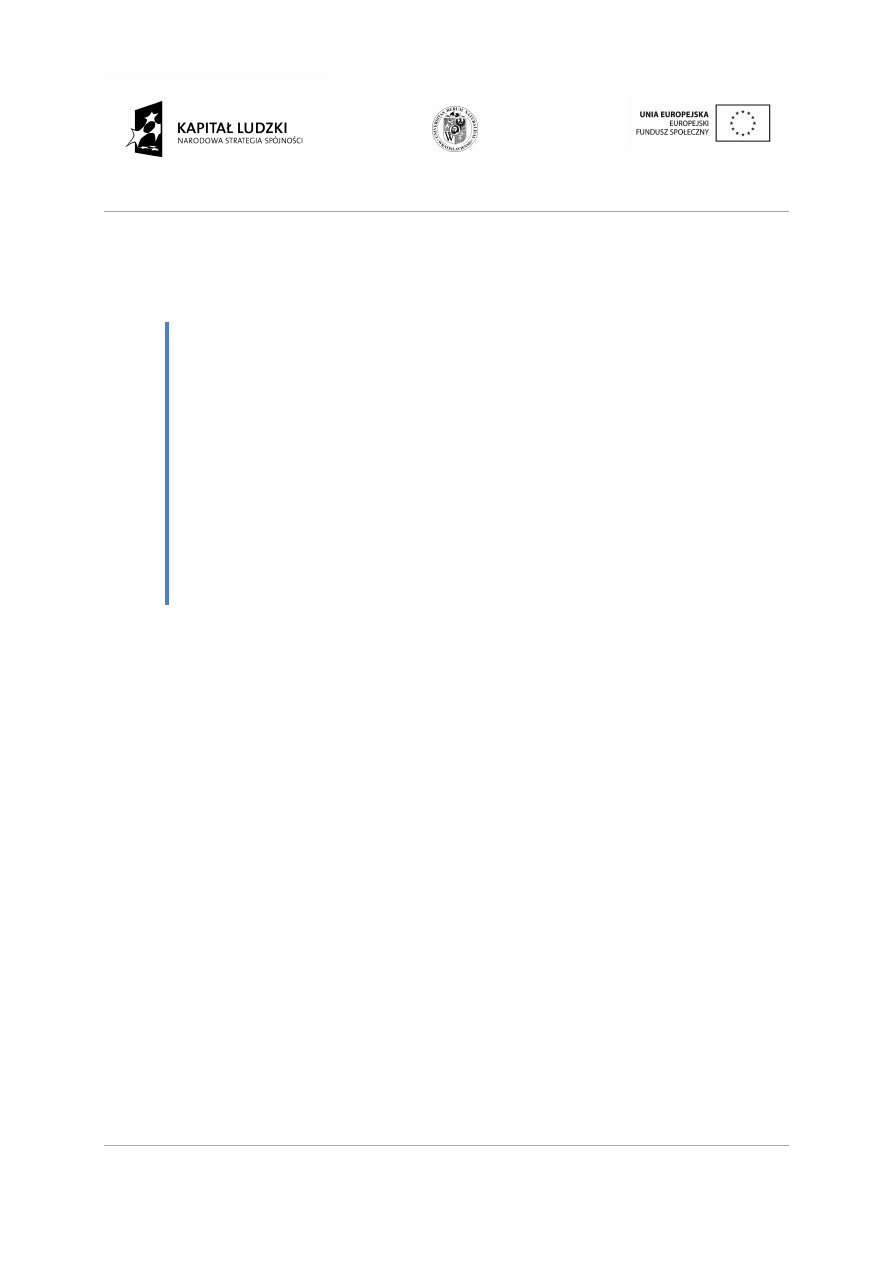
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Katarzyna Wińska
Wanda Mączka
Witold Gładkowski
Kurs wyrównawczy
z chemii organicznej
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
Kurs wyrównawczy
z chemii organicznej
Wrocław 2009
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Kurs wyrównawczy
z chemii organicznej

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kurs wyrównawczy z chemii organicznej
Uniwersytet Przyrodniczy we Wrocławiu
Katedra Chemii
Materiały do kursu wyrównawczego z chemii nieorganicznej
przeznaczony dla studentów kierunków przyrodniczych i technicznych
Uniwersytetu Przyrodniczego we Wrocławiu
w semestrze letnim roku akademickiego 2009/2010
Kurs przeprowadzono w ramach Programu Operacyjnego Kapitał Ludzki
współfinansowanego ze środków Europejskiego Funduszu Społecznego
Redakcja merytoryczna: Zespół autorów.
© Copyright Katedra Chemii Uniwersytetu Przyrodniczego we Wrocławiu.
Wrocław 2009
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
2
chemii organicznej
Wrocławiu
Materiały do kursu wyrównawczego z chemii nieorganicznej
kierunków przyrodniczych i technicznych
Uniwersytetu Przyrodniczego we Wrocławiu
roku akademickiego 2009/2010
przeprowadzono w ramach Programu Operacyjnego Kapitał Ludzki
rodków Europejskiego Funduszu Społecznego
autorów.
Katedra Chemii Uniwersytetu Przyrodniczego we Wrocławiu.
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Spis treści.
Ćwiczenie 1. ................................
1.1
Elementy budowy zwią
rozmieszczenie atomów w cząsteczkach.
1.1.1
Izomeria konstytucyjna
1.1.2
Izomeria przestrzenna (steroizomeria)
1.2
Ustalenia budowy zwią
1.2.1
Analiza elementarna
1.2.2
Wyznaczanie wzoru elementarnego i sumarycznego.
1.3
Zadania. ................................
Ćwiczenie 2. ................................
2.1
Grupy funkcyjne. ................................
2.2
Nazewnictwo związków organicznych.
2.3
Węglowodory. ................................
2.3.1
Węglowodory nasycone.
2.3.2
Węglowodory nienasycone.
2.3.3
Węglowodory aromatyczne.
2.4
Zadania. ................................
Ćwiczenie 3. ................................
3.1
Związki organiczne jednofunkcyjne zawieraj
3.1.1
Alkohole i fenole.
3.1.2
Aldehydy i ketony.
3.1.3
Kwasy karboksylowe.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
3
................................................................................................................................
Elementy budowy związków organicznych. Struktura cząsteczek. Przestrzenne
rozmieszczenie atomów w cząsteczkach. ................................................................
Izomeria konstytucyjna ................................................................................................
estrzenna (steroizomeria) ................................................................
Ustalenia budowy związków organicznych. ................................................................
Analiza elementarna ................................................................................................
Wyznaczanie wzoru elementarnego i sumarycznego. ................................
................................................................................................................................
................................................................................................................................
................................................................................................
ązków organicznych. ................................................................
................................................................................................
glowodory nasycone. ...............................................................................................
glowodory nienasycone. ................................................................
glowodory aromatyczne. ................................................................
................................................................................................................................
................................................................................................................................
zki organiczne jednofunkcyjne zawierające tlen. ................................
Alkohole i fenole. ................................................................................................
Aldehydy i ketony. ................................................................................................
Kwasy karboksylowe.................................................................................................
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
............................................ 5
steczek. Przestrzenne
............................................................ 5
................................... 6
............................................ 7
........................................... 9
........................................ 9
................................................... 11
................................. 13
.......................................... 17
................................................... 17
................................................ 18
....................................................... 22
............................... 22
.......................................................... 26
.......................................................... 28
................................. 30
.......................................... 34
.......................................................... 34
.......................................... 34
........................................ 37
.................................... 40

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3.1.4
Estry. ................................
3.1.5
Reakcje estrów.................................
3.2
Zadania. ................................
Ćwiczenie 4. ................................
4.1
Związki organiczne jednofunkcyjne zwieraj
4.1.1
Aminy. ................................
4.1.2
Amidy. ................................
4.1.3
Związki pierścieniowe zawieraj
4.2
Związki wielofunkcyjne.
4.2.1
Hydroksokwasy, ketokwasy.
4.2.2
Węglowodany. ................................
4.2.3
Aminokwasy i białka.
4.3
Zadania. ................................
Ćwiczenie 5. ................................
5.1
Typy reakcji organicznych.
5.2
Zadania. ................................
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
4
..............................................................................................................................
................................................................................................
................................................................................................................................
................................................................................................................................
organiczne jednofunkcyjne zwierające azot. ................................
................................................................................................
................................................................................................
cieniowe zawierające azot, tlen i siarkę. ................................
zki wielofunkcyjne. ................................................................................................
Hydroksokwasy, ketokwasy. ................................................................
................................................................................................
Aminokwasy i białka. ................................................................................................
................................................................................................................................
................................................................................................................................
Typy reakcji organicznych. ................................................................................................
................................................................................................................................
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
.............................. 43
.............................................. 43
................................. 45
.......................................... 48
........................................................... 48
........................................................... 48
........................................................... 50
.................................................. 51
....................................... 52
......................................................... 52
............................................... 54
.................................... 56
................................. 57
.......................................... 61
................................... 61
................................. 63
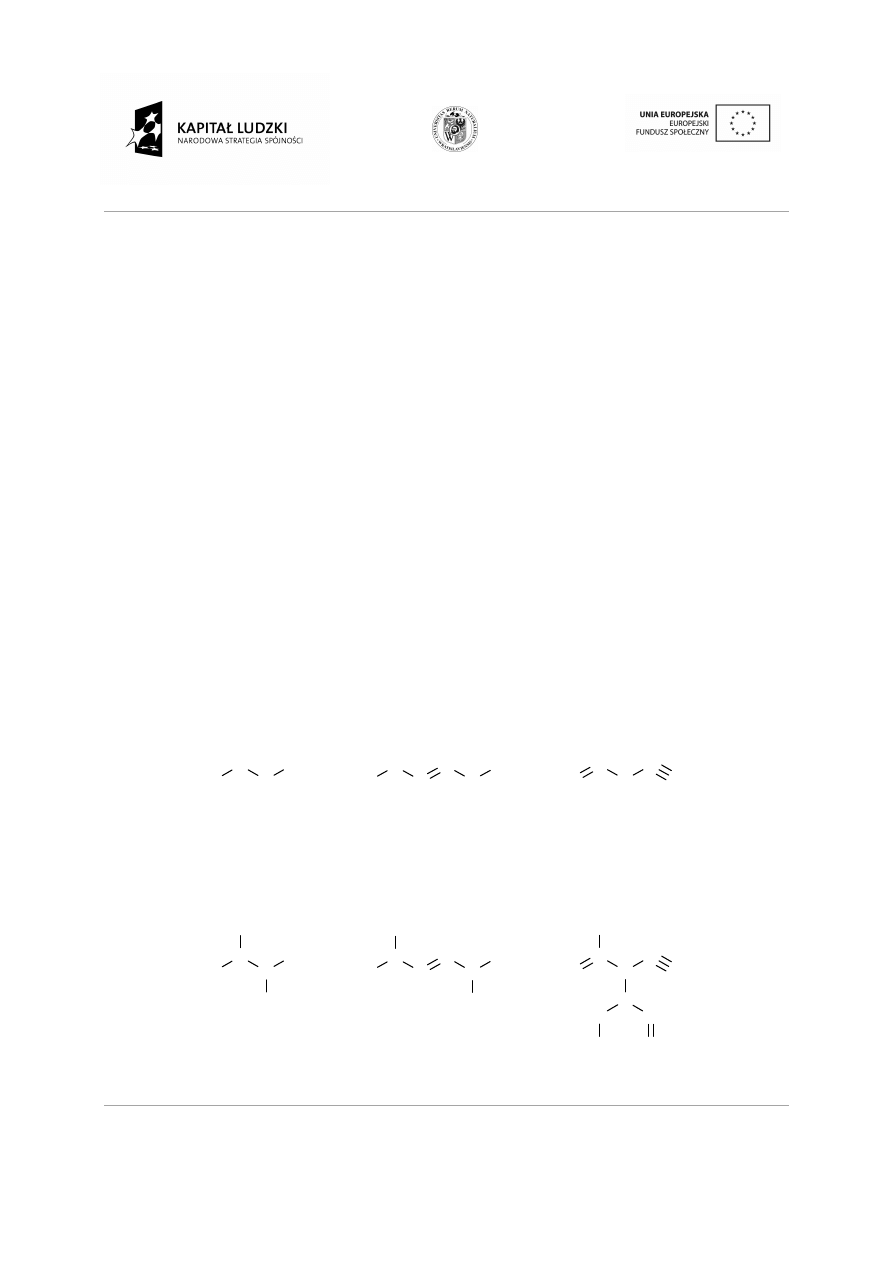
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Ć
wiczenie 1.
1.1
Elementy budowy zwi
Przestrzenne rozmieszczenie atomów w cz
Główny szkielet cząsteczek zwi
Pierwiastek ten leży w czwartej grupie układu okresowego, zatem mo
wiązania kowalencyjne z innymi atomami
także, choć w mniejszym stopniu
łączyć się między sobą a tak
podwójnymi lub potrójnymi. W ten sposób mo
węglowych.
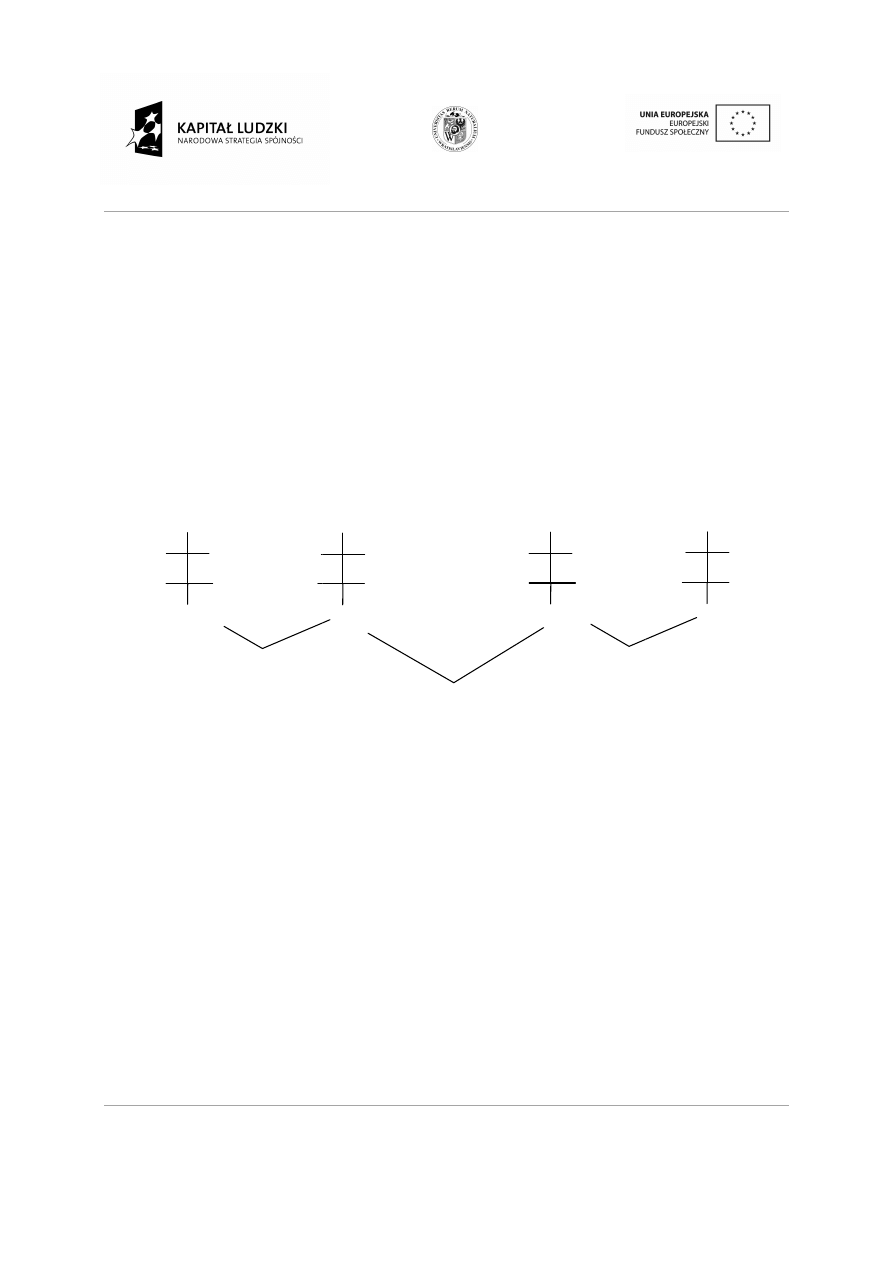
Rodzaje szkieletów węglowych:
•
Łańcuchy proste z wi
C
C
C
C
•
Łańcuchy rozgałę
C
C
C
C
C
C
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
5
Elementy budowy związków organicznych. Struktura czą
Przestrzenne rozmieszczenie atomów w cząsteczkach.
ąsteczek związków organicznych zbudowany jest z atomów w
y w czwartej grupie układu okresowego, zatem moż
zania kowalencyjne z innymi atomami - przede wszystkim z wodorem, tlenem, azotem a
mniejszym stopniu – z siarką, fosforem i fluorowcami. Atomy w
ą a także z innymi pierwiastkami wiązaniami pojedynczymi,
podwójnymi lub potrójnymi. W ten sposób możemy otrzymywać różne typy szkieletów
ęglowych:
cuchy proste z wiązaniami pojedynczymi i wielokrotnymi.
C
C
C
C
C
C
C
C
C
C
cuchy rozgałęzione.
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zków organicznych. Struktura cząsteczek.
zków organicznych zbudowany jest z atomów węgla.
y w czwartej grupie układu okresowego, zatem może tworzyć cztery
przede wszystkim z wodorem, tlenem, azotem a
fosforem i fluorowcami. Atomy węgla mogą
zaniami pojedynczymi,
żne typy szkieletów
zaniami pojedynczymi i wielokrotnymi.
C
C
C
C
C
C
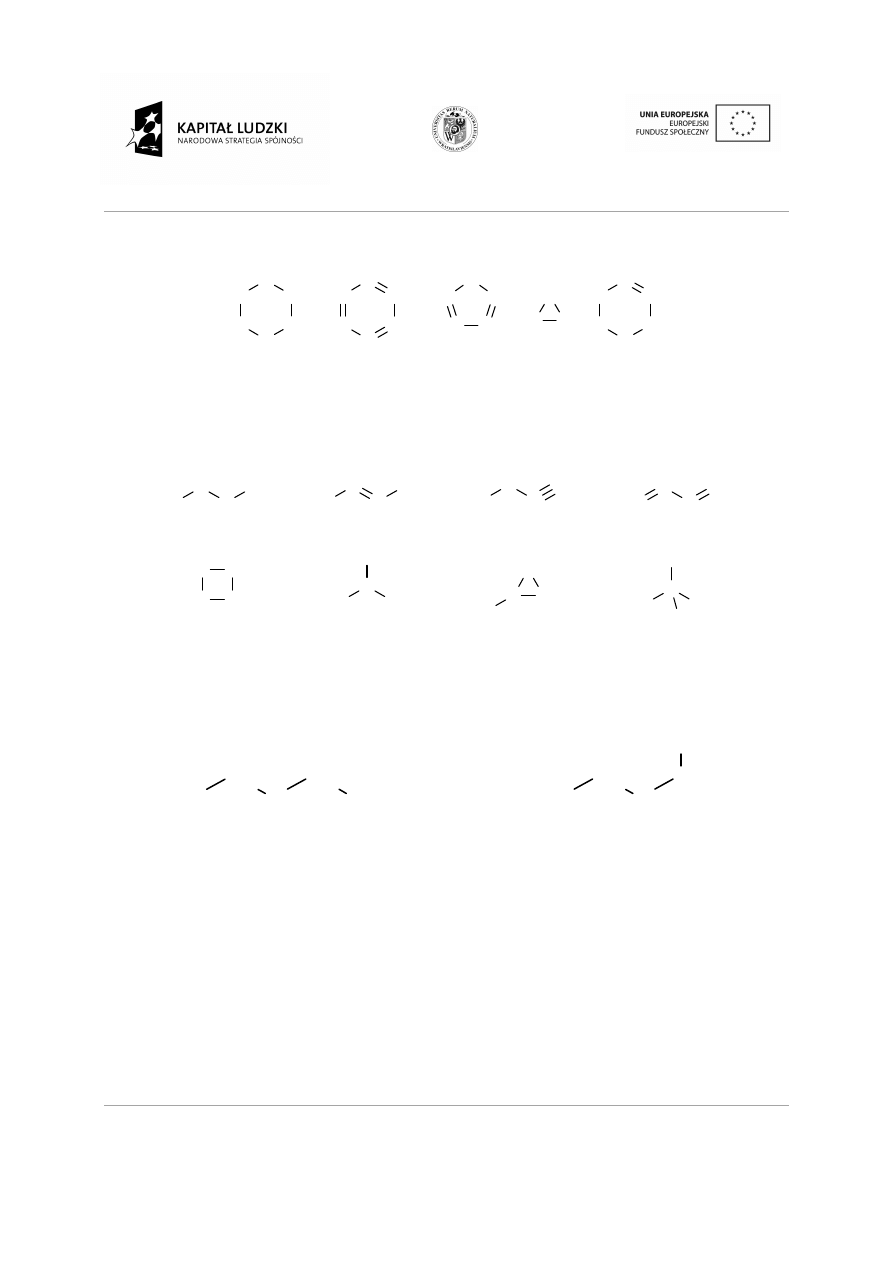
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
•
Połączenia pierścieniowe z wi
C
C
C
C
C
C
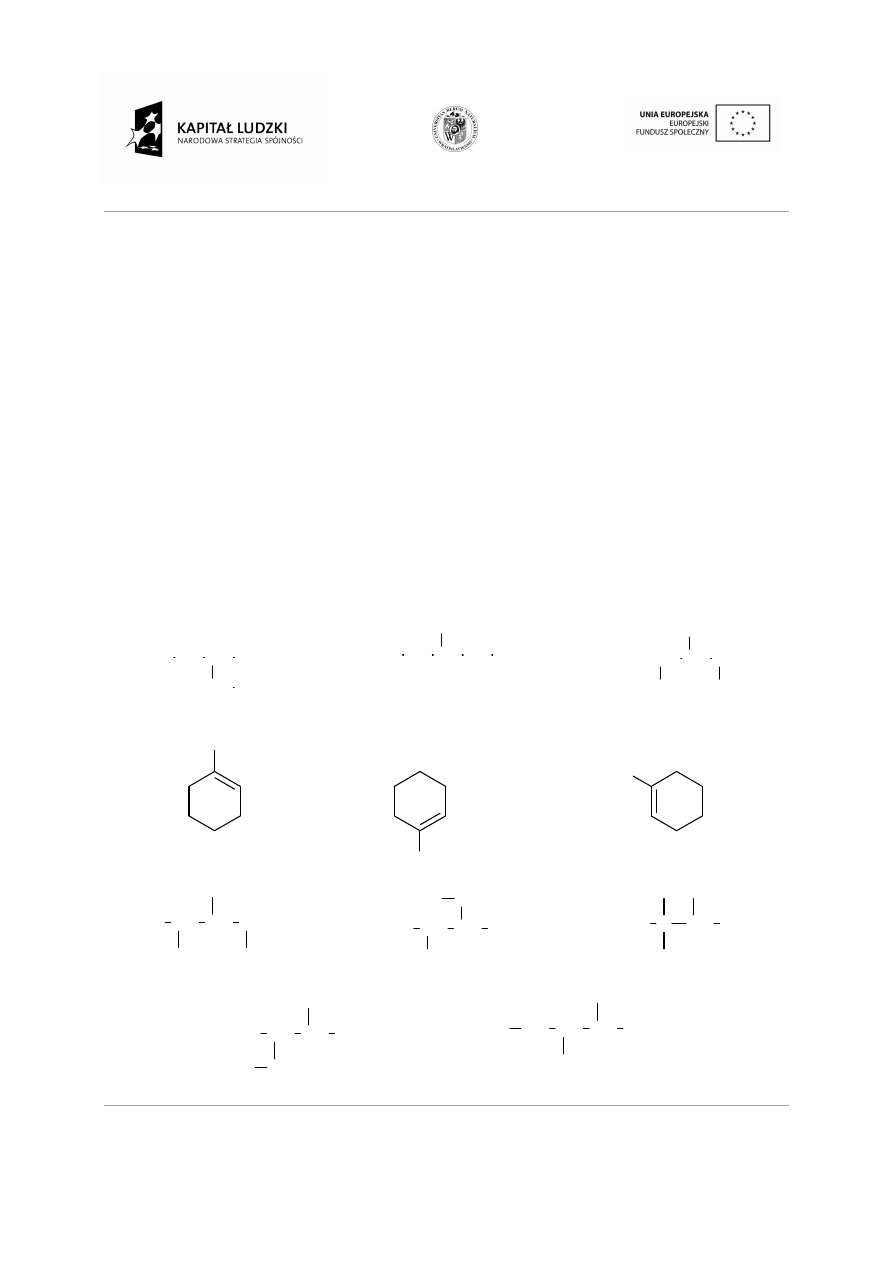
Przykład.
Mając do dyspozycji cztery atomy w
C
C
C
C
C
C
C
C
C
Rysując wzory związków organicznych pami
oznacza nowy związek.
CH
3
CH
2
CH
2
CH
1.1.1
Izomeria konstytucyjna
Izomerami konstytucyjnymi
siebie sposobem i kolejnością poł
na
izomerię szkieletową (gdy cz
lub
izomerię podstawienia
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
6
czenia pierścieniowe z wiązaniami pojedynczymi i wielokrotnymi.
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
dyspozycji cztery atomy węgla możemy połączyć je na wiele sposobów
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
ązków organicznych pamiętaj, ze nie każda narysowana struktura
H
2
CH
3
CH
3
CH
2
C
=
Izomeria konstytucyjna.
konstytucyjnymi (strukturalnymi) nazywamy cząsteczki ró
ścią połączenia atomów. Izomerię konstytucyjną mo
(gdy cząsteczki będą różniły się tylko budową szkieletu w
(gdy cząsteczki różnią się miedzy sobą tylko poło
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zaniami pojedynczymi i wielokrotnymi.
C
C
je na wiele sposobów.
C
C
C
C
C
C
C
C
da narysowana struktura
CH
2
CH
2
CH
3
ąsteczki różniące się od
konstytucyjną możemy podzielić
szkieletu węglowego)
ą tylko położeniem

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
wiązania podwójnego lub poło
szkieletu węglowego. Izomery konstytucje maj
Przykład.
Izomery szkieletowe:
CH
3
CH
2
CH
2
CH
2
CH
Izomery podstawienia
C
H
2
CH
CH
2
Izomery podstawienia:
CH
3
C
CH
2
C
O
1.1.2
Izomeria przestrzenna (steroizomeria)
Izomerami przestrzennymi
kolejność i sposób połączenia atomów a ró
Najprostszym przykładem tej izomerii s
względem podwójnego wiązan
znajdują się po tej samej stronie płaszczyzny odniesienia
przeciwnych stronach – są to izomery
atomów lub grup atomów w pier
stosujemy przedrostki cis
podstawników wokół wiązania podwójnego
Preloga w związkach łańcuchowych,
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
7
zania podwójnego lub położeniem podstawnika funkcyjnego, przy zachowaniu ogólnego
glowego. Izomery konstytucje mają odmienne właściwości fizyczne i chemiczne.
H
3
CH
3
CH
CH
2
CH
3
CH
3
o różnym miejscu położenia wiązania podwójnego:
CH
2
CH
3
CH
3
CH
C
Izomery podstawienia:
CH
2
CH
3
CH
3
CH
2
C
O
Izomeria przestrzenna (steroizomeria).
Izomerami przestrzennymi (steroizomerami) nazywamy cząsteczki, które maj
czenia atomów a różnią się rozmieszczeniem atomów w przestrzeni.
Najprostszym przykładem tej izomerii są związki różniące się położeniem podstawników
dem podwójnego wiązania lub innej określonej płaszczyzny. Je
po tej samej stronie płaszczyzny odniesienia – są to izomery cis
ą to izomery trans lub E. Do opisywania przestrzennego ustawienia
up atomów w pierścieniach lub w dwupodstawionych wiązaniach podwójnych
lub trans. W przypadku rozpatrywania rozmieszczenia
ązania podwójnego według reguł pierwszeństwa Cahna
owych, będziemy stosowali przedrostki Z lub
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
przy zachowaniu ogólnego
ci fizyczne i chemiczne.
CH
3
C
CH
3
CH
3
CH
3
zania podwójnego:
CH
CH
2
CH
3
C
CH
2
CH
3
O
steczki, które mają tą samą
rozmieszczeniem atomów w przestrzeni.
żeniem podstawników
lonej płaszczyzny. Jeżeli podstawniki
cis lub Z, a jeżeli po
Do opisywania przestrzennego ustawienia
ązaniach podwójnych
W przypadku rozpatrywania rozmieszczenia
ństwa Cahna-Ingloda-
lub E.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
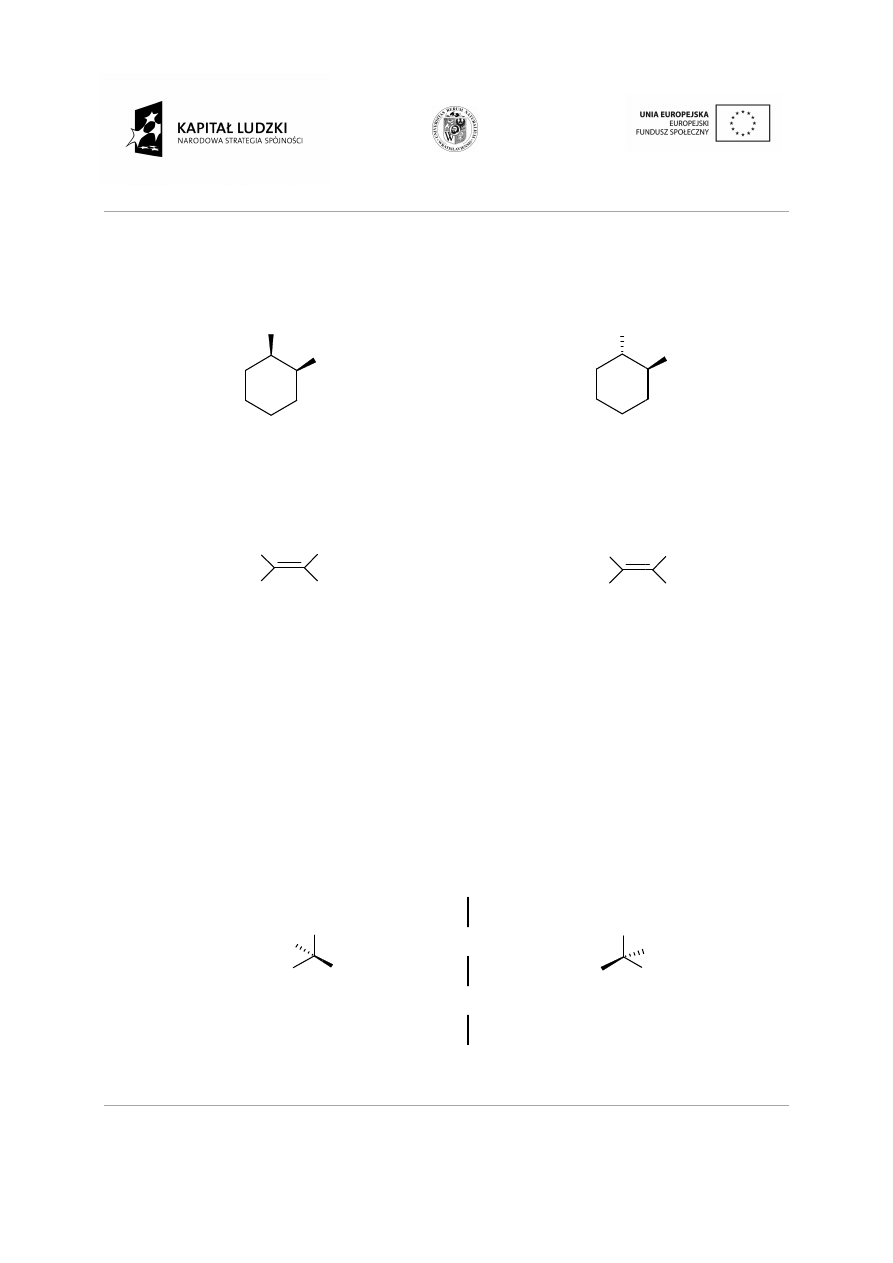
Przykład
Izomery cis-trans:
CH
3
C
cis-1,2-dimetylocykloheksan
Izomery E, Z:
H
Br
C
C
H
3
(E)-2-bromobut-2-en
Izomery konfiguracyjne
nie jest identyczna ze swoim odbiciem lustrzanym to jest
jest - achiralna). Najprostszym przykładem zwi
o hybrydyzacji sp
3
połączony z czterema ró
nosił nazwę asymetrycznego
Przykład
CH
Br
H
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
8
CH
3
CH
3
-1,2-dimetylocykloheksan
trans-1,2-dimetylocykloheksan
Br
CH
3
H
C
H
3
(E)-2-bromobut-2-en
(Z)-2-bromobut-2-en
Izomery konfiguracyjne związane są z chiralnością danego związku. Je
nie jest identyczna ze swoim odbiciem lustrzanym to jest
chiralna
Najprostszym przykładem związku chiralnego jest atom w
czony z czterema różnymi podstawnikami. Taki atom w
asymetrycznego i stanowi on centrum chiralności cząsteczki.
H
3
Cl
CH
3
Cl
Br
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
3
CH
3
-1,2-dimetylocykloheksan
Br
CH
3
(Z)-2-bromobut-2-en
ązku. Jeżeli cząsteczka
chiralna (jeżeli jest to
zku chiralnego jest atom węgla
nymi podstawnikami. Taki atom węgla będzie
steczki.
3
Br
H
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Pary izomerów konfiguracyjnych, które s
można ich nałożyć na siebie nazywamy enancjomerami. Maj
fizyczne i spektroskopowe, natomiast skr
sam kąt ale w przeciwnych znakach. Wszystkie pozostałe izomery konfiguracyjne, które nie
są enancjomerami nazywamy diasteroizomerami. Diasteroizomery ró
właściwo
Przykład
OH
H
I
H
COOH
COOH
O
H
I
enancjomery
1.2
Ustalenia budowy zwi
1.2.1
Analiza elementarna
Wszystkie związki organiczne maj
Aby poznać budowę związku organicznego nale
procentowy wykorzystując do tego celu metod
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
9
Pary izomerów konfiguracyjnych, które są swoimi odbiciami lustrzanymi, ale nie
na siebie nazywamy enancjomerami. Mają identyczne wła
fizyczne i spektroskopowe, natomiast skręcają płaszczyznę światła spolaryzowanego o ten
t ale w przeciwnych znakach. Wszystkie pozostałe izomery konfiguracyjne, które nie
enancjomerami nazywamy diasteroizomerami. Diasteroizomery różnią
ściwościami fizycznymi i spektroskopowymi.
H
H
COOH
COOH
OH
H
I
H
COOH
COOH
enancjomery
enancjomery
diasteroizomery
Ustalenia budowy związków organicznych.
Analiza elementarna.
zki organiczne mają stały, niezmienny skład jakościowy i ilo
ązku organicznego należy doświadczalnie wyznaczy
c do tego celu metody analizy elementarnej.
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
swoimi odbiciami lustrzanymi, ale nie
identyczne właściwości
wiatła spolaryzowanego o ten
t ale w przeciwnych znakach. Wszystkie pozostałe izomery konfiguracyjne, które nie
żnią się między sobą
H
O
H
H
I
COOH
COOH
enancjomery
stały, niezmienny skład jakościowy i ilościowy.
wiadczalnie wyznaczyć jego skład

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład
Po spaleniu 0,720 g nieznanego zwi
dwutlenku węgla i 0,432 g wody. Oblicz skład procentowy zwi
g/mol, M
O
= 16 g/mol)
Rozwiązanie:
Po spaleniu związku organicznego zawarty w nim w
wodór wodę. Obliczamy zatem masy w
proporcji:
m
C
m
H
Odejmujemy od masy próbki prze
0,720 g
Otrzymana różnica miedzy wag
w badanym materiale jeszcze jednego pierwiastka
spalania tego związku były CO
Obliczamy skład procentowy:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
10
Po spaleniu 0,720 g nieznanego związku organicznego wyłącznie otrzymano 1,05 g
i 0,432 g wody. Oblicz skład procentowy związku. (M
C
= 12 g/mol, M
zku organicznego zawarty w nim węgiel utworzył dwutlenek w
. Obliczamy zatem masy węgla i wodoru w produktach spalania
M
CO2
− M
C
m
CO2
− m
C
, /
/
0,286
M
H2O
− 2M
H
m
H2O
− m
H
, /
! /
0,048 g
od masy próbki przed spaleniem masy węgla i wodoru:
0,720 g – (0,286 g + 0,048 g) = 0,386 g
nica miedzy wagą próbki oraz masami węgla i wodoru wskazuje na obecno
szcze jednego pierwiastka – tlenu, ponieważ jedynymi produktami
zku były CO
2
i H
2
O.
m
próbki
− 100 %
m
C
− X
C
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
cznie otrzymano 1,05 g
= 12 g/mol, M
H
= 1
utworzył dwutlenek węgla a
gla i wodoru w produktach spalania z nastepujących
gla i wodoru wskazuje na obecność
ż jedynymi produktami

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
X
C
X
H
Zawartość procentowa tlenu jest wynikiem ró
X
O
= 100 %
Badany związek zawierał 39,72 % w
1.2.2
Wyznaczanie wzoru elementarnego i sumarycznego.
Po obliczeniu składu procentowego mo
elementarnego. Określa on stosunek liczb atomów poszczególnych pierwiastków w
cząsteczce badanego związku.
Przykład
Ustal wzór elementarny zwi
Rozwiązanie:
Możemy łatwo obliczyć
6,67 g wodoru i 53,61 g tlenu.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
11
$
%
&'ó)*+
,!, %
,-
39,72 %
m
próbki
− 100 %
m
H
− X
H
%
&'ó)*+
,! %
,-
6,67 %
procentowa tlenu jest wynikiem różnicy:
= 100 % − 39,72 % − 6,67 % = 53,61 %
zek zawierał 39,72 % węgla, 6,67 % wodoru i 53,61 % tlenu.
Wyznaczanie wzoru elementarnego i sumarycznego.
obliczeniu składu procentowego można przystąpić do obliczania wzoru
la on stosunek liczb atomów poszczególnych pierwiastków w
.
wzór elementarny związku z poprzedniego przykładu:
emy łatwo obliczyć, że w 100 g badanego związku znajduje si
6,67 g wodoru i 53,61 g tlenu.
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
do obliczania wzoru
la on stosunek liczb atomów poszczególnych pierwiastków w
zku znajduje się 39,72 g węgla,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Obliczamy liczby moli pierwiastków:
Wyznaczamy stosunek liczb tych pierwiastków mo
całkowitymi.
n
C
: n
H
: n
O
= 3,3 : 6,6 : 3,3 = 1 : 2 : 1
Otrzymujemy wzór elementarny
wzorem a jedynie określa jaka jest zawarto
może mieć wzór: CH
2
O, C
2
H
4
Na podstawie obliczonego wzoru elementarnego oraz ustalonej metodami
fizykochemicznymi masy cząsteczkowej, mo
Przykład
Oblicz wzór sumaryczny zwi
180 g/mol.
Rozwiązanie:
Obliczamy masę cząsteczkow
M 1 Mc 4 2 × MH 41 × MO
Wzór sumaryczny jest wielokrotno
tego związku będzie wielokrotno
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
12
Obliczamy liczby moli pierwiastków:
n
C
7
$
8,-
/
3,3 %
n
H
,,,-
/
6,6 %
n
O
,,
, /
3,3 %
Wyznaczamy stosunek liczb tych pierwiastków możliwie najmniejszymi liczbami
= 3,3 : 6,6 : 3,3 = 1 : 2 : 1
Otrzymujemy wzór elementarny związku CH
2
O. Nie jest on jednak rzeczywistym
la jaka jest zawartość pierwiastków względem siebie. Cz
4
O
2
, C
3
H
6
O
3
, C
4
H
8
O
itp.
Na podstawie obliczonego wzoru elementarnego oraz ustalonej metodami
ąsteczkowej, możemy ustalić wzór sumaryczny.
Oblicz wzór sumaryczny związku o wzorze elementarnym CH
2
O i masie cz
ąsteczkową związku o wzorze elementarnym CH
2
MO 1 × 12 g/mol 4 2 × 1 g/mol 41 ×16 g
Wzór sumaryczny jest wielokrotnością wzoru elementarnego, czyli masa cz
wielokrotnością masy CH
2
O.
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
liwie najmniejszymi liczbami
O. Nie jest on jednak rzeczywistym
dem siebie. Cząsteczka
Na podstawie obliczonego wzoru elementarnego oraz ustalonej metodami
wzór sumaryczny.
O i masie cząsteczkowej
2
O:
g/mol 30 g/mol
wzoru elementarnego, czyli masa cząsteczkowa
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Zatem możemy obliczyć
Czyli wzorem sumarycznym badanego zwi
Aby ustalić wzór strukturalny nale
spektroskopowe.
1.3
Zadania.
1.
Ustal, który z podanych wzorów przedstawiaj
CH
3
CH
2
CH CH
3
CH
2
CH
3
CH
3
CH
3
CH CH CH
2
CH
3
CH
3
Cl
CH
3
CH CH
CH
CH
2
Cl
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
13
emy obliczyć:
M M
<=>
x
czyli
180 g/mol 30 g/mol x
x 6
Czyli wzorem sumarycznym badanego związku jest wzór: C
6
H
12
O
6
wzór strukturalny należy zastosować różne metody chemiczne, fizyczne i
z podanych wzorów przedstawiają ten sam związek:
CH
3
CH
2
CH CH
2
CH
3
CH
3
CH
3
C
H
3
CH
3
CH CH CH
3
CH
2
CH
3
Cl
CH
H CH
3
H
3
CH
2
CH CH CH
CH
3
CH
3
Cl
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ne metody chemiczne, fizyczne i
CH
2
CH CH
2
CH
3
CH
3
CH
3
H
3
C
CH CH
3
CH
3
CH
3
Cl
H
3

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.
Narysować wzory półstrukturalne wszystkich zwi
sumarycznym:
a.
C
5
H
12
b.
C
4
H
9
Cl
c.
C
5
H
8
3.
Ustal wzór rzeczywisty w
reakcji spalania 3 g tego zwi
4.
Ustal najprostszy wzór sumaryczny zwi
wodoru oraz tlenu. Zaproponuj wzór
5.
Podaj nazwy poniższych zwi
Które z podanych wzorów przedstawiaj
a) homologi
b) izomery
c) te same cząsteczki
C
H
3
CH
CH
CH
CH
3
a)
d)
6.
Narysuj stereoizomery
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
14
wzory półstrukturalne wszystkich związków izomerycznych o wzorze
rzeczywisty węglowodoru o masie cząsteczkowej 60 g/mol, je
reakcji spalania 3 g tego związku otrzymano 8,8 g dwutlenku węgla
Ustal najprostszy wzór sumaryczny związku, który składa się z 58,80% w
wodoru oraz tlenu. Zaproponuj wzór półstrukturalny tego związku.
ższych związków.
Które z podanych wzorów przedstawiają:
C
H
2
CH
CH
CH
C
H
3
C
CH
CH
3
C
CH
3
CH
3
H
H
3
CH
3
C
H
CH
CH
3
CH
3
CH
3
CH
3
b)
c)
e)
f)
Narysuj stereoizomery E,Z 2-chlorobut-2-enu.
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zków izomerycznych o wzorze
steczkowej 60 g/mol, jeżeli w
ęgla i wodę.
z 58,80% węgla, 9,87%
H
H
3
CH
3
CH
3

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
7.
Narysuj wzory półstrukturalne
wobec siebie
a)
izomerami szkieletowymi
b)
izomerami położenia podstawnika
c)
izomerami optycznymi
8.
Wymień rodzaje izomerii i podaj po jednym przykładzie.
9.
Narysuj stereoizomery
10.
Które z wymienionych zwi
nazwij te stereoizomery.
a)
but-2-en
b)
heks-2-en
c)
3,4-dimetylo-heks
11.
Narysuj model przestrzenny cz
między wiązaniami.
12.
Porównaj budowę etanu, etenu i etynu. Jakiego typu wi
cząsteczkach?
13.
Określ liczbę atomów w
metylookta-1,6-dien-4-
14.
Podaj stopnie utlenienia poszczególnych atomów w
a)
propan
b)
propen
c)
propyn
15.
Wskaż za pomocą gwiazdki
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
15
Narysuj wzory półstrukturalne cząsteczek o wzorze sumarycznym C
izomerami szkieletowymi
żenia podstawnika
izomerami optycznymi
rodzaje izomerii i podaj po jednym przykładzie.
Narysuj stereoizomery cis-trans 1,2-dimetylocykloheksanu.
Które z wymienionych związków występują w formie stereoizomerów? Narysuj i
nazwij te stereoizomery.
heks-3-en
d)
pent-2-en
e)
metylopropen
Narysuj model przestrzenny cząsteczki metanu, podaj długość wią
ę etanu, etenu i etynu. Jakiego typu wiązania wyst
atomów węgla o hybrydyzacji sp, sp
2
, sp
3
w cząsteczce 3
-ynu.
Podaj stopnie utlenienia poszczególnych atomów węgla w następują
d)
propan-1-
e)
propanal
f)
kwas propanowy
gwiazdki asymetryczne atomy węgla w poniższych zwi
absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
steczek o wzorze sumarycznym C
4
H
8
Cl
2
, które są
w formie stereoizomerów? Narysuj i
metylopropen
ść wiązań i wartość kąta
zania występują w tych
w cząsteczce 3-bromo-2-
ępujących związkach:
-ol
kwas propanowy
ższych związkach.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
C
H
2
CH
CH
CH
3
CH
3
O
H
16.
Na dowolnym przykładzie wyja
mieszanina racemiczna, prawoskr
17.
Posługując się wzorami Fischera narysuj wszystkie
jodobutanu, wskaż pary enancjomerów i diastereoizomerów.
18.
Posługując się wzorami Fischera narysuj stereoizomery kwasu winowego. Która
struktura przedstawia izomer
19.
Określ przynależność narysowanych w konwencji Fischera stereoiz
szeregu konfiguracyjnego D lub L. Narysuj ich enancjomery.
C
CH
3
H
OH
O
OH
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
16
O
H
Cl
O
C
CH
2
O
O
H
H
O
H
O
H
CH
3
H
Br
Cl
OH
Na dowolnym przykładzie wyjaśnij pojęcia: enancjomery, diastereoizomery,
mieszanina racemiczna, prawoskrętność związku chemicznego.
wzorami Fischera narysuj wszystkie stereoizomery 2
ż pary enancjomerów i diastereoizomerów.
wzorami Fischera narysuj stereoizomery kwasu winowego. Która
struktura przedstawia izomer
mezo?
ść narysowanych w konwencji Fischera stereoiz
szeregu konfiguracyjnego D lub L. Narysuj ich enancjomery.
O
H
H
O
H
H
H
OH
C
H
OH
CH
2
OH
O
H
C
CH
3
N
H
2
H
O
OH
H
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
OH
O
H
OH
OH
CH
3
H
Br
Cl
OH
I
NH
2
CH
3
cia: enancjomery, diastereoizomery,
stereoizomery 2-chloro-3-
wzorami Fischera narysuj stereoizomery kwasu winowego. Która
narysowanych w konwencji Fischera stereoizomerów do
C
C
O
OH
H
H
H
OH
O
H
O
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2
Ć
wiczenie 2.
2.1
Grupy funkcyjne.
Jak już wcześniej wspomniano, wszystkie zwi
węglowego, do którego przyłą
również przyłączone inne atom
grupami funkcyjnymi. Decyduj
względu na jej wielkość i złożono
W tabeli zebrano najważ
karbonylowej.
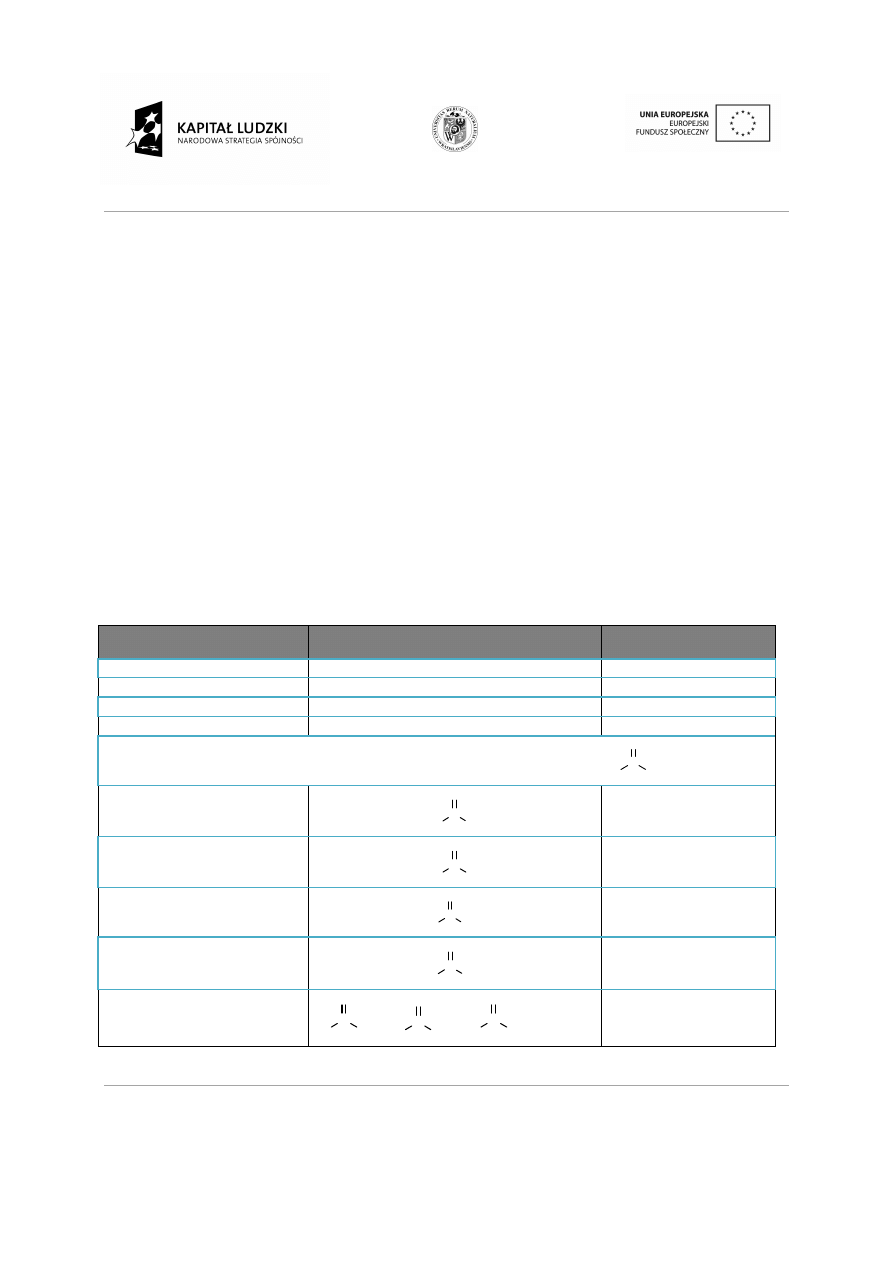
Tabela 1. Grupy funkcyjne.
Nazwa związku
Alkohole i fenole
Etery
Aminy
Związki nitrowe
Grupy funkcyjne zawieraj
Aldehydy
Ketony
Kwasy karboksylowe
Estry
Amidy
R
(R – łańcuch węglowodorowy
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
17
niej wspomniano, wszystkie związki organiczne zbudowane s
glowego, do którego przyłączone są głównie atomy wodoru. Do atomów w
atomy (np. chlor, siarka) lub grupy atomów
. Decydują one o właściwościach chemicznych cz
i złożoność.
ajważniejsze grupy funkcyjne z szczególnym omówieniem grupy
Wzór
Grupa funkcyjna
R - OH
hydroksylowa
R - O - R
eterowa
R - NH
2
aminowa
R - NO
2
nitrowa
Grupy funkcyjne zawierającą grupę karbonylową.
*
C
O
R
C
O
H
aldehydowa
R
C
O
R
karbonylowa
R
C
O
OH
karboksylowa
R
C
O
OR
estrowa
R
C
O
NH
2
R
C
O
NHR R
C
O
NR
2
amidowa
owy nasycony, nienasycony lub aromatyczny)
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zki organiczne zbudowane są z szkieletu
omy wodoru. Do atomów węgla mogą być
atomów, które nazywamy
ciach chemicznych cząsteczki, bez
z szczególnym omówieniem grupy
Grupa funkcyjna
hydroksylowa
eterowa
aminowa
nitrowa
*
aldehydowa
karbonylowa
karboksylowa
estrowa
amidowa

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.2
Nazewnictwo związków organicznych.
Obecnie stosowany system nazewnictwa zwi
(International Union of Pure and Applied Chemistry
składać się z trzech części: przedrostka,
położenia podstawników, rdzeń
atomów węgla) a przyrostek okre
Zasady nazywania związków
1.
Należy znaleźć najdłu
łańcuch może być
wybieramy ten, który ma wi
Przykład
CH
3
CH CH
2
CH
CH
2
CH
3
nie heksan
CH
3
CH CH
2
CH
CH
3
nie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
18
ą
zków organicznych.
Obecnie stosowany system nazewnictwa związków jest zgodny z zaleceniami IUPAC
International Union of Pure and Applied Chemistry). Nazwa związku organicznego powinna
: przedrostka, rdzenia i przyrostka. Przedrostek informuje o miejscu
enia podstawników, rdzeń – opisuje główny szkielet cząsteczki (m. in. mówi o ilo
gla) a przyrostek określa główną grupę funkcyjną, do której należ
Zasady nazywania związków organicznych:
źć najdłuższy łańcuch węglowy w cząsteczce. (Uwaga! Najdłu
że być „pozaginany”). Jeżeli w cząsteczce są dwa długie ła
wybieramy ten, który ma większą liczbę punktów rozgałęzienia.
H
2
CH CH
3
CH
2
CH
3
CH
3
C
C
H
2
CH CH
3
CH CH
3
CH
3
CH
3
C
C
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zków jest zgodny z zaleceniami IUPAC
organicznego powinna
Przedrostek informuje o miejscu
steczki (m. in. mówi o ilości
, do której należy cząsteczka.
steczce. (Uwaga! Najdłuższy
dwa długie łańcuchy –
ęzienia.
CH CH
2
CH
2
CH CH
3
CH
2
CH
3
CH
2
CH
3
oktan
CH CH
2
CH
2
CH CH
3
CH
3
CH CH
3
CH
3
tak

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.
Numerujemy atomy w
(wiązanie wielokrotne, grupy funkcyjne itp.) to numerowanie rozpoczynamy od
końca, na którym znajduje si
Przykład
CH
3
CH CH
2
CH
CH
3
nie
1
2
3
4
3.
Nazywamy i numerujemy podstawniki. Nazwy podstawników
pochodzą zazwyczaj od nazw odpowiednich w
podstawników stosujemy ze wzgl
CH
3
C CH
3
CH
3
grupa tert-butylowa
CH CH
CH
3
CH
3
grupa izopentylowa
Jeżeli na atomie w
sam numer.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
19
Numerujemy atomy węgla. Jeżeli w cząsteczce nie ma grup charakterystycznych
zanie wielokrotne, grupy funkcyjne itp.) to numerowanie rozpoczynamy od
ca, na którym znajduje się najbliższy punkt rozgałęzienia.
H
2
CH CH
3
CH CH
3
CH
3
CH
3
C
C
5
6
7
6
7
Nazywamy i numerujemy podstawniki. Nazwy podstawników
zazwyczaj od nazw odpowiednich węglowodorów. Dla niektórych
podstawników stosujemy ze względów historycznych nazwy zwyczajowe:
CH
3
CH
CH
3
grupa izopropylowa
CH
CH
3
CH
2
CH
3
butylowa
grupa sec-butylowa
CH
3
H
2
CH
2
grupa neopentylowa
grupa izopentylowa
eli na atomie węgla znajdują się dwa podstawniki to obydwa uzyskuj
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
steczce nie ma grup charakterystycznych
zanie wielokrotne, grupy funkcyjne itp.) to numerowanie rozpoczynamy od
zienia.
CH CH
2
CH
2
CH CH
3
CH
3
CH CH
3
CH
3
tak
1
2
3
4
5
6
Nazywamy i numerujemy podstawniki. Nazwy podstawników alkilowych
glowodorów. Dla niektórych
dów historycznych nazwy zwyczajowe:
CH
3
CH CH
2
CH
3
grupa izobutylowa
3
C
CH
2
CH
3
CH
3
grupa neopentylowa
dwa podstawniki to obydwa uzyskują ten

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4.
Zapisujemy nazw
obecne są dwa lub wi
alfabetycznej. Jeż
stosujemy przedrostki di
alfabetycznej.
Przykład
Ad. 2. Jeżeli w cz
z nich, leżąca najwy
pozostałe ustawione w kolejno
nazwy. Atom w
charakterystyczna powinien mie
Przykład
Dla eterów stosujemy przedrostek alkoksy np. grupa
nazwę metoksy-.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
20
Zapisujemy nazwę związku w postaci jednego słowa. Jeż
dwa lub więcej różnych podstawników to zapisujemy je
alfabetycznej. Jeżeli występują dwa lub więcej takich samych podstawników to
stosujemy przedrostki di-, tri-, tetra-, ale bez układania ich w kolejno
CH
3
CH CH
2
CH
2
C CH
2
CH
3
CH CH
3
CH
3
CH
3
CH
2
CH
3
1
2
3
4
5
6
7
3,3-dietylo-2,6-dimetyloheptan
eli w cząsteczce występują różne grupy charakterystyczne tylko jedna
ąca najwyżej w szeregu ważności, określa nazw
pozostałe ustawione w kolejności alfabetycznej zapisywane s
Atom węgla, przy którym znajduje się „najwa
charakterystyczna powinien mieć jak najniższy numer.
Dla eterów stosujemy przedrostek alkoksy np. grupa –OCH
.
CH
3
C
CH CH CH CH CH
3
O
OH
CH
3
1
2
3
4
5
6
7
6-hydroksy-5-metylohept-3-en-2-on
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zku w postaci jednego słowa. Jeżeli w cząsteczce
nych podstawników to zapisujemy je w kolejności
cej takich samych podstawników to
, ale bez układania ich w kolejności
ne grupy charakterystyczne tylko jedna
śla nazwę przyrostka,
ci alfabetycznej zapisywane są w przedrostku
„najważniejsza” grupa
OCH
3
będzie nosiła
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Tabela 2. Nazwy związków organicznych.
Nazwa grupy funkcyjnej
Kwasy karboksylowe
Bezwodniki kwasowe
Estry
Halogenki kwasowe
Amidy
Aldehydy
Ketony
Alkohole
Aminy
Alkeny
Alkiny
Alkany
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
21
. Nazwy związków organicznych.
Przyrostek nazwy
Przedrostek nazwy
kwas -owy
kwas -karboksylowy
bezwodnik -owy
bezwodnik -karboksylowy
-an
-karboksylan
alkoksykarbonylo
halogenek -oilu, -ylu
-amid
-karboksyamid
-al
-on
-ol
-amina
-en
-yn
-an
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Przedrostek nazwy
karboksy-
alkoksykarbonylo-
halokarbonylo-
karbamoilo-
okso-
okso-
hydroksy-
amino-
alkenylo-
alkinylo-
alkilo-

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.3
Węglowodory.
Węglowodory zbudowane s
budowę zostały podzielone na kilka grup:
Schemat 1. Podział węglowodorów.
2.3.1
Węglowodory nasycone.
Węglowodory nasycone
cząsteczki zbudowany jest z wi
z trzema atomami wodoru a pozostałe z dwoma.
Nasycone
Acykliczne
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
22
glowodory zbudowane są wyłącznie z atomów węgla i wodoru. Ze wzgl
zostały podzielone na kilka grup:
glowodory nasycone.
glowodory nasycone nazywamy ogólnie alkanami. Łańcuch w
steczki zbudowany jest z wiązań pojedynczych. Skrajne atomy wę
trzema atomami wodoru a pozostałe z dwoma.
Węglowodory
Nasycone
Cykliczne
Aromatyczne
Nienasycone
Acykliczne
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
gla i wodoru. Ze względu na
cuch węglowy szkieletu
pojedynczych. Skrajne atomy węgla połączone są
Nienasycone
Cykliczne
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Tabela 3. Węglowodory nasycone.
Nazwa alkanu
Wzór
Metan
Etan
Propan
Butan
Pentan
Heksan
Heptan
Oktan
Nonan
Dekan
Undekan
Dodekan
Tridekan
Tetradekan
Pentadekan
Wzór sumaryczny alkanów
atomów węgla. Cząsteczki kolejnych w
różnią sie od siebie jedynie o fragment
homologicznym a poszczególne zwi
Poza węglowodorami ła
łańcuchowe rozgałęzione, np. butan i 2
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
23
Wzór sumaryczny
Wzór strukturalny uproszczony
CH
4
CH
4
C
2
H
6
CH
3
CH
C
3
H
8
CH
3
CH
2
CH
C
4
H
10
CH
3
CH
2
CH
C
5
H
12
CH
3
CH
2
CH
2
CH
C
6
H
14
CH
3
CH
2
CH
2
CH
C
7
H
16
CH
3
CH
2
CH
2
CH
2
CH
C
8
H
18
CH
3
CH
2
CH
2
CH
2
CH
C
9
H
20
CH
3
CH
2
CH
2
CH
2
CH
2
CH
C
10
H
22
CH
3
CH
2
CH
2
CH
2
CH
2
CH
C
11
H
24
CH
3
(CH
2
)
C
12
H
26
CH
3
(CH
2
)
10
C
14
H
28
CH
3
(CH
2
)
11
C
16
H
30
CH
3
(CH
2
)
12
C
18
H
32
CH
3
(CH
2
)
13
Wzór sumaryczny alkanów zapisujemy wzorem: C
n
H
2n+2
, gdzie n oznacza liczb
steczki kolejnych węglowodorów maja podobną budow
sie od siebie jedynie o fragment –CH
2
–. Taką grupę związków nazywamy szeregiem
ym a poszczególne związki – homologami.
glowodorami łańcuchowymi prostymi znamy równie
zione, np. butan i 2-metylopropan.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Wzór strukturalny uproszczony
CH
3
CH
3
CH
2
CH
3
CH
2
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
)
9
CH
3
10
CH
3
11
CH
3
12
CH
3
13
CH
3
, gdzie n oznacza liczbę
budowę i właściwości a
zków nazywamy szeregiem
cuchowymi prostymi znamy również węglowodory
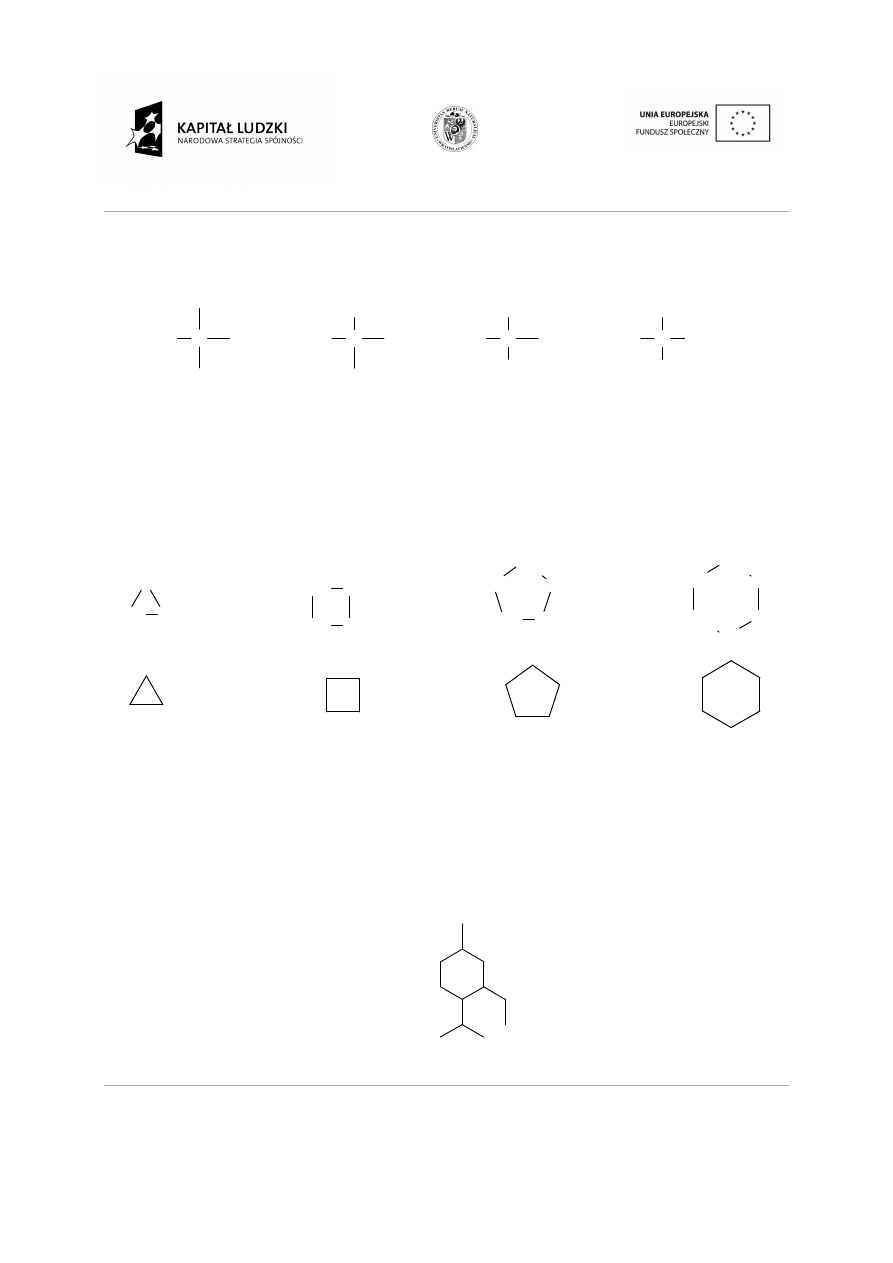
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Atom węgla ma rzędowo
możemy mieć atomy węgla I, II, III i IV rz
C
C
C
I-rzędowy
II-rz
Atomy węgla mogą łączy
węglowodory nazywamy cykloalkanami. Podobnie jak alkany tworz
o wzorze ogólnym C
n
H
2n
.
CH
2
CH
2
CH
2
CH
CH
cyklopropan
cyklobutan
Jeżeli do pierścienia przył
miejsce położenia oraz jego rodzaj.
Przykład
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
24
ędowość równą liczbie atomów węgla z nim zwi
gla I, II, III i IV rzędowe:
C
C
C
C
C
C
C
C
II-rzędowy
III-rzędowy
IV-rz
ą łączyć się nie tylko w łańcuchy, ale również w pier
glowodory nazywamy cykloalkanami. Podobnie jak alkany tworzą szereg homologiczny
H
2
H
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
cyklobutan
cyklopentan
cienia przyłączone są podstawniki to należy wskaza
enia oraz jego rodzaj.
1
2
3
4
5
6
2-etylo-1-izopropylo-4-metylocykloheksan
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
gla z nim związanych, zatem
C
C
C
C
IV-rzędowy
ż w pierścienie. Takie
ą szereg homologiczny
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
cykloheksan
y wskazać w nazwie jego
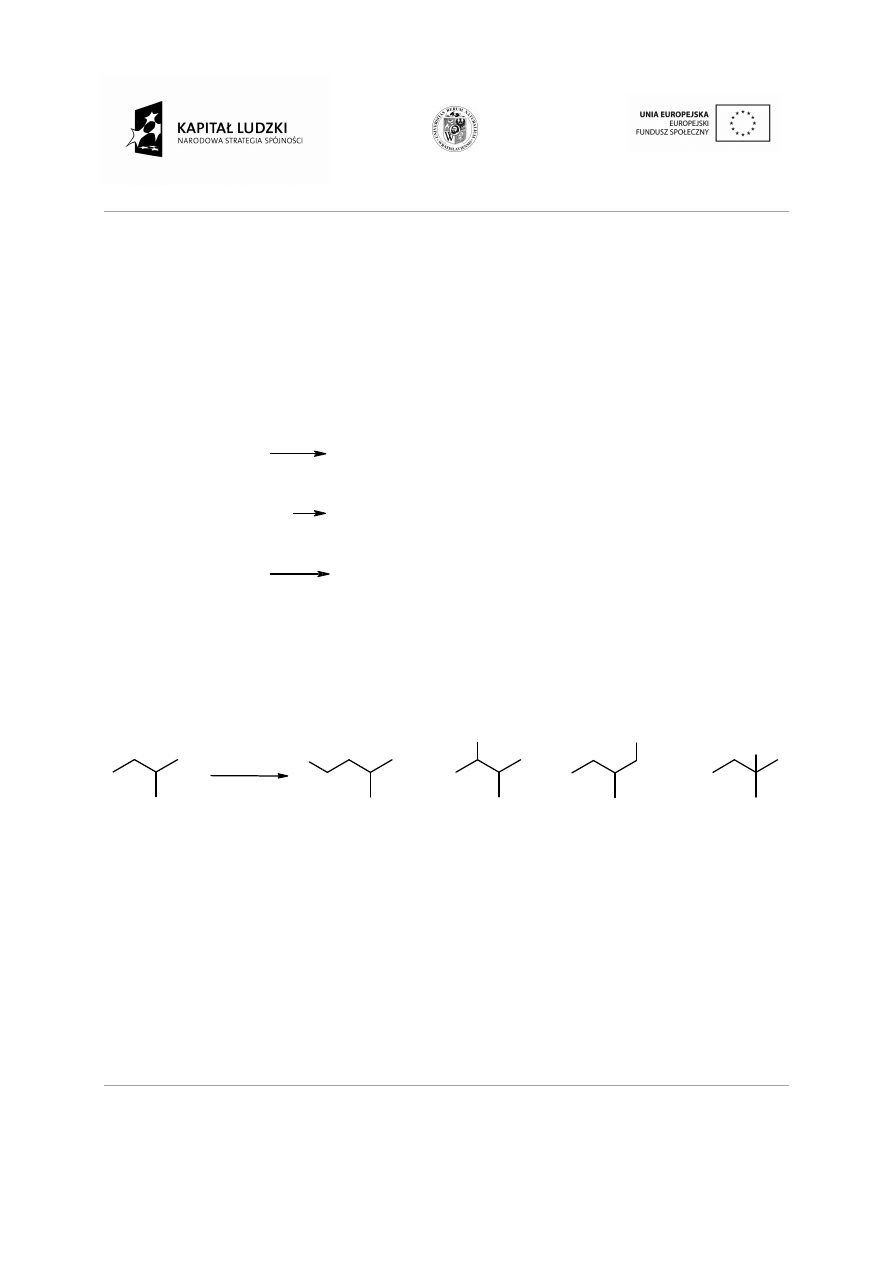
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.3.1.1
Reakcje węglowodorów nasyconych.
Węglowodory nasycone s
reakcjom spalania oraz reakcji z chlorem lub bromem w obecno
W spalaniu węglowodorów mo
otrzymać różne produkty:
C
5
H
12
+ 8 O
2
2 C
5
H
12
+ 11 O
2
C
5
H
12
+ 3 O
2
Alkany ulegają również
atomami fluorowców. Reakcja wymaga jednak zainicjowania przez
temperaturę. W wyniku reakcji tworzy si
Cl
Cl
2
, h
ν
Na podstawie doświadcze
przy trzeciorzędowym atomie w
reaktywne – przy pierwszorzę
2-chloro-2-metylobutan.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
25
glowodorów nasyconych.
nasycone są związkami mało aktywnymi chemicznie.
reakcjom spalania oraz reakcji z chlorem lub bromem w obecności światła.
glowodorów możemy w zależności od ilości dostarczonego
5 CO
2
+ 6 H
2
O
10 CO + 12 H
2
O
5 C + 6 H
2
O
również reakcjom podstawienia jednego lub kilku atomów wodoru
atomami fluorowców. Reakcja wymaga jednak zainicjowania przez światło lub podwy
W wyniku reakcji tworzy się mieszanina produktów podstawienia.
Cl
Cl
+
+
wiadczeń stwierdzono, ze najbardziej reaktywne jest wi
dowym atomie węgla, mniej reaktywne jest przy drugorzę
przy pierwszorzędowym. Dlatego głównym produktem powy
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zkami mało aktywnymi chemicznie. Alkany ulęgają
wiatła.
dostarczonego tlenu
reakcjom podstawienia jednego lub kilku atomów wodoru
wiatło lub podwyższoną
mieszanina produktów podstawienia.
Cl
Cl
+
stwierdzono, ze najbardziej reaktywne jest wiązanie C-H
gla, mniej reaktywne jest przy drugorzędowym a najmniej
powyższej reakcji jest
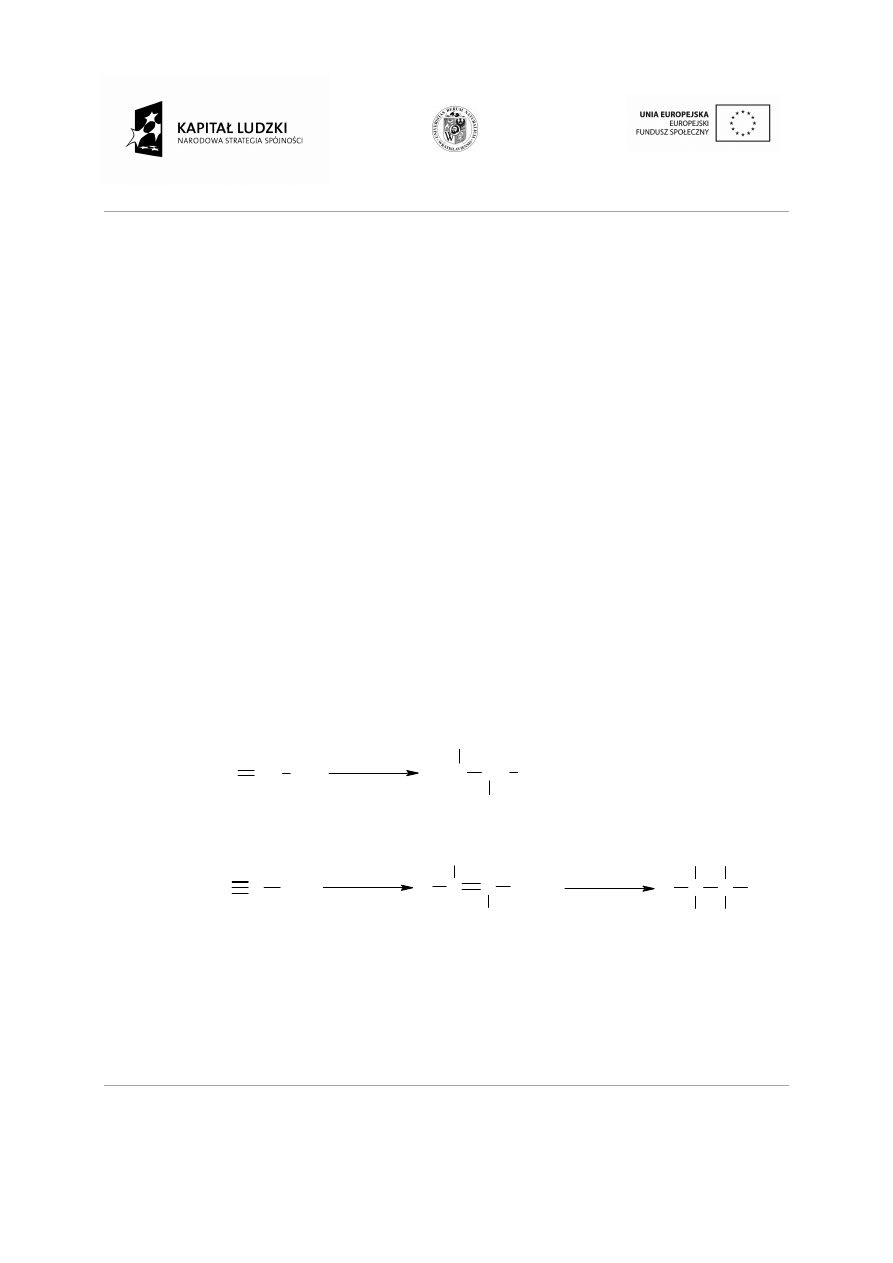
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.3.2
Węglowodory nienasycone.
Węglowodory nienasycone maj
podwójne (alkeny) lub potrójne
o reaktywności tych grup zwią
(addycji) i polimeryzacji.
2.3.2.1
Reakcje węglowodorów nienasyconych.
Reakcje addycji elektrofilowej do wi
Reguła Markownikowa:
wielokrotnego w przewadze tworzy si
przyłącza się do węgla połączonego z wi
Addycja halogenu.
C
H
2
CH CH
3
propen
C
H
C
CH
3
propyn
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
26
glowodory nienasycone.
glowodory nienasycone mają przynajmniej jedno wiązanie wielokrotne
lub potrójne (alkiny). Obecność wiązań wielokrotnych decyduje
ci tych grup związków. Mogą one ulęgać miedzy innymi reakcjom przył
glowodorów nienasyconych.
Reakcje addycji elektrofilowej do wiązania wielokrotnego:
a Markownikowa: W reakcjach addycji elektrofilowej
przewadze tworzy się ten produkt, gdzie odczynnik elektrofilowy (kation)
ączonego z większą ilością wodorów (o niższej rz
Addycja halogenu.
3
C
H
2
CH CH
3
Cl
Cl
Cl
2
1,2-dichloropropan
C
C
CH
3
Br
Br
H
Br
2
Br
2
1,2-dibromopropen
1,1,2,2-tetrabromopropan
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ązanie wielokrotne –
wielokrotnych decyduje
miedzy innymi reakcjom przyłączenia
W reakcjach addycji elektrofilowej do wiązania
ten produkt, gdzie odczynnik elektrofilowy (kation)
szej rzędowości).
C
C
CH
3
Br
Br
Br
Br
H
1,1,2,2-tetrabromopropan
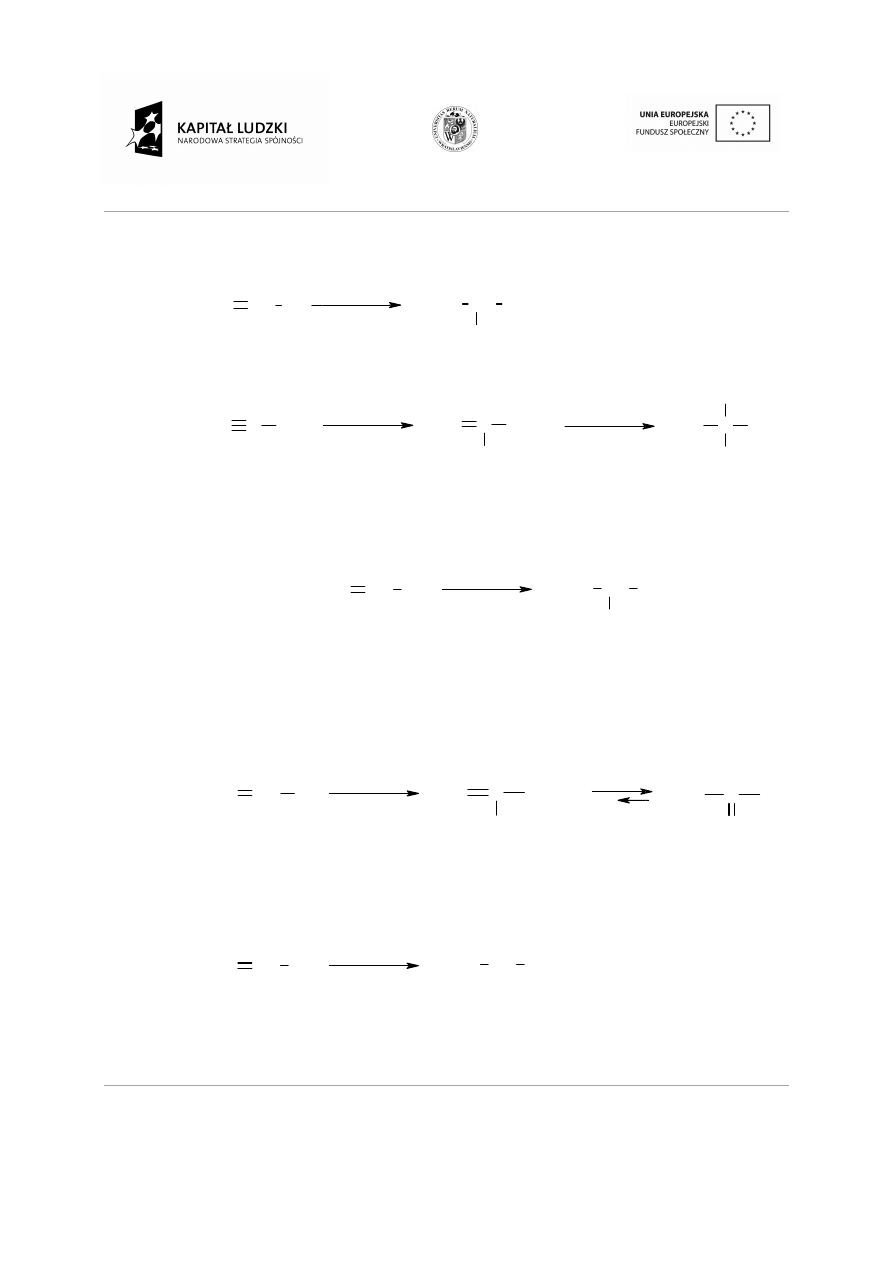
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Addycja halogenowodoru.
CH
2
CH CH
3
propen
C
H
C
CH
3
propyn
Addycja wody.
H
W reakcji addycji wody do wi
nienasycony alkohol, który
karbonylowego.
C
H
2
CH
CH
3
propen
Addycja wodoru.
C
H
2
CH CH
3
propen
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
27
Addycja halogenowodoru.
CH
3
CH CH
3
Cl
HCl
2-chloropropan
C
H
2
C
CH
3
Br
HBr
HBr
2-bromopropen
C
H
2
CH CH
3
CH
3
CH C
OH
H
2
O, H
+
propen
propan-2-ol
W reakcji addycji wody do wiązania potrójnego powstaje nietrwały
nienasycony alkohol, który izomeryzuje do bardziej trwałego zwi
karbonylowego.
3
C
H
2
C
CH
3
OH
H
2
O, H
+
Hg
2+
Addycja wodoru.
CH
3
CH
2
CH
3
H
2
propan
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
C
H
3
C
CH
3
Br
Br
2,2-dibromopropen
CH
3
propan-2-ol
zania potrójnego powstaje nietrwały
izomeryzuje do bardziej trwałego związku
CH
3
C
CH
3
O
propanon
keton dimetylowy
aceton
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
C
H
C
CH
3
propyn
Polimeryzacja:
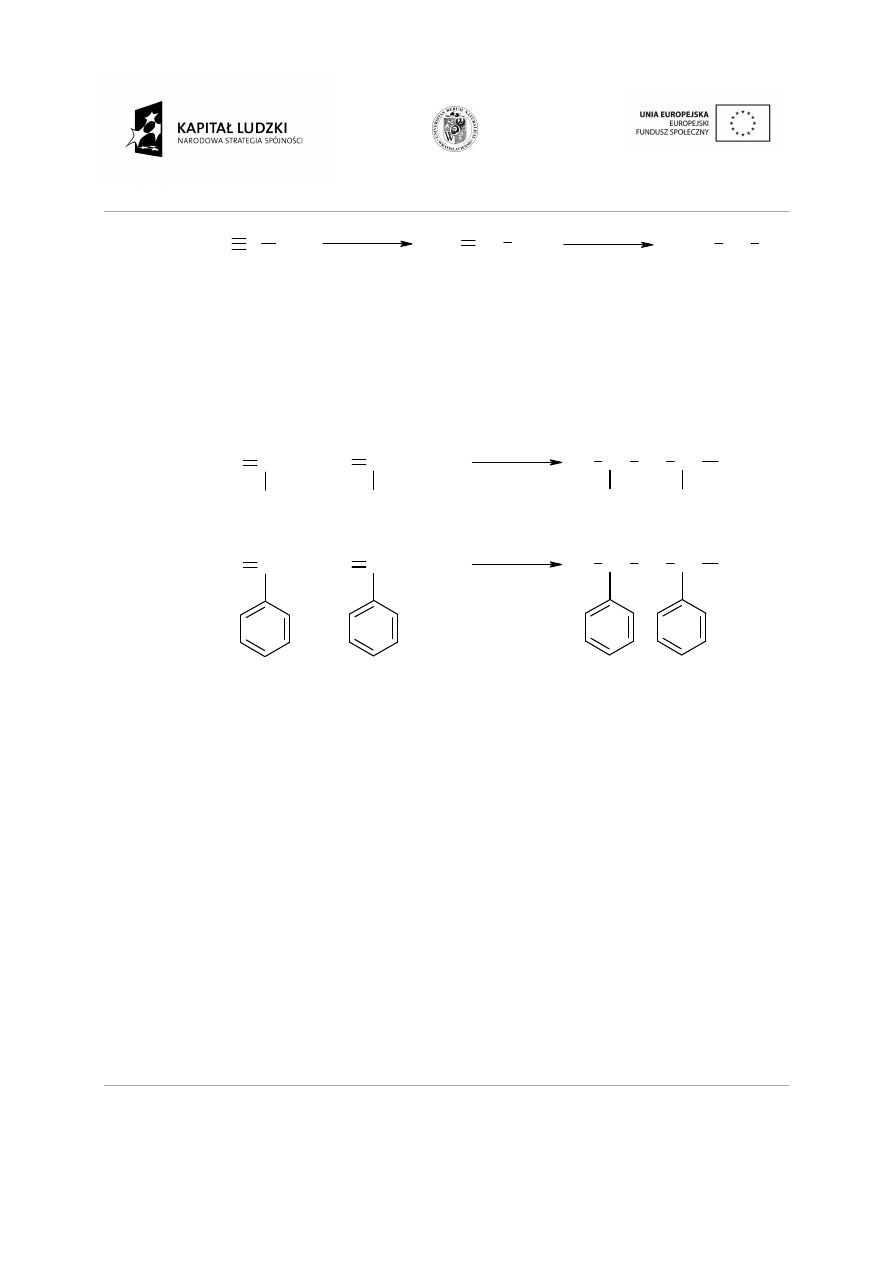
Reakcja ł
policząsteczki nazywamy polimeryzacj
H
C
H
2
CH
Cl
+
H
C
H
2
CH +
styren
2.3.3
Węglowodory aromatyczne.
Węglowodory aromatyczne maj
i zawierają wiązania zdelokalizowane, które ł
elektronów
π
powinna być zgodna z reguł
Benzen jest najprostszym zwi
homologiczne.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
28
C
H
2
CH CH
3
H
2
H
2
propen
Reakcja łączenia się pojedynczych cząsteczek (monomerów) w
eczki nazywamy polimeryzacją:
C
H
2
CH
Cl
CH
3
CH C
Cl
+
...
polichlorek winylu
C
H
2
CH
CH
3
CH C
+
...
polistyren
glowodory aromatyczne.
glowodory aromatyczne mają cząsteczkę płaską, cykliczną
zania zdelokalizowane, które łączą wszystkie atomy w pier
ć zgodna z regułą Hückla 4n+2, gdzie n = 0, 1, 2, 3….
Benzen jest najprostszym związkiem aromatycznym, tworzy
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
CH
3
CH
2
CH
3
propan
steczek (monomerów) w
CH
2
CH
Cl
...
polichlorek winylu
CH
2
CH
...
polistyren
, cykliczną (pierścieniową)
wszystkie atomy w pierścieniu. Liczba
Hückla 4n+2, gdzie n = 0, 1, 2, 3….
zkiem aromatycznym, tworzy różne szeregi
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
benzen
benzen
naftalen
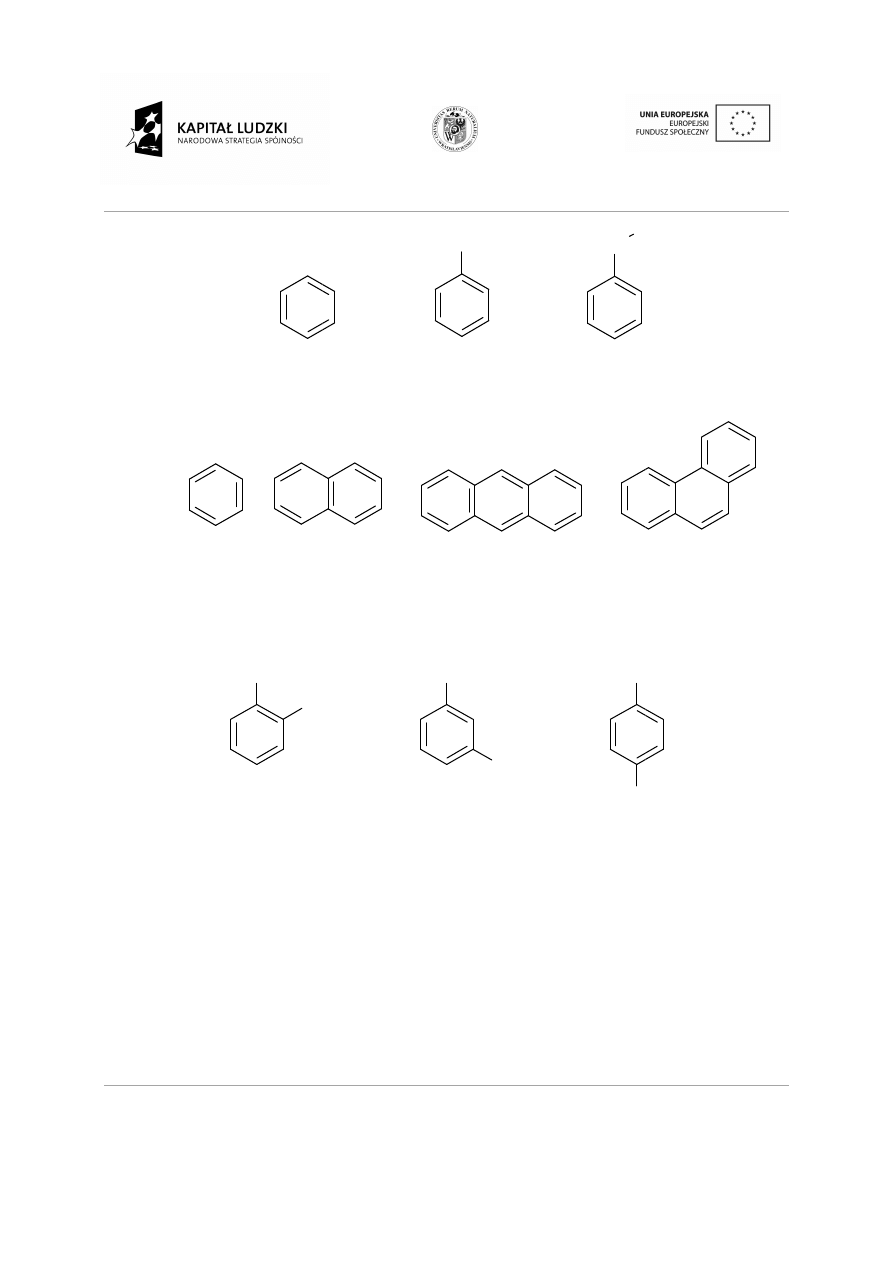
W nazwach dwupodstawionych pochodnych benzenu wykorzystuje si
orto (podstawienie 1,2), meta
CH
3
CH
1,2-dimetylobenzen
orto-ksylen
2.3.3.1
Reakcje węglowodorów aromatycznych.
Reakcje podstawienia (substytucji) elektrofilowej:
Reakcje substytucji elektrofilowej polega na
pierścieniu aromatycznym innym atomem lub grup
miedzy innymi reakcje nitrowania, sulfonowania, halogenowania i alkilowania.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
29
CH
3
CH
2
C
benzen
toluen
(metylobenzen)
etylobenzen
naftalen
antracen
W nazwach dwupodstawionych pochodnych benzenu wykorzystuje si
(podstawienie 1,3) i para (podstawienie 1,4).
H
3
CH
3
CH
3
CH
CH
1,2-dimetylobenzen
1,3-dimetylobenzen
meta-ksylen
1,4-dimetylobenzen
para-ksylen
glowodorów aromatycznych.
Reakcje podstawienia (substytucji) elektrofilowej:
Reakcje substytucji elektrofilowej polega na podstawieniu atomu wodoru w
cieniu aromatycznym innym atomem lub grupą funkcyjną. Reakcjami substytucji s
miedzy innymi reakcje nitrowania, sulfonowania, halogenowania i alkilowania.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
CH
3
etylobenzen
fenantren
W nazwach dwupodstawionych pochodnych benzenu wykorzystuje się przedrostki
(podstawienie 1,4).
H
3
H
3
1,4-dimetylobenzen
-ksylen
podstawieniu atomu wodoru w
. Reakcjami substytucji są
miedzy innymi reakcje nitrowania, sulfonowania, halogenowania i alkilowania.
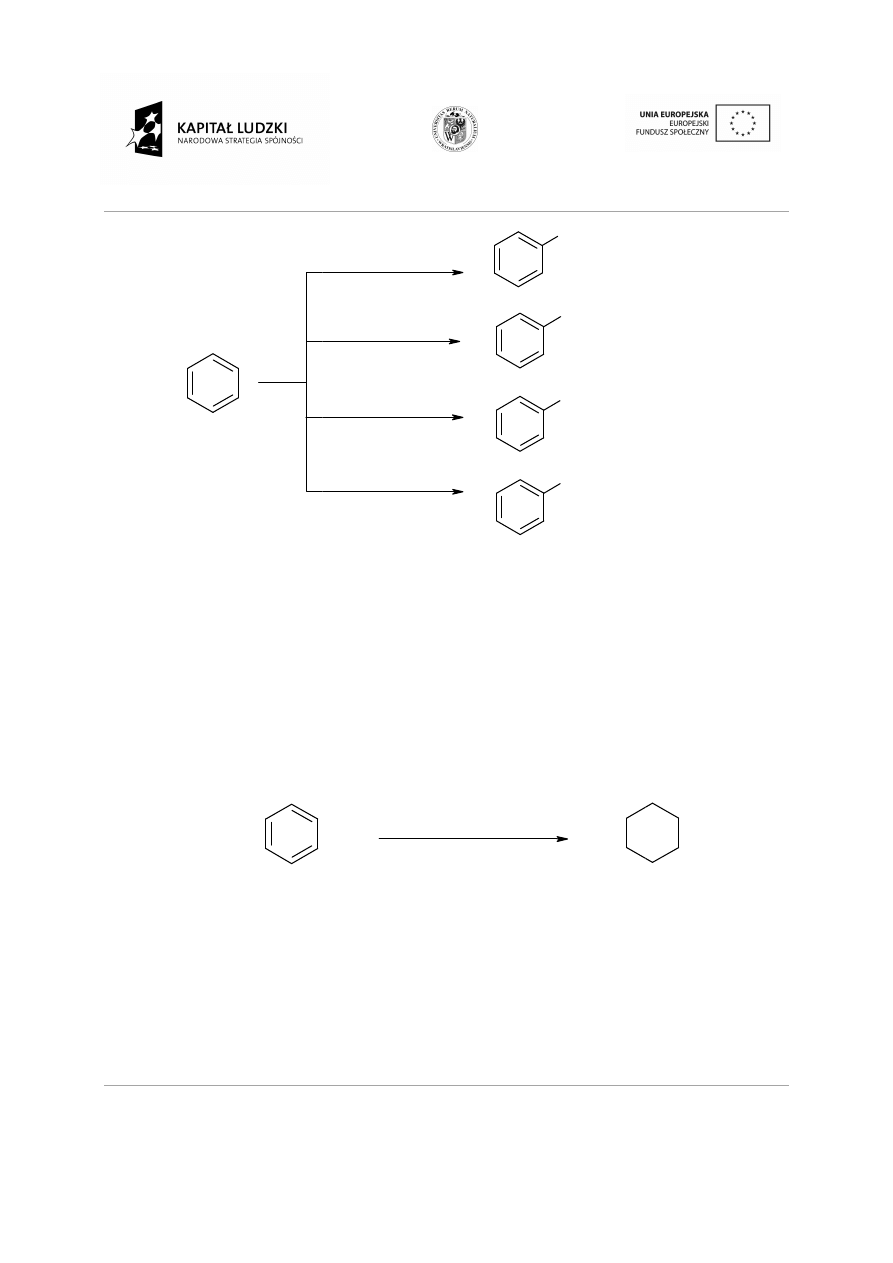
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Schemat 2. Reakcje substytucji elektrofilowej węglowodorów aromatycznych.
Reakcje uwodornienia
Benzen i inne węglowodory aromatyczne w obecno
podwyższonego ciśnienia ulega reakcjom przył
odpowiednie cykloalkany.
2.4
Zadania.
1.
Narysuj i nazwij po 3 zwi
węglowodorów nienasyconych, arenów, chlorowcoalkanów, alkoholi, eterów,
aldehydów, ketonów, kwasów karboksylowych, estrów, amin, amidów. Wska
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
30
NO
2
SO
3
H
Br
CH
3
HNO
3
+H
2
SO
4
H
2
SO
4
Br
2
, FeBr
3
CH
3
Cl, AlCl
3
nitrobenzen
kwas benzenosulfonowy
bromobenzen
toluen
substytucji elektrofilowej węglowodorów aromatycznych.
Reakcje uwodornienia:
ęglowodory aromatyczne w obecności katalizatora (nikiel) i
nienia ulega reakcjom przyłączenia wodoru. Produktem reakcji s
H
2
, kat. 2,5 MPa, 200
o
C
Narysuj i nazwij po 3 związki należące do węglowodorów nasyconych,
glowodorów nienasyconych, arenów, chlorowcoalkanów, alkoholi, eterów,
aldehydów, ketonów, kwasów karboksylowych, estrów, amin, amidów. Wska
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
nitrobenzen
kwas benzenosulfonowy
bromobenzen
ci katalizatora (nikiel) i
czenia wodoru. Produktem reakcji są
glowodorów nasyconych,
glowodorów nienasyconych, arenów, chlorowcoalkanów, alkoholi, eterów,
aldehydów, ketonów, kwasów karboksylowych, estrów, amin, amidów. Wskaż
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
charakterystyczne fragmenty budowy (wi
w postaci pełnych wzorów strukturalnych) decyduj
związków do poszczególnej klasy.
2.
Podaj nazwy systematyczne nast
CH
3
CH
CH
3
CH
3
CH
2
CH
2
CH
CH
3.
Określ rzędowość wszystkich atomów w
związków:
a) 4-etylo-4-metylooktan
b) 2,2-dimetylopropan
4.
Ile trzeciorzędowych atomów w
5.
Podaj ogólne wzory oraz narysuj i nazwij trzy pierwsze zwi
homologicznym alkanów, alkenów i alkinów.
6.
Napisz reakcje pełnego spalania butanu, propenu i acetylenu.
7.
Ile produktów monochlorowania uzyskasz w wyniku reakcji 2,3
etylocykloheksanu z chlorem? Dla pierwszego z wymienionych substratów podaj
nazwy wszystkich produktów i zaznacz produkt główny.
8.
Narysuj wzory półstrukturalne izomerycznych alkenów zawieraj
węgla w cząsteczce. Podaj ich nazwy systematyczne.
9.
Na przykładzie reakcji winylocykloheksanu z HBr wyja
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
31
charakterystyczne fragmenty budowy (wiązania, grupy funkcyjne narysowane
w postaci pełnych wzorów strukturalnych) decydujące o przynale
zków do poszczególnej klasy.
Podaj nazwy systematyczne następujących związków:
H
3
CH
2
CH
3
H CH
2
CH
2
CH
3
H
2
CH
2
CH CH
2
CH
3
CH
3
C
CH
2
C
Br
Cl
Cl
Br
ść wszystkich atomów węgla w cząsteczkach nast
metylooktan
c) 2,3,4-trimetylopentan
d) 3-etylo-2,2-dimetylopentan
dowych atomów węgla zawiera: neopentan, 3-metyloheksan.
Podaj ogólne wzory oraz narysuj i nazwij trzy pierwsze zwi
nów, alkenów i alkinów.
Napisz reakcje pełnego spalania butanu, propenu i acetylenu.
Ile produktów monochlorowania uzyskasz w wyniku reakcji 2,3-dimetylobutanu oraz
etylocykloheksanu z chlorem? Dla pierwszego z wymienionych substratów podaj
h produktów i zaznacz produkt główny.
Narysuj wzory półstrukturalne izomerycznych alkenów zawieraj
steczce. Podaj ich nazwy systematyczne.
Na przykładzie reakcji winylocykloheksanu z HBr wyjaśnij regułę Markownikowa.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zania, grupy funkcyjne narysowane
ce o przynależności tych
CH
3
Cl
CH CH CH
3
Br Cl
steczkach następujących
trimetylopentan
dimetylopentan
metyloheksan.
Podaj ogólne wzory oraz narysuj i nazwij trzy pierwsze związki w szeregu
dimetylobutanu oraz
etylocykloheksanu z chlorem? Dla pierwszego z wymienionych substratów podaj
Narysuj wzory półstrukturalne izomerycznych alkenów zawierających 5 atomów
ę Markownikowa.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
10.
Napisz reakcje addycji 1 mola HCl, Br
a) etylenu
b) metylopropenu
11.
Napisz reakcje uwodornienia i polimeryzacji:
a) etenu
12.
Na dowolnym przykładzie napisz dwie reakcje probówkowe, za pomoc
odróżnisz węglowodór nasycony od nienasyconego. Opisz krótko efekt wizualny tych
reakcji.
13.
Porównaj budowę i hybrydyzacj
i benzenu. Napisz reakcj
benzenu tym samym odczynnikiem w obecno
14.
Narysuj i nazwij możliwe izomery dowolnego dwupodstawionego benzenu.
15.
Jakie będą główne produkty nast
a) bromobenzenu z chlorem w obecno
b) nitrobenzenu z bromem w obecno
c) toluenu z kwasem azotowym (V) w obecno
d) fenolu z kwasem azotowym (V) w obecno
16.
Napisz po jednym przykładzie reakcji 1
a) substytucji
b) eliminacji
17.
Uzupełnij poniższy schemat reakcji.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
32
addycji 1 mola HCl, Br
2
oraz wody w środowisku kwa
c) 2-metylobut-2
d) acetylenu
Napisz reakcje uwodornienia i polimeryzacji:
b) metylopropenu
Na dowolnym przykładzie napisz dwie reakcje probówkowe, za pomoc
glowodór nasycony od nienasyconego. Opisz krótko efekt wizualny tych
ę i hybrydyzację atomów węgla w cząsteczkach cykloheksa
i benzenu. Napisz reakcję cykloheksanu z bromem pod wpływem
benzenu tym samym odczynnikiem w obecności FeBr
3
.
żliwe izomery dowolnego dwupodstawionego benzenu.
główne produkty następujących reakcji:
bromobenzenu z chlorem w obecności FeCl
3
b) nitrobenzenu z bromem w obecności FeBr
3
c) toluenu z kwasem azotowym (V) w obecności H
2
SO
4
d) fenolu z kwasem azotowym (V) w obecności H
2
SO
4
Napisz po jednym przykładzie reakcji 1-bromopropanu z KOH będą
szy schemat reakcji.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
rodowisku kwaśnym do:
2-enu
c) chlorku winylu
Na dowolnym przykładzie napisz dwie reakcje probówkowe, za pomocą których
glowodór nasycony od nienasyconego. Opisz krótko efekt wizualny tych
steczkach cykloheksanu
cykloheksanu z bromem pod wpływem światła oraz
liwe izomery dowolnego dwupodstawionego benzenu.
ędącej reakcją:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
C
H
3
CH
2
OH
H
A
18.
Ustal strukturę alkenów, które w wyniku ozonolizy daj
C
H
3
CH
2
C
O
H
CH
3
C
H
3
CH
2
C
O
CH
3
H
+
+
a)
b)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
33
C
H
2
CH
2
H
C
H
3
CH
2
Cl
C
H
3
CH
CH
2
CH
3
Cl
B
C
alkenów, które w wyniku ozonolizy dają następujące produkty:
C
O
H
C
O
H
O
CH
3
C
O
H
c)
+
d)
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
C
H
3
CH
2
CH
2
CH
3
D
ące produkty:
C
H
3
C
CH
3
O
CH
3
C
O
CH
3
+
+

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3
Ć
wiczenie 3.
3.1
Związki organiczne jednofunkcyjne
Wiele związków organicznych poza w
zawierające tlen np. grupa hydroksylowa, karbonylowa, karboksylowa.
3.1.1
Alkohole i fenole.
Alkohole to grupa zwi
węgla przyłączone są grupy hydroksylowe. W alkoholach alifatycznych grupa hydroksylowa
przyłączona jest do tetraedrycznego atomu w
z atomów wodory w pierścieniu aromatycznym.
CH
3
C
alkohol etylowy
etanol
W zależności od rzędowo
alkohole nazywa się alkoholami pierwszorz
CH
2
OH
CH
2
CH
3
alkohol pierwszorzędowy
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
34
zki organiczne jednofunkcyjne zawierające tlen.
zków organicznych poza węglem i wodorem ma grupy funkcyjne
ce tlen np. grupa hydroksylowa, karbonylowa, karboksylowa.
Alkohole to grupa związków organicznych, gdzie do jednego lub wi
grupy hydroksylowe. W alkoholach alifatycznych grupa hydroksylowa
czona jest do tetraedrycznego atomu węgla, w fenolach zaś podstawiony jest jeden
cieniu aromatycznym.
CH
2
OH
OH
alkohol etylowy
fenol
ędowości atomu węgla, do którego przyłączona jest grupa
alkoholami pierwszorzędowymi, drugorzędowymi i trzeciorz
CH
3
CH CH
3
OH
alkohol drugorzędowy
alkohol trzeciorz
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
glem i wodorem ma grupy funkcyjne
gdzie do jednego lub więcej atomów
grupy hydroksylowe. W alkoholach alifatycznych grupa hydroksylowa
podstawiony jest jeden
H
fenol
ączona jest grupa –OH
dowymi i trzeciorzędowymi.
CH
3
C CH
3
OH
CH
3
alkohol trzeciorzędowy
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3.1.1.1
Reakcje alkoholi i fenoli.
Reakcje alkoholi i fenoli z zasadami
Alkohole alifatyczne są
alkoholany:
CH
3
CH
2
OH
+
2
W reakcjach w wodzie
CH
3
CH
2
O
-
Na
+
H
Alkohole aromatyczne s
otrzymać można w reakcji z roztworami wodorotlenków litowców:
OH
+
Reakcja podstawienia grupy hydroksylowej atomem fluorowca:
W reakcji wymiany grupy hydroksylowej na atom fluorowca otrzymujemy
odpowiednią
halogenopochodn
florowcowodorowych często w podwy
bromki i jodki z alkoholi, nie da si
chlorków.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
35
Reakcje alkoholi i fenoli.
fenoli z zasadami:
są słabymi kwasami i w reakcji z aktywnymi metalami
CH
3
CH
2
Na
O
-
Na
+
2
2
W reakcjach w wodzie alkoholany ulegają hydrolizie:
CH
3
CH
2
OH
H
2
O
+ Na
+
Alkohole aromatyczne są silniejszymi kwasami niż alkohole i woda, wi
na w reakcji z roztworami wodorotlenków litowców:
O
NaOH
Na
+
+
Reakcja podstawienia grupy hydroksylowej atomem fluorowca:
W reakcji wymiany grupy hydroksylowej na atom fluorowca otrzymujemy
halogenopochodną.
Alkohol
poddajemy
działaniu
silnych
kwasów
sto w podwyższonej temperaturze. Możemy w ten sposób otrzyma
bromki i jodki z alkoholi, nie da się natomiast otrzymać z pierwszorzę
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
w reakcji z aktywnymi metalami tworzą
+
+
H
2
+ OH
-
alkohole i woda, więc fenolany
+
H
2
O
Reakcja podstawienia grupy hydroksylowej atomem fluorowca:
W reakcji wymiany grupy hydroksylowej na atom fluorowca otrzymujemy
.
Alkohol
poddajemy
działaniu
silnych
kwasów
emy w ten sposób otrzymać
z pierwszorzędowych alkoholi
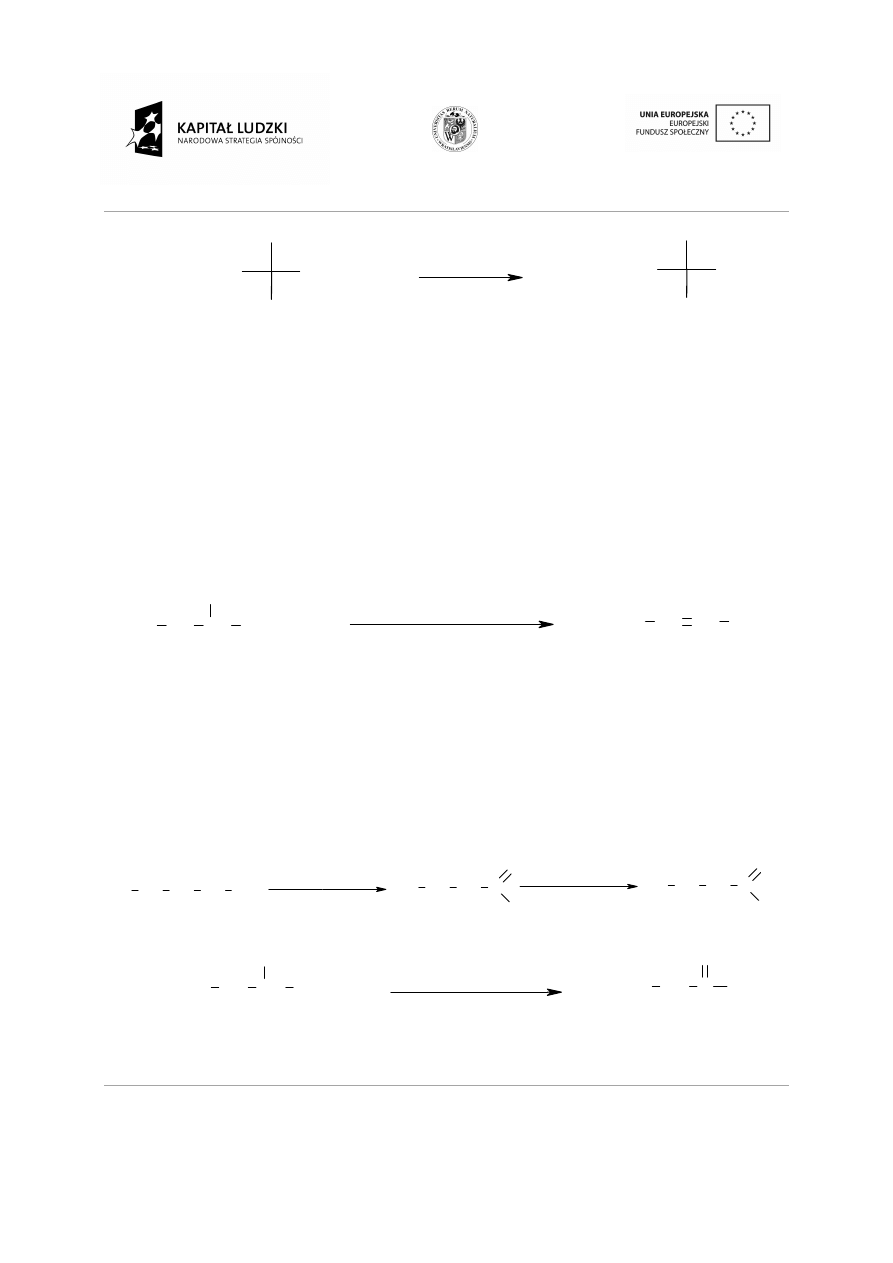
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
CH
3
CH
3
OH
C
H
3
Chlorki pierwszorzędowe otrzymamy w reakcji alkoholi pierwszorz
i ZnCl
2
jako katalizatorem, jednak reakcja powinna by
temperaturze.
Reakcja eliminacji wody.
Eliminacja cząsteczki wody z alkoholi prowadzi
zachodzi w obecności mocnych st
CH
3
CH
2
CH CH
3
OH
Reakcja utlenienia alkoholi alifatycznych.
Pierwszorzędowe alkohole alifatyczne
odczynnika do aldehydów lub kwasów karboksylowych, natomiast
utleniają się do ketonów.
stosowanymi utleniaczami.
CH
3
CH
2
CH
2
CH
2
OH
K
2
Cr
CH
3
CH
2
CH CH
3
OH
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
36
H
C
H
3
HBr
ędowe otrzymamy w reakcji alkoholi pierwszorz
, jednak reakcja powinna być prowadzona w podwy
Reakcja eliminacji wody.
steczki wody z alkoholi prowadzi do powstania alkenu. Reakcja
ci mocnych stężonych kwasów i wysokiej temperatury.
CH
3
H
+,
-
H
2
O
Reakcja utlenienia alkoholi alifatycznych.
alkohole alifatyczne utleniają się w zależno
odczynnika do aldehydów lub kwasów karboksylowych, natomiast drugorz
Trzeciorzędowe alkohole nie utleniają si
CH
3
CH
2
CH
2
C
O
H
C
Cr
2
O
7
, H
+
3
CH
K
2
Cr
2
O
7
, H
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
CH
3
CH
3
Br
C
dowe otrzymamy w reakcji alkoholi pierwszorzędowych z HCl
prowadzona w podwyższonej
do powstania alkenu. Reakcja
onych kwasów i wysokiej temperatury.
3
CH CH CH
3
zależności od użytego
drugorzędowe alkohole
dowe alkohole nie utleniają się powszechnie
CH
3
CH
2
CH
2
C
O
OH
H
3
CH
2
C
CH
3
O
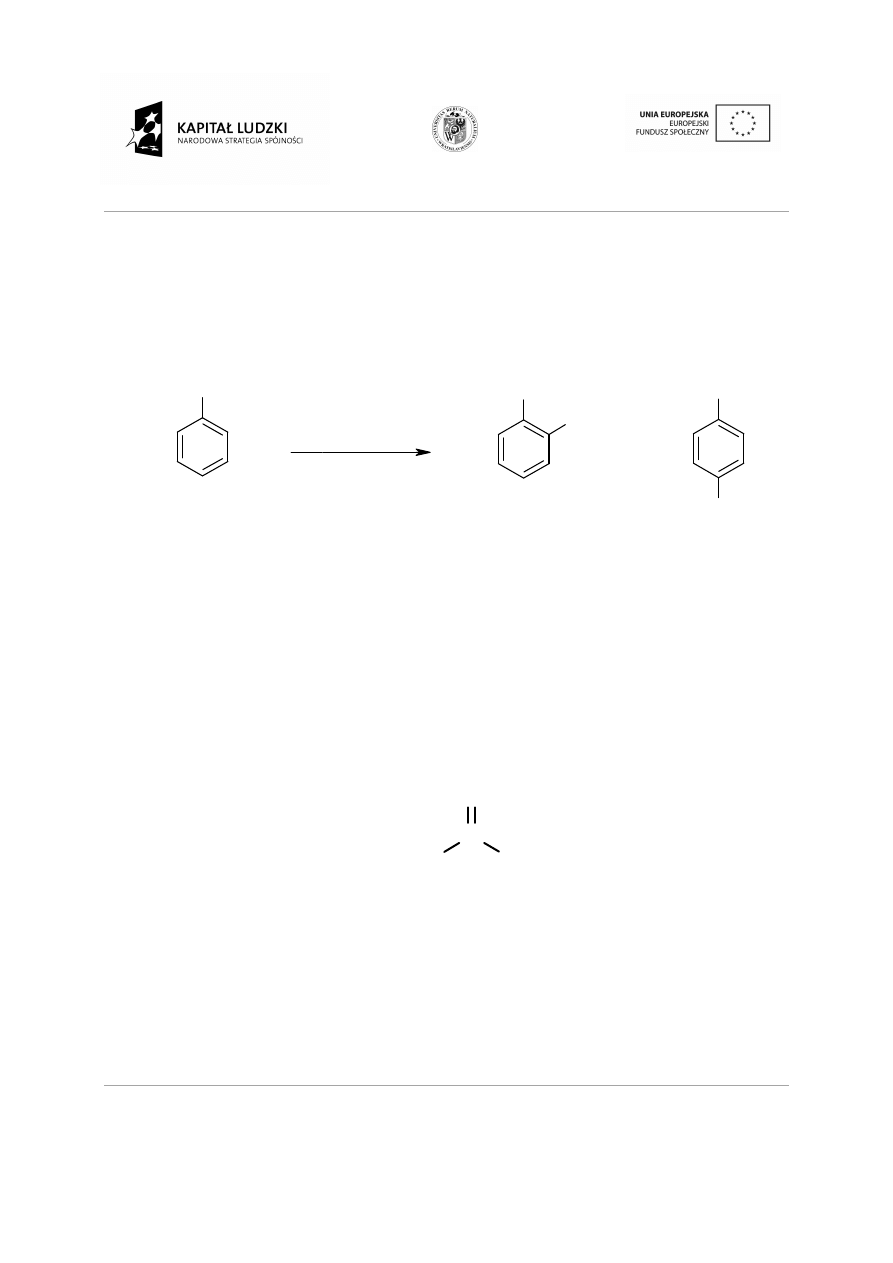
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Reakcje podstawienia wodoru w pier
Fenol podobnie jak benzen ulega reakcji podstawienia jednego z wodorów
w pierścieniu aromatycznym. W tej reakcji grupa hydroksylowa b
z podstawników w pozycję orto
OH
HNO
fenol
3.1.2
Aldehydy i ketony.
W aldehydach i ketonach atom tlenu jest zwi
podwójnym. Utworzona grupa funkcyjna nosi nazw
W aldehydach grupa karbonylowa poł
węglowodorową – alifatyczną
karbonylowa połączona jest z dwoma resztami w
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
37
podstawienia wodoru w pierścieniu aromatycznym fenolu.
Fenol podobnie jak benzen ulega reakcji podstawienia jednego z wodorów
cieniu aromatycznym. W tej reakcji grupa hydroksylowa będzie kierowała drugi
orto lub para.
OH
NO
2
+
HNO
3
, H
2
SO
4
orto-nitrofenol
Aldehydy i ketony.
W aldehydach i ketonach atom tlenu jest związany z atomem w
podwójnym. Utworzona grupa funkcyjna nosi nazwę grupy karbonylowej:
*
C
*
O
W aldehydach grupa karbonylowa połączona jest z atomem wodoru oraz z reszt
alifatyczną lub aromatyczną. Natomiast w cząsteczkach ketonów grupa
czona jest z dwoma resztami węglowodorowymi.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
cieniu aromatycznym fenolu.
Fenol podobnie jak benzen ulega reakcji podstawienia jednego z wodorów
ędzie kierowała drugi
OH
NO
2
para-nitrofenol
zany z atomem węgla wiązaniem
atomem wodoru oraz z resztą
steczkach ketonów grupa

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
R
C
O
H
3.1.2.1
Reakcje aldehydów i
Reakcje utlenienia:
Wszystkie aldehydy wykazuj
kwasów karboksylowych.
•
próba Tollensa
Odczynnik Tollensa to amoniak
wodorotlenek diaminosrebrowy).
wydzielające się na
utlenieniu.
CH
3
C
O
H
+ 2 Ag(NH
•
próba Trommera
W próbie Trom
wodorotlenek miedzi(
ulegają utlenieniu.
CH
3
C
O
H
+
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
38
aldehyd
R
C
O
R
Reakcje aldehydów i ketonów.
Wszystkie aldehydy wykazują właściwości redukujące – ulegaj
próba Tollensa
Odczynnik Tollensa to amoniakalny roztwór azotanu(V) srebra (
wodorotlenek diaminosrebrowy). O pozytywnym przebiegu reakcji
ę na ściankach probówki lustro srebrowe. Ketony nie ulegaj
CH
3
C
O
O
+
Ag(NH
3
)
2
OH
Ag
NH
4
+
era
W próbie Trommera czynnikiem utleniającym jest
wodorotlenek miedzi(II). Wydziela się ceglasty osad tlenku miedzi
CH
3
C
O
OH
Cu(OH)
2
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
keton
gają utlenieniu do
(V) srebra (a właściwie
wnym przebiegu reakcji świadczy
Ketony nie ulegają
+ H
2
O
Ag
+ 3 NH
3
cym jest świeżo strącony
ceglasty osad tlenku miedzi (I). Ketony nie
+
Cu
2
O + H
2
O
ceglasty osad
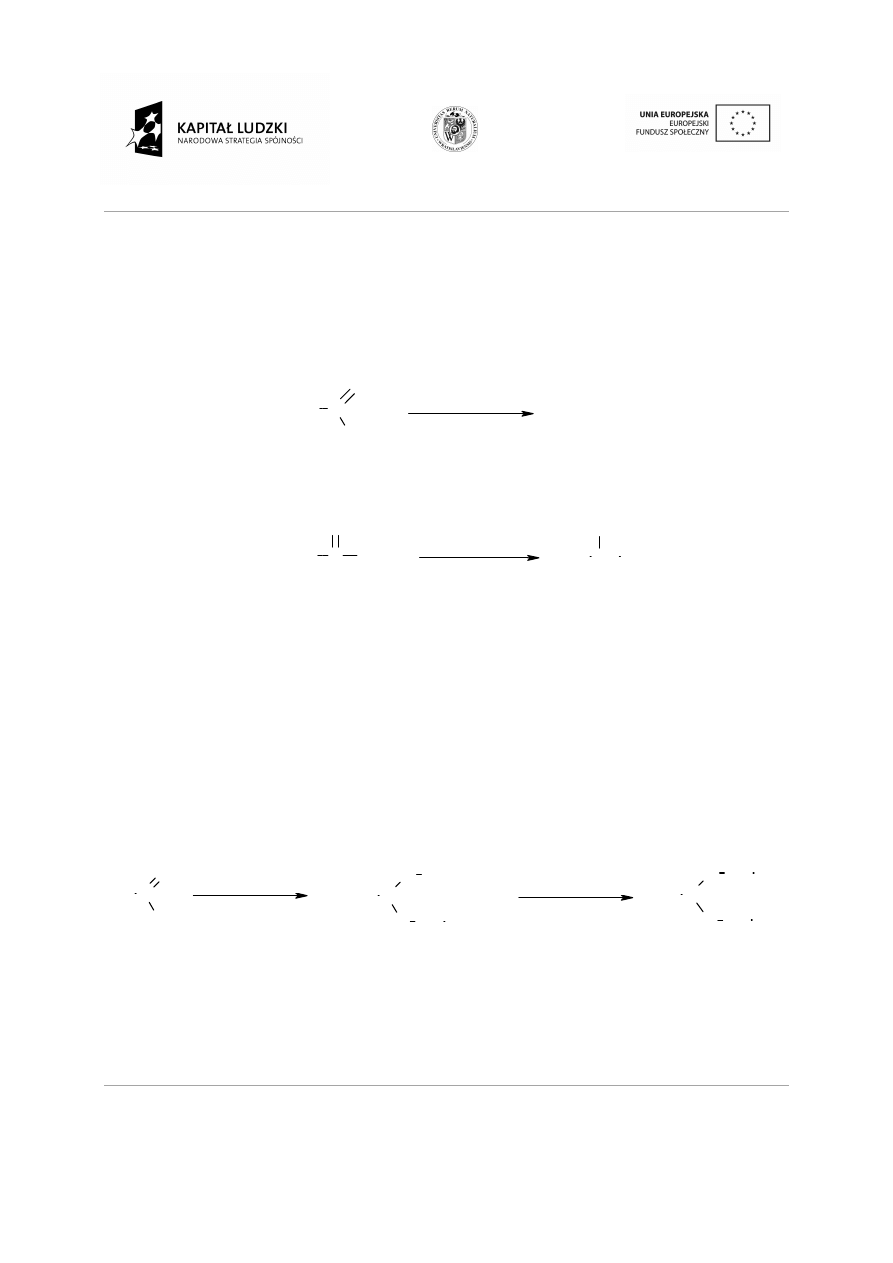
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Reakcje redukcji:
Aldehydy i ketony redukowane s
(glinowodorkiem litu lub borowodorkiem sodu)
alkoholi.
CH
3
CH
3
Reakcja przyłączenia alkoholi:
W obecności kwasów mo
karbonylowego atomu węgla aldehydów i ketonów. W wyniku tej reakcji tworzy si
hemiacetal. Jeżeli reakcja jest prowadzona w nadmiarze alkoholu to nast
kolejnej cząsteczki alkoholu do utworzenia acetalu. Acetale s
rozpadowi pod wpływem wodnego roztworu kwasu.
CH
3
C
O
H
CH
3
CH
2
OH, H
+
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
39
Aldehydy i ketony redukowane są głównie za pomocą wodorków metali
(glinowodorkiem litu lub borowodorkiem sodu) do odpowiednich pierwszo
3
C
O
H
NaBH
4
CH
3
CH
2
OH
C
CH
3
O
CH
3
CH CH
OH
LiAlH
4
alkoholi:
ci kwasów może nastąpić przyłączenie cząsteczek alkoholi do
ęgla aldehydów i ketonów. W wyniku tej reakcji tworzy si
eli reakcja jest prowadzona w nadmiarze alkoholu to nastę
steczki alkoholu do utworzenia acetalu. Acetale są nietrwałe i łatwo ulegaj
rozpadowi pod wpływem wodnego roztworu kwasu.
CH
3
CH
O
O
H
CH
2
CH
3
CH
3
CH
2
OH, H
+
hemiacetal
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ą wodorków metali
do odpowiednich pierwszo i drugorzędowych
OH
H
3
ąsteczek alkoholi do
gla aldehydów i ketonów. W wyniku tej reakcji tworzy się
eli reakcja jest prowadzona w nadmiarze alkoholu to następuje przyłączenie
nietrwałe i łatwo ulegają
CH
3
CH
O
O CH
2
CH
3
CH
2
CH
3
acetal

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Reakcja haloformowa:
Ketony z grupą metylow
utleniają się do kwasów w reakcji z fluorowcami w wodnym zasadowym roztworze.
zależności od użytego reagenta p
lub bromoform.
CH
3
C CH
3
O
+ 3 I
2
+ NaOH
3.1.3
Kwasy karboksylowe.
Grupą funkcyjną w kwasach karboksylowych jest grupa karboksylowa.
od budowy reszty węglowodorowej kwasy mo
Kwasy mogą mieć więcej ni
trikarboksylowe itp.
Nazwy systematyczne pochodz
w łańcuchu rozpoczyna się od grupy karboksylowej. Bardzo cz
zwyczajowe, które zazwyczaj
zwyczajowe dla pochodnych kwasów karboksylowych stosujemy oznaczenia atomów w
literami greckimi zaczynając numeracj
karboksylową.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
40
metylową przyłączoną bezpośrednio do karbonylowego atomu w
do kwasów w reakcji z fluorowcami w wodnym zasadowym roztworze.
ytego reagenta produktem reakcji poza kwasem jest jodoform, chlorofo
CH
3
C
O
OH
NaOH
+
CHI
3
+
Kwasy karboksylowe.
w kwasach karboksylowych jest grupa karboksylowa.
glowodorowej kwasy możemy podzielić na alifatyczne i aromatyczne.
ęcej niż jedną grupę karboksylową – kwasy dikarboksylowe,
Nazwy systematyczne pochodzą od odpowiednich węglowodorów a numeracje
ę od grupy karboksylowej. Bardzo często stosuje si
zwyczajowe, które zazwyczaj określają pochodzenie danego kwasu. Wyprowadzaj
zwyczajowe dla pochodnych kwasów karboksylowych stosujemy oznaczenia atomów w
literami greckimi zaczynając numerację od węgla bezpośrednio połą
CH
3
CH
2
CH
2
CH
2
COOH
1
2
3
4
5
α
β
γ
δ
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
arbonylowego atomu węgla
do kwasów w reakcji z fluorowcami w wodnym zasadowym roztworze. W
roduktem reakcji poza kwasem jest jodoform, chloroform
3NaI
+
3H
2
O
w kwasach karboksylowych jest grupa karboksylowa. W zależności
na alifatyczne i aromatyczne.
kwasy dikarboksylowe,
glowodorów a numeracje
sto stosuje się jednak nazwy
pochodzenie danego kwasu. Wyprowadzając nazwy
zwyczajowe dla pochodnych kwasów karboksylowych stosujemy oznaczenia atomów węgla
rednio połączonego z grupą
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Tabela 4. Wzory i nazwy kwasów karboksylowych
Wzór
HCOOH
CH
3
COOH
CH
3
CH
2
COOH
CH
3
(CH
2
)
2
COOH
CH
3
(CH
2
)
3
COOH
CH
3
(CH
2
)
4
COOH
CH
3
(CH
2
)
6
COOH
CH
3
(CH
2
)
7
COOH
CH
3
(CH
2
)
10
COOH
CH
3
(CH
2
)
14
COOH
CH
3
(CH
2
)
16
COOH
Przykład.
3.1.3.1
Reakcje kwasów karboksylowych.
Tworzenie soli:
W reakcjach kwasów karboksylowych
wodorotlenkami otrzymujemy sole kwasów karboksylowych. Niektóre z nich s
w życiu codziennym od dawna np. sole sodowe kwasów tłuszczowych s
składnikiem mydła, benzoesan sodu jest znanym
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
41
. Wzory i nazwy kwasów karboksylowych
Nazwa systematyczna
Nazwa zwyczajowa.
Kwas metanowy
Kwas mrówkowy
Kwas etanowy
Kwas octowy
Kwas propanowy
Kwas propionowy
Kwas butanowy
Kwas masłowy
Kwas pentanowy
Kwas walerianowy
Kwas heksanowy
Kwas kapronowy
Kwas oktanowy
Kwas kaprylowy
Kwas nonanowy
Kwas pelargonowy
Kwas dodekanowy
Kwas laurynowy
Kwas heksadekanowy
Kwas palmitynowy
Kwas oktadekanowy
Kwas stearynowy
CH
3
CH
2
CH CH
2
COOH
OH
kwas 3-hydroksypentanowy
kwas
β−
hydroksywalerianowy
Reakcje kwasów karboksylowych.
W reakcjach kwasów karboksylowych z aktywnymi metalami, tlenkami metali
jemy sole kwasów karboksylowych. Niektóre z nich s
yciu codziennym od dawna np. sole sodowe kwasów tłuszczowych s
składnikiem mydła, benzoesan sodu jest znanym środkiem konserwującym.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Nazwa zwyczajowa.
Kwas mrówkowy
Kwas octowy
Kwas propionowy
Kwas masłowy
Kwas walerianowy
Kwas kapronowy
Kwas kaprylowy
Kwas pelargonowy
Kwas laurynowy
Kwas palmitynowy
Kwas stearynowy
aktywnymi metalami, tlenkami metali lub
jemy sole kwasów karboksylowych. Niektóre z nich są stosowane
yciu codziennym od dawna np. sole sodowe kwasów tłuszczowych są głównym
cym.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
CH
3
CH
2
CH
2
CH
2
CH
2
C
CH
3
CH
2
CH
2
CH
2
CH
2
C
Reakcja estryfikacji:
W wyniku reakcji kwasów karboksylowych z alkoholami w
otrzymuje się estry.
C
O
OH
CH
2
CH
3
+
CH
3
CH
Reakcja tworzenia amidów:
W pierwszym etapie reakcji kwasu karboksylowego z amoniakiem otrzymuje si
amonowe. Dopiero po ogrzaniu sole przechodz
C
O
OH
CH
3
+
2 NH
3
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
42
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CO
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CO
W wyniku reakcji kwasów karboksylowych z alkoholami w środowisku kwa
C
O
O
CH
2
CH
3
H
+
CH
2
OH
W pierwszym etapie reakcji kwasu karboksylowego z amoniakiem otrzymuje si
grzaniu sole przechodzą w amidy kwasowe.
C
O
O NH
4
CH
3
T
-
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
OOH
OO Na
+
+ NaOH
+
H
2
O
-
rodowisku kwaśnym
O
OCH
2
CH
3
H
2
O
+
W pierwszym etapie reakcji kwasu karboksylowego z amoniakiem otrzymuje się sole
C
O
NH
2
CH
3

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Redukcja kwasów karboksylowych:
Kwasy karboksylowe mo
pierwszorzędowych alkoholi.
CH
3
COOH
3.1.4
Estry.
Produktami reakcji kwasów karboksylowych lub nieorganicznych z alkoholami
monowodorotlenowymi lub wielowodorotlenowymi s
w świecie roślinnym i zwierzę
zapachy, np. mrówczan etylu ma zapach rumowy, a ma
tworzy się podobnie ja nazwy soli, ale zamiast naz
pochodzącej od alkoholu.
3.1.5
Reakcje estrów.
Estry otrzymuje się w reakcji kwasów z alkoholami w
jest odwracalna, ponieważ powstaj
hydrolizę do kwasu i alkoholu. W trakcie reakcji ustala si
CH
3
CH
2
C
O
OH
CH
3
C
+
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
43
Redukcja kwasów karboksylowych:
Kwasy karboksylowe można zredukować np. glinowodorkiem litu
COOH
CH
3
CH
2
OH
LiAlH
4
Produktami reakcji kwasów karboksylowych lub nieorganicznych z alkoholami
monowodorotlenowymi lub wielowodorotlenowymi są estry. Te szeroko rozpowszechnione
linnym i zwierzęcym związki mają zazwyczaj charakterystyczne przyjemne
, np. mrówczan etylu ma zapach rumowy, a maślan etylu - ananasowy
podobnie ja nazwy soli, ale zamiast nazwy metalu podaje si
w reakcji kwasów z alkoholami w środowisku kwa
ż powstająca w reakcji woda reaguje z estrem powoduj
kwasu i alkoholu. W trakcie reakcji ustala się stan równowagi dynamicznej.
CH
2
OH
CH
3
CH
2
C
O
O CH
H
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
np. glinowodorkiem litu (LiAlH
4
) do
OH
Produktami reakcji kwasów karboksylowych lub nieorganicznych z alkoholami
Te szeroko rozpowszechnione
zazwyczaj charakterystyczne przyjemne
ananasowy.
Nazwy estrów
wy metalu podaje się nazwę grupy
rodowisku kwaśnym. Reakcja ta
ca w reakcji woda reaguje z estrem powodując jego
stan równowagi dynamicznej.
H
2
CH
3
+
H
2
O
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kwasy nieorganiczne również reaguj
CH
3
CH
2
OH
+
HNO
Reakcja hydrolizy kwaśnej:
Hydroliza kwaśna jest procesem odwrotnym
stan równowagi w kierunku produktów reakcji stosuje si
CH
3
CH
2
C
O
O CH
2
CH
3
+
CH
3
CH
2
O NO
2
+
Reakcja hydrolizy zasadowej:
Reakcja hydrolizy zasadowej jest procesem nieodwracalnym. Produkt
alkohol i sól kwasu.
CH
3
CH
2
C
O
O CH
2
CH
3
+
CH
3
CH
2
O NO
2
+
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
44
Kwasy nieorganiczne również reagują z alkoholami dając estry:
CH
3
CH
2
O NO
2
HNO
3
na jest procesem odwrotnym do reakcji estryfikacji. Aby przesun
stan równowagi w kierunku produktów reakcji stosuje się duży nadmiar wody.
H
+
CH
3
CH
2
C
O
OH
H
2
O
+
CH
3
CH
2
OH
H
+
H
2
O
+
Reakcja hydrolizy zasadowej:
Reakcja hydrolizy zasadowej jest procesem nieodwracalnym. Produkt
CH
3
CH
2
C
O
O
OH
H
2
O
+
-
CH
3
CH
2
OH
OH -
H
2
O
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
+
H
2
O
do reakcji estryfikacji. Aby przesunąć
y nadmiar wody.
CH
3
CH
2
OH
+
+
HNO
3
Reakcja hydrolizy zasadowej jest procesem nieodwracalnym. Produktami hydrolizy są
CH
3
CH
2
OH
+
+
NO
3
-
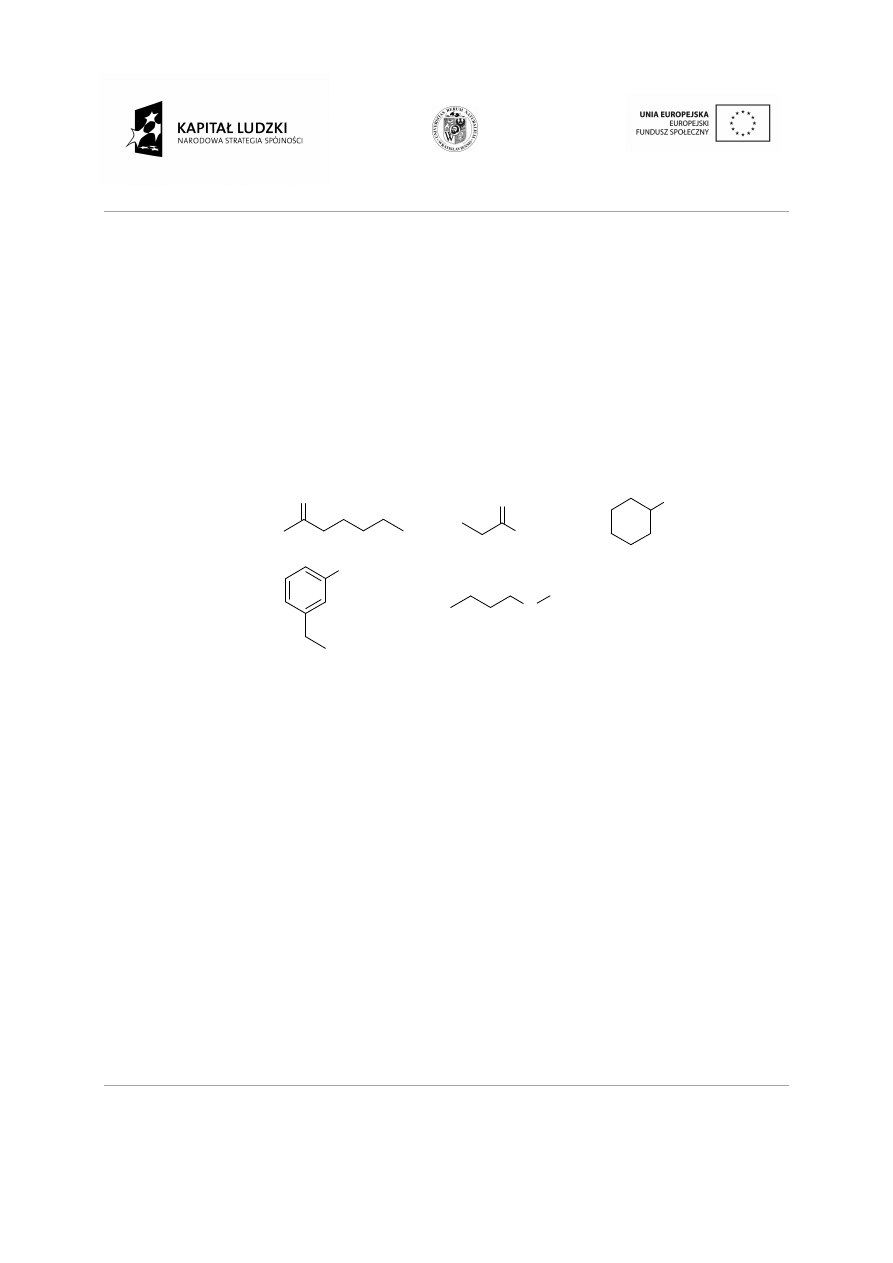
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3.2
Zadania.
1.
Narysuj lub nazwij nastę
a) butan-1-ol
b) 2-metylopropan-2-ol
c) etanal
d) propanon (aceton)
O
h)
k)
2. Narysuj wzory izomerycznych alkoholi o 4 atomach w
rzędowość. Jak za pomoc
o różnej rzędowości? Napisz odpowiednie
3. Porównaj kwasowość etanolu i fenolu pisz
świadczącą, że fenol jest kwasem słabszym od kwasu w
4. Jakie produkty otrzymasz w reakcjach butan
a) HBr
b) Al
2
O
3
(300
o
C)
5. Napisz jednoetapowe reakcje otrzymywania 2,4
a) alkenu
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
45
Narysuj lub nazwij następujące cząsteczki:
ol
e) eter dietylowy
f) octan etylu
g) fenol
H
O
OH
O
i)
j)
l)
Narysuj wzory izomerycznych alkoholi o 4 atomach węgla w cząsteczce i okre
. Jak za pomocą odczynnika Jonesa (K
2
Cr
2
O
7
w H
2
SO
4
) rozró
ci? Napisz odpowiednie reakcje.
ść etanolu i fenolu pisząc odpowiednie reakcje. Napisz reakcj
e fenol jest kwasem słabszym od kwasu węglowego.
4. Jakie produkty otrzymasz w reakcjach butan-2-olu z:
c) K
2
Cr
2
O
7
d) CH
3
COOH
Napisz jednoetapowe reakcje otrzymywania 2,4-dimetylopentan-3-olu z:
b) chlorowcoalkanu
c) związku karbonylowego
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
e) eter dietylowy
OH
ąsteczce i określ ich
) rozróżnisz alkohole
c odpowiednie reakcje. Napisz reakcję
olu z:
ązku karbonylowego
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
6.
Otrzymaj aldehyd octowy oraz aceton przez utlenianie
tlenkiem miedzi (II), a nast
z 2 molami etanolu w ś
7.
Napisz dwie reakcje probówkowe, za pomoc
Opisz efekty wizualne towarzysz
8.
Uzupełnij schemat reakcji:
2-metylobut-1-en
HCl
KMnO
4
, OH
-
D
9. Narysuj wzory:
a) pięciu pierwszych kwasów z szeregu homologicznego nierozgał
alkanowych (podaj ich nazwy)
b) kwasu benzoesowego
c) kwasu stearynowego i palmitynowego
d) kwasu oleinowego i linolowego (uwzgl
e) octanu propylu
f) maślanu butylu
10. Napisz reakcje:
a) estryfikacji kwasu propionowego w
b) hydrolizy benzoesanu etylu w
c) hydrolizy mrówczanu etylu w
Która z wymienionych reakcji jest reakcj
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
Otrzymaj aldehyd octowy oraz aceton przez utlenianie odpowiednich alkoholi
tlenkiem miedzi (II), a następnie napisz reakcje aldehydu octowego z 1 molem oraz
2 molami etanolu w środowisku kwaśnym.
Napisz dwie reakcje probówkowe, za pomocą których odróżnisz aldehyd od ketonu.
Opisz efekty wizualne towarzyszące tym reakcjom.
Uzupełnij schemat reakcji:
HCl
A
KOH, H
2
O
B
C
D
ciu pierwszych kwasów z szeregu homologicznego nierozgałę
alkanowych (podaj ich nazwy)
b) kwasu benzoesowego
c) kwasu stearynowego i palmitynowego
d) kwasu oleinowego i linolowego (uwzględnij konfigurację wiązań
a) estryfikacji kwasu propionowego w środowisku kwaśnym
b) hydrolizy benzoesanu etylu w środowisku zasadowym
zy mrówczanu etylu w środowisku kwaśnym
Która z wymienionych reakcji jest reakcją odwracalną?
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
odpowiednich alkoholi
pnie napisz reakcje aldehydu octowego z 1 molem oraz
nisz aldehyd od ketonu.
propanon
ciu pierwszych kwasów z szeregu homologicznego nierozgałęzionych kwasów
ązań podwójnych)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
11. Posługując się odpowiednimi reakcjami uszereguj podane zwi
wzrastających właściwo
krezol, etanol, kwas wę
12. Narysuj wzór trioleinianu gliceryny i napisz reakcj
a) będącą podstawą procesu produkcji mydeł
b) wykorzystywaną w technologii produkcji margaryny
c) wykorzystywaną do odró
efekt wizualny)
13. Napisz reakcję nitrogliceryny z kwasem azotowym
14. Uzupełnij schemat reakcji:
etan
Cl
2
,
15. Zaproponuj ciąg reakcji chemicznych, w wyniku których z etanu mo
octan izopropylu.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
47
odpowiednimi reakcjami uszereguj podane związki według
ściwości kwasowych.kwas octowy, butan-1-ol, glikol etylenowy,
etanol, kwas węglowy
12. Narysuj wzór trioleinianu gliceryny i napisz reakcję:
ą procesu produkcji mydeł
ą w technologii produkcji margaryny
ą do odróżnienia tego związku od tripalmitynianu gliceryny (pod
itrogliceryny z kwasem azotowym(V).
14. Uzupełnij schemat reakcji:
,hv
A
NaOH, H
2
O
B
CuO
Ag
2
O
D
NaOH
E
g reakcji chemicznych, w wyniku których z etanu moż
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zki według
ol, glikol etylenowy, p-
zku od tripalmitynianu gliceryny (podaj
C
g reakcji chemicznych, w wyniku których z etanu można otrzymać

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4
Ć
wiczenie 4.
4.1
Związki organiczne jednofunkcyjne zwieraj
Azot jest obok węgla, wodoru, tlenu i fluorowców jednym z najcz
pierwiastków w związkach organicznych.
związkach nitrowych oraz aminokwasach i białkach, a tak
budujących nukleotydy.
4.1.1
Aminy.
Aminy są to związki organiczne wywodz
wodorów znajdują się grupy w
wprowadzonych grup na pierwszorz
Przykład
Aminy pierwszorzędowe.
N
C
H
3
H
H
metyloamina
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
48
organiczne jednofunkcyjne zwierające azot.
gla, wodoru, tlenu i fluorowców jednym z najczęściej wyst
zkach organicznych. Występuje miedzy innymi w aminach, amidach,
zkach nitrowych oraz aminokwasach i białkach, a także jest w zasadach azotowych
zki organiczne wywodzące się od amoniaku, gdzie zamiast kolejnych
grupy węglowodorowe. Aminy dzielimy w zale
wprowadzonych grup na pierwszorzędowe, drugorzędowe i trzeciorzędowe.
ędowe.
N
CH
3
CH
2
H
H
N
H
H
CH
CH
3
CH
3
etyloamina
izopropyloamina
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ęściej występujących
puje miedzy innymi w aminach, amidach,
e jest w zasadach azotowych
od amoniaku, gdzie zamiast kolejnych
glowodorowe. Aminy dzielimy w zależności od ilości
dowe.
NH
2
anilina
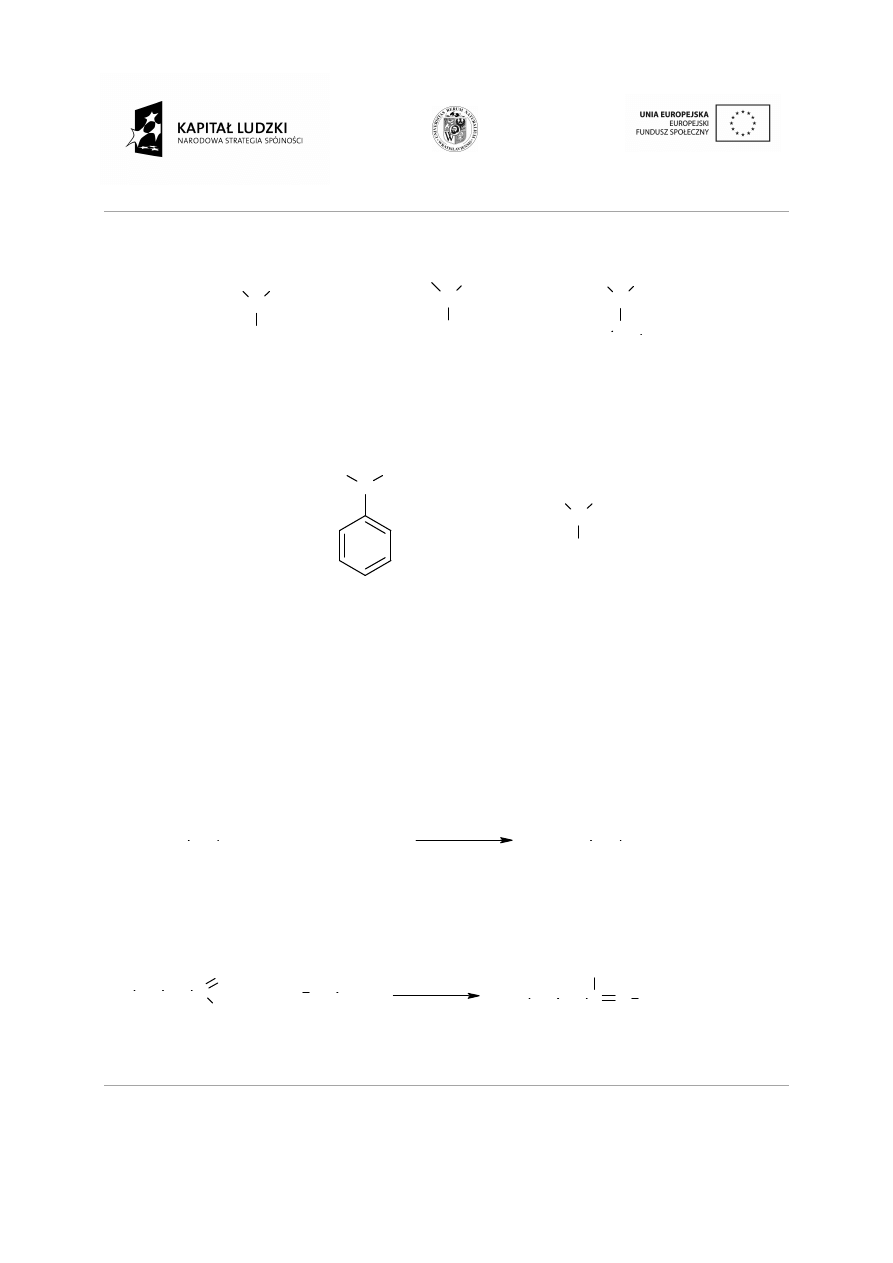
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Aminy drugorzędowe.
N
C
H
3
CH
3
H
dimetyloamina
Aminy trzeciorzędowe
H
N-etylo-N-metyloanilina
4.1.1.1
Reakcje amin.
Aminy, podobnie jak amoniak, zachowuj
słabszymi zasadami od amin alifatycznych i amoniaku). Reaguj
amoniowe:
CH
3
CH
2
NH
2
+
Aminy pierwszorzędowe
CH
3
CH
2
CH
2
C
O
H
N
H
2
CH
+
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
49
N
CH
3
CH
2
CH
3
H
N
H
C
CH
CH
3
C
dimetyloamina
etylometyloamina
izopropylometyloamina
dowe.
N
C
H
3
CH
2
CH
3
N
C
H
3
CH
3
CH
3
N-etylo-N-metyloanilina
trimetyloamina
Aminy, podobnie jak amoniak, zachowują się jak słabe zasady (aminy aromatyczne s
słabszymi zasadami od amin alifatycznych i amoniaku). Reagują z kwasami daj
CH
3
CH
2
NH
HCl
chlorowodorek etyloaminy
ędowe reagują z związkami karbonylowymi tworz
CH
2
CH
3
CH
3
CH
2
CH
2
C
N
H
C
zasada Schiffa
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
CH
3
CH
3
izopropylometyloamina
(aminy aromatyczne są
z kwasami dając sole
H
3
chlorowodorek etyloaminy
+
Cl-
tworząc zasady Schiffa.
CH
2
CH
3
+
H
2
O
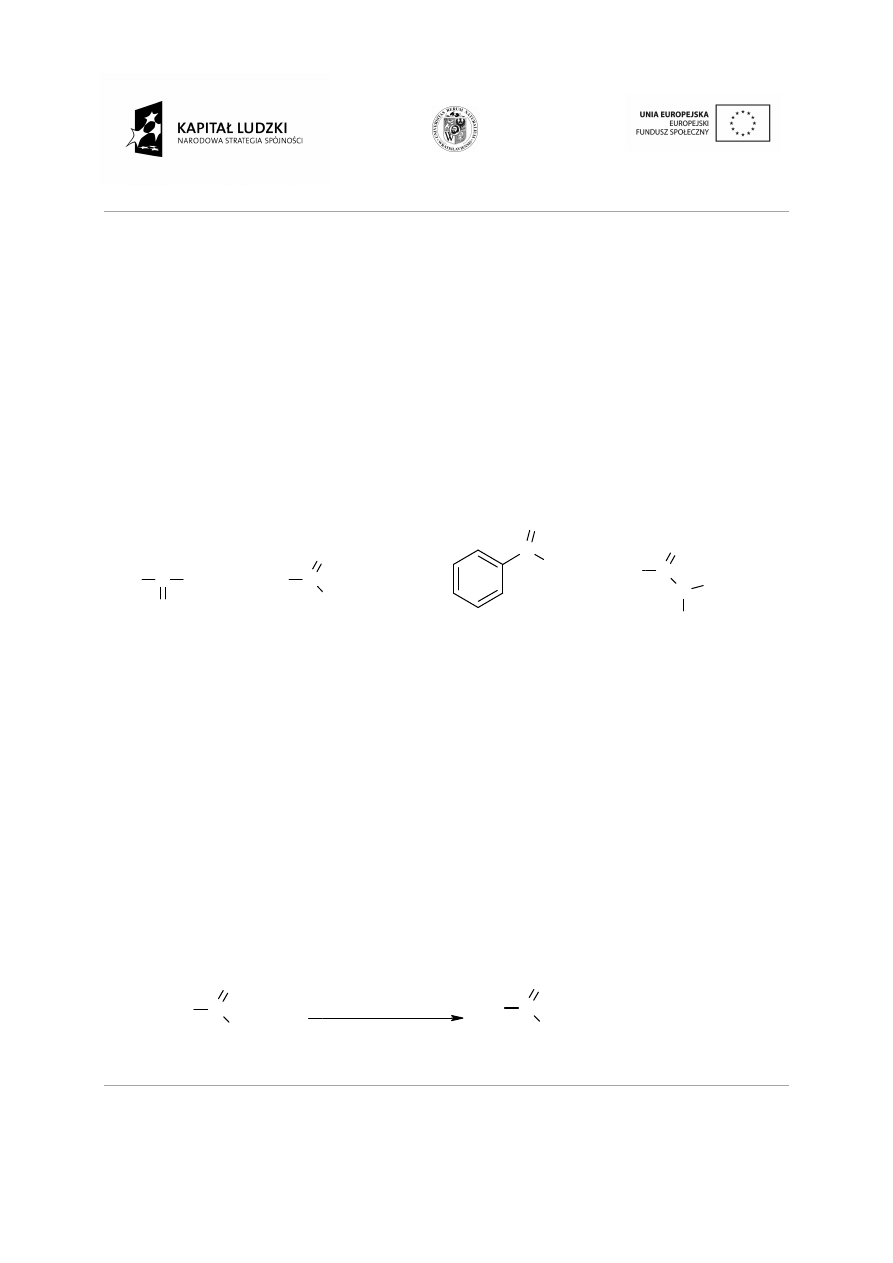
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Zasady Schiffa powstaj
aminokwasów przy udziale enzymów
4.1.2
Amidy.
Amidy są pochodnymi kwasów karboksylowych i amin. Zwi
amidowym występują bardzo cz
przemiany związków azotowych. Wi
antybiotykach i alkaloidach.
N
H
2
C
O
NH
2
C
H
3
C
O
mocznik
amid kwasu octowego
acetamid
4.1.2.1
Reakcje amidów.
Amidy w środowisku kwa
amoniowej. Natomiast w środowisku zasadowym hydrolizuj
i amoniaku lub aminy.
Przykład.
Hydroliza kwaśna.
C
H
3
C
O
NH
2
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
50
powstają w organizmach żywych w przemianach biochemicznych
przy udziale enzymów.
pochodnymi kwasów karboksylowych i amin. Związki z ugrupowaniem
bardzo często w przyrodzie np. mocznik będący koń
zków azotowych. Wiązanie amidowe występuje w białkach
O
NH
2
C
O
NH
2
C
H
3
amid kwasu octowego
benzamid
N,N-dimetyloacetamid
rodowisku kwaśnym hydrolizują do kwasu karboksylowego i soli
środowisku zasadowym hydrolizują do soli kwasu karboksylowego
C
H
3
C
O
OH
H
+
,
H
2
O
+
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ywych w przemianach biochemicznych
ązki z ugrupowaniem
cy końcowym produktem
puje w białkach, w wielu
C
O
N CH
3
CH
3
N,N-dimetyloacetamid
do kwasu karboksylowego i soli
do soli kwasu karboksylowego
NH
4
+
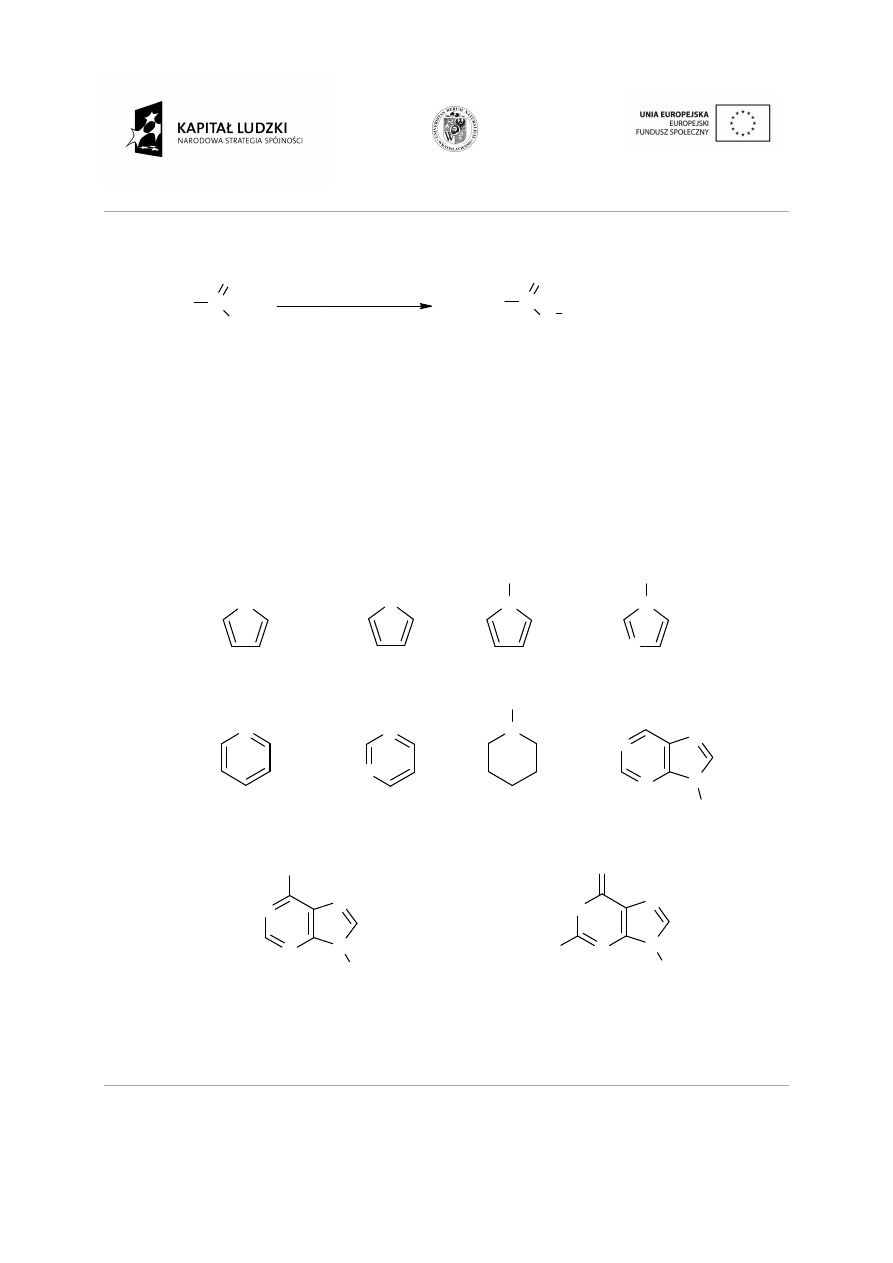
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Hydroliza zasadowa.
C
H
3
C
O
NH
2
4.1.3
Związki pierścieniowe zawieraj
Znamy wiele związków
wiele z nich ma znaczenie w procesach biochemicznych. Najcz
O
N
furan
pirydyna
N
N
NH
2
adenina
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
51
C
H
3
C
O
O
OH
+
-
cieniowe zawierające azot, tlen i siarkę.
zków naturalnych pierścieniowych zawierających azot. Zazwyczaj
wiele z nich ma znaczenie w procesach biochemicznych. Najczęściej spotykane zwi
S
N
H
N
N
H
N
N
N
H
N
N
tiofen
pirol
imidazol
pirymidyna
piperydyna
puryna
N
N
H
N
N
O
N
H
2
guanina
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
NH
3
cych azot. Zazwyczaj
ciej spotykane związki to:
N
H
N
N
N
H
imidazol
puryna
N
N
H

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
N
N
O
NH
H
cytozyna
4.2
Związki wielofunkcyjne.
Związki zawierające wię
Na właściwości chemiczne,
wszystkie obecne w cząsteczce grupy, które mog
jak również wewnątrzcząsteczkowo.
4.2.1
Hydroksokwasy, ketokwasy
Związki zawierające zarówno grup
hydroksykwasami. W produktach naturalnych s
w postaci estrów np. kwas jabłkowy w jabłkach, kwas winowy w winie.
biochemicznych występują jako produkty po
CH
2
OH
COOH
kwas glikolowy
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
52
H
2
N
N
O
O
H
N
O
H
uracyl
tymina
zki wielofunkcyjne.
ce więcej niż jedną grupę funkcyjną nazywamy wielofunkcyjnymi.
ich zachowanie i reaktywność takich zwi
steczce grupy, które mogą reagować z poszczególnymi odczynnikami,
steczkowo.
, ketokwasy.
ące zarówno grupę hydroksylową jak i karboksylow
W produktach naturalnych są często spotykane w stanie wolnym lub te
np. kwas jabłkowy w jabłkach, kwas winowy w winie.
ą jako produkty pośrednie, np. kwas cytrynowy w
C
H
3
CH
OH
COOH
CH
2
HOOC
kwas mlekowy
kwas jabłkowy
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
N
O
CH
3
tymina
nazywamy wielofunkcyjnymi.
takich związków wpływają
z poszczególnymi odczynnikami,
i karboksylową nazywamy
sto spotykane w stanie wolnym lub też
np. kwas jabłkowy w jabłkach, kwas winowy w winie. W procesach
wy w cyklu Krebsa.
CH
OH
COOH
kwas jabłkowy
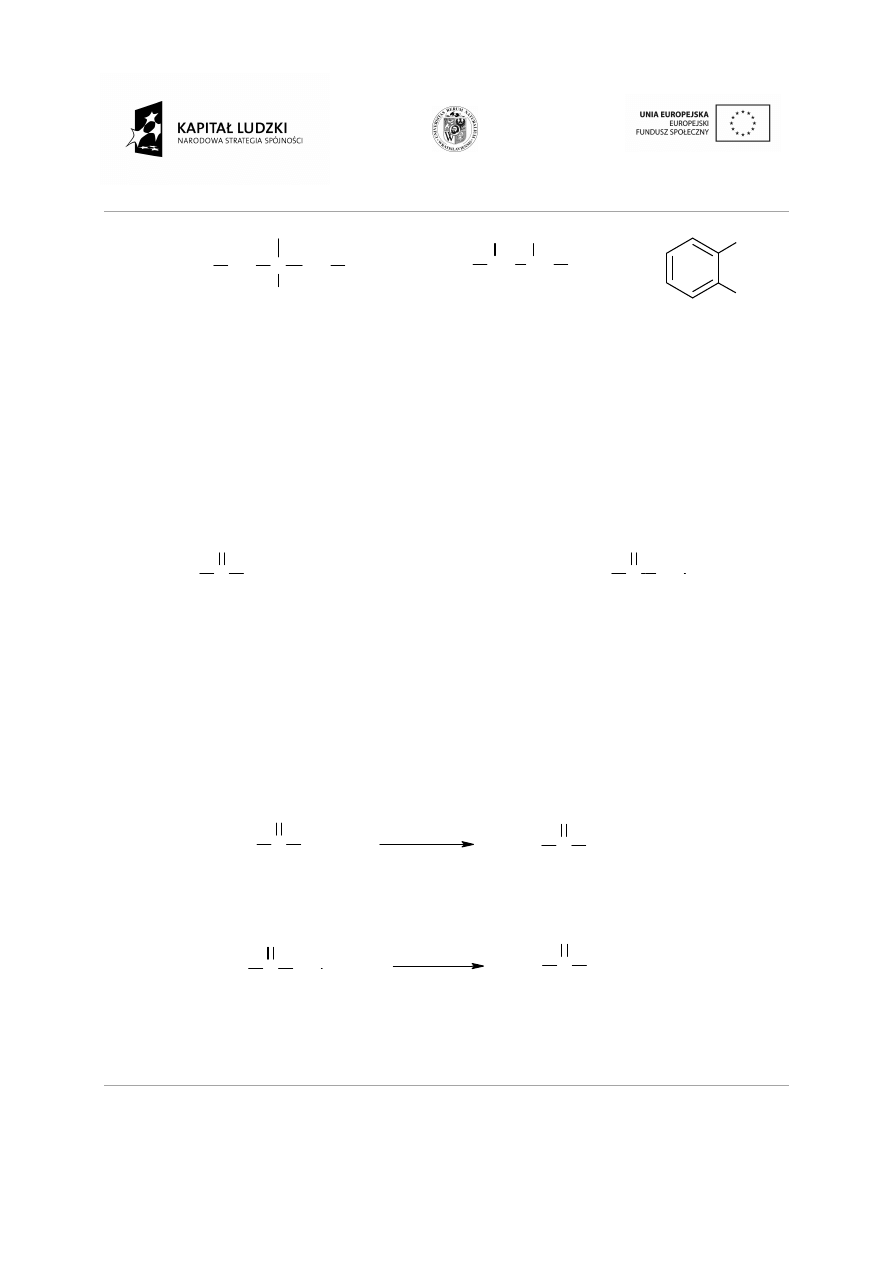
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
CH
2
C
CH
OH
HOOC
COOH
kwas cytrynowy
Cząsteczki hydroksykwasów mog
alkoholami,
mogą
reagowa
wewnatrzczasteczkowej estryfikacji
Najbardziej znane ketokwasy
C
H
3
C
O
COOH
kwas pirogronowy
Ketokwasy posiadają dwa rodzaje grup funkcyjnych
karbonylową. Związki te odgrywaj
Ketokwasy ulegają dekarboksylacji do zwi
Przykład
C
H
3
C
O
CO
kwas pirogronowy
C
H
3
C
CH
2
O
kwas acetylooctowy
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
53
H
2
COOH
H
CH CH
OH OH
COOH
HOOC
kwas winowy
steczki hydroksykwasów mogą tworzyć estry zarówno z kwasami jak i
reagować
miedzy
sobą
dając
poliestry,
lub
te
wewnatrzczasteczkowej estryfikacji – laktony.
ketokwasy to:
C
H
3
C
O
kwas acetylooctowy
Ketokwasy posiadają dwa rodzaje grup funkcyjnych – grupę
zki te odgrywają ważna role w wielu procesach biochemicznych.
dekarboksylacji do związków karbonylowych i dwutlenku w
OOH
C
H
3
C
O
H
kwas pirogronowy
+
aldehyd octowy
2
COOH
C
H
3
C
O
CH
3
kwas acetylooctowy
+
aceton
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
OH
COOH
kwas salicylowy
estry zarówno z kwasami jak i
c
poliestry,
lub
też
przy
CH
2
COOH
kwas acetylooctowy
grupę karboksylową i
na role w wielu procesach biochemicznych.
onylowych i dwutlenku węgla.
+
CO
2
+
CO
2
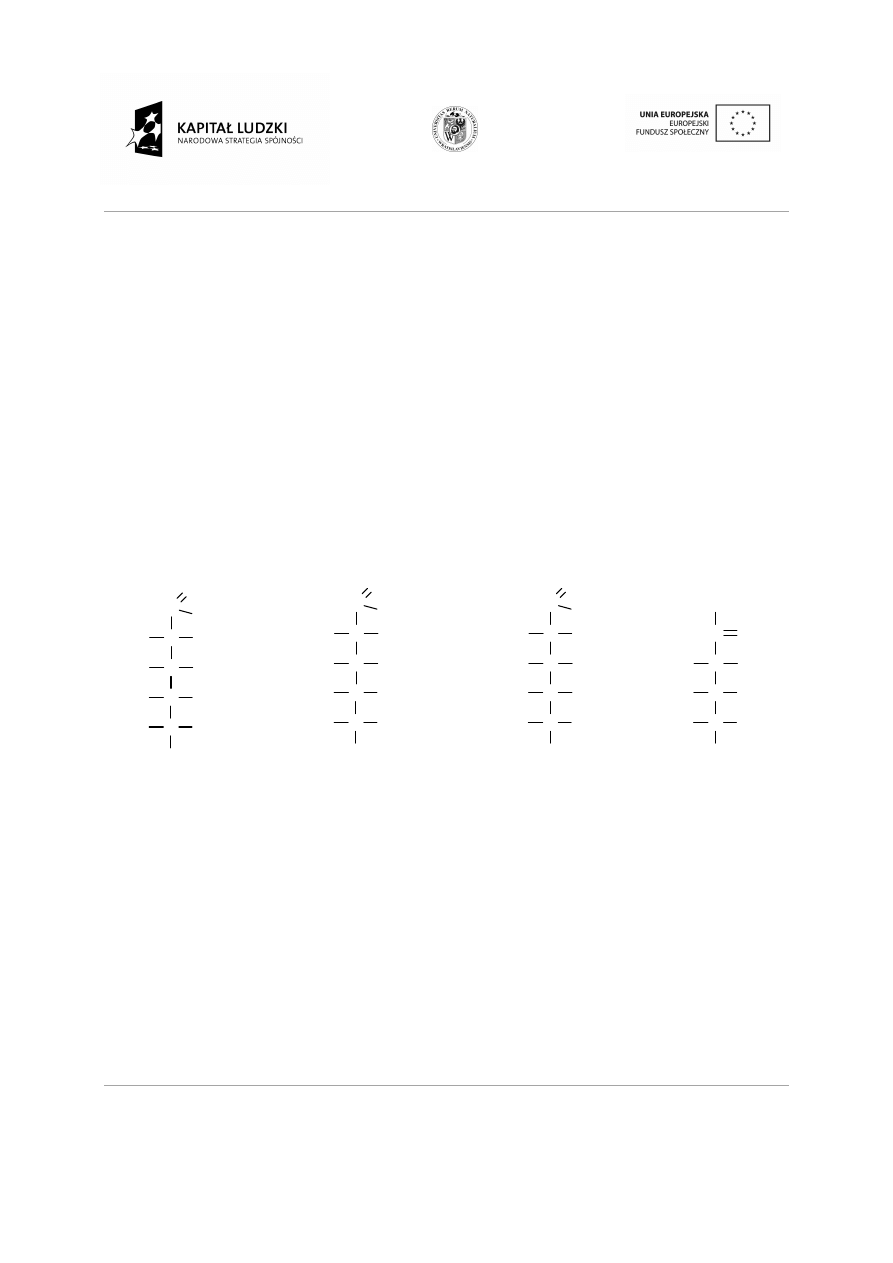
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4.2.2
Węglowodany.
Węglowodany posiadają
karbonylową (aldehydowa lub ketonowa) oraz grup
trzy grupy: monosacharydy (cukry proste), disacharydy (dwucukry) i polisacharydy
(wielocukry). Ponadto w zależ
aldozy. Cząsteczki cukrów prostych zawieraj
stąd podział na triozy (trzy atomy
atomów węgla) i heksozy (sześć
C
C
C
C
OH
H
H
O
H
OH
H
O
H
C
CH
2
OH
OH
H
O
H
O
H
H
H
D-glukoza
Wszystkie cukry (poza dihydroksyacetonem)
węgla. W zależności od konfiguracji na przedostatnim atomie w
do szeregu D lub L. Konfiguracj
przez Fischera – aldehydu glicerynowego.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
54
posiadają w swojej strukturze dwa rodzaje grup funkcyjnych: grup
(aldehydowa lub ketonowa) oraz grupy hydroksylowe. Możemy podzieli
trzy grupy: monosacharydy (cukry proste), disacharydy (dwucukry) i polisacharydy
(wielocukry). Ponadto w zależności od grupy funkcyjnej cukry proste dzielimy na ketozy i
cukrów prostych zawierają zazwyczaj od trzech do sześ
d podział na triozy (trzy atomy węgla), tetrozy (cztery atomy węgla
gla) i heksozy (sześć atomów węgla).
C
C
C
C
H
O
H
O
OH
H
O
H
C
CH
2
OH
OH
H
C
C
C
C
OH
H
H
O
H
H
O
H
O
H
C
CH
2
OH
OH
H
D-mannoza
D-galaktoza
(poza dihydroksyacetonem) mają przynajmniej jeden
ci od konfiguracji na przedostatnim atomie węgla, dany cukier zaliczamy
do szeregu D lub L. Konfigurację związku określa się względem wzorca zaproponowanego
aldehydu glicerynowego.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
grup funkcyjnych: grupę
żemy podzielić je na
trzy grupy: monosacharydy (cukry proste), disacharydy (dwucukry) i polisacharydy
ci od grupy funkcyjnej cukry proste dzielimy na ketozy i
sześciu atomów węgla,
ęgla), pentozy (pięć
CH
2
OH
C
C
C
O
H
O
H
OH
H
C
CH
2
OH
OH
H
D-fruktoza
przynajmniej jeden chiralny atom
gla, dany cukier zaliczamy
dem wzorca zaproponowanego
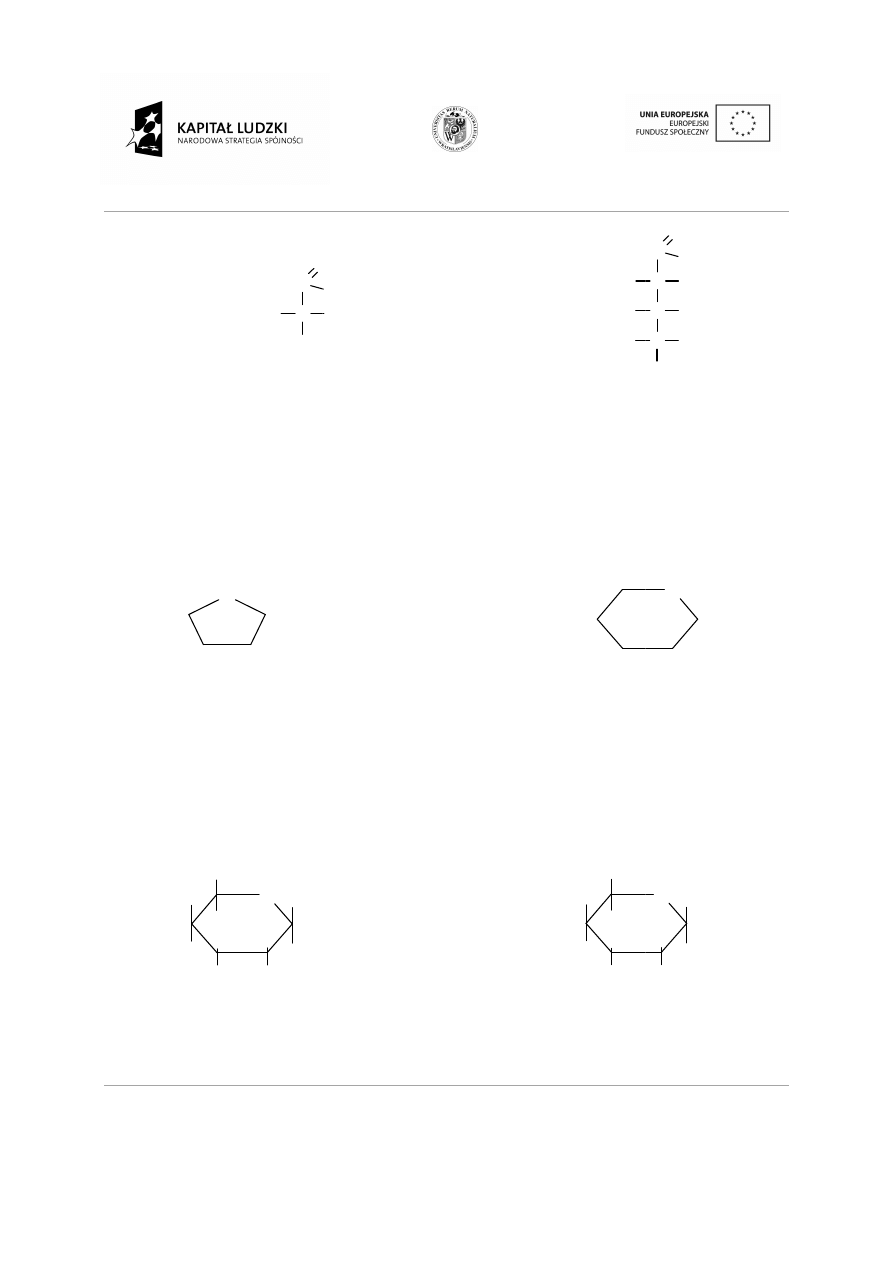
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
C
C
CH
2
H
O
aldehyd D-glicerynowy
Cukry proste mogą wyst
w jednej cząsteczce grupy -
wewnątrzcząsteczkowe wiązanie,
sześcioczłonowe heterocykliczne pier
O
furan
Izomery cukrów różni
nazywamy anomerami. Anomery skr
kąty. W roztworach cukrów nast
z przejściem anomeru α w β (i odwrotnie) poprzez form
O
CH
2
OH
H
H
OH
H
OH
OH
H
OH
H
α−
anomer
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
55
H
H
H
2
OH
OH
O
H
D-ryboza
aldehyd D-glicerynowy
występować w formie łańcuchowej i pierścieniowej. Wyst
aldehydowa lub ketonowa oraz hydroksylowa mog
steczkowe wiązanie, zwane hemiacetalowym. Utworzone pi
cykliczne pierścienie są pochodnymi furanu lub piranu.
piran
żniące się tylko konfiguracja na acetalowym atomie w
omery skręcają płaszczyznę światła spolaryzowanego o odmienne
cukrów następuje zmiana skręcalności cukrów (mutarotacja) zwi
(i odwrotnie) poprzez formę łańcuchową.
CH
2
O
H
H
OH
H
OH
β−
anomer
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
C
C
C
C
CH
2
OH
OH
OH
OH
O
H
D-ryboza
cieniowej. Występujące
aldehydowa lub ketonowa oraz hydroksylowa mogą tworzyć
zwane hemiacetalowym. Utworzone pięcio- lub
piranu.
O
piran
alowym atomie węgla
wiatła spolaryzowanego o odmienne
ci cukrów (mutarotacja) związana
O
OH
OH
H
H
OH
anomer
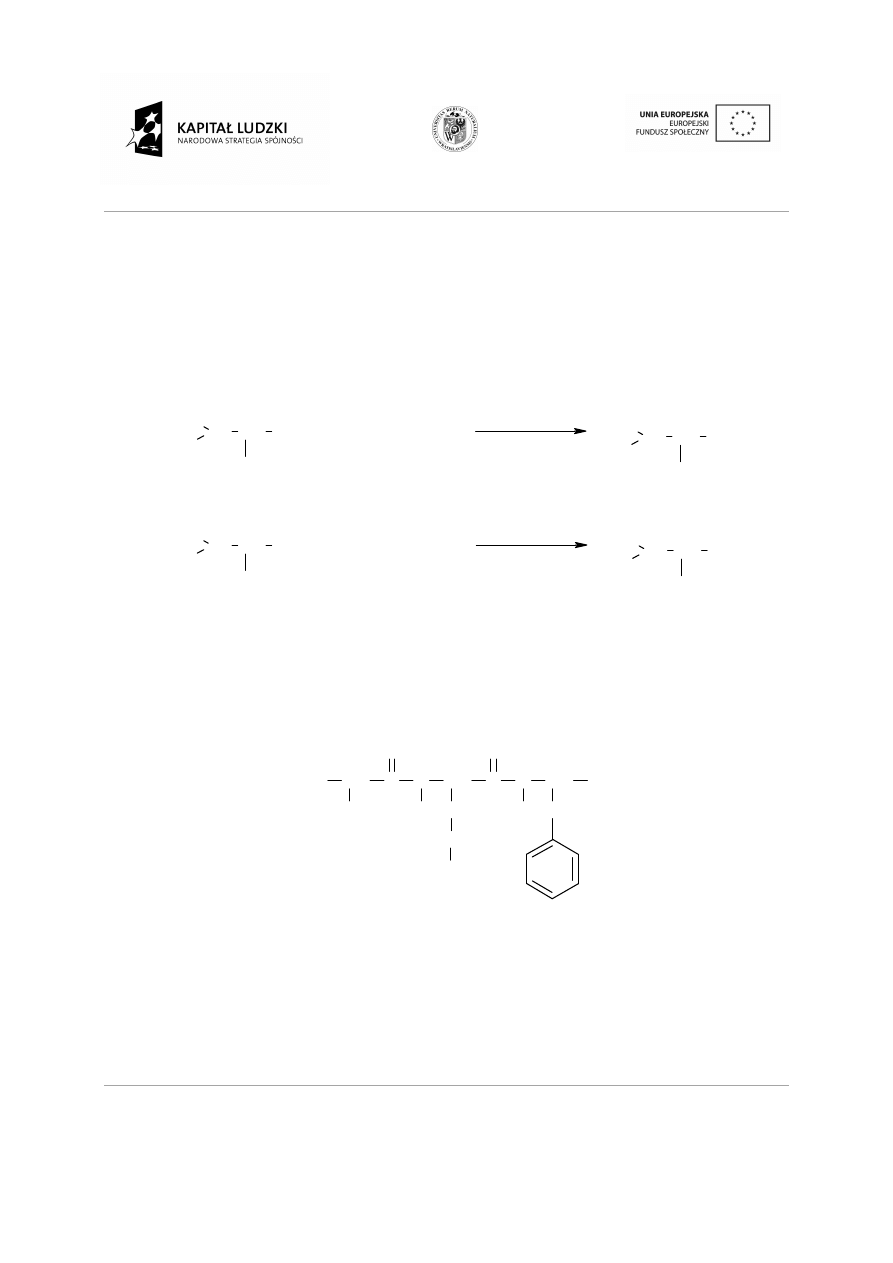
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4.2.3
Aminokwasy i białka.
Aminokwasy należą do zwi
i karboksylową. Obydwie grupy
nich pochodne, np. reagują z kwasami i zasadami.
CH
3
CH
CH
3
CH
NH
2
COOH
CH
3
CH
CH
3
CH
NH
2
COOH
Aminokwasy mogą równie
Powstałe łańcuchy nazywamy peptydami (białkami), które mog
aminokwasowych.
N
H
2
W przyrodzie występuje około 20 aminokwasów
zwyczajowe, a dla każdego aminokwasu obowi
trzyliterowy skrót.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
56
Aminokwasy i białka.
żą do związków dwufunkcyjnych – zawierają
Obydwie grupy, w charakterystycznych dla nich reakcjach
ą z kwasami i zasadami.
H
H
+
CH
3
C
CH
3
+
H
OH
CH
3
C
CH
3
+
_
również reagować ze sobą nawzajem tworząc wią
cuchy nazywamy peptydami (białkami), które mogą składać si
N
CH
C
O
CH
3
N
H
CH
CH
2
CH
2
C
O
N
H
CH
CH
2
COOH
COOH
alanyloglutamylofenyloalanina
Ala-Glu- Phe
ępuje około 20 aminokwasów białkowych. Ich nazwy s
dego aminokwasu obowiązuje również powszechnie stosowany
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ją grupę aminową
w charakterystycznych dla nich reakcjach, dają właściwe dla
CH CH
NH
3
COOH
+
CH CH
NH
2
COO
_
wiązanie peptydowe.
składać się z kilkuset reszt
wych. Ich nazwy są
powszechnie stosowany
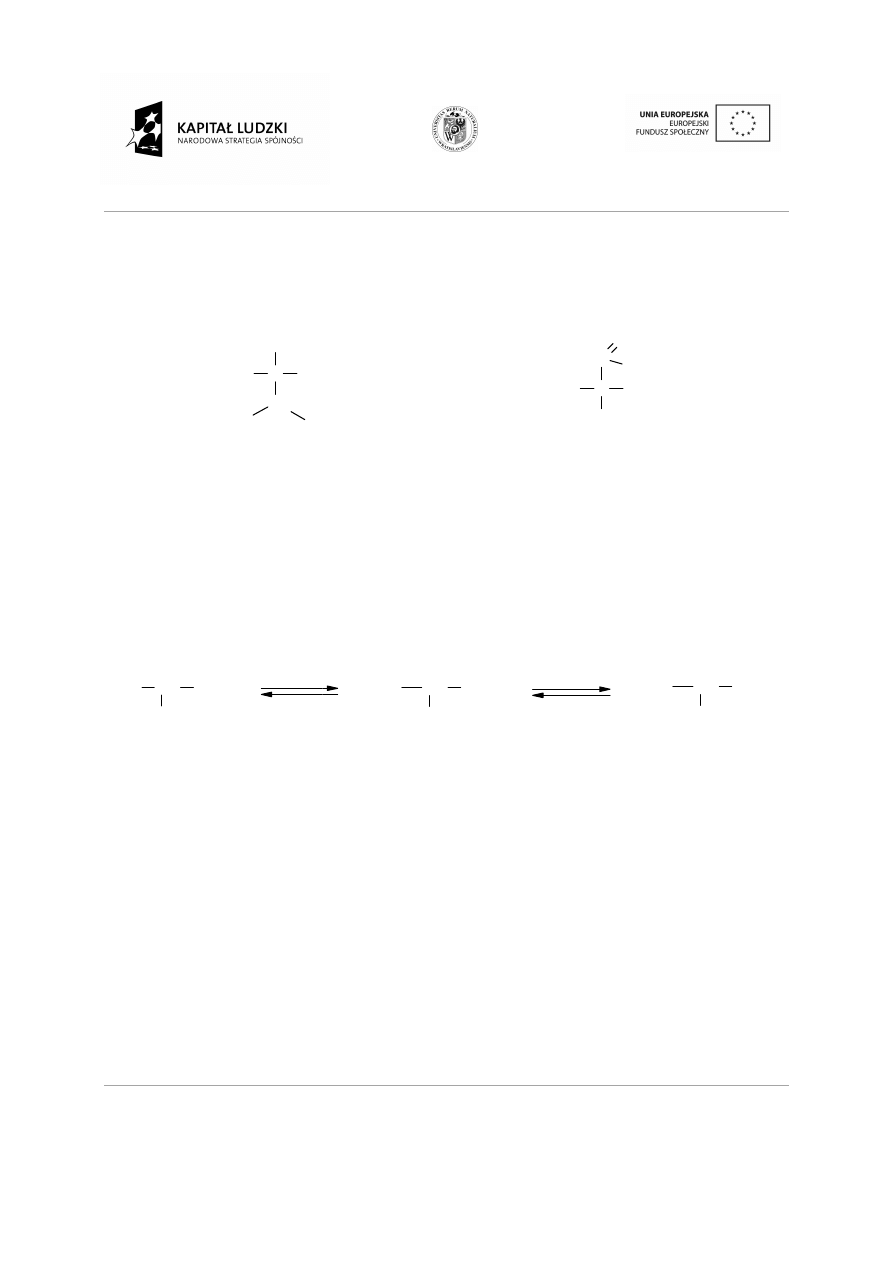
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Większość aminokwasów
(węgiel asymetryczny), jest wię
L zgodnie z konfiguracją aldehydu
C
N
H
2
H
CH
CH
3
CH
COOH
L-walina
Wartość pH roztworu, przy którym aminokwas
obojnaczego nazywamy punktem izoelektrycznym. Tworzenie jonu obojnaczego wynika
z istnienia równowagi miedzy form
N
H
2
CH
COO
R
H
+
+
H
+
_
_
4.3
Zadania.
1. Narysuj lub nazwij nastę
a) metyloamina
b)
n-propyloamina
c) fenyloamina (anilina)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
57
aminokwasów (poza glicyną) ma przynajmniej jedno centrum chi
jest więc optycznie czynna. Naturalne aminokwasy nale
aldehydu glicerynowego.
H
3
C
O
H
H
CH
2
OH
C
O
H
aldehyd L-glicerynowy
roztworu, przy którym aminokwas występuje głównie
nazywamy punktem izoelektrycznym. Tworzenie jonu obojnaczego wynika
miedzy formą kationową i anionową.
NH
3
CH
R
COO
+
H
+
+
H
+
_
+
_
+
1. Narysuj lub nazwij następujące związki:
d) N-metyloetyloamina
e) amid kwasu octowego (acetamid)
f) N-etyloamid kwasu benzoesowego
(N-metylobenzamid)
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
przynajmniej jedno centrum chiralności
. Naturalne aminokwasy należą do szeregu
H
aldehyd L-glicerynowy
głównie w formie jonu
nazywamy punktem izoelektrycznym. Tworzenie jonu obojnaczego wynika
NH
3
CH
R
COOH
+
metyloetyloamina
e) amid kwasu octowego (acetamid)
etyloamid kwasu benzoesowego
metylobenzamid)
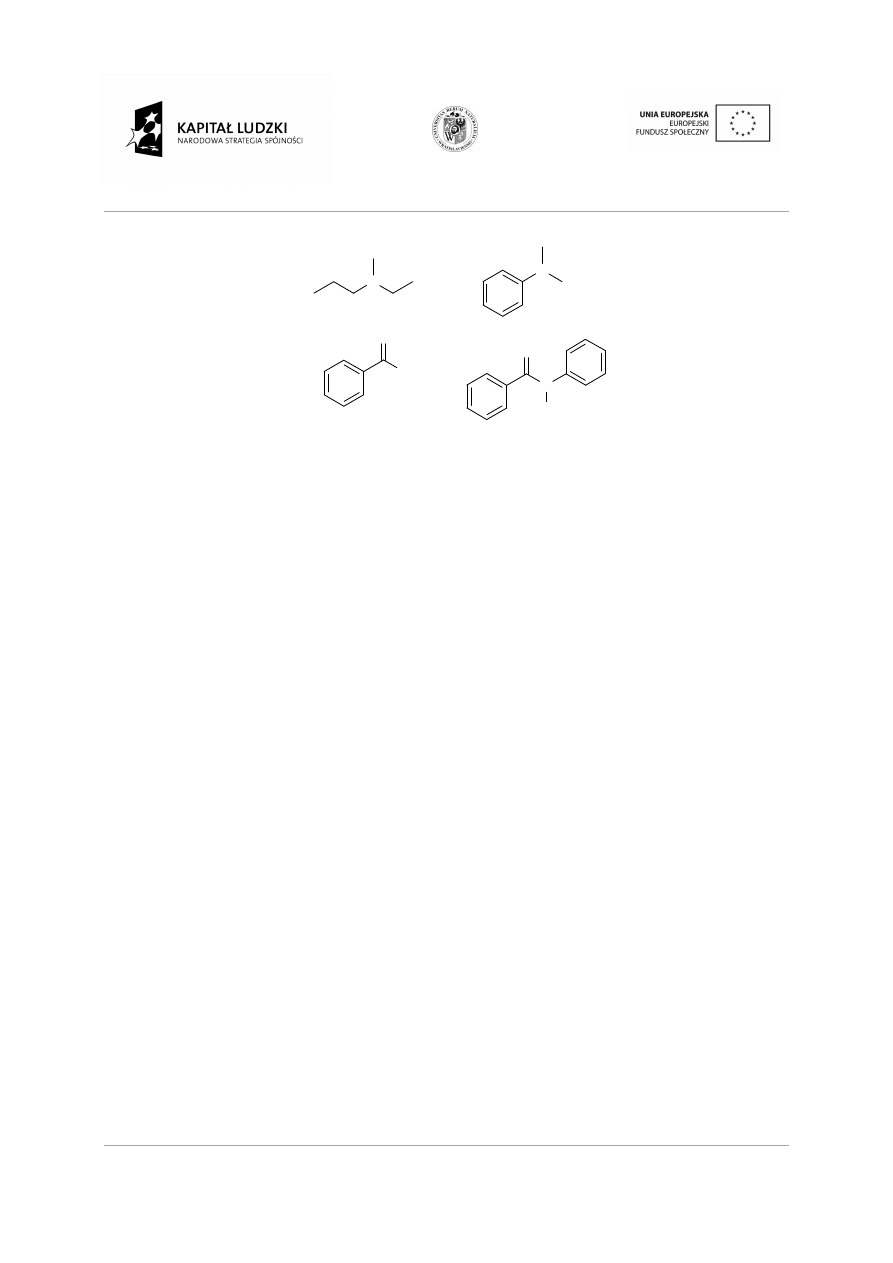
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
g)
i)
2. Napisz reakcje dysocjacji metyloaminy oraz aniliny i na ich podstawie okre
właściwości kwasowo-
3. Na trzech dowolnych przykładach napisz reakcje otrzymywania amin z odpowiednich
halogenków alkilowych oraz z odpowiednich nitrozwi
4. Jakie produkty powstaną
a) z kwasem solnym
b) z kwasem octowym podczas ogrzewania ?
5. Napisz reakcję hydrolizy N
6. Narysuj wzory i nazwij nast
a) aminokwasy alifatyczne
b) aminokwasy z pierścieniem aromatycznym
c) aminokwas z dodatkow
d) aminokwasy z grupą
e) aminokwasy siarkowe
7. Na przykładzie waliny napisz w
uzasadniające amfoteryczny charakter aminokwasów. Wska
punkt izoelektryczny. Wska
i pH=2.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
N
O
N
H
O
NH
2
N
h)
j)
Napisz reakcje dysocjacji metyloaminy oraz aniliny i na ich podstawie okre
-zasadowe amin.
Na trzech dowolnych przykładach napisz reakcje otrzymywania amin z odpowiednich
wych oraz z odpowiednich nitrozwiązków.
Jakie produkty powstaną w wyniku reakcji metyloaminy:
b) z kwasem octowym podczas ogrzewania ?
hydrolizy N-etyloacetamidu w środowisku kwaśnym i zasadowym.
y i nazwij następujące aminokwasy budujące białka:
a) aminokwasy alifatyczne
b) aminokwasy z pierścieniem aromatycznym
c) aminokwas z dodatkową grupą aminową
d) aminokwasy z grupą hydroksylową
e) aminokwasy siarkowe
Na przykładzie waliny napisz w zapisie cząsteczkowym i jonowym reakcje
ce amfoteryczny charakter aminokwasów. Wskaż jon obojnaczy; zdefiniuj
punkt izoelektryczny. Wskaż formę, w której aminokwas ten wystę
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Napisz reakcje dysocjacji metyloaminy oraz aniliny i na ich podstawie określ
Na trzech dowolnych przykładach napisz reakcje otrzymywania amin z odpowiednich
nym i zasadowym.
steczkowym i jonowym reakcje
jon obojnaczy; zdefiniuj
n występuje przy pH=11

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
8. Napisz reakcję kondensacji cysteiny z seryn
Cys-Ser. W otrzymanym produkcie wska
N-końcowy i C-końcowy.
8. Poniżej przedstawiono wzór glutationu
komórkach. Napisz reakcj
C
N
H
2
C
9. Co decyduje o przynale
aminokwasów budują białka?
10. Jakie produkty powstaną
a) HCl
b) KOH
c) alkoholem etylowym w
d) kwasem benzoesowym w
11. Narysuj wzory łańcuchowe Fischera: aldehydu D
D-glukozy, D-fruktozy i D
12. Narysuj wzory pierścieniowe Hawortha:
β-D-rybopiranozy,
sacharozy.
W
cz
charakterystyczne dla dwu
13. Napisz reakcję, za pomoc
efekt wizualny; o jakich wła
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
59
kondensacji cysteiny z seryną prowadzącą do powstania dipeptydu
Ser. W otrzymanym produkcie wskaż wiązanie peptydowe oraz aminokwas
ńcowy.
ej przedstawiono wzór glutationu – tripeptydu występują
komórkach. Napisz reakcję hydrolizy tego związku w środowisku kwa
C
O
NH
CH
2
COOH
CH CH
2
COOH
CH
2
C
O
NH CH
CH
2
SH
9. Co decyduje o przynależności aminokwasów do szeregu D lub L? Które z tych
ą białka?
10. Jakie produkty powstaną w wyniku reakcji treoniny z:
c) alkoholem etylowym w środowisku kwaśnym
d) kwasem benzoesowym w środowisku kwaśnym
ńcuchowe Fischera: aldehydu D-glicerynowego, D
fruktozy i D-galaktozy oraz ich formy L.
12. Narysuj wzory pierścieniowe Hawortha: α-D-glukopiranozy, β
rybopiranozy,
sacharozy.
W
cząsteczce
sacharozy
wska
charakterystyczne dla dwu- i polisacharydów wiązanie.
, za pomocą której możesz odróżnić α-D-maltozę od sacharozy. Podaj
efekt wizualny; o jakich właściwościach świadczy pozytywny wynik tej reakcji?
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
do powstania dipeptydu
zanie peptydowe oraz aminokwas
ępującego w żywych
rodowisku kwaśnym.
ci aminokwasów do szeregu D lub L? Które z tych
glicerynowego, D-rybozy,
glukopiranozy, β-D-fruktofuranozy,
steczce
sacharozy
wskaż
i
nazwij
ę od sacharozy. Podaj
wiadczy pozytywny wynik tej reakcji?

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
14. Na przykładzie glukozy narysuj przemian
towarzyszy tej przemianie? Która z postaci glukozy wykazuje wła
redukujące?
15. Napisz reakcję α-D-glukopiranozy z metanolem w
tej reakcji posiada wła
uzasadnij.
16. Narysuj fragment cząsteczki skrobi i celulozy. Wska
tych polisacharydów wią
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
60
14. Na przykładzie glukozy narysuj przemianę zwaną mutarotacją
towarzyszy tej przemianie? Która z postaci glukozy wykazuje wła
glukopiranozy z metanolem w środowisku kwaś
tej reakcji posiada właściwości redukujące? Czy ulega mutarotacji? Odpowied
ąsteczki skrobi i celulozy. Wskaż i nazwij charakterystyczne dla
tych polisacharydów wiązania.
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
mutarotacją. Jakie zjawisko
towarzyszy tej przemianie? Która z postaci glukozy wykazuje właściwości
dowisku kwaśnym. Czy produkt
ce? Czy ulega mutarotacji? Odpowiedź
i nazwij charakterystyczne dla
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
5
Ć
wiczenie 5.
5.1
Typy reakcji organicznych.
Reakcja podstawienia (substytucji):
pierwiastka połączonego z atomem w
pierwiastek.
Przykład:
Substytucja wolnorodnikowa:
udziale wolnych rodników.
Substytucja nukleofilowa:
nukleofilowy.
CH
3
CH
2
CH
2
CH
2
Cl
Substytucja elektrofilowa:
elektrofilowy.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
61
Typy reakcji organicznych.
podstawienia (substytucji): następuje zastąpienie jednej grupy lub
czonego z atomem węgla wiązaniem pojedynczym przez inna grup
Substytucja wolnorodnikowa: podstawienie atomu wodoru lub innego atomu
Cl
Cl
2,
h
ν
+
Substytucja nukleofilowa: podstawienie atomu lub grupy atomów przez czynnik
CH
3
CH
2
CH
2
CH
2
KOH
H
2
O
Substytucja elektrofilowa: podstawienie atomu lub grupy atomów przez czynnik
HNO
3
, H
2
SO
4
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
pienie jednej grupy lub
zaniem pojedynczym przez inna grupę lub
mu wodoru lub innego atomu przy
HCl
podstawienie atomu lub grupy atomów przez czynnik
OH
podstawienie atomu lub grupy atomów przez czynnik
NO
2
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Nukleofil to atom lub grupa atomów posiadaj
Elektrofil to atom lub grupa atomów z deficytem elektronów.
Reakcja przyłączenia (addycji):
podwójnego z równoczesnym rozerwaniem go i utworzeniem dwóch nowych wi
pojedynczych.
Przykład:
Addycja elektrofilowa:
C
H
2
CH
Reakcja eliminacji: nastę
podwójnego między atomami w
C
H
3
C
CH
3
OH
Reakcja przegrupowania:
w inne miejsce cząsteczki tworz
CH
3
C
CH
3
CH
3
C
O
Reakcja polimeryzacji:
nietrwałego pierścienia zwią
otrzymania produktu wielkoczą
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
62
to atom lub grupa atomów posiadająca wolną parę elektronów.
to atom lub grupa atomów z deficytem elektronów.
czenia (addycji): przyłączenie dwóch podstawników do wi
podwójnego z równoczesnym rozerwaniem go i utworzeniem dwóch nowych wi
Addycja elektrofilowa:
CH
3
C
H
3
CH
Br
HBr
następuje odczepienie dwóch podstawników i utw
dzy atomami węgla.
CH
3
3
C
H
3
C
CH
H
+
- H
2
O
przegrupowania: przemieszczenie grupy atomów lub pojedynczego atomu
steczki tworząc izomeryczny produkt.
H
+
CH
OH
CH
3
C
C
C
H
3
C
H
3
- H
2
O
polimeryzacji: w reakcji następuje rozerwanie wiązań
cienia związku małocząsteczkowego (monomery), które prowadzi
otrzymania produktu wielkocząsteczkowego (polimeru).
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
elektronów.
czenie dwóch podstawników do wiązania
podwójnego z równoczesnym rozerwaniem go i utworzeniem dwóch nowych wiązań
H
CH
3
puje odczepienie dwóch podstawników i utworzenie wiązania
CH
2
H
3
przemieszczenie grupy atomów lub pojedynczego atomu
CH
3
CH
3
ązań podwójnych lub
które prowadzi do

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
5.2
Zadania.
1.
Napisz po jednym przykładzie reakcji:
a) substytucji
b) eliminacji
c) addycji
2. Zapisz równania reakcji przedstawionych na schemacie. Okre
CaC
2
H
2
O
A
H
2
Ni
a)
b)
1-chloropropan
KOH/H
2
O
c)
etan
Cl
2
, hv
A
NaOH/C
3. Napisz reakcje:
a) 1,2-dichloropropanu z
b) kwasu butanowego z etanolem w
c) bromowania toluenu w obecno
Które z powyższych reakcji przedstawiaj
4. Otrzymaj aceton z propanolu w 5
redukcji, eliminacji, addycji, substytucji i utlenienia. Zapisz wszystkie reakcje i wzory
produktów pośrednich.
5. Podaj nazwę poniższej reakcji:
C
n
H
2n+2
+ Br
2
hv
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
63
Napisz po jednym przykładzie reakcji:
d) redukcji
f) utlenienia
g) hydrolizy
Zapisz równania reakcji przedstawionych na schemacie. Określ typ ka
B
Cl
2
C
Zn
D
O
A
B
Al
2
O
3
polimeryzacja
C
NaOH/C
2
H
5
OH
B
C
H
2
O
dichloropropanu z cynkiem
b) kwasu butanowego z etanolem w środowisku kwaśnym
c) bromowania toluenu w obecności FeBr
3
reakcji przedstawiają reakcję substytucji a które eliminacji?
Otrzymaj aceton z propanolu w 5-etapowej syntezie dokonując kolejno re
redukcji, eliminacji, addycji, substytucji i utlenienia. Zapisz wszystkie reakcje i wzory
rednich.
ższej reakcji:
C
n
H
2n+1
Br + HBr
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
l typ każdej reakcji.
substytucji a które eliminacji?
c kolejno reakcji:
redukcji, eliminacji, addycji, substytucji i utlenienia. Zapisz wszystkie reakcje i wzory

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
6. Podaj po dwa przykłady reakcji zoboj
organicznej.
7. Podaj dwa różne przykłady reakcji substytucji i eliminacji w chemii organicznej.
8. Podaj przykłady, w których cz
a) addycji elektrofilowej
b) substytucji elektrofilowej
c) substytucji wolnorodnikowej
9. Napisz reakcje, w których toluen ulega:
a) substytucji wolnorodnikowej
b) substytucji elektrofilowej
c) addycji
10. Napisz reakcje i określ typ tych reakcji:
a) nitrowania benzenu
b) dehydratacji butan-2
c) 1-jodopropanu z KOH w etanolu
d) wody ze styrenem (winylobenzenem) w
11. Napisz reakcje hydrolizy:
a) tripalmitynianu gliceryny w
b) laktozy
c) dowolnego dipeptydu
12. Uzupełnij schemat; wska
A
Br
2
B
Na
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
64
Podaj po dwa przykłady reakcji zobojętniania oraz reakcji polimeryzacji w ch
ne przykłady reakcji substytucji i eliminacji w chemii organicznej.
Podaj przykłady, w których cząsteczka chloru bierze udział w reakcjach:
b) substytucji elektrofilowej
wolnorodnikowej
Napisz reakcje, w których toluen ulega:
a) substytucji wolnorodnikowej
b) substytucji elektrofilowej
śl typ tych reakcji:
2-olu w środowisku kwaśnym
jodopropanu z KOH w etanolu
d) wody ze styrenem (winylobenzenem) w środowisku kwaśnym
Napisz reakcje hydrolizy:
a) tripalmitynianu gliceryny w środowisku kwaśnym
c) dowolnego dipeptydu
12. Uzupełnij schemat; wskaż reakcję substytucji nukleofilowej i wolnorodnikowej.
C
Cl
2
, hv
D
KOH/H
2
O
heksan-1-ol
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
tniania oraz reakcji polimeryzacji w chemii
ne przykłady reakcji substytucji i eliminacji w chemii organicznej.
steczka chloru bierze udział w reakcjach:
ji nukleofilowej i wolnorodnikowej.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
13. Po uzupełnieniu schematu wska
propionian sodu
NaOH
ogrzewanie
14. Podaj przykład reakcji utlenienia:
a) alkenu
b) aldehydu
c) alkoholu
15. Uzupełnij schemat, wska
organicznej.
A
HBr
H
2
O
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
65
13. Po uzupełnieniu schematu wskaż reakcję dekarboksylacji oraz addycji elektrofilowej.
ogrzewanie
A
Br
2
, hv
B
KOH/EtOH
C
H
2
O
Podaj przykład reakcji utlenienia:
Uzupełnij schemat, wskaż reakcję będącą przykładem reakcji kondensacji w chemii
B
C
CH
3
CH
2
OH
D
E
H
+
K
2
Cr
2
O
7
Cu
2+
OH -
kszenia liczby absolwentów kierunków
gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
dekarboksylacji oraz addycji elektrofilowej.
D
przykładem reakcji kondensacji w chemii
F
Wyszukiwarka
Podobne podstrony:
WWW Kurs wyrównawczy z chemii nieorganicznej biotechnologia
WWW Kurs wyrównawczy z chemii nieorganicznej ochrona środowiska
Zwięzły kurs chemii organicznej tom I
Zwięzły kurs chemii organicznej tom II
Zwięzły kurs chemii organicznej tom II
Zwięzły kurs chemii organicznej tom I
PROGRAM CWICZEN Z CHEMII ORGANICZNEJ BIOLOGIA 2010 2011
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
aminy otrzymywanie, podstawy chemii organicznej
11 Podstawy chemii organicznej Profesor Boduszek
Wprowadzenie do chemii organicznej
POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ
ROZKŁAD MATERIAŁU Z CHEMII ORGANICZNEJ
Pytanaia z chemii organicznej 13
więcej podobnych podstron