
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Wanda Mączka
Katarzyna Wińska
Kurs wyrównawczy z
chemii nieorganicznej
Skrypt dla studentów kierunku Ochrona Środowiska.
Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
Kurs wyrównawczy z
chemii nieorganicznej
Skrypt dla studentów kierunku Ochrona Środowiska.
Wrocław 2009
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Kurs wyrównawczy z
chemii nieorganicznej

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Spis treści
Ć
wiczenie 1. ................................
1.1
Podstawowe pojęcia chemiczne.
1.2
Rodzaje związków w chemii nieorganicznej.
1.2.1
Wodorki. ................................
1.2.2
Tlenki. ................................
1.2.3
Wodorotlenki. ................................
1.2.4
Kwasy. ................................
1.2.5
Sole. ................................
1.3
Zadania do rozwiązania na
Ć
wiczenie 2. Stechiometria ................................
2.1
Podstawowe pojęcia. ................................
2.2
Mol, masa molowa, liczno
2.3
Objętość molowa ................................
2.4
Obliczenia stechiometryczne
2.5
Zadania do rozwiązania na
Ć
wiczenie 3. Równania reakcji chemicznych
3.1
Reakcje łączenia. ................................
3.2
Reakcje rozkładu. ................................
3.3
Reakcje wymiany. ................................
3.3.1
Reakcje wymiany pojedynczej:
3.3.2
Reakcje wymiany podwójnej:
3.4
Reakcje utleniania i redukcji.
3.5
Zadania do rozwiązania na
Ć
wiczenie 4. Chemia roztworów wodnych
4.1
Reakcje dysocjacji elektrolitycznej.
4.1.1
Reakcje dysocjacji elektrolitycznej kwasów
4.1.2
Reakcje dysocjacji elektrolitycznej zasad
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
2
................................................................................................................................
cia chemiczne. ................................................................
zków w chemii nieorganicznej. ................................................................
................................................................................................
................................................................................................
................................................................................................
................................................................................................
...............................................................................................................................
zania na ćwiczeniach: ................................................................
................................................................................................
................................................................................................
Mol, masa molowa, liczność. ................................................................................................
................................................................................................
ia stechiometryczne ................................................................................................
zania na ćwiczeniach ................................................................
Równania reakcji chemicznych ................................................................
................................................................................................
................................................................................................
................................................................................................
Reakcje wymiany pojedynczej: ................................................................
Reakcje wymiany podwójnej: ................................................................
Reakcje utleniania i redukcji. ................................................................................................
zania na ćwiczeniach. ................................................................
Chemia roztworów wodnych ................................................................
Reakcje dysocjacji elektrolitycznej. ................................................................
Reakcje dysocjacji elektrolitycznej kwasów ................................................................
Reakcje dysocjacji elektrolitycznej zasad ................................................................
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
............................................ 4
............................................................. 4
.......................................... 8
.......................................................... 8
.............................................................. 9
................................................ 10
........................................................... 11
............................... 12
.............................................. 13
................................................... 15
............................................. 15
................................ 16
................................................... 18
................................. 18
............................................... 20
........................................................ 23
................................................... 23
.................................................. 25
................................................. 25
...................................................... 26
........................................................ 26
................................ 27
.............................................. 31
........................................................... 34
...................................................... 34
................................. 35
..................................... 35

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4.1.3
Reakcje dysocjacji elektrolitycznej soli
4.2
Reakcje zobojętniania.
4.3
Reakcje hydrolizy. ................................
4.3.1
Reakcje hydrolizy soli pochodz
4.3.2
Reakcje hydrolizy soli pochodz
4.3.3
Reakcje hydrolizy soli pochodz
4.4
Reakcje otrzymywania słabych elektrolitów.
4.5
Reakcje utleniania i redukcji.
4.6
Zadania do rozwiązania na
Ć
wiczenie 5. Podstawy obliczeń chemicznych
5.1
Rozpuszczalność. ................................
5.2
Stężenie procentowe roztworu.
5.3
Stężenie molowe roztworu.
5.4
Przeliczanie stężeń. ................................
5.5
Rozcieńczanie lub zatęż
5.6
pH roztworu. ................................
5.7
Zadania do rozwiązania na
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
3
Reakcje dysocjacji elektrolitycznej soli ................................................................
................................................................................................
................................................................................................
Reakcje hydrolizy soli pochodzących od słabych kwasów i mocnych zasad
Reakcje hydrolizy soli pochodzących od słabych zasad i mocnych kwasów
Reakcje hydrolizy soli pochodzących od słabych kwasów i słabych zasad
Reakcje otrzymywania słabych elektrolitów. ................................................................
Reakcje utleniania i redukcji. ................................................................................................
zania na ćwiczeniach. ................................................................
Podstawy obliczeń chemicznych ................................................................
................................................................................................
enie procentowe roztworu. ................................................................
enie molowe roztworu. ................................................................................................
................................................................................................
czanie lub zatężanie roztworu. ................................................................
................................................................................................
zania na ćwiczeniach. ................................................................
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
........................................ 36
........................................... 36
................................................. 37
cych od słabych kwasów i mocnych zasad................ 37
cych od słabych zasad i mocnych kwasów................ 38
cych od słabych kwasów i słabych zasad .................. 39
........................................ 40
................................ 41
.............................................. 43
..................................................... 45
.................................................. 45
............................................................. 46
................................... 47
............................................... 48
................................................. 50
.......................................................... 51
.............................................. 53

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Ć
wiczenie 1.
1.1
Podstawowe pojęcia chemiczne.
Chemia jest to nauka przyrodnicza zajmuj
właściwości, składu i budowy substancji oraz ich przemianami i
na te przemiany. Innymi słowami mo
nowych substancji o ciekawych wła
początek chemii uważa się rok 1661. W tym roku ukazała si
Sceptyk”, w której została zaproponowana nowoczesna definicja pierwiastka.
Współczesna chemia jest dziedzin
4 główne działy:
•
Chemia analityczna
substancji;
•
Chemia fizyczna – zajmuje si
materii;
•
Chemia organiczna –
•
Chemia nieorganiczna
około 100 pierwiastków.
Pierwiastek chemiczny
posiadających jednakową liczbę
Pierwiastki chemiczne mo
połysk, kowalność, ciągliwość
przeważającą większość pierwiastków. S
cynk, cyna, srebro czy złoto. Niemetale
i źle przewodzą ciepło i prąd elektryczny. Jest ich znacznie mniej ni
chlor, brom, jod, tlen, siarka, selen, azot, fosfor, w
Związki chemiczne to substancje zło
pierwiastków chemicznych w ś
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
4
ę
cia chemiczne.
jest to nauka przyrodnicza zajmująca się otrzymywaniem, badaniem
ci, składu i budowy substancji oraz ich przemianami i czynnikami wpływaj
na te przemiany. Innymi słowami można powiedzieć, że chemicy zajmują si
nowych substancji o ciekawych właściwościach, często użytecznych dla człowieka.
ę
rok 1661. W tym roku ukazała się praca Roberta Boyle’a „Chemik
Sceptyk”, w której została zaproponowana nowoczesna definicja pierwiastka.
Współczesna chemia jest dziedziną bardzo rozległą. Zasadniczo moż
– zajmuje się technikami wykrywania i oznaczania składu
zajmuje się ogólnymi prawami, które rządzą
koncentruje się wyłącznie na związkach węgla;
Chemia nieorganiczna – zajmuje się związkami wszystkich znanych do tej pory
około 100 pierwiastków.
Pierwiastek chemiczny to substancja prosta, która składa się wył
liczbę protonów w jądrze.
Pierwiastki chemiczne można podzielić na metale i niemetale.
gliwość i b. dobre przewodnictwo cieplne i elektryczne. Stanowi
pierwiastków. Są to np. sód, potas, wapń, magnez,
Niemetale w odróżnieniu od metali nie mają połysku, s
ą
d elektryczny. Jest ich znacznie mniej niż metali. S
chlor, brom, jod, tlen, siarka, selen, azot, fosfor, węgiel czy krzem.
to substancje złożone, które składają się z dwu lub wi
pierwiastków chemicznych w ściśle określonej, stałej proporcji.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
otrzymywaniem, badaniem
czynnikami wpływającymi
e chemicy zajmują się otrzymywaniem
ytecznych dla człowieka. Za
ca Roberta Boyle’a „Chemik
Sceptyk”, w której została zaproponowana nowoczesna definicja pierwiastka.
. Zasadniczo można ją podzielić na
a i oznaczania składu
ą
dzą zachowaniem się
ę
gla;
zkami wszystkich znanych do tej pory
ę
wyłącznie z atomów
e i niemetale. Metale wykazują
elektryczne. Stanowią
, magnez, żelazo, miedź,
niu od metali nie mają połysku, są kruche
metali. Są to np. fluor,
ę
z dwu lub więcej

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
W celu sprawnego przekazywania informacji chemicznych wprowadzono umowny
system znakowania chemicznego. Pierwiastki oznacza si
związki chemiczne stanowią zestawy symboli pierwiastków, z których dany zwi
składa, w określonej kolejności i proporcji. Otrzymany w ten sposób zestaw symboli to
chemiczny, np. wzór HCl jest wzorem zwi
chlorowodorem. Wzór ten dodatkowo informuje,
z jednego atomu chloru i jednego atomu wodoru.
samego pierwiastka, to ich liczb
indeksem stechiometrycznym
wzór Al
2
O
3
a zatem składa się z dwóch atomów glinu i trzech atomów tlenu.
Niektóre pierwiastki chemiczne wyst
Wzór takiej cząsteczki składa si
określającego liczbę atomów w cz
trójatomowa cząsteczka tlenu zwana ozonem.
Są dwa główne rodzaje wzorów chemicznych: wzory su
strukturalne. Wzory sumaryczne
chemicznego, ale nie określaj
strukturalne informują nas o składzie jako
połączenia pierwiastków w danym zwi
Wiązanie chemiczne
cząsteczkę. Wiązanie chemiczne
cząsteczkę. Liczba wiązań chemic
wartościowość. Należy jednak o tym pami
wartościowość w zależności od pierwiastka, z którym tworz
w zależności od warunków, w jakich
siarka w siarkowodorze (H
2
S) jest dwuwarto
tworzyć dwa związki chemiczne:
Dwutlenek siarki (SO
2
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
5
W celu sprawnego przekazywania informacji chemicznych wprowadzono umowny
system znakowania chemicznego. Pierwiastki oznacza się indywidualnymi
i chemiczne stanowią zestawy symboli pierwiastków, z których dany zwi
lonej kolejności i proporcji. Otrzymany w ten sposób zestaw symboli to
p. wzór HCl jest wzorem związku chemicznego wodoru z chlorem zwanym
odorem. Wzór ten dodatkowo informuje, że cząsteczka tego związku zbudowana jest
z jednego atomu chloru i jednego atomu wodoru. Jeżeli cząsteczka zawiera kilka atomów tego
samego pierwiastka, to ich liczbę zaznacza się w postaci prawego dolnego indeksu
indeksem stechiometrycznym. Liczby jeden nie podaje się, np. cząsteczka tlenku glinu ma
a zatem składa się z dwóch atomów glinu i trzech atomów tlenu.
Niektóre pierwiastki chemiczne występują w postaci kilkuatomowych cz
steczki składa się z symbolu pierwiastka i indeksu stechiometrycznego,
atomów w cząsteczce, np. O
2
to dwuatomowa cząsteczka tlenu
steczka tlenu zwana ozonem.
dwa główne rodzaje wzorów chemicznych: wzory sumaryczne i wzory
Wzory sumaryczne określają jakościowy i ilościowy skład danego zwi
ś
lają sposobu i kolejności połączeń między atomami.
nas o składzie jakościowym i ilościowym oraz dod
czenia pierwiastków w danym związku chemicznym.
to sposób wzajemnego oddziaływania atomów tworz
zanie chemiczne stanowi, więc połączenie między atomami tworz
ą
zań chemicznych jakie tworzy dany pierwiastek to jego
y jednak o tym pamiętać, że pierwiastki mogą
ś
ci od pierwiastka, z którym tworzą dany związek chemiczny lub
warunków, w jakich zostanie przeprowadzona dana reakcja chemiczna, n
S) jest dwuwartościowa. Ten sam pierwiastek z
zki chemiczne:
2
), gdzie siarka jest czterowartościowa
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
W celu sprawnego przekazywania informacji chemicznych wprowadzono umowny
indywidualnymi symbolami, a
zestawy symboli pierwiastków, z których dany związek się
ci i proporcji. Otrzymany w ten sposób zestaw symboli to wzór
zku chemicznego wodoru z chlorem zwanym
steczka tego związku zbudowana jest
steczka zawiera kilka atomów tego
prawego dolnego indeksu zwanego
steczka tlenku glinu ma
z dwóch atomów glinu i trzech atomów tlenu.
w postaci kilkuatomowych cząsteczek.
z symbolu pierwiastka i indeksu stechiometrycznego,
ą
steczka tlenu, a O
3
to
maryczne i wzory
ciowy skład danego związku
ę
dzy atomami. Wzory
ciowym oraz dodatkowo o sposobie
to sposób wzajemnego oddziaływania atomów tworzących
dzy atomami tworzącymi
znych jakie tworzy dany pierwiastek to jego
e pierwiastki mogą zmieniać swoją
dany związek chemiczny lub
owadzona dana reakcja chemiczna, np.
ciowa. Ten sam pierwiastek z tlenem może
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Trójtlenek siarki (SO
3
), gdzie siarka je
Tabela1 Symbole i wartościowo
Nazwa
Symbol
arsen
As
azot
N
bar
Ba
bor
B
brom
Br
chlor
Cl
chrom
Cr
cyna
Sn
cynk
Zn
fluor
F
fosfor
P
glin
Al
jod
I
krzem
Si
lit
Li
magnez
Mg
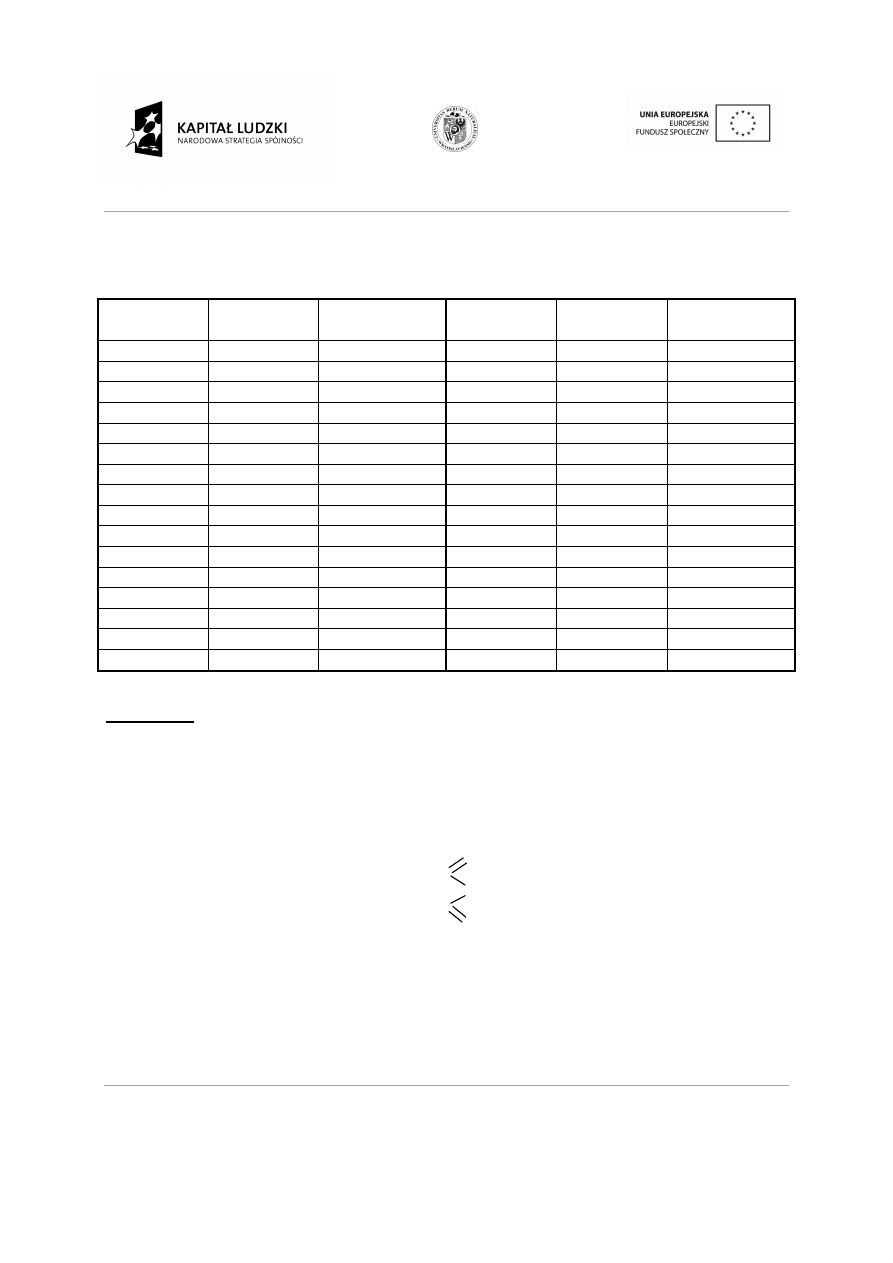
Przykład 1. Podaj wzór strukturalny tlenku glinu.
Rozwiązanie:
Wartościowość glinu wynosi III a tlenu II, wi
się przedstawiał następująco:
Rysując wzór strukturalny zwi
wchodzących w skład związku musi mie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
6
), gdzie siarka jest sześciowartościowa.
ś
ciowość wybranych pierwiastków chemicznych
Wartościowość
(typowa)
Nazwa
Symbol
III, V
mangan
Mn
III, V
miedź
Cu
II
nikiel
Ni
III
ołów
Pb
I
platyna
Pt
I, VII
potas
K
III, VI
rtęć
Hg
II, IV
siarka
S
II
sód
Na
I
srebro
Ag
III, V
tlen
O
III
wapń
Ca
I
węgiel
C
IV
wodór
H
I
złoto
Au
II
ż
elazo
Fe
Podaj wzór strukturalny tlenku glinu.
glinu wynosi III a tlenu II, więc wzór strukturalny tlenku glinu b
c wzór strukturalny związku chemicznego należy pamiętać, ż
ą
zku musi mieć tyle kresek, ile wynosi jego wartoś
Al
O
Al
O
O
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Wartościowość
(typowa)
II, VII
I, II
II
II, IV
II, IV
I
II
II, IV, VI
I
I
II
II
II, IV
I
I
II, III
c wzór strukturalny tlenku glinu będzie
ć
, że każdy z atomów
tyle kresek, ile wynosi jego wartościowość.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 2. Ustal wzór siarki(II) z:
a)
ołowiem(II),
b)
ołowiem(IV),
c)
żelazem(III).
Rozwiązanie:
a)
Związek siarki(II) z ołowiem(II):
Siarka w tym związku ma taką
b)
Związek siarki(II) z ołowiem(IV):
Ołów w tym związku ma dwa razy wi
na 1 atom ołowiu muszą przypada
następująco: PbS
2
.
c)
Związek siarki(II) z żelazem(III):
Sposób1: Najmniejszą wspóln
jest 6, co oznacza, że na 2 atomy
więc wzór tego związku to Fe
2
Sposób2: Wzór związku mo
Przemiany chemiczne prowadz
zapisać w postaci równań
i wzorami chemicznymi. W równaniach chemicznych, po lewej stronie znajd
chemiczne substratów, a po prawej stronie wzory
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
7
Ustal wzór siarki(II) z:
ołowiem(II),
ołowiem(IV),
elazem(III).
siarki(II) z ołowiem(II):
zku ma taką samą wartościowość co ołów, czyli wzór zwi
siarki(II) z ołowiem(IV):
zku ma dwa razy większą wartościowość co siarka, co oznacza,
przypadać 2 atomy siarki. Wzór tego związku przedstawia si
elazem(III):
Najmniejszą wspólną wielokrotnością wartościowości siarki(II) i
e na 2 atomy żelaza(III) muszą we wzorze przypadać 3 atomy siarki(II),
2
S
3
.
ku można też wyznaczyć stosując regułę „reguł
Przemiany chemiczne prowadzące do otrzymania związków chemicznych mo
ń
reakcji chemicznych posługując się prz
wzorami chemicznymi. W równaniach chemicznych, po lewej stronie znajd
, a po prawej stronie wzory produktów.
C + 2S = CS
2
Fe
2
S
3
III II
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
związku to PbS.
co siarka, co oznacza, że
zku przedstawia się więc
siarki(II) i żelaza(III)
we wzorze przypadać 3 atomy siarki(II),
„regułę na krzyż”.
zków chemicznych można
przy tym symbolami
wzorami chemicznymi. W równaniach chemicznych, po lewej stronie znajdą się wzory

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Jak ten zapis odczytać? Jeden atom w
jedną cząsteczkę siarczku węgla.
Duża cyfra poprzedzaj
oznacza liczbę atomów lub cz
współczynnika stechiometrycznego
1.2
Rodzaje związków w chemii
W chemii nieorganicznej najcz
tlenki, wodorotlenki, kwasy i sole.
1.2.1
Wodorki.
Wodorki to związki pierwiastków z wodorem.
jest jednowartościowy.
Funkcjonują głównie dwa rodzaje nazw systematycznych oraz nazwy zwyczajowe:
1.
Dla wodorków pierwiastków grup
dwuwyrazowy – najpierw słowo „
liczby pojedynczej, np.: wodorek sod
wzorze chemicznym wodór bę
2.
Nazwy wodorków niemetali grup VI i VII
pierwiastka z wyrazem „wodór
siarkowodór. Wówczas we wzorze chemicznym wodór stoi przed pierwiastkiem, np.: HCl,
HF, H
2
S
Przykład 3. Oznacz wartościowo
z wodorem: NH
3
, KH, H
2
S.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
8
Jak ten zapis odczytać? Jeden atom węgla łączy się z dwoma atomami siarki tworz
ę
gla.
a cyfra poprzedzająca symbol danego pierwiastka lub zwią
atomów lub cząsteczek uczestniczących w danej reakcji i nosi nazw
współczynnika stechiometrycznego.
zków w chemii nieorganicznej.
W chemii nieorganicznej najczęściej wyróżnia się 5 grup związków chemicznych: wodorki,
tlenki, wodorotlenki, kwasy i sole.
zki pierwiastków z wodorem. Wodór w związkach chemicznych
głównie dwa rodzaje nazw systematycznych oraz nazwy zwyczajowe:
Dla wodorków pierwiastków grup I do V układu okresowego stosuje si
najpierw słowo „wodorek” a później nazwa pierwiastka w dopełniaczu
liczby pojedynczej, np.: wodorek sodu, wodorek wapnia, wodorek fosforu. Wówczas we
wzorze chemicznym wodór będzie stał za pierwiastkiem np.: NaH, CaH
2
, PH
niemetali grup VI i VII można tworzyć przez poł
wodór” za pomocą litery „o” np.: chlorowodór, fluorowodór,
siarkowodór. Wówczas we wzorze chemicznym wodór stoi przed pierwiastkiem, np.: HCl,
Oznacz wartościowość pierwiastków na podstawie wzorów ich zwi
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
z dwoma atomami siarki tworząc
ca symbol danego pierwiastka lub związku chemicznego
cych w danej reakcji i nosi nazwę
zków chemicznych: wodorki,
ą
zkach chemicznych
głównie dwa rodzaje nazw systematycznych oraz nazwy zwyczajowe:
stosuje się system
niej nazwa pierwiastka w dopełniaczu
u, wodorek wapnia, wodorek fosforu. Wówczas we
, PH
3
.
przez połączenie nazwy
orowodór, fluorowodór,
siarkowodór. Wówczas we wzorze chemicznym wodór stoi przed pierwiastkiem, np.: HCl,
pierwiastków na podstawie wzorów ich związków

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Rozwiązanie:
Związek NH
3
to amoniak. Skoro wodór w zwi
jednowartościowy, a w skład amoniaku wchodz
związku jest trójwartościowy.
Związek KH to wodorek potasu. Skoro we wzorze tego zwi
atomów wodoru co potasu to znaczy,
Związek H
2
S to siarkowodór. Skoro w skład siarkowodoru wchodz
to znaczy, że siarka w tym zwią
1.2.2
Tlenki.
Tlenki to związki pierwiastków z tlenem. Niemal wszystkie pierwiastki tworz
Tworząc wzory tlenków należy pami
Nazwy systematyczne tlenków tworzy si
•
System przedrostków liczebnikowych
wartościom indeksów stechiometrycznych. Za słowem „tlenek” podaje si
w dopełniaczu liczby pojedynczej,
•
System Stocka – Za słowem „tle
a na końcu wartościowość pierwiastka cyfr
N
2
O
3
– tlenek azotu(III)
N
2
O
5
– tlenek azotu(V)
Przykład 4. Oznacz wartościowo
tlenem: K
2
O, Fe
2
O
3
, Cl
2
O
7
.
Rozwiązanie:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
9
to amoniak. Skoro wodór w związkach chemicznych jest
ciowy, a w skład amoniaku wchodzą 3 atomy wodoru to znaczy,
zek KH to wodorek potasu. Skoro we wzorze tego związku jest tyle samo
u co potasu to znaczy, że potas jest jednowartościowy.
S to siarkowodór. Skoro w skład siarkowodoru wchodzą
e siarka w tym związku jest dwuwartościowa.
zki pierwiastków z tlenem. Niemal wszystkie pierwiastki tworz
c wzory tlenków należy pamiętać, że tlen jest dwuwartościowy.
Nazwy systematyczne tlenków tworzy się jednym z dwóch systemów:
System przedrostków liczebnikowych – Przedrostki (di-, tri-, tetra-
ciom indeksów stechiometrycznych. Za słowem „tlenek” podaje się nazw
edynczej, np. tlenek wapnia (CaO), tritlenek dichromu (Cr
Za słowem „tlenek” podaje się nazwę pierwiastka w dopełniaczu l. poj.,
ść
pierwiastka cyfrą rzymską w nawiasie.
tlenek azotu(III)
FeO – tlenek żelaza(II)
tlenek azotu(V)
Fe
2
O
3
– tlenek żelaza(III)
ś
ciowość pierwiastków na podstawie wzorów ich zwi
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zkach chemicznych jest
3 atomy wodoru to znaczy, że azot w tym
zek KH to wodorek potasu. Skoro we wzorze tego związku jest tyle samo
S to siarkowodór. Skoro w skład siarkowodoru wchodzą 2 atomy wodoru
zki pierwiastków z tlenem. Niemal wszystkie pierwiastki tworzą tlenki.
jednym z dwóch systemów:
- itp.) odpowiadają
ciom indeksów stechiometrycznych. Za słowem „tlenek” podaje się nazwę pierwiastka
p. tlenek wapnia (CaO), tritlenek dichromu (Cr
2
O
3
)
pierwiastka w dopełniaczu l. poj.,
pierwiastków na podstawie wzorów ich związków z

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Skoro we wzorze tlenku K
jest dwuwartościowy, co oznacza,
We wzorze tlenku Fe
związku jest trójwartościowe.
We wzorze tlenku Cl
chloru w tym związku wynosi VII.
1.2.3
Wodorotlenki.
Wodorotlenki to związki chemiczne, któr
tlen-wodór (Me-O-H). Fragment wzoru wodorotlenku zbudowany z tlenu i wodoru nazywany jest
grupą wodorotlenową lub krócej grup
wodorotlenku jest tyle, ilu warto
Nazwy wodorotlenków tworzy si
słowem „wodorotlenek” podaje się
w nawiasie wartościowość metalu, np.:
Fe(OH)
2
– wodorotlenek ż
Fe(OH)
3
– wodorotlenek ż
Prawy dolny indeks za nawiasem odnosi si
nawiasu, czyli np. cząsteczka Fe(OH)
trzech atomów wodoru.
Jeżeli dany metal tworzy tylko jeden wodorotlenek, to wska
pominąć, np. NaOH – wodorotlenek sodu.
Przykład 5. Podaj wzory wodorotlenków cyny(II) i cyny(IV).
Rozwiązanie:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
10
Skoro we wzorze tlenku K
2
O dwa atomy potasu przypadają na jeden atom tlenu, który
ciowy, co oznacza, że potas jest jednowartościowy.
Fe
2
O
3
indeks dolny przy tlenie wynosi 3, wi
We wzorze tlenku Cl
2
O
7
indeks dolny przy tlenie wynosi 7, wię
zku wynosi VII.
ą
zki chemiczne, które zawierają w swojej strukturze ugrupowanie metal
H). Fragment wzoru wodorotlenku zbudowany z tlenu i wodoru nazywany jest
lub krócej grupą OH. Grup wodorotlenowych we wzorze danego
wodorotlenku jest tyle, ilu wartościowy jest dany metal.
Nazwy wodorotlenków tworzy się systemem Stocka omówionym już przy tlenkach, czyli za
słowem „wodorotlenek” podaje się nazwę pierwiastka w dopełniaczu l. poj., a na ko
metalu, np.:
orotlenek żelaza(II),
wodorotlenek żelaza(III).
Prawy dolny indeks za nawiasem odnosi się do każdego symbolu znajduj
steczka Fe(OH)
3
– składa się z jednego atomu żelaza, trzech atomów tlenu i
eli dany metal tworzy tylko jeden wodorotlenek, to wskaźnik warto
wodorotlenek sodu.
Podaj wzory wodorotlenków cyny(II) i cyny(IV).
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
na jeden atom tlenu, który
indeks dolny przy tlenie wynosi 3, więc żelazo w tym
indeks dolny przy tlenie wynosi 7, więc wartościowość
w swojej strukturze ugrupowanie metal-
H). Fragment wzoru wodorotlenku zbudowany z tlenu i wodoru nazywany jest
Grup wodorotlenowych we wzorze danego
ż
przy tlenkach, czyli za
pierwiastka w dopełniaczu l. poj., a na końcu cyfrą rzymską
dego symbolu znajdującego się wewnątrz
elaza, trzech atomów tlenu i
nik wartościowości można

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Pamiętając o tym, że grup wodorotlenowych we wzorze danego wodorotlenku ma by
wartościowy jest dany metal, wzór wodorotlenku cyny(II) to
to Sn(OH)
4
.
1.2.4
Kwasy.
W skład wszystkich
związek zawierający wodór jest kwasem. Kwasy wyró
wodoru tym, że ich wodór w reakcjach chemicznych mo
Kwasy dzielimy na dwa rodzaje:
•
Kwasy beztlenowe (wodne roztwory wodorków niemetali), np. HF
fluorowodorowy.
•
Kwasy tlenowe (wodór jest zapisywany na pierwszym miejscu, a tlen za niemetalem, np.
HClO – kwas chlorowy(I).
W przypadku nazywania
związków zawierają przymiotnik z
pierwiastka, którego ten kwas dotyczy, np. H
Jeżeli dany niemetal tworzy kilka kwasów, to warto
sygnalizuje się metodą Stocka.
Przykład 6. Narysuj wzory strukturalne nast
Rozwiązanie:
Wzór H
2
SO
4
to wzór kwasu siarkowego(VI), gdzie siarka jest sze
We wzorze strukturalnym od atomu siarki musi odchodzi
tlen jest dwuwartościowy, a wodór jednowarto
strukturalnym nie może bezpoś
się następująco:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
11
e grup wodorotlenowych we wzorze danego wodorotlenku ma by
ciowy jest dany metal, wzór wodorotlenku cyny(II) to Sn(OH)
2
, a wzór wodorotlenku cyny(IV)
W skład wszystkich kwasów wchodzi wodór, co jednak nie oznacza,
cy wodór jest kwasem. Kwasy wyróżniają się spośród innych zwi
e ich wodór w reakcjach chemicznych może być wymieniony na metal.
Kwasy dzielimy na dwa rodzaje:
(wodne roztwory wodorków niemetali), np. HF
(wodór jest zapisywany na pierwszym miejscu, a tlen za niemetalem, np.
W przypadku nazywania kwasów tlenowych oprócz wyrazu „
przymiotnik z końcówką –owy sygnalizujący atom centralny
pierwiastka, którego ten kwas dotyczy, np. H
2
CO
3
– kwas węglowy.
eli dany niemetal tworzy kilka kwasów, to wartościowość atomu centralnego
Stocka.
Narysuj wzory strukturalne następujących kwasów: H
2
SO
4
, HNO
to wzór kwasu siarkowego(VI), gdzie siarka jest sze
We wzorze strukturalnym od atomu siarki musi odchodzić 6 wiązań. Pami
ciowy, a wodór jednowartościowy oraz że wodór we wzorze
e bezpośrednio łączyć się z niemetalem, wzór tego kwasu przedstawia
O
H
S
O
O
O
H
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
e grup wodorotlenowych we wzorze danego wodorotlenku ma być tyle, ilu
, a wzór wodorotlenku cyny(IV)
wchodzi wodór, co jednak nie oznacza, że każdy
ś
ród innych związków
wymieniony na metal.
(wodne roztwory wodorków niemetali), np. HF
(aq)
, – kwas
(wodór jest zapisywany na pierwszym miejscu, a tlen za niemetalem, np.
oprócz wyrazu „kwas” nazwy tych
ą
cy atom centralny
ść
atomu centralnego
, HNO
3
, HClO
4
.
to wzór kwasu siarkowego(VI), gdzie siarka jest sześciowartościowa.
. Pamiętając o tym, że
e wodór we wzorze
z niemetalem, wzór tego kwasu przedstawia
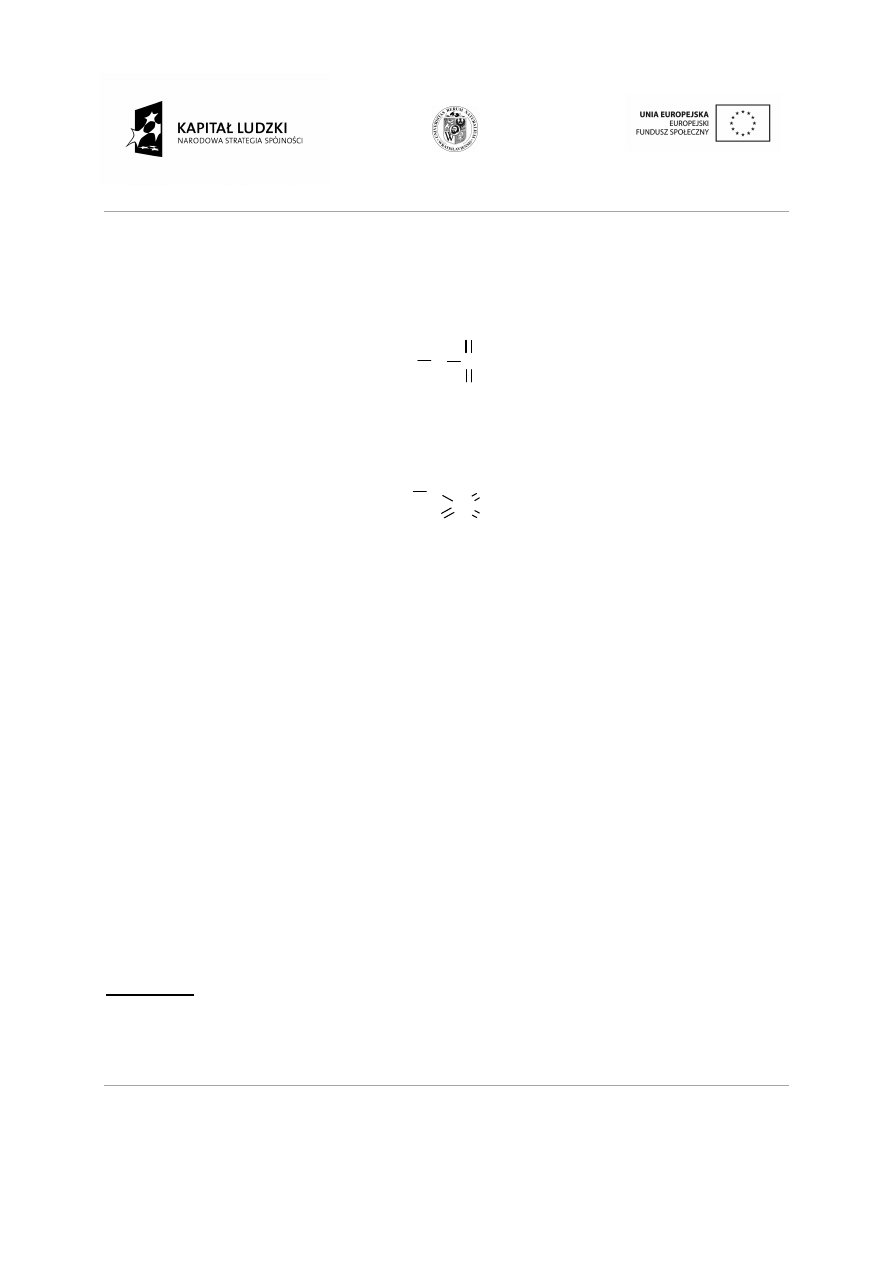
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Wzór HNO
3
to wzór kwasu azotowego(V), w którym azot jest pi
Wzór strukturalny tego kwasu to:
Wzór
HClO
4
to
wzór
kwasu
chlorowego(VII),
w
którym
chlor
jest
siedmiowartościowy. Wzór strukturalny tego kwasu to:
1.2.5
Sole.
Sole to związki chemiczne składaj
Wzór soli zaczyna się metalem a dopiero za nim stoi reszta odpowiedniego kwasu.
Nazwa soli składa się z dwóch wyrazów. Pierwszy okre
się ją od nazwy kwasu, który zawiera t
Dla soli kwasów tlenowych
Jeżeli dany niemetal tworzy kilka kwasów tlenowy
centralnego w postaci liczby Stocka. Mamy wi
i azotany(V).
Dla soli kwasów beztlenowych
kwasu siarkowodorowego to siarcz
Drugi wyraz w nazwie soli okre
wartościowość liczbą Stocka.
Przykład 7. Podaj wzór siarczku
Rozwiązanie:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
12
to wzór kwasu azotowego(V), w którym azot jest pi
Wzór strukturalny tego kwasu to:
to
wzór
kwasu
chlorowego(VII),
w
którym
chlor
jest
rukturalny tego kwasu to:
zki chemiczne składające się z metalu i reszty kwasowej.
Wzór soli zaczyna się metalem a dopiero za nim stoi reszta odpowiedniego kwasu.
ę
z dwóch wyrazów. Pierwszy określa resztę kwasow
od nazwy kwasu, który zawiera tą resztę.
soli kwasów tlenowych nazwa reszty kwasowej ma końcówkę
eli dany niemetal tworzy kilka kwasów tlenowych należy podać warto
centralnego w postaci liczby Stocka. Mamy więc siarczany(IV) i siarczany(VI); azotany(III)
soli kwasów beztlenowych nazwa reszty kwasowej ma końcówk
kwasu siarkowodorowego to siarczek, a sól kwasu chlorowodorowego to chlor
Drugi wyraz w nazwie soli określa metal i – w razie potrzeby – takż
Podaj wzór siarczku żelaza(III), siarczanu(VI) wapnia i azotanu(V) glinu.
N
O
H
O
O
Cl
O
O
O
O
H
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
to wzór kwasu azotowego(V), w którym azot jest pięciowartościowy.
to
wzór
kwasu
chlorowego(VII),
w
którym
chlor
jest
z metalu i reszty kwasowej.
metalem a dopiero za nim stoi reszta odpowiedniego kwasu.
ę
kwasową i tworzy
cówkę –an, np. siarczan.
ć
wartościowość atomu
c siarczany(IV) i siarczany(VI); azotany(III)
ń
cówkę –ek. Stąd sól
sól kwasu chlorowodorowego to chlorek.
także podaje się jego
elaza(III), siarczanu(VI) wapnia i azotanu(V) glinu.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Siarczek żelaza(III) to sól pochodz
tym związku jest więc dwuwarto
(tu Fe) a dopiero za nim stoi reszta odpowiedniego kwasu (tu S) wzór siarczku
Fe
2
S
3
.
Siarczan(VI) wapnia to sól pochodz
kwasowa (SO
4
) jest dwuwarto
siarczanu(VI) wapnia to CaSO
Azotan(V) glinu to sól pochodz
(NO
3
) jest jednowartościowa a glin jest trójwarto
azotanu(V) glinu na jeden atom glinu musz
azotanu(V) glinu przedstawia si
1.3
Zadania do rozwiązania na
1.
Ustal wzór sumaryczny związków chemicznych składaj
(w nawiasie podano wartościowo
Cu(II) i S(II), Fe(III) i Cl(I), S(IV) i O(II), Al(III) i C(IV), Cl(VII) i O(II
2.
Omów na dowolnych przykładach, co to s
3.
Ustal wartościowość pierwiastków na podstawie wzorów ich zwi
SiH
4
, AsH
3
, CaH
2
. Nazwij te zwi
4.
Ustal wartościowość pierwiastków na po
Al
2
O
3
, CO
2
, N
2
O
3
, N
2
O
5
, SO
2
, SO
5.
Podaj nazwy następujących tlenków: MnO, PbO
6.
Podziel podane niżej tlenki na tlenki metali i tlenki niemetali: Cl
MgO, N
2
O
3
, Fe
2
O
3
, Cr
2
O
3
. Nazwij te tlenki.
7.
Określ wartościowość metali w zwi
Nazwij te związki.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
13
elaza(III) to sól pochodząca od kwasu siarkowodorowego: H
c dwuwartościowa. Pamiętając o tym, że wzór soli zaczyna si
(tu Fe) a dopiero za nim stoi reszta odpowiedniego kwasu (tu S) wzór siarczku
Siarczan(VI) wapnia to sól pochodząca od kwasu siarkowego(VI): H
) jest dwuwartościowa oraz wapń jest też dwuwartościowy, wi
siarczanu(VI) wapnia to CaSO
4
.
Azotan(V) glinu to sól pochodząca od kwasu azotowego(V): HNO
ciowa a glin jest trójwartościowy. Z tego wynika,
azotanu(V) glinu na jeden atom glinu muszą przypaść 3 reszty kwasu azotowego(V). Wzór
azotanu(V) glinu przedstawia się więc następująco: Al(NO
3
)
3
.
Zadania do rozwiązania na ćwiczeniach.
Ustal wzór sumaryczny związków chemicznych składających się z niżej podanych pierwiastków
ś
ciowość pierwiastka):
Cu(II) i S(II), Fe(III) i Cl(I), S(IV) i O(II), Al(III) i C(IV), Cl(VII) i O(II), Mg(II) i Si(IV).
Omów na dowolnych przykładach, co to są wzory sumaryczne i strukturalne.
pierwiastków na podstawie wzorów ich związków z wodorem: LiH, PH
. Nazwij te związki.
pierwiastków na podstawie wzorów ich związków z tlenem: CaO, Ag
, SO
3
, PbO
2
, CrO
3
. Nazwij te związki.
cych tlenków: MnO, PbO
2
, SiO
2
, Cu
2
O, Cr
2
O
3
, P
2
O
5
.
ej tlenki na tlenki metali i tlenki niemetali: Cl
2
O, Ag
2
O, PbO
. Nazwij te tlenki.
metali w związkach: Ca(OH)
2
, Al(OH)
3
, Cu(OH)
2
, Pb(OH)
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ca od kwasu siarkowodorowego: H
2
S. Siarka w
e wzór soli zaczyna się metalem
(tu Fe) a dopiero za nim stoi reszta odpowiedniego kwasu (tu S) wzór siarczku żelaza(III) to:
ca od kwasu siarkowego(VI): H
2
SO
4
. Reszta
dwuwartościowy, więc wzór
V): HNO
3
. Reszta kwasowa
ciowy. Z tego wynika, że we wzorze
3 reszty kwasu azotowego(V). Wzór
ej podanych pierwiastków
), Mg(II) i Si(IV).
zków z wodorem: LiH, PH
3
,
zków z tlenem: CaO, Ag
2
O,
O, PbO
2
, CO
2
, SO
2
, ZnO,
, Pb(OH)
4
, Zn(OH)
2
.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
8.
Podaj wzory następujących kwasów: kwas solny, kwas bromowodorowy, kwas
kwas siarkowodorowy, kwas siarkowy(IV), kwas siarkowy(VI), kwas azotowy(III), kwas
azotowy(V), kwas fosforowy(V), kwas w
chlorowy(III), kwas chlorowy(V), kwas chlorowy(VII).
9.
Ustal wartościowość niemetalu w nast
te związki.
10.
Podaj nazwy następujących soli: CuCl
Al(ClO
4
)
3
, Ca
3
(PO
4
)
2
.
11.
Podaj wzory następujących soli: chlorek
wapnia, siarczan(VI) żelaza(III), siarczek chromu(III), siarczek wapnia, chlorek srebra, fosforan(V)
sodu, chloran(VII) manganu(II).
12.
Narysuj wzory strukturalne nast
fosforu(V), tlenek chloru(VII), wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek
ż
elaza(III), kwas węglowy, kwas azotowy(III),
chlorowy(VI), chlorek żelaza (III), siarczek chromu(III), azotan(V) sodu
fosforan(V) potasu.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
14
cych kwasów: kwas solny, kwas bromowodorowy, kwas
kwas siarkowodorowy, kwas siarkowy(IV), kwas siarkowy(VI), kwas azotowy(III), kwas
azotowy(V), kwas fosforowy(V), kwas węglowy, kwas chromowy(VI), kwas chlorowy(I), kwas
chlorowy(III), kwas chlorowy(V), kwas chlorowy(VII).
niemetalu w następujących kwasach: H
2
CO
3
, H
2
SO
3
, H
3
cych soli: CuCl
2
, AlBr
3
, Fe
2
S
3
, K
2
CO
3
, Zn(NO
3
)
2
, BaSO
cych soli: chlorek żelaza (II), jodek cynku, azotan(V) wapnia, siarczan(IV)
elaza(III), siarczek chromu(III), siarczek wapnia, chlorek srebra, fosforan(V)
sodu, chloran(VII) manganu(II).
Narysuj wzory strukturalne następujących związków: tlenek wapnia, tlenek azotu(III),
fosforu(V), tlenek chloru(VII), wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek
glowy, kwas azotowy(III), kwas siarkowy(IV), kwas fosforowy(V), kwas
elaza (III), siarczek chromu(III), azotan(V) sodu, siarczan(VI) wapnia,
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
cych kwasów: kwas solny, kwas bromowodorowy, kwas jodowodorowy,
kwas siarkowodorowy, kwas siarkowy(IV), kwas siarkowy(VI), kwas azotowy(III), kwas
glowy, kwas chromowy(VI), kwas chlorowy(I), kwas
3
PO
4
, HClO
3
. Nazwij
, BaSO
4
, Na
2
SO
3
, Ag
2
SO
4
,
cynku, azotan(V) wapnia, siarczan(IV)
elaza(III), siarczek chromu(III), siarczek wapnia, chlorek srebra, fosforan(V)
zków: tlenek wapnia, tlenek azotu(III), tlenek
fosforu(V), tlenek chloru(VII), wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek
kwas siarkowy(IV), kwas fosforowy(V), kwas
, siarczan(VI) wapnia,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2
Ć
wiczenie 2. Stechiometria
2.1
Podstawowe pojęcia.
Atom składa się z dodatnio naładowanego j
neutrony oraz z pozajądrowego układu
stosunkowo dużą masę. Układ elektronów kr
(10
-8
cm). Elektrony obdarzone s
1/1840 część masy najlżejszego atomu. J
pierwiastka, natomiast układ elektronów determinuje wła
właściwości fizyczne.
Liczbę protonów w ją
Oznacza się ją symbolem Z
pierwiastka. Liczba atomowa jest niepowtarzaln
pierwiastka.
Ponieważ atom jest elektrycznie oboj
odpowiada liczba elektronów kr
Liczba neutronów jest zwykle nieco wi
naturalny atom jodu zawiera 53 protony i 74 neutrony. Zbiór atomów nie ró
liczbą protonów ani liczbą neutronów nazywamy
liczba masowa danego pierwiastka i oznacza si
górny indeks nad liczbą atomow
Liczbę neutronów oblicza si
wynosi 127 – 53 = 74 neutrony.
Zwraca uwagę fakt, ż
pierwiastka ale nuklidu.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
15
Stechiometria.
ę
cia.
z dodatnio naładowanego jądra, w którym znajduj
drowego układu elektronów. Jądro atomu ma bardzo małe wymiary
. Układ elektronów krążących wokół jądra zajmuje znaczn
cm). Elektrony obdarzone są ładunkiem ujemnym i mają bardzo mał
ejszego atomu. Jądro atomu decyduje o właściwo
pierwiastka, natomiast układ elektronów determinuje właściwości chemiczne i tylko niektóre
protonów w jądrze atomu nazywamy liczbą atomową danego pierwiastka.
Z i zapisuje jako lewy dolny indeks przy symbolu danego
pierwiastka. Liczba atomowa jest niepowtarzalną, charakterystyczną
53
J
atom jest elektrycznie obojętny to liczbie protonów w j
odpowiada liczba elektronów krążących wokół jądra.
ów jest zwykle nieco większa od liczby protonów i elektronów. Np.
naturalny atom jodu zawiera 53 protony i 74 neutrony. Zbiór atomów nie ró
ą
neutronów nazywamy nuklidem. Suma protonów i neutronów to
anego pierwiastka i oznacza się ją symbolem A. Zapisuje si
atomową.
neutronów oblicza się z różnicy A – Z. Np. dla atomu jodu liczba neutronów
53 = 74 neutrony.
fakt, że liczba masowa nie jest cechą charakterystyczn
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
dra, w którym znajdują się protony i
dro atomu ma bardzo małe wymiary i
dra zajmuje znaczną przestrzeń
bardzo małą masę, zaledwie
ś
ciwościach fizycznych
ci chemiczne i tylko niektóre
danego pierwiastka.
zy symbolu danego
, charakterystyczną cechą danego
tny to liczbie protonów w jądrze atomu
ksza od liczby protonów i elektronów. Np.
naturalny atom jodu zawiera 53 protony i 74 neutrony. Zbiór atomów nie różniących się ani
. Suma protonów i neutronów to
. Zapisuje się ją jako lewy
Z. Np. dla atomu jodu liczba neutronów
charakterystyczną danego
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Zbiór atomów, które maj
nazywamy izotopem.
Masa atomowa (A
r
) to masa atomu wyra
Jest ona średnią ważoną mas izotopów danego pierwiastka wyst
Atomowa jednostka masy [u] to masa 1/12 masy atomu izotopu w
Masa cząsteczkowa (Mr)
więc jest także wyrażona w atomowych jednostkach masy [
Przykład 1. Oblicz masę cząsteczkow
Rozwiazanie:
Wzór wodorotlenku sodu to NaOH.
W układzie okresowym znajdujemy,
Skoro masa cząsteczkowa wodorotlenku sodu
w skład cząsteczki, więc
M
NaOH
= M
Na
+ M
O
Odpowiedź: Masa cząsteczkowa wodorotlenku sodu wynosi 40u.
2.2
Mol, masa molowa, liczno
W układzie SI jako podstaw
występujący izotop węgla
12
atomów lub cząsteczek, jaka znajduje si
Ile atomów znajduje się
Liczba 6,022
×
10
23
określana jest jako
Mol jest więc miarą liczno
w tuzinie znajduje się 12 sztuk, natomiast w molu zawsze jest 6,02·10
cząsteczek, itp..
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
16
Zbiór atomów, które mają tę samą liczbę protonów, ale różnią się
to masa atomu wyrażona w atomowych jednostkach masy [
mas izotopów danego pierwiastka występujących w przyrodzie.
] to masa 1/12 masy atomu izotopu węgla
12
C.
u = 1,66
×
10
24
g
steczkowa (Mr) jest sumą mas atomów wchodzących w skład cz
na w atomowych jednostkach masy [u].
ą
steczkową wodorotlenku sodu.
Wzór wodorotlenku sodu to NaOH.
W układzie okresowym znajdujemy, że M
Na
= 23u; M
O
= 16u; M
steczkowa wodorotlenku sodu jest sumą mas atomów wchodz
+ M
H
= 23u + 16u + 1u = 40u
ą
steczkowa wodorotlenku sodu wynosi 40u.
Mol, masa molowa, liczność.
W układzie SI jako podstawę definicji mola wykorzystuje się
12
C. Jeden mol dowolnej substancji zawiera tak
steczek, jaka znajduje się w 12g izotopu węgla
12
C.
Ile atomów znajduje się w 12g czystego izotopu węgla
12
C? Odp. to 6,022
lana jest jako liczba Avogadra i oznacza się ją symbolem
ą
liczności materii (podobnie, jak tuzin). Różnica jest tylko taka,
12 sztuk, natomiast w molu zawsze jest 6,02·10
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ą
się liczbą neutronów
ona w atomowych jednostkach masy [u].
pujących w przyrodzie.
C.
cych w skład cząsteczki, a
= 16u; M
H
= 1u
mas atomów wchodzących
tuje się najpowszechniej
C. Jeden mol dowolnej substancji zawiera taką samą liczbę
C? Odp. to 6,022
×
10
23
.
ą
symbolem N
A
.
ż
nica jest tylko taka, że
12 sztuk, natomiast w molu zawsze jest 6,02·10
23
atomów, jonów,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Masa molowa jest to masa jednego mola molekuł (atomów, cz
i jest ona liczbowo równa masie atomowej lub cz
w g/mol.
Przykład 2. W szklance znajduje si
znajduje się w tym naczyniu.
Rozwiazanie:
M
w
= 18g/mol
Układamy proporcję:
1mol = 18g
x = 200g ⇒ x = 11,1 mola
Aby obliczyć ilość czą
cząsteczek. Układamy więc proporcj
1mol = 6,02·10
23
cząsteczek
11,1 = x ⇒ x = 6,68·10
Odpowiedź: W szklance wody jest
Przypominam, ze mol jest jednostk
której mol jest jednostką została nazwana
Liczność materii należ
wzorem:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
17
jest to masa jednego mola molekuł (atomów, cząsteczek, jonów, itp.)
jest ona liczbowo równa masie atomowej lub cząsteczkowej danej substancji. Wyra
W szklance znajduje się 200g wody. Oblicz, ile moli wody oraz ile cz
x = 11,1 mola
ść
cząsteczek pamiętamy, że 1mol dowolnej substancji to
ę
c proporcję:
cząsteczek
x = 6,68·10
24
cząsteczek
: W szklance wody jest 6,68·10
24
cząsteczek wody.
Przypominam, ze mol jest jednostką, a nie wielkością fizyczną. Wielko
została nazwana licznością.
materii należy do grupy 7 wielkości podstawowych układu SI i wyra
n
s
s
s
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ą
steczek, jonów, itp.)
steczkowej danej substancji. Wyraża się ją
z, ile moli wody oraz ile cząsteczek
e 1mol dowolnej substancji to 6,02·10
23
ą
. Wielkość fizyczna,
ci podstawowych układu SI i wyraża się

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.3
Objętość molowa.
Innym ważnym poję
substancji (V
m
), która podobnie jak jej masa jest wielko
substancji i – w odróżnieniu od masy
gazów).
Objętość molowa wszystkich substancji lotnych w warunkach normalnych (T =
273K (0
°
C) i p = 1013hPa) przyjmuje tak
warunków standardowych (T = 298K (25
Wspólna dla wszystkich gazów warto
już w 1811 roku zasady Avogadra
znajduje się taka sama liczba drobin pod warunkiem,
identyczne.
Przykład 3. Jaką objętość w warunkach normalnych zajm
Rozwiązanie:
Skoro 1mol gazu w wa
zajmą objętość 44,8dm
3
.
Odpowiedź: Dwa mole tlenu zajm
2.4
Obliczenia stechiometryczne
Przy rozwiązywaniu zada
przeliczenia.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
18
nym pojęciem przydatnym w obliczeniach jest
), która podobnie jak jej masa jest wielkością charakterystyczn
nieniu od masy – zależy od temperatury i ciśnienia (zwłaszcza dla
molowa wszystkich substancji lotnych w warunkach normalnych (T =
i p = 1013hPa) przyjmuje taką samą wartość 22,4 dm
3
/mol
warunków standardowych (T = 298K (25
°
C) i p = 1013hPa) wartość 24,4 dm
Wspólna dla wszystkich gazów wartość objętości molowej wynika z postulowanej
zasady Avogadra, w myśl której w równej objętoś
taka sama liczba drobin pod warunkiem, że ciśnienie i temperatura tych gazów s
ść
w warunkach normalnych zajmą 2 mole tlenu?
Skoro 1mol gazu w warunkach normalnych zajmie objętość 22,4dm
Dwa mole tlenu zajmą objętość 44,8dm
3
.
Obliczenia stechiometryczne.
zywaniu zadań często trzeba uzgodnić jednostki, co wymaga ich
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ciem przydatnym w obliczeniach jest objętość molowa
charakterystyczną dla danej
ś
nienia (zwłaszcza dla
molowa wszystkich substancji lotnych w warunkach normalnych (T =
/mol a w przypadku
24,4 dm
3
/mol.
ci molowej wynika z postulowanej
ę
tości różnych gazów
nienie i temperatura tych gazów są
22,4dm
3
, to 2 mole tlenu
jednostki, co wymaga ich
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 4. Jeden g/cm
3
ile to jest g/dm
Rozwiązanie:
1dm = 10cm
1dm
3
= 10
3
cm
3
= 1000cm
1g/cm
3
= 1000g/dm
3
Skoro 1cm
3
waży 1g to 1dm
Odpowiedź: Jeden g/cm
Przykład 5. Jeden litr ile to jest cm
Rozwiązanie:
1litr = 10
3
ml = 10
3
cm
1litr = 1dm
3
Odpowiedź: Jeden litr to
W analizach chemicznych cz
procentowego pierwiastków wchodz
odwrotnie
−
na podstawie składu procentowego ustalenia wzoru sumarycznego zwi
chemicznego.
Przykład 6. Oblicz skład procentowy azotanu(V) amonu.
Rozwiązanie:
Najpierw obliczamy mas
M
s
= 2×14 + 4 ×1 + 3×16 = 80g/mol
Zakładamy, że dysponujemy 1 molem substancji. Wówczas:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
19
ile to jest g/dm
3
?
= 1000cm
3
y 1g to 1dm
3
musi ważyć 1000 razy więcej.
Jeden g/cm
3
to1000g/dm
3
.
Jeden litr ile to jest cm
3
?
cm
3
= 1000cm
3
Jeden litr to1000cm
3
.
W analizach chemicznych często zachodzi konieczność okre
procentowego pierwiastków wchodzących w skład danego związku chemicznego lub
na podstawie składu procentowego ustalenia wzoru sumarycznego zwi
Oblicz skład procentowy azotanu(V) amonu.
Najpierw obliczamy masę molową azotanu(V) amonu (NH
4
NO
3
):
= 2×14 + 4 ×1 + 3×16 = 80g/mol
e dysponujemy 1 molem substancji. Wówczas:
%N
28
80
100% 35%
%H
4
80
100% 5%
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ść
określenia składu
zku chemicznego lub
na podstawie składu procentowego ustalenia wzoru sumarycznego związku

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Odpowiedź: Skład procentowy azotanu(V) amonu wynosi 35% azotu, 5% wodoru
i 60% tlenu.
Przykład 7. Tlenek pewnego dwuwarto
tego tlenku.
Rozwiązanie:
Skoro tlenek zawiera 20% tlenu to drugi pierwiastek stanowi 80%. Wzór tlenku to
XO, ponieważ pierwiastek jest dwuwarto
Układamy proporcję:
Sprawdzamy w układzie okresowym jaki pierwiastek ma mas
to miedź, czyli szukany tlenek to tlenek miedzi(II)
Odpowiedź: Wzór tego tlenku to CuO.
2.5
Zadania do rozwią
1.
Oblicz masę cząsteczkow
kwasu chlorowego(VII) i azotanu(V) amonu.
2.
Ustal wzór rzeczywisty tlenku chloru o masie cz
on 39% chloru. Odp. Cl
2
O
3.
Ustal wzór rzeczywisty kwasu beztlenowego o masie
zawiera on 6% wodoru. Odp. H
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
20
%O
48
80
100% 60%
Skład procentowy azotanu(V) amonu wynosi 35% azotu, 5% wodoru
Tlenek pewnego dwuwartościowego pierwiastka zawiera 20% tlenu. Ustal wzór
Skoro tlenek zawiera 20% tlenu to drugi pierwiastek stanowi 80%. Wzór tlenku to
pierwiastek jest dwuwartościowy.
20
80
1
4
16
x = 4 × 16 = 64
M
x
= 64g/mol
Sprawdzamy w układzie okresowym jaki pierwiastek ma masę molow
, czyli szukany tlenek to tlenek miedzi(II) – CuO.
Wzór tego tlenku to CuO.
Zadania do rozwiązania na ćwiczeniach.
steczkową i molową wodorotlenku potasu, kwasu siarkowego(VI),
kwasu chlorowego(VII) i azotanu(V) amonu.
Ustal wzór rzeczywisty tlenku chloru o masie cząsteczkowej 183u wiedz
O
7
Ustal wzór rzeczywisty kwasu beztlenowego o masie cząsteczkowej 34u wiedz
zawiera on 6% wodoru. Odp. H
2
S
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Skład procentowy azotanu(V) amonu wynosi 35% azotu, 5% wodoru
a 20% tlenu. Ustal wzór
Skoro tlenek zawiera 20% tlenu to drugi pierwiastek stanowi 80%. Wzór tlenku to
ę
molową 64g/mol. Jest
wodorotlenku potasu, kwasu siarkowego(VI),
steczkowej 183u wiedząc, że zawiera
steczkowej 34u wiedząc, że

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4.
Tlenek pewnego dwuwarto
wodny roztwór barwi fenoloftalein
56u. Podać nazwę i wzór tego tlen
5.
W skład dolomitu wchodzi w
Odp. Sól Ca: Ca – 40%, C
6.
Oblicz skład procentowy ortofosforanu(V) wapnia.
Odp. Ca – 38,7%, P – 20%, O
7.
Ile moli, cząsteczek i atomów znajduje si
3,01·10
24
cząsteczek, 6,02·10
8.
Ile moli amoniaku przereaguje z 6 molami tlenu, je
para wodna? Odp. 8 moli
9.
Czy 15kg tlenu wystarczy do całkowitego spalenia 10kg w
10.
Oblicz ile moli wodoru wydzieli si
0,2mola
11.
Oblicz w ilu gramach tlenku siarki(VI), znajduje si
12.
Oblicz ile kilogramów tlenu, którego g
wymiarach 3m x 6m x 4m. Odp. 103kg
13.
Oblicz, ile atomów siarki znajduje si
14.
Ustal, która z próbek zawiera wi
15.
Ile gramów tlenku węgla zawiera tyle samo cz
80g
16.
Ile gramów magnezu należ
znajduje się w 16g siarki? Odp. 12g
17.
Jaką objętość w warunkach normalnych zajmi
Odp.44,8dm
3
18.
Jaka objętość tlenu jest potrzebna do spalenia 0,5dm
w warunkach normalnych)? Odp. 0,25dm
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
21
Tlenek pewnego dwuwartościowego pierwiastka reaguje z wodą dając zwi
wodny roztwór barwi fenoloftaleinę na malinowo. Masa cząsteczkowa tlenku wynosi
i wzór tego tlenku. Odp. CaO – tlenek wapnia
W skład dolomitu wchodzi węglan wapnia i magnezu. Ustal skład procentowy obu soli.
40%, C – 12%, O – 48%; sól Mg: Mg – 28,6%, C –
Oblicz skład procentowy ortofosforanu(V) wapnia.
20%, O – 41,3%
steczek i atomów znajduje się w 10g wodoru? Odp. 5moli,
steczek, 6,02·10
24
atomów
Ile moli amoniaku przereaguje z 6 molami tlenu, jeżeli produktami tej reakcji s
u wystarczy do całkowitego spalenia 10kg węgla? Odp. nie wystarczy
Oblicz ile moli wodoru wydzieli się podczas reakcji 13g cynku z kwasem solnym. Odp.
Oblicz w ilu gramach tlenku siarki(VI), znajduje się 1,6g tlenu. Odp. 2,3g
tlenu, którego gęstość wynosi 1,43g/dm³ znajduje si
wymiarach 3m x 6m x 4m. Odp. 103kg
Oblicz, ile atomów siarki znajduje się w 9,8g kwasu siarkowego(VI). Odp. 6,02·10
tóra z próbek zawiera więcej atomów – 5g glinu czy 10g żelaza? Odp
ę
gla zawiera tyle samo cząsteczek co 88g dwutlenku w
Ile gramów magnezu należy odważyć, aby próbka ta zawierała tyle samo atomów, ile
w 16g siarki? Odp. 12g
w warunkach normalnych zajmie 1,204·10
24
cząsteczek amoniaku?
tlenu jest potrzebna do spalenia 0,5dm
3
wodoru (odmierzonego
warunkach normalnych)? Odp. 0,25dm
3
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
dając związek, którego
steczkowa tlenku wynosi
glan wapnia i magnezu. Ustal skład procentowy obu soli.
– 14,3%, O – 57,1%
w 10g wodoru? Odp. 5moli,
eli produktami tej reakcji są azot i
gla? Odp. nie wystarczy
podczas reakcji 13g cynku z kwasem solnym. Odp.
1,6g tlenu. Odp. 2,3g
wynosi 1,43g/dm³ znajduje się w sali o
w 9,8g kwasu siarkowego(VI). Odp. 6,02·10
22
elaza? Odp. 5g glinu
steczek co 88g dwutlenku węgla? Odp.
, aby próbka ta zawierała tyle samo atomów, ile
ą
steczek amoniaku?
wodoru (odmierzonego

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
19.
Oblicz objętość wodoru w warunkach normalnych, jak
szklankę wody (250ml). Odp. 250cm
20.
Jaką objętość dwutlenku w
przez roztwór wodorotlenku wapnia, aby otrzyma
21.
Oblicz objętość dwutlenku w
21g węglanu magnezu z kwasem solnym.
22.
Reakcja przebiega według równania : 2Bi
Oblicz ile gramów bizmutu powstało w reakcji, je
mmola dwutlenku węgla (
23.
Oblicz ilość gramów kwasu ortofosforowego(V) konieczn
ortofosforanu(V) magnezu w reakcji kwasu z metalem. Odp. 98g
24.
Ile ton wapna palonego (CaO) mo
zanieczyszczeń? Odp. 1 t
25.
Ile gramów 12% kwasu siarkowego(VI) potrzeba w reakcji z cynkiem aby otrzyma
5,6dm
3
wodoru w warunkach normalnych? Odp. 204g
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
22
wodoru w warunkach normalnych, jaką należy spali
ml). Odp. 250cm
3
dwutlenku węgla zmierzoną w warunkach normalnych nale
przez roztwór wodorotlenku wapnia, aby otrzymać 15g węglanu wapnia? Odp. 3,36dm
dwutlenku węgla w warunkach normalnych, powstałego podczas reakcji
glanu magnezu z kwasem solnym. Odp. 5,6dm
3
Reakcja przebiega według równania : 2Bi
2
O
3
+ 3C
→
4Bi + 3CO
2
Oblicz ile gramów bizmutu powstało w reakcji, jeżeli równocześn
gla (warunki normalne). Odp. 2,1g
gramów kwasu ortofosforowego(V) konieczną do otrzymania 0,5 mola
ortofosforanu(V) magnezu w reakcji kwasu z metalem. Odp. 98g
Ile ton wapna palonego (CaO) można otrzymać z 2 ton wapienia zawieraj
Ile gramów 12% kwasu siarkowego(VI) potrzeba w reakcji z cynkiem aby otrzyma
wodoru w warunkach normalnych? Odp. 204g
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
y spalić aby otrzymać
w warunkach normalnych należy przepuścić
glanu wapnia? Odp. 3,36dm
3
gla w warunkach normalnych, powstałego podczas reakcji
eli równocześnie otrzymano 7,5
do otrzymania 0,5 mola
wapienia zawierającego 10%
Ile gramów 12% kwasu siarkowego(VI) potrzeba w reakcji z cynkiem aby otrzymać
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3
Ć
wiczenie 3. Równania reakcji chemicznych
Reakcje chemiczne
produkty – związki chemiczne o innych wła
substraty.
Pisząc równania reakcji nale
rzeczywistego przebiegu reakcji, a tylko prze
Pełny opis przebiegu reakcji uwzgl
reakcji. Przedstawia się go w postaci kilku równa
przemiany.
Wśród przemian chemicznych mo
chemicznych: reakcje łączenia, rozkładu, wymiany czy reakcje utleniania i redukcji.
3.1
Reakcje łączenia.
Reakcja łączenia (syntezy)
z wytworzeniem jednego produktu.
Reakcjami łączenia są
lub niemetal reaguje z tlenem) czy wodorki (kiedy dany pierwiastek reaguje z wodorem).
Pisząc reakcje należy pami
w reakcjach występują w postaci dwuatomowych cz
(Cl
2
).
Przykład 1. Napisz reakcje z tlenem sodu, w
Rozwiązanie:
Zawsze ilość atomów danego pierwiastka po lewej stronie równania musi by
ilości atomów tego pierwiastka po prawej stronie.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
23
Równania reakcji chemicznych.
Reakcje chemiczne to przemiany, w wyniku których z substratów
zki chemiczne o innych właściwościach fizycznych i chemicznych ni
c równania reakcji należy pamiętać, że równanie chemiczne nie wyja
rzeczywistego przebiegu reakcji, a tylko przedstawia początkowy i koń
Pełny opis przebiegu reakcji uwzględniający wszystkie etapy pośrednie to
go w postaci kilku równań chemicznych ilustruj
ród przemian chemicznych można wyróżnić kilka głównych typów reakcji
czenia, rozkładu, wymiany czy reakcje utleniania i redukcji.
czenia (syntezy) polega na połączeniu się dwu lub wi
wytworzeniem jednego produktu.
czenia są na przykład reakcje pozwalające otrzymać tlenki (kiedy metal
lub niemetal reaguje z tlenem) czy wodorki (kiedy dany pierwiastek reaguje z wodorem).
c reakcje należy pamiętać, że niektóre z pierwiastków są gazami i wówczas
w postaci dwuatomowych cząsteczek, np.: tlen (O
Napisz reakcje z tlenem sodu, węgla i żelaza.
atomów danego pierwiastka po lewej stronie równania musi by
w tego pierwiastka po prawej stronie.
4Na + O
2
= 2Na
2
O
2Mg + O
2
= 2MgO
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
substratów powstają
ciach fizycznych i chemicznych niż
e równanie chemiczne nie wyjaśnia
tkowy i końcowy stan układu.
ś
rednie to mechanizm
chemicznych ilustrujących kolejne
kilka głównych typów reakcji
czenia, rozkładu, wymiany czy reakcje utleniania i redukcji.
dwu lub więcej substancji
ce otrzymać tlenki (kiedy metal
lub niemetal reaguje z tlenem) czy wodorki (kiedy dany pierwiastek reaguje z wodorem).
ą
gazami i wówczas
steczek, np.: tlen (O
2
), azot (N
2
), chlor
atomów danego pierwiastka po lewej stronie równania musi być równa

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Innym przykładem reakcji ł
Należy zwrócić uwagę
i tlenki kwasowe. W zależnoś
produkt jego reakcji z wodą.
•
Tlenki zasadowe to ogólnie tlenki
o charakterze zasadowym, np.: Na
•
Tlenki kwasowe to na ogół tlenki
tlenowe, np.:
SO
2
+ H
2
O = H
Przykład 2. Napisz reakcje z wod
Rozwiązanie:
Sód i wapń to metale, których tlenki w reakcji z wod
Węgiel tworzy dwa tlenki: CO i CO
tworzy kwas węglowy.
Niektóre sole kwasów beztlenowych mo
pierwiastków tworzących te sole, np.:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
24
2C + O
2
= 2CO
C + O
2
= CO
2
2Fe + O
2
= 2FeO
4Fe + 3O
2
= 2Fe
2
O
3
Innym przykładem reakcji łączenia jest reakcja tlenku z wodą.
uwagę, że wśród tlenków można wyróżnić 2 grupy: tlenki zasadowe
ż
ności od tego, do której grupy należy dany tlenek, ró
to ogólnie tlenki metali, które reagując z wodą tworz
charakterze zasadowym, np.: Na
2
O – tlenek sodu.
to na ogół tlenki niemetali, które reagując z wod
O = H
2
SO
3
SO
3
+ H
2
O = H
Napisz reakcje z wodą tlenków: sodu, wapnia i węgla.
to metale, których tlenki w reakcji z wodą tworzą wodorotlenki:
Na
2
O + H
2
O = 2NaOH
CaO + H
2
O = Ca(OH)
2
giel tworzy dwa tlenki: CO i CO
2
, z których tylko ten drugi w r
CO
2
+ H
2
O = H
2
CO
3
Niektóre sole kwasów beztlenowych można też otrzymać w bezpo
cych te sole, np.:
Fe + S = FeS
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
2 grupy: tlenki zasadowe
y dany tlenek, różny będzie
ą
tworzą wodorotlenki
c z wodą tworzą kwasy
O = H
2
SO
4
wodorotlenki:
, z których tylko ten drugi w reakcji z wodą
w bezpośredniej reakcji
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Innym przykładem reakcji ł
zasadowego z tlenkiem kwasowym
Przykład 3. Napisz reakcje tlenku sodu z tlenkiem azotu(V) i tlenkiem siarki(VI) oraz tlenku
wapnia z dwutlenkiem węgla.
Rozwiązanie:
3.2
Reakcje rozkładu.
W reakcji rozkładu
Niektóre związki chemiczne łatwo ulegaj
palnikiem laboratoryjnym, np.:
2HgO = Hg + O
CaCO
3
2H
2
O
2
= 2H
3.3
Reakcje wymiany.
Reakcja wymiany polega na przekształceniu dwu lub wi
więcej produkty. Są dwa rodzaje reakcji wymiany: wymiana pojedyncza i wymiana
podwójna.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
25
2Na + Cl
2
= 2NaCl
2Ag + S = Ag
2
S
Innym przykładem reakcji łączenia pozwalającej otrzymać sól jest
zasadowego z tlenkiem kwasowym.
Napisz reakcje tlenku sodu z tlenkiem azotu(V) i tlenkiem siarki(VI) oraz tlenku
Na
2
O + N
2
O
5
= 2NaNO
3
Na
2
O + SO
3
= Na
2
SO
4
CaO + CO
2
= CaCO
3
występuje jeden substrat i co najmniej dwa produkty.
zki chemiczne łatwo ulegają rozkładowi podczas ich ogrzewania
p.:
2HgO = Hg + O
2
= CaO + CO
2
= 2H
2
O + O
2
Reakcje wymiany.
polega na przekształceniu dwu lub więcej substratów w dwa lub
dwa rodzaje reakcji wymiany: wymiana pojedyncza i wymiana
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
sól jest reakcja tlenku
Napisz reakcje tlenku sodu z tlenkiem azotu(V) i tlenkiem siarki(VI) oraz tlenku
puje jeden substrat i co najmniej dwa produkty.
rozkładowi podczas ich ogrzewania
cej substratów w dwa lub
dwa rodzaje reakcji wymiany: wymiana pojedyncza i wymiana

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
3.3.1
Reakcje wymiany pojedynczej
Przykładem reakcji wymiany pojedynczej mo
jeden ze sposobów otrzymania wodorotlenków metali z I i II grupy układu okresowego.
Przykład 4. Napisz reakcję sodu i wapnia z wod
Rozwiązanie:
2Na + H
2
O = 2NaOH + H
Ca + 2H
2
O = Ca(OH)
Innym przykładem reakcji wymiany pojedynczej mo
z kwasem, w wyniku której powstaje sól i wydziela si
Przykład 5. Napisz reakcję cynku z kwasem solnym
Zn + 2HCl = ZnCl
Na uwagę zasługuje fakt,
są przykładami reakcji roztwarzania
Roztwarzanie to reakcja ciała stałego z ciecz
w tej cieczy. Nie należy mylić
(np. rozpuszczania soli w wodzie), które nie jest reakcj
fizycznym.
3.3.2
Reakcje wymiany podwójnej
Przykładem reakcji wymiany podwójnej jest reakcja
zasadą, w wyniku której powstaje sól i woda. Dokładniej reakcja zoboj
rozdz. IV.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
26
Reakcje wymiany pojedynczej.
Przykładem reakcji wymiany pojedynczej może być reakcja metalu z wod
jeden ze sposobów otrzymania wodorotlenków metali z I i II grupy układu okresowego.
ę
sodu i wapnia z wodą
O = 2NaOH + H
2
↑
O = Ca(OH)
2
+ H
2
↑
Innym przykładem reakcji wymiany pojedynczej może być
kwasem, w wyniku której powstaje sól i wydziela się gazowy wodór.
ę
cynku z kwasem solnym
+ 2HCl = ZnCl
2
+ H
2
↑
zasługuje fakt, że powyższe reakcje otrzymania wodorotlenków oraz soli
roztwarzania.
to reakcja ciała stałego z cieczą, która daje produkt rozpuszczalny
ić reakcji roztwarzania z rozpuszczaniem ciała stałego w cieczy
(np. rozpuszczania soli w wodzie), które nie jest reakcją roztwarzania tylko procesem
Reakcje wymiany podwójnej.
Przykładem reakcji wymiany podwójnej jest reakcja zobojętniania, czy
, w wyniku której powstaje sól i woda. Dokładniej reakcja zobojętniania zostanie omówiona w
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
reakcja metalu z wodą. Jest to
jeden ze sposobów otrzymania wodorotlenków metali z I i II grupy układu okresowego.
e być reakcja metalu
sze reakcje otrzymania wodorotlenków oraz soli
, która daje produkt rozpuszczalny
reakcji roztwarzania z rozpuszczaniem ciała stałego w cieczy
roztwarzania tylko procesem
, czyli reakcja kwasu z
tniania zostanie omówiona w

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 6. Napisz reakcję wodorotlenku cynku z kwasem solnym
Rozwiązanie:
Zn
3.4
Reakcje utleniania i redukcji.
Reakcję chemiczną zalicza si
przemianie substratów w produkty towarzyszy zmiana stopnia utlenienia reaguj
atomów.
Stopień utlenienia jest t
wiązania chemiczne.
Termin przyjmuje lub oddaje mo
innemu atomowi (lub ich grupie), co prowadzi do powstawania wi
częściowe przekazanie elektronów w formie wi
Stopień utlenienia oblicza si
elektronów przez dany atom, w ramach danej cz
elektron więcej niż otrzymuje, to uzyskuje stopie
jeden elektron więcej niż sam przekazał uzyskuje stopie
Stopień utlenienia nie jest jednoznaczny z warto
wartościowość platyny wynosi 8 (bo ł
pojedyncze), zaś jej stopień utlenienia wynosi tylko +4, gdy
przekazanie elektronu od wodoru do platyny, za
daje platynie bilans 6 elektronów oddanych i dwóch przyj
Stopień utlenienia moż
całej ich grupy, przy czym reguły post
nie bierze się pod uwagę wiąza
grupą a resztą cząsteczki.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
27
wodorotlenku cynku z kwasem solnym
Zn(OH)
2
+ 2HCl = ZnCl
2
+ 2H
2
O
Zasada kwas sól woda
Reakcje utleniania i redukcji.
ą
zalicza się do reakcji utleniania i redukcji (redoks)
przemianie substratów w produkty towarzyszy zmiana stopnia utlenienia reaguj
jest to liczba elektronów jaką atom przyjmuje lub oddaje tworz
Termin przyjmuje lub oddaje może tu oznaczać zarówno pełne przekazanie elektronu
innemu atomowi (lub ich grupie), co prowadzi do powstawania wiązania jonowego; lub tylko
we przekazanie elektronów w formie wiązania spolaryzowanego lub koordynacyjnego.
utlenienia oblicza się jako bilans wszystkich przekazanych i przyj
elektronów przez dany atom, w ramach danej cząsteczki. Jeśli dany atom przekazuje o jeden
otrzymuje, to uzyskuje stopień utleniania +1, jeśli natomiast przyjmuje o
sam przekazał uzyskuje stopień utlenienia -1.
utlenienia nie jest jednoznaczny z wartościowością. Np. w H
wynosi 8 (bo łączy się z ośmioma innymi atomami poprzez wi
ń
utlenienia wynosi tylko +4, gdyż w wiązaniach H
przekazanie elektronu od wodoru do platyny, zaś w wiązaniach Pt-Cl na odwrót, co razem
bilans 6 elektronów oddanych i dwóch przyjętych (6-2=+4).
utlenienia można wyznaczać nie tylko dla pojedynczego atomu lecz tak
całej ich grupy, przy czym reguły postępowania są tu dokładnie takie same. W tym przypadku
wiązań występujących wewnątrz danej grupy lecz tylko mi
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
utleniania i redukcji (redoks), jeżeli
przemianie substratów w produkty towarzyszy zmiana stopnia utlenienia reagujących
atom przyjmuje lub oddaje tworząc
zarówno pełne przekazanie elektronu
zania jonowego; lub tylko
zania spolaryzowanego lub koordynacyjnego.
jako bilans wszystkich przekazanych i przyjętych
li dany atom przekazuje o jeden
li natomiast przyjmuje o
ś
cią. Np. w H
2
PtCl
6
mioma innymi atomami poprzez wiązania
zaniach H-Pt następuje
Cl na odwrót, co razem
nie tylko dla pojedynczego atomu lecz także dla
tu dokładnie takie same. W tym przypadku
trz danej grupy lecz tylko między tą
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przy zapisie stopni utlenienia trzeba pami
potem liczbę arabską.
Zasady określania stopnia utlenienia:
1.
Stopień utlenienia pierwiastka w stanie wolnym równy jest zero, np. Na, O
2.
Suma stopnia utleniania wszystkich atomów wchodz
wynosi zero.
3.
Metale będą miały dodatni stopie
4.
Fluor we wszystkich swych poł
5.
Tlen ma w związkach chemicznych głównie stopie
fluorek tlenu OF
2
(tlen +2) i nadtlenki np. H
utlenienia tlenu wynosi -1.
6.
Wodór ma zazwyczaj stopie
na –1stopniu utlenienia.
Przykład 7. Ustal stopnie utlenienia pierwiastków tworz
ż
elaza(III), chloran(VII) wapnia
Rozwiązanie:
Należy pamiętać, że zawsze suma stopni utlenienia pierwiastków w zwi
chemicznym wynosi zero.
W tlenku miedzi(II) tlen jest na
stopniu utlenienia aby suma wynosiła zero.
Siarczek żelaza(III) ma wzór Fe
utlenienia a więc siarka musi być
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
28
Przy zapisie stopni utlenienia trzeba pamiętać o tym, że najpierw pisze si
lania stopnia utlenienia:
pierwiastka w stanie wolnym równy jest zero, np. Na, O
Suma stopnia utleniania wszystkich atomów wchodzących w skład czą
miały dodatni stopień utlenienia a niemetale ujemny.
we wszystkich swych połączeniach występuje na -1 stopniu utlenienia.
zkach chemicznych głównie stopień utlenienia -2. Wyj
(tlen +2) i nadtlenki np. H
2
O
2
, Na
2
O
2
, BaO
2
, w których stopie
1.
ma zazwyczaj stopień utlenienia +1. Wyjątek stanowią wodorki metali, gdzie jest
Ustal stopnie utlenienia pierwiastków tworzących tlenek miedzi(II), siarczek
elaza(III), chloran(VII) wapnia.
ż
e zawsze suma stopni utlenienia pierwiastków w zwi
W tlenku miedzi(II) tlen jest na -2 stopniu utlenienia a więc miedź
stopniu utlenienia aby suma wynosiła zero.
elaza(III) ma wzór Fe
2
S
3
. Żelazo będąc metalem będzie tu na +3 stopniu
c siarka musi być na -2 stopniu utlenienia aby suma wynosiła zero.
CuO
+2 -2
Fe S
3
2
-2
+3
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
e najpierw pisze się znak, a
pierwiastka w stanie wolnym równy jest zero, np. Na, O
2
, O
3
.
cych w skład cząsteczki obojętnej
1 stopniu utlenienia.
2. Wyjątki stanowią:
, w których stopień
wodorki metali, gdzie jest
cych tlenek miedzi(II), siarczek
e zawsze suma stopni utlenienia pierwiastków w związku
c miedź musi być na +2
ę
dzie tu na +3 stopniu
2 stopniu utlenienia aby suma wynosiła zero.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Chloran(VII) wapnia ma wzór Ca(ClO
utlenienia a tlen na -2 stopniu utlenienia. Aby suma stopni utlenienia pierwiastków w tym
związku chemicznym wynosiła zero chlor mus
Utlenianie (dezelektronacja) jest to proces, w którym dany jon lub atom podwy
swój stopień utlenienia w wyniku utraty elektronów.
Redukcja (elektronacja) jest to proces, w którym dany jon lub atom obni
stopień utlenienia w wyniku przył
Ponieważ swobodne elektrony nie mog
i redukcji zachodzi zawsze jednocze
(nazywamy go reduktorem), drugi składnik ulega redukcji (nazywamy go
elektronów pobranych przez utleniacz musi si
reduktor. W związku z tym, ukł
elektronowy, na podstawie którego dobiera si
W reakcji wypierania bromu przez chlor
2Br
-
+ Cl
2
→
Br
2
+ 2Cl
atomy chloru zmieniły stopień
redukcji; a atomy bromu z -1
Chlor jest utleniaczem bromu, a brom
(dezelektronacji) towarzyszy redukcja (elektronacja).
Przykład 8. Dobierz współczynniki w nast
S + HNO
3
= H
2
SO
Rozwiązanie:
Przy doborze współczynników pierwsz
odszukanie pierwiastków, które zmieniaj
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
29
Chloran(VII) wapnia ma wzór Ca(ClO
4
)
2
. Wapń będąc metalem będzie tu na +2 stopniu
2 stopniu utlenienia. Aby suma stopni utlenienia pierwiastków w tym
zku chemicznym wynosiła zero chlor musi być na +7 stopniu utlenienia.
(dezelektronacja) jest to proces, w którym dany jon lub atom podwy
utlenienia w wyniku utraty elektronów.
(elektronacja) jest to proces, w którym dany jon lub atom obni
utlenienia w wyniku przyłączenia elektronów.
swobodne elektrony nie mogą istnieć w środowisku reakcji, proces utlenienia
redukcji zachodzi zawsze jednocześnie – jeden składnik reagującej mieszaniny ulega utlenieniu
), drugi składnik ulega redukcji (nazywamy go utleniaczem
elektronów pobranych przez utleniacz musi się równać liczbie elektronów oddanych przez
zku z tym, układając równanie redoks należy przeprowadzi
, na podstawie którego dobiera się współczynniki reakcji.
W reakcji wypierania bromu przez chlor
+ 2Cl
-
atomy chloru zmieniły stopień utlenienia z zerowego stopnia utlenienia na
1 stopnia utlenienia zmieniły na zerowy, czyli brom utlenił si
bromu, a brom reduktorem chloru. Zawsze utlenieniu
(dezelektronacji) towarzyszy redukcja (elektronacja).
Dobierz współczynniki w następującej reakcji:
SO
4
+ NO
Przy doborze współczynników pierwszą czynnością, jaką trzeba wykona
odszukanie pierwiastków, które zmieniają stopień utlenienia.
Ca(ClO
4
)
2
+2
-2
+7
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ę
dzie tu na +2 stopniu
2 stopniu utlenienia. Aby suma stopni utlenienia pierwiastków w tym
(dezelektronacja) jest to proces, w którym dany jon lub atom podwyższa
(elektronacja) jest to proces, w którym dany jon lub atom obniża swój
rodowisku reakcji, proces utlenienia
cej mieszaniny ulega utlenieniu
utleniaczem). Liczba
liczbie elektronów oddanych przez
y przeprowadzić tzw. bilans
tlenienia na –1, uległy więc
, czyli brom utlenił się.
chloru. Zawsze utlenieniu
trzeba wykonać jest
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Układamy równania połówkowe:
Podwyższenie stopnia utlenienia przez atom siarki musi by
obniżenie stopnia utlenienia przez azot. Aby
równaniu (a) jak i (b) trzeba pierwsze równanie pomno
mamy:
Uzyskany wynik przenosimy do wyj
Szczególnym przypadkiem procesów redoks jest
w której tylko jeden pierwiastek zmienia stopie
jak i reduktorem.
Przykład 9. Dobierz współczynniki w nast
Rozwiązanie:
Podobnie jak w poprzednim przykładzie dobór współczynników zaczynamy od
odszukania pierwiastków, które zmieniaj
HNO
3
H
2
SO
4
S + = + NO
0
+6
+5
+5
N + 3e = N
S - 6e = S
0
(a)
(b)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
30
Układamy równania połówkowe:
szenie stopnia utlenienia przez atom siarki musi być zrównowa
enie stopnia utlenienia przez azot. Aby po tyle samo elektronów przepłyn
równaniu (a) jak i (b) trzeba pierwsze równanie pomnożyć przez 3 a drugie przez 4. Wówczas
Uzyskany wynik przenosimy do wyjściowego równania:
S + 2HNO
3
= H
2
SO
4
+ 2NO
Szczególnym przypadkiem procesów redoks jest reakcja dysproporcjonowania
której tylko jeden pierwiastek zmienia stopień utlenienia, jest więc on zarówno utleniaczem
Dobierz współczynniki w następującej reakcji dysproporcjonowania:
NO
2
+ H
2
O = HNO
3
+ HNO
2
Podobnie jak w poprzednim przykładzie dobór współczynników zaczynamy od
odszukania pierwiastków, które zmieniają stopień utlenienia.
4
S + = + NO
+2
+2
N + 3e = N
S - 6e = S
+6
S - 6e = S
0
+6
+5
+2
2N + 6e = 2N
(a)
(b)
NO
2
HNO
2
HNO
3
+ H O = +
+4
+5
2
+3
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ć
zrównoważone przez
po tyle samo elektronów przepłynęło zarówno w
przez 3 a drugie przez 4. Wówczas
reakcja dysproporcjonowania,
c on zarówno utleniaczem
cej reakcji dysproporcjonowania:
Podobnie jak w poprzednim przykładzie dobór współczynników zaczynamy od

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
W tym przypadku azot jest zarówno utleniaczem jak i reduktorem.
Układamy równania połówkowe:
Przy przeniesieniu równa
dysproporcjonowania musimy pami
3.5
Zadania do rozwią
1.
Napisz reakcje łączenia pozwalaj
wodorek wapnia, wodorek glinu, amoniak, siarkowodór, chlorowodór, fluorowodór,
jodowodór.
2.
Napisz reakcje łączenia pozwalaj
wapnia, tlenek glinu, tlenek cynku, tlenek cyny(II), tlenek cyny(IV), tlenek srebra, tlen
azotu(III), tlenek azotu(V), tlenek fosforu(V), tlenek chloru(I), tlenek chloru(III), tlenek
chloru(VII), tlenek siarki(IV), tlenek siarki(VI).
3.
Napisz reakcje syntezy z tlenków nast
potasu, fosforanu(V) potasu
4.
Napisz reakcji rozkładu nast
chloru(III), chloru(IV).
5.
Napisz reakcję roztwarzania
siarkowym(VI)
6.
Napisz reakcje zobojętniania, pozwalaj
jodek cynku, siarczek sodu, azotan(V)
fosforan(V) sodu, chloran(VII) magnezu.
7.
Ułóż równania reakcji:
a)
Mg + Cl
2
= ?
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
31
W tym przypadku azot jest zarówno utleniaczem jak i reduktorem.
Układamy równania połówkowe:
Przy przeniesieniu równań połówkowych do wyjściowego równania w reakcji
dysproporcjonowania musimy pamiętać, żeby zsumować oba równania (a) i (b).
2NO
2
+ H
2
O = HNO
3
+ HNO
2
Zadania do rozwiązania na ćwiczeniach.
czenia pozwalające otrzymać następujące wodorki: wodorek sodu,
wapnia, wodorek glinu, amoniak, siarkowodór, chlorowodór, fluorowodór,
czenia pozwalające otrzymać następujące tlenki: tlenek sodu, tlenek
wapnia, tlenek glinu, tlenek cynku, tlenek cyny(II), tlenek cyny(IV), tlenek srebra, tlen
azotu(III), tlenek azotu(V), tlenek fosforu(V), tlenek chloru(I), tlenek chloru(III), tlenek
chloru(VII), tlenek siarki(IV), tlenek siarki(VI).
Napisz reakcje syntezy z tlenków następujących soli: węglan magnezu, siarczan(VI)
potasu, fosforanu(V) potasu, azotanu(V) glinu, fosforanu(V) cynku.
Napisz reakcji rozkładu następujących tlenków: azotu(III), azotu(V), chloru(I),
roztwarzania żelaza i glinu w kwasie solnym, magnezu w kwasie
ę
tniania, pozwalające otrzymać następujące sole: bromek glinu,
jodek cynku, siarczek sodu, azotan(V) żelaza(II), węglan magnezu, siarczan(VI) wapnia,
fosforan(V) sodu, chloran(VII) magnezu.
= ?
(a)
(b)
+4
+3
N + e = N
+5
N - e = N
+4
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
równania w reakcji
oba równania (a) i (b).
ce wodorki: wodorek sodu,
wapnia, wodorek glinu, amoniak, siarkowodór, chlorowodór, fluorowodór,
ce tlenki: tlenek sodu, tlenek
wapnia, tlenek glinu, tlenek cynku, tlenek cyny(II), tlenek cyny(IV), tlenek srebra, tlenek
azotu(III), tlenek azotu(V), tlenek fosforu(V), tlenek chloru(I), tlenek chloru(III), tlenek
glan magnezu, siarczan(VI)
cych tlenków: azotu(III), azotu(V), chloru(I),
elaza i glinu w kwasie solnym, magnezu w kwasie
ce sole: bromek glinu,
glan magnezu, siarczan(VI) wapnia,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
b)
Al + H
2
SO
4
= ?
c)
K
2
O + HNO
3
d)
SnO
2
+ HCl = ?
e)
FeO + HNO
3
f)
MgO + SO
2
= ?
g)
ZnO + P
2
O
5
= ?
h)
Mg(OH)
2
+ P
2
8.
Dobierz współczynniki w podanych poni
a)
Al + HCl = AlCl
b)
SiO
2
+ HF = SiF
c)
FeCl
3
+ NaOH = Fe(OH)
d)
H
2
S + O
2
= SO
e)
Zn + Pb(NO
3
)
f)
FeCl
3
+ SnCl
2
9.
Uzupełnij współczynniki w nast
a)
SiO
2
+ Mg = Si + MgO
b)
SiH
4
+ O
2
= SiO
c)
MnO
2
+ HCl = MnCl
d)
C + H
2
SO
4
= CO
e)
I
2
+ Cl
2
+ H
2
f)
Mn + H
2
SO
4
g)
Mg + HNO
3
= Mg(NO
h)
CrO
3
+ NH
3
= Cr
i)
KMnO
4
+ KNO
j)
K
2
Cr
2
O
7
+ H
2
SO
10.
Uzupełnij współczynniki w nast
a)
OF
2
+ H
2
O = O
b)
KMnO
4
= K
2
MnO
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
32
= ?
= ?
+ HCl = ?
= ?
= ?
= ?
2
O
5
= ?
Dobierz współczynniki w podanych poniżej reakcjach. Które z nich są procesami redoks?
Al + HCl = AlCl
3
+ H
2
+ HF = SiF
4
+ H
2
O
+ NaOH = Fe(OH)
3
+ NaCl
= SO
2
+ H
2
O
)
2
= Pb + Zn(NO
3
)
2
2
= FeCl
2
+ SnCl
4
Uzupełnij współczynniki w następujących reakcjach chemicznych:
+ Mg = Si + MgO
= SiO
2
+ H
2
O
+ HCl = MnCl
2
+ Cl
2
+ H
2
O
= CO
2
+ SO
2
+ H
2
O
2
O = HIO
3
+ HCl
= MnSO
4
+ SO
2
+ H
2
O
= Mg(NO
3
)
2
+ N
2
O + H
2
O
= Cr
2
O
3
+ N
2
+ H
2
O
+ KNO
2
+ H
2
SO
4
= MnSO
4
+ KNO
3
+ K
2
SO
4
SO
4
= K
2
SO
4
+ CrO
3
+ H
2
O
Uzupełnij współczynniki w następujących reakcjach dysproporcjonowania:
O = O
2
+ HF
MnO
4
+ MnO
2
+ O
2
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ej reakcjach. Które z nich są procesami redoks?
4
+ H
2
O
cych reakcjach dysproporcjonowania:

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
c)
H
2
S + H
2
SO
3
d)
HNO
2
= HNO
e)
P + KOH + H
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
33
= S + H
2
O
= HNO
3
+ NO + H
2
O
P + KOH + H
2
O = KH
2
PO
4
+ PH
3
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
4
Ć
wiczenie 4. Chemia roztworów wodnych
4.1
Reakcje dysocjacji elektrolitycznej.
Dysocjacja (łac. dyssociato
jony pod wpływem zewnętrznego czynnika np.
- temperatury – (dysocjacja
np. sole, tlenki, wodorotlenki niektórych metali)
- rozpuszczalnika – (dysocjacja
elektrolityczna nie zachodzi tylko w roztworze wodnym, ale równie
rozpuszczalników. Im większa jest stała dielektryczna rozpuszczalnika, tym dysocjacja
zachodzi łatwiej.
Elektrolity – substancje, których roztwory wodne przewodz
kwasy, wodorotlenki i sole.
Elektrolity można podzielić na:
-
mocne (kwasy, wodorotlenki, sole)
-
słabe (kwasy, wodorotlenki)
W przypadku mocnych
niezależnie od stężenia elektrolitu, dlatego w roztworze wodnym chlorku sodu nie znajdziemy
ż
adnej całej cząsteczki NaCl, tylko jony. Fakt całkowitej dysocjacji mocnego elektrolitu
uwzględnia się pisząc w równaniu reakcji tylko
Inaczej dysocjacja elektrolityczna wygl
ustala się stan równowagi mi
czyli w roztworze występują zarówno jony jak i cz
równania pisząc 2 strzałki w przeciwnych kierunkach
Nieelektrolity – substancje, których roztwory wodne
elektrycznego. Są to np. oboj
organicznych (np. mocznik, cukier, al
Każda dysocjująca substancja tworzy dwa rodzaje jonów: kationy i aniony.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
34
Chemia roztworów wodnych.
Reakcje dysocjacji elektrolitycznej.
dyssociato znaczy rozdzielanie) ogólnie to rozpad elektrolitów na
ę
trznego czynnika np.
(dysocjacja termiczna) – stopione substancje o
np. sole, tlenki, wodorotlenki niektórych metali)
(dysocjacja elektrolityczna) (tylko roztwory
elektrolityczna nie zachodzi tylko w roztworze wodnym, ale również w ś
ę
ksza jest stała dielektryczna rozpuszczalnika, tym dysocjacja
substancje, których roztwory wodne przewodzą prąd elektryczny. S
ć
na:
(kwasy, wodorotlenki, sole)
mocnych elektrolitów następuje prawie całk
enia elektrolitu, dlatego w roztworze wodnym chlorku sodu nie znajdziemy
steczki NaCl, tylko jony. Fakt całkowitej dysocjacji mocnego elektrolitu
c w równaniu reakcji tylko jedną strzałkę.
Inaczej dysocjacja elektrolityczna wygląda w przypadku słabych
między jonami a nie zdysocjowanymi cząsteczkami elektrolitu,
ą
zarówno jony jak i cząsteczki. Ten fakt uwzglę
2 strzałki w przeciwnych kierunkach.
substancje, których roztwory wodne nie
to np. obojętne tlenki (np. tlenek węgla) i wię
organicznych (np. mocznik, cukier, alkohol).
ca substancja tworzy dwa rodzaje jonów: kationy i aniony.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
znaczy rozdzielanie) ogólnie to rozpad elektrolitów na
stopione substancje o budowie jonowej,
roztwory). Dysocjacja
ż
w środowisku innych
ksza jest stała dielektryczna rozpuszczalnika, tym dysocjacja
ą
d elektryczny. Są to
puje prawie całkowita dysocjacja,
enia elektrolitu, dlatego w roztworze wodnym chlorku sodu nie znajdziemy
steczki NaCl, tylko jony. Fakt całkowitej dysocjacji mocnego elektrolitu
elektrolitów. Tutaj
ą
steczkami elektrolitu,
steczki. Ten fakt uwzględnia się w zapisie
przewodzą prądu
gla) i większość związków
ca substancja tworzy dwa rodzaje jonów: kationy i aniony.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kation – jon o ładunku dodatnim, który powstaje w wyniku utraty przez atom lub
ugrupowanie atomów jednego lub wi
Anion – jon o ładunku ujemnym, który tworzy si
pobierze jeden lub więcej elektronów.
Właściwości fizyczne i chemiczne jonów s
atomów czy cząsteczek i są
znajdujących się w roztworze.
Należy pamiętać, że
powstałych w wyniku dysocjacji elektrolitu jest zawsze równa zeru
4.1.1
Reakcje dysocjacji elektrolitycznej kwasów
Kwasy to związki chemiczne, które w roztworach wodnych dysocjuj
wodorowy (proton) i anion reszty kwasowej:
HAn = H
+
+ An
-
Przykład 1. Napisz równania dysocjacji elektrolitycznej kwasu solnego, kwasu
siarkowodorowego, kwasu azotowego(V) i kwasu octowego.
Rozwiązanie:
kwas solny:
HCl
kwas siarkowodorowy:
kwas azotowy(V): HNO
kwas octowy: CH
3
COOH
4.1.2
Reakcje dysocjacji elektrolitycznej zasad
Zasady – związki chemiczne, które w roztworach wodnych dysocjuj
metalu i anion wodorotlenowy.
KtOH = Kt
+
+ OH
-
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
35
jon o ładunku dodatnim, który powstaje w wyniku utraty przez atom lub
ugrupowanie atomów jednego lub więcej elektronów.
jon o ładunku ujemnym, który tworzy się gdy atom lub ugrupowanie atomów
cej elektronów.
ci fizyczne i chemiczne jonów są inne niż odpowiednich elektrooboj
steczek i są one niezależne od innych jonów przeciwnego znaku,
rze.
ż
e suma ładunków elektrycznych kationów i anionów
powstałych w wyniku dysocjacji elektrolitu jest zawsze równa zeru.
Reakcje dysocjacji elektrolitycznej kwasów.
zki chemiczne, które w roztworach wodnych dysocjuj
wodorowy (proton) i anion reszty kwasowej:
Napisz równania dysocjacji elektrolitycznej kwasu solnego, kwasu
siarkowodorowego, kwasu azotowego(V) i kwasu octowego.
HCl
(aq)
→
H
+
+ Cl
-
kwas siarkowodorowy: H
2
S H
+
+ HS
-
HS
-
H
+
+ S
2-
HNO
3
→
H
+
+ NO
3
-
COOH H
+
+ CH
3
COO
-
Reakcje dysocjacji elektrolitycznej zasad.
zki chemiczne, które w roztworach wodnych dysocjuj
metalu i anion wodorotlenowy.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
jon o ładunku dodatnim, który powstaje w wyniku utraty przez atom lub
gdy atom lub ugrupowanie atomów
odpowiednich elektroobojętnych
ne od innych jonów przeciwnego znaku,
suma ładunków elektrycznych kationów i anionów
zki chemiczne, które w roztworach wodnych dysocjują na kation
Napisz równania dysocjacji elektrolitycznej kwasu solnego, kwasu
zki chemiczne, które w roztworach wodnych dysocjują na kation

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 2. Napisz równania dysocjacji elektrolitycznej wodorotlenku sodu, wodorotlenku
amonu i wodorotlenku cynku
Rozwiązanie:
wodorotlenek sodu: NaOH
wodorotlenku amonu:
wodorotlenek cynku: Zn(OH)
4.1.3
Reakcje dysocjacji elektrolitycznej soli
Sole dysocjują jednostopniowo na kation metalu oraz anion reszty kwasowej.
KtAn = Kt
+
+ An
-
Przykład 3. Napisz równania dysocjacji
azotanu(V) cynku.
Rozwiązanie:
siarczek sodu: Na
2
S
→
węglan wapnia: CaCO
azotan(V) cynku: Zn(NO
4.2
Reakcje zobojętniania.
Reakcja zobojętniania to
Przykład 4. Napisz cząsteczkowo i jonowo reakcj
wodorotlenkiem wapnia oraz wodorotlenkiem cynku.
Rozwiązanie:
Zapis cząsteczkowy:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
36
Napisz równania dysocjacji elektrolitycznej wodorotlenku sodu, wodorotlenku
NaOH
→
Na
+
+ OH
-
NH
4
OH NH
4
+
+ OH
-
Zn(OH)
2
Zn(OH)
+
+ OH
-
Zn(OH)
+
Zn
2+
+ OH
-
Reakcje dysocjacji elektrolitycznej soli.
jednostopniowo na kation metalu oraz anion reszty kwasowej.
Napisz równania dysocjacji elektrolitycznej siarczku sodu, w
→
2Na
+
+ S
2-
CaCO
3
→
Ca
2+
+ CO
3
2-
Zn(NO
3
)
2
→
Zn
2+
+ 2NO
3
-
ę
tniania.
tniania to reakcja kwasu z zasadą w wyniku której powstaje sól i woda.
steczkowo i jonowo reakcję zobojętniania między kwasem solnym a
wodorotlenkiem wapnia oraz wodorotlenkiem cynku.
Ca(OH)
2
+ 2HCl CaCl
2
+ 2H
2
O
Wodorotlenek + kwas sól + woda
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Napisz równania dysocjacji elektrolitycznej wodorotlenku sodu, wodorotlenku
jednostopniowo na kation metalu oraz anion reszty kwasowej.
elektrolitycznej siarczku sodu, węglanu wapnia i
w wyniku której powstaje sól i woda.
ę
dzy kwasem solnym a
O

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Zapis jonowy:
Ca
2+
Zapis cząsteczkowy:
Zapis jonowy:
Zn(OH)
4.3
Reakcje hydrolizy.
Rozpuszczaniu niektórych soli w wodzie towarzyszy reakcja jonów soli z jonami
wody zwana reakcją hydrolizy lub krócej
odwrotnym do reakcji zobojętniania
SÓL + WODA
Nie wszystkie sole ulegaj
Hydrolizie nie ulegają
NaNO
3
, BaBr
2
, NaClO
4
, KMnO
hydrolizie.
4.3.1
Reakcje hydrolizy soli pochodz
Po rozpuszczeniu azotan
każda sól jest mocnym elektrolitem:
Powstające jony azotanowe
pochodzącymi z wody, które chocia
wodnym, bowiem pochodzą one z dysocjacji wody.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
37
+ 2OH
-
+ 2H
+
+ 2Cl
-
Ca
2+
+ 2Cl
-
+ 2H
OH
-
+ H
+
H
2
O
Zn(OH)
2
+ 2HCl ZnCl
2
+ 2H
2
O
Wodorotlenek + kwas sól + woda
Zn(OH)
2
↓
+ 2H
+
+ 2Cl
-
Zn
2+
+ 2Cl
-
+ 2H
Zn(OH)
2
↓
+ 2H
+
Zn
2+
+H
2
O
Reakcje hydrolizy.
Rozpuszczaniu niektórych soli w wodzie towarzyszy reakcja jonów soli z jonami
hydrolizy lub krócej hydrolizą. Reakcja hydrolizy jest procesem
zobojętniania.
SÓL + WODA KWAS + ZASADA
Nie wszystkie sole ulegają hydrolizie.
ulegają sole mocnych kwasów i mocnych zasad
, KMnO
4
, Li
2
SO
4
itp. Wszystkie pozostałe rodzaje soli ulegaj
Reakcje hydrolizy soli pochodzących od słabych kwasów i mocnych zasad
Po rozpuszczeniu azotan(III) sodu ulegnie w wodzie całkowitej dysocjacji, poniewa
da sól jest mocnym elektrolitem:
NaNO
2
→
Na
+
+ NO
2
-
ce jony azotanowe(III) są zdolne do reakcji z kationami wodorowymi
cymi z wody, które chociaż w minimalnych ilościach, istnieją w ka
ą
one z dysocjacji wody.
H
2
O H
+
+ OH
-
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
+ 2H
2
O
O
+ 2H
2
O
Rozpuszczaniu niektórych soli w wodzie towarzyszy reakcja jonów soli z jonami
. Reakcja hydrolizy jest procesem
mocnych zasad, czyli np. KCl,
itp. Wszystkie pozostałe rodzaje soli ulegają
cych od słabych kwasów i mocnych zasad.
dysocjacji, ponieważ
zdolne do reakcji z kationami wodorowymi
ą
w każdym roztworze

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Jony azotanowe(III) b
pozostaną jony OH
-
, które nie mog
mocnym elektrolitem. Nadmiar OH
Dwie zachodzące reakcje:
można przedstawić równaniem sumarycznym, zwanym
NO
2
-
Przykład 5. Napisz reakcje hydrolizy cyjanku potasu i w
Rozwiązanie:
cyjanek potasu: KCN
reakcja dysocjacji: KCN
HCN
reakcja dysocjacji wody:
reakcja hydrolizy: CN
węglan sodu: Na
2
CO
3
reakcja dysocjacji: Na
kwasu H
2
CO
3
reakcja dysocjacji wody:
reakcja hydrolizy: CO
HCO
4.3.2
Reakcje hydrolizy soli pochodz
Po rozpuszczeniu chlorku amonu, zachodzi dysocjacja tej soli na jony:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
38
(III) będą wychwytywały kationy wodoru, wi
, które nie mogą wejść w reakcję z kationem sodu, poniewa
mocnym elektrolitem. Nadmiar OH
-
powoduje zasadowy odczyn roztworu.
H
+
+ NO
2
-
HNO
2
ce reakcje:
H
2
O ↔ H
+
+ OH
-
H
+
+ NO
2
-
HNO
2
ć
równaniem sumarycznym, zwanym równaniem hydrolizy
+ H
2
O HNO
2
+ OH
-
odczyn zasadowy
Napisz reakcje hydrolizy cyjanku potasu i węglanu sodu.
KCN
→
K
+
+ CN
-
- jon cyjankowy pochodzi od słabego kwasu
reakcja dysocjacji wody: H
2
O H
+
+ OH
-
CN
-
+ H
2
O HCN + OH
-
Na
2
CO
3
→
2Na
+
+ CO
3
2-
- jon węglanowy pochodzi od słabego
reakcja dysocjacji wody: H
2
O H
+
+ OH
-
CO
3
2-
+ H
2
O HCO
3
-
+ OH
-
HCO
3
-
+ H
2
O H
2
CO
3
+ OH
-
Reakcje hydrolizy soli pochodzących od słabych zasad i mocnych kwasów
Po rozpuszczeniu chlorku amonu, zachodzi dysocjacja tej soli na jony:
NH
4
Cl
→
NH
4
+
+ Cl
-
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
wychwytywały kationy wodoru, więc w roztworze
sodu, ponieważ NaOH jest
powoduje zasadowy odczyn roztworu.
równaniem hydrolizy:
odczyn zasadowy
jon cyjankowy pochodzi od słabego kwasu
glanowy pochodzi od słabego
cych od słabych zasad i mocnych kwasów.
Po rozpuszczeniu chlorku amonu, zachodzi dysocjacja tej soli na jony:

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Powstające kationy amonowe s
pochodzącymi z dysocjacji wody. Aniony chlorkowe nie reaguj
ponieważ HCl jest mocnym elektrolitem.
Obie reakcje można zapisa
NH
4
+
Przykład 6. Napisz reakcje hydrolizy azotanu(V) srebra i siarczanu(VI) cynku
Rozwiązanie:
azotan(V) srebra: AgNO
reakcja dysocjacji: AgNO
wodorotlenku srebra
reakcja dysocjacji wody: H
2
O
reakcja hydrolizy: Ag
+
siarczan(VI) cynku: ZnSO
reakcja dysocjacji: ZnSO
wodorotlenku cynku
reakcja dysocjacji wody: H
2
O
reakcja hydrolizy: Zn
2+
Zn(OH)
4.3.3
Reakcje hydrolizy soli pochodz
Azotan(III) amonu po rozpuszczeniu ulegnie dysocjacji elektrolitycznej:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
39
ce kationy amonowe są zdolne do reakcji z anionami wodorotlenowymi,
cymi z dysocjacji wody. Aniony chlorkowe nie reagują z kationami wodorowymi,
HCl jest mocnym elektrolitem.
NH
4
+
+ OH
-
NH
3
+ H
2
O
H
2
O H
+
+ OH
-
na zapisać sumarycznie:
NH
4
+
+ H
2
O NH
3
+ H
2
O + H
+
+
NH
3
+ H
+
odczyn kwaśny
Napisz reakcje hydrolizy azotanu(V) srebra i siarczanu(VI) cynku
: AgNO
3
AgNO
3
→
Ag
+
+ NO
3
-
- kation srebra pochodzi od słabej zasady
O H
+
+ OH
-
+
+ H
2
O AgOH + H
+
: ZnSO
4
ZnSO
4
→
Zn
2+
+ SO
4
2-
- kation cynku pochodzi od słabej zasady
H
+
+ OH
-
2+
+ H
2
O Zn(OH)
+
+ H
+
Zn(OH)
+
+ H
2
O Zn(OH)
2
+ H
+
Reakcje hydrolizy soli pochodzących od słabych kwasów i słabych zasad
(III) amonu po rozpuszczeniu ulegnie dysocjacji elektrolitycznej:
NH
4
NO
2
→
NH
4
+
+ NO
2
-
H
2
O H
+
+ OH
-
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
zdolne do reakcji z anionami wodorotlenowymi,
z kationami wodorowymi,
ś
ny
Napisz reakcje hydrolizy azotanu(V) srebra i siarczanu(VI) cynku.
kation srebra pochodzi od słabej zasady
kation cynku pochodzi od słabej zasady
cych od słabych kwasów i słabych zasad.
(III) amonu po rozpuszczeniu ulegnie dysocjacji elektrolitycznej:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kation amonu będzie wyłapywał aniony wodorotlenowe, a aniony azotanowe(III)
będą wyłapywały kationy wodorowe
Wskazywałoby to na to,
on albo słabo kwaśny, albo słabo zasadowy, w zale
Jeżeli zasada jest słabsza od kwasu to st
stężenia anionów wodorotlenowych i odczyn roztworu b
odwrotnej odczyn będzie słabo zasadowy.
Zapisując reakcję hydrolizy w formie jonowej, otrzymamy:
Przykład 7. Napisz reakcje hydrolizy octanu amonu
Rozwiązanie:
octan amonu: CH
3
COONH
reakcja dysocjacji: CH
słabych elektrolitów, więc ulegaj
reakcja dysocjacji wody:
reakcja hydrolizy: CH
4.4
Reakcje otrzymywania słabych elektrolitów.
Słabe kwasy można otrzyma
schematu:
Sól słabego kwasu i mocnej zasady + mocny kwas
kwasu i mocnej zasady.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
40
dzie wyłapywał aniony wodorotlenowe, a aniony azotanowe(III)
wyłapywały kationy wodorowe
NH
4
+
+ OH
-
NH
3
+ H
2
O
H
+
+ NO
2
-
HNO
2
Wskazywałoby to na to, że odczyn roztworu będzie obojętny. W rzeczywisto
ny, albo słabo zasadowy, w zależności od mocy powstają
łabsza od kwasu to stężenie kationów wodorowych jest nieco wi
enia anionów wodorotlenowych i odczyn roztworu będzie słabo kwa
dzie słabo zasadowy.
hydrolizy w formie jonowej, otrzymamy:
NO
2
-
+ NH
4
+
NH
3
+ HNO
2
Napisz reakcje hydrolizy octanu amonu.
COONH
4
CH
3
COONH
4
→
CH
3
COO
-
+ NH
4
+
– oba jony pochodz
c ulegają hydrolizie.
reakcja dysocjacji wody: H
2
O H
+
+ OH
-
CH
3
COO
-
+ NH
4
+
+ H
2
O CH
3
COOH + NH
Reakcje otrzymywania słabych elektrolitów.
na otrzymać wypierając je mocnym kwasem z roztworu ich soli wg
Sól słabego kwasu i mocnej zasady + mocny kwas
→
słaby kwas + sól mocnego
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
dzie wyłapywał aniony wodorotlenowe, a aniony azotanowe(III)
tny. W rzeczywistości jest
ci od mocy powstających elektrolitów.
enie kationów wodorowych jest nieco większe od
dzie słabo kwaśny. W sytuacji
oba jony pochodzą od
COOH + NH
4
OH
c je mocnym kwasem z roztworu ich soli wg
słaby kwas + sól mocnego

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 8. Zaproponuj sposób otrzymania kwasu azotowego (III). Reakcje napisz
cząsteczkowo i jonowo.
Rozwiązanie:
NaNO
2
+ HCl
→
HNO
Na
+
+ NO
2
-
+ H
+
+
H
+
+ NO
2
-
→
HNO
2
Słabe zasady można otrzyma
schematu:
Sól słabej zasady i mocnego kwasu + mocna zasada
mocnego kwasu i mocnej zasady.
Jest to najprostszy sposób uzyskania wodorotlenków amfoterycznych, które str
się w postaci trudno rozpuszczalnego osadu.
Przykład 9. Zaproponuj sposób otrzymania wodorotlenku amonu. Reakcje napisz
cząsteczkowo i jonowo.
Rozwiązanie:
NH
4
Cl + NaOH
→
NH
NH
4
+
+ Cl
-
+ Na
+
+ OH
NH
4
+
+ OH
-
→
NH
4
OH
NH
4
OH
→
NH
3
+ H
4.5
Reakcje utleniania i redukcji.
Sposób doboru współczynników w jonowych reakcjach utleniania i redukcji jest taki
sam jak w przypadku cząsteczkowych reakcji (rozdz. 3). Nale
przypadku jonu prostego stopie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
41
Zaproponuj sposób otrzymania kwasu azotowego (III). Reakcje napisz
HNO
2
+ NaCl
+ Cl
-
→
HNO
2
+ Na
+
+ Cl
-
na otrzymać wypierając je mocną zasadą z roztworu ich soli wg
Sól słabej zasady i mocnego kwasu + mocna zasada
→
słaba zasada + sól
j zasady.
Jest to najprostszy sposób uzyskania wodorotlenków amfoterycznych, które str
w postaci trudno rozpuszczalnego osadu.
Zaproponuj sposób otrzymania wodorotlenku amonu. Reakcje napisz
NH
4
OH + NaCl
+ OH
-
→
NH
4
OH + Na
+
+ Cl
-
OH
+ H
2
O
Reakcje utleniania i redukcji.
Sposób doboru współczynników w jonowych reakcjach utleniania i redukcji jest taki
steczkowych reakcji (rozdz. 3). Należy tylko pami
przypadku jonu prostego stopień utlenienia jest równy ładunkowi jonu a dla jonu zło
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Zaproponuj sposób otrzymania kwasu azotowego (III). Reakcje napisz
z roztworu ich soli wg
słaba zasada + sól
Jest to najprostszy sposób uzyskania wodorotlenków amfoterycznych, które strącają
Zaproponuj sposób otrzymania wodorotlenku amonu. Reakcje napisz
Sposób doboru współczynników w jonowych reakcjach utleniania i redukcji jest taki
y tylko pamiętać o tym, że w
utlenienia jest równy ładunkowi jonu a dla jonu złożonego
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
suma stopni utlenienia pierwiastków tworz
całości.
Przykład 10. Ustal stopnie utlenienia pierwiastków tworz
siarczanowy(VI), anion chloranowy(VII)
Rozwiązanie:
W anionie siarczanowym(VI)
+6 stopniu utlenienia aby suma wynosiła
tworzących dany jon musi być
W anionie chloranowym(VII)
+7 stopniu utlenienia aby suma wynosiła
Przykład 11. Dobierz współczynniki w reakcji:
MnO
4
-
+ Cl
-
+ H
+
→
Rozwiązanie:
W powyższej reakcji stopie
0). Równania reakcji połówkowych wygl
Jeśli suma elektronów pobranych ma by
równanie (a) należy pomnożyć
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
42
suma stopni utlenienia pierwiastków tworzących jon jest równa ładunkowi tego jonu jako
Ustal stopnie utlenienia pierwiastków tworzących następuj
siarczanowy(VI), anion chloranowy(VII).
anionie siarczanowym(VI) tlen jest na -2 stopniu utlenienia a więc siarka musi by
utlenienia aby suma wynosiła -2, ponieważ suma stopni utlenienia pierwiastków
cych dany jon musi być równa ładunkowi tego jonu jako całości.
anionie chloranowym(VII) tlen jest na -2 stopniu utlenienia a więc chlor musi by
+7 stopniu utlenienia aby suma wynosiła -1.
współczynniki w reakcji:
→
Mn
2+
+ Cl
2
+ H
2
O
szej reakcji stopień utlenienia zmienia mangan (z +7 na +2) i chlor (z
0). Równania reakcji połówkowych wyglądają więc następująco:
li suma elektronów pobranych ma być równa sumie elektronów oddanych to
ż
yć przez 2, a (b) przez 5, co daje równanie:
SO
4
+6 -2
2-
ClO
4
-
+7 -2
(a)
Mn + 5e Mn
+7
+2
2+
Cl - 2e Cl
-1
0
(b)
2
-
2Mn + 10Cl 2Mn + 5Cl
2
2+
0
-
+7
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
cych jon jest równa ładunkowi tego jonu jako
cych następujące jony: anion
2 stopniu utlenienia a więc siarka musi być na
suma stopni utlenienia pierwiastków
2 stopniu utlenienia a więc chlor musi być na
utlenienia zmienia mangan (z +7 na +2) i chlor (z -1 na
równa sumie elektronów oddanych to

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Współczynniki z reakcji połówkowych nale
ilość jonów H
+
. Ostatecznie reakcja przedstawia si
2MnO
4
-
+ 10Cl
4.6
Zadania do rozwią
1.
Napisz równania dysocjacji elektrolitycznej nast
siarkowy(IV), węglowy, chlorowy(VII), chlorowy
2.
Napisz równania dysocjacji elektrolitycznej nast
cyny(II), srebra, żelaza(III), glinu.
3.
Napisz równania dysocjacji elektrolitycznej nast
siarczan(VI) magnezu, octan ołowiu(II), fosforan(V) wapnia, manganian(VII) potasu.
4.
Napisz równania hydrolizy nast
węglan wapnia, węglan amonu, mrówczan amonu, chlorek
potasu, bromek magnezu, siarczek wapnia, siarczan(VI) sodu, siarczan(IV) amonu.
5.
Napisz reakcje zobojętniania:
a)
kwas siarkowy(VI) + wodorotlenek
b)
kwas solny + wodorotlenek glinu
c)
kwas ortofosforowy(V) + wodorotlenek baru
d)
kwas octowy + wodorotlenek cyny(II)
e)
kwas azotowy(V) + wodorotlenek wapnia
6.
Na podstawie przykładu 8 i 9 zaproponuj sposób otrzymania nast
elektrolitów: kwasu octowego, kwasu w
ołowiu(II).
7.
Dobierz współczynniki w nast
a)
ClO
4
-
+ H
+
→
b)
NO
3
-
+ H
+
+ S
c)
Mg + NO
3
-
+ H
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
43
Współczynniki z reakcji połówkowych należy przenieść do reakcji wyjciowej i ustali
. Ostatecznie reakcja przedstawia się następująco:
+ 10Cl
-
+ 16H
+
→
2Mn
2+
+ 5Cl
2
+ 8H
2
O
rozwiązania na ćwiczeniach.
Napisz równania dysocjacji elektrolitycznej następujących kwasów: siarkowy(VI),
glowy, chlorowy(VII), chlorowy(III), mrówkowy.
Napisz równania dysocjacji elektrolitycznej następujących wodorotlenków: wapnia,
elaza(III), glinu.
Napisz równania dysocjacji elektrolitycznej następujących soli: azotan(V) amonu,
siarczan(VI) magnezu, octan ołowiu(II), fosforan(V) wapnia, manganian(VII) potasu.
Napisz równania hydrolizy następujących soli (jeżeli reakcja zachodzi): azotan(V) baru,
glan amonu, mrówczan amonu, chlorek żelaza(III), chloran(VII)
potasu, bromek magnezu, siarczek wapnia, siarczan(VI) sodu, siarczan(IV) amonu.
ę
tniania:
kwas siarkowy(VI) + wodorotlenek potasu
kwas solny + wodorotlenek glinu
kwas ortofosforowy(V) + wodorotlenek baru
kwas octowy + wodorotlenek cyny(II)
kwas azotowy(V) + wodorotlenek wapnia
Na podstawie przykładu 8 i 9 zaproponuj sposób otrzymania nastę
kwasu octowego, kwasu węglowego, wodorotlenku żelaza(III), cyny(II),
Dobierz współczynniki w następujących reakcjach:
→
Cl
-
+ H
2
O
+ S
2-
→
NO + SO
4
2-
+ H
2
O
+ H
+
→
Mg
2+
+ N
2
O + H
2
O
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
do reakcji wyjciowej i ustalić
O
cych kwasów: siarkowy(VI),
cych wodorotlenków: wapnia,
cych soli: azotan(V) amonu,
siarczan(VI) magnezu, octan ołowiu(II), fosforan(V) wapnia, manganian(VII) potasu.
kcja zachodzi): azotan(V) baru,
elaza(III), chloran(VII)
potasu, bromek magnezu, siarczek wapnia, siarczan(VI) sodu, siarczan(IV) amonu.
Na podstawie przykładu 8 i 9 zaproponuj sposób otrzymania następujących słabych
ż
elaza(III), cyny(II),

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
d)
MnO
4
-
+ H
2
O
2
e)
I
2
+ OH
-
→
I
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
44
2
+ H
+
→
Mn
2+
+ O
2
+ H
2
O
I
-
+ IO
3
-
+ H
2
O
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
5
Ć
wiczenie 5. Podstaw
Roztwór to mieszanina jednorodna, która składa si
rozpuszczalnika.
Roztwór nasycony to roztwór, w którym została rozpuszczona maksymalna ilo
substancji. Np. w 100g wody w T=20
dalszym dodawaniu soli, każda wprowadzona porcja pozostanie na dnie naczynia.
Roztwór nienasycony
substancji.
5.1
Rozpuszczalność.
Ilość substancji niezbę
fizyczna zwana rozpuszczalno
rozpuszczanie, które oznacza zja
Rozpuszczalność jest to ilo
rozpuszczalnika w roztworze nasyconym w danej temperaturze. Rozpuszczalno
w rozpuszczalnikach jest bardzo zró
srebra w wodzie wynosi zaledwie 0,000008g, ale ju
Przykład 1. Jaka jest rozpuszczalno
rozpuścić 30g tej soli.
Rozwiązanie:
Układamy proporcję: w 150g wody znajduje si
To z definicji: w 100g wody b
Odpowiedź: Rozpuszczalno
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
45
Podstawy obliczeń chemicznych.
to mieszanina jednorodna, która składa się z substancji rozpuszczonej i z
to roztwór, w którym została rozpuszczona maksymalna ilo
substancji. Np. w 100g wody w T=20
°
C można rozpuścić tylko 36,3g NaCl i przy ka
ż
da wprowadzona porcja pozostanie na dnie naczynia.
Roztwór nienasycony to roztwór, w którym można jeszcze rozpu
substancji niezbędna do uzyskania roztworu nasyconego okre
rozpuszczalnością. Nazwy tej nie należy mylić
, które oznacza zjawisko fizyczne.
jest to ilość gramów substancji przypadaj
rozpuszczalnika w roztworze nasyconym w danej temperaturze. Rozpuszczalno
w rozpuszczalnikach jest bardzo zróżnicowana. Np. w T=20
°
C rozpuszczalno
srebra w wodzie wynosi zaledwie 0,000008g, ale już chlorku sodu 36g i fluorku cezu a
Jaka jest rozpuszczalność soli, jeżeli w 150g wody maksymalnie mo
ę
: w 150g wody znajduje się 30g substancji
To z definicji: w 100g wody będzie x g substancji
x
100 30
150
20
Rozpuszczalność tej soli wynosiła 20g.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
z substancji rozpuszczonej i z
to roztwór, w którym została rozpuszczona maksymalna ilość
tylko 36,3g NaCl i przy każdym
da wprowadzona porcja pozostanie na dnie naczynia.
na jeszcze rozpuścić pewną ilość
dna do uzyskania roztworu nasyconego określa wielkość
y mylić z określeniem
gramów substancji przypadająca na 100g
rozpuszczalnika w roztworze nasyconym w danej temperaturze. Rozpuszczalność substancji
C rozpuszczalność bromku
chlorku sodu 36g i fluorku cezu aż 366g.
eli w 150g wody maksymalnie można
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
5.2
Stężenie procentowe roztworu.
Zawartości substancji rozpuszczonej w okre
roztworu. W praktyce najczęś
procentowe i stężenie molowe.
Stężenie procentowe
roztworu. Zależność tą można zdefiniowa
Pamiętając o tym, że roztwór składa si
mamy:
Przykład 2. Ile gramów chlorku sodu znajduje si
Rozwiazanie:
Zadanie to można rozwi
z proporcji.
Sposób a
Sposób b
Z definicji: w 100g roztworu s
więc w 200g roztworu b
Odpowiedź: W danym roztworze jest 6g NaCl.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
46
enie procentowe roztworu.
ci substancji rozpuszczonej w określonej ilości roztworu to
praktyce najczęściej stosuje się dwa sposoby wyrażania st
enie molowe.
enie procentowe określa ilość gramów substancji rozpuszczonej w 100g
ż
na zdefiniować wzorem:
p
m
s
m
r
100%
ż
e roztwór składa się z rozpuszczalnika i substancji rozpuszczonej
p
m
s
m
s
m
rozp
100%
Ile gramów chlorku sodu znajduje się w 200g 3% roztworu?
na rozwiązać na dwa sposoby: albo korzystają
p
s
r
100% ⇒
s
p
!
r
"##%
m
s
200 3
100
6g
Z definicji: w 100g roztworu są 3g substancji,
ę
c w 200g roztworu będzie xg substancji.
x
200 3
100
6g
W danym roztworze jest 6g NaCl.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ci roztworu to stężenie
ż
ania stężeń: stężenie
gramów substancji rozpuszczonej w 100g
z rozpuszczalnika i substancji rozpuszczonej
na dwa sposoby: albo korzystając ze wzoru, albo
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 3. Ile gramów chlorku sodu znajduje si
1,03g/cm
3
?
Rozwiazanie:
Najpierw przeliczamy jednostki: V
Potem obliczamy masę
Dalszą część zadania mo
albo z proporcji.
Sposób a
Sposób b
Z definicji: w 100g roztworu s
więc w 206g
Odpowiedź: W danym roztworze jest 6,18g NaCl.
5.3
Stężenie molowe roztworu.
Stężenie molowe okre
w 1dm
3
roztworu. Zależność tą
Przykład 4. Oblicz stężenie molowe solanki otrzymanej w wyniku rozpuszczenia 5g chlorku
sodu w 0,1dm
3
wody. Gęstość roztworu wynosi 1,03g/cm
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
47
Ile gramów chlorku sodu znajduje się w 0,2dm
3
3% roztworu o g
Najpierw przeliczamy jednostki: V
r
= 0,2dm
3
= 200cm
3
Potem obliczamy masę roztworu korzystając ze wzoru na gęstość
%
!&
'&
⇒
r
d V
r
m
r
= 1,03 × 200 = 206g
zadania można rozwiązać na dwa sposoby: albo korzystaj
p
s
r
100% ⇒
s
p
!
r
"##%
m
s
206 3
100
6,18g
Z definicji: w 100g roztworu są 3g substancji,
ę
c w 206g roztworu będzie xg substancji.
x
206 3
100
6,18g
W danym roztworze jest 6,18g NaCl.
enie molowe roztworu.
określa liczbę moli substancji rozpuszczonej znajduj
ść
tą można zdefiniować wzorem:
C
m
,
s
-
r
enie molowe solanki otrzymanej w wyniku rozpuszczenia 5g chlorku
ść
roztworu wynosi 1,03g/cm
3
.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
3% roztworu o gęstości
na dwa sposoby: albo korzystając ze wzoru,
moli substancji rozpuszczonej znajdujących się
enie molowe solanki otrzymanej w wyniku rozpuszczenia 5g chlorku
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Rozwiazanie:
Najpierw obliczamy mas
Potem wyliczamy liczno
aby można było obliczy
substancji obliczyć objętość roztworu
m
r
= m
s
+ m
rozp
= 5 + 100 = 105g
d
r
= 1,03g/cm
3
= 1030g/dm
%
!
r
'
r
⇒ -
r
!
r
.
"#/
"#0#
Ostatecznie:
Cm
1
s
2
r
Odpowiedź: Stężenie molowe tego roztworu wynosi 1mol /dm
5.4
Przeliczanie stężeń
Jeżeli dysponuje się roztworem o znanym st
znajomość stężenia molowego, mo
roztworu i wzór substancji rozpuszczonej.
Przeliczenie stężenia procentowego na molowe:
Wzór na stężenie molowe to:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
48
Najpierw obliczamy masę molową chlorku sodu: M
NaCl
= 23 + 35 = 58g/mol
wyliczamy liczność NaCl:
n
s
m
s
s
5
58
0,1mola
na było obliczyć stężenie molowe solanki trzeba jeszcze oprócz liczno
ść
roztworu
= 5 + 100 = 105g
= 1030g/dm
3
"#/
"#0#
0,1dm
0
#,"
#,"
1mol/dm
3
enie molowe tego roztworu wynosi 1mol /dm
3
.
ęż
eń.
ę
roztworem o znanym stężeniu procentowym, a potrzebna jest
enia molowego, można przeliczyć stężenie, jeżeli zna się dodatkowo g
roztworu i wzór substancji rozpuszczonej.
enia procentowego na molowe:
enie molowe to:
C
m
,
s
-
r
Skoro
%
!
r
'
r
⇒ -
r
!
r
.
, a
n
s
!
s
5s
to:
C
m
m
s
s
%
r
m
s
r
%
s
m
s
r
p
100
C
m
C
p
d
100
s
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
= 23 + 35 = 58g/mol
enie molowe solanki trzeba jeszcze oprócz liczności
eniu procentowym, a potrzebna jest
eli zna się dodatkowo gęstość
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Można również przeliczy
tych samych warunków:
Wyrażenia na m
s
i m
r
wstawiamy do wzoru na st
Skoro
m
6
s
'
r
to:
Przykład 5. Ilu procentowy jest 2 molowy roztwór kwasu solnego o g
Rozwiazanie:
Zakładamy, że V
r
= 1dm
%
m
n
s
p
Odpowiedź: Stężenie procentowe tego roztworu wynosi 7%.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
49
przeliczyć stężenie molowe na stężenie procentowe
n
s
!
s
5
s
⇒ m
s
= n × M
s
%
!
r
'
r
⇒ m
r
= d × V
r
wstawiamy do wzoru na stężenie procentowe:
p
m
s
m
r
100%
p
7
ssss
M
s
100
9
rrrr
d
p
:
m
m
m
m
M
s
100
d
Ilu procentowy jest 2 molowy roztwór kwasu solnego o gęstoś
= 1dm
3
!
r
'
r
⇒ m
r
= d × V
r
= 1 × 1050 = 1050g
6
s
'
r
⇒ n
s
= C
m
× V
r
= 1 × 2 = 2 mole
!;
5<
⇒ m
s
= n × M
s
= 2 × 36,5 = 73g
m
s
m
r
100%
73
1050
100% 7%
enie procentowe tego roztworu wynosi 7%.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
enie procentowe przy spełnieniu
enie procentowe:
ę
stości 1,05g/cm
3
?
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 6. Jakie jest stężenie molowe 38% roztworu HCl o g
Rozwiazanie:
Zakładamy, że m
r
= 100g, wówczas z definicji st
%
Odpowiedź: Roztwór w zadaniu był 12,4 molowy.
5.5
Rozcieńczanie lub zat
Czasami rozcieńcza się
molowym. Wówczas trzeba dokona
W roztworze nasyconym st
z dalszym dodawaniem substancji. Podobnie
substancji nie wpłynie na stężenie substancji w roztworze nasyconym.
Przykład 7. Ile gramów 10% kwasu octowego potrzeba do sporz
o gęstości 1,02g/cm
3
?
Rozwiazanie:
Najpierw uzgadniamy jed
Potem obliczamy masę
Następnie dysponując mas
wzoru na stężenie procentowe mo
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
50
ęż
enie molowe 38% roztworu HCl o gęstości 1,19g/cm
= 100g, wówczas z definicji stężenia procentowego m
!
r
'
r
⇒ -
r
!
r
.
"##
"">#
0,084 dm
3
n
s
!
s
5
s
0?
0@,/
1,04mola
m
6
s
'
r
",#A
#,#?A
= 12,4 mol/dm
3
r w zadaniu był 12,4 molowy.
czanie lub zatężanie roztworu.
cza się lub zatęża roztwór o konkretnym stężeniu procentowym lub
molowym. Wówczas trzeba dokonać konkretnych przeliczeń.
W roztworze nasyconym stężenie substancji rozpuszczonej pozostaje bez zmian wraz
z dalszym dodawaniem substancji. Podobnie odsączanie osadu lub oddzielenie nadmiaru
ęż
enie substancji w roztworze nasyconym.
Ile gramów 10% kwasu octowego potrzeba do sporządzenia 0,5dm
Najpierw uzgadniamy jednostki gęstości i objętości: V
r
= 0,5dm
3
Potem obliczamy masę roztworu końcowego ze wzoru na gęstość:
%
!
r
'
r
⇒
r
d V
r
m
r
= 1,02 × 500 = 510g
ą
c masą roztworu końcowego oraz stężeniem tego roztworu, ze
enie procentowe możemy wyliczyć masę substancji
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ci 1,19g/cm
3
?
enia procentowego m
s
= 38g.
ęż
eniu procentowym lub
enie substancji rozpuszczonej pozostaje bez zmian wraz
czanie osadu lub oddzielenie nadmiaru
dzenia 0,5dm
3
2% roztworu
= 500cm
3
eniem tego roztworu, ze

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Ponieważ źródłem substancji rozpuszczonej jest roztwór 10%, wi
obu roztworach będzie taka sama.
Końcowym etapem rozwi
początkowego:
Odpowiedź: Potrzeba 102g roztworu.
Przykład 8. Ile cm
3
12 molowego roztworu HCl potrzeba do sporz
molowego roztworu?
Rozwiazanie:
Najpierw obliczamy ilość
m
Ponieważ źródłem substancji jest pierwszy roztw
pierwotnego roztworu.
C
m
6
2
Odpowiedź: Potrzeba 33 cm
5.6
pH roztworu.
Woda, dla wielu substancji u
elektrolit jest minimalnie zdysocjowana na jony:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
51
p
!
s
!
r
100% ⇒
s
p
!
r
"##%
m
s
2 510
100
10,2g
ródłem substancji rozpuszczonej jest roztwór 10%, więc ilo
dzie taka sama.
cowym etapem rozwiązania zadania będzie obliczenie masy roztworu
p
!
s
!
r
100% ⇒
r
!
s
"##
B
m
r
10,2 100
10
102g
Potrzeba 102g roztworu.
12 molowego roztworu HCl potrzeba do sporzą
obliczamy ilość moli substancji jaka znajduje się w końcowym roztworze.
6
s
'
r
⇒ n
s
= C
m
× V
r
= 2 × 0,2 = 0,4mola
ródłem substancji jest pierwszy roztwór, więc możemy obliczy
6
s
2
r
⇒
-
r
6
s
m
#,A
"C
0,033 dm
3
= 33 cm
3
Potrzeba 33 cm
3
roztworu kwasu solnego.
Woda, dla wielu substancji używana jako rozpuszczalnik, sama jako bardzo słaby
elektrolit jest minimalnie zdysocjowana na jony:
2H
2
O H
3
O
+
+ OH
-
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ródłem substancji rozpuszczonej jest roztwór 10%, więc ilość substancji w
dzie obliczenie masy roztworu
12 molowego roztworu HCl potrzeba do sporządzenia 200cm
3
2
ń
cowym roztworze.
ż
emy obliczyć objętość
ywana jako rozpuszczalnik, sama jako bardzo słaby

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
co w uproszczeniu zapisuje si
Roztwór spełniający warunek: [H
odczyn kwaśny. Podobnie roztwór, w którym [H
odczynie zasadowym).
Kationy wodorowe powstaj
wodorotlenowe – podczas dysocjacji zasad. Mo
jednocześnie bardzo słabym kwasem i bardzo słab
jonów H
+
i OH
-
powstałych w procesie dysocjacji s
obojętny.
Iloczyn stężenia jonów wodorowych i wodorotlenowych jest wielko
i nazywany jest iloczynem jonowym wody
K
w
Stąd wynika, że dla czystej wody [H
Dla ułatwienia obliczeń
pojęcie wykładnika stężenia jonów wodorowych
dziesiętnym ze stężenia jonów wodorowych:
Analogicznie
można
napisa
wodorotlenowych, czyli pOH:
Po zlogarytmowaniu ze znakiem ujemnym wyra
otrzymamy:
Skoro iloczyn stężeń molowych jonów wodorowych i wodorotlenowych ma warto
stałą, to do określenia odczynu roztworu wystarczy zna
np.: gdy [H
+
] = 10
-2
mol/dm
3
, to [OH
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
52
co w uproszczeniu zapisuje się:
H
2
O H
+
+ OH
-
cy warunek: [H
+
] > [OH
-
] nazywamy kwaśnym, lub mówimy, ze ma
ny. Podobnie roztwór, w którym [H
+
] < [OH
-
] określamy jako zasadowy (o
owe powstają podczas dysocjacji elektrolitycznej kwasów, a aniony
podczas dysocjacji zasad. Można stąd wyciągnąć wniosek,
nie bardzo słabym kwasem i bardzo słabą zasadą o tej samej mocy, poniewa
powstałych w procesie dysocjacji są sobie równe. Odczyn wody jest wi
enia jonów wodorowych i wodorotlenowych jest wielko
iloczynem jonowym wody (K
w
)
= [H
+
] × [OH
-
] = 1×10
-14
mol/dm
3
dla czystej wody [H
+
] = [OH
-
] = 1×10
-7
mol/dm
3
Dla ułatwienia obliczeń, zamiast stężenia jonów wodorowych [H
enia jonów wodorowych (pH), który jest ujemnym logarytmem
enia jonów wodorowych:
pH = - log [H
+
]
ż
na
napisać
wyrażenie
na
wykładnik
st
, czyli pOH:
pOH = - log [OH
-
]
Po zlogarytmowaniu ze znakiem ujemnym wyrażenia na iloczyn jonowy wody
[H
+
] × [OH
-
] = 1×10
-14
pH + pOH = 14
ęż ń
molowych jonów wodorowych i wodorotlenowych ma warto
lenia odczynu roztworu wystarczy znać stężenie tylko jednego z tych jonów,
, to [OH
-
] = 10
-12
mol/dm
3
.
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
nym, lub mówimy, ze ma
lamy jako zasadowy (o
podczas dysocjacji elektrolitycznej kwasów, a aniony
wniosek, że woda jest
o tej samej mocy, ponieważ ilości
sobie równe. Odczyn wody jest więc
enia jonów wodorowych i wodorotlenowych jest wielkością stałą
enia jonów wodorowych [H
+
], wprowadzono
(pH), który jest ujemnym logarytmem
wykładnik
stężenia
jonów
enia na iloczyn jonowy wody
molowych jonów wodorowych i wodorotlenowych ma wartość
enie tylko jednego z tych jonów,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład 9. Obliczyć pH i pOH 0,001 molowego roztworu kwasu solnego.
Rozwiazanie:
Kwas solny jest mocnym elektrolitem, wi
HCl
→
H
+
+ Cl
-
[H
+
] = C
m
= 0,001
pH = - log [H
+
] = - log 0,001 = 3
pOH = 14 – pH = 14 –
Odpowiedź: Roztwór ten ma pH = 3 i pOH = 11.
5.7
Zadania do rozwią
1.
W 200g nasyconego roztworu chlorku amonu w pewnej temperaturze znajduje si
soli. Jaka jest rozpuszczalno
2.
Ile miligramów tlenu rozpuś
temperaturze wynosi 0,0043g. Odp. 43mg
3.
Ile kg wody należy wlać do 3kg sacharozy, aby otrzyma
27g
4.
W 180cm
3
wody destylowanej rozpuszczono 20cm
Oblicz stężenie procentowe
5.
Oblicz stężenie procentowe tlenu rozpuszczonego w wodzie deszczowej wiedz
tej wody zawiera 50mg rozpuszczonego tlenu. Odp. 0,005%
6.
Ile gramów jodu i ile cm
3
jodyny, czyli 10% roztworu jodu w etanolu? Odp. m
7.
Oblicz stężenie procentowe nasyconego roztworu substancji, je
wynosi 36g. Odp. 26%
8.
Do 100g 10% roztworu dodano 2g wodorotlenku sodu. Oblicz st
otrzymanego roztworu. Odp. 12%
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
53
pH i pOH 0,001 molowego roztworu kwasu solnego.
Kwas solny jest mocnym elektrolitem, więc
log 0,001 = 3
3 = 11
Roztwór ten ma pH = 3 i pOH = 11.
Zadania do rozwiązania na ćwiczeniach.
W 200g nasyconego roztworu chlorku amonu w pewnej temperaturze znajduje si
soli. Jaka jest rozpuszczalność tego związku? Odp. R = 55,6g
Ile miligramów tlenu rozpuści się w 20°C w litrze wody jeżeli jego rozpus
temperaturze wynosi 0,0043g. Odp. 43mg
ć
do 3kg sacharozy, aby otrzymać roztwór o stęż
wody destylowanej rozpuszczono 20cm
3
etanolu o gęsto
enie procentowe otrzymanego roztworu. Odp. 8,1%
enie procentowe tlenu rozpuszczonego w wodzie deszczowej wiedz
tej wody zawiera 50mg rozpuszczonego tlenu. Odp. 0,005%
3
etanolu o gęstości 0,78kg/dm
3
potrzeba do sporz
jodyny, czyli 10% roztworu jodu w etanolu? Odp. m
s
= 1g, V
rozp
= 11,4cm
enie procentowe nasyconego roztworu substancji, jeżeli jej rozpuszczalno
Do 100g 10% roztworu dodano 2g wodorotlenku sodu. Oblicz stęż
otrzymanego roztworu. Odp. 12%
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
pH i pOH 0,001 molowego roztworu kwasu solnego.
W 200g nasyconego roztworu chlorku amonu w pewnej temperaturze znajduje się 71,5g
eli jego rozpuszczalność w tej
roztwór o stężeniu 10%. Odp.
ę
stości d=0,79g/cm
3
.
enie procentowe tlenu rozpuszczonego w wodzie deszczowej wiedząc, że 1dm
3
potrzeba do sporządzenia 10g
= 11,4cm
3
eli jej rozpuszczalność
Do 100g 10% roztworu dodano 2g wodorotlenku sodu. Oblicz stężenie procentowe

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
9.
Do 300g 10% roztworu dodano 100ml wody. Oblicz st
roztworu. Odp. 7,5%
10.
Ile cm
3
wody należy odparowa
67g
11.
Zmieszano 80g 20% roztworu kwasu so
stężenie procentowe otrzymanego roztworu. Odp. 14%
12.
Ile gramów chlorku żelaza(II) nale
stężeniu 0,1mol/dm
3
? Odp. 1,3g
13.
Oblicz stężenie molowe roztworu otrzymanego w wyn
wodorotlenku sodu w 100g wody (d = 1,02 g/cm
14.
Oblicz masę molową substancji, której 20g rozpuszczono w 250ml 2 molowego roztworu.
Odp. 40g/mol
15.
Do jakiej objętości należy rozcie
0,5 molowy? Odp. 200cm
3
16.
255cm
3
roztworu kwasu siarkowego o nieznanym st
0,5kg 10% roztworu. Oblicz st
17.
Ile cm
3
9,8 molowego roztworu nadtlenku wodoru (H
3% roztworu? Odp. 9cm
3
18.
10ml 38% roztworu HCl o g
stężenie molowe tak otrzymanego roztworu. Odp. 0,25 mol/dm
19.
Z 500g 4% roztworu wodorotlenku sodu odparowano 100ml wody. O
molowe otrzymanego roztworu (d = 1,05 g/cm
20.
Oblicz stężenie procentowe 12,5 molowego roztworu wodorotlenku potasu, którego
gęstość wynosi 1,48 g/cm
3
21.
Oblicz stężenie molowe 10% roztworu bromku potasu o g
1mol/dm
3
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
54
Do 300g 10% roztworu dodano 100ml wody. Oblicz stężenie procentowe otrzymanego
y odparować z 200g 10% roztworu aby stężenie wzrosło do 15%? Odp.
Zmieszano 80g 20% roztworu kwasu solnego i 120g 10% roztworu tego kwasu. Oblicz
enie procentowe otrzymanego roztworu. Odp. 14%
ż
elaza(II) należy odważyć w celu otrzymania 100ml roztworu o
? Odp. 1,3g
enie molowe roztworu otrzymanego w wyniku rozpuszczenia 5g stałego
wodorotlenku sodu w 100g wody (d = 1,02 g/cm
3
). Odp. 1,25 mol/dm
3
substancji, której 20g rozpuszczono w 250ml 2 molowego roztworu.
ż
y rozcieńczyć 5cm
3
2 molowego roztworu aby otrzyma
3
roztworu kwasu siarkowego o nieznanym stężeniu zmieszano z wod
0,5kg 10% roztworu. Oblicz stężenie molowe wyjściowego roztworu kwasu.
9,8 molowego roztworu nadtlenku wodoru (H
2
O
2
) trzeba użyć aby otrzyma
10ml 38% roztworu HCl o gęstości 1,19kg/dm
3
rozcieńczono do objętoś
enie molowe tak otrzymanego roztworu. Odp. 0,25 mol/dm
3
Z 500g 4% roztworu wodorotlenku sodu odparowano 100ml wody. O
molowe otrzymanego roztworu (d = 1,05 g/cm
3
). Odp. 1,3 mol/dm
3
enie procentowe 12,5 molowego roztworu wodorotlenku potasu, którego
3
. Odp. 47%
enie molowe 10% roztworu bromku potasu o gęstości
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
enie procentowe otrzymanego
enie wzrosło do 15%? Odp.
lnego i 120g 10% roztworu tego kwasu. Oblicz
w celu otrzymania 100ml roztworu o
iku rozpuszczenia 5g stałego
substancji, której 20g rozpuszczono w 250ml 2 molowego roztworu.
aby otrzymać roztwór
eniu zmieszano z wodą otrzymując
ciowego roztworu kwasu.
ż ć
aby otrzymać 100g
ę
tości 500cm
3
. Oblicz
Z 500g 4% roztworu wodorotlenku sodu odparowano 100ml wody. Oblicz stężenie
enie procentowe 12,5 molowego roztworu wodorotlenku potasu, którego
ś
ci 1,16kg/dm
3
. Odp.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
22.
W warunkach normalnych w wodzie rozpuszczono 5,6dm
roztworu dopełniono do 0,5dm
0,5mol/dm
3
23.
Oblicz stężenie molowe roztworu jednoprotonowego kwasu o pH ró
0,003mol/dm
3
24.
Oblicz stężenie molowe roztworu jednoprotonowej zasady o pH równym 11,5. Odp.
0,003mol/dm
3
25.
Oblicz pH i pOH 0,0005 molowego roztworu wodorotlenku wapnia. Odp. pH = 3, pOH =
11
26.
Oblicz stężenie molowe i pH roztworu powstałego po ro
potasu w litrze wody. Odp. 0,0001 mol/dm
27.
Do 50cm³ roztworu NaOH o pH 12,63 wlano pewn
11,88. Ile cm
3
wody dolano? Odp. 233cm
28.
Do 50ml roztworu wodorotlenku potasu o pOH równym 1,2
pH tak przygotowanego roztworu. Odp. pH = 12
29.
37mg wodorotlenku wapnia rozpuszczono w 100cm
otrzymanego roztworu, gdy g
tego roztworu. Odp. 0,005
30.
Zmieszano 80cm
3
0,1 molowego roztworu kwasu solnego z 220cm
roztworu wodorotlenku sodu. Oblicz pH tak przygotowanego roztworu. Odp. pH = 2,1
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
55
W warunkach normalnych w wodzie rozpuszczono 5,6dm
3
tlenku siarki(VI). Obj
roztworu dopełniono do 0,5dm
3
. Oblicz stężenie molowe powstałego kwasu. Odp.
enie molowe roztworu jednoprotonowego kwasu o pH ró
enie molowe roztworu jednoprotonowej zasady o pH równym 11,5. Odp.
Oblicz pH i pOH 0,0005 molowego roztworu wodorotlenku wapnia. Odp. pH = 3, pOH =
enie molowe i pH roztworu powstałego po rozpuszczeniu 5,6mg wodorotlenku
potasu w litrze wody. Odp. 0,0001 mol/dm
3
i pH = 10
Do 50cm³ roztworu NaOH o pH 12,63 wlano pewną ilość wody uzyskuj
wody dolano? Odp. 233cm
3
Do 50ml roztworu wodorotlenku potasu o pOH równym 1,25 wlano 250ml wody. Oblicz
pH tak przygotowanego roztworu. Odp. pH = 12
37mg wodorotlenku wapnia rozpuszczono w 100cm
3
wody. Oblicz st
otrzymanego roztworu, gdy gęstość tego roztworu wynosi 1,02g/cm
3
tego roztworu. Odp. 0,005 mol/dm
3
i pH = 12
0,1 molowego roztworu kwasu solnego z 220cm
roztworu wodorotlenku sodu. Oblicz pH tak przygotowanego roztworu. Odp. pH = 2,1
kszenia liczby absolwentów kierunków
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
tlenku siarki(VI). Objętość
enie molowe powstałego kwasu. Odp.
enie molowe roztworu jednoprotonowego kwasu o pH równym 2,5. Odp.
enie molowe roztworu jednoprotonowej zasady o pH równym 11,5. Odp.
Oblicz pH i pOH 0,0005 molowego roztworu wodorotlenku wapnia. Odp. pH = 3, pOH =
zpuszczeniu 5,6mg wodorotlenku
wody uzyskując roztwór o pH
5 wlano 250ml wody. Oblicz
wody. Oblicz stężenie molowe
3
. Oblicz także pH
0,1 molowego roztworu kwasu solnego z 220cm
3
0,025 molowego
roztworu wodorotlenku sodu. Oblicz pH tak przygotowanego roztworu. Odp. pH = 2,1
Wyszukiwarka
Podobne podstrony:
WWW Kurs wyrównawczy z chemii nieorganicznej biotechnologia
WWW Kurs wyrównawczy z chemii organicznej
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
stechiometria1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
stechiometria2, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi3, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
ogniwa1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi2, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
stechiometria3, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Chromatografia Cieczowa, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Chromatografia cieczowa 2, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
redoksymetria zadania, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
Sprawozdanie 8 (tabela), studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, sprawozdania
Roztwory II, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
alkacymetria, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
więcej podobnych podstron