
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapi
Teresa Kołek
Alina Świzdor
Kurs wyrównawczy z
chemii nieorganicznej
Skrypt dla studentów kierunku Biotechnologia
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
Kurs wyrównawczy z
chemii nieorganicznej
Skrypt dla studentów kierunku Biotechnologia
Wrocław 2009
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
tał Ludzki współfinansowanego ze
ś
rodków
Kurs wyrównawczy z
chemii nieorganicznej

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kurs wyrównawczy z chemii nieorganicznej
dla kierunku Biotechnologia
Uniwersytet Przyrodniczy we Wrocławiu
Katedra Chemii
Materiały do kursu wyrównawczego z chemii nieorganicznej dla studentów
Kierunku Biotechnologia Uniwersytetu Przyrodniczego we Wrocławiu
w semestrze zimowym roku akademickieg
Kurs przeprowadzono w ramach Programu Operacyjnego Kapitał Ludzki
współfinansowanego ze środków Europejskiego Funduszu Społecznego
Redakcja merytoryczna: Zespół
Korekta: Anna Panek
© Copyright Katedra Chemii Uniwersytetu Przyrodniczego we Wrocławiu.
Wrocław 2009
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
2
Kurs wyrównawczy z chemii nieorganicznej
dla kierunku Biotechnologia
Uniwersytet Przyrodniczy we Wrocławiu
Materiały do kursu wyrównawczego z chemii nieorganicznej dla studentów
Kierunku Biotechnologia Uniwersytetu Przyrodniczego we Wrocławiu
w semestrze zimowym roku akademickiego 2009/2010
Kurs przeprowadzono w ramach Programu Operacyjnego Kapitał Ludzki
rodków Europejskiego Funduszu Społecznego
Redakcja merytoryczna: Zespół autorów
Katedra Chemii Uniwersytetu Przyrodniczego we Wrocławiu.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Spis treści
1.1
Właściwości pierwiastków w oparciu o poło
1.2
Dysocjacja elektrolityczna.
1.3
Reakcje w roztworach elektrolitów. Wzory strukturalne.
1.4
Dysocjacja wody, skala pH.
1.5
Hydroliza soli.
1.6
Zadania. ................................
1.6.1 Układanie równa
1.6.2 Hydroliza soli.
1.6.3 Układanie równa
2 ................................................................
2.1
Prawa chemiczne.
2.2
Mol i masy molowe; ustalanie wzoru chemicznego.
2.3
Obliczenia stechiometryczne.
2.4
Stężenia roztworów.
2.4.1 Stężenia procentowe
2.4.2 Stężenia molowe.
2.4.3 Obliczenia stechiometryczne z uwzgl
2.5
Zadania. ................................
2.5.1 Mol i masa molowa; ustalanie wzoru chemicznego; stechiometria.
2.5.2 Stężenia roztworów.
2.5.3 Zadania stechiometryczne z uwzgl
2.5.4 Stopień dysocjacji; wykładnik
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
3
ci pierwiastków w oparciu o położenie w układzie okresowym.
Dysocjacja elektrolityczna. ................................................................
Reakcje w roztworach elektrolitów. Wzory strukturalne. ................................
Dysocjacja wody, skala pH. ................................................................
................................................................................................
................................................................................................
Układanie równań reakcji chemicznych. ..............................................................
Hydroliza soli. ................................................................................................
danie równań reakcji w podanych schematach. ................................
................................................................................................
Prawa chemiczne. ................................................................................................
sy molowe; ustalanie wzoru chemicznego. ................................
Obliczenia stechiometryczne. ................................................................
enia roztworów. ................................................................................................
enia procentowe ................................................................
enia molowe. ................................................................................................
Obliczenia stechiometryczne z uwzględnieniem stężeń roztworów.
................................................................................................
Mol i masa molowa; ustalanie wzoru chemicznego; stechiometria.
enia roztworów. ................................................................
Zadania stechiometryczne z uwzględnieniem stężeń roztworów.
dysocjacji; wykładnik stężenia jonów wodorowych. ..............................
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
enie w układzie okresowym. ............... 4
.......................................................... 7
........................................... 9
...................................................... 14
........................................... 16
..................................................... 20
.............................. 20
...................................... 22
............................................ 22
................................................ 23
...................................... 24
................................................. 24
.................................................... 26
.................................. 30
............................................................. 30
.................................. 34
roztworów. .................... 37
..................................................... 41
Mol i masa molowa; ustalanie wzoru chemicznego; stechiometria. .................... 41
............................................................. 43
roztworów. ....................... 44
.............................. 45
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
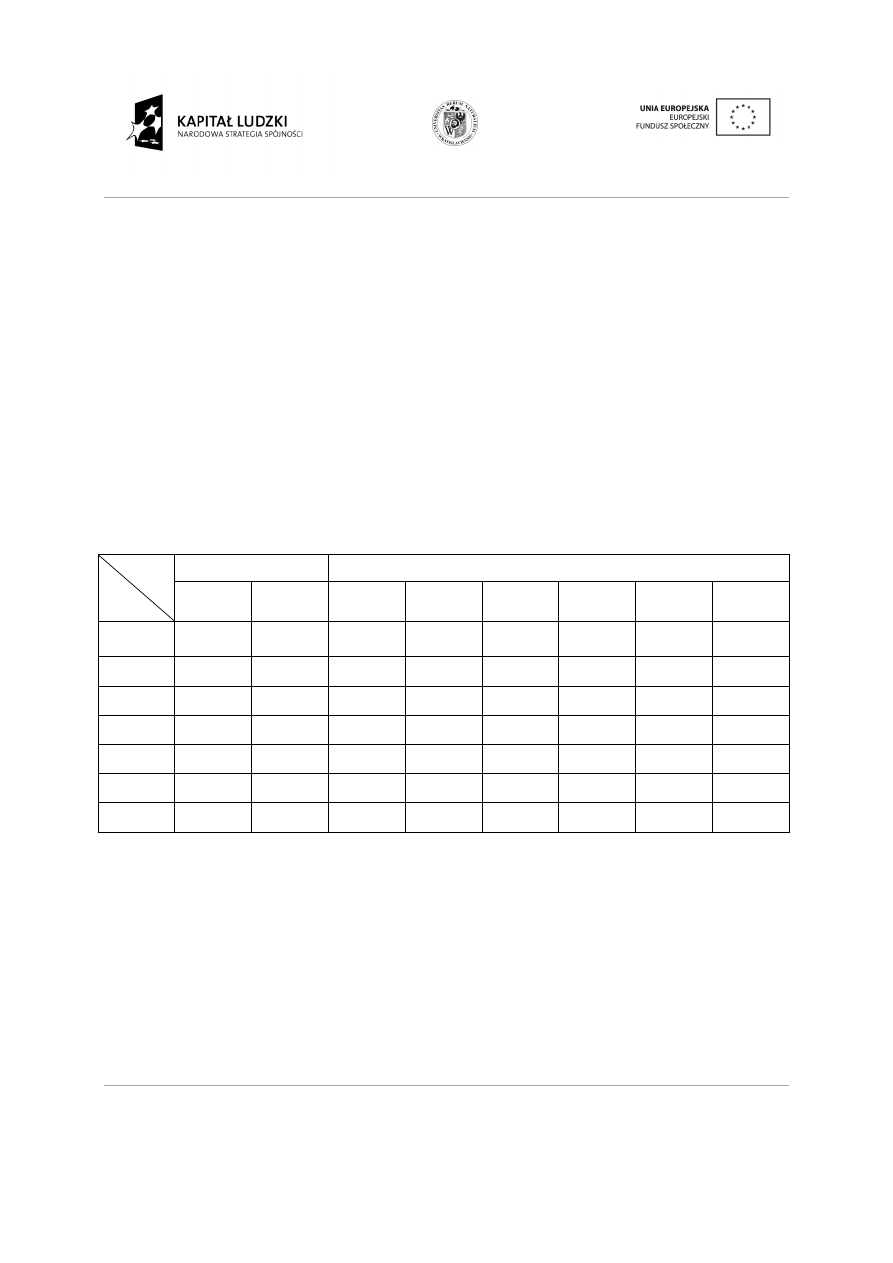
1.1
Właściwości pierwiastków w oparciu o poło
W tablicy Mendelejewa pierwiastki uszeregowane s
protonów w jądrze, w rzędach poziomych (okresach) i kolumnach (grupach). Pierwiastki poło
tej samej kolumnie mają analogiczn
walencyjne) i należą do tej samej g
Na podstawie położenia pierwiastka w układzie mo
chemiczne. Jedną z nich jest warto
wyższa niż numer grupy.
Tabela 1. Pierwiastki grup (rodzin) głównych
Grupa
Okres
Blok s
Ia
IIa
1
1
H
2
3
Li
4
Be
3
11
Na
12
Mg
4
19
K
20
Ca
5
37
Rb
38
Sr
6
55
Cs
56
Ba
7
87
Fr
88
Ra
Wartościowość to liczba atomów wodoru lub innego jednowarto
przypadająca w związku na 1 atom danego pierwiastka. Nie wszystkie pierwiastki tworz
połączenia z wodorem, ale wię
należy pamiętać, że wartoś
połączeniach nadtlenkowych).
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
4
ci pierwiastków w oparciu o położenie w układzie okresowym.
W tablicy Mendelejewa pierwiastki uszeregowane są w kolejności wzrastaj
dach poziomych (okresach) i kolumnach (grupach). Pierwiastki poło
analogiczną konfigurację zewnętrznej powłoki elektronowej (
do tej samej grupy. Ich właściwości chemiczne wykazują znaczne podobie
enia pierwiastka w układzie można przewidzieć jego niektóre wła
z nich jest wartościowość: w związku wartościowość pierwiastka nigdy nie jest
Tabela 1. Pierwiastki grup (rodzin) głównych
Blok p
IIIa
IVa
Va
VIa
5
B
6
C
7
N
8
O
13
Al
14
Si
15
P
16
S
31
Ga
32
Ge
33
As
34
Se
49
In
50
Sn
51
Sb
52
Te
81
Tl
82
Pb
83
Bi
84
Po
to liczba atomów wodoru lub innego jednowartościowego pierwiastka
zku na 1 atom danego pierwiastka. Nie wszystkie pierwiastki tworz
czenia z wodorem, ale większość łączy się z tlenem. Układając wzory cz
wartościowość tlenu w związkach wynosi II
czeniach nadtlenkowych). W grupach głównych, od grupy Va im wyż
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
enie w układzie okresowym.
ś
ci wzrastającej ilości
dach poziomych (okresach) i kolumnach (grupach). Pierwiastki położone w
trznej powłoki elektronowej (elektrony
ą
znaczne podobieństwa.
jego niektóre właściwości
pierwiastka nigdy nie jest
VIIa
0
2
He
9
F
10
Ne
17
Cl
18
Ar
35
Br
36
Ar
53
I
54
Xe
85
At
86
Rn
ś
ciowego pierwiastka
zku na 1 atom danego pierwiastka. Nie wszystkie pierwiastki tworzą
c wzory cząsteczek tlenków
zkach wynosi II (wyjątkowo I w
W grupach głównych, od grupy Va im wyższy numer grupy

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
tym mniej atomów wodoru przył
przyłączonych atomów wodoru wynosi
Na podstawie położenia pierwiastka w układzie okresowym mo
tlenków i połączeń z wodorem
Wartościowość pierwiastka w zwi
są tlenki chloru: Cl
2
O, Cl
2
O
3
,
Pierwiastki należące do grup Ib÷VIII charakteryzuj
przyjmować różne wartościowo
grupy. Wyjątek wśród tych pierwiastków stanowi cynk, który w zwi
wartościowy. Z pierwiastków grupy VIII tylko ruten i osm osi
równą numerowi grupy: OsO
najczęściej związki o wartościowo
Wzory tlenków
tlenku potasu
tlenku baru
tlenek boru(III)
tlenek krzemu(IV)
tlenek fosforu(V)
tlenek siarki(VI)
tlenek chloru(VII)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
5
tym mniej atomów wodoru przyłącza atom pierwiastka; suma numeru grupy i liczby
tomów wodoru wynosi 8.
ż
enia pierwiastka w układzie okresowym moż
z wodorem.
pierwiastka w związku może być niższa niż numer grupy
Cl
2
O
5
.
ce do grup Ib÷VIII charakteryzują się tym, że w zwi
ś
ciowości, jednak nigdy wartościowość nie jest wy
ród tych pierwiastków stanowi cynk, który w związkach jest zawsze II
ciowy. Z pierwiastków grupy VIII tylko ruten i osm osiągają w tlenkach warto
numerowi grupy: OsO
4
, RuO
4
, należące do tej grupy żelazo, kobalt, nikiel tworz
ś
ciowości II lub III.
Wzory połączeń pierwiastka wodorem
K
2
O
wodorek potasu
KH
BaO
wodorek baru
BaH
B
2
O
3
borowodór
BH
SiO
2
krzemowodór
SiH
P
2
O
5
fosforowodór
PH
SO
3
siarkowodór
H
Cl
2
O
7
chlorowodór
HCl
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
cza atom pierwiastka; suma numeru grupy i liczby
enia pierwiastka w układzie okresowym można podać wzory
numer grupy; np. znane
ż
e w związkach mogą
nie jest wyższa niż numer
ą
zkach jest zawsze II
w tlenkach wartościowość
elazo, kobalt, nikiel tworzą
Wzory połączeń pierwiastka wodorem
KH
BaH
2
BH
3
SiH
4
PH
3
H
2
S
HCl
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
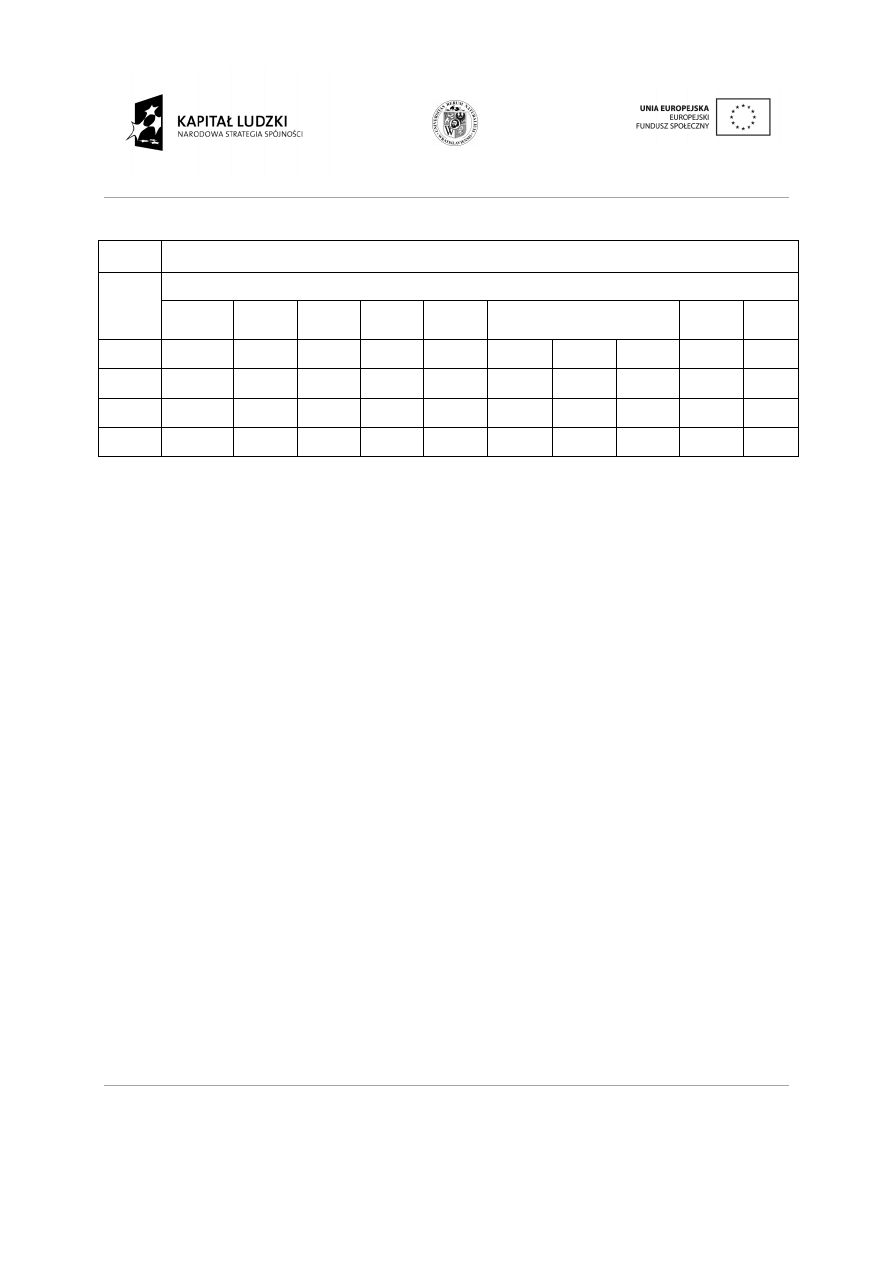
Tabela 2. Pierwiastki grup pobocznych.
okres
3
IIIb
IVb
4
21
Sc
22
Ti
23
5
39
Y
40
Zr
41
6
57
La
72
Hf
73
7
89
Ac
W układach okresowych zazwyczaj, obok symbolu pierwiastka umieszczone s
które odpowiadają stopniom utleniania (warto
Na podstawie poło
przewidzieć przebieg reakcji jego tlenku(ów ) z wod
pierwiastki położone w lewej cz
wodą tworzą zasady; w reakcji tlenków pierwiastków grup Va÷VIIa z wod
Na
2
O + H
2
O → 2NaOH
BaO + H
2
O → Ba(OH)
N
2
O
5
+ H
2
O → 2HNO
SO
3
+ H
2
O → H
2
SO
Tlenki niektórych pierwiastków grup IIIa i IVa w reakcji z wod
amfoteryczne.
Wszystkie pierwiastki grup pobocznych tj. Ib÷VIII) (tabela 2) nale
szereg wodorotlenków tych pierwiastków ma wła
wyższych stopniach utlenienia s
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
6
Tabela 2. Pierwiastki grup pobocznych.
grupa
blok d
Vb
VIb
VIIb
VIII
23
V
24
Cr
25
Mn
26
Fe
27
Co
28
41
Nb
42
Mo
43
Tc
44
Ru
45
Rh
46
Pd
73
Ta
74
W
75
Rc
76
Os
77
Ir
78
W układach okresowych zazwyczaj, obok symbolu pierwiastka umieszczone s
stopniom utleniania (wartościowości) pierwiastka w zwią
Na podstawie położenia pierwiastka w układzie okresowym mo
przebieg reakcji jego tlenku(ów ) z wodą. W grupach głównych (Ia÷IIIa)
one w lewej części okresu (tabela 1) to metale, których tlenki w reakcji z
zasady; w reakcji tlenków pierwiastków grup Va÷VIIa z wodą
2NaOH
Ba(OH)
2
2HNO
3
SO
4
Tlenki niektórych pierwiastków grup IIIa i IVa w reakcji z wodą tworz
Wszystkie pierwiastki grup pobocznych tj. Ib÷VIII) (tabela 2) nale
szereg wodorotlenków tych pierwiastków ma właściwości amfoteryczne, a ich tl
szych stopniach utlenienia są bezwodnikami kwasów.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
Ib
IIb
28
Ni
29
Cu
30
Zn
Pd
47
Ag
48
Cd
78
Pt
79
Au
80
Hg
W układach okresowych zazwyczaj, obok symbolu pierwiastka umieszczone są cyfry,
związkach.
enia pierwiastka w układzie okresowym można
. W grupach głównych (Ia÷IIIa)
ci okresu (tabela 1) to metale, których tlenki w reakcji z
zasady; w reakcji tlenków pierwiastków grup Va÷VIIa z wodą powstają kwasy.
ą
tworzą wodorotlenki
Wszystkie pierwiastki grup pobocznych tj. Ib÷VIII) (tabela 2) należą do metali,
ci amfoteryczne, a ich tlenki na

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
W reakcji tlenków z wod
ulegają zmianie; w podanych w niniejszych materiałach przykładach i problemach do
rozwiązania reakcje tego typu zachodz
1.2
Dysocjacja elektrolityczna.
W roztworze wodnym (lub polarnego rozpuszczalnika) wodorotlenki i kwasy ulegaj
dysocjacji elektrolitycznej. Dysocjacja elektrolityczna to rozpad, zazwyczaj odwracalny,
na jony. Jon to atom lub grupa
(kationy) lub ujemnym (aniony
NaOH → Na
+
+ OH
-
Ba(OH)
2
→
BaOH
+
+ OH
BaOH
+
→
Ba
2+
+ OH
HCl → H
+
+ Cl
-
H
2
SO
4
→ H
+
+
HSO
−
4
HSO
→ H
+
+
−
2
4
SO
Po obu stronach poprawnie napisanego równania reakcji s
atomów pierwiastka i sumaryczny ładunek jonów (w zapisie jonowym reakcji)
Równania reakcji podane powy
elektrolitów. Mocne elektrolity
nie występują cząsteczki, praktycznie wszy
dysocjacji mocnych elektrolitów stosuje si
W roztworach wodnych wielu wodorotlenków i kwasów zwi
w postaci cząsteczek; tylko niewielki ułamek
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
7
W reakcji tlenków z wodą zazwyczaj wartościowości pierwiastków nie
zmianie; w podanych w niniejszych materiałach przykładach i problemach do
zania reakcje tego typu zachodzą bez zmiany wartościowości.
Dysocjacja elektrolityczna.
W roztworze wodnym (lub polarnego rozpuszczalnika) wodorotlenki i kwasy ulegaj
Dysocjacja elektrolityczna to rozpad, zazwyczaj odwracalny,
. Jon to atom lub grupa atomów, obdarzona ładunkiem elektrycznym: dodatnim
aniony). Proces dysocjacji jest jednostopniowy lub wielostopniowy.
-
jednostopniowy
+ OH
-
dwustopniowy
+ OH
-
jednostopniowy
−
4
HSO
dwustopniowy
Po obu stronach poprawnie napisanego równania reakcji są takie same: ilo
sumaryczny ładunek jonów (w zapisie jonowym reakcji)
Równania reakcji podane powyżej przedstawiają dysocjację
Mocne elektrolity odznaczają się tym, że w ich średnio stęż
steczki, praktycznie wszystkie ulegają dysocjacji. W zapisie równania
dysocjacji mocnych elektrolitów stosuje się jedną strzałkę z grotem skierowanym w prawo.
W roztworach wodnych wielu wodorotlenków i kwasów związki wyst
steczek; tylko niewielki ułamek ulega rozpadowi na jony
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ś
ci pierwiastków nie
zmianie; w podanych w niniejszych materiałach przykładach i problemach do
W roztworze wodnym (lub polarnego rozpuszczalnika) wodorotlenki i kwasy ulegają
Dysocjacja elektrolityczna to rozpad, zazwyczaj odwracalny,
atomów, obdarzona ładunkiem elektrycznym: dodatnim
). Proces dysocjacji jest jednostopniowy lub wielostopniowy.
ą
takie same: ilości
sumaryczny ładunek jonów (w zapisie jonowym reakcji).
dysocjację tzw. mocnych
rednio stężonych roztworach
dysocjacji. W zapisie równania
z grotem skierowanym w prawo.
ą
zki występują głównie
ulega rozpadowi na jony – są to elektrolity

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
słabe. W zapisie reakcji dysocjacji słabych elektrolitów stosuje si
skierowanymi w przeciwne strony (
Fe(OH)
2
FeOH
+
+ OH
FeOH
+
Fe
2+
+ OH
H
2
SO
3
H
+
+
HSO
−
3
HSO
H
+
+ SO
Podane przykłady wskazuj
zawsze jednowartościowe, ujemne jony
Jony OH
-
obecne są równie
NH
3
+ H
2
O
+
4
NH + OH
Amoniak wiąże kation wodorowy z cz
równocześnie uwalniany jest jon OH
cząsteczek amoniaku bierze udział w tej reakcji, amoniak dysocjuje jak s
zapisie reakcji stosuje się dwie strzałki. W roztworze nie wyst
niezdysocjowaną część związku zapisuje si
Przynależność do mocnych lub słabych elektrolitów jest cech
zapamiętać, że do mocnych elektrolitów nale
wodorotlenki metali grup Ia i IIa
roztwory wodne fluorowcowodorów (z wyj
tlenowe kwasy azotu, siarki i chloru na najwy
(również HClO
3
). Pozostałe wodorotlenki i kwasy nale
Wodorotlenki Sn(OH)
amfoteryczne: w roztworze dysocjuj
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
8
. W zapisie reakcji dysocjacji słabych elektrolitów stosuje się dwie
skierowanymi w przeciwne strony (
):
+ OH
-
+ OH
-
−
3
HSO
−
2
3
Podane przykłady wskazują, że w rozworach wodnych wodorotlenków
ciowe, ujemne jony OH
-
, a w roztworach kwasów kationy
ą
również w roztworze wodnym amoniaku:
+ OH
-
e kation wodorowy z cząsteczki wody i tworzy kation amonowy
nie uwalniany jest jon OH
-
. Roztwór wodny amoniaku jest zasadowy. Tylko cz
steczek amoniaku bierze udział w tej reakcji, amoniak dysocjuje jak s
ę
dwie strzałki. W roztworze nie występują czą
ą
zku zapisuje się jako NH
3
·H
2
O.
do mocnych lub słabych elektrolitów jest cechą
o mocnych elektrolitów należą:
wodorotlenki metali grup Ia i IIa;
roztwory wodne fluorowcowodorów (z wyjątkiem fluorowodoru)
tlenowe kwasy azotu, siarki i chloru na najwyższych stopniach utlenienia
. Pozostałe wodorotlenki i kwasy należą do elektrolitów słabych.
2
, Sn(OH)
4
, Pb(OH)
2
, Zn(OH)
2
, Cr(OH)
3
amfoteryczne: w roztworze dysocjują jak kwasy (odszczepiają H
+
) lub zasady (odszczepiaj
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
dwie strzałki, z grotami
wodorotlenków obecne są
kationy H
+
.
steczki wody i tworzy kation amonowy
+
4
NH
,
. Roztwór wodny amoniaku jest zasadowy. Tylko część
steczek amoniaku bierze udział w tej reakcji, amoniak dysocjuje jak słaby elektrolit, w
ą
cząsteczki NH
4
OH,
do mocnych lub słabych elektrolitów jest cechą związku. Warto
tkiem fluorowodoru),
szych stopniach utlenienia
elektrolitów słabych.
3
mają właściwości
) lub zasady (odszczepiają

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
OH
-
). Wykazują właściwości kwasowe i zasadowe, s
słabymi zasadami:
Rys. 1. Amfoteryczny wodorotlenek ołowiu(II) dysocjuje jak kwas (
1.3
Reakcje w roztworach elektrolitów. Wzory strukturalne.
W reakcjach związków należą
opisuje ich faktyczny przebieg. W zapisie jonowym widoczne jest np. podobie
reakcji zobojętniania tj. reakcji kwasu z zasad
2NaOH + H
2
SO
4
→
Na
Mg(OH)
2
+ 2HCl → MgCl
2Na
+
+ 2OH
-
+
2H
+
+
SO
Mg
2+
+ 2OH
-
+
2H
+
+ 2Cl
W reakcji zasady z kwasem powstaje sól. Sole nale
elektrolity mocne. Zobojętnienie to reakcja ł
słabego elektrolitu. W zapisie reakcji zoboj
wszystkie jony OH
-
i
H
+
łączą się
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
9
ś
ci kwasowe i zasadowe, są zarówno słabymi
Pb(OH)
2
PbOH
+
+ OH
-
Pb
2+
+ OH
-
H
+
+ HPbO
2
-
H
+
+ PbO
2
2-
a
b
a
b
Rys. 1. Amfoteryczny wodorotlenek ołowiu(II) dysocjuje jak kwas (a) lub jak zasada (
Reakcje w roztworach elektrolitów. Wzory strukturalne.
zków należących do elektrolitów uczestniczą jony i jonowy zapis reakcji lepiej
opisuje ich faktyczny przebieg. W zapisie jonowym widoczne jest np. podobie
tj. reakcji kwasu z zasadą:
→
Na
2
SO
4
+ 2H
2
O
→
MgCl
2
+ 2H
2
O
−
2
4
SO
→
2Na
+
+
−
2
4
SO
+ 2H
2
O
+ 2Cl
-
→
Mg
2+
+ 2Cl
-
+ 2H
2
O
W reakcji zasady z kwasem powstaje sól. Sole należą do elektrolitów
tnienie to reakcja łączenia jonów OH
-
i
H
+
w cząsteczk
W zapisie reakcji zobojętniania stosuje się jedną strzałk
ą
się w cząsteczki.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
słabymi kwasami jak i
) lub jak zasada (b)
jony i jonowy zapis reakcji lepiej
opisuje ich faktyczny przebieg. W zapisie jonowym widoczne jest np. podobieństwo wszystkich
do elektrolitów - wszystkie sole to
ą
steczkę wody, bardzo
strzałkę, bo praktycznie

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
W reakcji z zasadą kwasu dysocjuj
wodorosole, a dysocjujące wielostopniowo zasady tworz
H
3
PO
4
+ NaOH → NaH
H
3
PO
4
+ 2NaOH → Na
H
3
PO
4
+ 3NaOH → Na
Cu(OH)
2
+ HNO
3
→
Cu(OH)NO
Cu(OH)
2
+ 2HNO
3
→
Cu(NO
Sole powstają także w reakcjach:
•
tlenku metalu z kwasem:
FeO + 2HCl → FeCl
2
+ H
2
O
FeO + 2H
+
+ 2Cl
-
→ Fe
2+
+ 2Cl
•
metalu z kwasem:
Fe + 2HCl → FeCl
2
+ H
2
↑
Fe + 2H
+
+ 2Cl
-
→ Fe
2+
+ 2Cl
•
zasady z bezwodnikiem kwasowym:
2KOH + CO
2
→
K
2
CO
3
+ H
2K
+
+ 2OH
-
+ CO
2
→
2K
+
+
dwutlenek węgla jest bezwodnikiem kwasu dysocjuj
reakcji powstaje również wodorow
KOH + CO
2
→
KHCO
3
K
+
+ OH
-
+ CO
2
→
K
+
+
HCO
•
tlenku metalu z tlenkiem niemetalu (bezwodnikiem kwasowym):
K
2
O + CO
2
→
K
2
CO
3
;
w takiej reakcji, w obecności wody, z bezwodnikiem kwasu wieloprotonowego tworzy si
wodorosól:
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
10
ą
kwasu dysocjującego wielostopniowo mogą powstawa
ce wielostopniowo zasady tworzą hydroksosole:
NaH
2
PO
4
+ H
2
O - diwodoroortofosforan(V) sodu
Na
2
HPO
4
+ 2H
2
O - wodoroortofosforan(V) sodu
Na
3
PO
4
+ 3H
2
O - ortofosforan(V) sodu
Cu(OH)NO
3
+ H
2
O - azotan(V) hydroksomiedzi(II)
Cu(NO
3
)
2
+ 2H
2
O - azotan(V) miedzi(II)
e w reakcjach:
tlenku metalu z kwasem:
+ 2Cl
-
+ H
2
O
+ 2Cl
-
+ H
2
↑
zasady z bezwodnikiem kwasowym:
+ H
2
O
+
−
2
3
CO
+ H
2
O
gla jest bezwodnikiem kwasu dysocjującego dwustopniowo, dlatego w
ż
wodorowęglan:
−
3
HCO
tlenku metalu z tlenkiem niemetalu (bezwodnikiem kwasowym):
ś
ci wody, z bezwodnikiem kwasu wieloprotonowego tworzy si
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ą
powstawać również
diwodoroortofosforan(V) sodu
wodoroortofosforan(V) sodu
azotan(V) hydroksomiedzi(II)
cego dwustopniowo, dlatego w
ci wody, z bezwodnikiem kwasu wieloprotonowego tworzy się
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
K
2
O + 2CO
2
+ H
2
O
→
2KHCO
K
2
O + 2CO
2
+ H
2
O
→
2K
+
+
lub hydroksosól, gdy tlenkiem jest metal o warto
2FeO + N
2
O
5
+ H
2
O
→
2Fe(OH)NO
2FeO + N
2
O
5
+ H
2
O
→
2FeOH
Wodorosole powstają też w reakcji soli z bezwodnikiem kwasu, od którego wywodzi si
sól:
K
2
CO
3
+ CO
2
+ H
2
O
2KHCO
2K
+
+
−
2
3
CO
+ CO
2
+ H
2
O
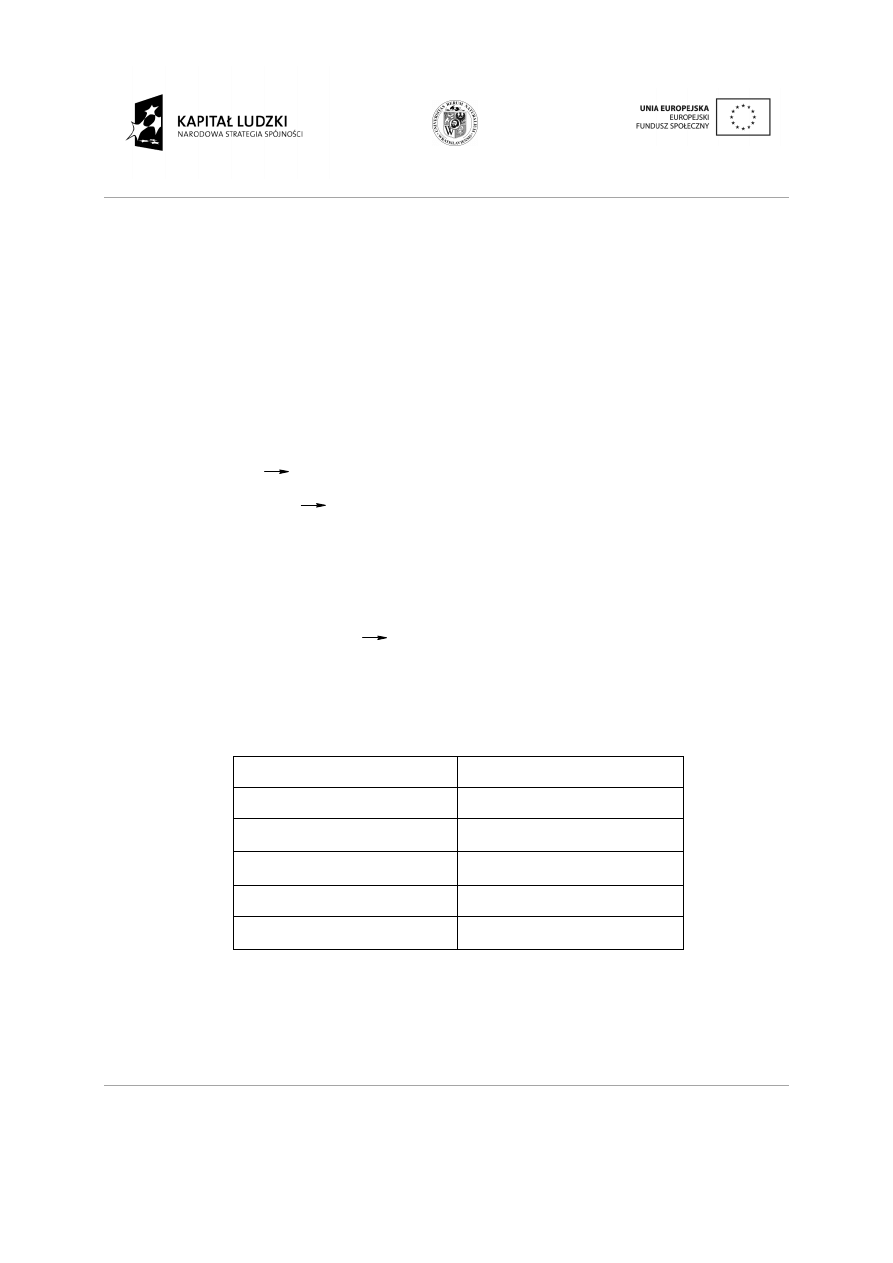
Niekiedy w reakcji zobojętniania wypada osad, ma to miejsce wtedy gdy powstaj
trudno rozpuszczalna w wodzie. Podczas takiej reakcji zoboj
OH
-
i H
+
lecz również jony soli:
Ca
2+
+ 2OH
-
+ 2H
+
+
SO
W zapisie jonowym reakcji zoboj
Tabela 3. Pospolite sole trudno rozpuszczalne
anion
Cl
-
−
3
4
PO
−
2
4
SO
S
2-
−
2
3
CO
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
11
2KHCO
3
+
−
3
HCO
2
;
lub hydroksosól, gdy tlenkiem jest metal o wartościowości wyższej niż
2Fe(OH)NO
3
2FeOH
+
+
−
3
NO
2
ż
w reakcji soli z bezwodnikiem kwasu, od którego wywodzi si
2KHCO
3
2K
+
+ 2
−
3
HCO
ę
tniania wypada osad, ma to miejsce wtedy gdy powstaj
trudno rozpuszczalna w wodzie. Podczas takiej reakcji zobojętnienia łączą
jony soli:
−
2
4
SO
CaSO
4↓
+ 2H
2
O
W zapisie jonowym reakcji zobojętniania należy uwzględnić rozpuszczalność
Tabela 3. Pospolite sole trudno rozpuszczalne
anion
kation
Ag
+
, Pb
2+
−
Ba
2+
, Ca
2+
−
Ba
2+
, Ca
2+
, Pb
2+
Ag
+
, Zn
2+
, Fe
2+
, Fe
3+
−
Ba
2+
, Ca
2+
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
szej niż I:
w reakcji soli z bezwodnikiem kwasu, od którego wywodzi się
tniania wypada osad, ma to miejsce wtedy gdy powstająca sól jest
ą
czą się nie tylko jony
rozpuszczalność soli (tabela 3).

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Wodorotlenki amfoteryczne reaguj
H
+
+ HPbO
2
+ Na
+
-
H
+
+ PbO
2
+ Na
+
2-
PbOH
+
+ OH
-
+ H
+
+ NO
H
+
+ HPbO
H
+
+ PbO
Pb
2+
+ OH
-
+ H
+
+ NO
Wodorotlenek amfoteryczny z zasad
wywodzi się z dysocjacji kwasowej wodorotlenku; z kwasem reaguje jak zasada (
reakcjach, jak w każdej reakcji zoboj
Kryształki kwasu szczawiowego lepiej rozpuszczaj
sodowej niż w samej wodzie. Jak mo
Kwas szczawiowy (o wzorze H
kwasy mrówkowy (HCOOH) octowy (CH
kwasy należą do słabych elektrolitów, ulegaj
HCOOH
HCOO
-
+ H
C
6
H
5
COOH
C
6
H
5
COO
H
2
C
2
O
4
H
+
+
2
O
HC
−
4
2
O
HC
H
+
+
2
O
C
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
12
Wodorotlenki amfoteryczne reagują z kwasami i zasadami:
Na
+
+ HPbO
2
+ H
2
O
wodoroołowian(II) sodu
+
+ OH
-
+
+ OH
-
Na
+
+ PbO
2
+ H
2
O
a
a
+ NO
3
b
b
ołowian(II) sodu
azotan(V) hydroksoołowiu(II)
azotan(V) ołowiu(II)
-
2-
Pb(OH)
2
PbOH
+
+ OH
-
Pb
2+
+ OH
-
+ HPbO
2
-
+ PbO
2
2-
a
b
a
b
-
-
-
-
PbOH
+
+ NO
3
+ H
2
O
Pb
2+
+ NO
3
+ H
2
O
+ NO
3
amfoteryczny z zasadą reaguje jak kwas (a) - anion powstaj
z dysocjacji kwasowej wodorotlenku; z kwasem reaguje jak zasada (
dej reakcji zobojętnienia, obok soli powstaje cząsteczka wody.
szczawiowego lepiej rozpuszczają się w roztworze wodnym zasady
w samej wodzie. Jak można to wyjaśnić?
Kwas szczawiowy (o wzorze H
2
C
2
O
4
) należy do kwasów organicznych, podobnie jak
kwasy mrówkowy (HCOOH) octowy (CH
3
COOH) i benzoesowy (C
6
H
5
COOH).
do słabych elektrolitów, ulegają w wodzie dysocjacji w niewielkim stopniu:
+ H
+
COO
-
+ H
+
−
4
O
−
2
4
O
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
wodoroołowian(II) sodu
ołowian(II) sodu
azotan(V) hydroksoołowiu(II)
azotan(V) ołowiu(II)
anion powstającej soli
z dysocjacji kwasowej wodorotlenku; z kwasem reaguje jak zasada (b). W tych
steczka wody.
w roztworze wodnym zasady
y do kwasów organicznych, podobnie jak
COOH). Wymienione
w wodzie dysocjacji w niewielkim stopniu:

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Nie wszystkie atomy wodoru obecne w cz
dysocjacji. To związane jest z budow
strukturalnych. Wzory strukturalne podaj
do budowy przestrzennej). W reakcji dysocjacji kwasów organicznych tylko atomy wodoru
połączone poprzez tlen ulegają
H
H
H
H
O
C
O
kwas octowy
C
kwas szczawiowy
H
H
O
O
C
kwas mrówkowy
kwas benzoesowy
H
O
O
C
H
H
H
H
H
H
O
O
C
H
O
O
C
Rys. 2. Wzory
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
13
Nie wszystkie atomy wodoru obecne w cząsteczce kwasu organicznego mog
zane jest z budową cząsteczki. Najlepiej to widoczne jest w ich wzorach
Wzory strukturalne podają połączenia atomów w cząsteczce (nie odnosz
do budowy przestrzennej). W reakcji dysocjacji kwasów organicznych tylko atomy wodoru
czone poprzez tlen ulegają odszczepieniu.
Pb
-
-
-
-
-
-
H
H
H
O
O
C
C
H
H
H
O
O
C
C
H
H
O
O
C
+
+
+
+
+
+
H
H
H
O
C
O
C
H
H
O
O
C
H
H
H
H
H
+
+ H
O
O
C
H
O
O
C
+
+ H
O
O
C
O
O
C
O
O
H
O
O
C
C
O
O
C
O
O
C
H
O
O
C
O
O
C
Ca
anion wodoroszczawianowy
anion szczawianowy
octan ołowiu(II)
szczawian wapnia
wodoroszczawian wapnia
Rys. 2. Wzory strukturalne kwasów organicznych i ich soli
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
steczce kwasu organicznego mogą ulegać
steczki. Najlepiej to widoczne jest w ich wzorach
steczce (nie odnoszą się
do budowy przestrzennej). W reakcji dysocjacji kwasów organicznych tylko atomy wodoru
Pb
H
H
Ca
Ca
octan ołowiu(II)
szczawian wapnia
wodoroszczawian wapnia
strukturalne kwasów organicznych i ich soli

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Większa rozpuszczalno
wodzie wynika z tego, że w reakcji z zasad
rozpuszczalny.
H
2
C
2
O
4
+ Na
+
+ OH
-
→
−
4
2
O
HC
+ Na
+
+ OH
-
→
Ogólna zasada dotyczą
Stężenie jonów szczawianowych w roztworze szczawianu sodu jest du
kwasu szczawiowego; w roztworach soli, pochodz
stężenie jonu (anionu, kationu) jest wy
roztwory soli są najczęściej stosowane do wytr
rozpuszczalnego osadu.
1.4
Dysocjacja wody, skala pH.
Chemicznie czysta woda wykazuje bardzo małe przewodnictwo elektryczne, które jest
wynikiem dysocjacji H
2
O:
H
2
O
H
+
+ OH
-
W dysocjacji wody powstaj
charakterystyczne dla kwasów, drugie dla zasad. Woda jest zarówno bardzo słabym kwasem
jak i bardzo słabą zasadą. Z równania dysocjacji wody wynika,
OH
-
są takie same ([H
+
] = [OH
słabym elektrolitem świadczy warto
[H
+
]·[OH
-
], zwany iloczynem jonowym wody
z temperaturą (rośnie ze wzrostem temperatury). W 25
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
14
ksza rozpuszczalność kwasu szczawiowego w wodnym roztworze NaOH ni
ż
e w reakcji z zasadą powstaje sól, mocny elektrolit
→
Na
+
+
−
4
2
O
HC
+ H
2
O
→
Na
+
+
−
2
4
2
O
C
+ H
2
O
Ogólna zasada dotycząca rozpuszczalności: podobny rozpuszcza podobne
enie jonów szczawianowych w roztworze szczawianu sodu jest du
w roztworach soli, pochodzących od słabego(ych) elektrolitu(ów)
enie jonu (anionu, kationu) jest wyższe niż w roztworze słabego elektrolitu. Dlatego
ciej stosowane do wytrącenia z roztworu jonu, w postaci trudno
Dysocjacja wody, skala pH.
Chemicznie czysta woda wykazuje bardzo małe przewodnictwo elektryczne, które jest
W dysocjacji wody powstają równocześnie jony H
+
i OH
-
, pierwsze to jony
charakterystyczne dla kwasów, drugie dla zasad. Woda jest zarówno bardzo słabym kwasem
. Z równania dysocjacji wody wynika, że ilości jonów H
] = [OH
-
]) i woda ma odczyn obojętny. O tym, że woda jes
wiadczy wartość iloczynu stężeń jonów: [H
+
] · [OH
iloczynem jonowym wody ma wartość stałą, nieznacznie zmieniaj
nie ze wzrostem temperatury). W 25ºC (temperatura p
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
kwasu szczawiowego w wodnym roztworze NaOH niż
mocny elektrolit lepiej
podobny rozpuszcza podobne.
enie jonów szczawianowych w roztworze szczawianu sodu jest dużo wyższe niż
cych od słabego(ych) elektrolitu(ów)
w roztworze słabego elektrolitu. Dlatego
cenia z roztworu jonu, w postaci trudno
Chemicznie czysta woda wykazuje bardzo małe przewodnictwo elektryczne, które jest
, pierwsze to jony
charakterystyczne dla kwasów, drugie dla zasad. Woda jest zarówno bardzo słabym kwasem
ś
ci jonów H
+
i jonów
tny. O tym, że woda jest bardzo
] · [OH
-
] = 10
-14
. Iloczyn
, nieznacznie zmieniającą się
ºC (temperatura pokojowa) iloczyn

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
jonowy wody ma wartość 10
-
we wszystkich roztworach wodnych.
W roztworach obojętnych [H
jeżeli [H
+
] = [OH
-
];
[H
[OH
W roztworach obojętnych:
Cząsteczki kwasu w roztworze wodnym odszczepiaj
wzrasta; w roztworze mocnego kwasu
dysocjacji. W roztworze kwasu obecne s
Na przykład w 0,05M roztworze mocnego HCl, który dysocjuje całkowicie
[H
W roztworach kwaśnych
Zasady w wodzie odszczepiaj
równocześnie zmniejsza się stęż
0,1M roztworze NaOH stężenie
jest 10
12
razy większe niż [H
+
].
W roztworach zasadowych
Przedstawione powyżej przykłady wskazuj
roztworach wodnych zmieniają
1
[H
+
] i [OH
-
] nie przyjmują nigdy warto
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
15
-14
. Iloczyn jonowy wody wyznacza stężenia jonów
we wszystkich roztworach wodnych.
ę
tnych [H
+
] = [OH
-
]
to [H
+
]
2
= 10
-14
; stąd:
14
10
]
[H
−
+
=
= 10
-7
mol/dm
3
;
[OH
-
] = 10
-7
mol/dm
3
ę
tnych: [H
+
] = [OH
-
] = 10
-7
mol/dm
3
steczki kwasu w roztworze wodnym odszczepiają jon H
+
, i st
wzrasta; w roztworze mocnego kwasu [H
+
] = c
Mkwasu
, bo wszystkie cz
dysocjacji. W roztworze kwasu obecne są zawsze również jony OH
-1
Na przykład w 0,05M roztworze mocnego HCl, który dysocjuje całkowicie
HCl
→
H
+
+ Cl
-
[H
+
] = 0,05, a
.
10
2
10
]
13
14
−
−
⋅
=
=
0,05
-
[OH
ś
nych [H
+
]>10
-7
Zasady w wodzie odszczepiają jony OH
-
i stężenie tych jonów ro
ę
stężenie jonów H
+
, bo iloczyn obu jonów ma warto
ęż
enie [OH
-
] = 0,1, a
13
14
10
10
]
−
−
+
=
=
0,1
[H
; w tym roztworze
].
W roztworach zasadowych [H
+
]<10
-7
.
Przedstawione powyżej przykłady wskazują, że wartości stęż
roztworach wodnych zmieniają się w szerokim zakresie (np. 0,05 do 10
-13
nigdy wartości „0”
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ęż
enia jonów H
+
i OH
-
, i stężenie tego jonu
, bo wszystkie cząsteczki ulegają
Na przykład w 0,05M roztworze mocnego HCl, który dysocjuje całkowicie
enie tych jonów rośnie,
, bo iloczyn obu jonów ma wartość stałą. W
; w tym roztworze [OH
-
]
ci stężeń jonów H
+
w
13
) i relacje między

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
stężeniami są bardziej wyraziste gdy st
jonów wodorowych pH:
roztwór obojętny: [H
0,05 M roztworze HCl: [H
+
] = 0,05;
0,1M roztwór NaOH: [H
W skali wykładniczej: pH = 7
pH < 7
pH > 7
1.5
Hydroliza soli.
W roztworach wodnych niektórych soli nast
soli i cząsteczkami wody, w wyniku której roztwór soli ma odczyn kwa
przykład roztwór cyjanku potasu (
[Cu(NO
3
)
2
] odczyn kwaśny. O odczynie roztworu soli decyduje reakcja jonów soli z wod
zwana hydrolizą.
Niektóre sole nie ulegaj
elektrolitów, tj. sole zawieraj
kwasu. Do takich soli należą np. NaCl, KNO
2
log
b
a = c ; b
c
= a
log a = c; 10
c
= a
log a
·d
= log a + log d
d
log
a
log
a
log
−
=
d
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
16
ej wyraziste gdy stężenia podawane są w postaci wykładnika st
pH= -log [H
+
]
2
[H
+
] = [OH
-
]=10
-7
; pH = - log10
-7
= 7;
] = 0,05;
pH = –log 0,05= –(log 5 + log10
-2
)= -
0,1M roztwór NaOH: [H
+
] = 10
-13
; pH = - log 10
-13
= 13
pH = 7 – roztwory obojętne
pH < 7 – roztwory kwaśne
pH > 7 – roztwory zasadowe
W roztworach wodnych niektórych soli następuje odwracalna reakcja mi
steczkami wody, w wyniku której roztwór soli ma odczyn kwaśny lub zasadowy. Na
przykład roztwór cyjanku potasu (KCN) ma odczyn zasadowy a azotanu(V)
ś
ny. O odczynie roztworu soli decyduje reakcja jonów soli z wod
Niektóre sole nie ulegają takiej reakcji – to sole wywodzące si
elektrolitów, tj. sole zawierające kation, który tworzy mocną zasadę
żą
np. NaCl, KNO
3
, Ca(ClO
3
)
2
.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
wykładnika stężenia
-0,71+2 = 1,3;
puje odwracalna reakcja między jonami
ś
ny lub zasadowy. Na
) ma odczyn zasadowy a azotanu(V) miedzi(II)
ny. O odczynie roztworu soli decyduje reakcja jonów soli z wodą
ą
ce się od mocnych
adę i anion mocnego

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Po rozpuszczeniu w wodzie cyjanku potasu cz
protonami pochodzącymi od czą
KCN → K
+
+ CN
-
H
2
O
OH
-
+ H
+
OH
-
+ HCN +K
Powyższe reakcje wskazuj
H
+
) więc część jonów cyjankowych utworzy HCN; pochodz
łączą się w KOH.
W uproszczonym zapisie jonowym:
CN
-
+ H
2
O
HCN + OH
W reakcji wiązane są tylko jony H
OH
-
- roztwór wodny soli będzie miał odczyn zasadowy, co widoczne jest w jonowym zapisie
reakcji hydrolizy soli.
Azotan(V) miedzi(II) wywodzi si
wodzie:
3
W roztworach słabych
cząsteczki, np.
HCN
H
+
+ CN
-
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
17
Po rozpuszczeniu w wodzie cyjanku potasu część jonów cyjankowych ł
cymi od cząsteczki wody w cząsteczkę HCN - słabego kwasu
- sól, mocny elektrolit dysocjuje całkowicie
- woda ulega (w b. małym stopniu) dysocjacji:
+ HCN +K
+
;
sze reakcje wskazują, że w roztworze obecne są jony słabego elektrolitu (CN
jonów cyjankowych utworzy HCN; pochodzące od mocnej zasady
W uproszczonym zapisie jonowym:
HCN + OH
-
zane są tylko jony H
+
, ich ilość w roztworze jest mniejsza ni
ę
dzie miał odczyn zasadowy, co widoczne jest w jonowym zapisie
Azotan(V) miedzi(II) wywodzi się od słabej zasady Cu(OH)
2
. Po rozpuszczeniu w
W roztworach słabych elektrolitów zawsze obok jonów występują
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
jonów cyjankowych łączy się z
słabego kwasu
3
.
sól, mocny elektrolit dysocjuje całkowicie
woda ulega (w b. małym stopniu) dysocjacji:
jony słabego elektrolitu (CN
-
i
ce od mocnej zasady jony K
+
nie
w roztworze jest mniejsza niż jonów
dzie miał odczyn zasadowy, co widoczne jest w jonowym zapisie
. Po rozpuszczeniu w
ę
pują niezdysocjowane

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Cu(NO
3
)
2
→
Cu
2+
+ 2NO
H
2
O
OH
-
+ H
dysocjacji:
CuOH
+
+ H
jony Cu
2+
łączą się z OH
jonów H
+
i odczyn roztworu soli jest
Cu
2+
+ H
2
O +
−
3
2NO
Jony
−
3
NO wywodzą się
występują po obu stronach równania, wiec równanie reakcji mo
Cu
2+
+ H
2
O
CuOH
W równaniu hydrolizy soli, reakcji odwracalnej,
skierowanymi w przeciwnych kierunkach (tylko cz
podaje się w postaci cząsteczki, bo H
prawej stronie w postaci czą
miedzi(II).
Hydroliza Cu(NO
3
)
2
przebiega dwustopniowo; cz
jonami OH
-
:
CuOH
+
+ H
2
O
Cu(OH)
Zapis jonowy reakcji hydrolizy soli najlepiej opisuje proces
biorą udział jony soli oraz jak i dlaczego zmienia si
Przykłady:
Zapisać reakcje hydrolizy:
d) siarczku sodu, e) siarczanu(VI) potasu; okre
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
18
−
3
2NO - sól, mocny elektrolit dysocjuje całkowicie
+ H
+
- woda ulega (w b. małym stopniu)
+ H
+
−
+
3
2NO
ę
z OH
-
; jony OH
-
są wiązane więc ich ilość
i odczyn roztworu soli jest kwaśny:
CuOH
+
+ H
+
+
−
3
2NO
ą
się od mocnego kwasu i nie łączą się w cz
po obu stronach równania, wiec równanie reakcji można zapisać:
CuOH
+
+ H
+
W równaniu hydrolizy soli, reakcji odwracalnej, stosuje się strzałki z grotami
skierowanymi w przeciwnych kierunkach (tylko część jonów soli ulega hydrolizie); wod
steczki, bo H
2
O jest znacznie słabszym elektrolitem ni
prawej stronie w postaci cząsteczki słaby elektrolit – cyjanowodór czy wodorotlenek
przebiega dwustopniowo; część jonów Cu(OH)
Cu(OH)
2
+ H
+
Zapis jonowy reakcji hydrolizy soli najlepiej opisuje proces – poka
udział jony soli oraz jak i dlaczego zmienia się odczyn roztworu.
reakcje hydrolizy: a) chlorku miedzi(I), b) octanu potasu, c
) siarczanu(VI) potasu; określić odczyn roztworu soli.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
sól, mocny elektrolit dysocjuje całkowicie
woda ulega (w b. małym stopniu)
c ich ilość jest mniejsza niż
ę
w cząsteczkę HNO
3
,
na zapisać:
ę
strzałki z grotami
jonów soli ulega hydrolizie); wodę
O jest znacznie słabszym elektrolitem niż zapisany po
cyjanowodór czy wodorotlenek
jonów Cu(OH)
+
łączy się z
pokazuje, że w reakcji
c) octanu miedzi(I),

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
•
W pierwszym etapie zapisuje si
a) CuCl → Cu
+
+ Cl
-
Cu
+
+ Cl
-
+ H
2
O
jony chlorkowe wystę
pominąć:
Cu
+
+ H
2
O
CuOH + H
b) CH
3
COOK → K
+
+
K
+
+ CH
3
COO
-
+ H
CH
3
COO
-
+ H
2
O
c) CH
3
COOCu → Cu
+
Cu
+
+ CH
3
COO
-
+ H
zasady i słabego kwasu zarówno kation jak i anion ł
d) Na
2
S → 2Na
+
+ S
2-
2Na
+
+ S
2-
+ H
2
O
S
2-
+ H
2
O
HS
-
HS
-
+ H
2
O
H
S
2-
+ 2H
2
O
H
e) K
2
SO
4
→
2K
+
+
elektrolitu, sól nie ulega hydrolizie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
19
W pierwszym etapie zapisuje się reakcje dysocjacji soli.
CuOH + H
+
+ Cl
-
- odczyn kwaśny;
jony chlorkowe występujące po obu stronach, nie biorą udziału w
CuOH + H
+
- odczyn kwaśny,
+ CH
3
COO
-
+ H
2
O
K
+
+ CH
3
COOH + OH
-
; po uproszczeniu:
CH
3
COOH + OH
-
- odczyn zasadowy,
+
+ CH
3
COO
-
+ H
2
O
CuOH + CH
3
COOH - gdy sól wywodzi si
zasady i słabego kwasu zarówno kation jak i anion łączą się w cząsteczkę słabego elektrolitu.
-
2Na
+
+ HS
-
+ OH
-
- odczyn zasadowy
+ OH
-
hydroliza dwustopniowa:
H
2
S + OH
-
H
2
S + 2OH
-
+
−
2
4
SO ; zarówno anion jak i kation pochodz
nie ulega hydrolizie.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
udziału w reakcji, można
po uproszczeniu:
gdy sól wywodzi się od słabej
ę
słabego elektrolitu.
hydroliza dwustopniowa:
; zarówno anion jak i kation pochodzą od mocnego

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
1.6
Zadania.
1.6.1
Układanie równań reakcji chemicznych.
1.
Podać wzory tlenków pierwiastków III okresu.
2.
Podać wzory połączeń z wodorem pierwiastków II okresu.
3.
Ułożyć równania reakcji zachodz
azotu(III), tlenek miedzi(II), tlenek chromu(VI), tlenek siarki(VI), tlenek siarki(IV),
tlenek chloru(V), tlenek chloru(VII), tlenek azotu(II), tlenek krzemu(IV), tlenek sodu
Zaznaczyć, przez przekre
4.
Krzem rozpuszcza się
metakrzemian sodu i wodór. Zapisa
H
2
SiO
3
.
5. Zapisać reakcję tlenku fosforu(V) z wod
a) kwas metafosforowy(V)
b)
kwas ortofosforowy(V)
c)
kwas pirofosforowy(V)
6.
Ułożyć równania reakcji z wodorem nast
7.
Bezwodnik kwasu azotowego(V) mo
drugim produktem jest kwas metafosforowy HPO
8.
Zapisać reakcje dysocjacji (w tym wielostopniowo): fluorowodoru, bromowodoru,
kwasu azotowego(V), kwasu azotowego(III), kwasu chlorowego(V), siarkowodoru,
wodorotlenku magnezu,
kwasu szczawiowego.
9.
Zapisać reakcje dysocjacji w wodzie (w tym wielostopniowo): wodorotlenku cynku,
wodorotlenku cyny(II).
10.
Podać w zapisie jonowym i cz
a)
zasady wapniowej z
b)
zasady glinowej z kwasem siarkowym(VI)
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
20
reakcji chemicznych.
wzory tlenków pierwiastków III okresu.
czeń z wodorem pierwiastków II okresu.
równania reakcji zachodzące podczas rozpuszczania w wodzie tlenków: tlenek
azotu(III), tlenek miedzi(II), tlenek chromu(VI), tlenek siarki(VI), tlenek siarki(IV),
tlenek chloru(V), tlenek chloru(VII), tlenek azotu(II), tlenek krzemu(IV), tlenek sodu
, przez przekreślenie strzałki, jeżeli reakcja nie zachodzi:.
Krzem rozpuszcza się w roztworze wodorotlenku sodu. Produktami reakcji s
metakrzemian sodu i wodór. Zapisać równanie reakcji. Kwas metakrzemowy ma wzór
tlenku fosforu(V) z wodą, w której powstaje:
kwas metafosforowy(V)
kwas ortofosforowy(V)
kwas pirofosforowy(V)
równania reakcji z wodorem następujących tlenków: CuO, MnO
Bezwodnik kwasu azotowego(V) można otrzymać z HNO
3
i tlenku fosfor
drugim produktem jest kwas metafosforowy HPO
3
. Zapisać równanie reakcji.
reakcje dysocjacji (w tym wielostopniowo): fluorowodoru, bromowodoru,
kwasu azotowego(V), kwasu azotowego(III), kwasu chlorowego(V), siarkowodoru,
wodorotlenku magnezu, wodorotlenku glinu, wodorotlenku miedzi(II), amoniaku,
reakcje dysocjacji w wodzie (w tym wielostopniowo): wodorotlenku cynku,
wodorotlenku cyny(II).
w zapisie jonowym i cząsteczkowym równania reakcji:
zasady wapniowej z kwasem azotowym(V)
zasady glinowej z kwasem siarkowym(VI)
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ce podczas rozpuszczania w wodzie tlenków: tlenek
azotu(III), tlenek miedzi(II), tlenek chromu(VI), tlenek siarki(VI), tlenek siarki(IV),
tlenek chloru(V), tlenek chloru(VII), tlenek azotu(II), tlenek krzemu(IV), tlenek sodu.
eli reakcja nie zachodzi:.
w roztworze wodorotlenku sodu. Produktami reakcji są
równanie reakcji. Kwas metakrzemowy ma wzór
cych tlenków: CuO, MnO
2
, Fe
2
O
3
.
i tlenku fosforu(V);
równanie reakcji.
reakcje dysocjacji (w tym wielostopniowo): fluorowodoru, bromowodoru,
kwasu azotowego(V), kwasu azotowego(III), kwasu chlorowego(V), siarkowodoru,
wodorotlenku glinu, wodorotlenku miedzi(II), amoniaku,
reakcje dysocjacji w wodzie (w tym wielostopniowo): wodorotlenku cynku,

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
c) zasady sodowej z kwasem ortofosforowym(V)
d) amoniaku z kwasem chlorowym(VII)
11. Zapisać reakcje:
a) tlenku siarki(IV) z wodorotlenkiem wapnia
b) tlenku magnezu z kwasem ortofosforowym(V)
c) tlenku litu z tlenkiem chloru(V)
d) tlenku sodu z siarkowodorem
e) tlenku azotu(V) z wod
12
Dobrać odpowiednie substraty i zapisa
a)
chlorek dihydroksoglinu
b)
chlorek hydroksoglinu
c)
wodorosiarczan(VI) potasu
d)
węglan potasu
13.
Wyjaśnić dlaczego naczynie, w którym przez dłu
amonu jest puste.
14.
Zapisać reakcje, zachodz
a)węglan sodu + azotan(V) srebra
b) siarczek sodu + siarczan(VI)
c) wodorofosforan(V)
d)
azotan(V) amonu + bromek potasu
e)
szczawian sodu + chlorek wapnia
15.
Skały wapienne, których głównym składnikiem jest w
wyniku działania wody i rozpuszczonego w niej tlenku w
reakcji tego procesu, równie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
21
c) zasady sodowej z kwasem ortofosforowym(V)
d) amoniaku z kwasem chlorowym(VII)
a) tlenku siarki(IV) z wodorotlenkiem wapnia
b) tlenku magnezu z kwasem ortofosforowym(V)
) tlenku litu z tlenkiem chloru(V)
d) tlenku sodu z siarkowodorem
e) tlenku azotu(V) z wodą amoniakalną
odpowiednie substraty i zapisać reakcje, w których powstają
chlorek dihydroksoglinu
chlorek hydroksoglinu
wodorosiarczan(VI) potasu
dlaczego naczynie, w którym przez dłuższy czas prażono wodorow
reakcje, zachodzące po zmieszaniu podanych soli:
glan sodu + azotan(V) srebra
b) siarczek sodu + siarczan(VI) żelaza(II)
c) wodorofosforan(V) sodu + chlorek baru
azotan(V) amonu + bromek potasu
szczawian sodu + chlorek wapnia
Skały wapienne, których głównym składnikiem jest węglan wapnia, ulegaj
wyniku działania wody i rozpuszczonego w niej tlenku węgla(IV). Poda
o procesu, również w zapisie jonowym.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
reakcje, w których powstają:
szy czas prażono wodorowęglan
glan wapnia, ulegają erozji w
gla(IV). Podać równanie

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
16.
W produkcji nawozu fosforowego z trudno rozpuszczalnego w wodzie
ortofosforanu(V) wapnia otrzymuje si
wapnia. Zapisz w formie cz
17.
Wodorotlenek sodu jest głównym składnikiem preparatów do czyszczenia
niedrożnych rur. Nie mo
aluminiowych. Zapisać
jonowej.
1.6.2
Hydroliza soli.
1.
Podać wzory czterech soli, które nie ulegaj
2.
Zapisać reakcje zachodz
azotanu(V) wapnia, c
potasu, f) wodorowęglanu sodu.
3.
Zapisać reakcje hydrolizy
4.
Zapisać reakcje hydrolizy i okre
wodorosiarczan(IV) sodu,
wapnia. d) wodorowęglan hydroksomiedzi(II).
1.6.3
Układanie równań reakcji w podanych schematach.
1.
Podać zapis jonowy reakcji:
a. Ca
2+
+ … → CaC
b.
CaC
2
O
4
↓
+ …→ Ca
c.
Mg
2+
+ …→ MgNH
d.
MgNH
4
PO
4
↓
+ …
e.
Zn
2+
+ NH
3
·H
2
O
f.
Zn(OH)
2
↓
+ …→
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
22
W produkcji nawozu fosforowego z trudno rozpuszczalnego w wodzie
ortofosforanu(V) wapnia otrzymuje się rozpuszczalny diwodoroortofosforan(V)
wapnia. Zapisz w formie cząsteczkowej i jonowej równanie tej reakcji.
lenek sodu jest głównym składnikiem preparatów do czyszczenia
nych rur. Nie można go jednak stosować do czyszczenia instalacji
aluminiowych. Zapisać reakcję uzasadniającą takie ostrzeżenie, równie
rech soli, które nie ulegają hydrolizie.
reakcje zachodzące podczas rozpuszczania w wodzie: a) azotanu(V) cynku,
c) wodorofosforanu sodu, d) bromku magnezu,
ę
glanu sodu.
reakcje hydrolizy dwóch soli, których roztwór wodny ma odczyn zasadowy.
reakcje hydrolizy i określić odczyn roztworu, w których produktami s
wodorosiarczan(IV) sodu, b) chlorek dihydroksożelaza(III),
ę
glan hydroksomiedzi(II).
reakcji w podanych schematach.
zapis jonowy reakcji:
CaC
2
O
4
↓
+ …
→
Ca
2+
+ …
MgNH
4
PO
4
↓
+ …
+ …
→
Mg
2+
+ …
O → Zn(OH)
2
↓
+ ….
→
−
2
2
ZnO
+ …
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
W produkcji nawozu fosforowego z trudno rozpuszczalnego w wodzie
rozpuszczalny diwodoroortofosforan(V)
steczkowej i jonowej równanie tej reakcji.
lenek sodu jest głównym składnikiem preparatów do czyszczenia
do czyszczenia instalacji
enie, również w formie
) azotanu(V) cynku, b)
) bromku magnezu, e) węglanu
dwóch soli, których roztwór wodny ma odczyn zasadowy.
odczyn roztworu, w których produktami są: a)
, c) wodorosiarczek

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
g.
−
2
2
ZnO
+ …→ Zn
h.
CaCO
3
↓
+ …→ CO
i.
Ca(HSO
3
)
2
+ ….
j.
(NH
4
)
2
HPO
4
+ ….
2.
Dobrać reagenty i zapisa
udziałem jonów podać w zapisie jonowym:
a. Na
2
O
Na
b.
FeO
FeCl
c.
MgCO
3
Mg(HCO
d. SnO
Na
2
SnO
3.
Dobrać reagenty i zapisa
H
2
S CaS
Ca(HS)
a.
b. Al
2
O
3
→ NaAlO
2
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
23
Zn
2+
+ …
↑
2
CO
+ …
+ ….→ CaSO
3
+ …
+ ….→ (NH
4
)
3
PO
4
+ …
reagenty i zapisać kolejne reakcje w poniższych przemianach; rekcje z
udziałem jonów podać w zapisie jonowym:
Na
2
SO
4
BaSO
4
↓
FeCl
2
FeS
Fe(HS)
2
Mg(HCO
3
)
2
↑
2
CO
SnO
2
Sn(OH)
2
↓
Sn
2+
genty i zapisać kolejne reakcje w poniższych przemianach:
Ca(HS)
2
H
2
S
NaAlO
2
→ AlCl
3
→
Al(OH)
3
↓
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
szych przemianach; rekcje z
szych przemianach:

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.1
Prawa chemiczne.
•
prawo zachowania masy: w reakcji suma mas substratów jest równa sumie mas
produktów;
•
prawo stałości składu: w zwi
stały.
2.2
Mol i masy molowe; ustalanie wzoru chemicznego.
Wzory chemiczne podaj
cząsteczka; w indeksie dolnym podana jest liczba atomów. Na podstawie wzoru
cząsteczkowego można okreś
pierwiastków.
Masa pojedynczego atomu lub cz
jest unit (u = 1,66·10
-24
g); w jednostkach u podawane s
układzie okresowym. Masa czą
wchodzących w jej skład; moż
przykład jedna cząsteczka Na
2
2·22,99u + 32,0u + 4·16,0u = 142,0u = 142
Ten przykład ilustruje jak mała jest masa 1 cz
masy atomowe i molowe masy cz
cząsteczkowa) to ilość gramów
jednostkach mas atomowych (
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
24
prawo zachowania masy: w reakcji suma mas substratów jest równa sumie mas
ci składu: w związku chemicznym stosunek mas pierwiastków jest
ustalanie wzoru chemicznego.
Wzory chemiczne podają symbole atomów pierwiastków, z których zbudowana jest
steczka; w indeksie dolnym podana jest liczba atomów. Na podstawie wzoru
na określić skład ilościowy związku; tj. udział poszcz
Masa pojedynczego atomu lub cząsteczki jest bardzo mała. Jednostk
g); w jednostkach u podawane są masy atomowe pierwiastków w
układzie okresowym. Masa cząsteczki jest równa sumie mas atomowych, wszystkich atomów
cych w jej skład; można ją wyliczyć posługując się danymi z układu okresowego. Na
2
SO
4
ma masę:
·
16,0u = 142,0u = 142· 1,66·10
-24
g = 2,35·10
-22
Ten przykład ilustruje jak mała jest masa 1 cząsteczki. W praktyce stosuje si
masy cząsteczkowe. Molowa masa atomowa (
gramów równa masie 1 atomu (1 cząsteczki)
mowych (u).
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
prawo zachowania masy: w reakcji suma mas substratów jest równa sumie mas
zku chemicznym stosunek mas pierwiastków jest
symbole atomów pierwiastków, z których zbudowana jest
steczka; w indeksie dolnym podana jest liczba atomów. Na podstawie wzoru
zku; tj. udział poszczególnych
steczki jest bardzo mała. Jednostką masy atomowej
masy atomowe pierwiastków w
h, wszystkich atomów
danymi z układu okresowego. Na
22
g
steczki. W praktyce stosuje się molowe
masa atomowa (molowa masa
ą
steczki) wyrażonej w

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
1 Mol zawiera taką liczb
gramach masie atomu (cząsteczki) w jednostce
definicję jednostki masowej u
N =
1
u
=
g
1,6604·10
Definicja mola: mol to ilość 6,02
związku to 6,02·10
23
cząsteczek, 1 mol elektronów to 6,02
Przykład I: Obliczyć masę a)
a) Masa atom tlenu wynosi 16 u; st
b) masa cząsteczki Na
2
SO
4
wynosi 142u;
M - symbol masy molowej (atomowej lub cz
W oparciu o wzór cząsteczki mo
związku.
Przykład II. Obliczyć zawartość
142 g (1 mol) Na
2
SO
4
zawiera dwa mole sodu czyli 2
przypada 46 g Na; udział sodu okre
Zamiana ułamka na procent:
Z definicji 1
100
1
=
%
(procent
3239
,
0
100
1
100
142
46
=
⋅
⋅
(
1
%
100
100
1
100
=
⋅
=
⋅
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
25
ą
liczbę (N) atomów (cząsteczek), że ich masa jest równa
ą
steczki) w jednostce u. Wartość N można wyliczy
.
1g
1,6604·10
-24
g
= 6,022·10
23
ść
6,02·10
23
. 1 mol pierwiastka zawiera 6,02·10
steczek, 1 mol elektronów to 6,02·10
23
elektronów.
a) 6,02·10
23
atomów tlenu, b) 6,02·10
23
cząsteczek Na
16 u; stąd
10
022
,
6
g
10
66
,
1
16
M
23
24
O
16g
=
⋅
⋅
⋅
⋅
=
−
wynosi 142u;
10
022
,
6
g
10
66
,
1
142
M
24
SO
Na
4
2
⋅
⋅
⋅
⋅
=
−
symbol masy molowej (atomowej lub cząsteczkowej).
steczki można obliczyć zawartości poszczególnych pierwiastków w
zawartość sodu w Na
2
SO
4
:
zawiera dwa mole sodu czyli 2·22,99 g = 46 g Na. Na 142 g Na
przypada 46 g Na; udział sodu określa ułamek:
.
g
142
g
46
(procent - z łacińskiego
pro centum, po polsku „na sto” ).
%
39
,
32
%
100
3239
=
⋅
⋅
; pomnożenie przez 1 nie zmienia wartości liczby).
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
e ich masa jest równa w
na wyliczyć w oparciu o
·
10
23
atomów; 1 mol
elektronów.
ą
steczek Na
2
SO
4
.
;
16g
.
10
23
g
142
=
ci poszczególnych pierwiastków w
22,99 g = 46 g Na. Na 142 g Na
2
SO
4
po polsku „na sto” ).
ś
ci liczby).

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
W oparciu o definicję
„zawartość procentowa składnika to liczba jednostek składnika w 100 jednostkach
całości”. Zawartość procentową
w 142 g Na
2
SO
4
a w 100 g Na
2
SO
4
W proporcji iloczyn wyrazów skrajnych jest równy iloczynowi wyrazów
100
23
2
x
142
⋅
⋅
=
⋅
;
W 100 g Na
2
SO
4
znajduje si
Ogólnie zawartość procentowa składnika w mieszaninie:
C
%
=
⋅
całości
składnika
m
m
2.3
Obliczenia stechiometryczne.
Zgodnie z prawami: zachowania masy i stało
chemicznej można wyznaczy
produktów. Można też wyliczy
przeprowadzenia reakcji z podan
Przykład II: Obliczyć masę
azotowego(V).
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
26
W oparciu o definicję
100
1
=
%
- można podać inną definicję udziału procentowe
procentowa składnika to liczba jednostek składnika w 100 jednostkach
procentową można obliczyć więc z proporcji:
jest 2 · 23,0 g Na
będzie x g Na
iloczyn wyrazów skrajnych jest równy iloczynowi wyrazów środkowych:
g
4
,
32
142
0
,
23
2
100
=
⋅
⋅
=
x
.
znajduje się 32,4 g Na, zatem sód stanowi 32,4%
procentowa składnika w mieszaninie:
%
100
⋅
ułamek
Obliczenia stechiometryczne.
Zgodnie z prawami: zachowania masy i stałości składu na podstawie równania reakcji
na wyznaczyć ilości reagujących substratów oraz mas
wyliczyć jaka ilość jednego z substratów potrzebna jest dla
przeprowadzenia reakcji z podaną masą drugiego substratu.
masę tlenku wapnia potrzebną do zobojętnienia 12 g kwasu
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
udziału procentowego:
procentowa składnika to liczba jednostek składnika w 100 jednostkach
iloczyn wyrazów skrajnych jest równy iloczynowi wyrazów środkowych:
soli.
ci składu na podstawie równania reakcji
cych substratów oraz masę powstających
jednego z substratów potrzebna jest dla
ę
tnienia 12 g kwasu

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
•
Równanie reakcji
CaO + 2HNO
Reakcja wskazuje, że 1 czą
6,02·10
23
(1 mol) cząsteczek CaO reaguje z
Współczynniki w równaniu reakcji odpowiadaj
tym przykładzie: 1 mol CaO reaguje z 2 molami HNO
1 mol H
2
O.
•
Obliczenie masy molowej reagentów, o których mowa w zadaniu:
g
56
16
0
,
40
M
CaO
=
+
=
;
Na 2·63 g HNO
3
potrzeba 56 g CaO; zatem na 1
a na 12 g HNO
3
12 razy tyle:
Taki sam wynik otrzyma się z proporcji:
56 g CaO zobojętnia 2·63 g
x g CaO zobojętni 12 g HNO
12
56
x
63
2
⋅
=
⋅
⋅
; stąd
x
Przy układaniu proporcji nale
informacje i zwracać uwagę
występują te same substancje (lub roztwory).
Przykład III: a) Obliczyć mas
kwasem solnym, 5 g dwutlenku w
b) Jaką objętość, w warunkach normalnych, zajmuje ta ilo
a) Produktami reakcji soli słabego kwasu z mocnym kwasem s
kwasu.
CaCO
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
27
CaO + 2HNO
3
→
Ca(NO
3
)
2
+ H
2
O
e 1 cząsteczka CaO reaguje z dwoma cząsteczkami HNO
steczek CaO reaguje z 2·6,02·10
23
(2 mol) cząsteczkami
Współczynniki w równaniu reakcji odpowiadają relacjom molowym reagentów. W
przykładzie: 1 mol CaO reaguje z 2 molami HNO
3
, w reakcji powstaje 1 mol Ca(NO
Obliczenie masy molowej reagentów, o których mowa w zadaniu:
g
63
16
3
14
0
,
1
M
3
HNO
=
⋅
+
+
=
potrzeba 56 g CaO; zatem na 1 g HNO
3
potrzebne jest
126
56
g
33
,
5
12
126
56
m
CaO
=
⋅
=
;
ę
z proporcji:
63 g HNO
3
tni 12 g HNO
3
;
g
33
,
5
63
2
12
56
x
=
⋅
⋅
=
CaO
Przy układaniu proporcji należy obok liczb podawać jednostki i symbole lub inne istotne
uwagę na to, czy w obu wierszach, w analogicznych pozycjach
te same substancje (lub roztwory).
ć
masę węglanu wapnia potrzebną do otrzymania, w reakcji z
kwasem solnym, 5 g dwutlenku węgla.
, w warunkach normalnych, zajmuje ta ilość CO
2
?
) Produktami reakcji soli słabego kwasu z mocnym kwasem są: słaby kwas i sól mocnego
CaCO
3
+ 2HCl → CaCl
2
+ H
2
CO
3
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
steczkami HNO
3
, zatem
steczkami HNO
3
.
relacjom molowym reagentów. W
, w reakcji powstaje 1 mol Ca(NO
3
)
2
i
126
56
g CaO;
jednostki i symbole lub inne istotne
na to, czy w obu wierszach, w analogicznych pozycjach
do otrzymania, w reakcji z
: słaby kwas i sól mocnego

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Kwas węglowy jest nietrwały i rozkłada si
można zapisać też równanie: CaCO
Z 1 mola CaCO
3
powstaje 1 mol kwasu w
Masy molowe reagentów:
M
CaCO
Ilościowe relacje CaCO
3
i CO
ze 100 g CaCO
3
otrzymuje si
z x g CaCO
3
otrzyma się
5
100
x
44
⋅
=
⋅
g
36
,
11
44
5
100
x
=
⋅
=
; potrzeba
b) W 1811. Avogadro sformułował prawo: „równe obj
warunkach ciśnienia i temperatury, zawieraj
definicji wynika, że
6,02·10
23
samych warunkach ciśnienia i temperatury zajmuje tak
normalnych (0 ˚C, 1013 hPa)
objętość molowa gazu.
W oparciu o prawo Awogadro mo
44 g CO
2
zajmuje obj
5 g CO
2
zajmuje obj
=
x
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
28
glowy jest nietrwały i rozkłada się wydzielając CO
2
H
2
CO
3
→
↑
2
CO + H
2
O
równanie: CaCO
3
+ 2HCl → CaCl
2
+
↑
2
CO + H
2
O
powstaje 1 mol kwasu węglowego, i po jego rozkładzie powstaje 1 mol CO
g
100
16
3
12
40
3
CaCO
=
⋅
+
+
=
;
12
M
2
CO
+
=
i CO
2
opisuje proporcja:
otrzymuje się 44 g CO
2
otrzyma się 5 g CO
2
; potrzeba
11,36 g CaCO
3
) W 1811. Avogadro sformułował prawo: „równe objętości różnych gazów, w tych samych
nienia i temperatury, zawierają jednakową ilość cząsteczek”. Z podanej
23
cząsteczek, czyli 1 mol każdej substancji gazowej w tych
nienia i temperatury zajmuje taką samą objęto
˚C, 1013 hPa)
1 mol gazu zajmuje objętość 22,4 dm
3
–
W oparciu o prawo Awogadro można zapisać proporcję:
zajmuje objętość 22,4 dm
3
zajmuje objętość
x dm
3
3
dm
2,54
=
⋅
=
44
4
,
22
5
CO
2
.
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
glowego, i po jego rozkładzie powstaje 1 mol CO
2
.
g
44
16
2
=
⋅
+
nych gazów, w tych samych
ą
steczek”. Z podanej
dej substancji gazowej w tych
objętość. W warunkach
wartość ta to tzw.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład IV. Jaką objętość tlenu (w warunkach normalnych) uzyska si
rozkładu 1 g chloranu(V) potasu, przy 4% stratach gazu?
•
Równanie reakcji:
Masy molowe:
M
3
KClO
z 2·122,6 g KClO
3
powstają 3 mo
z 1 g KClO
3
powstanie
6
,
122
2
1
4
,
22
3
x
=
⋅
⋅
⋅
=
Wyliczona objętość tlenu 0,274 dm
objętość będzie o 4% mniejsza:
Zadania tego typu najlepiej rozwi
100
1
=
%
-
wynika, że zamiast 100 jednostek obj
(4 jednostki to strata).
•
Objętość tlenu, po odliczeniu strat:
Przykład V: Ile g wodorowęglanu magnezu
jest do otrzymania, w wyniku rozkładu termicznego, 10 dm
normalnych)
Mg(HCO
3
)
2
∆
T
MgO + H
146
2
)
=
3
Mg(HCO
M
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
29
ść
tlenu (w warunkach normalnych) uzyska si
rozkładu 1 g chloranu(V) potasu, przy 4% stratach gazu?
2KClO
3
→
2KCl +
↑
2
3O
g
6
,
122
16
3
5
,
35
1
,
39
=
⋅
+
+
=
powstają 3 mole O
2
; tj. objętość 3·22,4 dm
3
O
2
powstanie x dm
3
O
2
2
O
3
dm
0,274
=
tlenu 0,274 dm
3
nie uwzględnienia strat. W rzeczywisto
dzie o 4% mniejsza:
Zadania tego typu najlepiej rozwiązywać w oparciu o definicję procentu.
e zamiast 100 jednostek objętościowych (dm
3
) uzysk
tlenu, po odliczeniu strat:
zamiast 100 dm
3
O
2
otrzymuje si
zamiast 0,274 dm
3
O
2
otrzyma si
100
97
274
,
0
dm
0,266
y
=
⋅
=
ę
glanu magnezu zawierającego 6,45% zanieczyszcze
jest do otrzymania, w wyniku rozkładu termicznego, 10 dm
3
CO
2
(mierzonego w warunkach
MgO + H
2
O +
↑
2
2CO
g
146
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
tlenu (w warunkach normalnych) uzyska się z termicznego
dnienia strat. W rzeczywistości otrzymana
procentu. Z definicji: 1
) uzyska się 96 jednostek
otrzymuje się 96 dm
3
otrzyma się y dm
3
2
O
3
dm
cego 6,45% zanieczyszczeń potrzebne
(mierzonego w warunkach

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
z 1 mola Mg(HCO
3
)
2
powstają
podczas prażenia 146 g Mg(HCO
z x g Mg(HCO
22
146
x
=
Obliczona na podstawie reakcji masa dotyczy czystego Mg(HCO
zadania sól zawiera domieszki i jej nawa
•
Obliczenie masy zanieczyszczonej soli, która zawiera oblicz
Mg(HCO
3
)
2
:
w 100 g zanieczyszczonej soli jest 93,55 g
y g zanieczyszczonej soli zawiera 32,6 g
34,84g
y
=
⋅
=
55
,
93
6
,
32
100
2.4
Stężenia roztworów.
2.4.1
Stężenia procentowe
W praktyce laboratoryjnej, podobnie jak w
Są to mieszaniny dwóch lub wi
jako udział procentowy składnika(ów) (np. opakowania leków, niek
spożywczych i in.). Zazwyczaj st
(C
%
), rzadziej objętościowych. Udział procentowy w relacji obj
jest najczęściej dla określenia składu mieszanin gazów lub cieczy
procentowa dotyczy objętości składników, to obok warto
podaje się dodatkowo: „v/v” lub „% obj.”) (np. etykiety na opakowaniach trunków
sprawdzić informacje w sklepie,
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
30
powstają 2 mole CO
2
enia 146 g Mg(HCO
3
)
2
otrzymuje się 2·22,4 dm
3
CO
2
g Mg(HCO
3
)
2
otrzyma 10 dm
3
CO
2
2
3
)
HCO
(
Mg
2
4
,
22
10
146
g
32,6
=
⋅
⋅
;
Obliczona na podstawie reakcji masa dotyczy czystego Mg(HCO
3
)
2
. Zgodnie z tre
zadania sól zawiera domieszki i jej naważka powinna być wyższa.
Obliczenie masy zanieczyszczonej soli, która zawiera obliczoną
w 100 g zanieczyszczonej soli jest 93,55 g Mg(HCO
3
)
2
(po odjęciu zanieczyszcze
g zanieczyszczonej soli zawiera 32,6 g Mg(HCO
3
)
2
Mg(HCO
3
)
2
z domieszkami.
W praktyce laboratoryjnej, podobnie jak w życiu codziennym, używane s
to mieszaniny dwóch lub większej ilości związków, których skład okre
jako udział procentowy składnika(ów) (np. opakowania leków, niek
ywczych i in.). Zazwyczaj stężenie procentowe odnosi się do procentów wagowych
ciowych. Udział procentowy w relacji objętości składników, stosowany
lenia składu mieszanin gazów lub cieczy. Jeżeli podana zawarto
ś
ci składników, to obok wartości liczbowej udziału procentowego
dodatkowo: „v/v” lub „% obj.”) (np. etykiety na opakowaniach trunków
informacje w sklepie, nie kupować).
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
. Zgodnie z treścią
oną wcześniej ilość
ciu zanieczyszczeń)
ż
ywane są roztwory.
zków, których skład określany jest często
jako udział procentowy składnika(ów) (np. opakowania leków, niektórych produktów
do procentów wagowych
ci składników, stosowany
ż
eli podana zawartość
ci liczbowej udziału procentowego
dodatkowo: „v/v” lub „% obj.”) (np. etykiety na opakowaniach trunków -można

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Zawartość składnika w mieszaninie okre
jako udział procentowy, zgodnie ze wzorem:
zamiana ułamka na procent omawiana wcze
Stężenie procentowe (c
jednostkach wagowych roztworu (mieszaniny)
Przykład VI: Ile g chlorku wapnia nale
6%?
Sposób I: Zgodnie z definicj
CaCl
2
i 94 jednostki (g) H
2
O.
Można zapisać proporcję
6 g CaCl
2
jest w
x g CaCl
CaCl
94
100
6
x
g
6,38
=
⋅
=
Sposób II: Zamiana ułamka na procent:
%
100
⋅
=
całości
składnika
m
m
%
c
; w rozwi
Szukana masa soli x, po dodaniu do 100 g wody
%
100
⋅
+
=
x
100
x
6%
;
600 + 6x = 100x;
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
31
składnika w mieszaninie określa ułamek:
)
roztworu
(
całości
substancji
m
m
, który mo
jako udział procentowy, zgodnie ze wzorem:
100
)
roztworu
(
⋅
=
całości
substancji
m
m
%
c
zamiana ułamka na procent omawiana wcześniej)
enie procentowe (c
%
) podaje ilość jednostek wagowych składnika w 100
jednostkach wagowych roztworu (mieszaniny).
Ile g chlorku wapnia należy dodać do 100 g wody aby otrzyma
Zgodnie z definicją 100 jednostek (g) roztworu zawiera 6 jednostek (g)
proporcję:
jest w 94 g H
2
O
g CaCl
2
będzie w 100 g H
2
O
2
CaCl
Sposób II: Zamiana ułamka na procent:
; w rozwiązywanym przykładzie:
=
roztworu
CaCl
m
m
%
c
, po dodaniu do 100 g wody - masa roztworu 100 + x
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
, który może być wyrażony
%
100
(matematyczna
jednostek wagowych składnika w 100
do 100 g wody aby otrzymać roztwór
100 jednostek (g) roztworu zawiera 6 jednostek (g)
%
100
⋅
roztworu
2
100 + x

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
94x = 600;
2
CaCl
94
600
x
g
6,38
=
=
Przykład VII: Ile stałego KOH nale
powstał roztwór 12%?
Sposób I: Podczas sporz
•
Obliczenie masy H
2
O w 400 g 10% roztworu:
100 g roztworu zawiera 90 g H
400 g roztworu zawiera
360
100
90
400
x
=
⋅
=
W 12% roztworze KOH zawarto
zadania będzie obliczenie masy 12% roztworu, w którym zawarte jest 360 g H
88 g H
2
O jest w 100 g roztworu
360 g H
2
O jest w
409,1
y
=
⋅
=
88
360
100
różnica mas roztworów 409,1g
Sprawdzenie:
100
⋅
=
roztworu
KOH
m
m
%
c
100
⋅
+
=
409,1
9,1
40
%
c
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
32
Ile stałego KOH należy dodać do 400 g 10% roztworu KOH aby
Podczas sporządzania roztworu nie zmieni się masa wody.
O w 400 g 10% roztworu:
100 g roztworu zawiera 90 g H
2
O
400 g roztworu zawiera x g H
2
O
O
H
g
2
; i 40 g KOH
W 12% roztworze KOH zawartość wody wynosi 88% (100% - 12%). Rozwi
dzie obliczenie masy 12% roztworu, w którym zawarte jest 360 g H
O jest w 100 g roztworu
O jest w y g roztworu
409,1 ; masa roztworu zwiększyła się bo dodano KOH;
nica mas roztworów 409,1g – 400 g = 9,1 g masa dodanego KOH
%
100
%
12
%
100
12
,
0
%
100
=
⋅
=
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
do 400 g 10% roztworu KOH aby
masa wody.
12%). Rozwiązaniem
dzie obliczenie masy 12% roztworu, w którym zawarte jest 360 g H
2
O:
bo dodano KOH;
masa dodanego KOH

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Sposób II: zamiana ułamka na procent
szukana masa KOH – x
100
x
%
12
⋅
+
+
=
x
m
m
10%
roztworu
roztworze
KOHw10%
•
W pierwszym etapie oblicza si
%
100
400
%
10
⋅
=
z
;
obliczoną wartość wstawiamy do równania:
12·400 +12x = 4000 + 100 x;
88·x = 800;
KOH
g
9,1
=
=
88
800
x
Przykład VIII: W jakim stosunku wagowym nale
otrzymać roztwór 10%?
Z wzoru
%
100
⋅
=
roztworu
składnika
m
m
%
c
W mieszaninie 12% i 2% roztworu masa CaCl
zmieszanych roztworach, a masa całego roztworu jest sum
m
%
10
=
Rozwiązaniem zadania będzie obliczenie masy 2% roztworu, któr
roztworu 12%; i równanie
VIII
można przekształcić w równanie
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
33
ułamka na procent
%
100
⋅
=
całości
składnika
m
m
%
c
x; po dodaniu KOH wzrasta masa roztworu:
%
100
;
W pierwszym etapie oblicza się masę (
z) KOH w 400 g 10% roztworu:
z = 40 g;
wstawiamy do równania:
%
100
x
0
%
12
⋅
+
+
=
x
400
4
400 +12x = 4000 + 100 x;
W jakim stosunku wagowym należy zmieszać 2% i 12% roztwór CaCl
; po zmieszaniu roztworów:
%
0
=
roztworu10
CaCl
m
m
10%
2
1
W mieszaninie 12% i 2% roztworu masa CaCl
2
jest równa sumie mas CaCl
zmieszanych roztworach, a masa całego roztworu jest sumą mas obu roztworów.
%
100
m
m
m
m
%
2
r
r12%
%
2
CaCl
%
12
CaCl
2
2
⋅
+
+
(VIII
ę
dzie obliczenie masy 2% roztworu, którą należ
VIII z czterema niewiadomymi (
%
2
1
CaCl
2
m
,
CaCl
m
w równanie VIIIa z jedną niewiadomą - m
r 2%
:
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
) KOH w 400 g 10% roztworu:
2% i 12% roztwór CaCl
2
aby
%
100
⋅
%
roztworu10
10%
;
jest równa sumie mas CaCl
2
w obu
mas obu roztworów.
VIII)
należy dodać do 100g
%
2
CaCl
2
,
%
12
r
m
,
%
2
r
m
)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
•
Obliczenie masy CaCl
2
w 100 g 12% roztworu:
wyznaczenie masy CaCl
po podstawieniu do wzoru VIII
Po zmieszaniu 100 g 12%
zmieszać roztwory w proporcji wagowej: 4
2.4.2
Stężenia molowe.
W laboratorium chemicznym cz
liczbę moli (n) związku zawart
roztworu to tzw. stężenie molowe (c
zawarta jest w objętości 1 dm
mol
[
)
dm
(
3
roztworu
)
substancji
moli
(liczba
V
n
c
M
=
Symbol związku (jonu) w nawiasie kwadratowym oznacza st
np. [H
+
] = 0,25 oznacza stężenie kationu wodorowego równe 0,25 mol/dm
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
34
w 100 g 12% roztworu:
%
100
m
m
%
12
r12%
%
12
CaCl
2
⋅
=
2
%
12
CaCl
CaCl
100
12
,
0
m
2
12g
=
⋅
=
wyznaczenie masy CaCl
2
w 2% roztworze:
%
100
m
m
%
2
r2%
2%
CaCl
2
⋅
=
r2%
2%
CaCl
m
02
,
0
m
2
⋅
=
VIII:
%
100
mr
00
1
m
02
,
0
2
1
%
10
%
2
%
2
r
⋅
+
⋅
+
=
(
%
2
%
2
r
mr
2
,
0
10
12
m
100
⋅
+
⋅
=
+
;
20
m
8
,
0
%
2
r
=
⋅
; m
r 2%
= 25 g
Po zmieszaniu 100 g 12% roztworu i 25 g 2% roztworu powstaje roztwór 10%. Nale
roztwory w proporcji wagowej: 4
12%
: 1
2%
W laboratorium chemicznym często używane są roztwory, których st
zku zawartą w objętości 1 dm
3
roztworu. Ten sposób okre
enie molowe (c
M
). Stężenie molowe (c
M
) to liczba moli zwi
ci 1 dm
3
roztworu:
]
dm
/
mol
3
Jednostką objętości jest 1 dm
(jonu) w nawiasie kwadratowym oznacza stężenie molowe (c
ęż
enie kationu wodorowego równe 0,25 mol/dm
3
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
%
(VIIIa)
roztworu i 25 g 2% roztworu powstaje roztwór 10%. Należy
roztwory, których stężenia podają
roztworu. Ten sposób określenia składu
) to liczba moli związku jaka
ci jest 1 dm
3
.
enie molowe (c
M
):
3
.

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład IX: Ile g chlorowodoru zawiera 400 cm
objętość chlorowodoru (mierzon
•
Obliczenie ilość moli HCl w roztworze:
•
Obliczenie masy rozpuszczonego HCl:
1 mol HCl to 36,45 g
a 0,08 mola HCl to y
g
2,91
y
=
⋅
=
1
08
,
0
45
,
36
•
Obliczenie objętości rozpuszczonego HCl w postaci gazu w warunkach
1 mol HCl zajmuje obję
0,08 mola HCl zajmuje obj
dm
1,79
z
=
⋅
=
4
,
22
08
,
0
Przykład X: W 100 g wody, w temperaturze 20°C rozpuszcza si
miedzi(II). Obliczyć stężenie roztworu
równa 1,08 g/cm
3
.
a) metoda I: Masa roztworu po rozpuszczeniu Cu(NO
18,4 g Cu(NO
3
)
2
x g Cu(NO
5
4
,
118
100
4
,
18
x
g
,54
1
=
⋅
=
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
35
Ile g chlorowodoru zawiera 400 cm
3
0,20M roztwór kwasu solnego? Jak
chlorowodoru (mierzoną w warunkach normalnych) rozpuszczono w tym roztworze?
moli HCl w roztworze:
1000 cm
3
0,2M roztworu zawiera 0,2 mola HCl
400 cm
3
0,2M roztworu zawiera x moli HCl
HCl
mola
0,08
x
=
⋅
=
1000
2
,
0
400
Obliczenie masy rozpuszczonego HCl:
g
45
,
36
45
,
35
0
,
1
M
HCl
=
+
=
1 mol HCl to 36,45 g
g
HCl
ci rozpuszczonego HCl w postaci gazu w warunkach
1 mol HCl zajmuje objętość 22,4 dm
3
0,08 mola HCl zajmuje objętość z dm
3
HCl
dm
3
W 100 g wody, w temperaturze 20°C rozpuszcza się 18,4 g azotanu(V)
enie roztworu a) procentowe, b) molowe. Gęsto
Masa roztworu po rozpuszczeniu Cu(NO
3
)
2
: 100 + 18,4 = 118,4 g
jest w 118,4 g roztworu
g Cu(NO
3
)
2
jest w 100 g roztworu
2
3
)
NO
(
Cu
g
; nasycony roztwór Cu(NO
3
)
2
ma st
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
0,20M roztwór kwasu solnego? Jaką
w warunkach normalnych) rozpuszczono w tym roztworze?
0,2M roztworu zawiera 0,2 mola HCl
moli HCl
;
g
ci rozpuszczonego HCl w postaci gazu w warunkach normalnych:
W 100 g wody, w temperaturze 20°C rozpuszcza się 18,4 g azotanu(V)
ę
stość roztworu jest
: 100 + 18,4 = 118,4 g
ma stężenie 15,54%

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
metoda II:
100
⋅
=
całości
składnika
m
m
%
c
c
%
=
⋅
=
4
,
118
4
,
18
%
100
2
roztworu
)
Cu(NO
m
m
3
b) Należy wyliczyć liczbę moli Cu(NO
•
Obliczenie masy 1dm
3
roztworu Cu(NO
Gęstość (d) to masa jednostki obj
Masa 1 dm
3
roztworu = 1,08 g/cm
•
Obliczenie masy Cu(NO
3
15,54 g Cu(NO
3
)
y g Cu(NO
100
1080
54
,
15
y
⋅
=
•
Liczba moli jaką zawiera obliczona masa Cu(NO
14
2
5
,
63
M
2
3
)
NO
(
Cu
+
⋅
+
=
187,5 g Cu(NO
3
)
167,8 g Cu(NO
5
,
187
8
,
167
0,894
z
=
=
Wyliczona z ostatniej proporcji ilo
)
molowa
masa
(
)
ą
zku
zwi
masa
(
M
m
)
z
(
=
n
4
1dm
3
=1000 cm
3
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
36
%
100
;
%
100
2
⋅
=
roztworu
)
Cu(NO
m
m
3
%
c
15,54%
=
⋅
=
⋅
%
100
1554
,
0
%
100
ę
moli Cu(NO
3
)
2
w 1 dm
3
roztworu.
roztworu Cu(NO
3
)
2
(d) to masa jednostki objętości:
V
m
=
d
; stąd
V
d
⋅
=
m
roztworu = 1,08 g/cm
3
·
1000 cm
34
= 1080 g,
3
)
2
w 1 dm
3
(1080 g) 15,54% roztworu:
)
2
jest w 100 g roztworu
g Cu(NO
3
)
2
jest w 1080 g roztworu
2
3
)
NO
(
Cu
1080
g
167,8
=
;
zawiera obliczona masa Cu(NO
3
)
2
:
g
5
,
187
16
6
=
⋅
+
;
)
2
to 1 mol
167,8 g Cu(NO
3
)
2
to z moli
2
3
)
NO
(
Cu
moli
0,894
; [Cu(NO
3
)
2
] = 0,894
Wyliczona z ostatniej proporcji ilość moli może być wyliczona również ze wzoru:
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ż
ze wzoru:

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Przykład XI: Obliczyć pH 0,15M roztworu kwasu octowego, którego stopie
3,7%.
CH
3
COOH
CH
3
COO
pH = -log [H
+
];
Stężenie jonów wodorowych w roztworze słabego kwasu wylicza si
c
0
= [CH
3
COOH] = 0,15 mol/dm
[H
+
] = c
j
= α·c
0
= 0,037·0,15 = 5,55·10
pH = -log 5,55·10
-3
= 2,25
Uwaga: w obliczeniach wartość
2.4.3
Obliczenia stechiometryczne z uwzgl
Przykład XII: Obliczyć obję
wytrącenia wodorotlenku magnezu z 100 cm
MgSO
4
•
Obliczenie ilości moli MgSO
)
dm
(
M
3
v
c
⋅
=
⋅
n
; n = 0,12
reakcji przereaguje 0,024 moli KOH.
•
Obliczenie masy KOH: 1 mol KOH to 56 g
0,024 mola KOH to
x
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
37
pH 0,15M roztworu kwasu octowego, którego stopie
COO
-
+ H
+
enie jonów wodorowych w roztworze słabego kwasu wylicza się z wzoru:
COOH] = 0,15 mol/dm
3
;
·0,15 = 5,55·10
-3
;
2,25
Uwaga: w obliczeniach wartość α podajemy jako ułamek a nie %
Obliczenia stechiometryczne z uwzględnieniem stężeń roztworów.
objętość 2% roztworu KOH o gęstości 1,02 g/cm
cenia wodorotlenku magnezu z 100 cm
3
0,12M roztworu MgSO
4
.
+ 2KOH → Mg(OH)
2
↓
+ K
2
SO
4
ci moli MgSO
4
:
]
dm
/
mol
[
)
dm
(
3
3
roztworu
)
substancji
moli
(liczba
V
n
c
M
=
n = 0,12·0,1 = 0,012 moli MgSO
4
– z tą ilością, zgodnie z równaniem
reakcji przereaguje 0,024 moli KOH.
56
M
KOH
=
Obliczenie masy KOH: 1 mol KOH to 56 g
0,024 mola KOH to x g
x = 0,024·56 = 1,34 g KOH
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
pH 0,15M roztworu kwasu octowego, którego stopień dysocjacji α =
z wzoru:
0
j
c
c
=
α
;
ci 1,02 g/cm
3
potrzebną do
ą
, zgodnie z równaniem
g
56

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
lub z wzoru:
molowa
masa
(
M
zwi
masa
(
m
=
n
•
Obliczenie w jakiej masie 2% roztworu KOH, znajduje si
w 100 g 2% roztworu jest 2 g
w
y g 2% roztworu jest 1,34 g KOH
67,0
y
=
⋅
=
2
100
34
,
1
Z wzoru:
V
m
=
d
; objętość 2% roztworu:
Przykład XIII: Do 300 cm
3
0,15M azotanu ołowiu(II) dodano 250 cm
siarkowego(VI) o gęstości 1,05 g/cm
reakcji?
Pb(NO
3
)
Masy molowe:
M
4
2
SO
H
=
•
Obliczenie liczby moli Pb(NO
)
dm
(
M
3
v
c
⋅
=
⋅
n
;
•
Obliczenie liczby moli H
2
SO
1:
Obliczenie masy 7% roztworu H
m
2:
Ile gramów H
2
SO
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
38
)
molowa
)
ą
zku
zwi
; m = n·M = 0,024·56 = 1,34 g KOH
Obliczenie w jakiej masie 2% roztworu KOH, znajduje się 1,34 g zasady:
w 100 g 2% roztworu jest 2 g KOH
g 2% roztworu jest 1,34 g KOH
g
67,0
ść
2% roztworu:
3
65,7cm
v
=
=
=
3
cm
/
g
02
,
1
g
0
,
67
d
m
2% KOH
0,15M azotanu ołowiu(II) dodano 250 cm
3
7% roztworu kwasu
ci 1,05 g/cm
3
. Ile gramów siarczanu(VI) ołowiu(II) wytr
)
2
+ H
2
SO
4
→ PbSO
4↓
+ 2HNO
3
g
98
=
;
g
2
,
303
M
4
PbSO
=
Pb(NO
3
)
2
:
:
]
dm
/
mol
[
)
dm
(
3
3
roztworu
)
substancji
moli
(liczba
V
n
c
M
=
;
045
,
0
3
,
0
15
,
0
=
⋅
=
2
3
)
Pb(NO
n
SO
4
:
Obliczenie masy 7% roztworu H
2
SO
4
: (z wzoru
V
m
=
d
);
g
5
,
262
cm
/
g
05
,
1
cm
250
3
3
=
⋅
=
4
2
SO
7%H
m
;
SO
4
znajduje się w 262,5 g 7% roztworu:
%
=
262,5
m
H
7
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
KOH
1,34 g zasady:
2% KOH
7% roztworu kwasu
. Ile gramów siarczanu(VI) ołowiu(II) wytrąciło się w
045
%
100
⋅
262,5
4
2
SO
H
;

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
⋅
=
100
262,5
7
m
4
2
SO
H
Po zmieszaniu 0,045 Pb(NO
część kwasu pozostaje w nadmiarze.
Obliczenie masy osadu z wzoru:
Przykład XIV: Do 300 cm
dodano 500 cm
3
roztworu zasady sodowej o pH = 12. Obliczy
roztworu?
2NaOH + H
•
Obliczenie liczby moli H
2
SO
1:
obliczenie masy H
z wzoru:
V
m
=
d
w 100 g 0,25 % roztworu jest 0,25 g
w 300 g 0,25% roztworu jest x g
0,75
x
=
⋅
=
100
25
,
0
300
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
39
18,37g
=
; z wzoru:
)
molowa
masa
(
M
)
ą
zku
zwi
masa
(
m
=
n
0,187mola
n
4
2
SO
H
=
=
98
37
,
18
Pb(NO
3
)
2
mola i 0,187 mola H
2
SO
4
wytrąci się
w nadmiarze.
Obliczenie masy osadu z wzoru:
)
molowa
masa
(
M
)
ą
zku
zwi
masa
(
m
=
n
13,62g
m
4
PbSO
=
⋅
=
045
,
0
2
,
303
300 cm
3
0,25% roztworu kwasu siarkowego(VI) o g
roztworu zasady sodowej o pH = 12. Obliczyć pH mieszaniny. Jaki jest odczyn
2NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O
SO
4
:
obliczenie masy H
2
SO
4
w 300 cm
3
0,25% roztworu:
; m
0,12%
= d·v = 300 cm
3
·
1 g/cm
3
= 300 g
w 100 g 0,25 % roztworu jest 0,25 g H
2
SO
4
w 300 g 0,25% roztworu jest x g H
2
SO
4
4
2
SO
H
g
0,75
,
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ę
0,045 mola PbSO
4↓
;
0,25% roztworu kwasu siarkowego(VI) o gęstości d = 1g/cm
3
pH mieszaniny. Jaki jest odczyn

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2:
Obliczenie liczby moli H
)
molowa
masa
(
M
)
ą
zku
zwi
masa
(
m
=
n
98
75
,
0
mola
10
7,65
n
3
−
⋅
=
=
•
Obliczenie liczby moli NaOH:
NaOH → [Na
+
] + [OH
roztwór NaOH o pH = 12:
12
14
14
10
10
]
H
[
10
−
−
+
−
=
=
=
]
[OH
-
z wzoru:
roztworu
moli
(liczba
V
n
c
M
=
- na zobojętnienie 0,005 moli NaOH potrzebne jest
roztwór H
2
SO
4
zawierał 0,00765
0,00765- 0,0025 = 0,00515
•
Obliczenie pH roztworu po zmieszaniu:
H
1:
Obliczenie
2
H
M
c
objętość roztworu po zmieszaniu jest równa sumie obj
W 800 cm
3
(300 cm
c
[H
+
] = 2· 0,00643 = 0,0128;
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
40
Obliczenie liczby moli H
2
SO
4
w 300 cm
3
0,25% roztworu:
;
g
98
M
4
2
SO
H
=
4
2
SO
H
mola
Obliczenie liczby moli NaOH:
] + [OH
-
] - mocna zasada [OH
-
] = [NaOH]
roztwór NaOH o pH = 12:
[H
+
] = 10
-12
; [H
+
]·[OH
-
] = 10
-14
2
10
−
=
;
[OH
-
] = c
MNaOH
= 10
-2
= 0,01M,
]
dm
/
mol
[
)
dm
(
3
3
)
substancji
moli
;
n
NaOH
= c
M
·
v = 0,01
tnienie 0,005 moli NaOH potrzebne jest 0,0025 mola H
2
SO
4
;
0,00765 mola – część kwasu:
0,00515 moli pozostaje i odczyn roztworu będzie kwaś
Obliczenie pH roztworu po zmieszaniu:
H
2
SO
4
→
2H
+
+
−
2
4
SO
[H
+
] = 2
4
2
SO
H
M
c
⋅
4
2
SO
: Przy mieszaniu roztworów rozcieńczonych mo
roztworu po zmieszaniu jest równa sumie objętości:
(300 cm
3
+ 500 cm
3
) roztworu jest 0,00515 mola H
2
SO
4
:
mol
[
8
,
0
00515
,
0
)
dm
(
3
0,00643
n
c
M
=
=
=
roztworu
)
substancji
moli
(liczba
V
; pH = -log 0,0128 = 1,89
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
v = 0,01·0,5 = 0,005 moli
dzie kwaśny.
czonych można założyć, że
]
dm
/
mol
3

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Podsumowanie: W rozwiązaniu zada
100
⋅
=
całości
składnika
m
m
%
c
V
m
=
d
molowa
masa
(
M
zwi
masa
(
m
=
n
dm
(
roztworu
substancji
moli
(liczba
V
n
c
M
=
Należy pamiętać, że woda w
2.5
Zadania.
2.5.1
Mol i masa molowa; ustalanie wzoru chemicznego; stechiometria.
1.
Ile moli diwodoroortofosforanu(V) amonu zawarte jest w 10 g zwi
2. Obliczyć masę wodorow
azotowym(V) 2 dm
3
zanieczyszczeń.
3.
Jaka jest masa molowa gazu, którego g
g/dm
3
?
4. Masa mieszaniny węglanu sodu i tlenku sodu po wypra
zmniejszyła się o 3%. Co pozostało w naczyniu; jaki był pocz
mieszaniny?
5. Jaka objętość (warunki normalne) amoniaku potrzebna jest do przeprowadzenia 15 g
kwasu ortofosforowego(V) w wodoroortofosforan(V) amonu?
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
41
zaniu zadań warto korzystać ze wzorów, które są podstaw
%
100
)
molowa
)
ą
zku
zwi
]
dm
/
mol
[
)
dm
3
3
)
substancji
e woda w temperaturze pokojowej ma gęstość 1 g/cm
3
.
Mol i masa molowa; ustalanie wzoru chemicznego; stechiometria.
Ile moli diwodoroortofosforanu(V) amonu zawarte jest w 10 g zwią
wodorowęglanu sodu, potrzebną do otrzymania w reakcji z kwasem
(warunki normalne) dwutlenku węgla. Sól zawiera 8 %
.
Jaka jest masa molowa gazu, którego gęstość w warunkach normalnych wynosi 0,714
ę
glanu sodu i tlenku sodu po wyprażeniu do stałej masy
o 3%. Co pozostało w naczyniu; jaki był pocz
mieszaniny? (odp. 7,23% Na
2
CO
(warunki normalne) amoniaku potrzebna jest do przeprowadzenia 15 g
kwasu ortofosforowego(V) w wodoroortofosforan(V) amonu?
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
podstawą definicji:
Ile moli diwodoroortofosforanu(V) amonu zawarte jest w 10 g związku?
(odp. 0,087 mola)
do otrzymania w reakcji z kwasem
gla. Sól zawiera 8 %
(odp. 8,16 g)
w warunkach normalnych wynosi 0,714
(odp. 16 g/mol)
ż
eniu do stałej masy
o 3%. Co pozostało w naczyniu; jaki był początkowy skład
CO
3
i 92,77% Na
2
O)
(warunki normalne) amoniaku potrzebna jest do przeprowadzenia 15 g
kwasu ortofosforowego(V) w wodoroortofosforan(V) amonu? (6,86 dm
3
)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
6. Podczas rozkładu 29 g tlenku srebra(I) powstaje 27 g srebra. Ile gramów tlenu
uzyskano w takiej reakcji, je
7. Stosunki mas molowych kwasów wynosz
kwasów zawiera 2, a drugi 3 atomy wodoru w cz
kwasów.
8. Zmieszano 36 g wody i 1,7 g amoniaku. Ile cz
cząsteczkę amoniaku?
9. Do 10 milimoli tlenku fosforu(V) wkroplono 600 mg wody. Obliczy
ortofosforowego(V) wytworzonego w tej reakcji.
10. Gęstość mieszaniny azotu i wodoru w warunkach normalnych wynosi 0,38 g/dm
Obliczyć
skład
procentowy
tej
mieszaniny
(%obj.).
3
g/cm
O,09
=
2
H
d
.
11. Podać wzór hydratu MgHPO
12. Obliczyć masę molową
g/mol.
13. Obliczyć ułamek molowy wodoru w mieszaninie zawieraj
14. Mieszanina zawiera 70% wagowych wodoru i 30% wagowych tlenu. Obliczy
mieszaniny w procentach obj
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
42
6. Podczas rozkładu 29 g tlenku srebra(I) powstaje 27 g srebra. Ile gramów tlenu
w takiej reakcji, jeśli powstało 54 g srebra?
7. Stosunki mas molowych kwasów wynoszą 1:1, a ich soli sodowych 53:64. Pierwszy z
kwasów zawiera 2, a drugi 3 atomy wodoru w cząsteczce. Obliczyć
kwasów.
8. Zmieszano 36 g wody i 1,7 g amoniaku. Ile cząsteczek wody przypada na jedn
amoniaku?
9. Do 10 milimoli tlenku fosforu(V) wkroplono 600 mg wody. Obliczy
ortofosforowego(V) wytworzonego w tej reakcji.
mieszaniny azotu i wodoru w warunkach normalnych wynosi 0,38 g/dm
skład
procentowy
tej
mieszaniny
(%obj.).
. (odp. 25% N
wzór hydratu MgHPO
4
, jeśli wiadomo, że zawiera on 40,8% P
(odp.
molową soli glinu i dwuprotonowego kwasu o masie molowej 62
ułamek molowy wodoru w mieszaninie zawierającej 4 g wodoru i 16 g tlenu.
14. Mieszanina zawiera 70% wagowych wodoru i 30% wagowych tlenu. Obliczy
mieszaniny w procentach objętościowych (% obj.).
(odp. 97,4% obj. wodoru i 2,6% obj. tlenu)
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
6. Podczas rozkładu 29 g tlenku srebra(I) powstaje 27 g srebra. Ile gramów tlenu
li powstało 54 g srebra? (odp. 4 g)
1:1, a ich soli sodowych 53:64. Pierwszy z
steczce. Obliczyć masę molową obu
kwasów. (odp. 62 g/mol)
steczek wody przypada na jedną
(odp. 20)
9. Do 10 milimoli tlenku fosforu(V) wkroplono 600 mg wody. Obliczyć masę kwasu
ortofosforowego(V) wytworzonego w tej reakcji. (odp. 1,96 g)
mieszaniny azotu i wodoru w warunkach normalnych wynosi 0,38 g/dm
3
.
skład
procentowy
tej
mieszaniny
(%obj.).
3
g/cm
1,25
=
2
N
d
,
(odp. 25% N
2
i 75% H
2
)
e zawiera on 40,8% P
2
O
5
.
(odp. MgHPO
4
·3H
2
O)
soli glinu i dwuprotonowego kwasu o masie molowej 62
(odp. 234 g/mol)
cej 4 g wodoru i 16 g tlenu.
(odp. 0,8)
14. Mieszanina zawiera 70% wagowych wodoru i 30% wagowych tlenu. Obliczyć skład
(odp. 97,4% obj. wodoru i 2,6% obj. tlenu)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
2.5.2
Stężenia roztworów.
1. Perhydrol to 30% roztwór nadtlenku wodoru. Obliczy
cm
3
perhydrolu, którego g
2.
Jaką objętość wody nale
5%?
3.
Ile gramów siarczanu(VI) magnezu nale
otrzymać roztwór 18%?
4.
15 g 15% roztworu azotanu(V) amonu rozcie
stężenie molowe roztworu.
5.
85 g chlorku sodu rozpuszczono w 300 cm
g/cm
3
. Oblicz stężenie molowe rozt
6.
Obliczyć stężenie procentowe 2M roztworu kwasu azotowego(V). G
1,07 g/cm
3
.
7.
Ile gramów manganianu(VII) sodu zawieraj
sporządzenia 250 cm
3
8.
W kolbie o pojemności 500 cm
roztworu kwasu siarkowego(VI). Obliczy
powstałego roztworu. G
9.
Do jakiej objętości nale
gęstości 1,26 g/cm
3
, aby otrzyma
10.
Obliczyć, w jakim stosunku wagowym nale
6,10M roztwór wodorotlenku sodu o g
11.
Ile wody należy odparowa
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
43
1. Perhydrol to 30% roztwór nadtlenku wodoru. Obliczyć masę nadtlenku wodoru w 150
perhydrolu, którego gęstość wynosi 1,11 g/cm
3
.
wody należy dodać do 100 g 12% roztworu cukru, aby powstał roztwór
Ile gramów siarczanu(VI) magnezu należy dodać do 150 g 15% roztworu, aby
roztwór 18%?
15 g 15% roztworu azotanu(V) amonu rozcieńczono do objętości 500 cm
enie molowe roztworu. (odp. 0,056 mol/dm
85 g chlorku sodu rozpuszczono w 300 cm
3
wody i otrzymano roztwór o g
enie molowe roztworu. (odp. 4,44 mol/dm
enie procentowe 2M roztworu kwasu azotowego(V). G
nianu(VII) sodu zawierającego 10% zanieczyszcze
0,2M roztworu?
W kolbie o pojemności 500 cm
3
sporządzono roztwór przez rozcie
roztworu kwasu siarkowego(VI). Obliczyć stężenie a) procentowe,
powstałego roztworu. Gęstość roztworu 1 g/cm
3.
. (odp. a) 0,14%, b) 0,015M)
ci należy rozcieńczyć 25 cm
3
30% roztworu zasady sodowej o
, aby otrzymać roztwór 0,25M?
, w jakim stosunku wagowym należy zmieszać ze sobą wod
6,10M roztwór wodorotlenku sodu o gęstości 1,22 g/cm
3
, aby otrzyma
y odparować ze 150 g 20% roztworu, aby otrzymać roztwór 28%?
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
nadtlenku wodoru w 150
(odp. 49,95 g)
do 100 g 12% roztworu cukru, aby powstał roztwór
(odp. 140 cm
3
)
do 150 g 15% roztworu, aby
roztwór 18%? (odp. 5,49 g)
ś
ci 500 cm
3
. Obliczyć
(odp. 0,056 mol/dm
3
)
wody i otrzymano roztwór o gęstości 1,18
(odp. 4,44 mol/dm
3
)
enie procentowe 2M roztworu kwasu azotowego(V). Gęstość roztworu
(odp. 11,8%)
cego 10% zanieczyszczeń należy użyć do
0,2M roztworu? (odp. 7,9 g)
dzono roztwór przez rozcieńczenie 2 g 36%
) procentowe, b) molowe
(odp. a) 0,14%, b) 0,015M)
% roztworu zasady sodowej o
(odp. 945 cm
3
)
ą
wodę destylowaną i
, aby otrzymać roztwór 10%.
(odp. 1:1)
ć
roztwór 28%?
(odp. 43 g)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
12.
Zmieszano 100 cm
3
1M roztworu kwasu azotowego(V) o g
cm
3
12% roztworu tego kwasu o g
molowe otrzymanego roztworu; g
13.
Ile gramów Ca(NO
3
)
2
jonów azotanowych(V) wzrosło dwukrotnie?
14.
Ile wody należy dodać do 1 dm
2.5.3
Zadania stechiometryczne z uwzgl
1. Ile gramów 15% roztworu kwasu solnego potrzebne jest na zoboj
wodorotlenku wapnia.
2.
Jaka objętość 0,2M molowego roztworu KOH zoboj
H
2
SO
4
?
3.
Obliczyć objętość 10%
potrzebną na zobojętnienie 1,2 mola NaOH.
4.
Na zobojętnienie naważ
0,33M roztworu kwasu solnego. Obliczy
5.
Jaka objętość 0,8% roztworu NaCl o g
jonów srebrowych z 80 cm
6.
Po rozpuszczeniu naważ
roztworem azotanu(V) srebra otrzymano 0,344 g chlorku srebra. Obliczy
czystości chlorku wapnia.
7.
Czy po wprowadzeniu 10 cm
0,025M roztworu azotanu(V) ołowiu(II) nast
8.
Obliczyć stężenie procentowe kwasu solnego, je
nadmiaru metalicznego glinu wydzieliło si
warunkach normalnych).
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
44
1M roztworu kwasu azotowego(V) o gęstości 1,03 g/cm
12% roztworu tego kwasu o gęstości 1,07 g/cm
3
. Obliczyć stęż
molowe otrzymanego roztworu; gęstość mieszaniny 1,05 g/cm
3
.
(odp. 10,0%, 1,68M)
należy dodać do 25 cm
3
0,25 M roztworu tej so
jonów azotanowych(V) wzrosło dwukrotnie?
y dodać do 1 dm
3
roztworu, aby uzyskać 10-krotne rozcie
Zadania stechiometryczne z uwzględnieniem stężeń roztworów.
Ile gramów 15% roztworu kwasu solnego potrzebne jest na zoboj
0,2M molowego roztworu KOH zobojętni 100 cm
ść
10% roztworu kwasu siarkowego(VI) o gę
ę
tnienie 1,2 mola NaOH.
tnienie naważki wodorotlenku magnezu o masie 0,1248g zu
0,33M roztworu kwasu solnego. Obliczyć zawartość procentową Mg(OH)
0,8% roztworu NaCl o gęstości 1g/cm
3
potrzebna jest do wytr
jonów srebrowych z 80 cm
3
0,02M roztworu AgNO
3
?
Po rozpuszczeniu naważki 0,155 g CaCl
2
w wodzie i wytrąceniu jonów chlorkowych
roztworem azotanu(V) srebra otrzymano 0,344 g chlorku srebra. Obliczy
ci chlorku wapnia.
(odp. zawarto
Czy po wprowadzeniu 10 cm
3
8% roztworu H
2
SO
4
o gęstości 1,05 g/cm
0,025M roztworu azotanu(V) ołowiu(II) nastąpi strącenie wszystkich jonów Pb
enie procentowe kwasu solnego, jeżeli po dodaniu do 12,5 g tego kwasu
nadmiaru metalicznego glinu wydzieliło się 1,25 dm
3
wodoru (mierzonego w
warunkach normalnych).
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
ś
ci 1,03 g/cm
3
i 200
ć
stężenie procentowe i
(odp. 10,0%, 1,68M)
0,25 M roztworu tej soli, aby stężenie
jonów azotanowych(V) wzrosło dwukrotnie? (odp. 1,02 g)
krotne rozcieńczenie?
Ile gramów 15% roztworu kwasu solnego potrzebne jest na zobojętnienie 10 g
(odp. 65,7 g)
tni 100 cm
3
0,5M roztworu
(odp. 500 cm
3
)
roztworu kwasu siarkowego(VI) o gęstości 1,06 g/cm
3
(odp. 555 cm
3
)
ki wodorotlenku magnezu o masie 0,1248g zużyto 10,1 cm
3
ą
Mg(OH)
2
w próbce.
(odp. 77,4%)
potrzebna jest do wytrącenia
(odp. 11,7 cm
3
)
ceniu jonów chlorkowych
roztworem azotanu(V) srebra otrzymano 0,344 g chlorku srebra. Obliczyć stopień
(odp. zawartość CaCl
2
85,6%)
ci 1,05 g/cm
3
do 150 cm
3
cenie wszystkich jonów Pb
2+
?
(odp. tak)
eli po dodaniu do 12,5 g tego kwasu
oru (mierzonego w
(odp. 8,1%)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
9.
W 50 cm
3
wody rozpuszczono 2g tlenku wapnia. Jakie jest procentowe st
otrzymanego roztworu zasady wapniowej?
10.
Tlenek siarki(VI) powstały w wyniku utlenienia 1 tony SO
wody.
Obliczyć
stęż
11.
Ile g metalicznego cynku rozpu
12.
Obliczyć stężenie procentowe rozt
rozpuszczenia 2,5 g metalicznego litu w 100 g wody.
2.5.4
Stopień dysocjacji; wykładnik st
1.
30 g kwasu octowego rozcie
roztworze znajduje się
octowego.
2.
Do 100 cm
3
1,0% roztworu NaOH o d=1,0 g/cm
pH = 3. Obliczyć pH otrzymanego roztworu.
3.
Obliczyć stężenie molowe jednoprotonowego kwasu, którego pH=3 a
4.
Obliczyć pH roztworu zawieraj
5.
Obliczyć
stężenie
molowe
niezdysocjowanych
cz
jednoprotonowego 0,05M kwasu, którego
6.
Obliczyć pH roztworu Ca(OH)
7.
Jakie będzie pH roztworu po zmieszaniu 3 dm
dm
3
roztworu o pH=4?
8.
Obliczyć stężenie molowe roztworu kwasu siarkowego(VI), którego pH=2,7.
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
45
wody rozpuszczono 2g tlenku wapnia. Jakie jest procentowe st
otrzymanego roztworu zasady wapniowej?
Tlenek siarki(VI) powstały w wyniku utlenienia 1 tony SO
2
rozpuszczono w 1 m
stężenie
procentowe
powstałego
kwasu
siarkowego(VI).
Ile g metalicznego cynku rozpuści się w 150 cm
3
0,25M roztworu kwasu solnego?
enie procentowe roztworu zasady litowej otrzymanej w wyniku
rozpuszczenia 2,5 g metalicznego litu w 100 g wody.
dysocjacji; wykładnik stężenia jonów wodorowych.
30 g kwasu octowego rozcieńczono wodą do objętości 1 dm
znajduje się 1,7·10
21
jonów H
+
. Obliczyć stopień dysocjacji kwasu
1,0% roztworu NaOH o d=1,0 g/cm
3
dodano 100 cm
pH otrzymanego roztworu.
enie molowe jednoprotonowego kwasu, którego pH=3 a
pH roztworu zawierającego 5,1·10
-3
g jonów OH
–
w 1 dm
enie
molowe
niezdysocjowanych
cząsteczek
w
roztworze
jednoprotonowego 0,05M kwasu, którego α = 1,9%.
pH roztworu Ca(OH)
2
o stężeniu 2·10
-4
mol/dm
3
.
dzie pH roztworu po zmieszaniu 3 dm
3
roztworu mocnego kwasu o pH=3 z 5
roztworu o pH=4?
enie molowe roztworu kwasu siarkowego(VI), którego pH=2,7.
(odp. 1·10
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
wody rozpuszczono 2g tlenku wapnia. Jakie jest procentowe stężenie
(odp. 5,1%)
ozpuszczono w 1 m
3
enie
procentowe
powstałego
kwasu
siarkowego(VI).
(odp. 68%)
0,25M roztworu kwasu solnego?
(odp. 1,23 g)
woru zasady litowej otrzymanej w wyniku
(odp. 8,48%)
ci 1 dm
3
. W powstałym
ń
dysocjacji kwasu
(odp. 0,56%)
dodano 100 cm
3
kwasu solnego o
pH otrzymanego roztworu. (odp. 13,1)
enie molowe jednoprotonowego kwasu, którego pH=3 a
α
=4%.
(odp. 0,025M )
w 1 dm
3
. (odp. 10,48)
steczek
w
roztworze
(odp. 0,049M)
. (odp. 10,6)
roztworu mocnego kwasu o pH=3 z 5
(odp. 3,36)
enie molowe roztworu kwasu siarkowego(VI), którego pH=2,7.
(odp. 1·10
-3
mol/dm
3
)

„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
kierunków przyrodniczo-technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
9.
Ile gramów NaOH nale
10. Po zmieszaniu 3,65 g HCl, 9,8 g H
2000 cm
3
. Obliczyć pH uzyskanego roztworu.
11.
Obliczyć pH roztworu uzyskanego przez 170
pH = 12,72 .
12.
Zmieszano 275 cm
3
0,05M HNO
dodano 5,61 g stałego KOH. Obliczy
13.
Ile gramów kwasu mlekowego (CH
stężenie jonów wodorowych jest równe 5,294· 10
wynosi 2,647% ?
„Program Uniwersytetu Przyrodniczego we Wrocławiu dotycz
ą
cy zwi
ę
kszenia
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
Europejskiego Funduszu Społecznego.
46
Ile gramów NaOH należy dodać do 100 ml wody, aby powstał roztwór o pH 10?
10. Po zmieszaniu 3,65 g HCl, 9,8 g H
2
SO
4
roztwór rozcieńczono wod
ć
pH uzyskanego roztworu.
pH roztworu uzyskanego przez 170-krotne rozcieńczenie roztworu KOH o
pH = 12,72 .
0,05M HNO
3
i 325 cm
3
0,01M HCl. Do uz
dodano 5,61 g stałego KOH. Obliczyć pH powstałego roztworu?
Ile gramów kwasu mlekowego (CH
3
CHOHCOOH) zawiera 1 dm
3
roztworu, w którym
enie jonów wodorowych jest równe 5,294· 10
-3
mola/dm
3
a stopie
kszenia liczby absolwentów
technicznych o kluczowym znaczeniu dla gospodarki opartej na wiedzy”
Projekt realizowany w ramach Programu Operacyjnego Kapitał Ludzki współfinansowanego ze
ś
rodków
do 100 ml wody, aby powstał roztwór o pH 10?
(odp. 0,4 mg)
czono wodą do objętości
(odp. 0,82)
czenie roztworu KOH o
pH = 12,72 . (odp. 10,49)
0,01M HCl. Do uzyskanego roztworu
pH powstałego roztworu? (odp. 13,14)
roztworu, w którym
a stopień dysocjacji
(odp. 18,02 g)
Wyszukiwarka
Podobne podstrony:
WWW Kurs wyrównawczy z chemii nieorganicznej ochrona środowiska
WWW Kurs wyrównawczy z chemii organicznej
Bufory sprawko, Biotechnologia PWR, Semestr 2, Podstawy chemii nieorganicznej Laboratorium, Instrukc
sciaga egz nieorg, podstawy chemii nieorganicznej
Podstawy chemii nieorganicznej egzamin 13
,podstawy chemii nieorganicznej L, Pojemność buforu
Egzamin z Chemii nieorganicznej, Egzamin z Chemii nieorganicznej
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
statystyka kurs wyrównawczy 2 statystyka 7
statystyka kurs wyrównawczy statystyka 10
statystyka kurs wyrównawczy statystyka 7
statystyka kurs wyrównawczy statystyka 2
statystyka kurs wyrównawczy 2 statystyka 8
,podstawy chemii nieorganicznej L, Pojemność buforu
fizyka kurs wyrownawczy
statystyka kurs wyrównawczy statystyka 11
więcej podobnych podstron