
Analiza substancji prostych i mieszanin
FAZA I
Badanie wstępne substancji stałej
Analiza jakościowa substancji stałej składa się kolejno z następujących
po sobie etapów:
obserwacje wstępne,
przeprowadzenie substancji stałej do roztworu (przygotowanie do
analizy systematycznej),
ustalenie grupy analitycznej kationu i anionu,
reakcje charakterystyczne.

Obserwacje wstępne soli, kwasów, tlenków
i wodorotlenków.
Obserwacje wstępne polegają na określeniu:
postaci substancji
– czy jest krystaliczna, jaką ma barwę, czy jest higroskopijna,
czy nie,
zachowania podczas prażenia
– czy zachodzi rozkład z wydzieleniem gazu, zmiana barwy,
sublimacja,
zabarwienia płomienia palnika gazowego,
zachowania się substancji podczas stapiania z perłą
fosforanową lub boraksową.

Zabarwienie tlenków
metali grup analitycznych jest następujące:
tlenki czarne: HgO, CuO, NiO, FeO, Fe
3
O
4
, MnO
2
;
tlenki brunatne: Ag
2
O, PbO
2
, Bi
2
O
3
, CdO, Fe
2
O
3
(rdzawobrunatny);
tlenki żółte: HgO, PbO (siarczki arsenu As
2
S
3
, As
2
S
5
);
tlenki czerwone: HgO, Cu
2
O, Pb
3
O
4
.
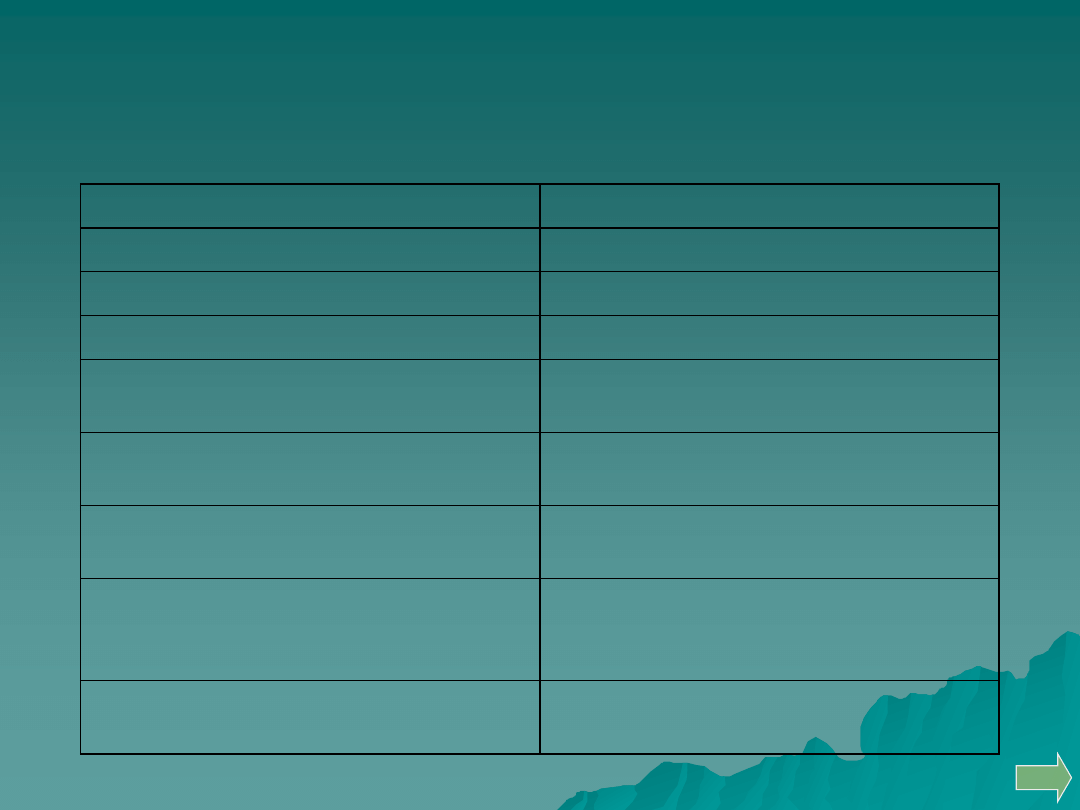
Obserwacje wydzielających się gazów podczas
prażenia i rozkładu substancji.
Wydzielające się gazy
Obecność anionów
Fioletowe pary – I
2
jodki I
-
Czerwonobrunatne duszące pary – Br
2
bromiany (I) BrO
-
, bromki Br
-
Żółtozielony duszący gaz – Cl
2
chlorany (I) ClO
-
Brunatne dymy tlenków azotu - NO
i
NO
2
azotany (III) NO
2
-
, azotany (V) NO
3
-
Duszący charakterystyczny zapach
palonej siarki – bezbarwny gaz – SO
2
siarczany (IV) SO
3
2-
Duszący gaz SO
2
i zmętnienie
(koloidalna S)
tiosiarczan (VI) S
2
O
3
2-
Zapach gorzkich migdałów – bezbarwny
palny gaz dicyjan – (CN)
2
cyjanki CN
-
, tiocyjaniany SCN
-
,
heksacyjanożelazian (II) [Fe(CN)
6
]
4-
heksacyjanożelazian (III) [Fe(CN)
6
]
3-
Zapach zgniłych jaj – bezbarwny, palny
gaz siarkowodór H
2
S
uwodnione siarczki S
2-

Wydzielające się gazy
Obecnść anionów
Zapach amoniaku – NH
3
sole amonu NH
4
+
Bezbarwny gaz – N
2
, nie pali się,
nie podtrzymuje palenia, nie
powoduje zmętnienia wody
wapiennej
azotan (III) amonu NH
4
NO
2
, związki
dicyjanu (CN)
2
Bezbarwny gaz – CO
2
, nie pali się i
nie podtrzymuje palenia.
Zawieszona kropla wody wapiennej
mętnieje
węglany CO
3
2-
, szczawiany C
2
O
4
2-
,
możliwa obecność substancji
organicznych
Bezbarwny gaz - CO
- pali się
niebieskim płomieniem
mrówczany HCOO
-
, szczawiany
C
2
O
4
2-
Bezbarwny gaz – O
2
obecność tlenków, nadtlenków,
azotanów (V) NO
3
-
, chloranów (V)
ClO
3
-
, jodanów (V) IO
3
-
manganianu (VII) MnO
4
-

Lotne kwasy
Sole lotnych kwasów: azotany, węglany, siarczany (IV) mogą
przechodzić w tlenki metali o innej barwie niż wyjściowa sól.
Przykładowo:
3
3
2
2
4
2
2
2
2
3
4
2
4
2
2
2
2
SO
O
Co
O
CoSO
CO
MnO
MnO
O
MnCO
Zmiana barwy pod wpływem ogrzewania lub prażenia
Niektóre substancje podczas ogrzewania i prażenia nie
rozkładają się, ale zmieniają barwę. Zmiana barwy świadczy
o obecności następujących tlenków i siarczków:
Na zimno
Po ogrzaniu
Obecność
pomarańczowa
czerwona
CdS,
biała
żółta
ZnO,
żółta
brunatna
PbO, Bi
2
O
3
, SnO
2
,
rdzawoczerwona
czarna
Fe
2
O
3

Zmiana barwy pod wpływem sublimacji
Podczas ogrzewania barwne osady wydzielające się na chłodnych
ściankach górnej części próbówki wskazują na obecność lotnych
substancji sublimujących, takich jak:
biały
HgCl
2
, Hg
2
Cl
2
, HgBr
2
, NH
4
Cl, As
2
O
3
, Sb
2
O
3
,
żółty
S, As
2
S
3
, HgI
2
fioletowy
I
2
szary lub
czarny
Hg, HgO, HgS, As, Cd, substancji
organicznych.

Obserwacje po zmieszaniu z niewielkim nadmiarem sody
Obserwacje zachowania się substancji zmieszanej z niewielkim
nadmiarem sody Na
2
CO
3
podczas prażenia na węglu w płomieniu
utleniającym dmuchawki:
obserwuje się energiczne spalanie substancji
– możliwa obecność azotanów (V) i (III), chloranów (V)
i (VII), bromianów (V), jodanów (V), manganianów (VII),
substancja topi się i wsiąka w węgiel
– możliwa obecność soli litowców,
substancja pozostawia białą, nie topiącą się masę
– możliwa obecność berylowców, soli, Al, Zn, Sn.

Obserwacje po prażeniu z azotanem (V) kobaltu (II)
Zwilżenie białej pozostałości roztworem Co(NO
3
)
2
i powtórne
prażenie zabarwia masę na:
Szaro
CaO, SrO
Ceglastobrunatno
BaO
Cielisto
MgO
Niebiesko
Al
2
O
Żółtozielono
ZnO
Niebieskozielono
SnO

Azotan (V) kobaltu (III) prażony przechodzi w CoO, który daje barwne
stopy z powstałymi tlenkami.
powstaje nalot bez ziarna metalu:
na gorąco żółty, na zimno biały, nie utleniający się – Zn,
czerwonobrunatny, łatwo palny (prawie oczko) – Cd,
biały, lotny, zapach czosnku – As,
powstaje ziarno metaliczne z nalotem:
nalot żółty i ziarno metaliczne, kowalne – Pb,
białe dymy i gęsty nalot, ziarno metaliczne, kruche – Sb,
nalot żółtawo-pomarańczowy, ziarno kruche, ogrzewane z KI i S
daje czerwone zabarwienie – Bi,
nalot na gorąco żółtawy, po oziębieniu biały (u wylotu rurki ziarno
metaliczne miękkie) – Sn,
obserwuje się ziarno metaliczne bez nalotu:
czerwone, kowalne – Cu,
białe, kowalne (rozpuszczalne w rozcieńczonym HNO
3
, z HCl
serowaty biały osad AgCl) – Ag,
metal nie stopiony, bez nalotu:
szary proszek – Fe, Co, Ni.
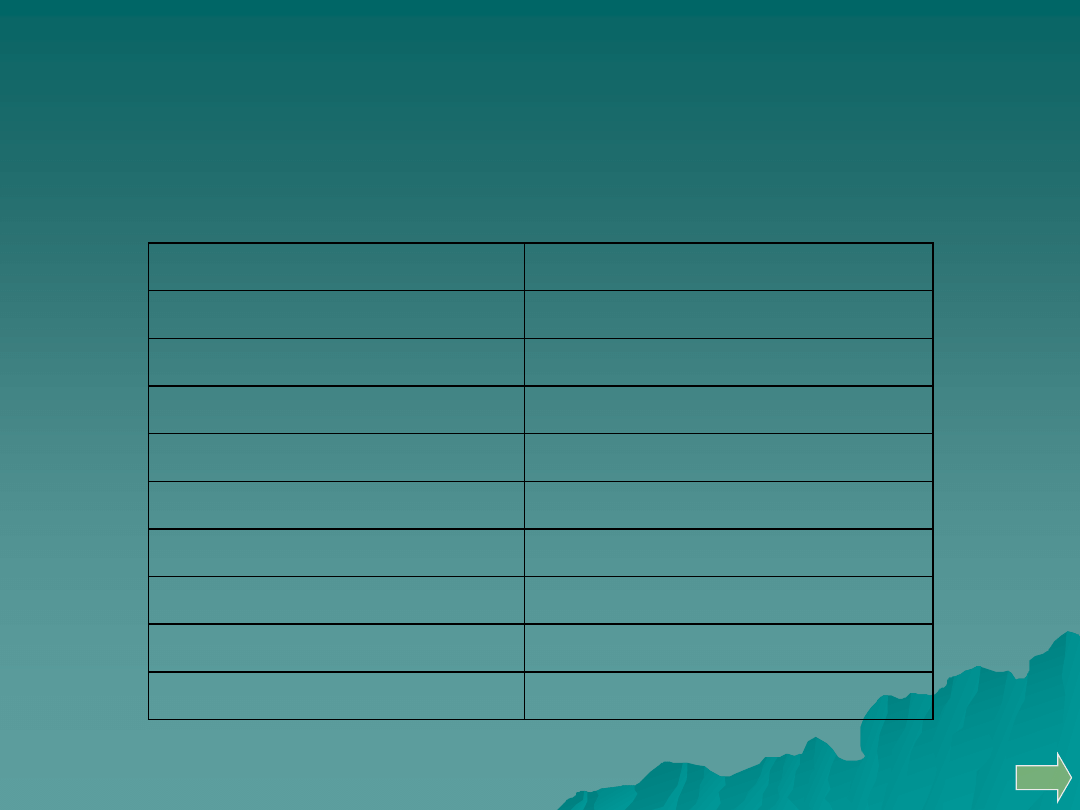
Obserwacja zabarwienia płomienia palnika
Do badań wstępnych należy także obserwacja zabarwienia płomienia
palnika gazowego przez badaną substancję.
Zabarwienie płomienia
Badana substancja zawiera
żółte, długo utrzymujące się
Na
fioletowe
K
fioletowo-różowe
Rb, Cs
karminowo-czerwone
Sr
czerwone
Li
ceglasto-czerwone
Ca
zielone
Cu, B, Tl
żółto-zielone
Ba
jasnoniebieskie
As, Sb, Pb, Sn

Obserwacja zabarwienia perły boraksowej
Kolejny etap obserwacji wstępnych to badanie zachowania się
substancji podczas stapiania z perłą fosforanową lub boraksową
(Na
2
B
4
O
7
).
Zabarwienie perły
Zabarwienie perły boraksowej
Symbol
pierwiastka
w płomieniu utleniającym
w płomieniu redukującym
na zimno
na gorąco
na zimno
na gorąco
Fe
żółte
żółto-
czerwone
żółto-
czerwone
Ni
żółte do
brunatnego
fioletowe
szare
szare
Cr
zielone
żółtoczerwo
ne
zielone
zielone
Cu
niebieskie
zielone
czerwone
Co
niebieskie
niebieskie
niebieskie
niebieskie
Mn
fioletowe
fioletowe
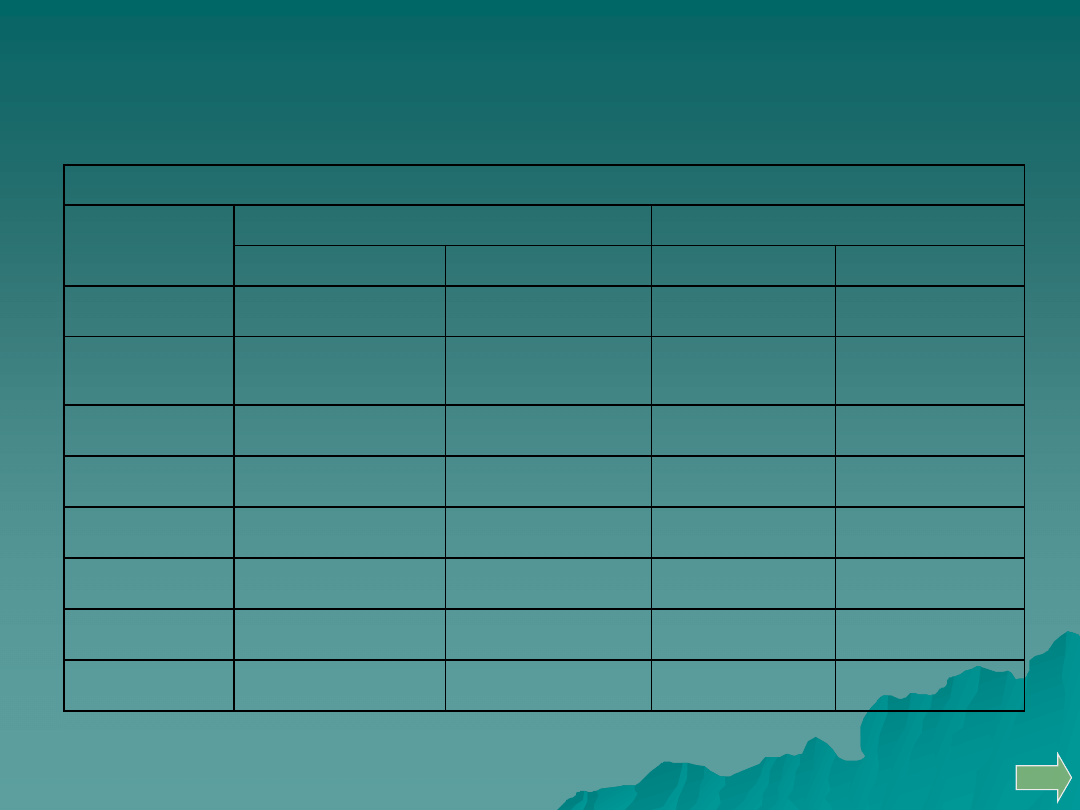
Zabarwienie perły fosforanowej
na druciku Pt stopiony wodorofosforan (V) amonowo sodowy
Zabarwienie perły boraksowej
Symbol
pierwiastka
w płomieniu utleniającym
w płomieniu redukującym
na zimno
na gorąco
na zimno
na gorąco
Fe
żółte
żółto-czerwone
żółte
Ni
brunatne
czerwono-
brunatne
jasnożółte lub
jasnoczerwone
jasnożółte lub
jasnoczerwone
Cr
zielone
żółte
Cu
zielono-niebieskie zielone
zielone
zielone
Co
niebieskie
czerwone
jasnozielone
Mn
niebieskie
fioletowe
niebieskie
niebieskie
Zn, Cd, Sb
fioletowe
szare
szare
Bi, Pb, Ag
szare
szare

Obserwacje wstępne metalu lub stopu
Do najważniejszych właściwości metali, które należy wziąć pod uwagę
podczas obserwacji wstępnych, należą:
połysk powierzchniowy,
silne odbijanie światła,
duże przewodnictwo elektryczne i cieplne,
właściwości magnetyczne (np. Fe, Co, Ni),
kowalność i ciągliwość (odkształcalność plastyczna),
tworzenie sieci krystalicznych o dużych liczbach koordynacyjnych,
zdolność tworzenia stopów.

1. Powierzchnia metali jest gładka i błyszcząca.
2. Metale, z wyjątkiem miedzi i złota, mają barwę srebrzystą.
3. Występowanie metalicznego połysku jest spowodowane zdolnością
metali do absorbowania i natychmiastowego emitowania światła
o wszystkich długościach fali, czyli następuje pełne odbicie światła.
4. Wiązanie metaliczne, elektronowa struktura metalu i kwantowo-
mechaniczne oddziaływania między atomami w metalach i stopach
są odpowiedzialne za ich charakterystyczne właściwości optyczne,
elektryczne i magnetyczne.
5. Struktura metalu może być stosunkowo łatwo odkształcona,
charakteryzuje się jednak dużą kohezją, czyli spójnością. Miarą siły
kohezji jest ciepło atomizacji (ΔH
), czyli energia kohezji. Ciepło
atomizacji jest odwrotnie proporcjonalne do odległości,
międzyjądrowej, czyli maleje w obrębie grupy układu okresowego
wraz ze wzrostem liczby atomowej.
6. Budowa sieci krystalicznej większości metali wynika z „zasady
najgęstszego upakowania kul”.
7. Stopy metali są połączeniami dwu lub większej liczby składników,
które stopniowo rozpuszczają się w sobie wzajemnie.

FAZA II
Przeprowadzanie substancji stałej do roztworu.
Przeprowadzenie metalu lub stopu do roztworu z utworzeniem soli
Odczynnik
Obserwacja
Wnioski
Uwagi
Roztwarzanie metalu w
stęż. lub 6mol l
-1
HCl
wydzielanie gazowego
produktu – wodoru np.:
Me+2HCl
MeCl
2
+H
2
(metal przechodzi w
odpowiedni chlorek)
roztwarzaniu ulegają
metale Cd, Sn, Zn, Al., Cr,
Mg i inne leżące przed
wodorem w szeregu
elektrochemicznym metali
roztwarzanie
przeprowadza się
w parowniczce
z ogrzewaniem
w możliwie małej
objętości rozpuszczalnika;
powstały roztwór
odparowuje się pod
wyciągiem do sucha,
a następnie suchą
pozostałość rozpuszcza
w wodzie; z otrzymanym
roztworem przeprowadza
się reakcje grupowe i
charakterystyczne
Roztwarzanie w stęż. lub
6mol l
-1
HNO
3
albo
roztwarzanie w stęż.
H
2
SO
4
wydzielanie gazowego
produktu (brunatne
dymy) – tlenki azotu,
np.:3Cu+8HNO
3
3Cu(NO
3
)
2
+2NO
+
4H
2
O (metal przechodzi
w azotan (V))
roztwarzaniu ulegają
stopy lub metale leżące
w szeregu
elektrochemicznym za
wodorem (i przed
wodorem). Nie
roztwarzają się: Al., Cr
pasywacja (nierozp.
Al
2
O
3
); Sn
nierozp.
(H
2
SnO
3
) (SnO
2
∙H
2
O);
Sb
dobrze rozpuszczalny
w stężonym HNO
3

Przeprowadzenie metalu lub stopu do roztworu z utworzeniem soli
( c.d. tabeli )
Przeprowadzenie inny substancji do roztworu
Rozpuszczanie
Tworzenie soli
Odczynnik
Obserwacja
Wnioski
Uwagi
Roztwarzanie w
6mol l
-1
NaOH
wydzielanie gazowego produktu –
wodoru np.:
Zn+2NaOH
Na
2
ZnO
2
+H
2
(metal przechodzi do anionu,
np. cynkan lub glinian sodu)
roztwarzaniu ulegają
metale o charakterze
amfoterycznym,
np. Zn, Al
Woda królewska
roztwarzaniu tylko w
wodzie królewskiej
ulegają Pt, Au, Hg

Do celów praktycznych można posłużyć się też regułami
rozpuszczalności:
1. Ze względu na rodzaj kationu – rozpuszczalne są wszystkie sole sodu,
potasu, amonu.
2. Ze względu na rodzaj anionu – rozpuszczalne są wszystkie:
- azotany (V) oprócz SbONO
3
, BiOBO
3
,
- azotany (III) oprócz AgNO
2
,
- octany oprócz CH
3
COOAg, (CH
3
COO)
2
Hg
2
3. Ponadto większość:
- chlorków jest rozpuszczalna oprócz AgCl, Hg
2
Cl
2
, PbCl
2
, TICl;
- siarczanów (VI) jest rozpuszczalna w wodzie oprócz BaSO
4
,
SrSO
4
, PbSO
4
, Hg
2
SO
4
;
- siarczanów (IV) jest nierozpuszczalna w wodzie oprócz
(NH
4
)
2
SO
4
i siarczanów (IV) litowców.

Badanie rozpuszczalności przeprowadza się w następujących kolejno
rozpuszczalnikach:
1. wodzie destylowanej,
2. rozcieńczonym HCl lub rozcieńczonym H
2
SO
4
,
3. stężonym H
2
SO
4
,
4. rozcieńczonym HNO
3
lub stężonym HNO
3
,
5. wodzie królewskiej,
6. rozcieńczonym KOH lub rozcieńczonym NaOH,
7. w odczynnikach kompleksujących: NH
4
OH, KCN, Na
2
S
2
O
3
, KI,
8. stapianie z sodą (Na
2
CO
3
).

FAZA III
Analiza systematyczna mieszanin i substancji stałych
Analiza systematyczna soli, kwasów, tlenków i wodorotlenków.
Wykrywanie reduktorów
KMnO
4
– manganian (VII) potasu.
• silnym utleniaczem w środowisku kwasowym – redukuje się do
Mn
2+
- następuje odbarwienie fioletowego roztworu:
V
E
O
H
Mn
e
H
MnO
51
,
1
4
5
8
2
2
4

• słabszym utleniaczem w środowisku obojętnym – redukuje się do
MnO
2
- powstaje brunatny osad:
V
E
OH
MnO
e
O
H
MnO
23
,
1
4
3
2
2
2
4
• jeszcze słabszym utleniaczem w środowisku zasadowym – redukuje się
do MnO
4
2-
następuje zmiana barwy roztworu z fioletowej na zieloną:
V
E
MnO
e
MnO
56
,
0
2
4
4
Roztwór jodu w jodku potasu (I
2
w KI)
- SO
3
2-
, S
2
O
3
2-
, SCN
-
,
- [Fe(CN)
6
]
4-
- zależy od stężenia (odbarwia się tylko przy
dużym stężeniu tego jonu);
- AsO
2
-
- zależy od stężenia i pH (odbarwia się tylko przy
dużym stężeniu tego jonu; jeżeli w roztworze obecne są jony
AsO
4
3-
, przy dużym zakwaszeniu roztworu odbarwienie nie
nastąpi),
- S
2-
- odbarwia roztwór jodoskrobiowy, pod warunkiem, że
przechodzi do wyciągu sodowego).

Wykrywanie utleniaczy.
Roztwór jodku potasu
Zmiana koloru roztworu na niebieski świadczy o obecności
następujących utleniaczy:
- NO
2
-
, [Fe(CN)
6
]
3-
, MnO
4
-
, CrO
4
2-
, Cr
2
O
7
2-
,
- ClO
3
-
- zmiana koloru roztworu na niebieski następuje powoli,
- AsO
4
3-
- zalezy od pH (przy słabym zakwaszeniu i obecności
AsO
2
-
zmiana koloru roztworu na niebieski nie nastąpi),
- Fe
3+
- powoduje zmianę koloru roztworu jodoskrobiowego na
niebieski pod warunkiem, że przechodzi do wyciągu sodowego,
- Cu
2+
- powoduje zmianę koloru roztworu jodoskrobiowego na
niebieski pod warunkiem, że przechodzi do wyciągu sodowego.

Reakcja z AgNO
3
Wytrącenie osadu nierozpuszczalnego w stężonym HNO
3
świadczy
o obecności następujących anionów:
- Cl
-
- biały osad AgCl
,
- Br
-
- żółtawy osad AgBr
,
- I
-
- żółty osad AgI
,
- CN
-
- biały osad AgCN
,
- SCN
-
- biały osad AgSCN
,
- [Fe(CN)
6
]
4-
- biały osad Ag
4
[Fe(CN)
6
]
,
- [Fe(CN)
6
]
3-
- pomarańczowy osad Ag
3
[Fe(CN)
6
]
.

Wytrącenie osadu rozpuszczalnego w HNO
3
świadczy o obecności
następujących anionów:
- S
2
O
3
2-
- początkowo biały osad Ag
2
S
2
O
3
żółkniejący, wreszcie
przechodzi w czarny osad siarczku srebra Ag
2
S
rozpuszczalny
w stężonym HNO
3
,
- CO
3
2-
- biały osad Ag
2
CO
3
, który gotowany rozkłada się do
brunatnego tlenku srebra Ag
2
O i ditlenku węgla CO
2
,
- S
2-
- czarny osad Ag
2
S
rozpuszczalny w gorącym
rozcieńczonym HNO
3
,
- AsO
2
-
- żółty osad Ag
3
AsO
3
rozpuszczalny w rozcieńczonym
HNO
3
,
- AsO
4
3-
- czekoladowobrunatny osad Ag
2
C
4
H
4
O
6
rozpuszczalny
w rozcieńczonym HNO
3
,
- Ag
2
C
4
H
4
O
6
– rozpuszczalny w NH
3
∙H
2
O, ogrzany na łaźni
wodnej w idealnie czystej probówce daje na ściankach lustro
srebrowe.

Zabarwienie roztworu może wskazywać na obecność następujących
anionów:
- MnO
4
-
- zabarwienie fioletowe,
- [Fe(CN)
6
]
4-
, [Fe(CN)
6
]
3-
- zabarwienie żółtawozielone,
- CrO
4
2-
- zabarwienie żółte,
- Cr
2
O
7
2-
- zabarwienie pomarańczowe.
Wyszukiwarka
Podobne podstrony:
chemia, oznaczenie wagowe, Oznaczenie wagowe (grawimetryczne) ilościowego składu analizowanej substa
chemia, oznaczenia osady, Oznaczenie wagowe (grawimetryczne) ilościowego składu analizowanej substan
odkrywki ANALIZA SUBSTANCJI OBIEKTU
Analiza substancji chemicznej atmosferycznych aerozoli, Analiza substancji chemicznej atmosferycznyc
CHROMATOGRAFIA CIECZOWA cz.2, INSTRUMENTALNE METODY ROZDZIAŁU I ANALIZY SUBSTANCJI - ŚREDNIOCIŚNIENI
ANALIZA SUBSTANCJI ORGANICZNYCH Nieznany
prosty analizator stanów logiczych
Analiza ilosciowa substancji farmakopealnych metoda bromianometryczna
Oznaczanie cukrow prostych metoda Antronowa, Tż, Analiza żywności II, Sprawozdania
Prosty analizator stanów logicznych
Nowa ustawa o substancjach chemicznych i ich mieszaninach 2
analiza matematyczna II, Przodki IL PW Inżynieria Lądowa budownictwo Politechnika Warszawska, Semest
Nowa ustawa o substancjach chemicznych i ich mieszaninach 2
Analizowanie prostych układów elektrycznych
Oznaczanie cukrow prostych metoda Antronowa, Tż, Analiza żywności II, Sprawozdania
Nowa ustawa o substancjach chemicznych i ich mieszaninach
więcej podobnych podstron