
temat sezonu
weterynaria w terenie
2/2009
6
S
lek. wet. Justyna Radwińska, prof. dr hab. Zygmunt Kuleta, dr n. wet. Anna Snarska
Katedra Chorób Wewnętrznych z Kliniką Wydziału Medycyny Weterynaryjnej
Uniwersytetu Warmińsko-Mazurskiego w Olsztynie
nież ze spadkiem poziomu przeciwciał
i dużą ekspozycją zwierząt na wirusa
(np. obecność osobników trwale zaka-
żonych w stadzie) (1, 2, 3).
Do wniknięcia patogenu najczę-
ściej dochodzi drogą układów pokar-
mowego i oddechowego. Wektorem
zakażenia mogą być owady. Zdarza
się niestety również, że do infekcji do-
chodzi na drodze jatrogennej w wyni-
ku zaniedbania podstawowych zasad
Dobrej Praktyki Klinicznej
(np. wielo-
krotne użycie tej samej igły, strzykaw-
ki, rękawicy).
Obraz kliniczny wirusowej biegun-
ki bydła i choroby błon śluzowych jest
bardzo zróżnicowany (fot. 1). Przebie-
gać może w sposób bezobjawowy lub
łagodny, z przemijającymi objawami
ze strony górnych dróg oddechowych,
aż do postaci ciężkiej, ostrej z biegun-
kami, zaburzeniami w układach odde-
chowym
i rozrodczym. Chorobie często
towarzyszą powikłania związane z za-
każeniami przez bakterie oraz wirusy.
Istotnym elementem jest zdolność
wirusa BVD do przekraczania bariery
łożyskowej i infekowanie rozwijającego
się płodu (4).
Konsekwencją śródmacicznej infek-
cji niecytopatycznymi szczepami wiru-
sa między 40. a 125. dniem ciąży jest
poród (rodzenie) cieląt trwale zakażo-
nych (PI, persistent infected) (5). Osobni-
ki takie przypominają zdrowe zwierzę-
ta, czasem mogą być od nich mniejsze
ze względu na słabsze przyrosty masy
ciała, jednak nie jest to reguła. Cielę-
ta PI nie wytwarzają przeciwciał skie-
rowanych przeciwko wirusowi BVD.
Podczas badań serologicznych mają
wyniki ujemne. Zdolne są natomiast
do siewstwa wirusa przez całe swo-
je życie, ze wszystkimi wydzielinami
i wydalinami (6). Stają się w ten sposób
najważniejszym źródłem zakażenia dla
pozostałych zwierząt w stadzie.
Płody zakażone śródmacicznie mię-
dzy 100.-150. dniem ciąży mogą rodzić
się z wrodzonymi wadami rozwojowy-
mi. Najczęściej są to:
• niedorozwój móżdżku,
• niedorozwój mózgu,
• małoocze,
• niedorozwój pokrywy włosowej (7).
Infekcja w późnym okresie ciąży
(125.-285. dzień ciąży) pobudza ak-
tywny już układ odpornościowy pło-
du do odpowiedzi immunologicznej.
Rezultatem są narodziny cieląt posia-
dających czynne przeciwciała przeciw
BVDV (przeciwciała przedsiarowe).
W momencie gdy system immunolo-
giczny płodu nie jest w stanie poradzić
sobie z wirusem, rodzą się młode z kli-
nicznymi objawami choroby (8). Skutki
zakażenia wirusem BVD krów cielnych
przedstawia schematycznie ryc. 1.
Wspomnieć należy, że osobniki trwa-
le zakażone po zetknięciu się z jedna-
kowym antygenowo, jednak cytopatycz-
nym wirusem BVD (np. przeniesionym
spoza fermy), chorują na śmiertelną
w skutkach chorobę błon śluzowych.
W przypadkach gdy do infekcji osob-
ników PI dochodzi przez szczep he-
terogenny, wytwarzane są normalne
przeciwciała. Jest to ważne przy rozpo-
znaniu i analizie sytuacji w stadzie cho-
rych zwierząt. W tym momencie cielę
lub krowa PI (wcześniej seronegatyw-
na) stają się serologicznie dodatnie.
Wskazania i strategia
Szczepienia
przeciw BVD/MD
Wirusową biegunkę i chorobę błon ślu-
zowych bydła wywołuje wirus należący
do rodziny Flaviviridae (rodzaj Pestivi-
rus), genotypowo spokrewniony z pa-
togenami odpowiedzialnymi za rozwój
pomoru klasycznego świń i choroby gra-
nicznej owiec. Podobnie jak inne RNA
wirusy, BVD/MD ma zdolność tworze-
nia wielu typów antygenowych. Dzię-
ki temu udaje mu się „obronić” przed
układem immunologicznym gospoda-
rza i w rezultacie długotrwale utrzymy-
wać w zainfekowanym stadzie.
Na zakażenie podatne jest bydło
w każdym wieku, nie mające wcze-
śniej kontaktu z wirusem i nie posia-
dające skierowanych przeciwko niemu
przeciwciał. Zawsze należy wziąć pod
uwagę możliwość nadkażenia innym
genotypem wirusa zwierząt, które były
wcześniej szczepione lub przechoro-
wały. Przeciwciała przeciwko genoty-
powi I nie chronią przed zakażeniem
genotypem II. Przełamanie odpor-
ności u bydła może wiązać się rów-
Duże rozpowszechnienie wiru-
sa BVD/MD w pogłowiu bydła
na całym świecie i związane
z tym ogromne straty ekono-
miczne ponoszone przez ho-
dowców zmuszają lekarzy we-
terynarii do skutecznej walki
z owym patogenem. Postępu-
jąc zgodnie ze słowami „le-
piej zapobiegać niż leczyć”,
najważniejszą metodą ochro-
ny całych stad przed wirusem
jest prawidłowo prowadzona
profilaktyka.
temat sezonu
weterynaria w terenie
2/2009
8
Krowy trwale zakażone zawsze będą
rodziły cielęta trwale zakażone i szcze-
pienie takich krów nie wyeliminuje tego
zjawiska.
Szczepić – nie szczepić?
Oto jest pytanie!
W ciągu ostatniej dekady wpływ wiru-
sowej biegunki i choroby błon śluzo-
wych na stan zdrowia bydła stał się bar-
dziej wyraźny i znaczący. Spowodowało
to większe zainteresowanie programa-
mi dążącymi do ochrony bydła i erady-
kacji wirusa BVD ze stad. Ze względu
na brak w Polsce programów zwalcza-
nia BVD/MD w pogłowiu bydła decyzja
o szczepieniach zależy głównie od wła-
ścicieli zwierząt i lekarzy weterynarii
zajmujących się danym stadem. Z regu-
ły opiera się ona na analizie prawdopo-
dobieństwa zakażenia krów i kosztów
wynikających z choroby. Wśród czynni-
ków, które powinny skłonić właściciela
do ochrony krów przed wirusem BVD,
są konsekwencje związane m.in. z:
• ronieniem krów,
• spadkiem mleczności,
• nieefektywnością pierwszej insemi-
nacji,
• upadkami cieląt,
• leczeniem (9).
Przytaczając dane z Bretanii (Fran-
cja), szacunkowe straty finansowe spo-
wodowane wirusem BVD w stadach
krów mlecznych mogą sięgać rocznie
60-100 euro na krowę. W tym straty wy-
nikłe z produkcji to 50-85 euro, a koszty
leczenia – 10-15 euro. Są to więc niema-
łe kwoty, które w odniesieniu do całego
stada mogą sięgać kilku czy nawet kil-
kudziesięciu tysięcy euro (7, 10).
Szczepienia przeciwko wirusowej
biegunce i chorobie błon śluzowych
są wykorzystywane także w progra-
mach zwalczania zakażenia w stadach
bydła. Przykładem może być model
niemiecki, wprowadzony w Dolnej
Saksonii. Oprócz identyfikacji i bra-
kowania z hodowli osobników trwale
zakażonych stosowane są systematycz-
ne szczepienia jałówek. Zabezpieczane
są wszystkie jałówki powyżej 6. miesią-
ca życia co najmniej 10 tygodni przed
pierwszym kryciem. W dalszym etapie
programu, mającym na celu utrzyma-
nie statusu stada wolnego od choro-
by, stosowane są szczepienia dwueta-
powe (11).
Celem szczepień, oprócz ogranicze-
nia strat ekonomicznych i zastosowa-
nia ich w programach walki z chorobą,
jest przede wszystkim uniknięcie śród-
macicznej infekcji płodów i rodzenie
osobników PI – siewców wirusa (5).
Szczepionki – którą wybrać?
Na rynku europejskim dostępne są
szczepionki wielu firm, zarówno żywe
(modyfikowane, atenuowane), jak i za-
bite (inaktywowane) (4).
Preparaty pierwszego typu zawiera-
ją szczepy wirusa poddanego w róż-
nym stopniu atenuacji. Procesy te mają
na celu zmniejszenie lub całkowitą eli-
minację właściwości chorobotwórczych
antygenu. Uważa się, że szczepionki
tego typu powodują wykształcenie „lep-
szej” i długotrwałej odporności. Po ich
zastosowaniu indukowana jest odpo-
wiedź limfocytów T i B. Podobna reak-
cja zachodzi w organizmie, kiedy do in-
fekcji wirusem dochodzi w warunkach
naturalnych szczepem terenowym.
Szczepionki żywe dają jednak tę nie-
pewność, że możliwe jest przepasażo-
wanie szczepu zastosowanego w szcze-
pionce w postać zjadliwą, wywołującą
objawy chorobowe, na przykład za-
szczepienie krów we wczesnym okre-
sie ciąży może skutkować urodzeniem
osobnika trwale zakażonego (5).
Drugi rodzaj szczepionek powoduje
wytworzenie przede wszystkim odpor-
ności humoralnej. Są one zdecydowa-
nie bezpieczniejsze w użyciu i znaj-
dują zastosowanie w każdym okresie
cielności. Nie zostało jednoznacznie
stwierdzone, jak długo utrzymywana
jest odporność. Nie jest też do koń-
ca poznane i wyjaśnione wytwarzanie
krzyżowej odporności płodowej (12).
Dlatego wymagana jest częsta rewakcy-
nacja w przypadku uodparniania zwie-
rząt szczepionką inaktywowaną.
Antygeny BVD/MD mogą być za-
warte również w szczepionkach poli-
walentnych, uodparniających jednocze-
śnie na wiele patogenów. Przykładem
mogą być szczepionki stosowane
w profilaktyce syndromu oddecho-
wego bydła. Wirus BVD nie indukuje
choroby samodzielnie. Może działać
immunosupresyjnie na układ odpor-
nościowy krowy, umożliwiając roz-
wój innych drobnoustrojów biorą-
cych udział w patogenezie BRDC (np.
BHV-1, PI-3, BRSV, Pasterella, Haemo-
philus). Dostępne obecnie szczepionki
poliwalentne nie posiadają udowodnio-
nej zdolności ochrony płodu, co jest
istotne dla preparatów stosowanych
przy biegunce wirusowej i chorobie
błon śluzowych (5).
0
5
25
75
95
100
0
5
25
75
95
100
0
5
25
75
95
100
0
5
25
75
95
100
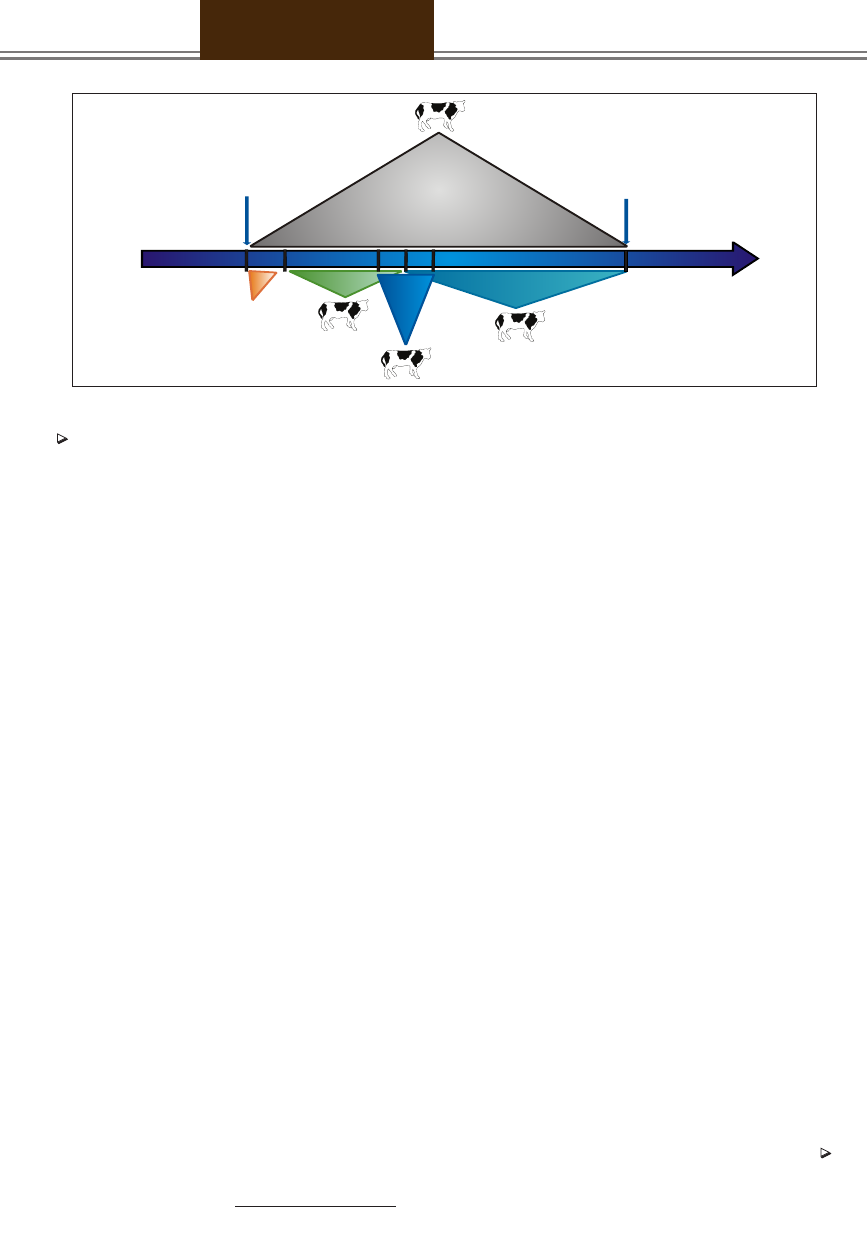
Rysunek1
23 marca 2009 08:16:53
ZAPŁODNIENIE
0
40
100 125 150
285
dzień
ZAKAŻENIE
WIRUSEM
BVD/MD
PORÓD
Ryc. 1. Skutki zakażenia wirusem BVD/MD w różnych okresach ciąży

temat sezonu
weterynaria w terenie
2/2009
10
Dobór odpowiedniej szczepionki po-
winien być poparty dokładnym rozpo-
znaniem sytuacji epizootycznej w sta-
dzie i szczegółową analizą czynników
ryzyka zagrażających zwierzętom.
W 1995 roku Frey i Eicken opraco-
wali procedurę dwuetapowego szcze-
pienia krów przy użyciu preparatów
ze szczepami inaktywowanymi i zmo-
dyfikowanymi żywymi. Jako pierwsze
stosowane są szczepionki inaktywo-
wane. Po upływie czterech tygodni
podaje się szczepionki atentowane.
Reakcja układu odpornościowego
na tak przeprowadzoną immunopro-
filaktykę jest znacznie wyższa i po-
woduje wykształcenie długotrwałej
odpowiedzi humoralnej. Przeciwciała
przeciwko BVDV stwierdzane były na-
wet po trzech latach od tak przepro-
wadzonych szczepień. Średnie mia-
no przeciwciał sięgało od 30 do 300.
Najniższe miana obserwowano w od-
niesieniu do BVDV-2. Pierwsze szcze-
pienie z wykorzystaniem szczepu
inaktywowanego zdaje się reduko-
wać, a wręcz zapobiegać wiremii
powstającej po zastosowaniu szcze-
pionki żywej i przez to zmniejsza roz-
przestrzenienie wirusa w organizmie
krów (13).
Ze względu na duże zróżnicowa-
nie antygenowe wirusa BVD może
się rodzić pytanie: czy zastosowa-
ne w szczepionkach szczepy będą
zdolne do indukowania odporności
przeciwko poszczególnym grupom
antygenowym BVDV występującym
w środowisku. Dzięki postępom na-
uki i możliwościom poznania genomu
wirusa stało się jasne, jak duże mogą
to być różnice (antygenowe i genetycz-
ne) (1, 14-17). W opisanym poniżej
doświadczeniu Frey i współpracow-
nicy w 2002 roku potwierdzili zdol-
ność do wytwarzania ochrony śródma-
cicznej płodów, po przeprowadzeniu
szczepień dwuetapowych, nawet prze-
ciwko dwóm różnym genotypom wiru-
sa (BVDV-1 i BVDV-2). Pierwsza grupa,
utworzona z dziewięciu seronegatyw-
nych jałówek, została zaszczepiona
dwukrotnie. Drugiej grupy, sześciu
jałówek, nie szczepiono. Między 30.
a 120. dniem ciąży jałówki obu grup
zakażono donosowo mieszaniną wi-
rusów BVDV-1 i BVDV-2. Wszystkie
krowy z grupy pierwszej ocieliły się,
dając zdrowe, seronegatywne (przed
pobraniem siary) cielęta, wolne od wi-
rusa BVD. Natomiast w grupie drugiej
urodziły się cztery słabo rozwinięte
cielęta z wiremią; jedno cielę martwe;
jedno cielę niezdolne do życia (pa-
dło po dwóch dniach). U wszystkich
cieląt pochodzących z grupy drugiej
stwierdzono wirusa BVDV-2. Pomi-
mo wykazania krzyżowej odporno-
ści między genotypami wirusa, nie
do końca wyjaśniono procesy jej po-
wstawania (18).
Nasze możliwości
W Polsce, jak do tej pory, istnieje moż-
liwość stosowania szczepionek inakty-
wowanych, produkowanych przez róż-
ne firmy. Zawierają one przykładowo:
inaktywowane szczepy C86, Aveyroni-
te, New York. W zależności od zasto-
sowanego szczepu producenci infor-
mują o odporności utrzymującej się
przez minimum osiem czy dziewięć
miesięcy. Prawidłowe użycie szcze-
pionki, wybranej zgodnie z naszymi
oczekiwaniami pozwala na zabezpie-
czenie matek/płodów jeszcze przed
zacieleniem bądź w trakcie ciąży (prze-
ciwciała siarowe).
Pierwszy typ szczepionek pozwala
na ochronę płodów pod warunkiem,
że ostatnia podana dawka była zasto-
sowana co najmniej 4 tygodnie przed
zacieleniem (szczepienia indywidual-
ne). W trakcie szczepień całego stada
stosuje się dwukrotne iniekcje w odstę-
pach czterech tygodni. Kolejne szcze-
pienie przypominające zalecane jest
co pół roku. Zabezpieczenie płodów
w tym systemie można uzyskać, gdy
pierwsze szczepienie zakończono czte-
ry tygodnie przed rozpoczęciem ciąży.
Późniejsza wakcynacja nie spowoduje
wykształcenia odporności ochrania-
jącej płód przed ewentualnym zaka-
żeniem śródmacicznym. Szczepione
są zwierzęta powyżej 8. miesiąca ży-
cia (19, 21).
Zastosowanie szczepionek u krów
wysokocielnych w szóstym i drugim
tygodniu przed porodem prowadzi
do wytworzenia wysokiego miana prze-
ciwciał seroneutralizujących w siarze.
Zgodnie z informacjami podanymi
przez producenta cielęta zabezpiecza-
ne są w ten sposób przez okres co naj-
mniej czterech miesięcy od narodzin.
Kolejne użycie szczepionki u takiej
młodzieży stosuje się po ukończeniu
4. miesiąca życia. Ważne jest, że u cie-
ląt pozbawionych ochrony przeciw-
ciał matczynych pierwsze szczepienie
możemy wykonać w 15. dniu życia.
Po przeprowadzeniu szczepień zasad-
niczych (dwie iniekcje co 3-4 tygodnie),
szczepienia przypominające zalecane
są co 9-12 miesięcy (20, 21).
Podsumowanie
Jak wspomniano, w Polsce nie opra-
cowano jeszcze ogólnokrajowego czy
regionalnych programów uwalniania
ferm od wirusowej biegunki bydła
i choroby błon śluzowych. Wiadomo,
że oprócz identyfikowania i elimi-
nacji osobników trwale zakażonych
ze stad, istotne jest zabezpieczenie
cieląt i krów przed zakażeniem wiru-
sem BVD. Wybór schematu szczepień
i rodzaj szczepionki uzależniony jest
od sytuacji w stadzie. Dopasowanie
programu ochrony krów przed BVD/
MD powinno być przeprowadzane
indywidualnie w porozumieniu z wła-
ścicielem zwierząt, aby uniknąć nie-
porozumień i ewentualnych błędów
związanych np. z wprowadzaniem
osobników „niepewnych”, niespraw-
dzonych pod kątem opisywanej cho-
roby. Straty ponoszone przez hodow-
ców winny być istotnym czynnikiem
skłaniającym do stosowania profilak-
tyki w wirusowej biegunce i chorobie
błon śluzowych.
q
Piśmiennictwo
1. Stadler H.P., Meier P.H., Pfaffen G.,
Wageck-Canal C., Rufenacht J., Schal-
ler P., Bachofen C., Marti S., Vogt H.R.,
Peterhans E.: Genetic heterogeneity of pe-
stiviruses of ruminants in Switzerland.
„Preventive Veterinary Medicine”, 72,
2005, 37-41.
2. Murphy F.A., Fauquet C.M., Bishop C.M.:
Viral Taxonomy. [w:] Family Flaviviridae.
Springer, New York, 1995, s. 27-45.
3. Bhudevi B., Weinstock D.: Fluorogenic
RT – PCR assay (TaqMan) for detection
and classification of bovine viral diarrhoea
Fot. 1. 2-letnia krowa zakażona BVDV, postać z silną,
wodnistą biegunką, osłabieniem, brakiem łaknienia
Fo
t. J. Radwińs
ka

temat sezonu
weterynaria w terenie
2/2009
11
r e k l a m a
virus. „Veterinary Microbiology”, 2001,
83, 1-10.
4. Niza-Ribeiro J., Pereira A., Souza J.,
Madeira H., Barbosa A., Afonso C.:
Estimated BVDV- prevalence, contact and
vaccine use in dairy herds in Northern
Portugal. „Preventive Veterinary Medi-
cine”, 2005, 72, 81-85.
5. Oirschot J.T., Bruschke C.J.M., van
Rijn P.A.: Vaccination of cattle against
bovine viral diarrhea. „Veterinary Micro-
biology”, 1999, 64, 169-183.
6. Sandvik T.: Laboratory diagnostic inve-
stigations for bovine viral diarrhea virus
infections in cattle. „Veterinary Microbio-
logy”, 1999, 64, 123-134.
7. Houe H.: Epidemiological features
and economical importance of bovine
virus diarrhea virus (BVDV) infections.
„Vete rinary Microbiology”, 1999, 64,
89-107.
8. Sorensen J.T., Enevoldsen C., Houe H.:
A stochastic model for simulation of the
economic consequence of bovine virus
diarrhoea virus infection in dairy herd.
„Preventive Veterinary Medicine”, 1995,
23, 215-227.
9. Biuk-Rudan N., Cvetnić S., Madić J.,
Rudan D.: Prevalence of antibodies to IBR
and BVD viruses in dairy cows with re-
productive disorders. „Theriogenology”,
1999, 51, 875-881.
10. Letellier C., Kerkhofs P.: Epidemiologia
zakażeń BVDV i strategie ich ogranicza-
nia. Rozród bydła a choroby zakaźne
– materiały Międzynarodowej Konfe-
rencji Naukowej, 2006, 27-35.
11. Greiser-Wilke I., Grummer B., Moen-
nig V.: Bovine viral diarrhea eradication
and control programs in Europe. „Biolo-
gicals”, 2003, 31, 113-118.
12. Graham D.A., Calvert V., Mooney J.,
Crawford J., Clery D.: Birth of persi-
stentlyinfected calves in two herds using
inactivated BVDV vaccines. Abstracts, Se-
cond European Symposium on BVDV
Control, Porto, 2004, 87.
13. Moennig V., Eicken K., Flebbe U., Frey
H.-R., Grummer B., Haas L., Greiser-Wil-
ke I., Liess B.: Implementation of two-step
vaccination in the control of bovine viral
diarrhea (BVD). „Preventive Veterinary
Medicine”, 2005, 72, 109-114.
14. Bachofen C., Stalder H., Braun U., Hil-
be M., Ehrensperger F., Peterhans E.:
Co-existence of genetically and antigeni-
cally diverse bovine viral diarrhea viruses
in an endemic situation. „Veterinary
Microbiology”, 2008, 131, 93-102.
15. Ridpath J.F., Bolin S.R.: Differentiation
of types Ia, Ib and II bovine viral diarr-
hoea virus (BVDV) by PCR. „Mol. Cell.
Probes”, 1998, 12, 101-106.
16. Ridpath J.F., Bolin S.R., Dubovi E.J.:
Segregation of bovine viral diarrhoea virus
into genotypes. „Virology”, 1994, 205,
66-74.
17. Ridpath J.F., Bolin S.R.: The genomic se-
quence of a virulent bovine viral diarrhoea
virus from the type II genotype: detection
of large genomic insertion in a noncytopa-
thic BVDV. „Virology”, 1995, 212, 39-46.
18. Alvarez M., Munoz Bielsa J., Santos L.,
Makoschey B.: Compatibility of live infec-
tious bovine rhinotraheitis (IBR) marker
vaccine and an inactivated bovine viral
diarrhoea virus (BVDV) vaccine. „Vacci-
ne”, 2007, 25, 6613-6617.
19. Materiały informacyjne firmy Intervet
na temat produkowanych szczepionek.
20. Materiały informacyjne firmy VetTrade
na temat produkowanych szczepionek.
21. Obwieszczenie Prezesa Urzędu Rejestra-
cji Produktów Leczniczych, Wyrobów
Medycznych i Produktów Biobójczych
z 7 marca 2008 r. w sprawie ogłoszenia
Urzędowego Wykazu Produktów Lecz-
niczych Dopuszczonych do Obrotu
na terytorium Rzeczypospolitej Polskiej,
Część 2A, Wykaz produktów leczni-
czych weterynaryjnych dopuszczonych
do obrotu na terytorium Rzeczypo-
spolitej Polskiej, s. 14 (Dz.U. Ministra
Zdrowia z 31 marca 2008 nr 2 poz. 8).
Wyszukiwarka
Podobne podstrony:
BVD MD
Kolejne zgony niemowląt po szczepionce przeciwko WZW B, Polska dla Polaków, Co by tu jeszcze spieprz
BVD-MD BVD-MD 3, Weterynaria, bydła + konie + trzoda chlerwna
4079 Szczepienie przeciwko wsciekliznie
aneta, jo 17, Do szczepionek możliwych do zastosowania w czasie ciąży należą szczepionki przeciw:
Wirus brodawczaka ludzkiego oraz szczepionki przeciwHPV
MICHALKIEWICZ Szczepionka przeciw wściekliźnie (2)
BVD-MD 2, Weterynaria, bydła + konie + trzoda chlerwna
Infekcje BVD MD w stadach bydła mogą się okazać przyczyną poważnych strat ekonomicznych tjx
SZCZEPIONKA PRZECIW PALENIU, NAUKA, WIEDZA
aneta, jo 19, Do szczepionek możliwych do zastosowania w czasie ciąży należą szczepionki przeciw:
BVD MD
3964 zamordowanych ludzi w UE przez eksperymentalne szczepionki przeciw Covid
Szczepienia przeciw grypie
Szokujący brak dowodów na skuteczność szczepionki przeciwgrypowej – 2
więcej podobnych podstron