
20
ARAZYTOLOGIA
P
WETERYNARIA
W PRAKTYCE
LIPIEC-SIERPIEŃ • 4/2004
G
ORĄCZKA
GÓR
SKALISTYCH
Wstęp
Choroba ta najczęściej występuje na
obszarach obydwu Ameryk. W Polsce
występuje sporadycznie i to zazwyczaj
jedynie jako tzw. choroba z importu.
Czynnik etiologiczny
Za wystąpienie choroby odpowiedzial-
na jest Rickettsia rickettsii.
Drogi szerzenia się choroby
Rezerwuarem zarazka są gryzonie,
zwierzyna płowa i zwierzęta gospodar-
skie. Wektorem zakażenia są kleszcze.
Objawy i przebieg choroby
Przyjmuje się, że aby zakażony kleszcz
mógł przekazać infekcję zwierzęciu, musi
żerować na nim od 4 do 6 godzin. Okres
inkubacji choroby to następne 5-10 dni.
Wtedy to pojawiają się pierwsze niespecy-
ficzne objawy choroby (13). Początkowo są
to stany podgorączkowe i gorączka, nud-
ności i wymioty, bóle mięśniowo-stawowe,
spadek i brak apetytu. W późniejszym
okresie pojawia się niepokój, bóle brzucha
z towarzyszącymi biegunkami. Na kończy-
nach pojawiać się mogą wybroczyny.
Diagnostyka
Immunofluorescencja pośrednia (IFA)
jest badaniem rutynowym w diagnostyce
tej jednostki chorobowej (14).
Leczenie
Tetracykliny – doksycyklina 10 mg/kg
mc. Leczenie kontynuować przez trzy dni
po spadku gorączki (15). W zależności od
szybkości podjętego leczenia powinno być
ono kontynuowane przez około 7-10 dni.
Zapobieganie
– Unikanie ekspozycji zwierząt na
kleszcze w terenie, gdzie endemicznie
występują zakażenia.
– Używanie repelentów przeciwko klesz-
czom.
– Stosowanie profilaktycznego podawania
niskich dawek tetracyklin psom żyjącym
w terenach najbardziej zagrożonych.
U psów choroba przybiera jeszcze
mniej wyraźny przebieg. O ile wcześniej
pies nie miał notowanych schorzeń
śledziony i o ile nie odnotowano u niego
zakażeń, np. erlichiozą, babeszjozą,
a dochodzi wciąż do niszczenia erytro-
cytów, to jest bardzo prawdopodobne, że
przyczyną jest haemobartonella.
Diagnostyka
Mikroskopowe badanie parazytologicz-
ne rozmazów krwi barwionych Giemsą
i wykrycie obecności haemobartonelli
w erytrocytach to wciąż podstawowe
i rutynowe badanie w diagnostyce tej
choroby. Ażeby badanie było miarodajne,
należy wykonać kilka badań rozmazów
w odstępach kilku dni.
Wykrycie obecności w erytrocytach
haemobartonelli jest metodą potwier-
dzającą podejrzenie, jednakże nie
świadczącą jednoznacznie o chorobie.
Okazuje się bowiem, że np. u wielu
kotów wykrywano haemobartonel-
lę, a osobniki takie nie wykazywały
żadnych niepokojących objawów kli-
nicznych. Z drugiej jednak strony
bezspornym jest fakt, że u 20% kotów
z haemobartenellozą wykryto potwier-
dzone testami współzakażenie FeLV, co
może ewidentnie przemawiać za opor-
tunistycznym charakterem zakażenia
haemobartonellą.
PCR (polimerazowa reakcja łań-
cuchowa), jako niezawodna metoda
diagnostyczna, udziela jednoznacznej
odpowiedzi, czy zwierzę dotknięte jest
haemobartenellozą (18).
Leczenie
Leczenie z wyboru to antybiotykote-
rapia tetracyklinami, a w szczególno-
ści oxytetracykliną lub doxycykliną,
podawanymi p.o. przez trzy tygodnie.
Pamiętać jednak trzeba o tym, że le-
czenie takie może nie dać całkowitego
oczekiwanego efektu i choroba może
nawracać. U kotów czasami w ostrym
H
AEMOBARTENELLOZA
Wstęp
Jest to choroba szeroko rozpowszech-
niona wśród psów i kotów na wielu
kontynentach. Za wystąpienie choroby
odpowiedzialne są:
– u psów Haemobartonella canis,
– u kotów Haemobartonella felis (16).
Czynnik chorobotwórczy
Haemobartonella jest gram-ujemnym
drobnoustrojem o śródkomórkowym
powinowactwie, zakwalifikowanym do
Rickettsiales. Atakuje ona erytrocyty, pro-
wadząc tym samym do ich degradacji.
Drogi szerzenia się choroby
Wektorem zakażenia najprawdopo-
dobniej mogą być pchły, kleszcze, wszy
i komary. Częstokroć do zakażenia do-
chodzi na drodze jatrogennej, np. przez
transfuzję krwi lub przeszczepy narzą-
dów i tkanek pochodzących od chorych
osobników. Choć nie jest to dostatecznie
udowodnione, do zakażenia potomstwa
suk i kotek może dojść śródmacicznie.
Nie wyklucza się także gryzoni jako
potencjalnego wektora zakażenia, gdyż
wielokrotnie izolowano od nich te drob-
noustroje chorobotwórcze.
Objawy choroby
U kotów choroba najczęściej przebiega
w sposób łagodny, bez wyraźnych objawów,
lub jedynie ze słabo zaznaczoną anemią.
Niespecyficzne objawy, jak: utrata apetytu
i wagi ciała zwierzęcia, depresja i nierzadko
żółtaczka, mogą dopełniać obrazu zakaże-
nia. Jedynie w przypadkach, kiedy koty
zakażone są FeLV bądź FIV, choroba jako
zakażenie oportunistyczne staje się bardzo
niebezpieczna (17). W warunkach natural-
nych, kiedy wolny od innych zakażeń kot
zainfekowany zostaje haemobartonellą,
z reguły z opanowaniem choroby nie ma
problemów. Koty zdrowieją, jednakże stają
się stałym źródłem zakażenia i wszelkie
sytuacje immunosupresyjne są w stanie
uaktywnić proces chorobowy.
Niebezpieczne choroby
przenoszone przez
kleszcze i komary
CZ. II
Artur Dobrzyński
specjalista chorób psów i kotów, Lecznica dla Zwierząt w Warszawie
Prezentujemy drugą część artykułu tego autora. W części pierwszej opisano jednostki
chorobowe: babeszjozę, boreliozę i erlichiozę.
WETERYNARIA
W PRAKTYCE
22
ARAZYTOLOGIA
P
WETERYNARIA
W PRAKTYCE
LIPIEC-SIERPIEŃ • 4/2004
i powikłanym przebiegu konieczne jest
podanie glikokortykosteroidów, a nawet
konieczność przeprowadzenia transfuzji
krwi. Niezbędne okazać się mogą leki
poprawiające krwiotworzenie, wysokiej
jakości karma i suplementacja mineral-
no-witaminowa.
Zapobieganie
Stosowanie repelentów na ektopasoży-
ty, unikanie miejsc, gdzie haemobarte-
nelloza występuje enzootycznie.
T
ULAREMIA
Wstęp
Tularemia jest chorobą rozpowszech-
nioną głównie na półkuli północnej.
W naszych warunkach klimatycznych
największą liczbę zachorowań obserwuje
się od wiosny do jesieni.
Czynnik etiologiczny
Za wystąpienie choroby odpowiedzial-
na jest gram-ujemna pałeczka Franci-
sella tularensis. Jest ona stosunkowo
wrażliwa na działanie podstawowych
środków dezynfekcyjnych. W temp. 56
stopni Celsjusza ginie po 10 minutach,
natomiast jest oporna na działanie ni-
skich temperatur.
Drogi szerzenia się choroby
Głównym wektorem choroby w przy-
padku zwierząt są owady – kleszcze, gzy
i komary. W przypadku człowieka, ale
i zwierząt mięsożernych – zając.
Objawy i przebieg choroby
Do zakażenia najczęściej dochodzi
na skutek przekazania zakażenia od
żerującego i zainfekowanego owada,
przez zjedzenie surowego lub wpółsu-
rowego zająca bądź rzadziej poprzez
spojówki lub na drodze aerogennej.
Jeszcze rzadziej, ale stwierdzono i takie
przypadki, do zakażenia dochodziło na
skutek spożycia zainfekowanej wody.
Chorobotwórcze zarazki namnażają
się bezpośrednio w miejscu wniknięcia
do organizmu i wraz z kwioobiegiem
następuje ich rozsiew do różnych na-
rządów. Okres inkubacji choroby to
zwykle 3-6 dni.
W zależności od miejsca wtargnię-
cia zarazka wyróżnia się kilka postaci
choroby:
– Wrzodziejąco-węzłowa to postać
tularemii charakterystyczna dla
zakażenia skórnego. Znacznemu
powiększeniu i bolesności ulegają
regionalne węzły chłonne bezpośred-
nio sąsiadujęce z wrotami zakażenia.
Następstwem zakażenia jest ich mar-
twica i ropowica wraz z przetokami
na zewnątrz.
– Oczno-węzłowa najczęściej jest następ-
stwem zakażenia dospojówkowego.
Pojawiają się nacieki zapalne spojó-
wek, a następnie ich owrzodzenia.
Zakażeniu również towarzyszy powięk-
szenie i bolesność węzłów chłonnych
podżuchwowych i szyjnych.
– Węzłowa charakteryzuje się powiększe-
niem wszystkich węzłów chłonnych.
Niekiedy choroba może przybierać
nawet formę posocznicy.
– Anginowa jest następstwem zaka-
żenia doustnego i charakteryzuje
się zmianami w migdałkach oraz
powiększeniem regionalnych węzłów
chłonnych.
– Trzewna, do której dochodzi na drodze
zakażenia alimentarnego i która jest
wyjątkowo trudna do rozpoznania.
Dominującymi objawami są luźne
stolce, wymioty, nawet owrzodzenia
jelit i krwawienia z przewodu pokar-
mowego (19).
– Płucna jest następstwem zakażenia
aerogennego. Charakteryzuje się
śródmiąższowym zapaleniem płuc,
niekiedy z odkrztuszaniem krwistej
wydzieliny. Wyraźnie zaznaczona
jest duszność, zaś sam przebieg tej
postaci jest bardzo ciężki.
Diagnostyka
Najważniejsze znaczenie (oprócz
wywiadu) w diagnostyce ma badanie
bakteriologiczne krwi i materiału po-
chodzącego ze zmienionych miejsc.
W przypadku badań serologicznych
w diagnostyce wykorzystywane są: im-
munofluorescencja, test Elisa i odczyn
wiązania dopełniacza, a także odczyn
hemaglutynacji biernej.
Leczenie
Antybiotykiem z wyboru jest strep-
tomycyna w dawce 7,5-10 mg/kg mc.
przez 7-10 dni. Można zastosować rów-
nież tetracykliny i gentamycynę (chlo-
ramphenicol i rifampicyna dostępne są
tylko w leczeniu zamkniętym) (20).
Profilaktyka
Unikanie kontaktu ze zwierzętami
potencjalnie chorymi – szczególnie
w terenie, gdzie tularemia występuje
enzootycznie. Stosowanie repelentów
odstraszających owady. Unikanie jedze-
nia surowych i półsurowych produktów
z udziałem mięsa z zająca.
D
IROFILARIOZA
–
ROBAKI
SERCOWE
I
PŁUCNE
Wstęp
W chwili obecnej, kiedy następują tak
widoczne zmiany klimatyczne, zmierza-
jące ku stałemu ocieplaniu klimatu na
naszym globie, następuje stała reorgani-
zacja patogenów, a w tym także czynni-
ków parazytologicznych. Dobrym na to
przykładem mogą być inwazje Dirofilaria
immitis, nazywanej popularnie z angiel-
ska „robakami sercowymi”. Pasożyty te,
niebezpieczne dla psów, kotów, wilków,
kojotów, lisów, fretek, niedźwiedzi i in-
nych zwierząt, spotykane są obecnie
na całym świecie, z wyjątkiem terenów
arktycznych.
Pierwsze nieśmiałe doniesienia na
temat tej parazytozy ukazały się już
w 1856 roku w Stanach Zjednoczo-
nych Ameryki Północnej. Wówczas
to w stanie Winsconsin odnotowano
niespotykaną dotąd inwazję komarów
i masowe upadki zwierząt z nie wy-
jaśnionych do końca przyczyn. Zna-
miennym był jednak fakt, że zwierzęta
padały wśród objawów niewydolności
układu sercowo-naczyniowego. Kon-
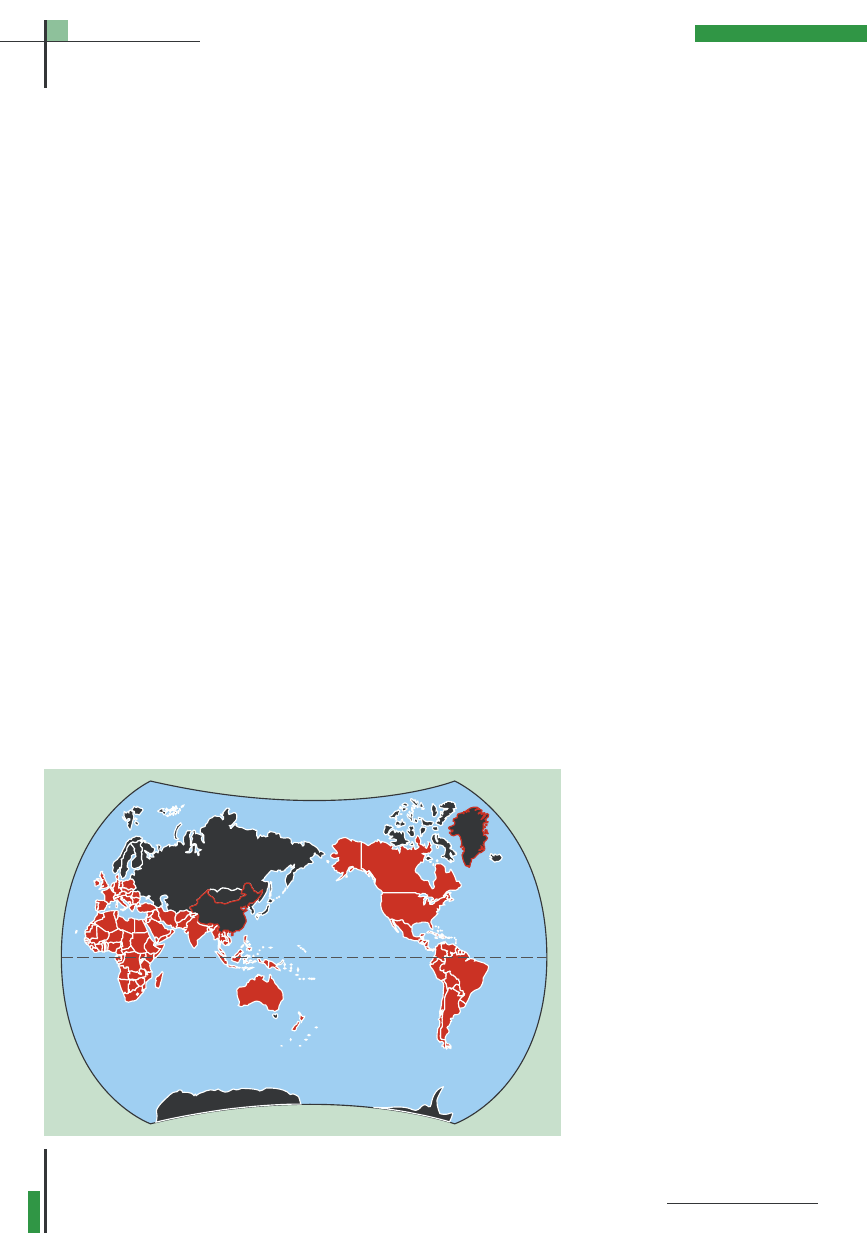
Rys. 1. Występowanie Dirofilaria immitis na świecie.
23
PARAZYTOLOGIA
WETERYNARIA
W PRAKTYCE
LIPIEC-SIERPIEŃ • 4/2004
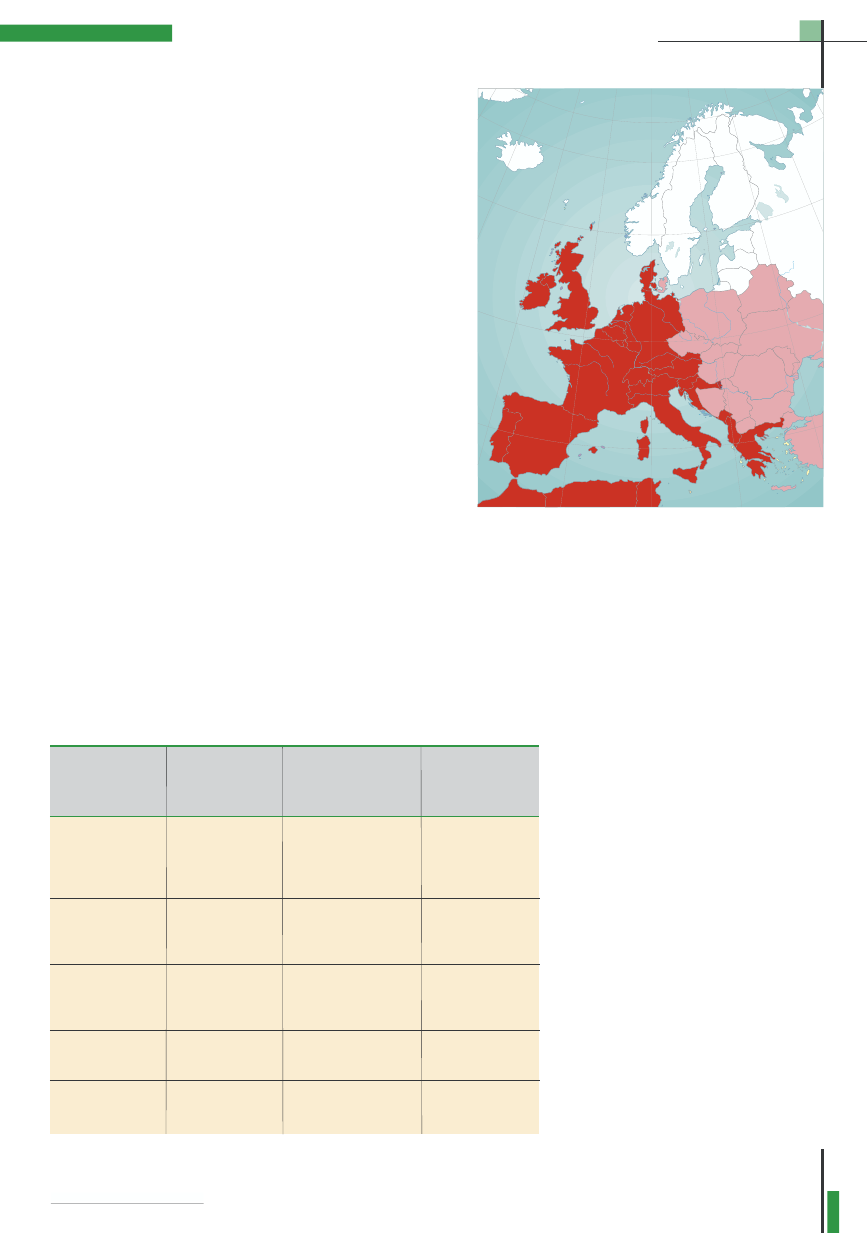
Rys. 2. Notowane przypadki dirofilariozy w niektórych krajach Europy.
tynent europejski do niedawna wolny
był od tej parazytozy. Jednak kilka lat
temu stwierdzono pierwsze przypadki
tej choroby w Hiszpanii, Grecji, Francji,
Niemczech, a ostatnio także na Wę-
grzech. Biorąc pod uwagę bliskość tych
państw i wręcz sąsiedzkie odległości
od Polski, wydaje się, że ta dotychczas
spotykana sporadycznie w naszym
kraju „choroba z importu” będzie
częstym powodem wizyt w gabinetach
weterynaryjnych.
Objawy choroby
U psów pierwsze niepokojące obja-
wy występują w chwili, kiedy zwierzę
opadnięte jest inwazją 20-25 pasożytów.
Kiedy inwazja sięga 50-60 pasożytów,
pojawiają się objawy niewydolności
krążenia. W przypadku masowej inwazji,
tj. 100 i więcej pasożytów, dochodzi do
zablokowania tętnicy płucnej i prawej
komory serca. Nierzadko również na
skutek takiej inwazji następuje przerost
i znaczne powiększenie prawej komory
serca.
Wśród niespecyficznych objawów
mogących wskazywać na inwazję
Dirofilaria immitis trzeba wspomnieć
o tym, że zwierzęta łatwo się męczą,
występuje u nich uporczywy suchy
kaszel wraz z odkrztuszaniem krwistej
wydzieliny, widoczny jest wyraźny
spadek apetytu, a co za tym – spadek
wagi ciała, są apatyczne i kache-
tyczne. Temperatura ciała jest tylko
nieznacznie podwyższona. Widoczna
jest wyraźna bladość śluzówek i spo-
jówek. W badaniach biochemicznych
krwi zaznaczona jest niewydolność
wątroby i nerek wynika-
jąca z niedostatecznego
ukrwienia tych narządów
wewnętrznych (21).
U opadniętych chorobą
kotów objawy są bardzo
podobne, z tym jednak,
że zakażenie jest mniej
częste, ponieważ koty
nie są idealnym gospo-
darzem dla Dirofilaria
immitis. Tak więc koty
są wrażliwe na zakaże-
nie, ale są stosunkowo
opornym gospodarzem.
W warunkach doświad-
czalnych wykazano, że
są one o około 30% mniej
wrażliwe niż psy. Wynika
to po części z faktu, że
komary wolą żywić się
krwią psią, a nie kocią,
ale także z faktu, iż pa-
sożyty u kota nie osią-
gają aż takich dużych
rozmiarów, co nie jest
bez znaczenia w cyklu
rozwojowym pasożyta.
Długość cyklu życiowego dirofilarii
u kota wynosi mniej niż dwa lata,
u psów zaś około pięciu lat. Tak więc
i sama choroba u kota ma charakter
bardziej przemijający niż u psa.
Cykl życiowy pasożyta
Dorosłe pasożyty, jak już zostało
wspomniane, spotykane są w prawej
komorze serca i tętnicy płucnej.
Tam to samice składają mikrofilarie,
które to uwalniane są do krwioobiegu.
Wektorem choroby są samice koma-
rów, które wraz z zassaną krwią od
chorego zwierzęcia pobierają mikro-
filarie. W ciągu 24-36 godzin w kana-
likach Malphigiego komara następuje
linienie pasożyta i przeobrażenie się go
z pierwszego stadium (L
1
) rozwojowego
w drugie (L
2
). Po około 10-20 dniach
następuje kolejne linienie i przeobra-
żenie się larw w stadium trzecie (L
3
). Te
wędrują do aparatu gębowego komara.
Ten w czasie kolejnego żerowania na
zwierzęciu przekazuje mu zakażenie.
Dostawszy się do tkanki podskórnej
zwierzęcia, larwy przeobrażają się
w czwarte stadium (L
4
) po około 9-12
dniach od chwili ukąszenia komara.
Rozpoczyna się wędrówka pasożyta
naczyniami krwionośnymi w kierunku
prawej komory serca, która trwać może
60-70 dni. Po osiągnięciu miejsca do-
celowego następuje rozwój dojrzałych
form pasożyta, zdolnych po 174-223
dniach wydać kolejne pokolenie mi-
krofilarii (22).
Diagnostyka
Test Elisa: użyteczny po około 30-60
dniach od chwili zakażenia.
Badanie RTG: powiększenie prawej
komory serca i tętnicy płucnej. Rzadziej
można wykazać obecność samych pa-
sożytów. Nierzadko ogniska zwapnień
w płucach będących następstwem
wydalanych do nich martwych postaci
pasożyta.
Badanie hematologiczne: istotny
wzrost granulocytów kwasochłonnych
w rozmazie krwi. Ponadto można wyka-
Tab. 1. Leczenie dirofilariozy.
Nazwa
substancji
czynnej/
preparatu
Ivermectin
(Heartquard)
(Heartquard plus)
(Heartquard
for cats)
Milbemycin
oxime
(Interreceptor)
(Sentinel)
Dietylcarbamazin
(Filarbits)
(Filarbits plus)
Moxidectin
(Pro Heart)
Moxidectin
(Pro Heart 6)
Dawka
1 raz na miesiąc
1 raz na miesiąc
1 raz dziennie
1 raz na miesiąc
co 6 miesięcy
Minimalny
wiek
leczonego
zwierzęcia
powyżej
6. tygodnia życia
powyżej
4. tygodnia życia
brak wieku
minimalnego
powyżej 8.
tygodnia życia
powyżej 6.
miesiąca życia
Uwagi
stosować, gdy
zakażenie już
miało miejsce
stosować, gdy
zakażenie już
miało miejsce
stosować, gdy
w chwili obecnej
jest ekspozycja
na zakażenie
stosować, gdy
zakażenie
już miało miejsce
stosować, gdy
zakażenie już
miało miejsce

24
ARAZYTOLOGIA
P
WETERYNARIA
W PRAKTYCE
LIPIEC-SIERPIEŃ • 4/2004
zać ich obecność w odkrztusinie z płuc.
Wykazanie obecności mikrofilarii w roz-
mazie krwi (wyjątkowo rzadko) (23).
Leczenie
Stosowanie takich preparatów, jak
Thiacetarsamide (Caparsolate), opartych
na arsenie, jest bardzo efektywne, ale
ryzykowne. Preparat musi być ze względu
na swoją wysoką toksyczność podawany
dożylnie za pomocą dokładnie założonego
wenflonu. Podanie go poza żyłę może być
powodem poważnej martwicy kończyny.
Podobnie rzecz wygląda w przypadku Me-
larsomine (Immiticide), który także oparty
jest na arsenie i wymaga bardzo staran-
nego i głębokiego podania domięśniowego.
W chwili obecnej bardzo szerokie zastoso-
wanie ma Salamectin (Stronghold).
Zapobieganie
Unikanie ekspozycji zwierząt na ko-
mary w terenie, gdzie endemicznie wy-
stępują inwazje Dirofilaria immitis. Uży-
wanie repelentów przeciwko komarom.
Stosowanie profilaktycznego podawania
leków o bójczym działaniu wobec filarii.
Serologiczne monitorowanie z użyciem
testu Elisa raz na sześć miesięcy.
Podsumowanie
Praktycznie w chwili obecnej nie jest
znana liczba psów i kotów dotkniętych
inwazją Dirofilaria immitis. Sytuacja
taka ma miejsce nie tylko w Europie,
ale i USA. Biorąc jednak pod uwagę
fakt, że chorobę transmitować może
50 gatunków komarów, a w tym np.
Aodes sp. i komar widliszek, należy
przypuszczać, że będzie ona coraz
częstszym powodem odwiedzin ga-
binetów weterynaryjnych również
w naszym kraju.
Piśmiennictwo:
1. Koehler P.G., O. i F.M.; Ticks. University of
Florida. www.edis.ifas.ufl.edu/IG088.
2. Hułas C., Dobrzyński A., Przypadki babe-
szjozy psów, „Medycyna Weterynaryjna”
1995, nr 51.
3. Taboada J., Babesiosis. Infectious Diseases
of the Dog and Cat, W.B. Saunders 1998.
4. Ano H., Makimura S., Harasawa R., Detec-
tion of Babesia species from infected dog
blood by polymerase chain reaction, J Vet.
Med. Sci. 2001, 63.
5. Briknenheuer A.J., Levy M.G., Savary K.C.,
Babesia gibsoni infections in dogs from
North Carolina, J Am Anim. Hosp. Assoc.
1999, 35.
6. Perkins S.C., Babesia and the pet travel
scheme, Vet. Rec. 2000.
7. Winiarczyk S., Grądzki Z., Choroby zakaźne
zwierząt domowych z elementami zoonoz,
2000.
8. Straubinger R.K., Straubinger A.F., Sum-
mers B.A., Jacobson R.H., Status of Bor-
relia burgdorferi infection after antibiotic
treatment and the effects of corticostero-
ids, J. Infect. Dis. 2000, 181.
9. Straubinger R.K., Straubinger A.F, Sum-
mers B.A., Jacobson R.H., Erb H.N.,
Clinical manifestation, pathogenesis, and
effect of antibiotic treatment on Lyme bor-
reliosis in dogs, Wien. Klin. Wochenschr.
1998, 110.
10. Winiarczyk S., Grądzki Z., Choroby za-
kaźne zwierząt domowych z elementami
zoonoz, 2000.
11. Harrus S., Warner T., Bark H., Canine mo-
nocytic ehrlichiosisan update. Compend.
Contin. Educ. Prac. Vet., 1997, 19.
12. Keysary A., Waner T., Rosner M., Warner
C.K, Dawson J.E., Zass R., Biggie K.L.,
Harrus S., The first isolation, in vitro
propagation, and genetic characterization
of Ehlichia canis in Israel. Vet. Parasitol.
1996, 62.
13.
Neer T.M., Canine monocytic and granu-
locytic ehrlichiosis, In: Greene C.E., ed.
Infectious diseases of the dog and cat,
Philadelphia, W.B. Saunders Co., 1998.
14. Peacock M.G., Burgdorfer W., Ormsbee
R.A., Rapid Fliorescent-antibody conjuga-
tion procedure, Infect. Immun. 1971.
15. Breitschwerdt E.B., The rickettsioses,
In: Ettinger S.J., Feldman E.C., eds.
Textbook of Veterinary Internal Medicine.
Philadelphia, W.B. Saunders Co., 2000.
16. Winiarczyk S., Grądzki Z., Choroby za-
kaźne zwierząt domowych z elementami
zoonoz, 2000.
17. Bobade P.A., Nash A.S., Rogerson P.,
Feline haemobartonellosis; clinical, ha-
ematological and pathological studies in
natural infections and the relationship to
infecton with feline leukemia virus, Vet.
Rec. 1998, 122.
18. Messick J.B., Berent L.M., Cooper S.K.,
Development of a PCR-based assay for
the detection of Haemobartonella felis in
cats and differentiation of H. felis from
related bacteria by restriction fragment
length polimorphism, J. Clin. Mikrobiol.
1998, 36.
19. Elis J., Oyston P.C.F., Green M., Titball
R.W., Tularemia, Clin. Mikrobiol. Rev.
2002, 15.
20. Frymus T., Choroby zakaźne psów, Wy-
dawnictwo SI-MA 1999.
21. Lok J.B., Knight D.H., A review of the tre-
atment options for heartworm infections,
Supplement to Veterinary Medicine 1997.
22. http://ucdnema.ucdavis.edu/imagemap/
nemmap/ent156html/nemas/dirofilaria-
immitis
23. Hendrix C.M., Diagnostic Veterinary Parasi-
tology, Mosby, Inc., St. Louis MO 1998.
lek. wet. Artur Dobrzyński
Lecznica dla Zwierząt
04-052 Warszawa
ul. Grenadierów 13
Wyszukiwarka
Podobne podstrony:
Choroby przenoszone przez kleszcze
Choroby przenoszone przez kleszcze
Choroby przenoszone przez kleszcze i salmonella
niebespieczne choroby przenoszone przez kleszcze
Choroby przenoszone przez zywnosc
więcej podobnych podstron