
Analiza instrumentalna
14. Przewodnictwo
elektrolitów
Ćwiczenia laboratoryjne
Pracownia Analizy Instrumentalnej

1
Przewodnictwo elektrolitów.
PRZEWODNICTWO ELEKTROLITÓW
REWERS
1. Czujnik konduktometryczny
1 szt.
2. Pipeta automatyczna poj. 1 cm
3
1 szt.
3. Zlewki: 50 cm
3
1 szt.
400 (lub 600) cm
3
1 szt.
4. Nasadka na pipetę automatyczną z wężykiem
2 szt.
5. Tryskawka
1 szt.
6. Sztabka mieszająca ( w pojemniku)
1 szt.
7. Konduktometr 1 szt.
8. Pipeta szklana 20ml 1 szt.
9. Nasadka na pipetę szklaną 1 szt.
10. Zlewka 25 ml 1 szt.

Przewodnictwo elektrolitów.
2
1. Wykonanie ćwiczenia
Zadanie: Oznaczenie stężenia NaCl w próbce otrzymanej do analizy P.
1. W uchwycie umieścić czujnik konduktometryczny.
2. Obie otrzymane kolbki o poj. 10ml oznaczone (z roztworem analizowanym P
oraz z wzorcem W) uzupełnić wodą destylowaną do kreski.
W obu kolbkach wydano NaCl .
W kolbce oznaczonej literą W wydano 1 cm
3
NaCl o stężeniu 1 mola.
3. Zmierzyć przewodnictwo wody destylowanej.
W tym celu do zlewki miarowej poj. 50 cm
3
:
- dolać 40 cm
3
wody destylowanej do zlewki;
- włożyć sztabkę mieszającą.
Ustawić zlewkę na mieszadle magnetycznym, uruchomić mieszanie i zanurzyć czujnik
w roztworze miareczkowanym tak, aby oba pierścienie platynowe znalazły się poniżej
powierzchni roztworu.
Wskazania miernika powinny być poniżej 4 µS.
Jeśli są większe należy przepłukać elektrodę konduktometryczną wodą de3stylowaną
i wrócić do pkt 3.
4. Przygotować roztwór do pomiaru. W tym celu do zlewki poj. 50 cm
3
:
- odpipetować 1 cm
3
roztworu z kolbki P;
- dolać 40 cm
3
wody destylowanej do zlewki;
- włożyć sztabkę mieszającą.
Ustawić zlewkę na mieszadle magnetycznym, uruchomić mieszanie i zanurzyć czujnik
w roztworze miareczkowanym tak, aby oba pierścienie platynowe znalazły się poniżej
powierzchni roztworu.
W celu usunięcia bąbelków powietrza z roztworu należy po około 1 minucie wyłączyć
mieszanie i uruchomić je ponownie.
Ustalenie wskazań miernika następuje po około 3 minutach.
Spisać ustaloną wartość wskazań.
5. Z kolbki oznaczonej literą W pobrać 1 cm
3
roztworu i wlać do kolbki oznaczonej literą P
i dokładnie wymieszać.
6. Wykonać pomiar tak jak w pkt 4.
7. Czynność opisaną w pkt 5 powtórzyć 9 razy.
8. Po zakończeniu pomiarów dokładnie przepłukać elektrodę konduktometryczną oraz
używane akcesoria.
9. Elektrodę konduktometryczną pozostawiamy zanurzoną w wodzie destylowanej.
3
Przewodnictwo elektrolitów.
2. Opracowanie wyników
1. Obliczyć różnice przewodnictwa roztworu NaCl i wody.
2. Obliczyć stężenie molowe NaCl w kolejnych badanych roztworach w kolbce P.
Dla próbki przyjmij 0 mol/dm
3
.
3. Narysować wykres zależności różnicy przewodnictwa roztworu NaCl i wody w
zależności od stężenia NaCl w kolbce P.
4. Z równania prostej wyznaczyć stężenie NaCl w analizowanej próbce, a następnie
obliczyć jego liczność i masę.
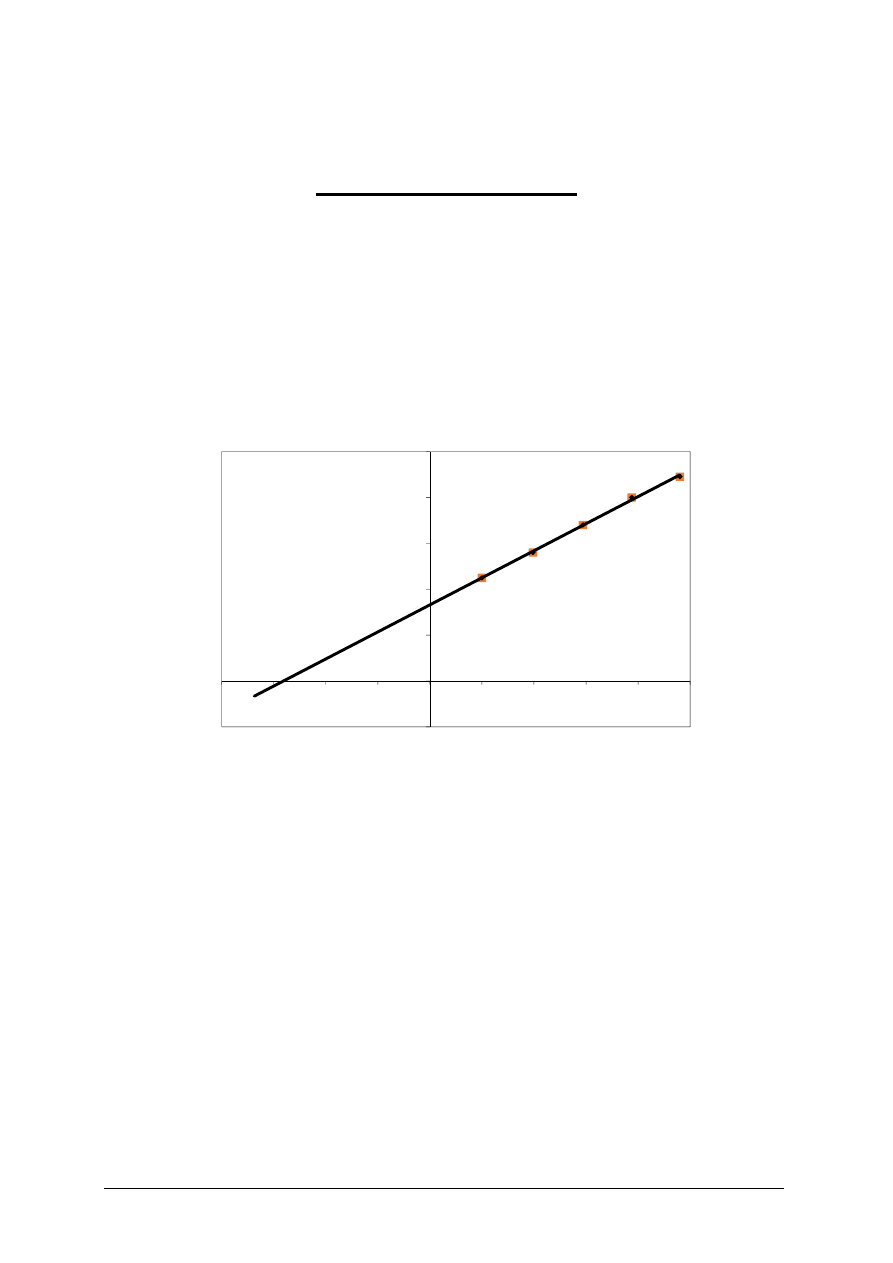
Rys. 3. Przykładowy wykres zależności różnicy przewodnictwa roztworu NaCl i wody od
stężenia. Szukaną wartość stężenia dla analizowanej próbki wyznaczyć z równania
prostej dla y = 0.
-0,0020
0,0000
0,0020
0,0040
0,0060
0,0080
0,0100
-8,0
-6,0
-4,0
-2,0
0,0
2,0
4,0
6,0
8,0
10,0
C[mol]

Przewodnictwo elektrolitów.
4
2.1. Statystyczne opracowanie wyników
Aby przeprowadzić ocenę statystyczną wyników, korzysta się z następującego
schematu obliczeń:
średnia arytmetyczna x (z liczby moli NaCl
)
N
x
x
i
∑
=
(1.1)
gdzie:
i
x - liczba moli NaCl i-tych wyników w mol;
N
- liczba obliczonych wyników moli NaCl (jeżeli któryś wynik wydaje się
wątpliwy i odbiega od pozostałych wartości, należy go pominąć w
dalszych obliczeniach).
wariancja S
2
(
)
1
2
2
−
−
=
∑
N
x
x
S
i
(1.2)
odchylenie standardowe S
(
)
1
2
−
−
=
∑
N
x
x
S
i
(1.3)
odchylenie standardowe średniej arytmetycznej
x
S
(
)
(
)
N
S
N
N
x
x
S
i
x
=
−
−
=
∑
1
2
(1.4)
przedział ufności średniej arytmetycznej
x
S
t
x
⋅
±
(1.5)
gdzie:
t - rozkład „t – Studenta”
Wartość współczynnika t znaleźć w poniższej tabeli rozkładu Studenta dla
prawdopodobieństwa równego 95% (najczęściej przyjmuje się takie prawdopodobieństwo).

5
Przewodnictwo elektrolitów.
Stopień swobody
k = N- 1
Współczynnik t dla
prawdopodobieństwa
95%
1
12,706
2
4,303
3
3,182
4
2,776
5
2,571
6
2,447
N – liczba pomiarów
Wynik końcowy liczby moli NaCl
w badanej próbce należy podać w postaci:
n
S
t
n
n
⋅
±
=
Wyniki umieścić w arkuszu sprawozdania
oraz dołączyć obliczenia, wraz z wykresami.
(1.6)
Wyszukiwarka
Podobne podstrony:
3 Przewodnictwo elektryczne
Przewodnictwo elektryczne
13 14 Przewodnik po programie podstaw dydaktykiid 14580
Przewodnictwo Elektrolityczne
,Laboratorium podstaw fizyki, Zależność przewodnictwa elektrolitu od temperatury sprawdzanie reguły
14?le elektromagnetyczne
Sprawozdania Karol, Przewodnictwo elektrolitów
Ćw nr 16. Kondensator, Kondensatorem nazywa si? dwa przewodniki elektryczne, odizolowane od siebie n
Przewodnictwo elektrolitu, Fizyka- Zależność przewodnictwa elektrolitu od temperatury., _________And
Przewodnictwo elektrolitu, Fizyka- Zależność przewodnictwa elektrolitu od temperatury. Sprawdzanie r
sekuła, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyczna,
PRZEWODNICTWO ELEKTRYCZNE TKANEK
10 PRZEWODNICTWO ELEKTRYCZNE TKANEK
Jak postępować w przypadku przewiercenia w ścianie przewodu elektrycznego(1)
chgrg w 14 subs elektrofilowa
Przewodnictwo elektryczne gazów i cieczy ll, FIZYKA-ZBIÓR MATERIAŁÓW
Wnioski ćw.przewody, Elektroenergetyka
Ściągi z fizyki-2003 r, Przewodnictwo elektryczne cieczy i gazów
47, Ćw 47 Zależność przewodnictwa elektrycznego elektrolitów od temperatury sprawdzenie reguły Walde
więcej podobnych podstron