‹#›
RJC
Aromatyczne
Aromatyczne
Substytucje Elektrofilowe
Substytucje Elektrofilowe
Aromatyczne
Aromatyczne
Substytucje Elektrofilowe
Substytucje Elektrofilowe
Slides 1 to 41
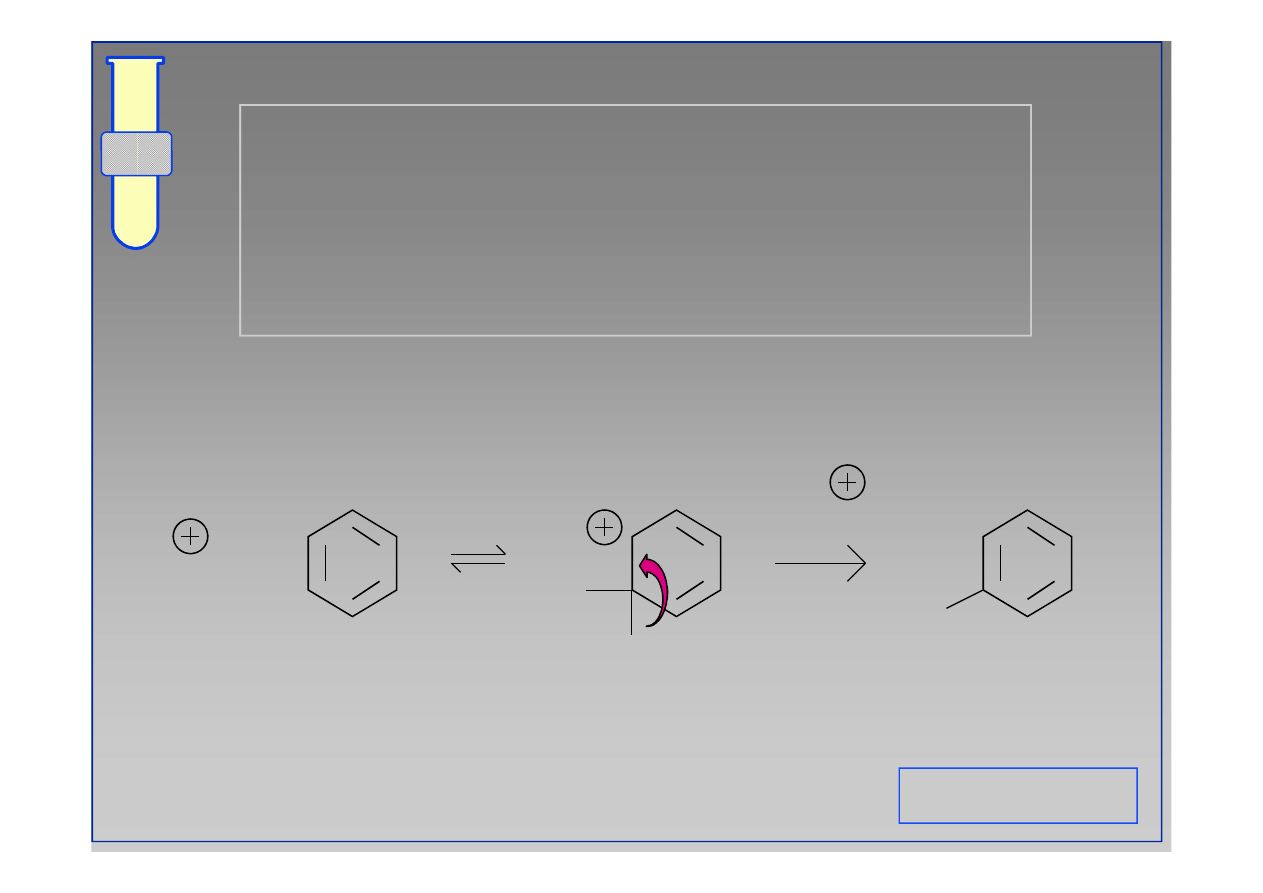
E
H
E
+
E
-H
‹#›
RJC
Aromatyczne
Aromatyczne
Addycje Elektrofilowe
Addycje Elektrofilowe
...do pierścienia aromatycznego przerywa
...do pierścienia aromatycznego przerywa
sprzężenie elektronów
sprzężenie elektronów
ππ
i powoduje utratę
i powoduje utratę
stabilizacji poprzez rezonans.
stabilizacji poprzez rezonans.
E
X
+
X
E
‹#›
RJC
Aromatyczna Substytucja Eltrofilowa
Aromatyczna Substytucja Eltrofilowa
...nie zakłóca aromatycznego charakteru cząsteczki
...nie zakłóca aromatycznego charakteru cząsteczki
(jej aromatyczności).
(jej aromatyczności).
E
+
E
-H
‹#›
RJC
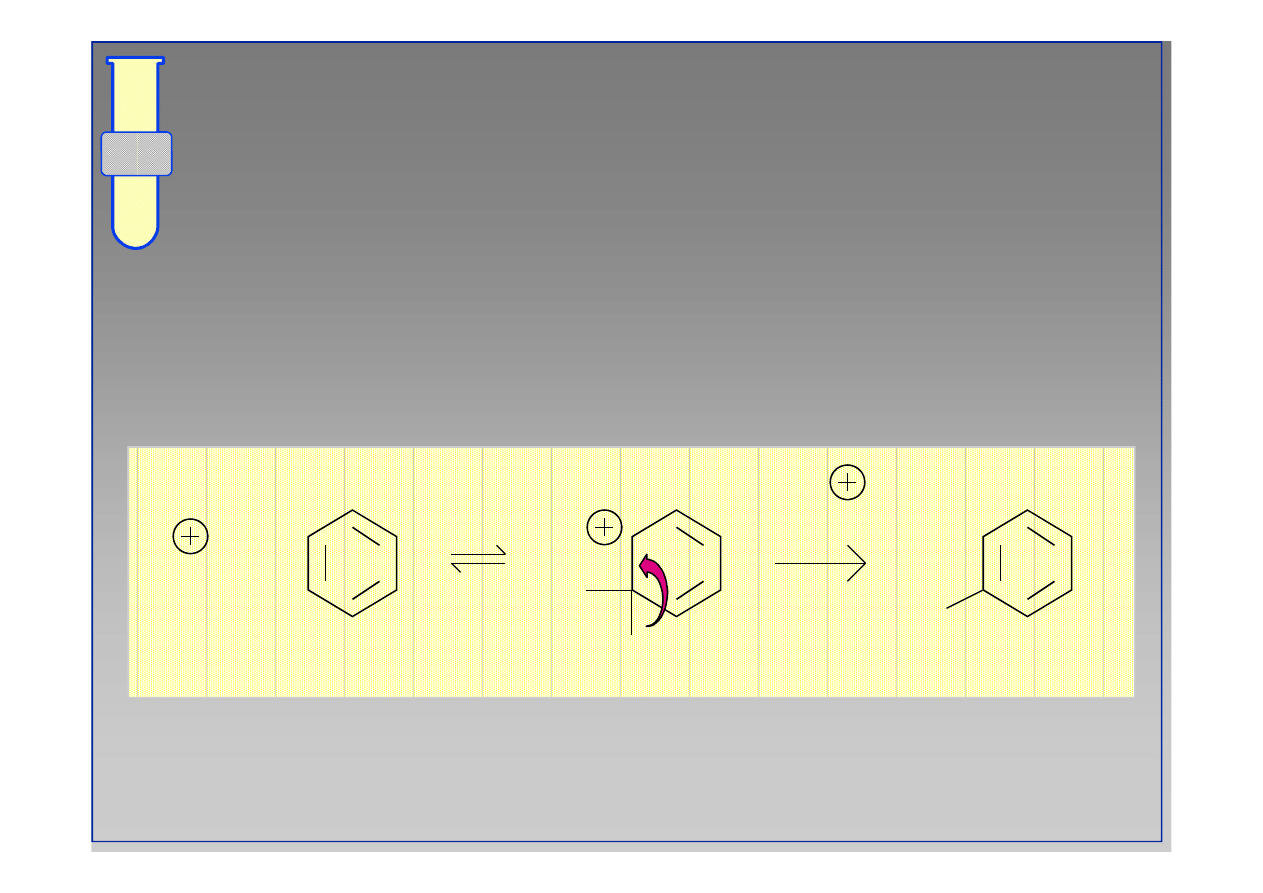
Mechanizm Substytucji Elektrofilowej
Mechanizm Substytucji Elektrofilowej
Addycja cząsteczki elektrofila (E
Addycja cząsteczki elektrofila (E
+
+
) prowadzi do
) prowadzi do
powstania karbokationu, który następnie eliminuje
powstania karbokationu, który następnie eliminuje
H
H
+
+
co powoduje, że główny pierścień odzyskuje
co powoduje, że główny pierścień odzyskuje
charakter aromatyczny.
charakter aromatyczny.
E
H
E
+
E
-H
‹#›
RJC
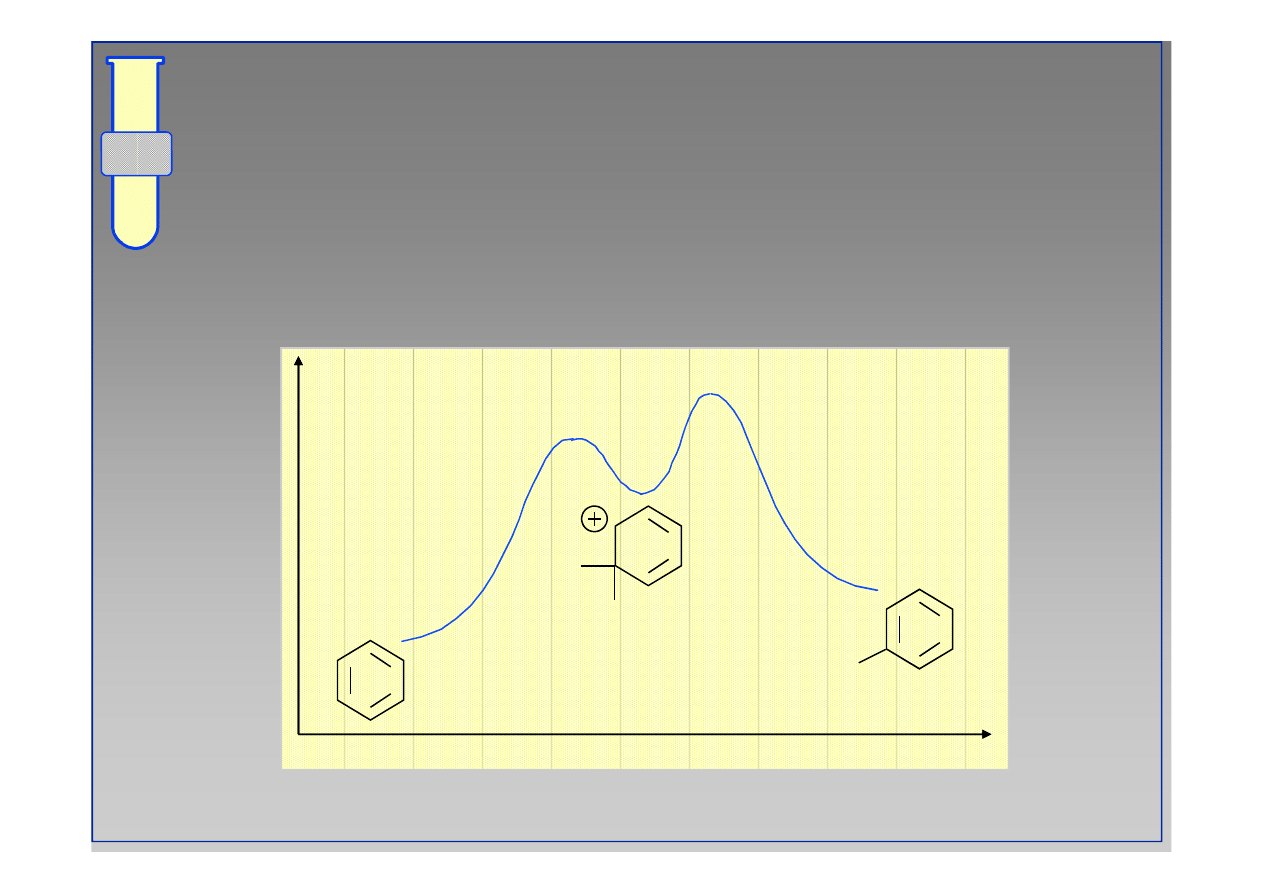
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Aromatyczna substytucja elektrofilowa jest
Aromatyczna substytucja elektrofilowa jest
procesem dwuetapowym; na profilu energii
procesem dwuetapowym; na profilu energii
występuje więc minimum.
występuje więc minimum.
Energia
Postęp reakcji
E
E
H
‹#›
RJC
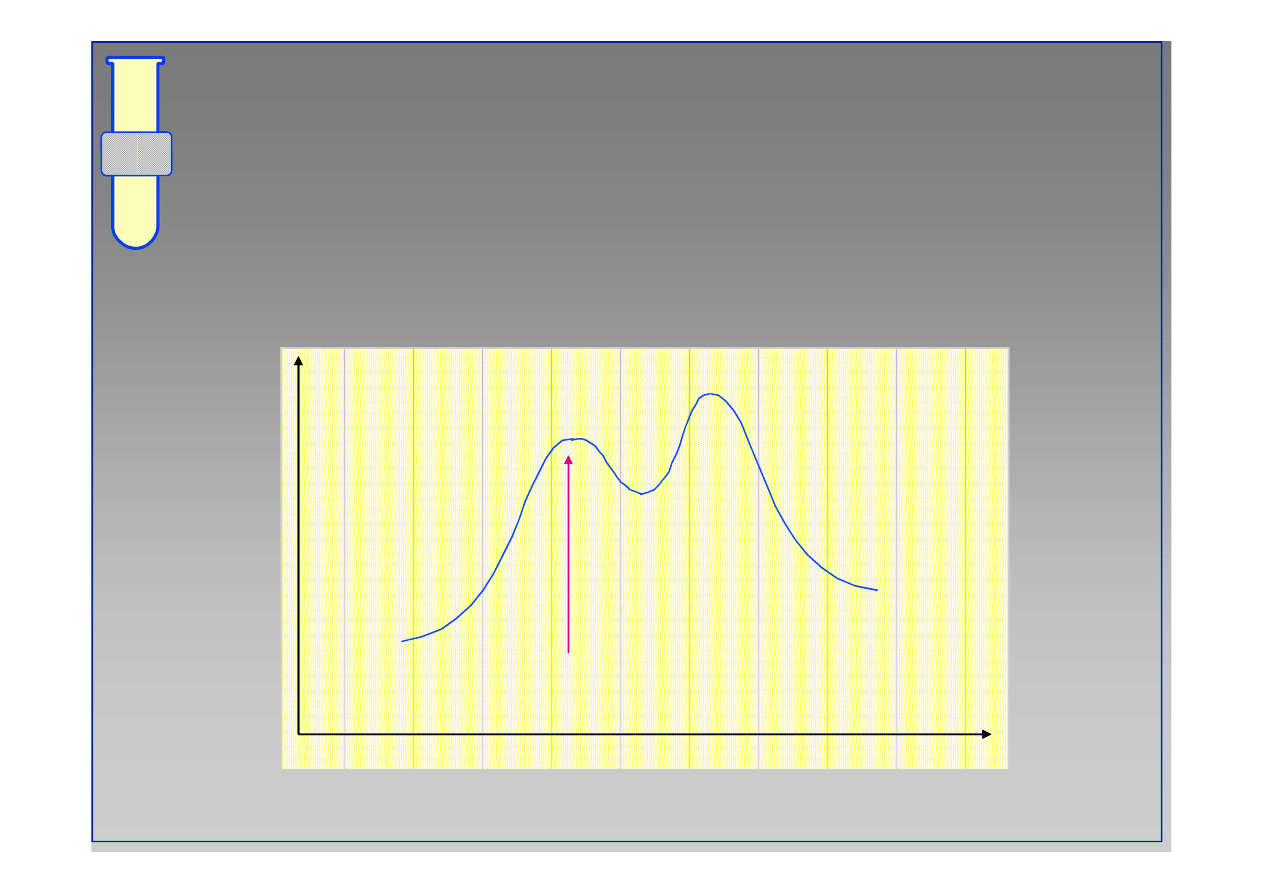
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Szybkość całej reakcji jest określona przez energię
Szybkość całej reakcji jest określona przez energię
swobodną
swobodną
∆∆
G
G
‡
‡
pierwszego etapu (first step).
pierwszego etapu (first step).
Energia
Postęp reakcji
∆
G
‡
‹#›
RJC
Odczynniki Elektrofilowe (Elektrofile)
Odczynniki Elektrofilowe (Elektrofile)
Pierścienie aromatyczne są mniej podatne na
Pierścienie aromatyczne są mniej podatne na
reakcje z elektrofilami niż alkeny i dlatego
reakcje z elektrofilami niż alkeny i dlatego
wymagana jest ‘aktywacja’ elektrofila.
wymagana jest ‘aktywacja’ elektrofila.
Br
CH
2
=CH
2
Br
2
Br
2
Br
CH
2
CH
2
Br
‹#›
RJC
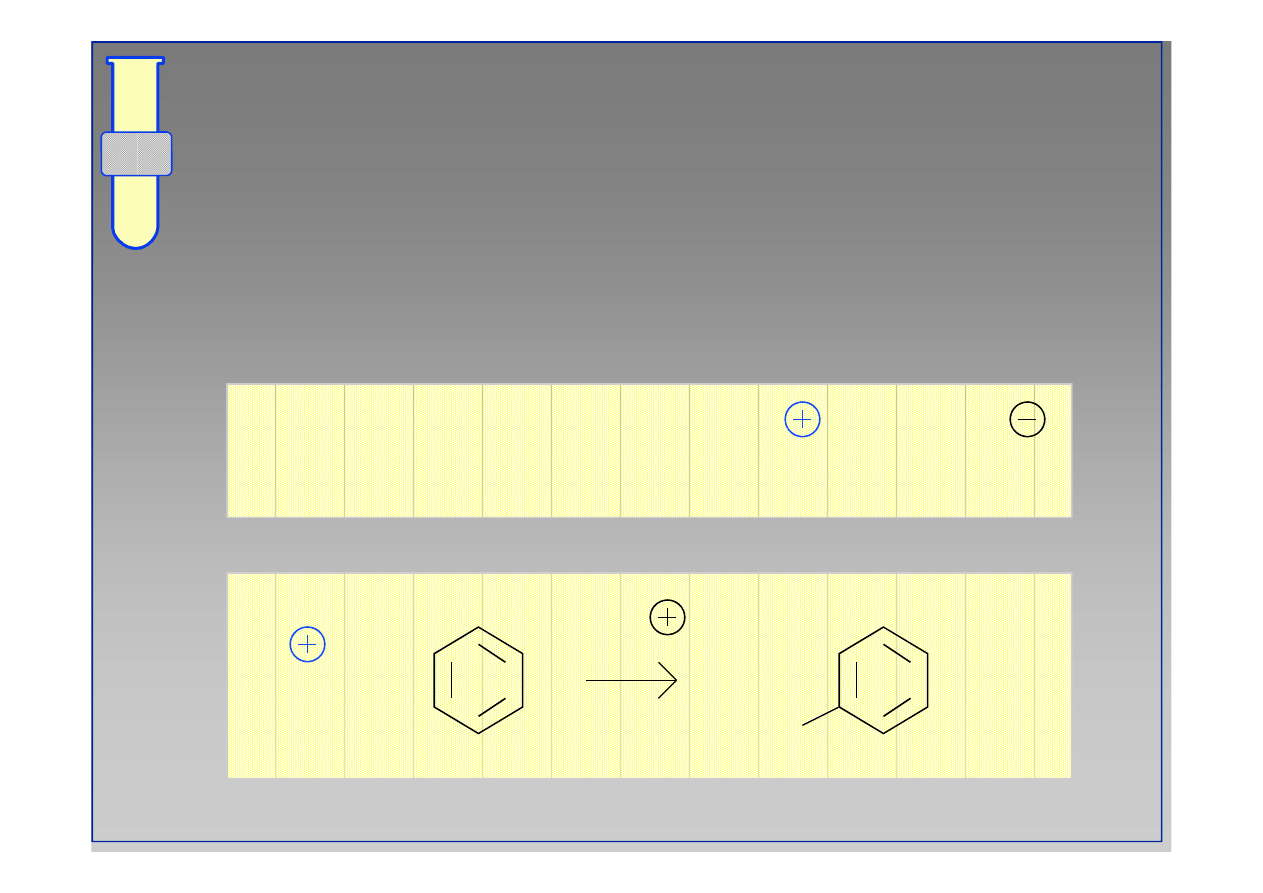
Słaby odczynnik elektrofilowy jakim jest brom Br
Słaby odczynnik elektrofilowy jakim jest brom Br
2
2
jest aktywowany przez kwas Lewisa, np. chlorek
jest aktywowany przez kwas Lewisa, np. chlorek
ż
elaza (III) FeBr
ż
elaza (III) FeBr
3
3
..
Br
+ FeBr
Br
+ (FeBr )
Bromowanie
Bromowanie
Br
2
+ FeBr
3
Br
+ (FeBr
4
)
Br
+
Br
-H
‹#›
RJC
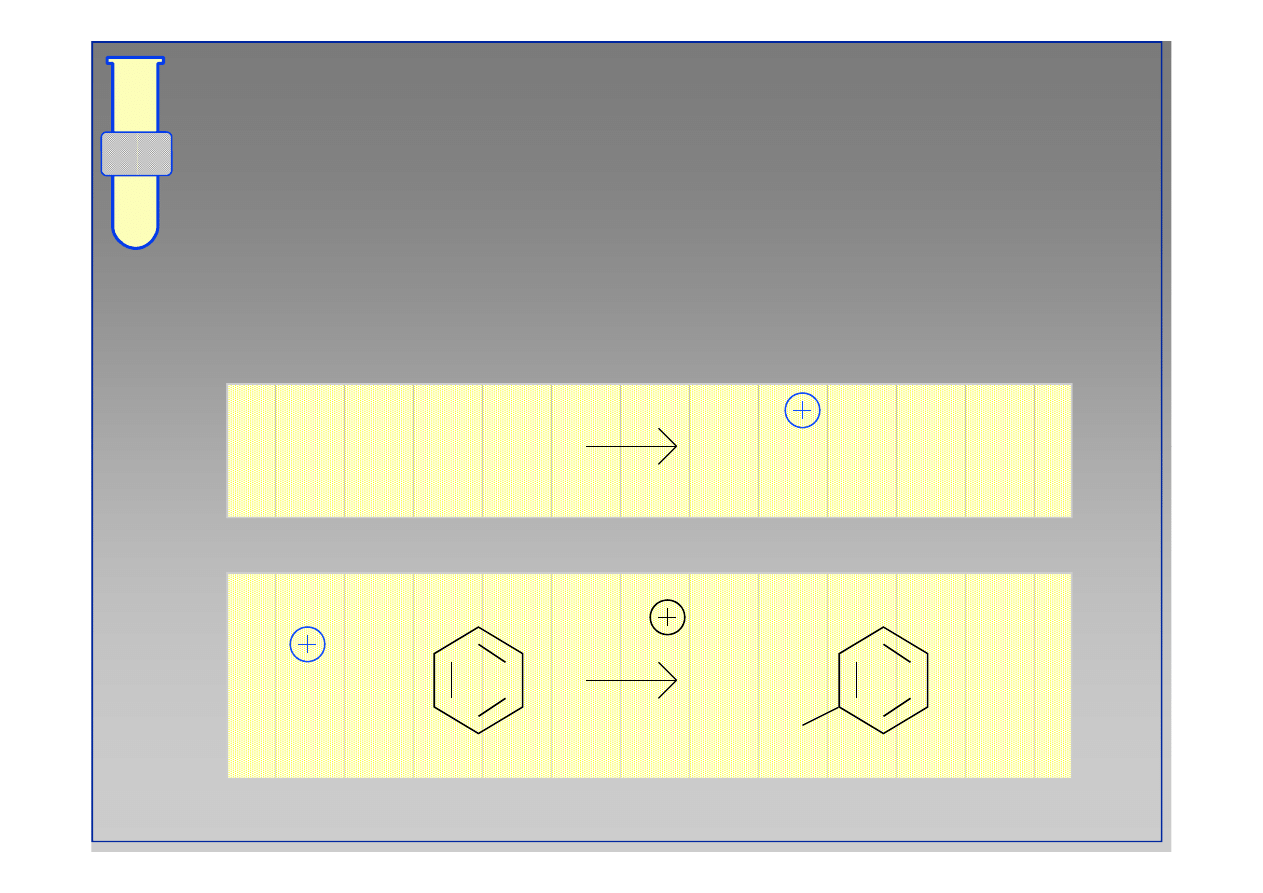
Chlorowanie
Chlorowanie
W podobny sposób następuje aktywacja
W podobny sposób następuje aktywacja
elektrofilowej cząsteczki chloru Cl
elektrofilowej cząsteczki chloru Cl
2
2
(dodatek
(dodatek
FeCl
FeCl
3
3
).
).
Cl
+ FeCl
→
Cl
+ (FeCl )
Cl
2
+ FeCl
3
→
Cl
+ (FeCl
4
)
Cl
+
Cl
-H
‹#›
RJC
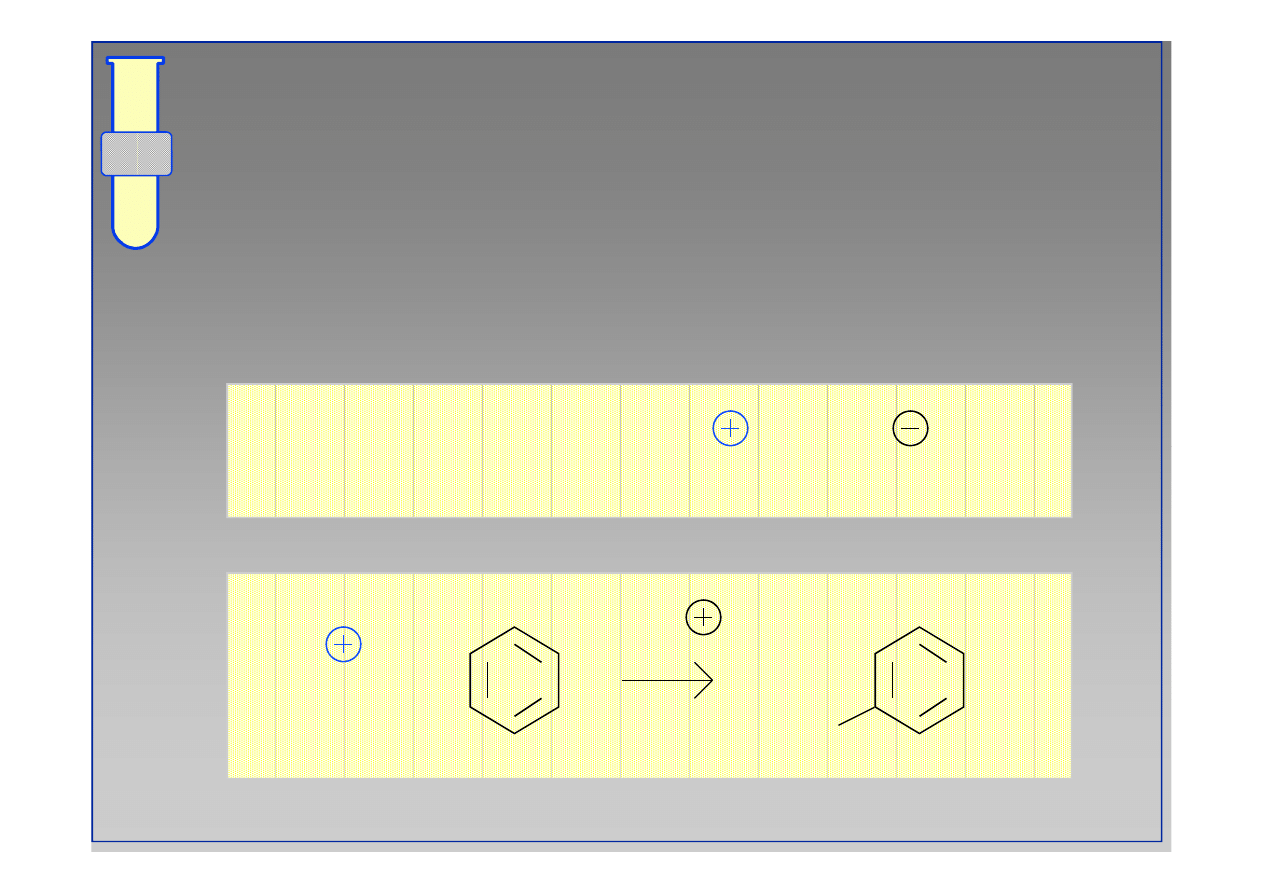
Jodowanie
Jodowanie
Bardzo słaby elektrofil, jakim jest cząsteczka jodu
Bardzo słaby elektrofil, jakim jest cząsteczka jodu
II
2
2
jest aktywowany przez dodatek soli Cu
jest aktywowany przez dodatek soli Cu
2+
2+
..
I
2
+ 2Cu
2+
2
I
+ 2Cu
+
I
2
+ 2Cu
2+
2
I
+ 2Cu
+
I
+
I
-H
‹#›
RJC
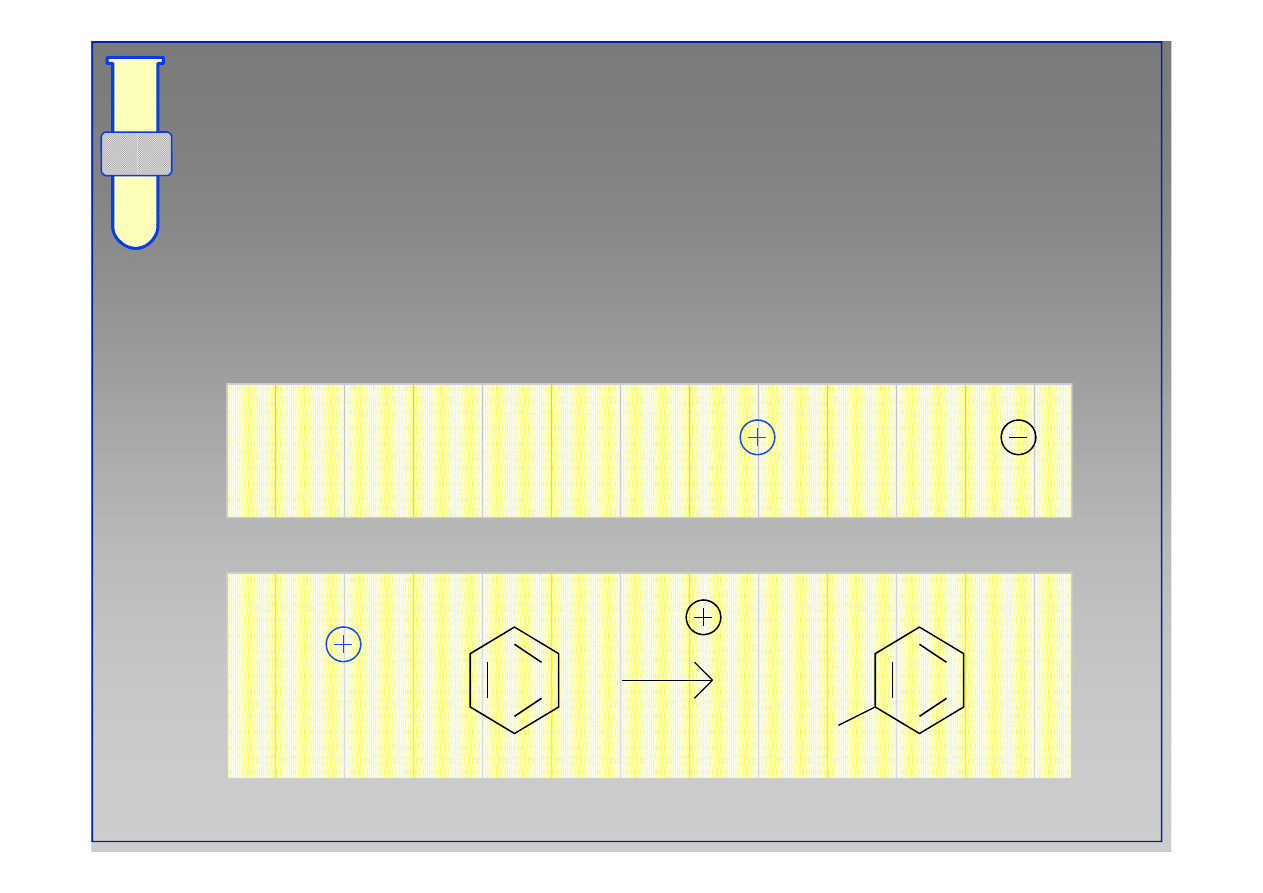
Nitrowanie
Nitrowanie
Kation nitroniowy NO
Kation nitroniowy NO
2
2
+
+
jest reaktywnym
jest reaktywnym
odczynnikiem elektrofilowym.
odczynnikiem elektrofilowym.
HNO + H SO
→
NO
+ HSO + H O
HNO
3
+ H
2
SO
4
→
NO
2
+ HSO
4
+ H
2
O
NO
2
+
NO
2
-H
‹#›
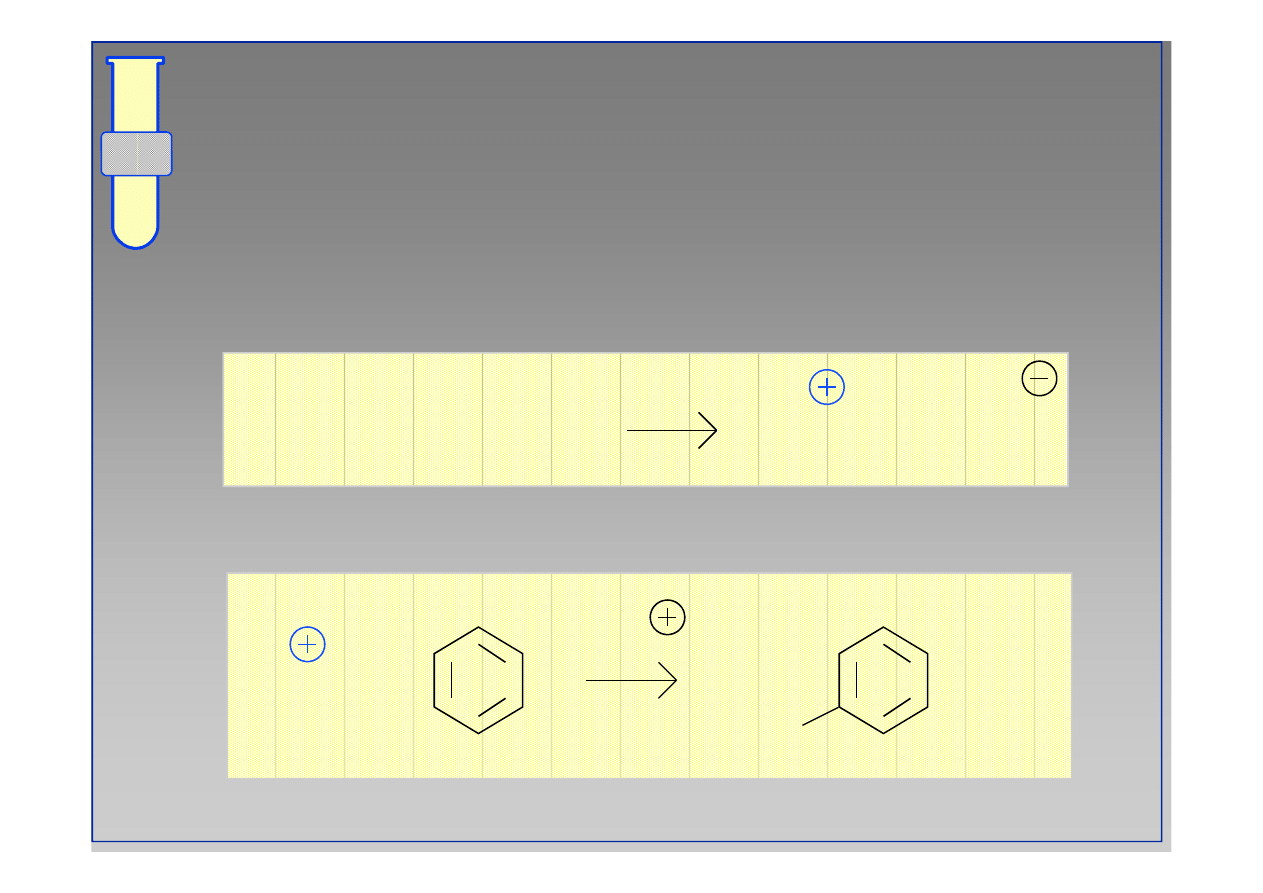
RJC
Sulfonowanie
Sulfonowanie
Dymiący kwas siarkowy (VI) jest źródłem
Dymiący kwas siarkowy (VI) jest źródłem
reaktywnego odczynnika (SO
reaktywnego odczynnika (SO
3
3
lub HSO
lub HSO
3
3
+
+
).
).
SO + H SO
→
HSO
+ HSO
HSO
3
+
+
HO
3
S
-H
SO
3
+ H
2
SO
4
→
HSO
3
+ HSO
4
‹#›
RJC
Alkilowanie Friedla
Alkilowanie Friedla--Craftsa
Craftsa
Aktywacja halogenków alkilowych przy użyciu chlorku
Aktywacja halogenków alkilowych przy użyciu chlorku
glinu AlCl
glinu AlCl
3
3
prowadzi do powstawania reaktywnego
prowadzi do powstawania reaktywnego
elektrofila w postaci karbokationu (R
elektrofila w postaci karbokationu (R
+
+
).
).
R-Cl + AlCl
3
R
+ (AlCl
4
)
R-Cl + AlCl
3
R
+ (AlCl
4
)
R
+
R
--H
H
‹#›
RJC
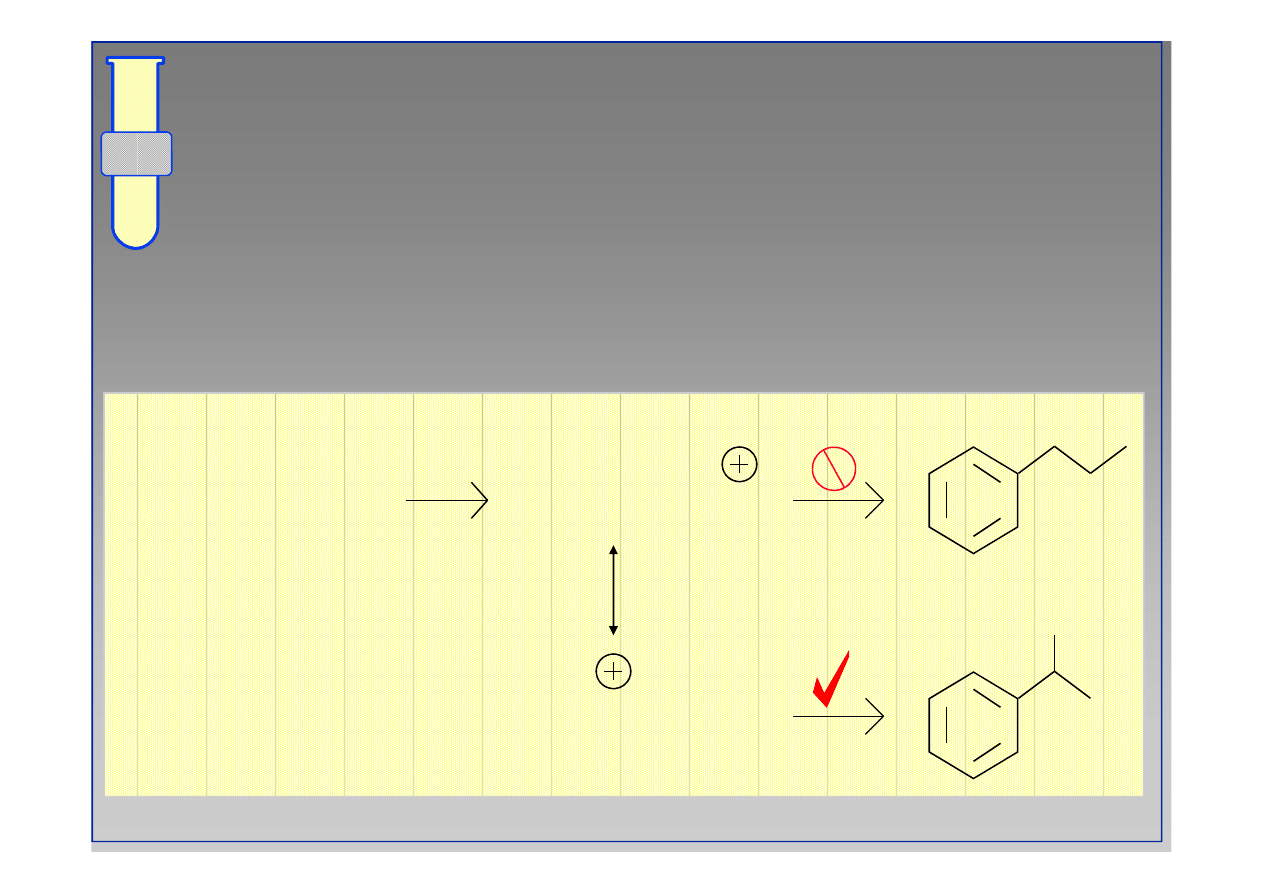
Ograniczenia i utrudnienia w reakcji alkilowania;
Ograniczenia i utrudnienia w reakcji alkilowania;
Nie nadają się halogenki arylowe oraz
allilowe.
Ograniczenia w Reakcji Alkilowania
Ograniczenia w Reakcji Alkilowania
Metodą Friedla
Metodą Friedla--Craftsa
Craftsa
allilowe.
Polialkilowanie
Przegrupowania karbokationów
‹#›
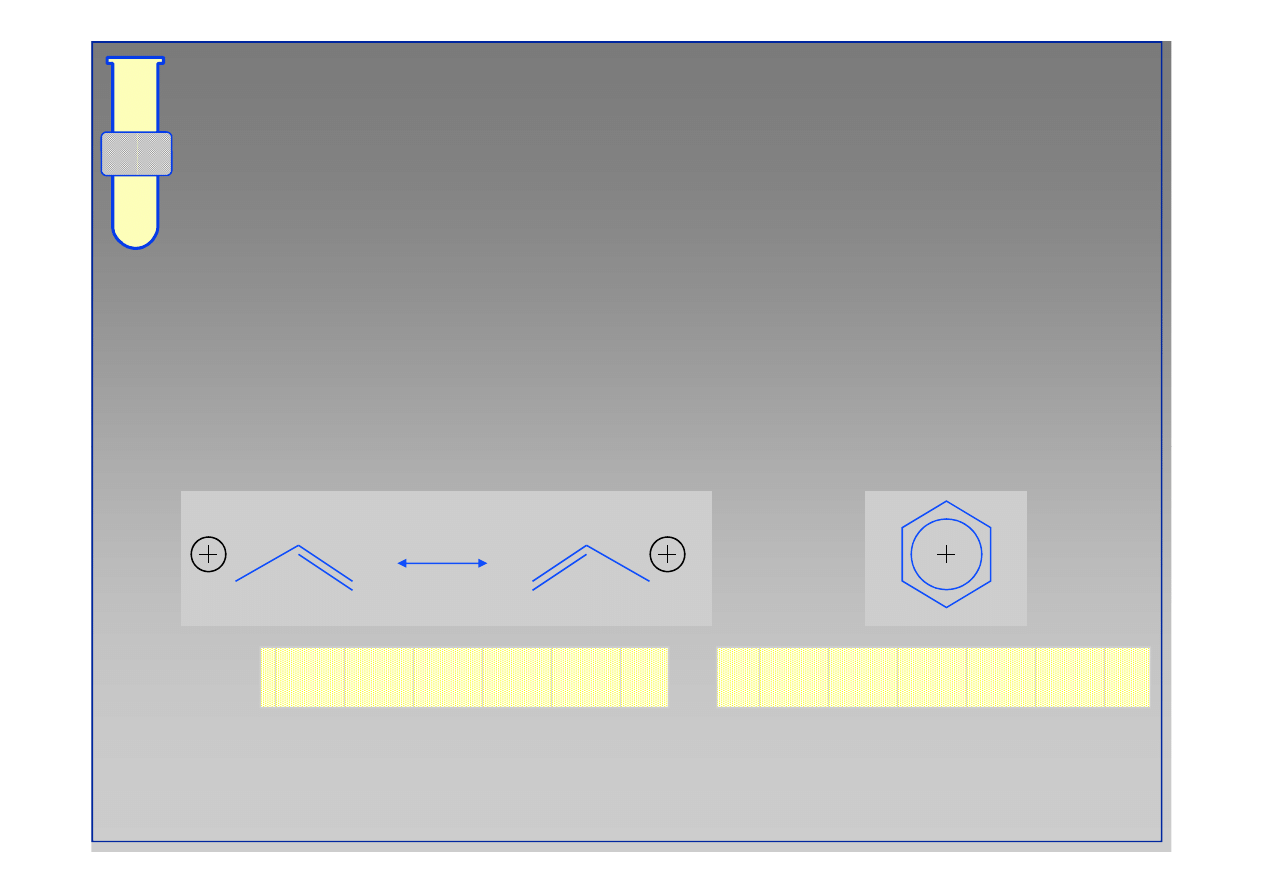
RJC
Halogenki Allilowe oraz Arylowe
Halogenki Allilowe oraz Arylowe
...karbokationy pochodzące od halogenków
...karbokationy pochodzące od halogenków
arylowych oraz allilowych są stabilizowane
arylowych oraz allilowych są stabilizowane
rezonansem elektronowym i dlatego są b. mało
rezonansem elektronowym i dlatego są b. mało
reaktywnymi elektrofilami.
reaktywnymi elektrofilami.
reaktywnymi elektrofilami.
reaktywnymi elektrofilami.
karbokation allilowy
karbokation arylowy
‹#›
RJC
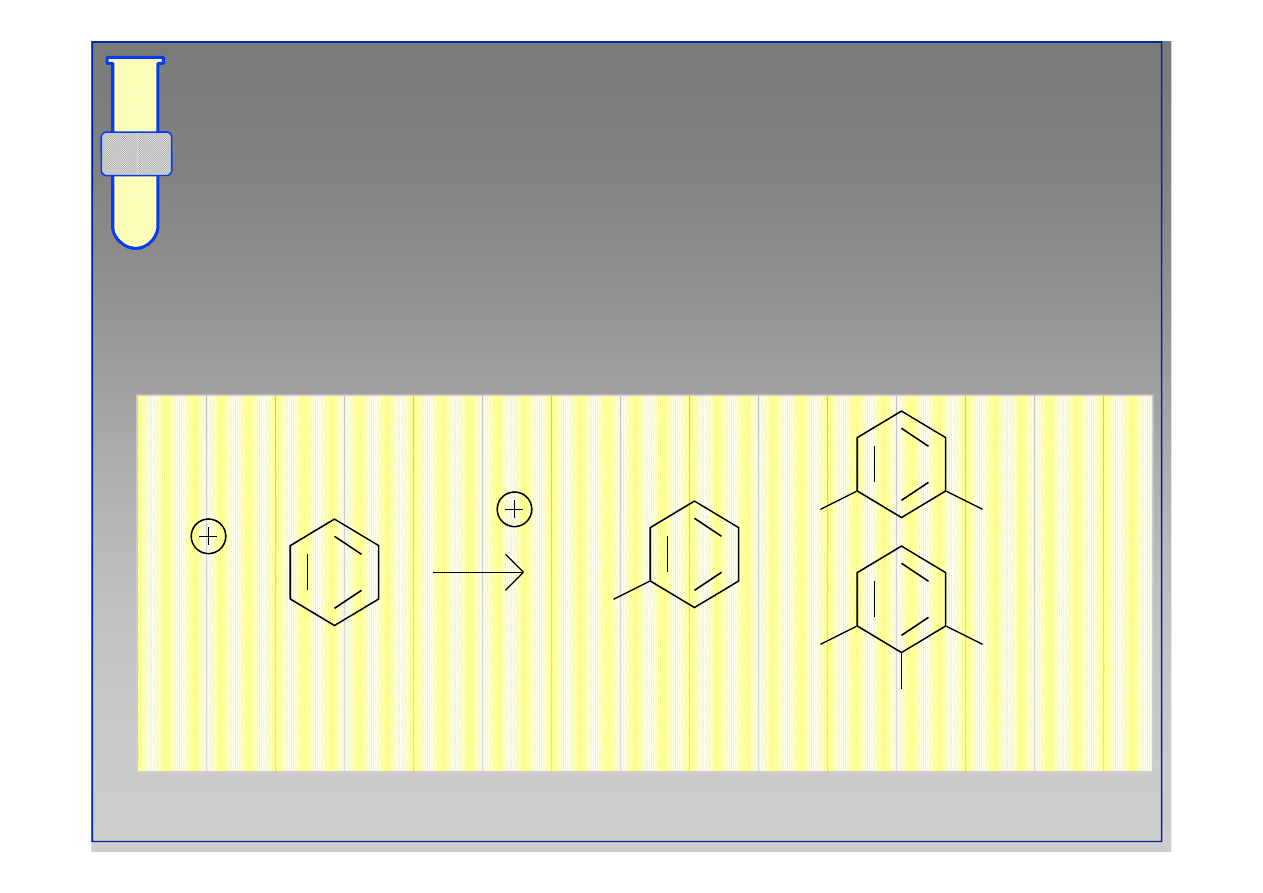
Polialkilowania
Polialkilowania
W reakcjach Friedla
W reakcjach Friedla--Craftsa możliwe są poli
Craftsa możliwe są poli--
alkilowania, ponieważ powstający produkt jest
alkilowania, ponieważ powstający produkt jest
bardziej reaktywny od niepodstawionego
bardziej reaktywny od niepodstawionego
substratu.
substratu.
R
+
-H
R
etc...
etc...
R
R
R
R
R
‹#›
RJC
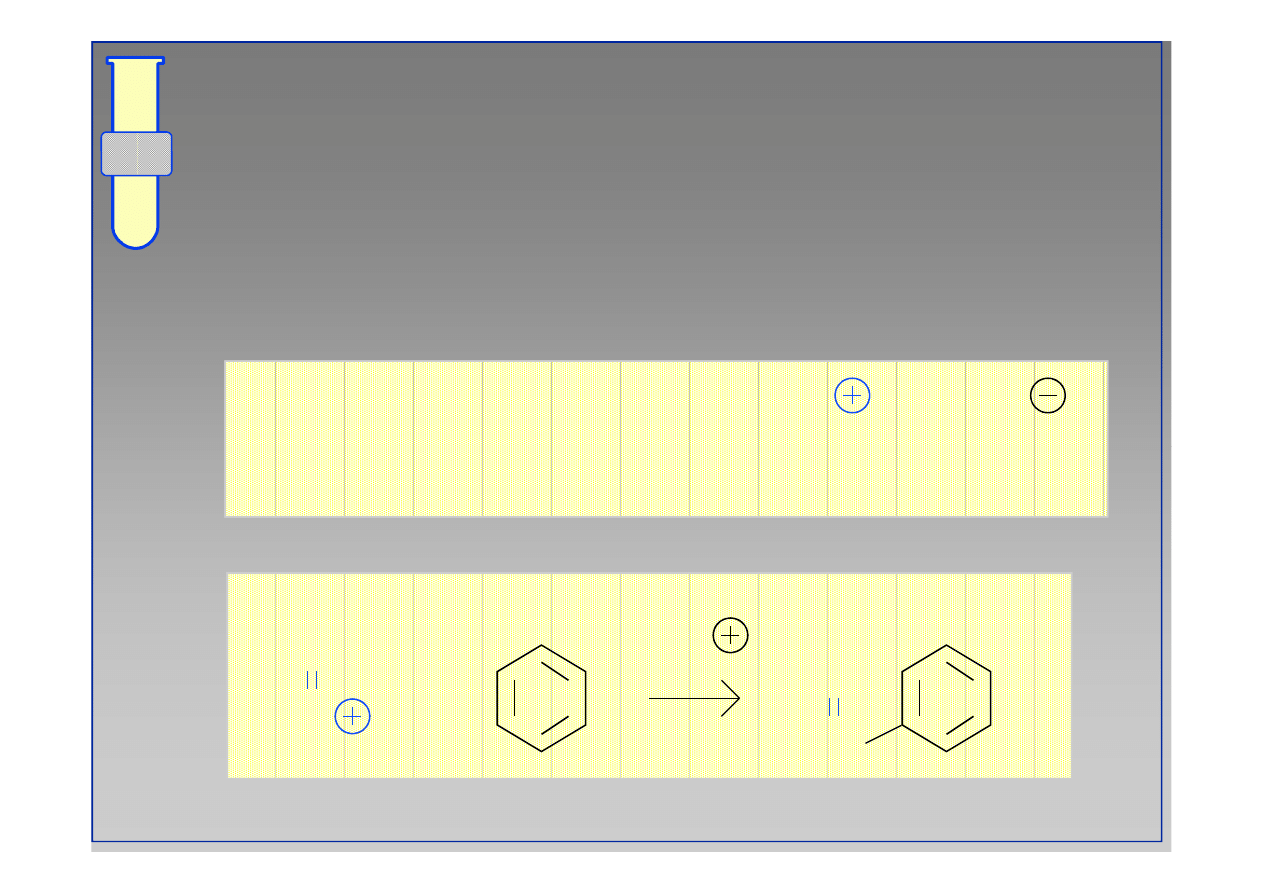
Przegrupowania Karbokationów
Przegrupowania Karbokationów
Pierwszorzędowy karbokation ulega
Pierwszorzędowy karbokation ulega
przegrupowaniu do innego karbokationu o wyższej
przegrupowaniu do innego karbokationu o wyższej
rzędowości (migracja protonu).
rzędowości (migracja protonu).
CH
3
CH
2
CH
2
Cl
CH
3
CH
2
CH
2
CH
3
CHCH
3
‹#›
RJC
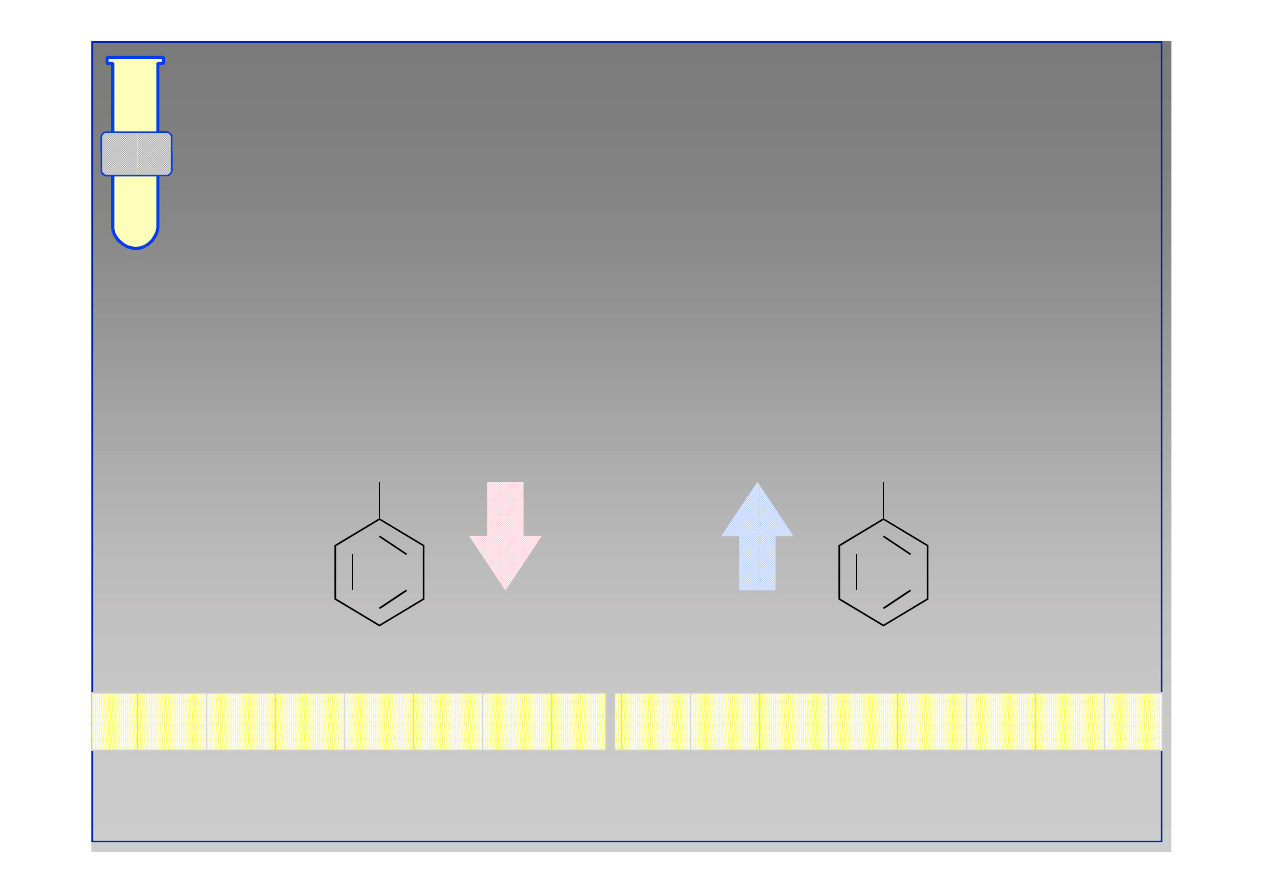
Acylowanie Friedla
Acylowanie Friedla--Craftsa
Craftsa
Aktywacja chlorku kwasowego przy użyciu AlCl
Aktywacja chlorku kwasowego przy użyciu AlCl
3
3
prowadzi do powstawania jonu acyliowego, który
prowadzi do powstawania jonu acyliowego, który
jest aktywnym elektrofilem.
jest aktywnym elektrofilem.
RCOCl + AlCl
3
→
RCO
+ (AlCl
4
)
RCOCl + AlCl
3
→
RCO
+ (AlCl
4
)
RC
RC
--H
H
O
O
+
+
‹#›
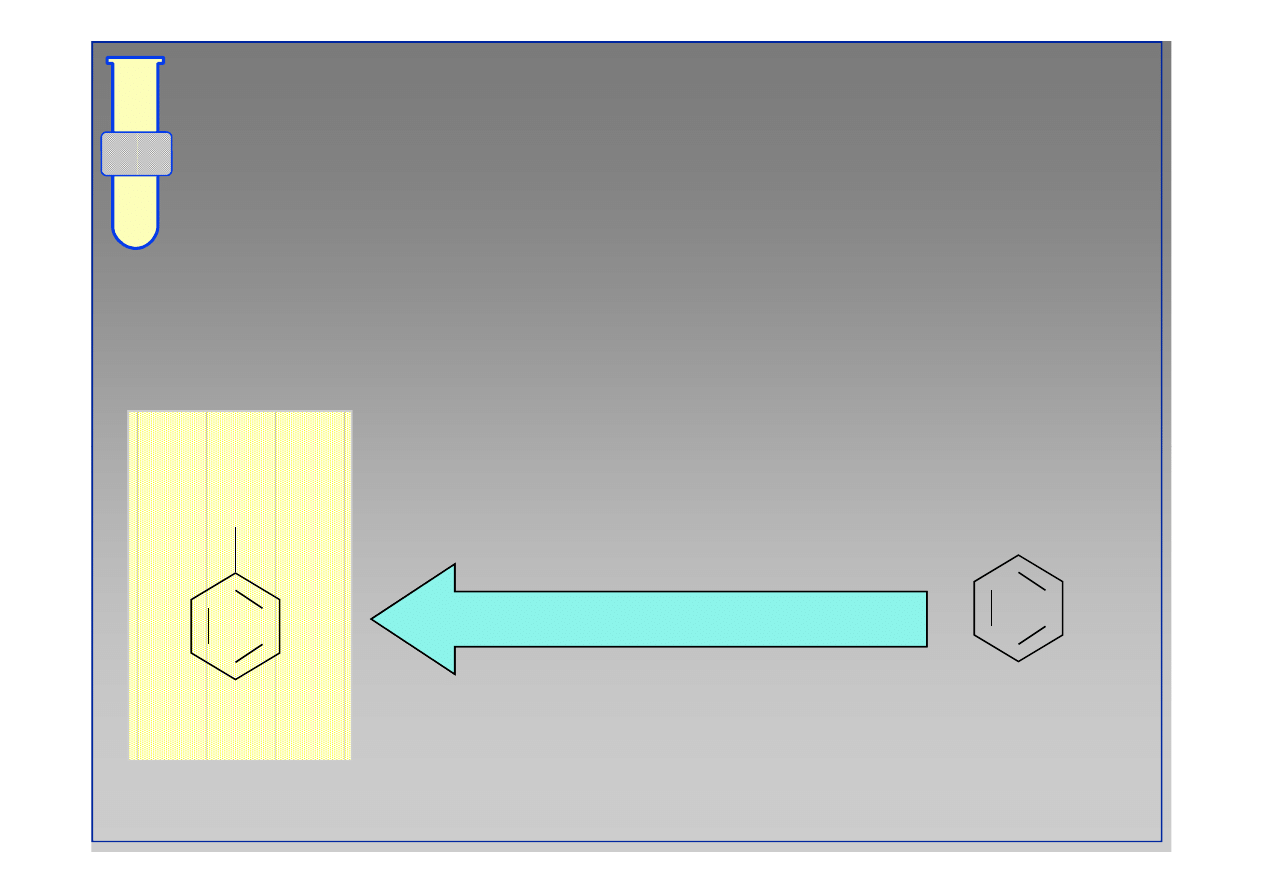
RJC
Wpływ Podstawników na Aromatyczne
Wpływ Podstawników na Aromatyczne
Substytucje Elektrofilowe
Substytucje Elektrofilowe
Podstawniki obecne w pierścieniu aromatycznym
Podstawniki obecne w pierścieniu aromatycznym
działają jako grupy elektrono
działają jako grupy elektrono--donorowe lub
donorowe lub
elektrono
elektrono--akceptorowe.
akceptorowe.
G
G
G
G
G
G
G
G
wpływ elektrono-donorowy
wpływ elektrono-akceptorowy
‹#›
RJC
Podstawniki (Grupy) Elektrono
Podstawniki (Grupy) Elektrono--Donorowe
Donorowe
Zwiększają gęstość elektronową, czyli aktywują
Zwiększają gęstość elektronową, czyli aktywują
pierścień aromatyczny
pierścień aromatyczny
δ
+
G
δ
+
δ
-
δ
-
δ
-
wzrost gęstości elektronowej
‹#›
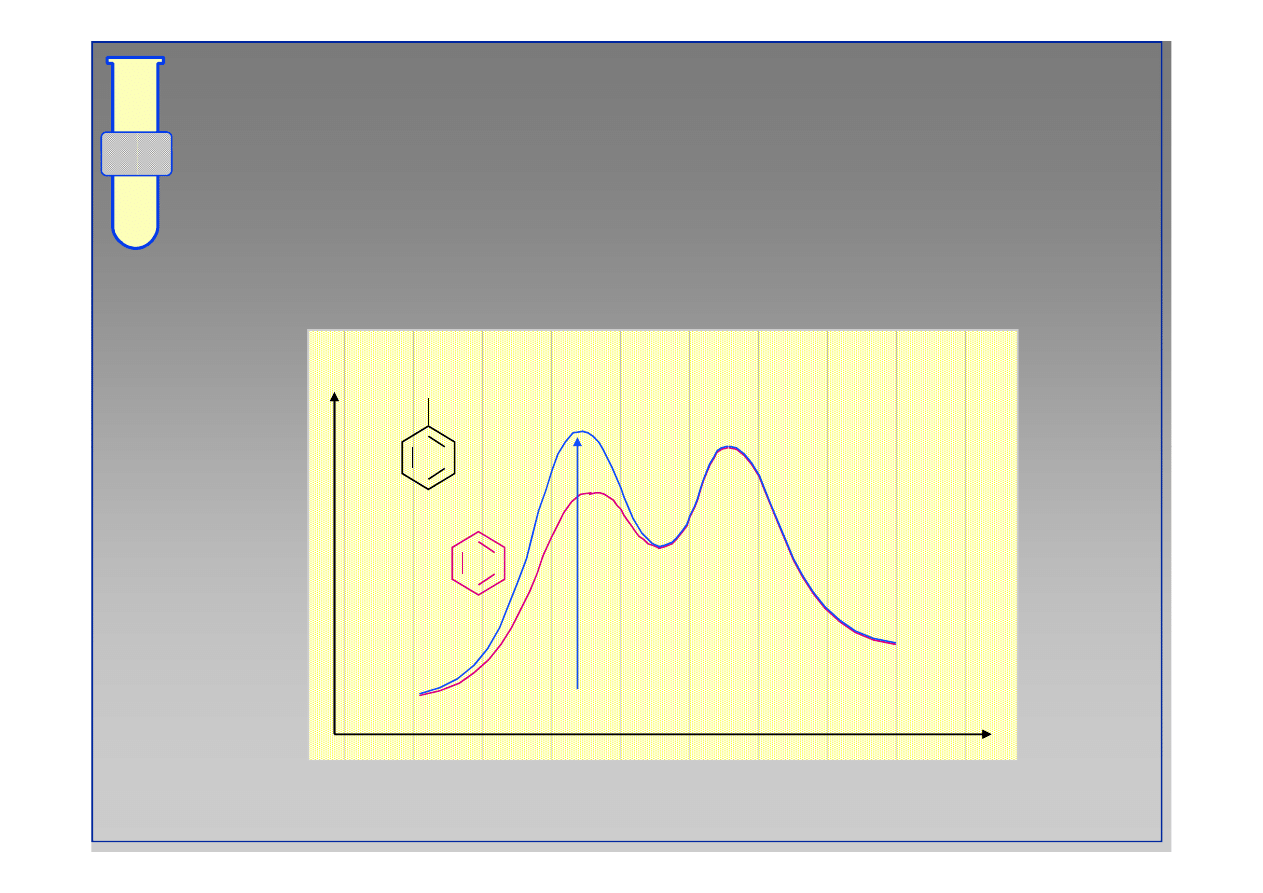
RJC
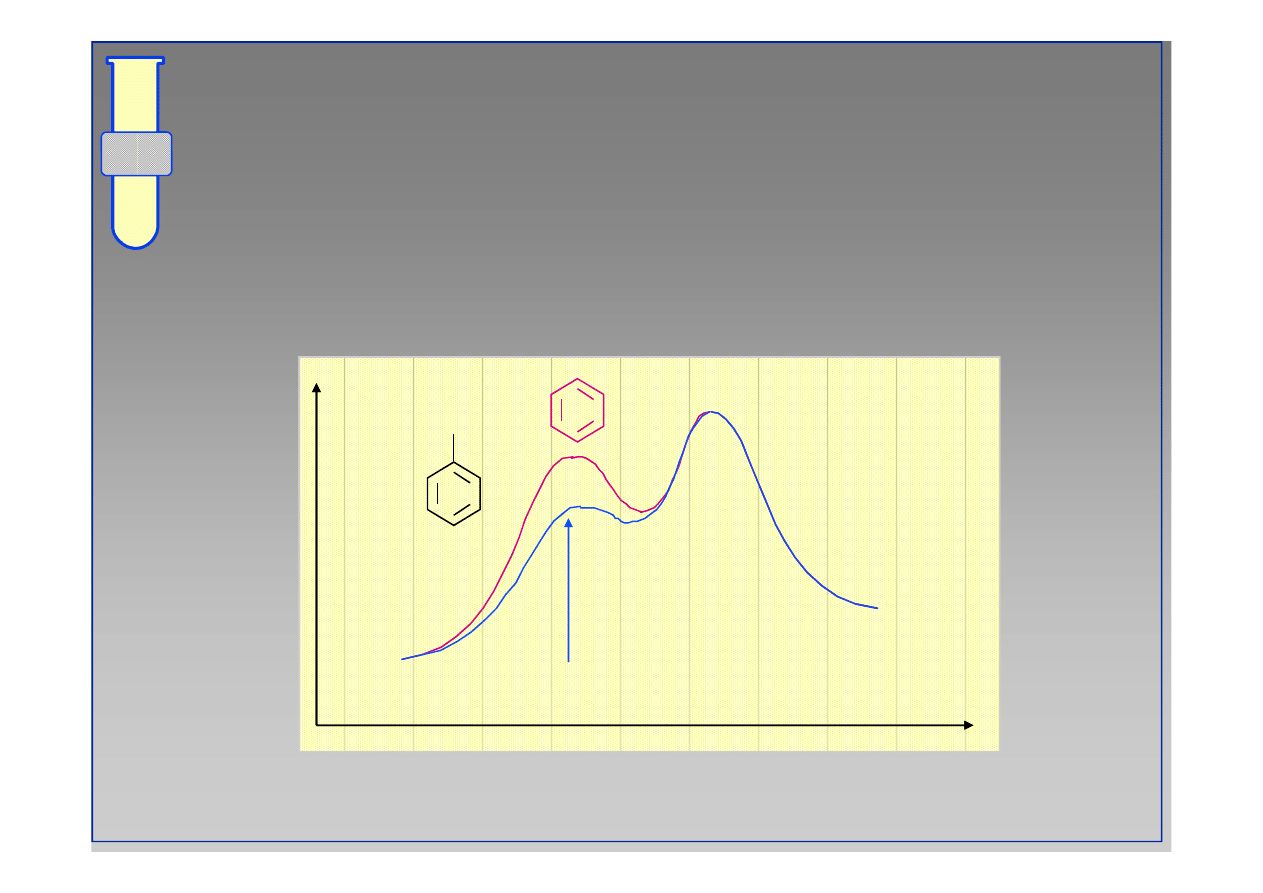
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Obniżenie wartości
Obniżenie wartości
∆∆
G
G
‡
‡
oznacza wzrost szybkości
oznacza wzrost szybkości
reakcji.
reakcji.
G
δ
+
-
-
energia
postęp reakcji
δ
-
δ
-
δ
-
∆
G
‡
‹#›
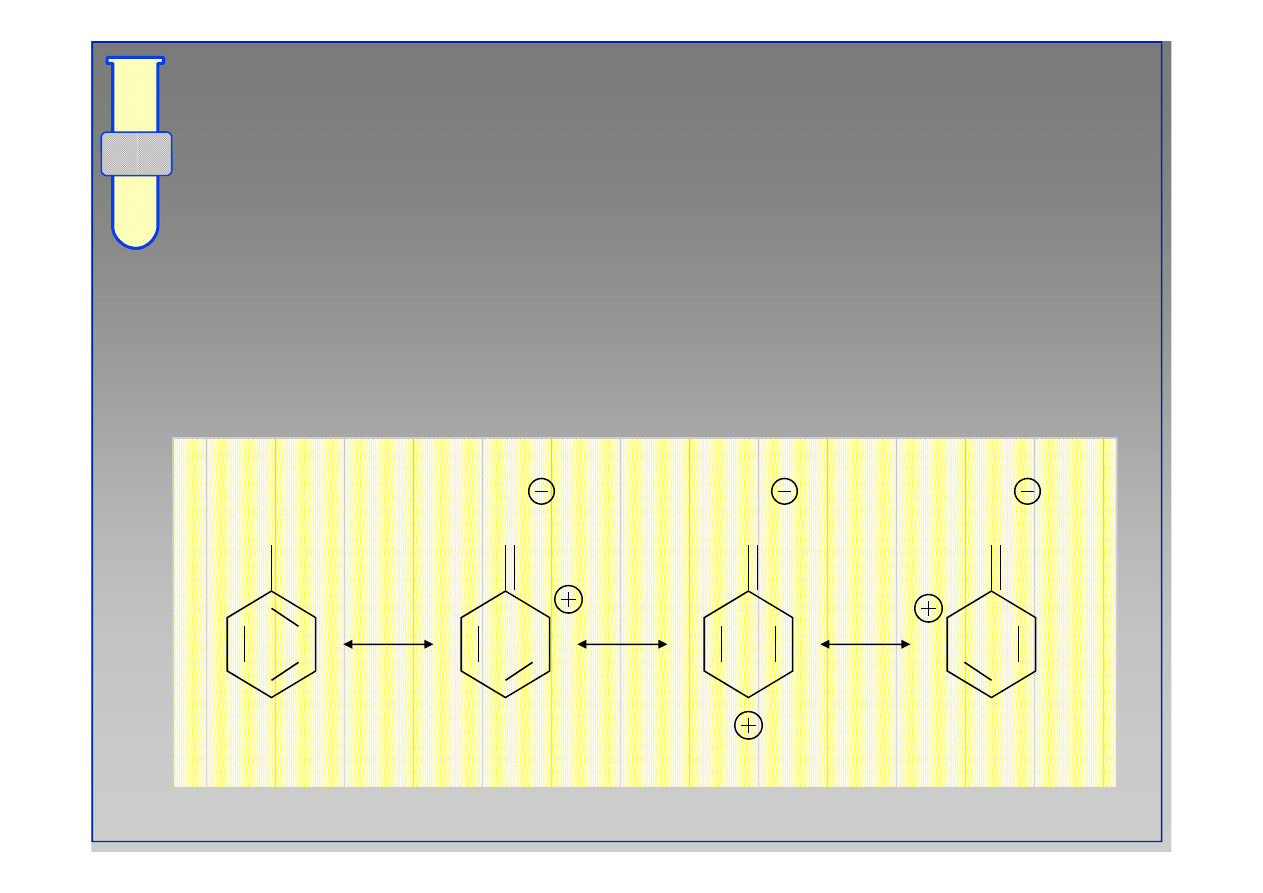
RJC
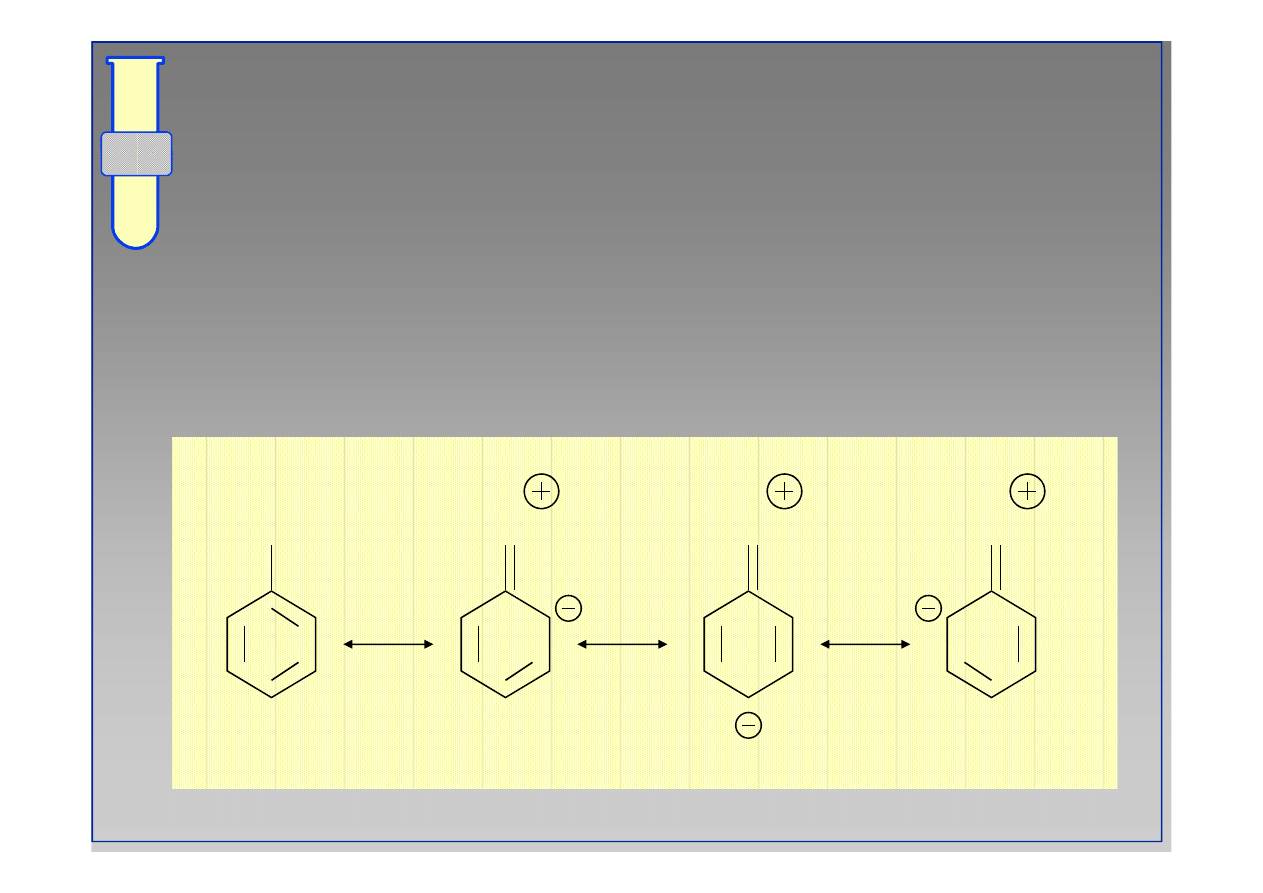
Struktury Rezonansowe
Struktury Rezonansowe
... ilustrują fakt delokalizacji zwiększonej gęstości
... ilustrują fakt delokalizacji zwiększonej gęstości
elektronowej w obrębie pierścienia
elektronowej w obrębie pierścienia
aromatycznego.
aromatycznego.
G
G
G
G
‹#›
RJC
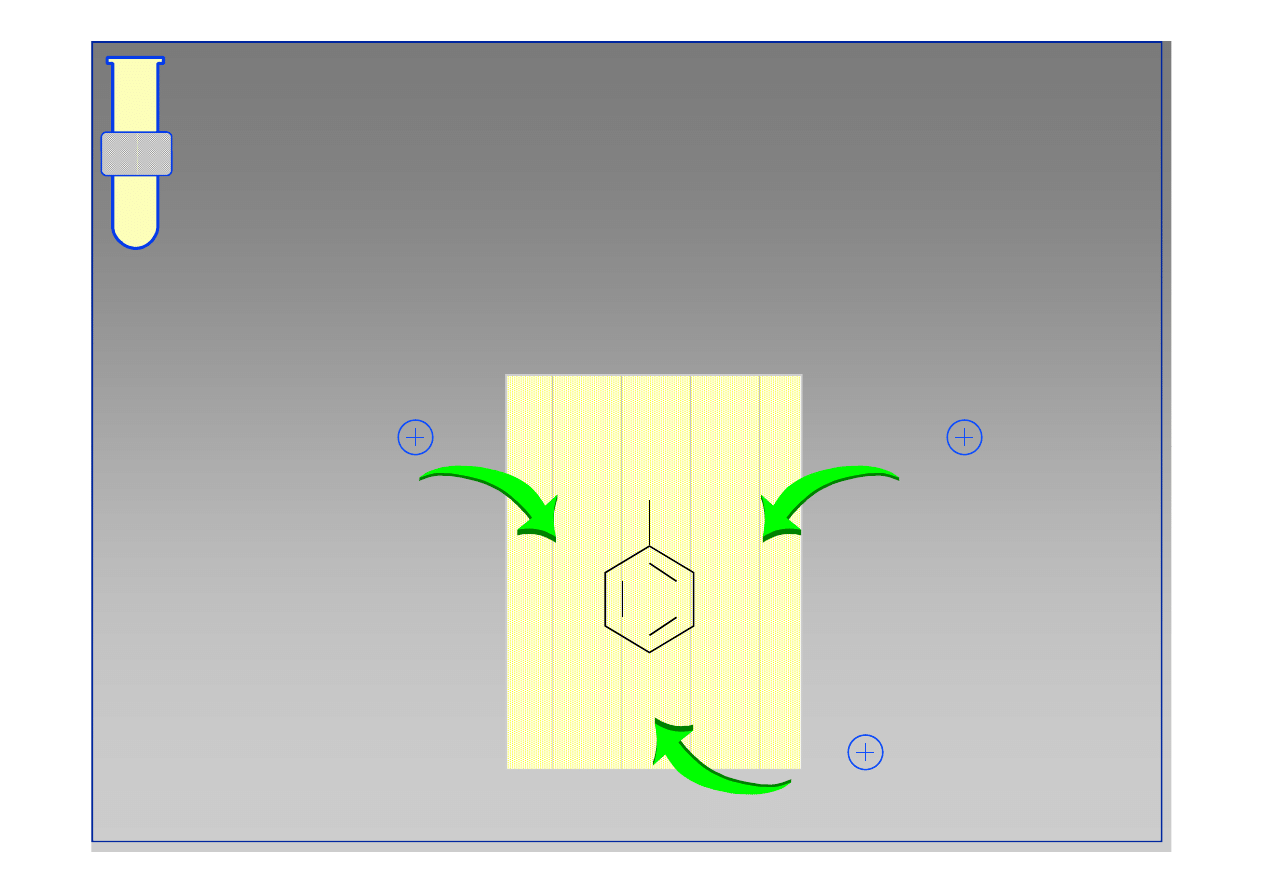
Wpływ Kierujący Orto & Para
Wpływ Kierujący Orto & Para
Zwiększona gęstość elektronowa w pozycjach orto
Zwiększona gęstość elektronowa w pozycjach orto
i para wpływa na dominujący kierunek substytucji.
i para wpływa na dominujący kierunek substytucji.
δ
+
E
E
G
δ
δ
-
δ
-
δ
-
E
E
E
‹#›
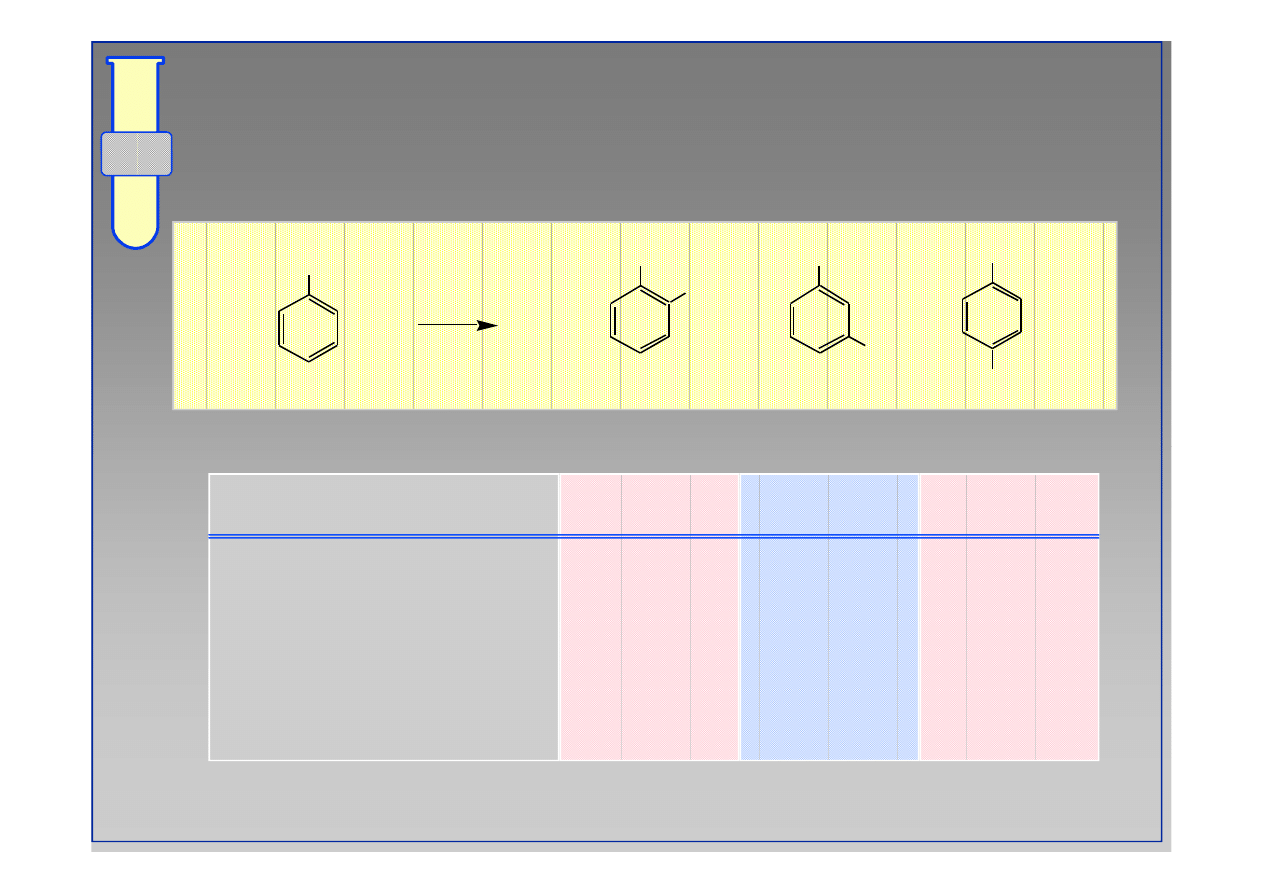
RJC
Podstawniki Aktywujące i Kierujące w
Podstawniki Aktywujące i Kierujące w
Pozycje orto & para
Pozycje orto & para
anilina
fenol
metoksybenzen (anizol)
toluen (metylobenzen)
‹#›
RJC
Dystrybucja Produktów Nitowania Benzenu
Dystrybucja Produktów Nitowania Benzenu
G
H
NO
3
/H
2
SO
4
G
G
G
NO
2
NO
2
NO
2
Podstawnik (G)
Orto
Meta
Para
CH
3
63
3
34
OH
50
0
50
NHAc(NHCOMe)
19
2
79
‹#›
RJC
Podstawniki Elektrono
Podstawniki Elektrono--Akceptorowe
Akceptorowe
Powodują obniżenie gęstości elektronowej, czyli
Powodują obniżenie gęstości elektronowej, czyli
dezaktywację pierścienia aromatycznego.
dezaktywację pierścienia aromatycznego.
δ
-
obniżenie gęstości elektronowej
G
δ
-
δ
+
δ
+
δ
+
‹#›
RJC
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Wzrost wartości
Wzrost wartości
∆∆
G
G
‡
‡
oznacza zmniejszenie
oznacza zmniejszenie
szybkości reakcji.
szybkości reakcji.
G
δ
+
δ
-
δ
+
energia
postęp reakcji
∆
G
‡
δ
δ
δ
+
‹#›
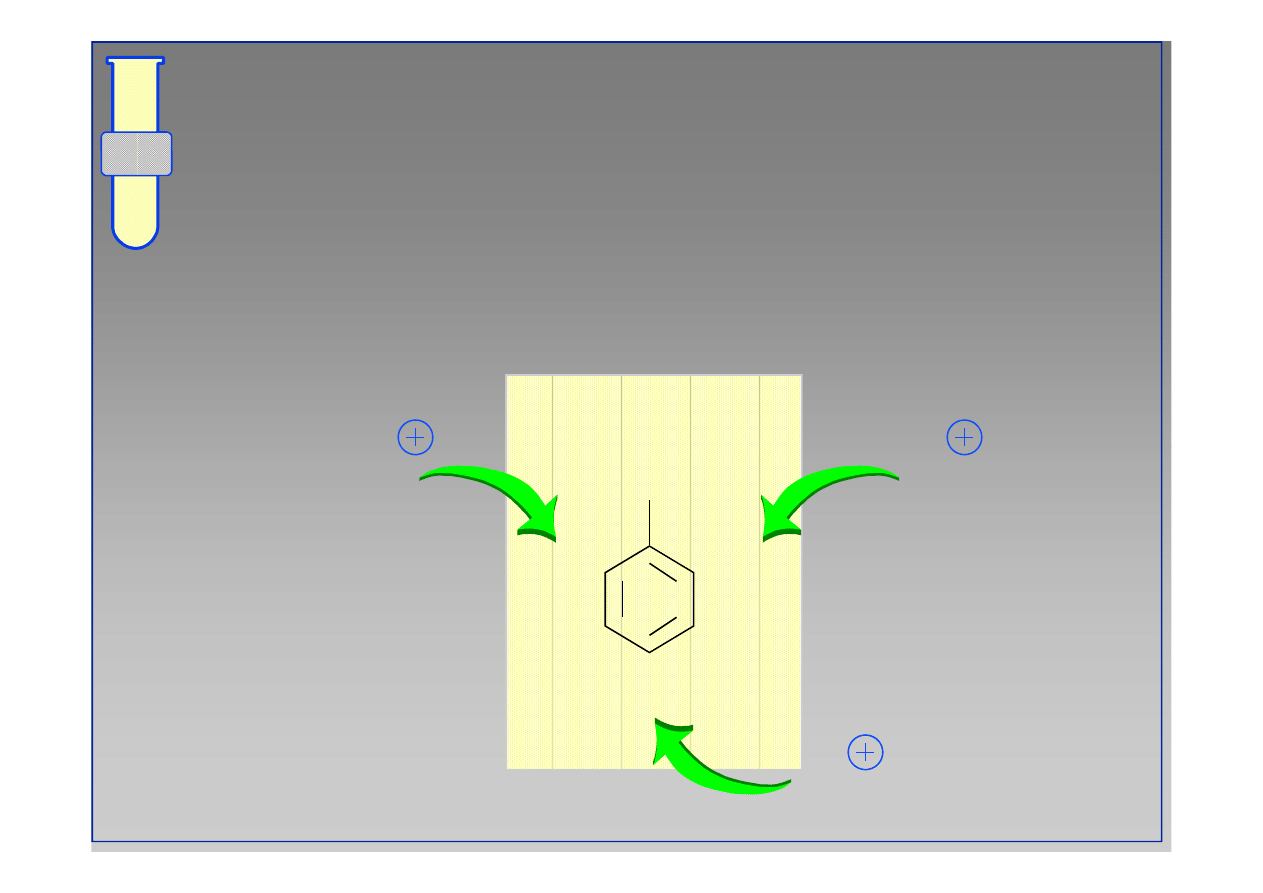
RJC
Struktury Rezonansowe
Struktury Rezonansowe
...ilustrują delokalizację obniżonej gęstości
...ilustrują delokalizację obniżonej gęstości
elektronowej w pierścieniu aromatycznym.
elektronowej w pierścieniu aromatycznym.
G
G
G
G
‹#›
RJC
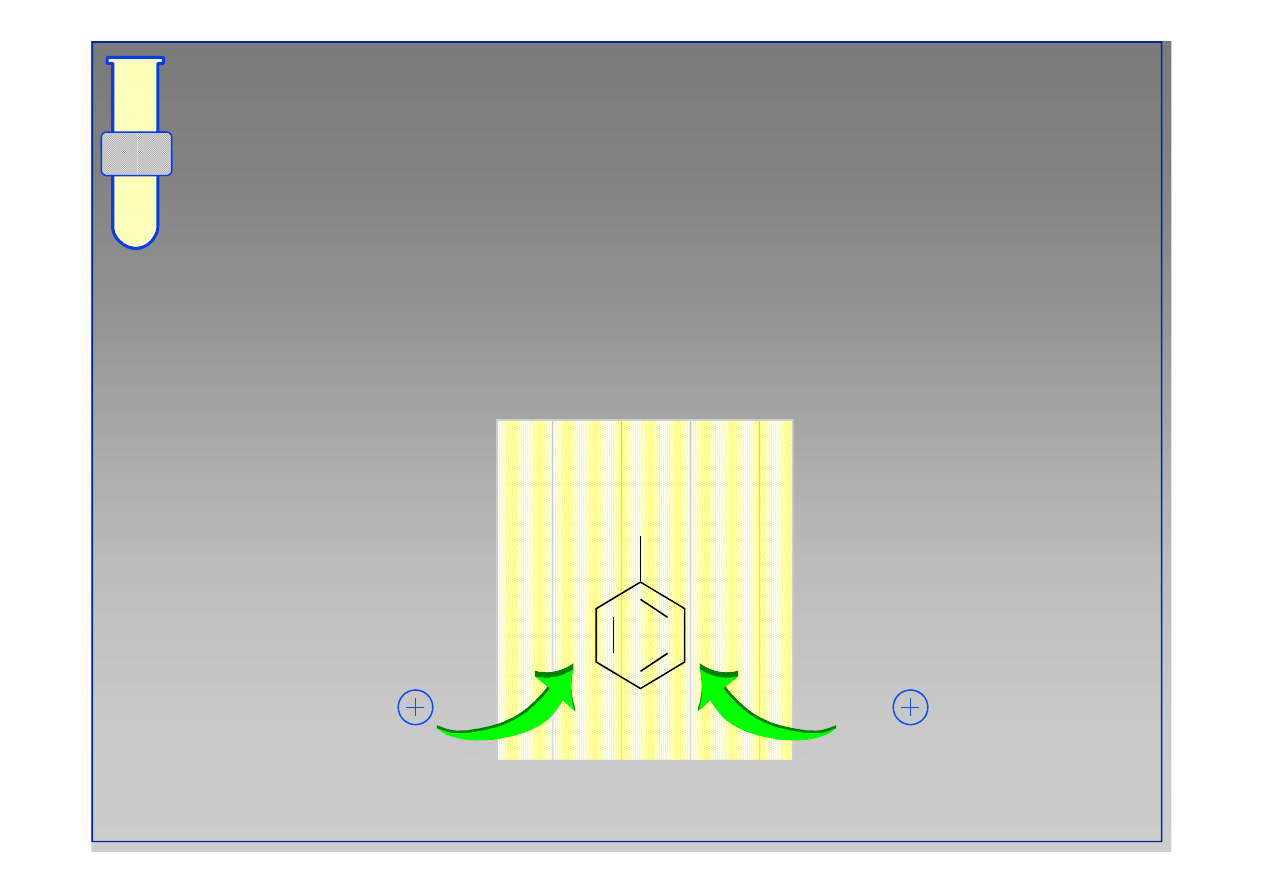
Wpływ Kierujący Meta
Wpływ Kierujący Meta
Obniżenie gęstości elektronowej w pozycjach orto
Obniżenie gęstości elektronowej w pozycjach orto
i para powoduje, że podstawienie elektrofilowe
i para powoduje, że podstawienie elektrofilowe
zachodzi głównie w pozycji meta.
zachodzi głównie w pozycji meta.
δ
-
E
G
δ
+
δ
-
δ
+
δ
+
E
‹#›
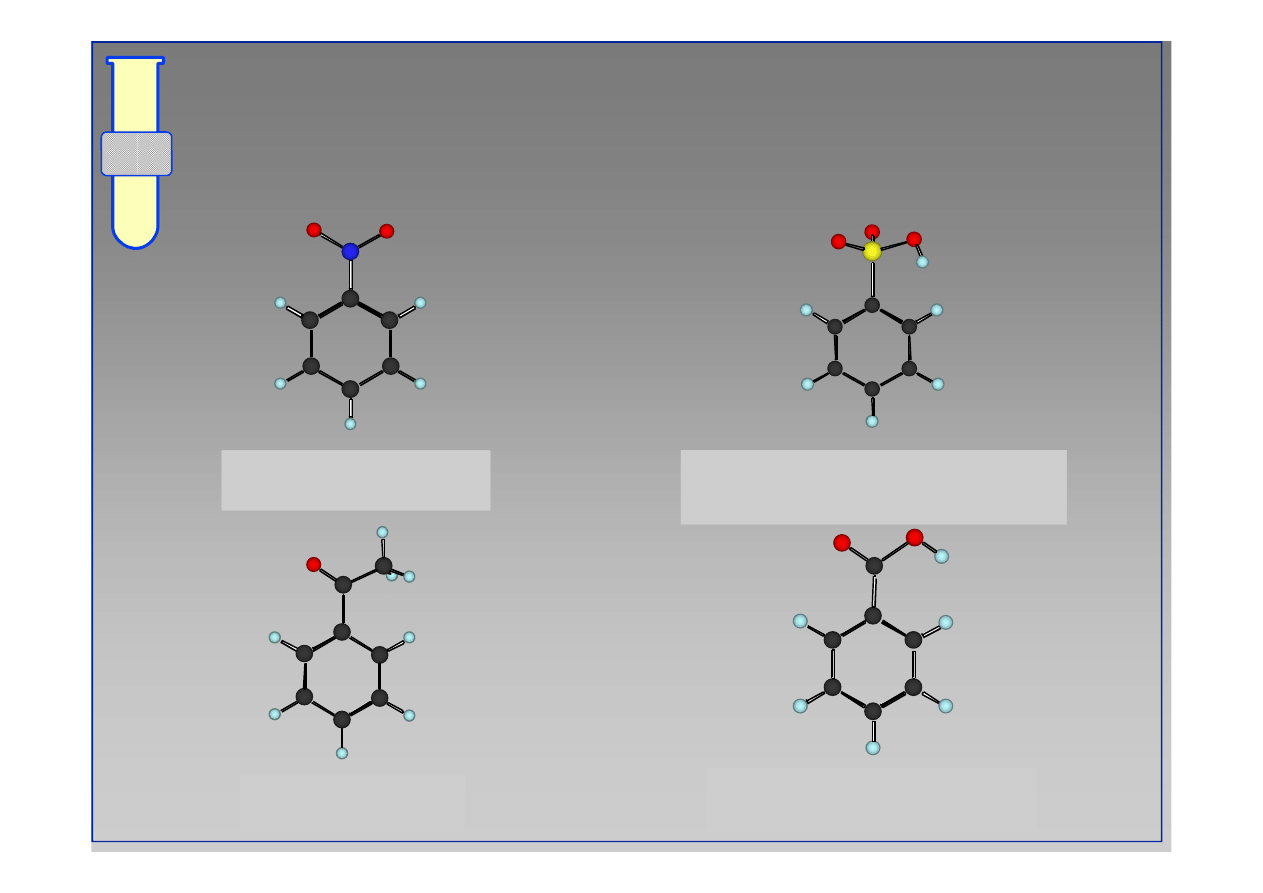
RJC
Podstawniki Kierujące w Pozycję meta;
Podstawniki Kierujące w Pozycję meta;
Podstawniki Dezaktywujące
Podstawniki Dezaktywujące
nitrobenzen
kwas benzenosulfonowy
kwas benzoesowy
acetofenon
‹#›
RJC
Dystrybucja Produktów Nitrowania
Dystrybucja Produktów Nitrowania
G
H
NO
3
/H
2
SO
4
G
G
G
NO
2
NO
2
NO
2
Podstawnik (G)
Orto
Meta
Para
NO
2
7
91
2
CO
2
H
22
77
1
CN
17
81
2
COCH
3
26
72
3
CHO
19
72
9

‹#›
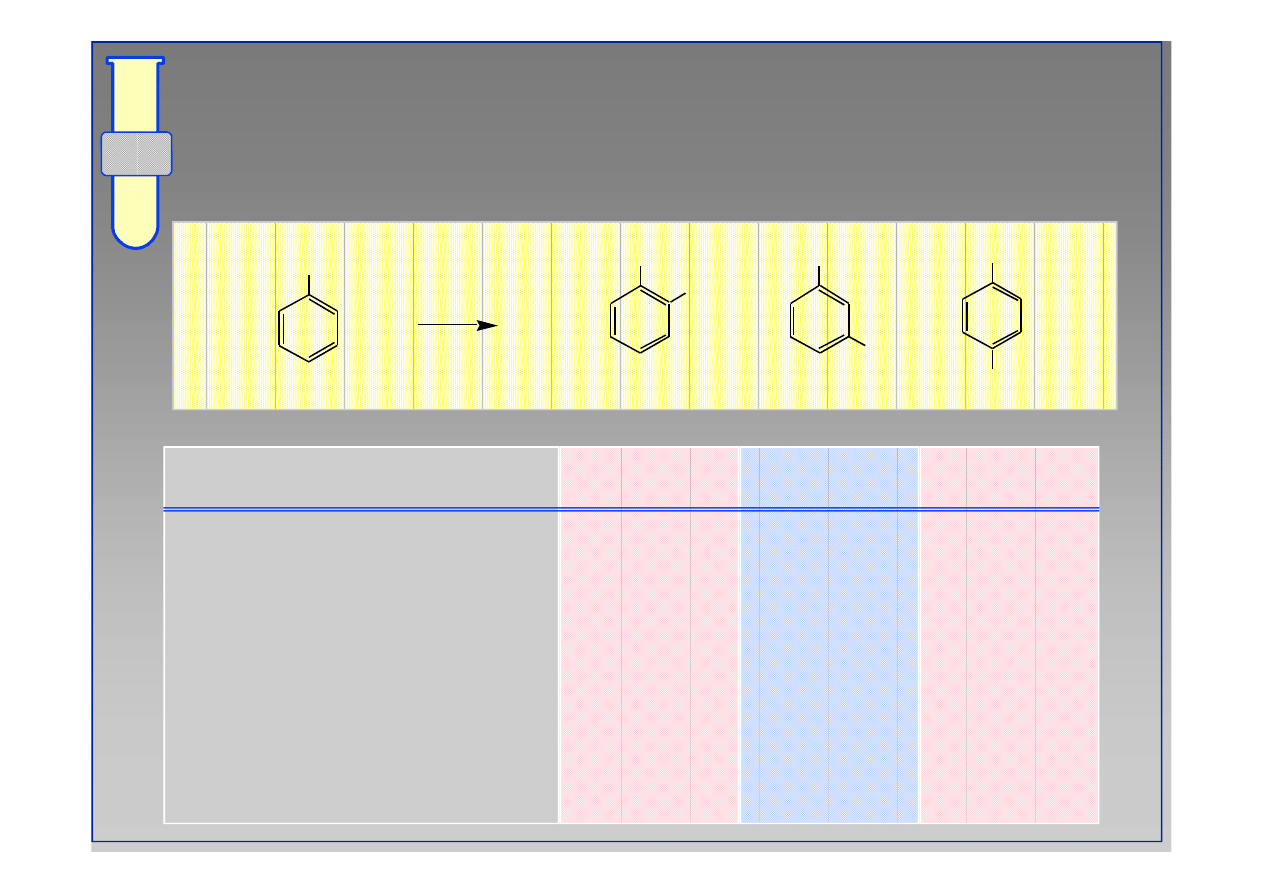
RJC
Atomy Fluorowców : Przypadek Szczególny
Atomy Fluorowców : Przypadek Szczególny
...atomy X (F, Cl, Br, I), które są elektrono
...atomy X (F, Cl, Br, I), które są elektrono--
akceptorowe i dezaktywujące, kierują nowe grupy
akceptorowe i dezaktywujące, kierują nowe grupy
w pozycje orto & para. W tym przypadku
w pozycje orto & para. W tym przypadku
konkurują dwa przeciwstawne efekty;
konkurują dwa przeciwstawne efekty;
dodatni efekt rezonansowy
ujemny efekt indukcyjny
‹#›
RJC
(+) Efekt Rezonansowy
(+) Efekt Rezonansowy
(wpływ kierujący orto & para)
(wpływ kierujący orto & para)
...powoduje on korzystne ulokowanie (wzrost)
...powoduje on korzystne ulokowanie (wzrost)
gęstości elektronowej w pozycjach orto & para.
gęstości elektronowej w pozycjach orto & para.
δ
+
E
E
••
••
Cl
δ
-
δ
-
δ
-
E
E
E
••
••
•
•
•
•
•
•
•
•
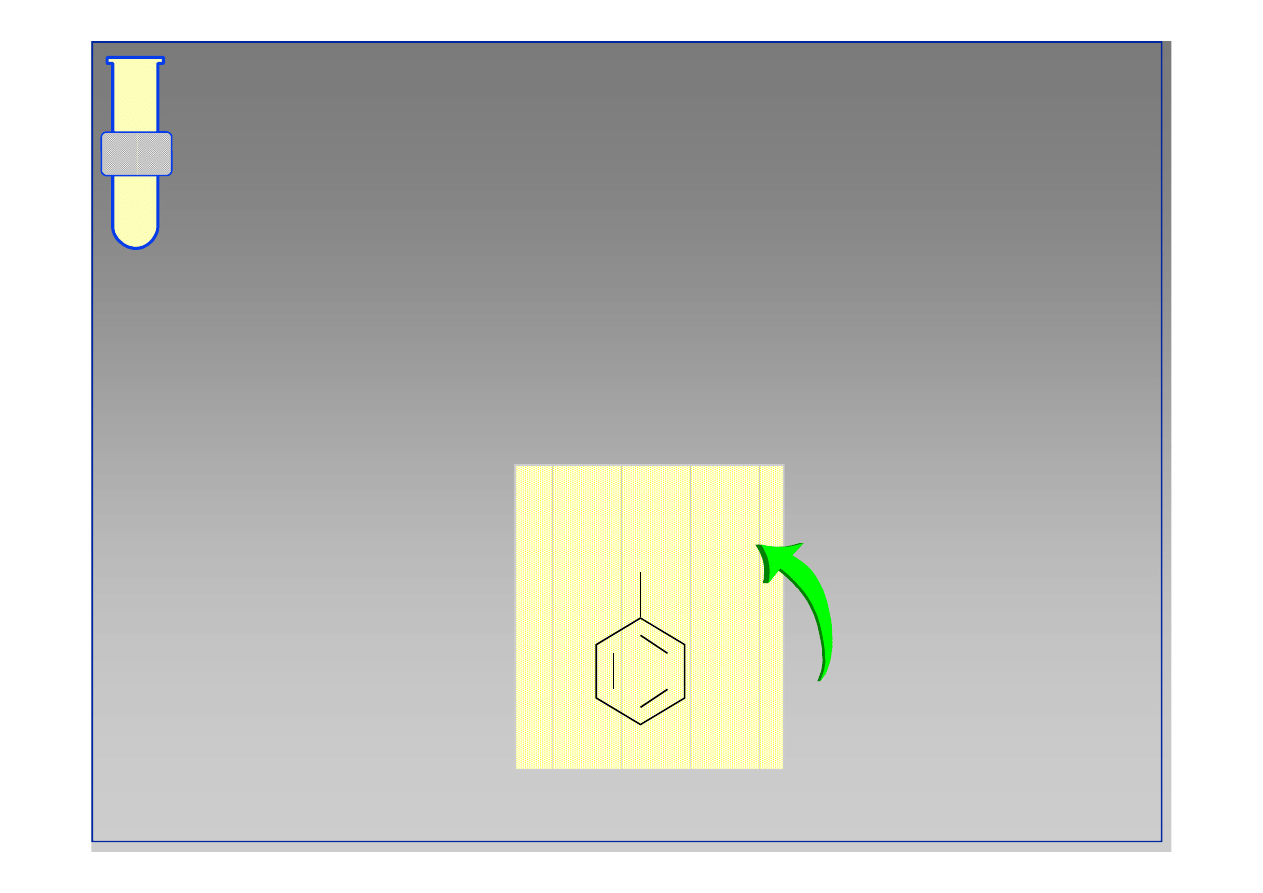
‹#›
RJC
((--) Efekt Indukcyjny (dezaktywujący)
) Efekt Indukcyjny (dezaktywujący)
Duża elektroujemność atomów typu X (F, Cl, Br,
Duża elektroujemność atomów typu X (F, Cl, Br,
I) powoduje sumarycznie obniżenie gęstości
I) powoduje sumarycznie obniżenie gęstości
elektronowej w pierścieniu aromatycznym.
elektronowej w pierścieniu aromatycznym.
δ
+
δ
-
Cl
‹#›
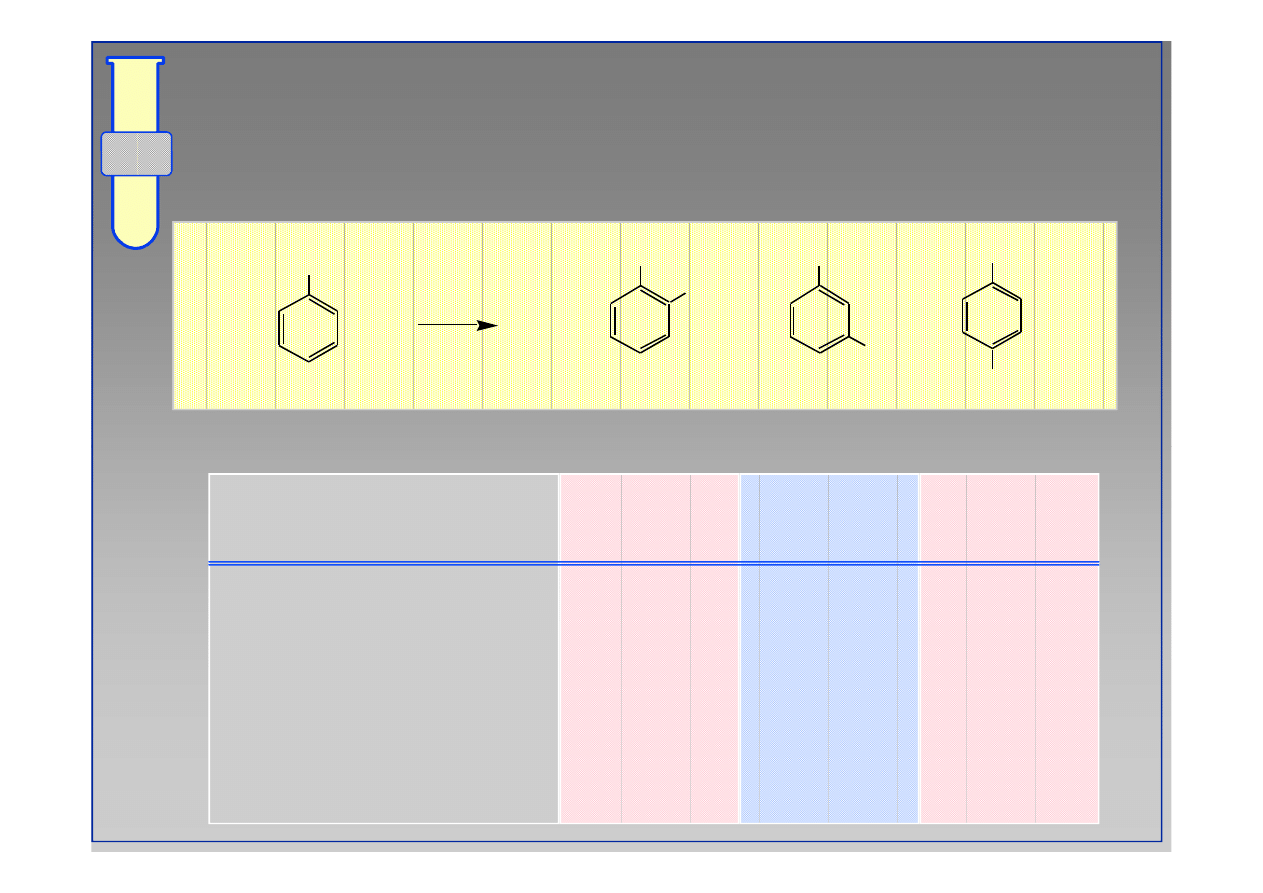
RJC
Dystrybucja Produktów Nitrowania
Dystrybucja Produktów Nitrowania
G
G
G
NO
2
NO
2
NO
2
G
H
NO
3
/H
2
SO
4
Podstawnik (G)
Orto
Meta
Para
F
13
1
86
Cl
35
1
64
Br
43
1
56
I
45
1
54
‹#›
RJC
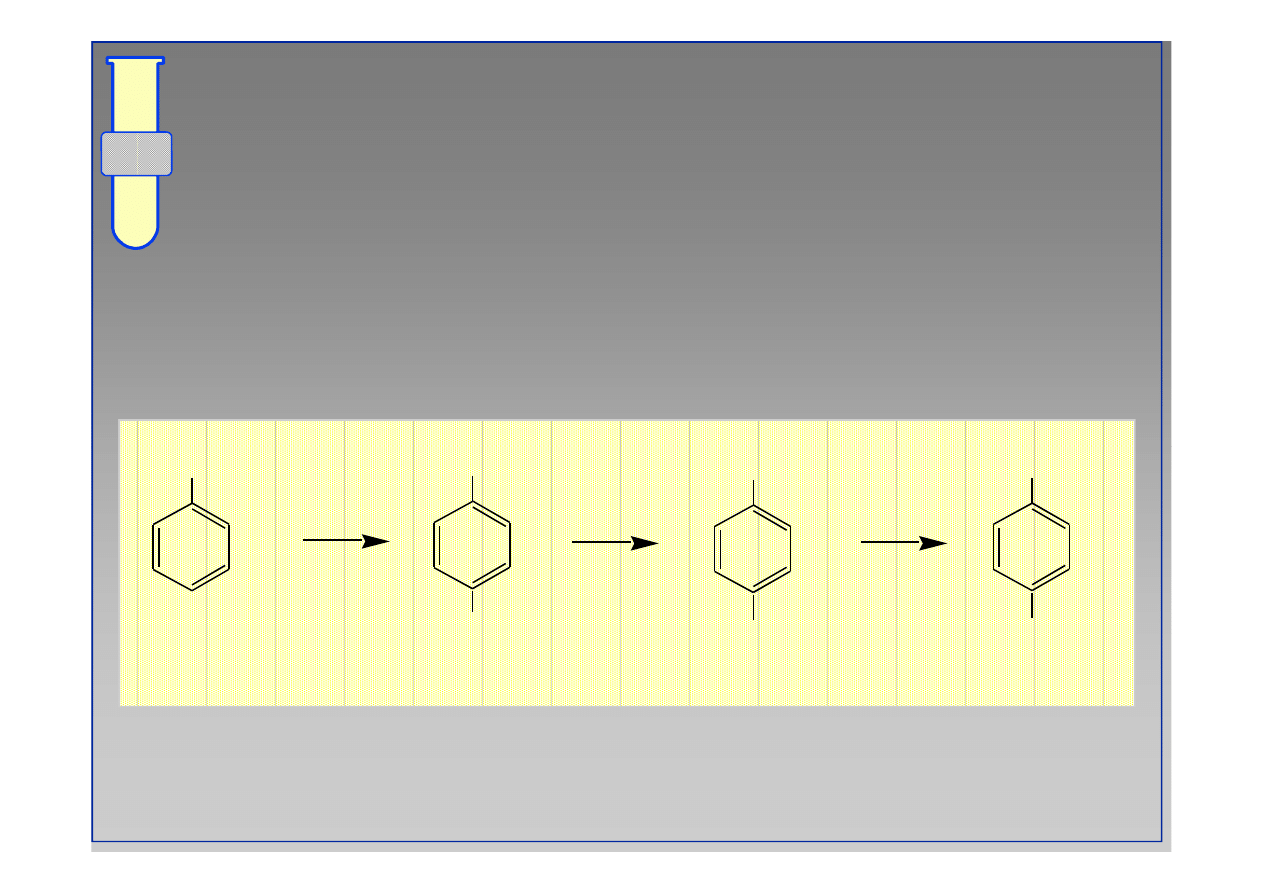
Planowanie Syntezy... Przykład # 1
Planowanie Syntezy... Przykład # 1
...odpowiedni dobór podstawników umożliwia kontrolę
...odpowiedni dobór podstawników umożliwia kontrolę
reaktywności oraz regiochemii reakcji podstawienia...
reaktywności oraz regiochemii reakcji podstawienia...
NH
2
NH
Ac
NH
Ac
NO
2
NH
2
NO
2
Ac
2
O
HNO
3
H
2
SO
4
H
2
SO
4
‹#›
RJC
Planowanie Syntezy... Przykład # 2
Planowanie Syntezy... Przykład # 2
Synteza kwasu p
Synteza kwasu p--aminobenzoesowego
aminobenzoesowego
CH
3
CH
3
CO
2
H
NO
2
CO
2
H
NH
2
O
2
HNO
3
H
2
SO
4
Zn/HCl
NO
2
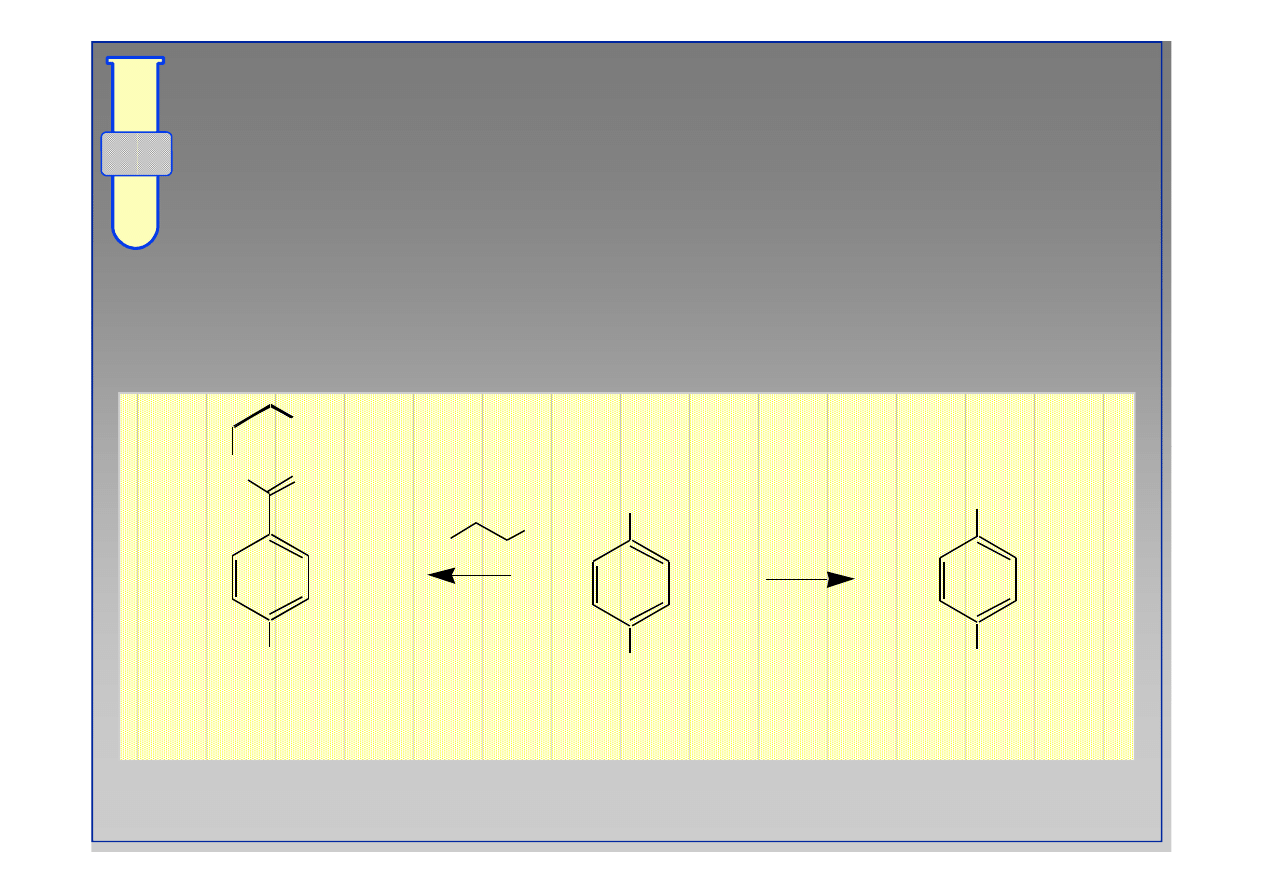
‹#›
RJC
Planowanie Syntezy... Przykład # 3
Planowanie Syntezy... Przykład # 3
Synteza anastetyków (benzokaina & novokaina)
Synteza anastetyków (benzokaina & novokaina)
N(Et)
2
. HCl
CO
2
H
NH
2
CO
2
Et
NH
2
NH
2
EtOH
benzokaina
N(Et)
2
OH
O
O
2
HCl
novokaina
‹#›
RJC
Planowanie Syntezy... Przykład # 4
Planowanie Syntezy... Przykład # 4
Synteza analgestyku (paracetamol)
Synteza analgestyku (paracetamol)
OH
OAc
OAc
OAc
OH
OAc
OAc
NH
2
OAc
NH
Ac
1. Ac
2
O
2. HNO
3
/H
2
SO
4
Zn/HCl
NO
2
AcOH/H
2
O

‹#›
RJC
Podsumowanie
Podsumowanie
Aromatyczna substytucja elektrofilowa
Stabilizacja rezonansowa
Elektrofilowe bromowanie, chlorowanie,
jodowanie, nitrowanie oraz sulfonowanie
Alkilowanie i acylowanie Friedla-Craftsa
Podstawniki elektrono-donorowe i elektrono-
Podstawniki elektrono-donorowe i elektrono-
akceptorowe
Wpływ kierujący o & p, podstawniki aktywujące i
dezaktywujące
Wpływ kierujący m, podstawniki dezaktywujące
Planowanie syntezy organicznej
Wyszukiwarka
Podobne podstrony:
14?le elektromagnetyczne
14. Dokumenty elektroniczne, pytania egzamin inżynierski AiR ARS
14 indukcja elektromagnetycznai Nieznany (2)
E 14, sgsp, Elektroenergetyka, ELEKTROE
sprawko Św. 14, fizyka, elektrotech, Elektro sprawka, Sprawka w ofice 2003
14 Mikroskopia elektronowa
14 Podstawy elektroniki i elektrotechniki
14 silowniki i elektrozawory
14 indukcja elektromagnetyczna (2)
14 przewodnictwo elektrolitow
14 indukcja elektromagnetyczna 2
04 14 schemat elektryczny LM1 LS2 typ BA1
elektro lab 14
14 Elektrostatyka (2)
El en i środowisko 13 14 1, Prywatne, EN-DI semestr 4, Elektroenergetyka, wykład + ćwiczenia
więcej podobnych podstron