

WYDANIE SPECJALNE 1/2007
Światowa strategia rozpoznawania, leczenia i prewencji astmy
Aktualizacja 2006
Global strategy for asthma management and prevention. Revised 2006
Global Initiative for Asthma
http://www.ginasthma.org (cyt. 14.12.2006)
Tłumaczył
dr med. Piotr Gajewski
Konsultowali:
prof. dr hab. med. Wacław Droszcz
Instytut Gruźlicy i Chorób Płuc w Warszawie
prof. dr hab. med. Jerzy Kruszewski
Klinika Chorób Infekcyjnych i Alergologii, Wojskowy Instytut Medyczny w Warszawie
prof. dr hab. med. Piotr Kuna
Klinika Chorób Wewnętrznych, Astmy i Alergii, Uniwersytecki Szpital Kliniczny im. N. Barlickiego,
Uniwersytet Medyczny w Łodzi
dr hab. med. Henryk Mazurek
Klinika Pneumonologii i Mukowiscydozy
Instytut Gruźlicy i Chorób Płuc, Oddział Terenowy im. Jana i Ireny Rudników w Rabce
prof. dr hab. med. Ewa Niżankowska-Mogilnicka
II Katedra Chorób Wewnętrznych Collegium Medicum Uniwersytetu Jagiellońskiego w Krakowie
dr hab. med. Marek Sanak
II Katedra Chorób Wewnętrznych Collegium Medicum Uniwersytetu Jagiellońskiego w Krakowie
Redakcja językowa i opracowanie edytorskie
Krystyna Moćko, Katarzyna Jagieła, Lucyna Niespodziewany
Redakcja techniczna
Maciej Dora, Łukasz Łukasiewicz, Mirosław Szymański
Wydawca
Medycyna Praktyczna
ul. Krakowska 41, 31-066 Kraków
tel. +4812 2934000, fax 2934019
e-mail: listy@mp.pl, http://www.mp.pl
© Copyright by Medycyna Praktyczna, Kraków 2007
Druk
Drukarnia TECHNET, Kraków
wydanie specjalne 1/2007

WYDANIE SPECJALNE 1/2007
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Komitet Wykonawczy GINA*
Paul O’Byrne, MD, przewodniczący
McMaster University
Hamilton, Ontario, Kanada
Eric D. Bateman, MD
University of Cape Town
Kapsztad, Republika Południowej Afryki
Jean Bousquet, MD, PhD
M
ontpellier University and INSERM
Montpellier, Francja
Tim Clark, MD
National Heart and Lung Institute
Londyn, Wielka Brytania
Ken Ohta, MD, PhD
Teikyo University School of Medicine
Tokio, Japonia
Pierluigi Paggiaro, MD
University of Pisa
Piza, Włochy
Soren Erik Pedersen, MD
Kolding Hospital
Kolding, Dania
Manuel Soto-Quiroz, MD
Hospital Nacional de Niños
San José, Kostaryka
Raj B. Singh, MD
Apollo Hospital
Madras, Indie
Wan-Cheng Tan, MD
St
Paul’s Hospital,
Vancouver, BC, Kanada
Komitet Naukowy GINA*
Eric D. Bateman, MD, przewodniczący
University of Cape Town
Kapsztad, Republika Południowej Afryki
Peter J. Barnes, MD
National Heart and Lung Institute
Londyn, Wielka Brytania
Jean Bousquet, MD, PhD
Montpellier University and INSERM
Montpellier, Francja
Jeffrey M. Drazen, MD
Harvard Medical School
Boston, Massachusetts, USA
Mark FitzGerald, MD
University of British Columbia
Vancouver, BC, Kanada
Peter Gibson, MD
John Hunter Hospital
Newcastle, NSW, Australia
Paul O’Byrne, MD
McMaster University
Hamilton, Ontario, Kanada
Ken Ohta, MD, PhD
Teikyo University School of Medicine
Tokio, Japonia
Soren Erik Pedersen, MD
Kolding Hospital
Kolding, Dania
Emilio Pizzichini, MD
Universidade Federal de Santa Catarina
Florianópolis, SC, Brazylia
Sean D. Sullivan, PhD
University of Washington
Seattle, Waszyngton, USA
Sally E. Wenzel, MD
National Jewish Medical/Research Center
Denver, Kolorado, USA
Heather J. Zar, MD
University of Cape Town
Kapsztad, Republika Południowej Afryki
Konsultanci
Louis P. Boulet, MD
Hopital Laval
Quebec, QC, Kanada
William W. Busse, MD
University of Wisconsin
Madison, Wisconsin, USA
Neil Barnes, MD
The London Chest Hospital, Barts and the London NHS
Trust
Londyn, Wielka Brytania
Yoshinosuke Fukuchi, MD, PhD
Prezes Asian Pacific Society of Respirology
Tokio, Japonia
* Deklaracje sprzeczności interesów członków Komitetu Wy
konawczego i Komitetu Naukowego GINA można znaleźć na
stronie http://ginasthma.com/Committees.asp?I1=7&I2=2

WYDANIE SPECJALNE 1/2007
John E. Heffner, MD
Prezes American Thoracic Society
Providence Portland Medical Center
Portland, Oregon, USA
Dr Mark Levy
Kenton Bridge Medical Centre
Kenton, Wielka Brytania
Carlos M. Luna, MD
Prezes ALAT
University of Buenos Aires
Buenos Aires, Argentyna
Dr Helen K. Reddel
Woolcock Institute of Medical Research
Camperdown, New South Wales, Australia
Stanley Szefler, MD
National Jewish Medical & Research Center
Denver, Kolorado, USA
Członkowie Zgromadzenia GINA,
którzy przesłali uwagi
Profesor Nguygen Nang An
Bachmai University Hospital
Hanoi, Wietnam
Profesor Richard Beasley
Medical Research Institute New Zealand
Wellington, Nowa Zelandia
Yu-Zi Chen, MD
Children’s Hospital of The Capital Institute of Pediatrics
Pekin, Chiny
Ladislav Chovan, MD, PhD
Prezes Slovak Pneumological and Phthisiological Society
Bratysława, Słowacja
Motohiro Ebisawa, MD, PhD
National Sagamihara Hospital/Clinical Research Center for
Allergology
Kanagawa, Japonia
Profesor Amiran Gamkrelidze
Tbilisi, Gruzja
Dr Michiko Haida
Hanzomon Hospital, Chiyoda-ku
Tokio, Japonia
Dr Carlos Adrian Jiménez
San Luis Potosí, Meksyk
Sow-Hsong Kuo, MD
National Taiwan University Hospital
Tajpej, Tajwan
Eva Mantzouranis, MD
University Hospital
Iraklion, Kreta, Grecja
Dr Yousser Mohammad
Tishreen University School of Medicine
Latakia, Syria
Hugo E. Neffen, MD
Children Hospital
Santa Fe, Argentyna
Profesor Ewa NiżankowskaMogilnicka
Collegium Medicum Uniwersytetu Jagiellońskiego
Kraków, Polska
Afshin Parsikia, MD, MPH
Asthma and Allergy Program
Iran
Jose Eduardo Rosado Pinto, MD
Hospital Dona Estefania
Lizbona, Portugalia
Joaquín Sastre, MD
Universidad Autonoma de Madrid
Madryt, Hiszpania
Dr Jeana Rodica Radu
N. Malaxa Hospital
Bukareszt, Rumunia
Mostafizur Rahman, MD
Director and Head, NIDCH
Dakka, Bangladesz
Václav Špičák, MD
Czech Initiative for Asthma
Praga, Czechy
G.W. Wong, MD
Chinese University of Hong Kong
Hongkong, Chiny
Program GINA
Suzanne S. Hurd, PhD
Dyrektor naukowy
Sarah DeWeerdt
Redaktor medyczny

WYTYCZNE
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Przedmowa
Astma stanowi poważny problem zdrowotny na
całym świecie. Ta przewlekła choroba dróg od-
dechowych dotyka ludzi w każdym wieku i jeśli
nie jest kontrolowana – może bardzo ograniczać
aktywność życiową chorego, a niekiedy prowa-
dzi do zgonu. W większości krajów częstość wy-
stępowania astmy się zwiększa, zwłaszcza wśród
dzieci. Astma powoduje znaczne obciążenie, nie
tylko poprzez koszty opieki medycznej, ale rów-
nież zmniejszenie produktywności i ograniczenie
udziału chorych w życiu rodzinnym.
W ciągu ostatnich 20 lat byliśmy świadkami
wielu odkryć naukowych, które wzbogaciły naszą
wiedzę na temat astmy oraz możliwości jej sku-
tecznego leczenia. Jednak odmienności systemów
opieki zdrowotnej oraz różnice w dostępności me-
tod leczenia astmy w poszczególnych krajach po-
wodują konieczność przystosowania wytycznych
postępowania w astmie do warunków lokalnych.
Ponadto osoby zarządzające służbą zdrowia po-
trzebują informacji o kosztach leczenia astmy,
metodach skutecznego postępowania w tej prze-
wlekłej chorobie i najlepszych metodach edukacji
– w celu opracowania systemu opieki nad chorymi
na astmę uwzględniającego specyficzne potrzeby
i uwarunkowania w poszczególnych krajach.
W 1993 roku National Heart, Lung and Blood
Institute nawiązał współpracę ze Światową Or-
ganizacja Zdrowia w celu zorganizowania spot-
kania, które zaowocowało opracowaniem raportu
(Workshop Report) zatytułowanego „Światowa
strategia rozpoznawania, leczenia i prewencji ast-
my”. Raport ten przedstawiał kompleksowy plan
postępowania w astmie, mający na celu zmniej-
szenie przewlekłego upośledzenia sprawności
i częstości przedwczesnych zgonów, tak by umoż-
liwić chorym na astmę prowadzenie w pełni pro-
duktywnego i satysfakcjonującego życia.
W tym samym czasie rozpoczęto wdrażanie
programu o nazwie Światowa Inicjatywa Zwalcza-
nia Astmy (Global Initiative for Asthma – GINA)
w celu stworzenie sieci osób, organizacji i urzęd-
ników zajmujących się zdrowiem publicznym, od-
powiedzialnych za rozpowszechnianie informacji
na temat właściwej opieki nad chorymi na astmę
oraz zapewnienie mechanizmów wykorzystania
wyników badań naukowych w praktyce klinicz-
nej.
Na podstawie Raportu GINA przygotowano
dodatkowe publikacje, przetłumaczone na kil-
ka języków, w celu ułatwienia międzynarodowej
współpracy i rozpowszechniania informacji. Z za-
miarem rozpowszechniania informacji na temat
postępowania w astmie powołano Zgromadzenie
GINA (GINA Assembly), w którego skład weszli
eksperci z wielu krajów. Ich zadaniem jest pro-
wadzenie warsztatów edukacyjnych z lekarzami
i ekspertami w poszczególnych krajach oraz orga-
nizowanie seminariów krajowych i międzynaro-
dowych. Ponadto GINA zainicjowała (w 2001 r.)
organizowanie dorocznego Światowego Dnia Ast-
my, cieszącego się z roku na rok coraz większym
zainteresowaniem, w celu uświadamiania obcią-
żeń związanych z astmą oraz zapoczątkowania
lokalnych i ogólnokrajowych działań edukacyj-
nych dla rodzin chorych i dla pracowników opieki
zdrowotnej na temat skutecznych metod kontroli
astmy.
Pomimo tych wysiłków międzynarodowe bada-
nia dostarczyły bezpośrednich dowodów, że w wie-
lu krajach kontrola astmy nie jest optymalna,
chociaż dostępne są skuteczne metody leczenia tej
choroby. Oczywiste jest, że jeśli zalecenia zawarte
w tym raporcie, mają poprawić opiekę nad chory-
mi na astmę, to trzeba dołożyć wszelkich starań,
by nakłonić decydentów w opiece zdrowotnej do
zapewnienia dostępności leków oraz opracować
sposoby wdrażania skutecznych programów le-
czenia astmy, obejmujących właściwe narzędzia
do oceny efektów.
W 2002 roku w Raporcie GINA napisano: „moż-
na oczekiwać, że u większości chorych na astmę
można i powinno się uzyskać i utrzymać kontrolę
choroby”. Aby sprostać temu wyzwaniu, w 2005
roku Komitet Wykonawczy zalecił przygotowanie
nowego raportu nie tylko w celu uwzględnienia
nowych danych naukowych, ale także zmiany po-
stępowania w astmie polegającej na kierowaniu
się stopniem kontroli choroby, a nie stopniem jej
ciężkości. W niniejszym dokumencie podano za-
lecenia dotyczące oceny, osiągnięcia i utrzymania
kontroli astmy. Metody użyte do aktualizacji opi-
sano we „Wprowadzeniu”.
Mam przyjemność podziękować wielu osobom
za ich wkład w przygotowanie uaktualnienia
Raportu, a także za wspaniałą pracę wszystkich
osób, które przyczyniły się do sukcesu programu
GINA.

WYTYCZNE
Przedmowa
Program GINA jest prowadzony dzięki bezwa-
runkowym grantom edukacyjnym otrzymanym
od następujących firm: Altana, AstraZeneca,
Boehringer Ingelheim, Chiesi Group, GlaxoSmith-
-Kline, Meda Pharma, Merck Sharp & Dohme, Mit-
subishi Pharma, Novartis i PharmAxis. Szczodre
wsparcie ze strony wymienionych firm umożliwi-
ło członkom grupy roboczej spotkania w celu omó-
wienia poszczególnych zagadnień i wypracowania
wspólnego stanowiska w sposób konstruktywny
i w krótkim czasie. Jednakże za stwierdzenia
i wnioski zawarte w tym dokumencie są odpowie-
dzialni wyłącznie członkowie Komitetów GINA.
Publikacje GINA są dostępne w internecie
(http://www.ginasthma.org).
Paul O’Byrne, MD
Przewodniczący Komitetu Wykonawczego GINA
McMaster University
Hamilton, Ontario, Kanada

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Spis treści
Przedmowa .........................................................
Wprowadzenie ................................................... 9
Podsumowanie postępowania w astmie
u dzieci w wieku 5 lat i młodszych ................
Rozdział 1. Definicja i ogólna
charakterystyka .............................................. 9
Główne punkty.....................................................19
Definicja ...............................................................19
Obciążenia związane z astmą ...............................20
Częstość występowania, chorobowość
i umieralność ...................................................20
Obciążenie społeczne i ekonomiczne .................20
Czynniki wpływające na rozwój i ujawnienie się
astmy .................................................................21
Czynniki osobnicze .............................................22
Czynniki genetyczne ........................................22
Otyłość .............................................................22
Płeć ..................................................................22
Czynniki środowiskowe ........................................22
Alergeny ..........................................................22
Zakażenia .........................................................23
Zawodowe czynniki uczulające ........................23
Dym tytoniowy ................................................25
Zanieczyszczenia powietrza atmosferycznego
i wewnątrz pomieszczeń................................25
Dieta ................................................................25
Mechanizmy astmy ..............................................25
Zapalenie dróg oddechowych w astmie .............25
Komórki zapalne ..............................................26
Mediatory zapalne ...........................................26
Zmiany strukturalne w drogach
oddechowych ................................................26
Patofizjologia .....................................................26
Nadreaktywność dróg oddechowych ...............27
Zaostrzenia ......................................................27
Astma nocna ....................................................27
Nieodwracalne zwężenie dróg oddechowych ..28
Astma trudna ...................................................28
Palenie tytoniu i astma .....................................28
Piśmiennictwo ......................................................28
Rozdział 2. Rozpoznanie i klasyfikacja .............
Główne punkty.....................................................31
Wprowadzenie .....................................................31
Rozpoznanie kliniczne ..........................................31
Wywiad ..............................................................31
Objawy podmiotowe .......................................31
Wariant kaszlowy astmy ..................................31
Skurcz oskrzeli wywoływany przez wysiłek
fizyczny ..........................................................32
Badanie przedmiotowe ......................................32
Badania pomocnicze służące do rozpoznania
i monitorowania ..............................................33
Pomiary czynności płuc ....................................33
Pomiary reaktywności dróg oddechowych .......35
Nieinwazyjne markery zapalenia dróg
oddechowych ................................................35
Diagnostyka alergii ..........................................36
Trudności diagnostyczne i rozpoznanie
różnicowe ..........................................................36
Dzieci w wieku 5 lat i młodsze ...........................36
Dzieci starsze i dorośli ........................................37
Osoby w podeszłym wieku .................................37
Astma zawodowa ..............................................38
Odróżnienie astmy od POChP.............................38
Klasyfikacja astmy ................................................38
Klasyfikacja etiologiczna ....................................38
Klasyfikacja na podstawie ciężkości astmy .........39
Kontrola astmy ...................................................39
Piśmiennictwo ......................................................40
Rozdział 3. Leki przeciwastmatyczne ............... 2
Główne punkty.....................................................42
Wprowadzenie .....................................................42
Leki przeciwastmatyczne u dorosłych ...................42
Drogi podawania leków .....................................42
Leki kontrolujące ..................................................44
Glikokortykosteroidy wziewne ..........................44
Leki przeciwleukotrienowe .................................45
Długo działające β
2
-mimetyki wziewne ..............45
Teofilina .............................................................46
Kromony: kromoglikan sodu i nedokromil
sodu.................................................................47
Długo działające β
2
-mimetyki doustne .................47
Przeciwciała anty-IgE .........................................47
Glikokortykosteroidy stosowane
ogólnoustrojowo .............................................47
Doustne leki przeciwalergiczne ..........................48
Inne leki kontrolujące .........................................48
Swoista immunoterapia alergenowa ..................49
Leki doraźne .........................................................50
Szybko działające β
2
-mimetyki wziewne ............50
Glikokortykosteroidy stosowane
ogólnoustrojowo .............................................50
Leki przeciwcholinergiczne .................................51
Teofilina .............................................................51
Krótko działające β
2
-mimetyki doustne ..............51
Medycyna komplementarna i alternatywna .......51
Leki przeciwastmatyczne u dzieci ........................52

WYTYCZNE
Spis treści
Drogi podawania leków .....................................52
Leki kontrolujące ................................................53
Glikokortykosteroidy wziewne ...........................53
Leki przeciwleukotrienowe .................................56
Długo działające β
2
-mimetyki wziewne ..............56
Teofilina .............................................................56
Kromony: kromoglikan sodu i nedokromil
sodu.................................................................57
Długo działające β
2
-mimetyki doustne ...............57
Glikokortykosteroidy stosowane
ogólnoustrojowo .............................................58
Leki doraźne .........................................................58
Szybko działające β
2
-mimetyki wziewne i krótko
działające β
2
-mimetyki doustne .......................58
Leki przeciwcholinergiczne .................................58
Piśmiennictwo ......................................................58
Rozdział 4. Leczenie i prewencja astmy ........... 6
Wprowadzenie ................................................. 6
Składowa 1: wypracowanie partnerskiej relacji
między pacjentem a lekarzem ....................... 6
Główne punkty.....................................................63
Wprowadzenie .....................................................64
Edukacja w astmie ...............................................64
Pierwsza wizyta lekarska ....................................65
Osobisty plan działania w astmie .......................65
Wizyty kontrolne i ocena ....................................66
Poprawa przestrzegania zaleceń ........................67
Samodzielne postępowanie dzieci .....................67
Edukacja innych osób ...........................................67
Składowa 2: identyfikacja i zmniejszenie
narażenia na czynniki ryzyka ......................... 68
Główne punkty.....................................................68
Wprowadzenie .....................................................68
Prewencja astmy ..................................................68
Zapobieganie objawom i zaostrzeniom astmy .....69
Alergeny wewnątrz pomieszczeń .......................69
Roztocze kurzu domowego .............................69
Zwierzęta mające sierść ...................................70
Karaluchy .........................................................70
Grzyby .............................................................70
Alergeny środowiska zewnętrznego ...................71
Zanieczyszczenia powietrza wewnątrz
pomieszczeń ....................................................71
Zanieczyszczenia powietrza atmosferycznego ....71
Narażenia zawodowe .........................................71
Żywność i dodatki do żywności ..........................72
Leki ....................................................................72
Szczepienie przeciwko grypie .............................72
Otyłość ...............................................................72
Stres emocjonalny ..............................................72
Inne czynniki, które mogą wywoływać
zaostrzenia astmy ............................................72
Składowa 3: Ocena kontroli astmy, leczenie
w celu jej osiągnięcia i monitorowanie .........
Główne punkty.....................................................73
Wprowadzenie .....................................................73
Ocena kontroli astmy ...........................................73
Leczenie w celu uzyskania kontroli astmy .............73
Stopnie leczenia do osiągnięcia kontroli ............74
Stopień 1: leki doraźne ......................................74
Skurcz oskrzeli wywoływany przez wysiłek
fizyczny ..........................................................75
Stopień 2: leki doraźne w połączeniu z 1 lekiem
kontrolującym ..................................................76
Stopień 3: leki doraźne w połączeniu
z 1 lub 2 lekami kontrolującymi .......................76
Stopień 4: leki doraźne w połączeniu
z ≥2 lekami kontrolującymi ..............................77
Stopień 5: leki doraźne w połączeniu
z dodatkowymi lekami kontrolującymi
astmę ...............................................................77
Leczenie w celu utrzymania kontroli astmy ..........78
Czas trwania i dostosowywanie leczenia ............78
Zmniejszanie intensywności leczenia
po uzyskaniu kontroli astmy ............................78
Intensyfikacja leczenia w odpowiedzi na utratę
kontroli astmy ..................................................79
Astma trudna .....................................................80
Składowa 4: leczenie zaostrzeń astmy ............. 8
Główne punkty.....................................................81
Wprowadzenie .....................................................81
Ocena ciężkości zaostrzenia .................................82
Postępowanie w warunkach ambulatoryjnych .....82
Leczenie .............................................................82
Leki rozszerzające oskrzela ...............................82
Glikokortykosteroidy ........................................82
Postępowanie na oddziale pomocy doraźnej........84
Ocena ................................................................84
Leczenie .............................................................84
Tlen ..................................................................84
Szybko działające β
2
-mimetyki wziewne ..........84
Adrenalina .......................................................86
Dodatkowe leki rozszerzające oskrzela ............86
Glikokortykosteroidy stosowane
ogólnoustrojowo ...........................................86
Glikokortykosteroidy wziewne .........................87
Magnez ............................................................87
Leczenie mieszaniną helu i tlenu ......................87
Leki przeciwleukotrienowe ...............................87
Leki sedatywne ................................................87

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Wskazania do hospitalizacji lub wypisania
chorego z oddziału pomocy doraźnej
do domu ..........................................................88
Składowa 5: sytuacje szczególne ..................... 89
Ciąża ..................................................................89
Operacje ...............................................................89
Nieżyt nosa, zapalenie zatok przynosowych
i polipy nosa ....................................................90
Nieżyt nosa ......................................................90
Zapalenie zatok przynosowych ........................90
Polipy nosa ......................................................90
Astma zawodowa ..............................................91
Zakażenia układu oddechowego ........................91
Refluks żołądkowo-przełykowy ..........................91
Astma aspirynowa .............................................92
Anafilaksja i astma .............................................93
Piśmiennictwo ......................................................93
Rozdział 5. Wdrażanie wytycznych
postępowania w astmie w systemach
opieki zdrowotnej ........................................ 00
Główne punkty...................................................100
Wprowadzenie ...................................................100
Strategie wdrażania wytycznych ........................100
Wartość ekonomiczna interwencji i wdrażanie
wytycznych postępowania w astmie ................102
Wykorzystanie i koszt zasobów opieki
zdrowotnej ....................................................102
Określenie ekonomicznej wartości interwencji
w astmie ........................................................103
Zasoby służące rozpowszechnianiu i wdrażaniu
wytycznych GINA .............................................103
Piśmiennictwo ....................................................104

WYTYCZNE
Wprowadzenie
9
Wprowadzenie
Astma jest przewlekłą chorobą dróg oddechowych
stanowiącą poważny problem zdrowia publiczne-
go na całym świecie. Dotyka ludzi w każdym wie-
ku, może mieć ciężki przebieg, a niekiedy prowa-
dzi do śmierci.
W 1993 roku utworzono Światową Inicjatywę
Zwalczania Astmy (Global Initiative for Asthma
– GINA). Cele i założenia tego programu opisano
w 1995 roku w Raporcie NHLBI/WHO „Światowa
strategia rozpoznawania, leczenia i prewencji ast-
my”. Raport ten (nowa wersja ukazała się w 2002
r.) i towarzyszące mu dokumenty zostały szeroko
rozpowszechnione i przetłumaczone na wiele ję-
zyków. Powstała sieć osób i organizacji zajmują-
cych się leczeniem astmy oraz zainicjowano liczne
krajowe programy leczenia tej choroby. Jednak
dużo jest jeszcze do zrobienia dla zmniejszenia
chorobowości i umieralności z powodu astmy.
W styczniu 2004 roku Komitet Wykonawczy
GINA zalecił modyfikację Światowej Strategii
Leczenia i Prewencji Astmy w celu oparcia po-
stępowania w astmie na kontroli klinicznej, a nie
na klasyfikacji chorych według ciężkości choroby.
Ta ważna zmiana strategii opieki nad chorymi
na astmę odzwierciedla postęp, jaki się dokonał
w farmakoterapii. Wielu chorych na astmę otrzy-
muje leki przeciwastmatyczne. Rolą lekarza jest
ustalenie aktualnego poziomu leczenia i kontro-
li choroby u każdego pacjenta, a następnie takie
dostosowanie leczenia, aby uzyskać i utrzymać
kontrolę choroby. Oznacza to, że chorzy na astmę
powinni odczuwać co najwyżej minimalne objawy
podmiotowe (dotyczy to także objawów w nocy),
nie mieć żadnych ograniczeń aktywności (w tym
możliwości wykonywanie ćwiczeń fizycznych), co
najwyżej sporadycznie przyjmować leki doraźne,
mieć niemal prawidłową czynność płuc i bardzo
rzadko doświadczać zaostrzeń choroby.
Zadania na przyszłość
Pomimo podejmowanych w ostatnim dziesięcio-
leciu godnych uznania wysiłków w celu poprawy
opieki nad chorymi na astmę większość chorych
nie korzysta z postępów w leczeniu, a wielu nie
ma zapewnionej nawet podstawowej opieki. Zada-
niem na nadchodzące kilka lat jest praca z leka-
rzami podstawowej opieki zdrowotnej i osobami
zajmującymi się zdrowiem publicznym w różnych
krajach w celu opracowania, wdrożenia i oceny
programów leczenia astmy uwzględniających lo-
kalne potrzeby. Komitet Wykonawczy GINA, zda-
jąc sobie sprawę z trudności tego zadania, powołał
do pomocy w jego realizacji kilka grup światowych
ekspertów, w tym: Grupę ds. Rozpowszechniania,
Zgromadzenie GINA, sieć osób zajmujących się
chorymi na astmę w różnych warunkach opieki
zdrowotnej oraz programy regionalne (pierwsze
dwa to: GINA Mesoamerica i GINA Mediterra-
nean). Ma on usprawnić przepływ informacji do
specjalistów zajmującymi się astmą, lekarzy pod-
stawowej opieki zdrowotnej, innych pracowników
służby zdrowia oraz organizacji wsparcia skupia-
jących chorych na astmę. Komitet Wykonawczy
nadal stara się wykrywać trudności we wdraża-
niu zaleceń postępowania w astmie, zwłaszcza
problemów stojących przed lekarzami pierwszego
kontaktu i występujących w krajach rozwijają-
cych się.
Wczesne rozpoznanie astmy i zastosowanie od-
powiedniego leczenia znacząco zmniejsza obciąże-
nie społecznoekonomiczne powodowane przez
chorobę i poprawia jakość życia chorych, ale głów-
ny składnik całkowitych kosztów leczenia astmy
wciąż stanowi koszt leków. Z tego powodu ceny
leków stanowią palące zagadnienie i przedmiot
zainteresowań badawczych, ze względu na ważne
implikacje dla całkowitego kosztu leczenia astmy.
Ponadto znaczna część populacji świata miesz-
ka na obszarach, gdzie dostęp do opieki medycz-
nej jest niewystarczający, a przeznaczane na nią
nakłady finansowe są niewielkie. Komitet Wyko-
nawczy GINA ma świadomość tego, że „sztywne”
międzynarodowe wytyczne i protokoły naukowe
mogą być nie do zrealizowania w wielu miejscach
na świecie. Dlatego zalecenia zawarte w tym Ra-
porcie muszą być dostosowane do lokalnych wa-
runków praktyki medycznej i środków przezna-
czanych na ochronę zdrowia.
W miarę rozszerzania działań Komitetów
GINA będą podejmowane wszelkie wysiłki w celu
rozwoju współpracy chorych i lekarzy w poszcze-
gólnych krajach i regionach, jak również lokalnie,
w różnych systemach opieki zdrowotnej, w celu
ciągłej oceny nowych metod mających zapewnić
chorym na astmę najlepszą opiekę. GINA bierze
udział w programie rozpoczętym w marcu 2006

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
roku przez Światową Organizację Zdrowia pod na-
zwą Global Alliance Against Chronic Respiratory
Diseases (GARD). Dzięki pracy Komitetów GINA
i współdziałaniu w inicjatywach GARD w ciągu
następnej dekady powinien się dokonać znaczny
postęp w kierunku lepszej opieki nad chorymi na
astmę.
Metodologia
Przygotowanie dorocznych aktualizacji
Zaraz po ogłoszeniu aktualizacji Raportu GINA
w 2002 roku Komitet Wykonawczy powołał Komi-
tet Naukowy GINA, powierzając mu bieżącą ak-
tualizację Raportu poprzez przeglądanie publiko-
wanych badań naukowych dotyczących leczenia
i prewencji astmy, ocenę wpływu tych badań na
zalecenia dotyczące postępowania w astmie w do-
kumentach GINA oraz umieszczanie dorocznych
aktualizacji tych dokumentów na stronie interne-
towej GINA. Pierwszą aktualizację umieszczono
w internecie w październiku 2003 roku; była ona
oparta na publikacjach z okresu od stycznia 2000
roku do końca grudnia 2002 roku. Druga aktu-
alizacja ukazała się w październiku 2004 roku,
a trzecia – w październiku 2005 roku; każda obej-
mowała publikacje z okresu od stycznia do końca
grudnia roku poprzedzającego.
Proces dorocznych aktualizacji rozpoczynał
się przeglądem piśmiennictwa w bazie Pub Med
z użyciem haseł i ograniczeń wyszukiwania usta-
lonych przez Komitet: 1) asthma, All Fields, All
ages, only items with abstracts, Clinical Trial,
Human, sorted by Authors; i 2) asthma AND sy-
stematic, All fields, ALL agents, only items with
abstracts, Human, sorted by Author. Ponadto
członkom Komitetu można było przedłożyć publi-
kacje recenzowane nieujęte w bazie Pub Med, pod
warunkiem że były dostępne w formie streszcze-
nia i w całości, w języku angielskim (lub przetłu-
maczone na angielski).
Wszyscy członkowie Komitetu otrzymali zesta-
wienie pozycji piśmiennictwa i wszystkie stresz-
czenia. Poszczególne streszczenia przydzielano
2 członkom Komitetu, a wszyscy pozostali mieli
możliwość wyrażenia opinii na temat każdego
streszczenia. Członkowie oceniali streszczenie
lub, jeśli uznali to za konieczne, całą publikację,
odpowiadając na określone pytania w krótkim
kwestionariuszu; określali, czy przedstawione
dane naukowe wpływają na zalecenia w Raporcie
GINA. Jeśli tak, proszono członka Komitetu o za-
proponowanie zmian, które powinny zostać wpro-
wadzone. Cały Komitet Naukowy GINA spotykał
się regularnie w celu przedyskutowania każdej
publikacji, która została uznana przez co najmniej
1 członka Komitetu za mającą wpływ na zalecenia
dotyczące leczenia i prewencji astmy, i uzgodnie-
nia stanowiska co do zmian w Raporcie. Rozbież-
ności opinii rozstrzygano poprzez głosowanie.
Publikacje, które spełniały kryteria wyszuki-
wania do każdej dorocznej aktualizacji (250–300
artykułów rocznie), miały wpływ głównie na roz-
działy dotyczące postępowania klinicznego. Wy-
kaz publikacji uwzględnionych przez Komitet Na-
ukowy każdego roku, wraz z aktualną wersją Ra-
portu umieszczano na stronie internetowej GINA
(www.ginasthma.org).
B. Przygotowanie nowego raportu w 2006
roku
W styczniu 2005 roku Komitet Naukowy GINA
rozpoczął prace nad niniejszym nowym raportem.
Podczas dwudniowego spotkania Komitet ustalił,
że głównym tematem nowego raportu powinna
być kontrola astmy. Przygotowano spis treści,
ustalono tematykę każdego rozdziału i utworzono
zespoły redakcyjne. Komitet spotkał się w maju
i we wrześniu 2005 roku w celu oceny postępu
prac i uzgodnienia zakresu informacji w każdym
rozdziale. Intencją prac Komitetu było opraco-
wanie na podstawie aktualnego piśmiennictwa
naukowego możliwie najbardziej zwięzłego do
kumentu o zasięgu ogólnoświatowym. Jednocześ-
nie zdawano sobie sprawę z tego, że jedną z zalet
Raportu GINA było dostarczenie podstawowych
informacji na temat postępowania w astmie i da-
nych naukowych, na których oparto zalecenia do-
tyczące tego postępowania.
W styczniu 2006 roku Komitet spotkał się
ponownie na dwudniowej sesji, podczas której
przeprowadzono kolejną dogłębną ocenę każde-
go rozdziału. Podczas tego spotkania członkowie
Komitetu przeanalizowali piśmiennictwo z roku
2005, kierując się tymi samymi kryteriami opra-
cowanymi dla procesu aktualizacji. Lista 285

WYTYCZNE
Wprowadzenie
uwzględnionych publikacji z 2005 roku znajduje
się na stronie internetowej GINA. Podczas stycz-
niowego spotkania było jasne, że prace będzie
można zakończyć latem 2006 roku; w związku
z tym Komitet postanowił, że w miarę ukazywa-
nia się nowych publikacji na początku 2006 roku
będą one dokładnie przeglądane pod kątem ewen-
tualnego wpływu na zalecenia. Na kolejnym spot-
kaniu Komitetu w maju publikacje z 2006 roku,
które spełniały przyjęte kryteria wyszukiwania,
zostały uwzględnione i włączone do aktualnych
wersji roboczych rozdziałów, jeśli było to uzasad-
nione. Końcowe spotkanie Komitetu odbyło się
we wrześniu 2006 roku; wówczas przeanalizowa-
no publikacje, które ukazały się do 31 lipca 2006
roku, pod kątem ich ewentualnego wpływu na
treść raportu.
W okresie prac nad niniejszym raportem
przedstawiciele Komitetu Naukowego GINA re-
gularnie spotykali się z członkami Zgromadzenia
GINA (w maju i wrześniu 2005 roku oraz w maju
2006 roku) w celu omówienia ogólnego zagadnie-
nia kontroli astmy i zagadnień odnoszących się do
poszczególnych rozdziałów. Zgromadzenie GINA
składa się z przedstawicieli ponad 50 krajów i wie-
lu z nich brało udział w tych dyskusjach. Ponadto
poproszono członków Zgromadzenia o zgłaszanie
uwag do wersji roboczej dokumentu latem 2006
roku. Uwagi te, wraz z uwagami otrzymanymi od
innych osób zaproszonych jako recenzentów, Ko-
mitet przeanalizował we wrześniu 2006 roku.
Podsumowanie głównych zmian
Głównym celem rewizji raportu było przedstawie-
nie informacji na temat postępowania w astmie
w sposób wyczerpujący na tyle, na ile to możliwe,
ale nie tak szczegółowo jak w podręcznikach. Doło-
żono wszelkich starań, by wybrać główne pozycje
piśmiennictwa, aczkolwiek w wielu przypadkach
można by zacytować inne publikacje. Dokument
ma służyć jako materiał źródłowy; zostaną przy-
gotowane inne raporty podsumowujące, w tym
podręczny przewodnik dotyczący opieki nad nie-
mowlętami i małymi dziećmi chorymi na astmę.
Niektóre główne zmiany wprowadzone w tym
raporcie to:
1. Dołożono wszelkich starań, by opracować
dokument bardziej zwięzły i przejrzysty, który
będzie użyteczniejszy dla zapracowanych lekarzy,
szczególnie w podstawowej opiece zdrowotnej. Po-
dano aktualne pozycje piśmiennictwa, zaintereso-
wani czytelnicy mogą więc znaleźć więcej szczegó-
łów na różne tematy podsumowane w raporcie.
2. Cały dokument obecnie podkreśla kontrolę
astmy. Istnieją mocne dowody na to, że kliniczne
przejawy astmy – objawy podmiotowe, zaburzenia
snu, ograniczenie codziennej aktywności, upośle-
dzenie czynności płuc i zużycie leków doraźnych
– można kontrolować, stosując właściwe leczenie.
3. Podsumowano aktualne dane epidemiolo-
giczne, szczególnie pochodzące z raportu Global
Burden of Asthma. Chociaż z perspektywy pacjen-
ta oraz całego społeczeństwa koszt kontroli astmy
wydaje się duży, to koszt niestosowania właściwe-
go leczenia astmy jest jeszcze większy.
4. Wprowadzono pojęcie „astmy trudnej” (dif-
ficult-to-treat asthma) i rozwinięto je w różnych
miejscach raportu. Chorzy na astmę trudną czę-
sto są względnie niewrażliwi na glikokortykoste-
roidy i niekiedy nie można u nich osiągnąć takie-
go samego stopnia kontroli astmy jak u innych
chorych.
5. Nadal zaleca się badanie czynności płuc
za pomocą spirometrii lub pomiaru szczytowego
przepływu wydechowego (PEF) w celu ułatwienia
rozpoznania choroby i jej monitorowania. Więk-
szą rolę przypisano pomiarom zmienności ograni-
czenia przepływu powietrza przez drogi oddecho-
we, gdyż parametr ten ma zasadnicze znaczenie,
zarówno dla rozpoznania astmy, jak i dla oceny jej
kontroli.
6. Używanie dotychczasowego podziału astmy
na podstawie stopnia jej ciężkości – na sporadycz-
ną, przewlekłą lekką, przewlekłą umiarkowaną
i przewlekłą ciężką – zaleca się obecnie wyłącznie
do celów naukowych.
7. Zamiast tego podziału zalecono klasyfikowa-
nie astmy na podstawie poziomu jej kontroli: kon-
trolowana, częściowo kontrolowana lub niekon-
trolowana. Odzwierciedla to wiedzę, że ciężkość
astmy obejmuje nie tylko nasilenie samej choroby,
ale także odpowiedź na leczenie, oraz fakt, że cięż-
kość astmy nie jest cechą stałą u danego chorego,
lecz może się zmieniać w ciągu miesięcy lub lat.
8. W całym raporcie położono nacisk na kon-
cepcję, że celem leczenia astmy jest osiągnięcie
i utrzymanie kontroli klinicznej. Kontrolę astmy
definiuje się następująco:

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
1) nie ma objawów podmiotowych w ciągu dnia
(≤2/tydz.)
2) dzienna aktywność, w tym możliwość wykony-
wania ćwiczeń fizycznych, nie jest ograniczo-
na
3) nie występują nocne objawy astmy, nie budzą
chorego w nocy
4) nie ma potrzeby przyjmowania leków doraź-
nych (≤2/tydz.)
5) wartości parametrów czynności płuc są pra-
widłowe lub niemal prawidłowe
6) nie występują zaostrzenia choroby.
9. Podkreślono, że zwiększone zużycie, zwłasz-
cza w ciągu dnia, leków doraźnych, stanowi
ostrzeżenie przed pogarszaniem się kontroli ast-
my i wskazuje na potrzebę ponownej oceny stoso-
wanego leczenia.
10. Od ostatniej wersji raportu zmieniła się
rola poszczególnych leków:
1) Ostatnie dane wskazujące na możliwy wzrost
ryzyka zgonu związanego z astmą w związku
ze stosowaniem β
2
mimetyków długo działa-
jących w małej grupie chorych spowodowały
mocniejsze podkreślenie przesłania, że nie
powinno się stosować β
2
mimetyków długo
działających w monoterapii astmy, lecz trzeba
je koniecznie łączyć z glikokortykosteroidem
wziewnym w odpowiedniej dawce.
2) Leki przeciwleukotrienowe odgrywają teraz
większą rolę w leczeniu kontrolującym prze-
bieg astmy, szczególnie u dorosłych. Doustne
β
2
mimetyki długo działające w monoterapii
nie są już przedstawiane jako alternatywa
w intensyfikacji leczenia na żadnym stopniu,
chyba że w połączeniu z glikokortykosteroida-
mi wziewnymi.
3) Monoterapia z użyciem kromonów nie jest już
alternatywą dla monoterapii glikokortykoste-
roidami wziewnymi w małej dawce u doro-
słych.
4) Wprowadzono pewne zmiany w tabeli równo-
ważnych dawek dobowych glikokortykosteroi-
dów wziewnych, zarówno u dzieci, jak i doro-
słych.
11. Zmieniono 6częściowy program leczenia
astmy, przedstawiony szczegółowo we wcześniej-
szych wersjach raportu. Obecnie program ten
obejmuje 5 składowych:
składowa 1 – wypracowanie partnerskiej relacji
między pacjentem i lekarzem
składowa 2 – identyfikacja czynników ryzyka
i zmniejszenie ekspozycji na te czynniki
składowa 3 – ocena kontroli astmy, leczenie
w celu jej osiągnięcia i monitorowanie
składowa 4 – leczenie zaostrzeń astmy
składowa 5 – sytuacje szczególne.
12. Włączenie składowej 1 odzwierciedla fakt,
że skuteczne leczenie astmy wymaga wypraco-
wania partnerskiej relacji między osobą z ast-
mą i opiekującymi się nią pracownikami opieki
zdrowotnej (oraz z rodzicami lub opiekunami
w przypadku dzieci chorych na astmę). Relacja ta
powstaje i umacnia się, gdy pacjenci i ich lekarze
omawiają i uzgadniają cele leczenia, opracowują
w formie pisemnej indywidualny plan samodziel-
nego postępowania obejmujący samodzielne mo-
nitorowanie astmy i okresowo analizują leczenie
i poziom kontroli astmy. Edukacja pozostaje za-
sadniczym elementem wszelkich interakcji mię-
dzy pracownikami opieki zdrowotnej a pacjen-
tem.
13. Składowa 3 przedstawia ogólną koncepcję
leczenia astmy zorientowanego na kontrolę ast-
my. Leczenie rozpoczyna się i dostosowuje w cią-
głym cyklu (ocena kontroli astmy, leczenie w celu
uzyskania kontroli i monitorowanie w celu jej
utrzymania) napędzanym przez zmiany w kon-
troli astmy u chorego.
14. Możliwości leczenia zostały ujęte w 5 stop-
ni odzwierciedlających zwiększającą się intensyw-
ność terapii (wielkość dawek lub liczbę leków)
koniecznych do uzyskania kontroli astmy. Na
każdym stopniu powinno się stosować leki doraź-
ne, przyjmowane w razie potrzeby. Na stopniach
2–5 dostępne są różne leki kontrolujące przebieg
astmy.
15. Jeśli aktualnie stosowane leczenie nie za-
pewnia kontroli astmy, powinno się je zintensy-
fikować aż do uzyskania kontroli. Gdy kontrola
jest utrzymana, intensywność leczenia można
zmniejszyć w celu określenia najniższego stopnia
i dawek leków zapewniających kontrolę.
16. Każda składowa zawiera wskazówki doty-
czące postępowania dla wszystkich grup wieko-
wych, jeśli takie rozróżnienie uznano za właści-
we, jednak szczególne trudności spotyka się przy
formułowaniu zaleceń odnośnie do leczenia astmy
u dzieci w wieku do 5 lat. W związku z tym przy-
gotowano i umieszczono na końcu tego wprowa-
dzenia podsumowanie informacji dotyczących

WYTYCZNE
Wprowadzenie
rozpoznania i leczenia astmy w tej bardzo młodej
grupie wiekowej.
17. Wykazano w różnych warunkach, że opie-
ka nad chorymi zgodna z wytycznymi postępo-
wania w astmie opartymi na danych naukowych
daje lepsze wyniki. Jednakże aby uzyskać zmia-
ny w praktyce medycznej, a następnie poprawę
wyników leczenia chorych, wytyczne muszą być
wdrożone i rozpowszechnione na poziomie ogól-
nokrajowym i lokalnym. Dodano więc rozdział
poświęcony wdrażaniu wytycznych postępowa-
nia w astmie w systemach opieki zdrowotnej,
w którym szczegółowo opisano proces i ekonomi-
kę wdrażania wytycznych.
Klasyfikacja jakości danych naukowych
W niniejszym dokumencie (w rozdziale 4) odpo-
wiednim zaleceniom dotyczącym postępowania
przypisano poziom jakości danych naukowych
– czcionką wytłuszczoną w nawiasach po odnoś-
nym stwierdzeniu, na przykład (
jakość danych
A). Starannie rozważono zagadnienia metodolo-
giczne związane z wykorzystywaniem danych po-
chodzących z metaanaliz.
1
Klasyfikacja jakości danych (
ryc. A) była sto-
sowana tak we wcześniejszych raportach GINA,
jak i podczas prac nad niniejszym dokumentem.
Ostatnio Komitetowi Naukowemu GINA przed-
stawiono nowe podejście do klasyfikowania jako-
ści danych.
2
Komitet planuje rozważenie tego po-
dejścia w przyszłych raportach i rozszerzenia go
na aspekty diagnostyczne.
Piśmiennictwo
1. Jadad A.R., Moher M., Browman G.P., Booker L., Sigouis C., Fuentes M., et al.:
Systematic reviews and meta-analyses on treatment of asthma: critical evaluation.
BMJ, 2000; 320: 537–540
2. Guyatt G., Vist G., Falck-Ytter Y., Kunz R., Magrini N., Schunemann H.: An emerging
consensus on grading recommendations? Available from URL: http://www.evidence-
basedmedicine.com
Ryc. A. Klasyfikacja jakości (wiarygodności) danych
Kategoria Źródła danych
Definicja
A
badania
z randomizacją,
liczne dane
Dane pochodzą z prawidłowo zaplanowanych badań z randomizacją, których wyniki
są zgodne i uzyskane w populacji, której dotyczy zalecenie. Kategorię A przyznaje się
wówczas, gdy dostępne są dane z większej liczby badań, przeprowadzonych w dużych
grupach chorych.
B
badania
z randomizacją,
nieliczne dane
Dane pochodzą z badań interwencyjnych przeprowadzonych w niewielkich grupach
chorych, z analizy wyników badań z randomizacją przeprowadzonej post hoc lub
w podgrupach, albo z metaanalizy badań z randomizacją. Kategorię B przyznaje
się wówczas, gdy dostępne badania z randomizacją są nieliczne, gdy przeprowadzono
je w niewielkich grupach chorych bądź w populacji różniącej się od tej, której dotyczy
zalecenie, albo gdy wyniki badań nie są w pełni zgodne.
C
badania bez
randomizacji,
badania
obserwacyjne
Dane pochodzą z badań bez grupy kontrolnej lub bez randomizacji albo z badań
obserwacyjnych.
D
uzgodniona opinia
grupy ekspertów
Kategorię tę wykorzystuje się tylko wówczas, gdy sformułowanie pewnych wskazówek
postępowania uznano za cenne, natomiast dane z piśmiennictwa dotyczące
określonego zagadnienia są niewystarczające, by zaliczyć je do wyższej kategorii.
Uzgodniona opinia ekspertów opiera się na doświadczeniu klinicznym lub wiedzy,
która nie spełnia wyżej wymienionych kryteriów.

WYTYCZNE
MEDYCYNA PRAKTYCZNA WYDANIE SPECJALNE 1/2007
Podsumowanie postępowania
w astmie u dzieci w wieku lat
i młodszych
Wprowadzenie
Od czasu opublikowania pierwszych wytycznych
postępowania w astmie ponad 30 lat temu pano-
wała tendencja do opracowywania zunifikowa-
nych wytycznych obejmujących wszystkie grupy
wiekowe. Do takiego podejścia skłoniły następują-
ce fakty: ustalenie, że we wszystkich przypadkach
astmy występują wspólne mechanizmy patogene-
tyczne i zapalne; dane naukowe wykazały sku-
teczność głównych leków kontrolujących przebieg
astmy i leków stosowanych doraźnie; dążenie do
ujednolicenia postępowania leczniczego u cho-
rych na astmę w różnym wieku. Takie podejście
pozwala uniknąć powtarzania szczegółowych in-
formacji, które są wspólne dla wszystkich chorych
na astmę. Istnieje stosunkowo niewiele danych
dotyczących postępowania w astmie u dzieci,
a w wytycznych na ogół ekstrapolowano dane
uzyskane u młodzieży i dorosłych.
Niniejsza rewizja Światowej Strategii Rozpo-
znawania, Leczenia i Prewencji Astmy i tym ra-
zem dostarcza jednolitego tekstu jako dokumentu
źródłowego. Każdy rozdział ma oddzielne podroz-
działy ze szczegółowymi informacjami i wskazów-
kami odnośnie do postępowania w określonych
grupach wiekowych, jeśli takie rozróżnienie było
właściwe. Te grupy wiekowe to: dzieci w wieku
5 lat i młodsze (niekiedy nazywane dziećmi w wie-
ku przedszkolnym), dzieci w wieku ponad 5 lat,
młodzież, dorośli i osoby w podeszłym wieku.
Większość różnic pomiędzy tymi grupami wieko-
wymi wynika z naturalnego przebiegu choroby
oraz z chorób współistniejących, ale są też ważne
różnice w postępowaniu diagnostycznym, sposo-
bach oceny ciężkości choroby i monitorowania jej
kontroli, w odpowiedzi na różne leki, w sposobach
angażowania chorego i jego rodziny w opracowa-
nie i realizację planu leczenia oraz w problemach
psychospołecznych na różnych etapach życia.
Szczególne problemy, jakie trzeba brać pod
uwagę w postępowaniu z dziećmi w pierwszych
5 latach życia, dotyczą trudności w rozpoznaniu
astmy, udokumentowania skuteczności i bezpie-
czeństwa stosowanych leków i urządzeń do ich
podawania, jak również braku danych na temat
nowych sposobów leczenia. Dzieci te często są le-
czone przez pediatrów, którzy na co dzień mają
do czynienia z przeróżnymi problemami związa-
nymi z chorobami wieku dziecięcego. Dlatego też
dla wygody czytelników podsumowano tu infor-
macje z różnych rozdziałów raportu odnoszące się
do rozpoznania i leczenia astmy u dzieci w wieku
5 lat i młodszych. Informacje te można również
znaleźć w głównym tekście, wraz ze szczegóło-
wym omówieniem innych danych dotyczących
astmy w tej grupie wiekowej.*
Jak podkreślono w całym raporcie, celem le-
czenia chorych z potwierdzonym rozpoznaniem
astmy we wszystkich grupach wiekowych powin-
no być osiągnięcie i utrzymanie kontroli choroby
(p.
ryc. 4.3-1) przez dłuższy czas, z przykłada-
niem należytej wagi do bezpieczeństwa leczenia,
możliwych skutków niepożądanych oraz kosztu
leczenia koniecznego do osiągnięcia tego celu.
Rozpoznanie astmy u dzieci w wieku
5 lat i młodszych
Świszczący oddech i rozpoznanie astmy
Rozpoznanie astmy u dzieci w wieku 5 lat i młod-
szych stanowi szczególnie trudny problem. Jest to
spowodowane tym, że epizody świszczącego odde-
chu i kaszlu również często występują u dzieci bez
astmy, szczególnie do 3. roku życia. Świszczący
oddech jest zwykle związany z wirusowym zaka-
żeniem układu oddechowego, głównie wirusem
RSV (respiratory syncytial virus) u dzieci do 2.
roku życia i innymi wirusami u starszych dzieci
w wieku przedszkolnym. U dzieci w wieku 5 lat
i młodszych opisano 3 kategorie świszczącego od-
dechu:
1)
przemijające wczesne świsty, z których
dziecko często wyrasta w ciągu pierwszych
3 lat życia. Często są one związane z wcześnia-
ctwem i paleniem tytoniu przez rodziców.
2)
utrzymujące się wczesne świsty (do 3. rż.).
U tych dzieci typowo występują nawracają-
ce epizody świszczącego oddechu związane
* Odwołania do piśmiennictwa i poziomy jakości danych zo
stały usunięte z tego podsumowania, ale można je znaleźć
w głównym tekście.

WYTYCZNE
Podsumowanie postępowania w astmie u dzieci w wieku 5 lat...
z ostrymi zakażeniami wirusowymi układu
oddechowego; dzieci te nie mają cech atopii
ani obciążającego wywiadu rodzinnego w kie-
runku atopii. Objawy podmiotowe utrzymują
się u nich zwykle przez okres szkolny i u dużej
części występują jeszcze w wieku 12 lat. Przy-
czyną epizodów świszczącego oddechu u dzieci
do 2. roku życia jest zwykle zakażenie wirusem
RSV, natomiast u dzieci w wieku 2–5 lat domi-
nują inne wirusy.
3)
świsty o późnym początku lub astma. Dzie-
ci te chorują na astmę, która często utrzymuje
się przez okres dzieciństwa i w wieku dorosłym.
Typowo mają one wywiad atopowy, często wy-
prysk oraz zmiany patologiczne w drogach
oddechowych charakterystyczne dla astmy.
Na astmę mocno wskazują następujące objawy:
częste epizody świstów (częściej niż raz w miesią-
cu), kaszel lub świsty wywoływane przez aktyw-
ność fizyczną, kaszel występujący w nocy niezwią-
zany z zakażeniem wirusowym, niewystępowanie
sezonowej zmienności świstów oraz utrzymywa-
nie się objawów po 3. roku życia. Wykazano, że
wystąpienie astmy w późnym dzieciństwie można
przewidywać na podstawie prostego wskaźnika
klinicznego, uwzględniającego występowanie świ-
stów przez 3. rokiem życia oraz jednego dużego
czynnika ryzyka (astma lub wyprysk u rodziców)
albo 2 z 3 małych czynników ryzyka (eozynofilia,
świszczący oddech bez przeziębienia, alergiczny
nieżyt nosa).
Trzeba rozważyć i wykluczyć alternatywne
przyczyny nawracających świstów, do których na-
leżą:
1) przewlekłe zapalenie błony śluzowej nosa i za-
tok przynosowych
2) refluks żołądkowoprzełykowy
3) nawracające zakażenia wirusowe dolnych
dróg oddechowych
4) mukowiscydoza
5) dysplazja oskrzelowopłucna
6) gruźlica
7) wady wrodzone powodujące zwężenie dróg od-
dechowych wewnątrz klatki piersiowej
8) aspiracja ciała obcego
9) zespół pierwotnej dyskinezji rzęsek
10) niedobory odporności
11) wrodzona choroba serca.
Wystąpienie objawów w okresie noworodko-
wym (z towarzyszącym zahamowaniem wzrasta-
nia), wymiotów lub miejscowych płucnych lub
sercowonaczyniowych objawów przedmiotowych
przemawia za alternatywnym rozpoznaniem
i wskazuje na potrzebę dalszych badań diagno-
stycznych.
Badania w celu rozpoznania
i monitorowania choroby
U dzieci w wieku 5 lat i młodszych rozpoznanie
astmy musi się opierać głównie na ocenie klinicz-
nej objawów podmiotowych i przedmiotowych.
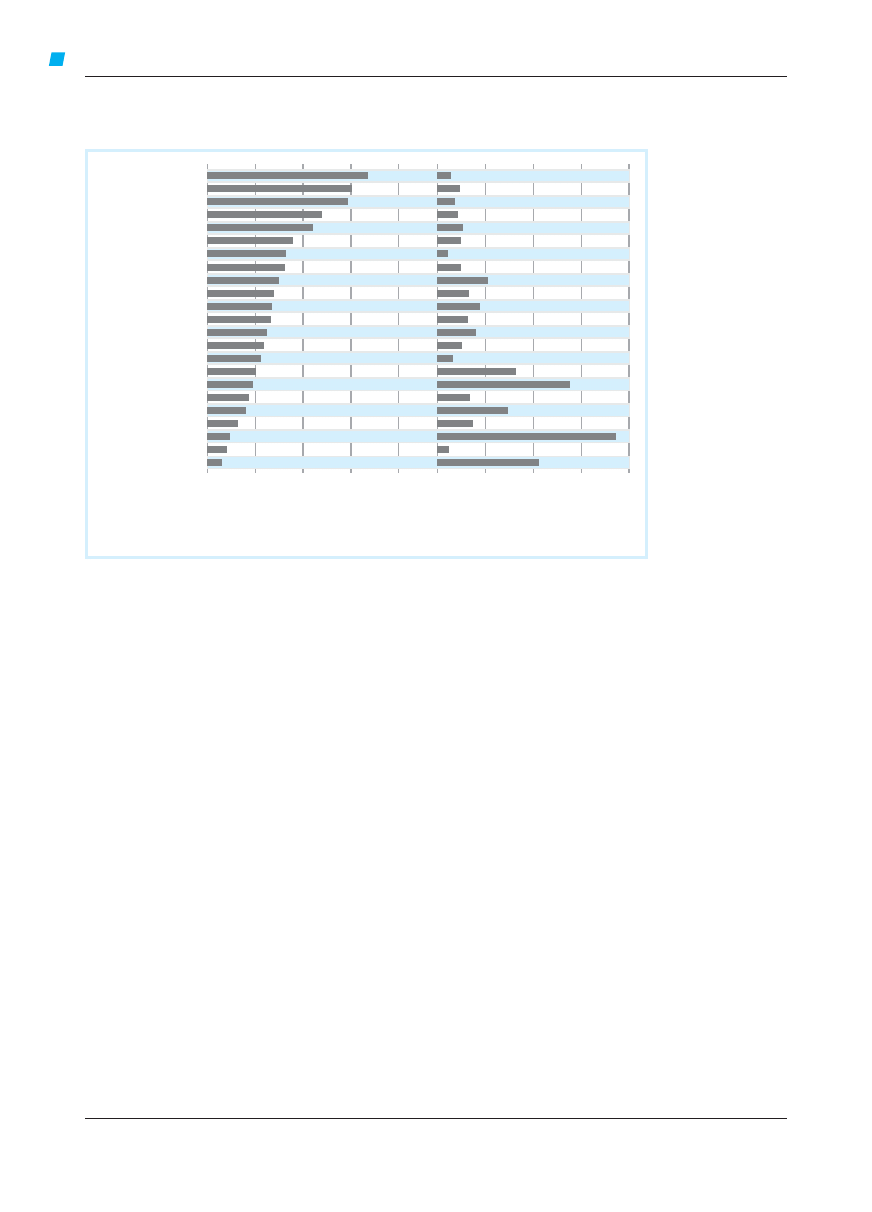
Ryc. 4.3-1. Stopnie kontroli astmy
Kryterium
Kontrolowana
(wszystkie kryteria
spełnione)
Częściowo kontrolowana
(≥1 kryterium spełnione
w ≥1 tyg.)
Niekontrolowana
objawy dzienne
nie występują
(
≤2/tyg.)
>2/tyg.
≥3 kryteria astmy częściowo
kontrolowanej spełnione
w którymkolwiek tygodniu
ograniczenie aktywności
życiowej
nie ma
jakiekolwiek
objawy nocne, przebudzenia
nie występują
jakiekolwiek
potrzeba leczenia doraźnego
(ratunkowego)
nigdy (
≤2/tyg.)
>2/tyg.
czynność płuc (PEF lub FEV
)
a
prawidłowa
<80% wn. lub wm. (jeśli jest znana)
zaostrzenia
nie występują
≥1/rok
b
1 w każdym tygodniu
c
a
Czynność płuc nie jest wiarygodnym kryterium u dzieci w wieku
≤5 lat.
b
Po każdym zaostrzeniu powinno się niezwłocznie ocenić leczenie podtrzymujące w celu upewnienia się, czy jest wystarczające.
c
Każdy tydzień z zaostrzeniem astmy uznaje się za tydzień z astmą niekontrolowaną.
wm. – wartość maksymalna dla chorego, wn. – wartość należna

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA WYDANIE SPECJALNE 1/2007
Przydatną metodą służącą do potwierdzenia roz-
poznania astmy w tej grupie wiekowej jest próbne
leczenie krótko działającymi lekami rozszerzają-
cymi oskrzela i glikokortykosteroidami wziewny-
mi. Wyraźna poprawa kliniczna w czasie leczenia
i pogorszenie po jego zaprzestaniu potwierdza
rozpoznanie astmy. Metody diagnostyczne zaleca-
ne dla dzieci starszych i dorosłych, takie jak po-
miary nadreaktywności dróg oddechowych i ozna-
czanie markerów zapalenia dróg oddechowych są
trudne, a niektóre wymagają skomplikowanego
sprzętu,
41
co sprawia, że nie nadają się do rutyno-
wego stosowania. Ponadto badania czynnościowe
płuc – zwykle stanowiące podstawę rozpoznania
i monitorowania astmy – są często niewiarygod-
ne u małych dzieci. Dzieci w wieku 4–5 lat moż-
na nauczyć używania miernika PEF, ale pomiary
muszą być nadzorowane przez rodziców, aby ich
wyniki były wiarygodne.
Kontrola astmy
Pojęcie „kontrola astmy” odnosi się do kontroli
klinicznych objawów choroby. Roboczy, jeszcze
niezweryfikowany podział oparty na aktualnych
poglądach, wyróżnia astmę kontrolowaną, częś-
ciowo kontrolowaną i niekontrolowaną. Leczenie
często pozwala uzyskać pełną kontrolę astmy; ce-
lem leczenia powinno być osiągnięcie i utrzyma-
nie tej kontroli przez dłuższy czas, z należytym
uwzględnieniem bezpieczeństwa leczenia, możli-
wych skutków niepożądanych oraz kosztu lecze-
nia koniecznego do osiągnięcia tego celu.
Leki przeciwastmatyczne
(Szczegółowe informacje podstawowe na te-
mat leków przeciwastmatycznych stosowa-
nych u dzieci we wszystkich grupach wieko-
wych znajdują się w rozdziale 3).
Podstawę leczenia astmy u dzieci w każdym
wieku stanowią leki wziewne. Niemal wszystkie
dzieci można nauczyć skutecznego stosowania te-
rapii wziewnej. Różne grupy wiekowe wymagają
stosowania różnego typu inhalatorów, aby lecze-
nie było skuteczne, tak więc wybór inhalatora
musi być zindywidualizowany (rozdz. 3,
ryc. 3-3).
Leki kontrolujące przebieg choroby
Glikokortykosteroidy wziewne
Leczenie dzieci w wieku 5 lat i młodszych gliko-
kortykosteroidami wziewnymi na ogół daje po-
dobne efekty kliniczne jak u dzieci starszych, ale
zależność między dawką a odpowiedzią jest w tej
grupie wiekowej słabiej przebadana. Odpowiedź
kliniczna na glikokortykosteroidy wziewne może
zależeć od typu inhalatora i umiejętności dzie-
cka właściwego posługiwania się nim. Budezonid
w dawkach dobowych ≤400 µg lub inny glikokor-
tykosteroid w dawce równoważnej, przyjmowany
wziewnie z użyciem komory inhalacyjnej (zwanej
też przystawką lub spejserem [od ang. spacer]),
przynosi prawie maksymalne korzyści u większo-
ści chorych. Stosowanie glikokortykosteroidów
wziewnych nie powoduje remisji astmy, a objawy
podmiotowe nawracają po zaprzestaniu leczenia.
Korzyści kliniczne z przerywanego stosowa-
nia glikokortykosteroidów ogólnoustrojowo lub
wziewnie u dzieci z nawracającym świszczącym
oddechem wywoływanym przez zakażenia wi-
rusowe są kontrowersyjne. Niektóre badania
u starszych dzieci wykazały niewielkie korzyści,
natomiast w badaniu przeprowadzonym u dzie-
ci młodszych nie stwierdzono wpływu na wystę-
powanie świszczącego oddechu. Nie ma danych
uzasadniających przewlekłe stosowanie glikokor-
tykosteroidów wziewnych w małej dawce w celu
zapobiegania przemijającym wczesnym świstom.
Leki przeciwleukotrienowe
Korzyści kliniczne z monoterapii lekami przeciw-
leukotrienowymi wykazano u dzieci w wieku >2
lat. Leki przeciwleukotrienowe zmniejszają czę-
stość zaostrzeń astmy wywoływanych przez zaka-
żenia wirusowe u dzieci w wieku 2–5 lat z astmą
sporadyczną. U dzieci nie stwierdzono działań
niepożądanych związanych z lekami przeciwleu-
kotrienowych.
Teofilina
Wyniki kilku badań przeprowadzonych u dzieci
w wieku 5 lat i młodszych wskazują na pewne ko-
rzyści kliniczne ze stosowania teofiliny. Jednakże
skuteczność teofiliny jest mniejsza w porówna-
niu z glikokortykosteroidami wziewnymi w małej
dawce, a skutki uboczne są większe.

WYTYCZNE
Podsumowanie postępowania w astmie u dzieci w wieku 5 lat...
Inne leki kontrolujące przebieg astmy
Dotychczas nie przebadano odpowiednio stosowa-
nia długo działających β
2
-mimetyków wziewnych
(oddzielnie lub w preparatach złożonych) u dzieci
w wieku 5 lat i młodszych. Badania nad stosowa-
niem kromonów w tej grupie wiekowej są nielicz-
ne, a ich wyniki na ogół negatywne. Ze względu
na skutki uboczne długotrwałego stosowania
glikokortykosteroidów doustnych u dzieci z ast-
mą powinno się je ograniczyć do leczenia ciężkich
zaostrzeń wywołanych przez zakażenie wirusowe
lub inne czynniki.
Leki doraźne
Szybko działające β
2
mimetyki wziewne są najsku-
teczniejszymi z dostępnych leków rozszerzających
oskrzela i dlatego preferuje się je w napadach ast-
my u dzieci we wszystkich grupach wiekowych.
Leczenie i prewencja astmy
Strategia leczenia i prewencji astmy, mająca na
celu osiągnięcie i utrzymanie kontroli astmy przez
dłuższy czas, obejmuje 5 wzajemnie powiązanych
składowych: 1) wypracowanie partnerskiej rela-
cji między pacjentem i lekarzem; 2) identyfikację
czynników ryzyka i zmniejszenie ekspozycji na te
czynniki; 3) ocenę kontroli astmy, leczenie w celu
jej osiągnięcia i monitorowanie; 4) leczenie zaost-
rzeń astmy; 5) sytuacje szczególne.
Składowa 1: wypracowanie partnerskiej relacji
między pacjentem i lekarzem
Edukacja powinna być integralną częścią wszyst-
kich interakcji między lekarzami i pacjentami.
W przypadku małych dzieci edukacja będzie skon-
centrowana na ich rodzicach i opiekunach, nato-
miast już dzieci w wieku 3 lat można nauczyć pro-
stych umiejętności potrzebnych w postępowaniu
w astmie.
Składowa 2: identyfikacja czynników ryzyka
i zmniejszenie ekspozycji na te czynniki
Interwencje farmakologiczne są bardzo skuteczne
w kontrolowaniu objawów podmiotowych i popra-
wie jakości życia u chorych na astmę, niemniej jed-
nak zawsze – jeśli tylko jest to możliwe – powinno
się wdrażać metody zapobiegania rozwojowi ast-
my oraz występowaniu objawów podmiotowych
i zaostrzeń choroby poprzez unikanie narażenia
na czynniki ryzyka lub zmniejszenie tego naraże-
nia – w szczególności dotyczy to narażenia na dym
tytoniowy.
U dzieci po 3. roku życia z ciężką astmą za-
leca się szczepienie przeciwko grypie co roku lub
przynajmniej wtedy, kiedy zaleca się szczepienie
populacji ogólnej. Jednakże rutynowe szczepienie
przeciwko grypie dzieci z astmą nie chroni ich
przed zaostrzeniami astmy ani nie poprawia kon-
troli astmy.
Składowa 3: ocena kontroli astmy, leczenie
w celu jej osiągnięcia i monitorowanie
Cel leczenia astmy – uzyskanie i utrzymanie
kontroli klinicznej – można osiągnąć u większo-
ści chorych, stosując leczenie farmakologiczne
uzgodnione przez pacjenta, jego rodzinę i lekarza.
Leczenie omówiono w
rozdziale 4, składowa 3
–
ryc. 4.3-2.
Dostępne piśmiennictwo dotyczące leczenia
astmy u dzieci w wieku 5 lat i młodszych wyklucza
sformułowanie szczegółowych zaleceń. Najlepiej
udokumentowane leczenie kontrolujące astmę
w tych grupach wiekowych to stosowanie gliko-
kortykosteroidów wziewnych; w stopniu 2 zaleca
się jako leczenie wstępne stosowanie glikokorty-
kosteroidu wziewnego w małej dawce. Równo-
ważne dawki glikokortykosteroidów wziewnych
(niektóre z nich można podawać raz dziennie) dla
dzieci w wieku 5 lat i młodszych podano w
roz-
dziale 3 (ryc. 3-4).
Jeśli glikokortykosteroidy wziewne stosowane
w małych dawkach nie kontrolują objawów pod-
miotowych, najlepszym rozwiązaniem może być
zwiększenie dawki glikokortykosteroidu. Powinno
się wnikliwie sprawdzać technikę inhalacji leku,
gdyż w tej grupie wiekowej może być ona słaba.
Leczenie skojarzone – dodanie β
2
-mimetyku
długo działającego, leku przeciwleukotrienowego
lub teofiliny, gdy astma nie jest dobrze kontrolo-
wana przez glikokortykosteroidy wziewne stoso-
wane w średnich dawkach – nie zostało przebada-
ne u dzieci w wieku 5 lat i młodszych.
Przerywane leczenie glikokortykosteroidem
wziewnym jest co najwyżej tylko marginalnie sku-
teczne. Optymalne leczenie świszczącego oddechu
wywołanego przez zakażenie wirusowe u dzieci
z przemijającymi wczesnymi świstami (bez ast-

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA WYDANIE SPECJALNE 1/2007
my) nie jest znane. Żaden z obecnie dostępnych
leków przeciwastmatycznych nie przynosił prze-
konujących efektów u tych dzieci.
Czas trwania i modyfikacja leczenia
Objawy podmiotowe astmy ustępują samoistnie
u znacznej części dzieci w wieku 5 lat i młodszych.
Dlatego też potrzeba ciągłego leczenia astmy
w tej grupie wiekowej wymaga oceny przynajmniej
2 razy do roku.
Składowa 4: leczenie zaostrzeń astmy
Zaostrzenia astmy (napady astmy) to epizody na-
rastającej duszności, kaszlu, świszczącego odde-
chu lub ściskania w klatce piersiowej, bądź kom-
binacji tych objawów. Ciężkie zaostrzenia mogą
zagrażać życiu, a ich leczenie wymaga ścisłego
nadzoru. Chorych z ciężkimi zaostrzeniami po-
winno się nakłaniać do niezwłocznego zgłoszenia
się do swojego lekarza lub – w zależności od orga-
nizacji lokalnej opieki medycznej – do najbliższego
szpitala zapewniającego doraźne leczenie chorych
z napadem astmy.
Ocena. Kilka różnic w budowie i fizjologii płuc
sprawia, że niemowlęta są teoretycznie obciążone
większym ryzykiem wystąpienia niewydolności
oddechowej niż starsze dzieci. Mimo to niewydol-
ność oddechowa rzadko występuje u niemowląt.
Ścisłe monitorowanie z użyciem różnych para-
metrów innych niż PEF (
rozdz. 4, składowa 4:
ryc. 4.4-1) pozwoli na dość dokładną ocenę stanu
chorego dziecka. Duszność na tyle ciężka, że unie-
możliwia karmienie, jest ważnym objawem zagra-
żającej niewydolności oddechowej.
Wysycenie hemoglobiny krwi tętniczej tlenem
(SaO
2
), które powinno się mierzyć u niemowląt
za pomocą pulsoksymetru, prawidłowo przekra-
cza 95%. Wykonanie gazometrii krwi tętniczej
lub arterializowanej krwi włośniczkowej powinno
się rozważyć u tych niemowląt z SaO
2
<90% przy
oddychaniu mieszaniną oddechową o dużym stę-
żeniu tlenu, których stan się pogarsza. Nie zaleca
się rutynowego wykonywania radiogramów klatki
piersiowej, chyba że się stwierdzi objawy przed-
miotowe nasuwające podejrzenie choroby miąż-
szu płucnego.
Leczenie. W celu osiągnięcia SaO
2
≥95% po-
winno się podawać tlen przez cewnik donosowy,
maskę lub – rzadko – z użyciem budki tlenowej
u niektórych niemowląt. Szybko działające β
2
-
mimetyki wziewne powinno się podawać w re-
gularnych odstępach czasu. Leczenie skojarzone
β
2
-mimetykiem i lekiem przeciwcholinergicznym
wiąże się z mniejszą częstością hospitalizacji oraz
większą poprawą PEF i FEV
1
. Jeśli dziecko z ast-
mą zostanie przyjęte do szpitala po intensyw-
nym leczeniu doraźnym, to dodanie w nebulizacji
bromku ipratropium do β
2
-mimetyku i glikokor-
tykosteroidu podawanego ogólnoustrojowo nie
przynosi dodatkowych korzyści.
Wobec skuteczności i względnego bezpieczeń-
stwa stosowania szybko działających β
2
-mime-
tyków wziewnych teofilina odgrywa niewielką
rolę w leczeniu zaostrzeń astmy. Stosowanie tego
leku wiąże się z ciężkimi, potencjalnie śmiertel-
nymi skutkami ubocznymi, szczególnie u chorych
przyjmujących przewlekle teofilinę w postaci o po-
wolnym uwalnianiu, a jej efekt bronchodylatacyj-
ny jest mniejszy niż β
2
mimetyków. W jednym ba-
daniu przeprowadzonym u dzieci z zaostrzeniem
astmy zagrażającym życiu dożylne stosowanie
teofiliny przyniosło dodatkowe korzyści u cho-
rych otrzymujących również β
2
-mimetyk wziew-
nie i dożylnie, bromek ipratropium wziewnie oraz
glikokortykosteroid dożylnie. Nie przeprowadzo-
no badań nad zastosowaniem siarczanu magne-
zu podawanego dożylnie u dzieci w wieku 5 lat
i młodszych.
U dzieci z astmą przewlekłą lekką w leczeniu
zaostrzeń odpowiednia dawka doustna glikokor-
tykosteroidu wynosi 1 mg/kg/d. Za na ogół właś-
ciwe uważa się leczenie przez 3–5 dni. Aktualne
dane wskazują, że nie ma korzyści ze stopniowe-
go zmniejszania dawki glikokortykosteroidu do-
ustnego, ani w krótkim czasie, ani w ciągu kilku
tygodni. Niektóre badania wykazały, że glikokor-
tykosteroidy wziewne w dużych dawkach, poda-
wane często w ciągu dnia, są skuteczne w leczeniu
zaostrzeń, ale potrzeba więcej badań, zanim bę-
dzie można zalecić takie postępowanie.
Kryteria wypisania z oddziału pomocy doraź-
nej albo przyjęcia do szpitala dla dzieci przyjmo-
wanych do oddziałów leczenia stanów nagłych
z powodu zaostrzenia astmy podano w
rozdziale
4 (Składowa 4).

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
9
Rozdział 1. Definicja i ogólna
charakterystyka
W tym rozdziale omówiono szereg zagadnień
związanych z astmą, w tym definicję, obciążenia
związane z tą chorobą, czynniki wpływające na
ryzyko jej rozwoju oraz jej mechanizmy. Celem
rozdziału nie jest całościowe potraktowanie tych
zagadnień, lecz raczej krótkie przedstawienie
podstaw, uzasadniających postępowanie diagno-
styczne i terapeutyczne omówione szczegółowo
w następnych rozdziałach. Więcej informacji moż-
na znaleźć w artykułach przeglądowych i innych
wymienionych na końcu rozdziału.
Definicja
Astma jest chorobą definiowaną na podstawie
cech klinicznych, fizjologicznych i patologicznych.
W wywiadzie chorobowym dominują epizody
duszności, szczególnie występujące w nocy, któ-
rym często towarzyszy kaszel. Najczęściej stwier-
dzanym objawem przedmiotowym są świsty sły-
szalne podczas osłuchiwania klatki piersiowej.
Główną cechą czynnościową astmy są epizody
obturacji oskrzeli powodującej ograniczenie wyde-
chowego przepływu powietrza. Główną cechą pa-
tologiczną jest zapalenie dróg oddechowych, któ-
remu niekiedy towarzyszą zmiany strukturalne.
W patogenezie astmy istotną rolę odgrywają
czynniki genetyczne i środowiskowe, ale ponieważ
patogeneza tej choroby nie jest jasna, definiuje się
ją głównie opisowo. Na podstawie czynnościowych
następstw zapalenia dróg oddechowych sformuło-
wano następującą roboczą definicję astmy:
Astma jest przewlekłą chorobą zapalną
dróg oddechowych, w której uczestniczy
wiele komórek i substancji przez nie uwal-
nianych. Przewlekłemu zapaleniu towarzy-
szy nadreaktywność oskrzeli, prowadząca
do nawracających epizodów świszczące-
go oddechu, duszności, uczucia ściskania
w klatce piersiowej i kaszlu, występujących
szczególnie w nocy lub nad ranem. Epizo-
dom tym zwykle towarzyszy rozlane, zmien-
ne ograniczenie przepływu powietrza w płu-
cach, często ustępujące samoistnie lub pod
wpływem leczenia.
Ponieważ fenotyp astmy nie jest dokładnie
określony, badacze starający się poznać rozwój
tej złożonej choroby posługują się cechami, które
można obiektywnie zmierzyć, takimi jak: atopia
(manifestująca się dodatnimi wynikami skórnych
testów punktowych lub kliniczną odpowiedzią na
pospolite alergeny środowiskowe), nadreaktyw-
ność dróg oddechowych (skłonność dróg oddecho-
wych do nadmiernego zwężania się w odpowie-
dzi na bodźce, które mają co najwyżej niewielki
wpływ u osób zdrowych) i inne wskaźniki uczu-
lenia. Związek między astmą i atopią jest dobrze
udokumentowany, ale dokładne powiązania mię-
dzy tymi dwoma stanami nie zostały jasno i wy-
czerpująco określone.
Obecnie istnieją przekonujące dowody na to, że
kliniczne objawy astmy – objawy podmiotowe, za-
Główne punkty
n
Astma jest przewlekłą chorobą zapalną dróg od-
dechowych, w której uczestniczy wiele komórek
i substancji przez nie uwalnianych. Przewlekłemu
zapaleniu towarzyszy nadreaktywność oskrzeli,
prowadząca do nawracających epizodów świsz-
czącego oddechu, duszności, uczucia ściskania
w klatce piersiowej i kaszlu, występujących szcze-
gólnie w nocy lub nad ranem. Epizodom tym
zwykle towarzyszy rozlane, zmienne ogranicze-
nie przepływu powietrza w płucach, często ustę-
pujące samoistnie lub pod wpływem leczenia.
n
Kliniczne objawy astmy można kontrolować,
stosując właściwe leczenie. Gdy astma jest pod
kontrolą, napady astmy powinny występować
tylko sporadycznie, a ciężkie zaostrzenia – rzad-
ko. Astma jest problemem ogólnoświatowym;
szacuje się, że chorobą tą dotkniętych jest 300
mln osób.
n
Chociaż z perspektywy pacjenta i całego społe-
czeństwa koszt kontroli astmy wydaje się duży,
to koszt niestosowania właściwego leczenia ast-
my jest jeszcze większy.
n
Zidentyfikowano kilka czynników wpływających
na ryzyko rozwoju astmy. Czynniki te można po-
dzielić na osobnicze (głównie genetyczne) i śro-
dowiskowe.
n
Spektrum kliniczne astmy jest bardzo zróżnico-
wane i zaobserwowano dominację różnych ro-
dzajów komórek, ale stałą cechą pozostaje zapa-
lenie dróg oddechowych.
WYTYCZNE
20
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
burzenia snu, ograniczenie dziennej aktywności,
upośledzenie czynności płuc i stosowanie leków
doraźnych – można kontrolować, stosując właś-
ciwe leczenie. Gdy astma jest pod kontrolą, obja-
wy podmiotowe powinny występować co najwyżej
sporadycznie, a ciężkie zaostrzenia – rzadko.
1
Obciążenia związane z astmą
Częstość występowania, chorobowość
i umieralność
Astma jest problemem na całym świecie, a liczbę
chorych szacuje się na 300 mln.
2,3
Pomimo setek
doniesień na temat występowania astmy w bar-
dzo różnych populacjach brak precyzyjnej i po-
wszechnie przyjętej definicji astmy sprawia, że
wiarygodne porównanie opisywanych częstości
występowania astmy w różnych częściach świata
jest problematyczne. Niemniej jednak na podsta-
wie wystandaryzowanych pomiarów częstości wy-
stępowania astmy i świszczącego oddechu u dzie-
ci
3
i dorosłych
4
chorobowość na świecie ocenia się
na 1–18% w populacjach różnych krajów (
ryc.
1-1)
2,3
. Istnieją przekonujące dane, że częstość
występowania astmy wzrasta w niektórych kra-
jach
46
, a w innych wzrosła ostatnio, ale obecnie
utrzymuje się na stałym poziomie
7,8
. Światowa
Organizacja Zdrowia szacuje liczbę utraconych
z powodu astmy lat z uwzględnieniem niespraw-
ności (disability adjusted life years – DALY) na 15
mln, co stanowi 1% globalnego obciążenia choro-
bami.
2
Liczbę zgonów z powodu astmy na świecie
szacuje się na 250 000 rocznie, a umieralność nie
wykazuje dobrej korelacji z chorobowością (
ryc.
1-1).
2,3
Nie ma wystarczających danych do wy-
jaśnienia prawdopodobnych przyczyn opisanych
różnic w częstości występowania astmy w obrębie
populacji i między populacjami.
Obciążenie społeczne i ekonomiczne
Aby zrozumieć astmę i jej leczenie, trzeba uwzględ-
nić czynniki społeczne i ekonomiczne widziane
z perspektywy indywidualnego chorego, pracow-
nika opieki zdrowotnej lub instytucji płacącej za
opiekę zdrowotną. Absencja w szkole i utracone
dni pracy zawodowej stanowią znaczące społeczne
i ekonomiczne konsekwencje astmy w badaniach
przeprowadzonych w Azji i krajach Pacyfiku,
w Indiach, Ameryce Łacińskiej, Wielkiej Brytanii
i w USA.
9-12
Finansowe koszty astmy oszacowane
Walia
Nowa Zelandia
Irlandia
Kostaryka
USA
Izrael
Ekwador
Czechy
Kolumbia
Francja
Japonia
Tajlandia
Belgia
Hiszpania
Estonia
Singapur
Uzbekistan
Łotwa
Korea Południowa
Dania
Rosja
Grecja
Albania
odsetek osób chorych na astmę
w populacji (%)
zgodę na wykorzystanie tej ryciny uzyskano od J. Bousqueta
śmiertelność na 100 000 osób
chorych na astmę
0
5
10
15
20
0
5
10
15
20
Ryc. 1-1. Chorobo-
wość i śmiertelność
w astmie
2,3

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
2
w różnych systemach opieki zdrowotnej, w tym
w USA
1315
i w Wielkiej Brytanii,
16
są znaczące.
W analizach ekonomicznego obciążenia związane-
go z astmą trzeba zwracać uwagę zarówno na bez-
pośrednie koszty medyczne (hospitalizacje i koszt
leków), jak i na koszty pośrednie niemedyczne
(utrata dni pracy, przedwczesny zgon).
17
Na przy-
kład astma jest ważną przyczyną absencji w pracy
w wielu krajach, w tym w Australii, Szwecji, Wiel-
kiej Brytanii i USA.
16,1820
Porównanie kosztów
leczenia astmy w różnych regionach geograficz-
nych prowadzi do oczywistych wniosków:
1) Koszty leczenia astmy zależą od poziomu jej
kontroli u chorego i od tego, jak skutecznie za-
pobiega się zaostrzeniom.
2) Leczenie stanów nagłych jest droższe niż le-
czenie planowe.
3) Niemedyczne koszty ekonomiczne astmy są
znaczące.
4) Leczenie astmy według wytycznych może być
opłacalne.
5) Leczenie astmy może stanowić znaczne obcią-
żenie finansowe dla rodzin chorych.
Chociaż zarówno z perspektywy chorego, jak
i całego społeczeństwa koszt kontroli astmy wyda-
je się duży, to koszt nieleczenia astmy we właściwy
sposób jest jeszcze większy. Prawidłowe leczenie
choroby jest wyzwaniem dla chorych, dla lekarzy,
instytucji służby zdrowia i rządów państw. Istnieją
wszelkie powody, by sądzić, że znaczące globalne
obciążenie związane z astmą można zdecydowa-
nie zmniejszyć poprzez wysiłki samych chorych,
ich lekarzy, instytucji służby zdrowia oraz rządów
w celu poprawy kontroli astmy.
Szczegółowe informacje źródłowe na temat ob-
ciążeń związanych z astmą można znaleźć w ra-
porcie Global Burden of Asthma* Dalsze badania
nad społecznymi i ekonomicznymi obciążeniami
związanymi z astmą oraz nad opłacalnością lecze-
nia są potrzebne zarówno w krajach rozwiniętych,
jak i rozwijających się.
Czynniki wpływające na rozwój
i ujawnienie się astmy
Czynniki mające wpływ na ryzyko wystąpienia
astmy można podzielić na powodujące rozwój ast-
my i wyzwalające jej objawy kliniczne; niektóre
czynniki wykazują podwójne działanie. Do pierw-
szych należą czynniki osobnicze (głównie gene-
tyczne), a drugie to zwykle czynniki środowiskowe
(
ryc. 1-2).
21
Jednakże mechanizmy wpływu tych
czynników na rozwój i ujawnienie się astmy są
złożone i powiązane ze sobą. Na przykład, warun-
kując podatność na astmę, geny prawdopodobnie
wykazują interakcje zarówno z innymi genami,
jak i z czynnikami środowiskowymi.
22,23
Ponadto
ważnymi czynnikami modyfikującymi ryzyko ast-
my u osoby predysponowanej genetycznie okazują
się czynniki rozwojowe, takie jak dojrzewanie od-
powiedzi immunologicznej i ekspozycja na czynni-
ki zakaźne w pierwszych latach życia.
Co więcej niektóre cechy zostały powiązane
ze zwiększonym ryzykiem astmy, ale nie są one
prawdziwymi czynnikami sprawczymi. Różnice
rasowe i etniczne w częstości występowania ast-
my odzwierciedlają zróżnicowanie genetyczne
oraz znaczące nakładanie się czynników społecz-
noekonomicznych i środowiskowych. Natomiast
powiązania między astmą i stanem społeczno
ekonomicznym – częstsze występowanie astmy
w krajach rozwiniętych niż rozwijających się,
* http://www.ginasthma.org/ReportItem.asp?l1=2&l2=2&intId=94
Ryc. 1-2. Czynniki wpływające na rozwój
i ekspresję astmy
czynniki osobnicze
genetyczne, np.
predyspozycja genetyczna do atopii
predyspozycja genetyczna do nadreaktywności oskrzeli
otyłość
płeć
czynniki środowiskowe
alergeny
występujące wewnątrz pomieszczeń: roztocze kurzu
domowego, zwierzęta mające sierść (psy, koty,
myszy), alergen karaluchów, grzyby pleśniowe
i drożdżopodobne
środowiska zewnętrznego: pyłki roślin, grzyby pleśniowe
i drożdżopodobne
czynniki zawodowe o działaniu uczulającym
dym tytoniowy
bierne palenie tytoniu
czynne palenie tytoniu
zanieczyszczenie powietrza atmosferycznego i powietrza
wewnątrz pomieszczeń
dieta

WYTYCZNE
22
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
w populacjach biednych w porównaniu z bogaty-
mi w krajach rozwiniętych oraz w populacjach bo-
gatych w porównaniu z biednymi w krajach roz-
wijających się – prawdopodobnie odzwierciedlają
różnice w stylu życia, czyli także w narażeniu na
alergeny, dostępie do opieki zdrowotnej itp.
Wiedza na temat czynników ryzyka astmy
pochodzi głównie z badań przeprowadzonych
u małych dzieci. Czynniki ryzyka rozwoju astmy
u dorosłych, szczególnie de novo u tych dorosłych,
którzy nie chorowali na astmę w dzieciństwie – są
słabiej poznane.
Brak precyzyjnej definicji astmy jest istotnym
problemem w badaniu roli różnych czynników
ryzyka w rozwoju tej złożonej choroby, ponieważ
cechy określające astmę (np. nadreaktywność
dróg oddechowych, atopia i uczulenie) same są
skutkiem złożonych interakcji genetycznośrodo-
wiskowych; są więc zarówno cechami astmy, jak
i czynnikami ryzyka rozwoju tej choroby.
Czynniki osobnicze
Czynniki genetyczne
Astma ma składową dziedziczną, ale uwarunko-
wanie genetyczne nie jest proste. Aktualne dane
wskazują, że w patogenezie astmy mogą być za-
angażowane liczne geny,
24,25
a w różnych gru-
pach etnicznych mogą odgrywać rolę inne geny.
Poszukiwania genów związanych z rozwojem ast-
my koncentrują się na 4 głównych aspektach: wy-
twarzanie alergenowo swoistych przeciwciał kla-
sy IgE (atopia); ekspresja nadreaktywności dróg
oddechowych; produkcja mediatorów zapalnych,
takich jak cytokiny, chemokiny i czynniki wzro-
stowe; oraz określenie stosunku między odpowie-
dzią immunologiczną Th1 i Th2 (co się odnosi do
hipotezy higienicznej rozwoju astmy)
26
.
Badania rodzin oraz kliniczno-kontrolne bada-
nia asocjacji genetycznych pozwoliły wykryć sze-
reg regionów chromosomalnych związanych z po-
datnością na astmę. Na przykład skłonność do
wytwarzania w zwiększonych ilościach przeciw-
ciał IgE dziedziczy się razem z nadreaktywnością
dróg oddechowych, a gen (lub geny) odpowiedzial-
ny za nadreaktywność oskrzeli znajduje się blisko
miejsca odpowiedzialnego za regulację stężenia
IgE w osoczu na chromosomie 5q.
27
Jednakże
poszukiwania szczególnego genu (lub genów) od-
powiedzialnego za podatność na atopię lub astmę
trwają nadal, gdyż wyniki dotychczasowych ba-
dań nie są spójne.
24,25
Oprócz genów predysponujących do rozwoju
astmy istnieją geny powiązane z odpowiedzią ast-
my na leczenie. Na przykład występowanie wa-
riantów genu kodującego receptor adrenergiczny
β może tłumaczyć różnice między chorymi w od-
powiedzi na β
2
-mimetyki.
28
Inne geny modyfikują
odpowiedź na glikokortykosteroidy
29
i leki prze-
ciwleukotrienowe
30
. Te markery genetyczne praw-
dopodobnie staną się ważne nie tylko jako czynniki
ryzyka w patogenezie astmy, ale również jako czyn-
niki warunkujące odpowiedź na leczenie.
28,3033
Otyłość
Wykazano, że otyłość także jest czynnikiem ry-
zyka rozwoju astmy. Określone mediatory, takie
jak leptyny, mogą wpływać na czynność dróg od-
dechowych i zwiększać prawdopodobieństwo roz-
woju astmy.
34,35
Płeć
Płeć męska jest czynnikiem ryzyka rozwoju astmy
u dzieci. Do 14. roku życia astma występuje pra-
wie 2 razy częściej u chłopców niż u dziewcząt.
36
Z wiekiem różnica ta maleje i w okresie dorosłości
astma występuje częściej u kobiet niż u mężczyzn.
Przyczyny tej różnicy związanej z płcią nie są jas-
ne. Płuca są mniejsze u mężczyzn niż u kobiet
w chwili narodzin,
37
natomiast większe w okresie
dorosłości.
Czynniki środowiskowe
Czynniki środowiskowe, które wpływają na ryzy-
ko rozwoju astmy i czynniki, które wywołują obja-
wy astmy, do pewnego stopnia się nakładają – na
przykład zawodowe czynniki uczulające należą do
obu tych kategorii. Istnieją jednak pewne ważne
czynniki wyzwalające objawy astmy, takie jak za-
nieczyszczenie powietrze i niektóre alergeny, któ-
re nie zostały jasno powiązane z rozwojem astmy.
Czynniki ryzyka wyzwalające objawy astmy omó-
wiono szczegółowo w
rozdziale 4.2.
Alergeny
Alergeny występujące wewnątrz i na zewnątrz
pomieszczeń wywołują zaostrzenia astmy, ale ich
rola w rozwoju tej choroby nie została w pełni wy-

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
2
jaśniona. Badania kohortowe wykazały, że uczule-
nie na alergeny roztoczy kurzu domowego, kota,
psa
38,39
i grzybów pleśniowych z rodzaju Asper-
gillus
40
są niezależnymi czynnikami ryzyka obja-
wów astmatycznych u dzieci do 3. roku życia. Jed-
nakże powiązanie między ekspozycją na alergen
a uczuleniem u dzieci nie jest proste. Zależy ono
od rodzaju alergenu, jego dawki, czasu narażenia,
wieku dziecka i prawdopodobnie też od czynni-
ków genetycznych.
W przypadku niektórych alergenów, takich jak
alergeny roztoczy kurzu domowego i karaluchów,
częstość występowania uczulenia koreluje wprost
z wielkością narażenia.
38,41
Jednakże chociaż nie-
które dane wskazują na to, że narażenie na aler-
geny roztoczy kurzu domowego może być czynni-
kiem sprawczym w rozwoju astmy,
42
to inne ba-
dania podają w wątpliwość taką interpretację
43,44
.
Wykazano, że zasiedlenie mieszkania przez kara-
luchy jest ważnym czynnikiem alergizacji, szcze-
gólnie w domach śródmiejskich.
45
W przypadku psów i kotów niektóre badania
epidemiologiczne wykazały, że wczesna ekspo-
zycja na te zwierzęta może chronić dzieci przed
alergizacją lub rozwojem astmy,
4648
natomiast
inne badania wskazują, że taka ekspozycja może
zwiększać ryzyko alergizacji
47,4951
. Zagadnienie
to pozostaje niewyjaśnione.
Astma występuje rzadziej u dzieci wychowy-
wanych na wsi, co może być związane z występo-
waniem endotoksyn w tym środowisku.
52
Zakażenia
Kilka wirusów powiązano z wystąpieniem fenoty-
pu astmatycznego u niemowląt. Wirus RSV i wirus
paragrypy wywołują zapalenie oskrzelików, które
ma wiele cech astmy u dzieci.
53,54
Szereg długo-
terminowych badań prospektywnych u dzieci
przyjmowanych do szpitala z udokumentowanym
zakażeniem wirusem RSV wykazało, że u blisko
40% z nich świszczący oddech się utrzymuje lub
rozwija się astma w późniejszym dzieciństwie.
53
Istnieją również dane wskazujące na to, że pew-
ne zakażenia układu oddechowego we wczesnym
okresie życia, w tym wirusem odry, a niekiedy też
zakażenia RSV, mogą chronić przed rozwojem
astmy.
55,56
Dostępne dane nie pozwalają na wy-
ciągnięcie jednoznacznych wniosków.
Według „hipotezy higienicznej” ekspozycja
na zakażenia we wczesnym okresie życia wpły-
wa na rozwój układu immunologicznego dziecka,
kierując go na tor „niealergiczny”, co powoduje
zmniejszenie ryzyka rozwoju astmy i innych cho-
rób alergicznych. Trwają badania nad tą hipotezą,
ale mechanizm ten może tłumaczyć obserwowane
powiązania między wielkością rodziny, kolejnoś-
cią narodzin i uczęszczaniem do żłobka lub przed-
szkola a ryzykiem rozwoju astmy. Na przykład
małe dzieci mające starsze rodzeństwo oraz dzieci
uczęszczające do żłobka lub przedszkola są obcią-
żone zwiększonym ryzykiem zakażeń, natomiast
są chronione przed rozwojem chorób alergicznych,
w tym astmy w późniejszym okresie życia.
5759
Interakcja między atopią i zakażeniami wi-
rusowymi jest złożona;
60
stan atopii może wpły-
wać na odpowiedź dolnych dróg oddechowych na
zakażenie wirusowe, zakażenia wirusowe mogą
wpływać na rozwój alergizacji, a interakcje mogą
zachodzić, gdy osoba jest narażona jednocześnie
na alergeny i wirusy.
Zawodowe czynniki uczulające
Ponad 300 substancji powiązano z astmą zawo-
dową,
6165
którą definiuje się jako astmę wywo-
ływaną przez ekspozycję na czynnik występujący
w miejscu pracy zawodowej. Do tych substancji
należą bardzo reaktywne małe cząsteczki, takie
jak izocyjaniany, czynniki drażniące, które mogą
zmieniać reaktywność dróg oddechowych, znane
immunogeny, takie jak sole platyny oraz złożone
produkty biologiczne roślin i zwierząt pobudzają-
ce wytwarzanie IgE (
ryc. 1-3).
Astma zawodowa rozwija się głównie u do-
rosłych,
66,67
i szacuje się, że zawodowe czynniki
uczulające są przyczyną około 1 na 10 przypad-
ków astmy u dorosłych w wieku produkcyjnym
68
.
Astma jest najczęstszą chorobą zawodową układu
oddechowego w krajach uprzemysłowionych.
69
Zawody związane z dużym ryzykiem rozwoju ast-
my zawodowej to: rolnik, malarz (w tym używają-
cy farb w aerozolu), sprzątacz i pracownik prze-
mysłu tworzyw sztucznych.
62
W większości przypadków astmy zawodowej
występuje mechanizm immunologiczny i okres
utajenia trwający miesiące lub lata od początku
narażenia.
70
Zaangażowane są zarówno reakcje
alergiczne z udziałem IgE, jak i reakcje typu ko-
mórkowego.
71,72
Dla wielu zawodowych czynników uczulających
określono poziomy ekspozycji, powyżej których

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
często dochodzi do uczulenia. Nie zidentyfikowa-
no natomiast czynników, które przy tym samym
poziomie ekspozycji u jednych osób wywołują ast-
mę zawodową, a u innych nie. Bardzo duże na-
rażenie na wziewne czynniki drażniące może wy-
wołać „astmę wywoływaną przez czynniki draż-
niące” (ang. irritant induced asthma; uprzednio
nazywaną zespołem reaktywnej dysfunkcji dróg
oddechowych) nawet u osób bez atopii. Atopia
i palenie tytoniu mogą zwiększać ryzyko uczule-
nia na czynniki zawodowe, ale badania przesiewo-
we w kierunku atopii mają ograniczoną wartość
w zapobieganiu astmie zawodowej.
73
Najważniej-
szą metodą zapobiegania astmie zawodowej jest
wyeliminowanie lub zmniejszenie narażenia na
zawodowe czynniki uczulające.
Dym tytoniowy
Palenie tytoniu wiąże się z przyśpieszoną utra-
tą czynności płuc u chorych na astmę, zwiększa
ciężkość astmy, może osłabić odpowiedź chorych
na leczenie glikokortykosteroidami wziewnymi
74
Ryc. 1-3. Przykłady czynników wywołujących astmę w wybranych grupach zawodowych
Zawód lub miejsce zatrudnienia
Czynnik
białka zwierzęce i roślinne
piekarze
mąka, amylaza
pracownicy gospodarstw mleczarskich
roztocze spichrzowe
wytwórnie detergentów
enzymy Bacillus subtilis
lutowanie przewodów elektrycznych
kalafonia (żywica sosny)
rolnicy
pył z ziaren soi
pracownicy przetwórni ryb
ochotki, pasożyty
obróbka żywności
pył ziaren kawowych, środek zmiękczający mięso, herbata, skorupiaki, amylaza,
białka jaja, enzymy trzustkowe, papaina
pracownicy spichlerzy
roztocze spichrzowe, Aspergillus, ambrozja, trawy
pracownicy ochrony zdrowia
psylium, lateks
produkcja środków przeczyszczających
ispagula, nasiona babki płesznika (Psyllium)
pracownicy ferm drobiu
roztocze ptasie, odchody, pierze
pracownicy laboratoriów naukowych,
weterynarze
szarańcza, białka naskórka i moczu zwierząt
pracownicy tartaków, stolarze
pył drzewny (czerwony cedr zachodni, dąb, mahoń, drewno Connarus guianensis,
sekwoja, cedr libański, klon afrykański, biały cedr wschodni)
transport zbóż
pył zbożowy (grzyby, pleśniowe, owady, ziarna)
pracownicy przemysłu jedwabnego
motyle i gąsienice jedwabnika
nieorganiczne związki chemiczne
kosmetyczki
nadsiarczany
galwanizacja
sole niklu
pracownicy rafinerii
sole platyny i wanadu
organiczne związki chemiczne
lakierowanie samochodów
etanolamina, diizocyjaniany
pracownicy szpitali
środki dezynfekujące (sulfatiazol, chloramina, formaldehyd, aldehyd glutarowy),
lateks
fabryki
antybiotyki, piperazyna, metylodopa, salbutamol, cymetydyna
przemysł gumowy
formaldehyd, etylenodiamina, bezwodnik kwasu ftalowego
przemysł tworzyw sztucznych
diizocyjanian toluenu, diizocyjanian heksametylu, izocyjanian defenylometylu,
bezwodnik kwasu ftalowego, trietylenotetraminy, bezwodnik trimelitowy,
heksametylotetramina, pochodne akrylowe
Pełna lista znanych czynników uczulających jest dostępna na stronie http://www.bohrf.org.uk.

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
2
i podawanymi ogólnoustrojowo
75
oraz zmniejszyć
szanse uzyskania kontroli astmy
76
.
Narażenie na dym tytoniowy, zarówno przed
urodzeniem, jak i po urodzeniu wiąże się z wymier-
nymi skutkami szkodliwymi, w tym ze zwiększo-
nym ryzykiem rozwoju objawów astmatycznych
we wczesnym dzieciństwie. Jednakże dane doty-
czące zwiększonego ryzyka chorób alergicznych
są niepewne.
77,78
Rozdzielenie wpływu palenia ty-
toniu przez matkę w okresie ciąży i po urodzeniu
dziecka stwarza problemy.
79
Jednakże badania
czynności płuc dziecka przeprowadzone bezpo-
średnio po urodzeniu wykazały, że palenie tytoniu
przez matkę w okresie ciąży wpływa na rozwój
płuc.
37
Ponadto niemowlęta, których matki palą
papierosy, są obciążone 4krotnie większym ryzy-
kiem rozwoju choroby przebiegającej ze świszczą-
cym oddechem w pierwszym roku życia.
80
Prze-
ciwnie – niewiele jest danych (co wynika z meta-
analizy), że palenie przez matkę w okresie ciąży
wpływa na ryzyko alergizacji.
78
Bierne narażenie
na dym tytoniowy (palenie bierne) zwiększa ryzy-
ko chorób dolnych dróg oddechowych w okresie
niemowlęctwa
81
i dzieciństwa
82
.
Zanieczyszczenia powietrza atmosferycznego
i wewnątrz pomieszczeń
Rola zanieczyszczenia powietrza atmosferycz-
nego w wywoływaniu astmy nadal budzi kon-
trowersje.
83
Dzieci wychowywane w środowisku
zanieczyszczonym mają zmniejszone wartości pa-
rametrów czynności płuc,
84
ale związek pomiędzy
utratą czynności płuc a rozwojem astmy nie jest
znany.
Wykazano związek między częstym występo-
waniem zaostrzeń astmy a zwiększonym zanie-
czyszczeniem powietrza, co może być wynikiem
zwiększenia całkowitej ilości zanieczyszczeń lub
ilości określonego alergenu, na który chory jest
uczulony.
8587
Rola zanieczyszczeń powietrza
w rozwoju astmy jest jednak słabiej poznana. Po-
dobne powiązania zaobserwowano w odniesieniu
do zanieczyszczeń wewnątrz pomieszczeń, na
przykład dymu lub wyziewów ze spalania gazu
i biomasy w celu ogrzewania pomieszczeń i go-
towania, grzybów pleśniowych i zasiedlenia po-
mieszczeń przez karaluchy.
Dieta
Prowadzono szeroko zakrojone badania nad rolą
diety, szczególnie karmienia piersią, w odniesie-
niu do rozwoju astmy. Ogólnie rzecz biorąc, ba-
dania te ujawniły, że u niemowląt karmionych
mieszankami zawierającymi niezmodyfikowane
białka mleka krowiego lub białka soi częściej wy-
stępują epizody świszczącego oddechu we wczes-
nym dzieciństwie w porównaniu z dziećmi kar-
mionymi piersią.
88
Niektóre dane wskazują również, że pewne
cechy diet zachodnich, takie jak zwiększone spo-
życie pokarmów przetworzonych i zmniejszona
podaż antyoksydantów (w postaci owoców i wa-
rzyw), zwiększone spożycie wielonienasyconych
kwasów tłuszczowych n6 (spotykanych w marga-
rynach i oleju roślinnym) oraz zmniejszone spoży-
cie wielonienasyconych kwasów tłuszczowych n3
(spotykanych w olejach rybnych) – przyczynia się
do obserwowanego ostatnio wzrostu częstości wy-
stępowania astmy i chorób atopowych.
89
Mechanizmy astmy
Astma jest chorobą zapalną dróg oddechowych,
w której uczestniczą liczne komórki zapalne
i mediatory powodujące charakterystyczne zmia-
ny patofizjologiczne.
21,90
W sposób ciągle słabo
poznany ta reakcja zapalna jest silnie związana
z nadreaktywnością dróg oddechowych i występo-
waniem objawów podmiotowych astmy.
Zapalenie dróg oddechowych w astmie
Spektrum kliniczne astmy jest bardzo zróżnicowa-
ne – zaobserwowano dominację różnych rodzajów
komórek, ale stałą cechą pozostaje zapalenie dróg
oddechowych. Zapalenie dróg oddechowych w ast-
mie utrzymuje się nawet wtedy, gdy objawy pod-
miotowe występują epizodycznie, a związek mię-
dzy ciężkością astmy i nasileniem zapalenia nie
jest jednoznacznie ustalony.
91,92
Zapalenie obej-
muje wszystkie odcinki dróg oddechowych, w tym
górne drogi oddechowe i jamę nosową u większości
chorych, ale czynnościowe konsekwencje zapale-
nia są najsilniej wyrażone w oskrzelach średniego
kalibru. Charakter zapalenia dróg oddechowych
jest podobny we wszystkich klinicznych posta-
ciach astmy, niezależnie od tego czy jest to astma

WYTYCZNE
26
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
alergiczna, niealergiczna czy aspirynowa, oraz we
wszystkich grupach wiekowych.
Komórki zapalne
W astmie obserwuje się charakterystyczne ce-
chy zapalenia stwierdzanego w chorobach aler-
gicznych, z udziałem pobudzonych mastocytów,
zwiększoną liczbą pobudzonych eozynofilów oraz
komórek T typu invariant natural killer (iNKT)
i limfocytów pomocniczych Th2, które uwalniają
mediatory odpowiedzialne za występowanie ob-
jawów podmiotowych (
ryc. 1-4). Komórki ściany
dróg oddechowych również wytwarzają mediatory
zapalne i przyczyniają się do podtrzymywania za-
palenia w różnoraki sposób (
ryc. 1-5).
Mediatory zapalne
Obecnie znanych jest ponad 100 różnych me-
diatorów uczestniczących w patogenezie astmy
i pośredniczących w złożonej odpowiedzi zapalnej
dróg oddechowych
103
(
ryc. 1-6).
Zmiany strukturalne w drogach oddechowych
Poza odpowiedzią zapalną w drogach oddecho-
wych u chorych na astmę zachodzą charaktery-
styczne zmiany struktury, często opisywane jako
przebudowa dróg oddechowych (
ryc. 1-7). Niektó-
re z tych zmian są powiązane z ciężkością choroby
i mogą powodować częściowo nieodwracalne zwę-
żenie dróg oddechowych.
109,110
Zmiany te mogą
odzwierciedlać procesy naprawcze w odpowiedzi
na przewlekłe zapalenie.
Patofizjologia
Zwężenie dróg oddechowych jest końcowym zja-
wiskiem prowadzącym do wystąpienia objawów
podmiotowych astmy i zmian w parametrach
Ryc. 1-4. Komórki zapalne w drogach
oddechowych u chorych na astmę
Mastocyty: pobudzone mastocyty błony śluzowej
uwalniają mediatory kurczące oskrzela (histaminę,
leukotrieny cysteinylowe, prostaglandynę D
2
).
93
Komórki
te są pobudzane przez alergeny za pośrednictwem
receptorów dla IgE o wysokim powinowactwie, jak
również przez bodźce osmotyczne (co tłumaczy skurcz
oskrzeli wywoływany przez wysiłek fizyczny). Zwiększona
liczba mastocytów w mięśniówce gładkiej ściany dróg
oddechowych może się wiązać z nadreaktywnością dróg
oddechowych.
94
Eozynofile, występujące w zwiększonej liczbie w drogach
oddechowych, uwalniają białka zasadowe, które mogą
uszkadzać komórki nabłonka dróg oddechowych.
Mogą również odgrywać rolę w uwalnianiu czynników
wzrostowych i przebudowie ściany dróg oddechowych.
95
Limfocyty T, występujące w zwiększonej liczbie w drogach
oddechowych, uwalniają określone cytokiny, w tym
IL-4, IL-5, IL-9, IL-13, które „dyrygują” zapaleniem
eozynofilowym i wytwarzaniem IgE przez limfocyty B.
96
Zwiększona aktywność komórek Th2 może być po części
spowodowana zmniejszeniem liczby regulatorowych
komórek T, które w prawidłowych warunkach hamują
komórki Th2. Zwiększona może być też liczba komórek
iNKT, które uwalniają w dużych ilościach cytokiny profilu
Th1 i Th2.
97
Komórki dendrytyczne pobierają alergeny z powierzchni
dróg oddechowych i migrują do regionalnych węzłów
chłonnych, gdzie wchodzą w interakcje z regulatorowymi
komórkami T i ostatecznie pobudzają przekształcanie
„dziewiczych” komórek T w komórki Th2.
98
Makrofagi, występujące w zwiększonej liczbie w drogach
oddechowych, mogą być pobudzane przez alergeny
za pośrednictwem receptorów dla IgE o małym
powinowactwie, do uwalniania mediatorów zapalnych
i cytokin, które napędzają odpowiedź zapalną.
99
Neutrofile występują w zwiększonej liczbie w drogach
oddechowych i plwocinie u chorych na ciężką astmę
i u chorych na astmę palących tytoń, ale patofizjologiczna
rola tych komórek jest niepewna, a podczas leczenia
glikokortykosteroidami ich liczba może nawet
wzrastać.
100
Ryc. 1-5. Komórki ściany dróg oddechowych
uczestniczące w patogenezie astmy
Komórki nabłonka dróg oddechowych rejestrują bodźce
mechaniczne, wytwarzają liczne białka zapalne w astmie
i uwalniają cytokiny, chemokiny i mediatory lipidowe.
Z komórkami nabłonkowymi wchodzą w interakcje wirusy
i zanieczyszczenia powietrza.
Komórki mięśni gładkich dróg oddechowych wytwarzają
podobne białka zapalne jak komórki nabłonkowe.
101
Komórki śródbłonka naczyń krążenia oskrzelowego
odgrywają rolę w rekrutacji komórek zapalnych z krążenia
do dróg oddechowych.
Fibroblasty i miofibroblasty wytwarzają składniki
tkanki łącznej, takie jak kolageny i proteoglikany, które
odgrywają rolę w przebudowie ściany dróg oddechowych.
Unerwienie dróg oddechowych również odgrywa rolę
w patogenezie astmy. Nerwy cholinergiczne mogą
być pobudzane odruchowo w drogach oddechowych
i wywoływać skurcz oskrzeli oraz wydzielanie śluzu.
Nerwy czuciowe, które mogą być uwrażliwione przez
bodźce zapalne, takie jak neurotrofiny, wywołują reakcje
odruchowe i objawy, takie jak kaszel i uczucie ściskania
w klatce piersiowej. Mogą też uwalniać neuropeptydy
zapalne.
102

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
2
czynności płuc. Do rozwoju zwężenia dróg odde-
chowych w astmie przyczynia się wiele czynników
(
ryc. 1-8).
Nadreaktywność dróg oddechowych
Nadreaktywność dróg oddechowych – charaktery-
styczne zaburzenie czynnościowe w astmie – pro-
wadzi do zwężenia dróg oddechowych u chorego
na astmę w odpowiedzi na bodziec, który dla oso-
by zdrowej jest nieszkodliwy. Z kolei to zwężenie
skutkuje zmiennym ograniczeniem przepływu
powietrza przez drogi oddechowe i okresowym
występowaniem objawów podmiotowych. Nadre-
aktywność dróg oddechowych jest powiązana za-
równo z zapaleniem, jak i procesami naprawczymi
w drogach oddechowych i jest częściowo odwra-
calna pod wpływem leczenia. Mechanizmy nadre-
aktywności (
ryc. 1-9) nie są w pełni poznane.
Zaostrzenia
Przemijające pogorszenie astmy może wystąpić
w wyniku ekspozycji na czynniki wyzwalające
objawy choroby, takie jak wysiłek fizyczny, zanie-
czyszczenia powietrza,
115
a nawet pewne warunki
pogodowe, na przykład podczas burzy
116
. Dłużej
utrzymujące się pogorszenie jest zwykle spowo-
dowane zakażeniem wirusowym górnych dróg od-
dechowych (szczególnie rynowirusami, wirusem
RSV)
117
lub ekspozycją na alergen. Czynniki te
nasilają zapalenie w dolnych drogach oddecho-
wych (nałożenie się zapalenia ostrego na przewle-
kłe), które może się utrzymywać przez szereg dni
lub tygodni.
Astma nocna
Mechanizmy odpowiedzialne za nasilanie się ast-
my w nocy nie są w pełni poznane, ale mogą być
związane z rytmem dobowym krążących hormo-
nów, takich jak adrenalina, kortyzol i melatoni-
na, oraz mechanizmów nerwowych, takich jak
napięcie układu cholinergicznego. Opisano nasi-
Ryc. 1-6. Główne mediatory astmy
Chemokiny odgrywają ważną rolę w rekrutacji komórek
zapalnych do dróg oddechowych i są wytwarzane
głównie przez komórki nabłonka dróg oddechowych.
104
Eotaksyna jest względnie wybiórcza dla eozynofilów,
natomiast chemokiny TARC (tymus and activation
regulated chemokines) i chemokiny pochodzące
z makrofagów (microphage derived chemokines – MDC)
rekrutują komórki Th2.
Leukotrieny cysteinylowe to silne substancje kurczące
oskrzela, będące też mediatorami prozapalnymi,
pochodzące głównie z mastocytów i eozynofilów. Są
jedynymi mediatorami, których zahamowanie wiąże
się z poprawą w zakresie czynności płuc i objawów
podmiotowych astmy.
105
Cytokiny zawiadują odpowiedzią zapalną w astmie
i determinują jej nasilenie.
106
Do głównych cytokin należą:
IL-1β i TNF-α, które nasilają odpowiedź zapalną, oraz
GM-CSF, który wydłuża przeżycie eozynofilów w drogach
oddechowych. Do cytokin pochodzących z komórek
Th2 należą: IL-5, która jest niezbędna do różnicowania
eozynofilów i ich przeżycia; IL-4, odgrywająca ważną rolę
w różnicowaniu komórek Th2; oraz IL-13 potrzebna do
wytwarzania IgE.
Histamina jest uwalniania z mastocytów i przyczynia się
do skurczu oskrzeli oraz odpowiedzi zapalnej.
Tlenek azotu (NO) jest silną substancją rozszerzającą
naczynia, wytwarzaną głównie przez indukowalną
syntazę tlenku azotu w komórkach nabłonka dróg
oddechowych.
107
Coraz częściej wykorzystuje się pomiar
stężenia NO w powietrzu wydychanym do monitorowania
skuteczności leczenia astmy, ponieważ opisano związek
między tym parametrem a występowaniem zapalenia
w astmie.
108
Prostaglandyna D
2
jest substancją kurczącą oskrzela
pochodzącą głównie z mastocytów i odgrywającą rolę
w rekrutacji komórek Th2 do dróg oddechowych.
Ryc. 1-7. Zmiany strukturalne w drogach
oddechowych u chorych na astmę
Włóknienie podnabłonkowe jest wynikiem odkładania
włókien kolagenu i proteoglikanów pod błoną
podstawną. Występuje u wszystkich chorych na astmę,
także u dzieci, nawet przed wystąpieniem objawów
podmiotowych, ale może ulegać zmianom pod wpływem
leczenia. Włóknienie, z gromadzeniem kolagenu
i proteoglikanów, występuje też w innych warstwach
ściany dróg oddechowych.
Mięśniówka gładka dróg oddechowych powiększa
się zarówno wskutek przerostu (powiększenia
poszczególnych komórek mięśniowych), jak i rozrostu
(zwiększenia liczby komórek), i przyczynia się do
zwiększenia grubości ściany dróg oddechowych.
111
Proces ten może być powiązany z ciężkością choroby i jest
powodowany przez mediatory zapalne, takie jak czynniki
wzrostowe.
Naczynia krwionośne w ścianie dróg oddechowych
proliferują pod wpływem czynników wzrostowych, takich
jak śródbłonkowy czynnik wzrostowy naczyń (VEGF)
i mogą się przyczyniać do zwiększenia grubości ściany
dróg oddechowych.
Nadmierne wydzielanie śluzu jest wynikiem
zwiększenia liczby komórek kubkowych w nabłonku
dróg oddechowych oraz zwiększenia liczby gruczołów
podśluzówkowych.

WYTYCZNE
28
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
lenie zapalenia w drogach oddechowych w nocy,
co może odzwierciedlać osłabienie endogennych
mechanizmów przeciwzapalnych.
118
Nieodwracalne zwężenie dróg oddechowych
U niektórych chorych na ciężką astmę rozwija się
postępujące zwężenie dróg oddechowych, które
może nie być w pełni odwracalne przy obecnie do-
stępnych metodach terapii. Może to odzwiercied-
lać zmiany strukturalne w drogach oddechowych
w astmie przewlekłej.
119
Astma trudna
Nie jest jasne, dlaczego u niektórych chorych
rozwija się astma trudna do leczenia i względnie
niewrażliwa na działanie glikokortykosteroidów.
Często wiąże się ona z nieprzestrzeganiem przez
chorego zaleceń lekarskich dotyczących leczenia
oraz z zaburzeniami psychicznymi. U niektórych
chorych jednak mogą odgrywać rolę czynniki ge-
netyczne. Wielu tych chorych ma astmę trudną
od samego początku, a nie rozwijającą się z astmy
łagodniejszej. W astmie trudnej zamknięcie dróg
oddechowych prowadzi do powstania pułapki po-
wietrznej i rozdęcia płuc. Zmiany patologiczne są
podobne jak w innych postaciach astmy, ale obser-
wuje się zwiększenie liczby neutrofilów, większe
zajęcie drobnych dróg oddechowych i bardziej na-
silone zmiany strukturalne.
100
Palenie tytoniu i astma
Palenie tytoniu utrudnia kontrolę astmy, zwięk-
sza częstość zaostrzeń i hospitalizacji, powoduje
szybszą utratę czynności płuc oraz zwiększa ry-
zyko zgonu.
120
U chorych na astmę, którzy palą,
w zapaleniu dróg oddechowych mogą dominować
neutrofile i odpowiedź na leczenie glikokortyko-
steroidami jest słaba.
Piśmiennictwo
1. Vincent S.D., Toelle B.G., Aroni R.A., Jenkins C.R., Reddel H.K.: Exasperations of
asthma: a qualitative study of patient language about worsening asthma. Med. J.
Aust., 2006; 184: 451–454
2. Masoli M., Fabian D., Holt S., Beasley R.: The global burden of asthma: executive
summary of the GINA Dissemination Committee report. Allergy, 2004; 59: 469–478
3. Beasley R.: The Global Burden of Asthma Report, Global Initiative for Asthma (GINA).
Available from http://www.ginasthma.org 2004
4. Yan D.C., Ou L.S., Tsai T.L., Wu W.F., Huang J.L.: Prevalence and severity of symptoms
of asthma, rhinitis, and eczema in 13- to 14-year-old children in Taipei, Taiwan. Ann.
Allergy Asthma Immunol., 2005; 95: 579–585
5. Ko F.W., Wang H.Y., Wong G.W., Leung T.F., Hui D.S., Chan D.P., et al.: Wheezing
in Chinese schoolchildren: disease severity distribution and management practices,
a community-based study in Hong Kong and Guangzhou. Clin. Exp. Allergy, 2005;
35: 1449–1456
6. Carvajal-Uruena I., Garcia-Marcos L., Busquets-Monge R., Morales Suarez-Varela M.,
Garcia de Andoin N., Batlles-Garrido J., et al. [Geographic variation in the prevalence
of asthma symptoms in Spanish children and adolescents. International Study of
Asthma and Allergies in Childhood (ISAAC) Phase 3, Spain]. Arch. Bronconeumol.,
2005; 41: 659–666
7. Teeratakulpisarn J., Wiangnon S., Kosalaraksa P., Heng S.: Surveying the prevalence
of asthma, allergic rhinitis and eczema in school-children in Khon Kaen, Northeastern
Thailand using the ISAAC questionnaire: phase III. Asian Pac. J. Allergy Immunol.,
2004; 22: 175–181
8. Garcia-Marcos L., Quiros A.B., Hernandez G.G., Guillen-Grima F., Diaz C.G., Urena I.C.,
et al.: Stabilization of asthma prevalence among adolescents and increase among
schoolchildren (ISAAC phases I and III) in Spain. Allergy, 2004; 59: 1301–1307
9. Mahapatra P.: Social, economic and cultural aspects of asthma: an exploratory study
in Andra Pradesh, India. Hyderbad, India, Institute of Health Systems, 1993
10. Lai C.K., De Guia T.S., Kim Y.Y., Kuo S.H., Mukhopadhyay A., Soriano J.B., et al.:
Asthma control in the Asia-Pacific region: the Asthma Insights and Reality in Asia-
Pacific Study. J. Allergy Clin. Immunol., 2003; 111: 263–268
11. Lenney W.: The burden of pediatric asthma. Pediatr. Pulmonol. Suppl., 1997; 15:
13–16
Ryc. 1-8. Zwężenie dróg oddechowych
w astmie
Skurcz mięśni gładkich dróg oddechowych wywoływany
przez liczne substancje kurczące i neuroprzekaźniki jest
głównym mechanizmem zwężenia dróg oddechowych,
w dużej mierze odwracalnym przez leki rozszerzające
oskrzela.
Obrzęk dróg oddechowych jest spowodowany
zwiększoną przepuszczalnością naczyń mikrokrążenia
wskutek działania mediatorów zapalnych. Może mieć
szczególnie duże znaczenie w okresach zaostrzeń.
Pogrubienie ściany dróg oddechowych wskutek
zmian strukturalnych, często nazywane przebudową
(remodeling), może odgrywać ważną rolę w cięższych
postaciach choroby i nie jest w pełni odwracalne przy
współczesnych możliwościach terapeutycznych.
Nadmierne wydzielanie śluzu może prowadzić do
zamknięcia światła oskrzela (zatkanie przez śluz) i jest
wynikiem zwiększonego wydzielania śluzu i powstawania
wysięku zapalnego.
Ryc. 1-9. Mechanizmy nadreaktywności dróg
oddechowych
Nadmierny skurcz mięśni gładkich oskrzeli może być
wynikiem zwiększonej masy lub kurczliwości komórek
mięśni gładkich.
112
Rozprzężenie skurczu dróg oddechowych w wyniku zmian
zapalnych w ścianie może prowadzić do nadmiernego
zwężenia i utraty plateau maksymalnego skurczu
obserwowanego w prawidłowych drogach oddechowych
pod wpływem inhalacji substancji kurczących oskrzela.
113
Pogrubienie ściany dróg oddechowych wskutek obrzęku
i zmian strukturalnych nasila zwężenie dróg oddechowych
spowodowane skurczem mięśni gładkich, co wynika z ich
geometrii.
114
Nerwy czuciowe mogą być uwrażliwione poprzez
zapalenie, co prowadzi do nadmiernego skurczu oskrzeli
w odpowiedzi na bodźce czuciowe.

WYTYCZNE
Rozdział 1. Definicja i ogólna charakterystyka
29
12. Neffen H., Fritscher C., Schacht F.C., Levy G., Chiarella P., Soriano J.B., et al.: Asthma
control in Latin America: the Asthma Insights and Reality in Latin America (AIRLA)
survey. Rev. Panam. Salud. Publica, 2005; 17: 191–197
13. Weiss K.B., Gergen P.J., Hodgson T.A.: An economic evaluation of asthma in the
United States. N. Engl. J. Med., 1992; 326: 862–866
14. Weinstein M.C., Stason W.B.: Foundations of cost-effectiveness analysis for health
and medical practices. N. Engl. J. Med., 1977; 296: 716–721
15. Weiss K.B., Sullivan S.D.: The economic costs of asthma: a review and conceptual
model. Pharmacoeconomics, 1993; 4: 14–30
16. Action asthma: the occurrence and cost of asthma. West Sussex, United Kingdom:
Cambridge Medical Publications; 1990
17. Marion R.J., Creer T.L., Reynolds R.V.: Direct and indirect costs associated with the
management of childhood asthma. Ann. Allergy, 1985; 54: 31–34
18. Action against asthma. A strategic plan for the Department of Health and Human
Services. Washington, DC: Department of Health and Human Services; 2000
19. Thompson S.: On the social cost of asthma. Eur. J. Respir. Dis. Suppl., 1984; 136:
185–191
20. Karr R.M., Davies R.J., Butcher B.T., Lehrer S.B., Wilson M.R., Dharmarajan V., et al.:
Occupational asthma. J. Allergy Clin. Immunol., 1978; 61: 54–65
21. Busse W.W., Lemanske R.F. Jr: Asthma. N. Engl. J. Med., 2001; 344: 350–362
22. Ober C.: Perspectives on the past decade of asthma genetics. J. Allergy Clin.
Immunol., 2005; 116: 274–278
23. Holgate S.T.: Genetic and environmental interaction in allergy and asthma. J. Allergy
Clin. Immunol., 1999; 104: 1139–1146
24. Holloway J.W., Beghe B., Holgate S.T.: The genetic basis of atopic asthma. Clin. Exp.
Allergy, 1999; 29: 1023–1032
25. Wiesch D.G., Meyers D.A., Bleecker E.R.: Genetics of asthma. J. Allergy Clin.
Immunol., 1999; 104: 895–901
26. Strachan D.P.: Hay fever, hygiene, and household size. BMJ, 1989; 299: 1259–1260
27. Postma D.S., Bleecker E.R., Amelung P.J., Holroyd K.J., Xu J., Panhuysen C.I., et al.:
Genetic susceptibility to asthma – bronchial hyperresponsiveness coinherited with
a major gene for atopy. N. Engl. J. Med., 1995; 333: 894–900
28. Israel E., Chinchilli V.M., Ford J.G., Boushey H.A., Cherniack R., Craig T.J., et al.: Use of
regularly scheduled albuterol treatment in asthma: genotype-stratified, randomised,
placebo-controlled cross-over trial. Lancet, 2004; 364: 1505–1512
29. Ito K., Chung K.F., Adcock I.M.: Update on glucocorticoid action and resistance.
J. Allergy Clin. Immunol., 2006; 117: 522–543
30. In K.H., Asano K., Beier D., Grobholz J., Finn P.W., Silverman E.K., et al.: Naturally
occurring mutations in the human 5-lipoxygenase gene promoter that modify tran-
scription factor binding and reporter gene transcription. J. Clin. Invest., 1997; 99:
1130–1137
31. Drazen J.M., Weiss S.T.: Genetics: inherit the wheeze. Nature, 2002; 418: 383–384
32. Lane S.J., Arm J.P., Staynov D.Z., Lee T.H.: Chemical mutational analysis of the hu-
man glucocorticoid receptor cDNA in glucocorticoid-resistant bronchial asthma. Am.
J. Respir. Cell Mol. Biol., 1994; 11: 42–48
33. Tattersfield A.E., Hall I.P.: Are beta2-adrenoceptor polymorphisms important in asth-
ma – an unravelling story. Lancet, 2004; 364: 1464–1466
34. Shore S.A., Fredberg J.J.: Obesity, smooth muscle, and airway hyperresponsiveness.
J. Allergy Clin. Immunol., 2005; 115: 925–927
35. Beuther D.A., Weiss S.T., Sutherland E.R.: Obesity and asthma. Am. J. Respir. Crit.
Care Med., 2006; 174: 112–119
36. Horwood L.J., Fergusson D.M., Shannon F.T.: Social and familial factors in the devel-
opment of early childhood asthma. Pediatrics, 1985; 75: 859–868
37. Martinez F.D., Wright A.L., Taussig L.M., Holberg C.J., Halonen M., Morgan W.J.:
Asthma and wheezing in the first six years of life. The Group Health Medical
Associates. N. Engl. J. Med., 1995; 332: 133–138
38. Wahn U., Lau S., Bergmann R., Kulig M., Forster J., Bergmann K., et al.: Indoor al-
lergen exposure is a risk factor for sensitization during the first three years of life.
J. Allergy Clin. Immunol., 1997; 99 (6 Pt 1): 763–769
39. Sporik R., Holgate S.T., Platts-Mills T.A., Cogswell J.J.: Exposure to house-dust mite
allergen (Der p I) and the development of asthma in childhood. A prospective study.
N. Engl. J. Med., 1990; 323: 502–507
40. Hogaboam C.M., Carpenter K.J., Schuh J.M., Buckland K.F.: Aspergillus and asthma
– any link? Med. Mycol., 2005; 43 (suppl.) 1: S197–S202
41. Huss K., Adkinson N.F. Jr, Eggleston P.A., Dawson C., Van Natta M.L., Hamilton R.G.:
House dust mite and cockroach exposure are strong risk factors for positive allergy
skin test responses in the Childhood Asthma Management Program. J. Allergy Clin.
Immunol., 2001; 107: 48–54
42. Sears M.R., Greene J.M., Willan A.R., Wiecek E.M., Taylor D.R., Flannery E.M., et
al.: A longitudinal, population-based, cohort study of childhood asthma followed to
adulthood. N. Engl. J. Med., 2003; 349: 1414–1422
43. Sporik R., Ingram J.M., Price W., Sussman J.H., Honsinger R.W., Platts-Mills T.A.:
Association of asthma with serum IgE and skin test reactivity to allergens among
children living at high altitude. Tickling the dragon’s breath. Am. J. Respir. Crit. Care
Med., 1995; 151: 1388–1392
44. Charpin D., Birnbaum J., Haddi E., Genard G., Lanteaume A., Toumi M., et al.:
Altitude and allergy to house-dust mites. A paradigm of the influence of environ-
mental exposure on allergic sensitization. Am. Rev. Respir. Dis., 1991; 143 (5 Pt 1):
983–986
45. Rosenstreich D.L., Eggleston P., Kattan M., Baker D., Slavin R.G., Gergen P., et al.: The
role of cockroach allergy and exposure to cockroach allergen in causing morbidity
among inner-city children with asthma. N. Engl. J. Med., 1997; 336: 1356–1363
46. Platts-Mills T., Vaughan J., Squillace S., Woodfolk J., Sporik R.: Sensitisation, asthma,
and a modified Th2 response in children exposed to cat allergen: a population-based
cross-sectional study. Lancet, 2001; 357: 752–756
47. Ownby D.R., Johnson C.C., Peterson E.L.: Exposure to dogs and cats in the first year
of life and risk of allergic sensitization at 6 to 7 years of age. JAMA, 2002; 288:
963–972
48. Gern J.E., Reardon C.L., Hoffjan S., Nicolae D., Li Z., Roberg K.A., et al.: Effects of dog
ownership and genotype on immune development and atopy in infancy. J. Allergy
Clin. Immunol., 2004; 113: 307–314
49. Celedon J.C., Litonjua A.A., Ryan L., Platts-Mills T., Weiss S.T., Gold D.R.: Exposure to
cat allergen, maternal history of asthma, and wheezing in first 5 years of life. Lancet,
2002; 360: 781–782
50. Melen E., Wickman M., Nordvall S.L., van Hage-Hamsten M., Lindfors A.: Influence
of early and current environmental exposure factors on sensitization and outcome of
asthma in pre-school children. Allergy, 2001; 56: 646–652
51. Almqvist C., Egmar A.C., van Hage-Hamsten M., Berglind N., Pershagen G., Nordvall
S.L., et al.: Heredity, pet ownership, and confounding control in a population-based
birth cohort. J. Allergy Clin. Immunol., 2003; 111: 800–806
52. Braun-Fahrlander C.: Environmental exposure to endotoxin and other microbial prod-
ucts and the decreased risk of childhood atopy: evaluating developments since April
2002. Curr. Opin. Allergy Clin. Immunol., 2003; 3: 325–329
53. Sigurs N., Bjarnason R., Sigurbergsson F., Kjellman B.: Respiratory syncytial virus
bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7.
Am. J. Respir. Crit. Care Med., 2000; 161: 1501–1507
54. Gern J.E., Busse W.W.: Relationship of viral infections to wheezing illnesses and
asthma. Nat. Rev. Immunol., 2002; 2: 132–138
55. Stein R.T., Sherrill D., Morgan W.J., Holberg C.J., Halonen M., Taussig L.M., et al.:
Respiratory syncytial virus in early life and risk of wheeze and allergy by age 13
years. Lancet, 1999; 354: 541–545
56. Shaheen S.O., Aaby P., Hall A.J., Barker D.J., Heyes C.B., Shiell A.W., et al.: Measles
and atopy in Guinea-Bissau. Lancet, 1996; 347: 1792–1796
57. Illi S., von Mutius E., Lau S., Bergmann R., Niggemann B., Sommerfeld C., et al.: Early
childhood infectious diseases and the development of asthma up to school age:
a birth cohort study. BMJ, 2001; 322: 390–395
58. Ball T.M., Castro-Rodriguez J.A., Griffith K.A., Holberg C.J., Martinez F.D., Wright A.L.:
Siblings, day-care attendance, and the risk of asthma and wheezing during child-
hood. N. Engl. J. Med., 2000; 343: 538–543
59. de Meer G., Janssen N.A., Brunekreef B.: Early childhood environment related to
microbial exposure and the occurrence of atopic disease at school age. Allergy, 2005;
60: 619–625
60. Zambrano J.C., Carper H.T., Rakes G.P., Patrie J., Murphy D.D., Platts-Mills T.A., et al.:
Experimental rhinovirus challenges in adults with mild asthma: response to infection
in relation to IgE. J. Allergy Clin. Immunol., 2003; 111: 1008–1016
61. Malo J.L., Lemiere C., Gautrin D., Labrecque M.: Occupational asthma. Curr. Opin.
Pulm. Med., 2004; 10: 57–61
62. Venables K.M., Chan-Yeung M.: Occupational asthma. Lancet, 1997; 349: 1465–1469
63. Chan-Yeung M., Malo J.L.: Table of the major inducers of occupational asthma. In:
Bernstein I.L., Chan-Yeung M., Malo J.L., Bernstein D.I., eds: Asthma in the work-
place. New York, Marcel Dekker, 1999: 683–720
64. Newman L.S.: Occupational asthma. Diagnosis, management, and prevention. Clin.
Chest Med., 1995; 16: 621–636
65. Fabbri L.M., Caramori G., Maestrelli P.: Etiology of occupational asthma. In: Roth R.A.,
ed.: Comprehensive toxicology: toxicology of the respiratory system. Cambridge,
Pergamon Press, 1997: 425–435
66. Bernstein I.L., Chan-Yeung M., Malo J.L., Bernstein D.I.: Definition and classification
of asthma. In: Bernstein I.L., Chan-Yeung M., Malo J.L., Bernstein D.I., eds: Asthma in
the workplace. New York, Marcel Dekker, 1999: 1–4
67. Chan-Yeung M., Malo J.L.: Aetiological agents in occupational asthma. Eur. Respir. J.,
1994; 7: 346–371
68. Nicholson P.J., Cullinan P., Taylor A.J., Burge P.S., Boyle C.: Evidence based guidelines
for the prevention, identification, and management of occupational asthma. Occup.
Environ. Med., 2005; 62: 290–299
69. Blanc P.D., Toren K.: How much adult asthma can be attributed to occupational fac-
tors? Am. J. Med., 1999; 107: 580–587
70. Sastre J., Vandenplas O., Park H.S.: Pathogenesis of occupational asthma. Eur. Respir.
J., 2003; 22: 364–373
71. Maestrelli P., Fabbri L.M., Malo J.L.: Occupational allergy. In: Holgate S.T., Church
M.K., Lichtenstein L.M., eds: Allergy. 2nd ed. London, Mosby Int.
72. Frew A., Chang J.H., Chan H., Quirce S., Noertjojo K., Keown P., et al.: T-lymphocyte
responses to plicatic acid-human serum albumin conjugate in occupational asthma
caused by western red cedar. J. Allergy Clin. Immunol., 1998; 101 (6 Pt 1): 841–847
73. Bernstein I.L., ed.: Asthma in the workplace. New York, Marcel Dekker, 1993

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
74. Chalmers G.W., Macleod K.J., Little S.A., Thomson L.J., McSharry C.P., Thomson N.C.:
Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma.
Thorax, 2002; 57: 226–230
75. Chaudhuri R., Livingston E., McMahon A.D., Thomson L., Borland W., Thomson N.C.:
Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic
asthma. Am. J. Respir. Crit. Care Med., 2003; 168: 1308–1311
76. Bateman E.D., Boushey H.A., Bousquet J., Busse W.W., Clark T.J., Pauwels R.A., et
al.: Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma
ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
77. Strachan D.P., Cook D.G.: Health effects of passive smoking. 6. Parental smoking
and childhood asthma: longitudinal and casecontrol studies. Thorax, 1998; 53:
204–212
78. Strachan D.P., Cook D.G.: Health effects of passive smoking .5. Parental smoking and
allergic sensitisation in children. Thorax, 1998; 53: 117–123
79. Kulig M., Luck W., Lau S., Niggemann B., Bergmann R., Klettke U., et al.: Effect of pre-
and postnatal tobacco smoke exposure on specific sensitization to food and inhalant
allergens during the first 3 years of life. Multicenter Allergy Study Group, Germany.
Allergy, 1999; 54: 220–228
80. Dezateux C., Stocks J., Dundas I., Fletcher M.E.: Impaired airway function and wheez-
ing in infancy: the influence of maternal smoking and a genetic predisposition to
asthma. Am. J. Respir. Crit. Care Med., 1999; 159: 403–410
81. Nafstad P., Kongerud J., Botten G., Hagen J.A., Jaakkola J.J.: The role of passive
smoking in the development of bronchial obstruction during the first 2 years of life.
Epidemiology, 1997; 8: 293–297
82. Environmental tobacco smoke: a hazard to children. American Academy of Pediatrics
Committee on Environmental Health. Pediatrics, 1997; 99: 639–642
83. American Thoracic Society. What constitutes an adverse health effect of air pollution?
Official statement of the American Thoracic Society. Am. J. Respir. Crit. Care Med.,
2000; 161 (2 Pt 1): 665–673
84. Gauderman W.J., Avol E., Gilliland F., Vora H., Thomas D., Berhane K., et al.: The
effect of air pollution on lung development from 10 to 18 years of age. N. Engl. J.
Med., 2004; 351: 1057–1067
85. Anto J.M., Soriano J.B., Sunyer J., Rodrigo M.J., Morell F., Roca J., et al.: Long term
outcome of soybean epidemic asthma after an allergen reduction intervention.
Thorax, 1999; 54: 670–674
86. Chen L.L., Tager I.B., Peden D.B., Christian D.L., Ferrando R.E., Welch B.S., et al.:
Effect of ozone exposure on airway responses to inhaled allergen in asthmatic sub-
jects. Chest, 2004; 125: 2328–2335
87. Marks G.B., Colquhoun J.R., Girgis S.T., Koski M.H., Treloar A.B., Hansen P., et al.:
Thunderstorm outflows preceding epidemics of asthma during spring and summer.
Thorax, 2001; 56: 468–471
88. Friedman N.J., Zeiger R.S.: The role of breast-feeding in the development of allergies
and asthma. J. Allergy Clin. Immunol., 2005; 115: 1238–1248
89. Devereux G., Seaton A.: Diet as a risk factor for atopy and asthma. J. Allergy Clin.
Immunol., 2005; 115: 1109–1117
90. Tattersfield A.E., Knox A.J., Britton J.R., Hall I.P.: Asthma. Lancet, 2002; 360: 1313–1322
91. Cohn L., Elias J.A., Chupp G.L.: Asthma: mechanisms of disease persistence and pro-
gression. Annu. Rev. Immunol., 2004; 22: 789–815
92. Bousquet J., Jeffery P.K., Busse W.W., Johnson M., Vignola A.M.: Asthma. From bron-
choconstriction to airways inflammation and remodeling. Am. J. Respir. Crit. Care
Med., 2000; 161: 1720–1745
93. Galli S.J., Kalesnikoff J., Grimbaldeston M.A., Piliponsky A.M., Williams C.M., Tsai M.:
Mast cells as „tunable” effector and immunoregulatory cells: recent advances. Annu.
Rev. Immunol., 2005; 23: 749–786
94. Robinson D.S.: The role of the mast cell in asthma: induction of airway hyperrespon-
siveness by interaction with smooth muscle? J. Allergy Clin. Immunol., 2004; 114:
58–65
95. Kay A.B., Phipps S., Robinson D.S.: A role for eosinophils in airway remodelling in
asthma. Trends Immunol., 2004; 25: 477–482
96. Larche M., Robinson D.S., Kay A.B.: The role of T lymphocytes in the pathogenesis of
asthma. J. Allergy Clin. Immunol., 2003; 111: 450–463
97. Akbari O., Faul J.L., Hoyte E.G., Berry G.J., Wahlstrom J., Kronenberg M., et al.: CD4+
invariant T-cell-receptor+ natural killer T cells in bronchial asthma. N. Engl. J. Med.,
2006; 354: 1117–1129
98. Kuipers H., Lambrecht B.N.: The interplay of dendritic cells, Th2 cells and regulatory
T cells in asthma. Curr. Opin. Immunol., 2004; 16: 702–708
99. Peters-Golden M.: The alveolar macrophage: the forgotten cell in asthma. Am. J.
Respir. Cell Mol. Biol., 2004; 31: 3–7
100. Wenzel S.: Mechanisms of severe asthma. Clin. Exp. Allergy, 2003; 33: 1622–1628
101. Chung K.F.: Airway smooth muscle cells: contributing to and regulating airway mu-
cosal inflammation? Eur. Respir. J., 2000; 15: 961–968
102. Groneberg D.A., Quarcoo D., Frossard N., Fischer A.: Neurogenic mechanisms in
bronchial inflammatory diseases. Allergy, 2004; 59: 1139–1152
103. Barnes P.J., Chung K.F., Page C.P.: Inflammatory mediators of asthma: an update.
Pharmacol. Rev., 1998; 50: 515–596
104. Miller A.L., Lukacs N.W.: Chemokine receptors: understanding their role in asthmatic
disease. Immunol. Allergy Clin. North Am., 2004; 24: 667–683, vii
105. Leff A.R.: Regulation of leukotrienes in the management of asthma: biology and
clinical therapy. Annu. Rev. Med., 2001; 52: 1–14
106. Barnes P.J.: Cytokine modulators as novel therapies for asthma. Annu. Rev. Pharmacol.
Toxicol., 2002; 42: 81–98
107. Ricciardolo F.L., Sterk P.J., Gaston B., Folkerts G.: Nitric oxide in health and disease of
the respiratory system. Physiol. Rev., 2004; 84: 731–765
108. Smith A.D., Taylor D.R.: Is exhaled nitric oxide measurement a useful clinical test in
asthma? Curr. Opin. Allergy Clin. Immunol., 2005; 5: 49–56
109. James A.: Airway remodeling in asthma. Curr. Opin. Pulm. Med., 2005; 11: 1–6
110. Vignola A.M., Mirabella F., Costanzo G., Di Giorgi R., Gjomarkaj M., Bellia V., et al.:
Airway remodeling in asthma. Chest, 2003; 123 (3 suppl.): 417S–422S
111. Hirst S.J., Martin J.G., Bonacci J.V., Chan V., Fixman E.D., Hamid Q.A., et al.:
Proliferative aspects of airway smooth muscle. J. Allergy Clin. Immunol., 2004; 114
(2 suppl.): S2–S17
112. Black J.L.: Asthma – more muscle cells or more muscular cells? Am. J. Respir. Crit.
Care Med., 2004; 169: 980–981
113. McParland B.E., Macklem P.T., Pare P.D.: Airway wall remodeling: friend or foe? J.
Appl. Physiol., 2003; 95: 426–434
114. Wang L., McParland B.E., Pare P.D.: The functional consequences of structural chang-
es in the airways: implications for airway hyperresponsiveness in asthma. Chest,
2003; 123 (3 suppl.): 356S–362S
115. Tillie-Leblond I., Gosset P., Tonnel A.B.: Inflammatory events in severe acute asthma.
Allergy, 2005; 60: 23–29
116. Newson R., Strachan D., Archibald E., Emberlin J., Hardaker P., Collier C.: Acute asth-
ma epidemics, weather and pollen in England, 1987–1994. Eur. Respir. J., 1998; 11:
694–701
117. Tan W.C.: Viruses in asthma exacerbations. Curr. Opin. Pulm. Med., 2005; 11: 21–26
118. Calhoun W.J.: Nocturnal asthma. Chest, 2003; 123 (3 suppl.): 399S–405S
119. Bumbacea D., Campbell D., Nguyen L., Carr D., Barnes P.J., Robinson D., et al.:
Parameters associated with persistent airflow obstruction in chronic severe asthma.
Eur. Respir. J., 2004; 24: 122–128
120. Thomson N.C., Chaudhuri R., Livingston E.: Asthma and cigarette smoking. Eur.
Respir. J., 2004; 24: 822–833

WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
Rozdział 2. Rozpoznanie
i klasyfikacja
Wprowadzenie
Prawidłowe rozpoznanie astmy jest niezbędne do
zastosowania właściwej farmakoterapii. Objawy
podmiotowe astmy mogą przemijać i być niedoce-
niane przez chorych i lekarzy bądź też – ponieważ
są nieswoiste – mogą prowadzić do błędnego rozpo-
znania (np. zapalenia oskrzeli ze świstami, POChP
lub duszności związanej z podeszłym wiekiem).
Szczególnie dotyczy to dzieci, u których błędne
rozpoznania obejmują różne postaci zapalenia
oskrzeli i prowadzą do niewłaściwego leczenia.
Rozpoznanie kliniczne
Wywiad
Objawy podmiotowe
Rozpoznanie kliniczne astmy jest często oparte
na napadowych objawach podmiotowych, takich
jak duszność, świszczący oddech, kaszel i uczucie
ściskania w klatce piersiowej.
1
Pomocnymi wska-
zówkami diagnostycznymi są również: występo-
wanie objawów po przypadkowym narażeniu na
alergen, sezonowa zmienność objawów oraz do-
datni wywiad rodzinny w kierunku astmy i cho-
rób atopowych. Astma związana z nieżytem nosa
może występować okresowo, a między okresami
narażenia na czynnik sprawczy chory w ogóle nie
ma objawów; może też dochodzić do sezonowego
pogorszenia objawów astmy lub nasilenia astmy
przewlekłej. Cechy objawów zdecydowanie wska-
zujące na astmę to: zmienność, występowanie
po narażeniu na nieswoiste czynniki drażniące,
takie jak dym, opary, silne zapachy lub wysiłek
fizyczny; nasilenie w nocy oraz ustępowanie pod
wpływem właściwego leczenia przeciwastma-
tycznego.
Rycina 2-1 zawiera pytania przydatne
w rozpoznaniu astmy.
U niektórych uczulonych chorych astma może
się nasilać w wyniku sezonowego wzrostu ekspo-
zycji na określone aeroalergeny,
2
takie jak Alter-
naria oraz pyłki brzozy, traw i ambrozji.
Wariant kaszlowy astmy
Przewlekły kaszel jest główną, jeśli nie jedyną
dolegliwością u chorych z wariantem kaszlowym
astmy.
3
Występuje on szczególnie często u dzieci
i zwykle stanowi większy problem w nocy; wyni-
Główne punkty
n
Rozpoznanie kliniczne astmy jest często oparte
na napadowych objawach podmiotowych, takich
jak duszność, świszczący oddech, kaszel i uczucie
ściskania w klatce piersiowej.
n
Pomiary czynności płuc (spirometria lub pomiar
szczytowego przepływu wydechowego) pozwa-
lają ocenić stopień, odwracalność i zmienność
ograniczenia przepływu powietrza w drogach
oddechowych oraz potwierdzają rozpoznanie
astmy.
n
Badania w kierunku alergii mogą pomóc zidenty-
fikować czynniki ryzyka, które wywołują objawy
astmy u poszczególnych chorych.
n
Do rozpoznania astmy u dzieci w wieku 5 lat
i młodszych, u osób w podeszłym wieku oraz
w astmie zawodowej mogą być konieczne spe-
cjalne metody.
n
U chorych z objawami typowymi dla astmy, ale
z prawidłową czynnością płuc, pomocne w usta-
leniu rozpoznania mogą być pomiary reaktywno-
ści dróg oddechowych.
n
Astmę klasyfikowano we wcześniejszych rapor-
tach na podstawie ciężkości. Jednakże ciężkość
astmy może się zmieniać z upływem czasu i zale-
ży nie tylko od ciężkości samej choroby, ale rów-
nież od odpowiedzi na leczenie.
n
W celu ułatwienia postępowania klinicznego za-
leca się klasyfikowanie astmy na podstawie stop-
nia jej kontroli.
n
Kliniczną kontrolę astmy definiuje się następują-
cymi kryteriami:
1)
Nie występują objawy podmiotowe w ciągu
dnia (nie częściej niż 2 razy w tygodniu).
2)
Dzienna aktywność nie jest ograniczona, w tym
możliwość wykonywania ćwiczeń fizycznych.
3)
Nie występują objawy w nocy i astma nie bu-
dzi chorego w nocy.
4)
Nie ma potrzeby stosowania leków doraźnych
(nie częściej niż 2 razy w tygodniu).
5)
Czynność płuc jest prawidłowa lub niemal pra-
widłowa.
6)
Nie występują zaostrzenia astmy.

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
ki badań przeprowadzonych w ciągu dnia mogą
być prawidłowe. U tych chorych szczególnie waż-
ne jest udokumentowanie zmienności czynności
płuc lub nadreaktywności dróg oddechowych oraz
prawdopodobnie także ocena liczby eozynofilów
w plwocinie.
4
Wariant kaszlowy astmy trzeba od-
różnić od tzw. eozynofilowego zapalenia oskrzeli,
w którym chory kaszle i ma eozynofilię plwociny,
natomiast prawidłowe wskaźniki czynności płuc,
oceniane za pomocą spirometrii i próby prowoka-
cyjnej w kierunku nadreaktywności dróg odde-
chowych.
5
W rozpoznaniu różnicowym należy też
uwzględnić kaszel wywoływany przez inhibitory
konwertazy angiotensyny (ACE), refluks żołąd-
kowoprzełykowy, spływanie wydzieliny po tylnej
ścianie gardła, przewlekłe zapalenie zatok przy-
nosowych i dysfunkcję fałdów głosowych.
6
Skurcz oskrzeli wywoływany przez wysiłek
fizyczny
Aktywność fizyczna jest ważną przyczyną obja-
wów astmatycznych u większości chorych, a u nie-
których – jedyną przyczyną. Skurcz oskrzeli wy-
woływany przez wysiłek fizyczny zwykle rozwija
się w ciągu 5–10 minut po zakończeniu wysiłku
(rzadko podczas wysiłku). U chorego występu-
ją typowe objawy podmiotowe astmy, a niekie-
dy uciążliwy kaszel, który ustępuje samoistnie
w ciągu 30–45 minut. Niektóre formy wysiłku fi-
zycznego, takie jak bieganie, są silniejszymi czyn-
nikami wyzwalającymi objawy astmy.
7
Skurcz
oskrzeli wywoływany przez wysiłek fizyczny
może wystąpić w każdych warunkach klimatycz-
nych, ale zdarza się częściej, gdy chory oddycha
suchym, zimnym powietrzem, a rzadziej w klima-
cie gorącym i wilgotnym.
8
Szybka poprawa objawów powysiłkowych po
inhalacji β
2
mimetyku lub zapobieżenie wystąpie-
niu objawów poprzez inhalację β
2
-mimetyku przed
wysiłkiem fizycznym potwierdza rozpoznanie
astmy. U niektórych dzieci z astmą objawy wystę-
pują wyłącznie po wysiłku fizycznym. W tej gru-
pie, a także u pacjentów, u których istnieją wątpli-
wości co do rozpoznania, pomocne jest wykonanie
próby wysiłkowej. Próba polegająca na 8minuto-
wym biegu jest łatwa do przeprowadzenia w prak-
tyce i może potwierdzić rozpoznanie astmy.
9
Badanie przedmiotowe
Ponieważ objawy astmy charakteryzują się
zmiennością, wynik badania przedmiotowego
układu oddechowego może być prawidłowy. Naj-
częstszą nieprawidłowością stwierdzaną w bada-
niu przedmiotowym są świsty wykrywane osłu-
chiwaniem płuc, które potwierdzają ograniczenie
przepływu powietrza w drogach oddechowych.
Jednakże u niektórych chorych na astmę świsty
mogą nie występować lub można je wykryć tylko
podczas nasilonego wydechu, nawet w przypad-
ku znacznego ograniczenia przepływu powietrza.
Niekiedy w ciężkich zaostrzeniach astmy świsty
mogą nie występować wskutek dużego ograni-
czenia przepływu powietrza i wentylacji. Jednak
u chorych w tym stanie zwykle występują inne
objawy przedmiotowe świadczące o zaostrzeniu
i jego ciężkości, takie jak sinica, zaburzenia świa-
domości, trudności w mówieniu, tachykardia,
wdechowe ustawienie klatki piersiowej, praca
dodatkowych mięśni oddechowych i zaciąganie
międzyżebrzy.
Inne objawy przedmiotowe mogą występować,
gdy bada się chorego w okresach objawowych. Ce-
chy rozdęcia płuc są wynikiem oddychania przy
większych objętościach płuc w celu zwiększenia
zewnętrznego pociągania ścian dróg oddecho-
wych i utrzymania drożności mniejszych oskrzeli
(które są zwężone wskutek skurczu mięśni gład-
kich, obrzęku i nadmiernego wydzielania śluzu).
Połączenie rozdęcia płuc i ograniczenia prze-
pływu powietrza w zaostrzeniu astmy wyraźnie
zwiększa pracę oddechową.
Ryc. 2-1. Pytania, które warto zadać
w diagnostyce astmy
Czy pacjent miał napad lub nawracające napady
świszczącego oddechu?
Czy pacjent miewa w nocy męczący kaszel?
Czy u pacjenta występuje świszczący oddech lub kaszel po
wysiłku fizycznym?
Czy u pacjenta występuje świszczący oddech, uczucie
ściskania w klatce piersiowej lub kaszel po narażeniu na
alergeny wziewne lub zanieczyszczenia powietrza?
Czy pacjent skarży się, że przeziębienia „schodzą na płuca”
lub trwają dłużej niż 10 dni?
Czy objawy ustępują pod wpływem właściwego leczenia
przeciwastmatycznego?

WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
Badania pomocnicze służące
do rozpoznania i monitorowania
Pomiary czynności płuc
Rozpoznanie astmy zwykle opiera się na występo-
waniu charakterystycznych objawów. Jednakże
pomiary czynności płuc, a szczególnie wykazanie
odwracalności zaburzeń czynności płuc, ogrom-
nie zwiększają pewność rozpoznania. Dzieje się
tak, ponieważ chorzy na astmę często mają trud-
ności w ocenie nasilenia objawów, zwłaszcza jeśli
astma jest ciężka i trwa od dawna.
10
Ocena przez
lekarza takich objawów, jak duszność i świszczący
oddech, również może być niedokładna. Pomiary
czynności płuc pozwalają ocenić stopień, odwra-
calność i zmienność ograniczenia przepływu po-
wietrza w drogach oddechowych oraz potwierdza-
ją rozpoznanie astmy. Chociaż wyniki pomiarów
czynności płuc nie wykazują ścisłej korelacji z ob-
jawami i innymi wskaźnikami kontroli choroby
u dorosłych
11
i dzieci
12
, dostarczają one informa-
cji uzupełniających na temat różnych aspektów
kontroli astmy.
Dostępne są różne metody oceny ograniczenia
przepływu powietrza w drogach oddechowych,
ale dwie z nich zostały szeroko przyjęte do stoso-
wania u chorych po 5. roku życia. Badania te to
spirometria, szczególnie pomiar natężonej pierw-
szosekundowej objętości wydechowej (FEV
1
) i na-
tężonej pojemności życiowej (FVC) oraz pomiary
szczytowego przepływu wydechowego (PEF).
Na podstawie badań populacyjnych ustalono
wartości FEV
1
, FVC i PEF należne dla wieku,
płci i wzrostu. Wartości te są ciągle weryfikowa-
ne i z wyjątkiem PEF, którego przedział wartości
należnych jest zbyt szeroki, są przydatne do oce-
ny, czy określona wartość uzyskana u pacjenta
jest nieprawidłowa.
Określenia „
odwracalność” i „zmienność”
odnoszą się do zmian objawów, którym towarzy-
szą zmiany stopnia ograniczenia przepływu po-
wietrza w drogach oddechowych, występujące sa-
moistnie lub w odpowiedzi na leczenie. „Odwra-
calność” na ogół odnosi się do szybkiej poprawy
FEV1 (lub PEF) mierzonej w ciągu minut po in-
halacji szybko działającego leku rozszerzającego
oskrzela – na przykład 200–400 μg salbutamolu
13
– lub bardziej trwałej poprawy w ciągu dni lub
tygodni po rozpoczęciu skutecznego leczenia kon-
trolującego chorobę, na przykład glikokortyko-
steroidem wziewnym
13
. „Zmienność” odnosi się
do poprawy lub pogorszenia objawów i czynności
płuc zachodzących z upływem czasu. Zmienność
może zachodzić w ciągu jednego dnia (wówczas
jest nazywana zmiennością okołodobową), z dnia
na dzień, z miesiąca na miesiąc lub sezonowo.
Stwierdzenie zmienności w wywiadzie jest pod-
stawową składową rozpoznania astmy. Ponadto
zmienność jest jednym z parametrów oceny kon-
troli astmy.
Spirometria jest zalecaną metodą pomiaru
ograniczenia przepływu powietrza w drogach od-
dechowych i jego odwracalności w celu ustalenia
rozpoznania astmy. Pomiary FEV
1
i FVC wyko-
nuje się podczas natężonego wydechu za pomocą
spirometru. Opublikowano zalecenia dotyczące
standaryzacji spirometrii.
1315
Jako stopień od-
wracalności FEV
1
, który wskazuje na astmę, na
ogół przyjmuje się wartość ≥12% (lub ≥200 ml)
w stosunku do wartości przed inhalacją leku roz-
kurczającego oskrzela.
13
Jednakże u większości
chorych na astmę nie stwierdza się odwracalności
przy każdym pomiarze, zwłaszcza u tych w trak-
cie leczenia, i dlatego badanie to nie jest czułe.
Poleca się powtarzanie badania podczas różnych
wizyt.
Spirometria jest badaniem powtarzalnym, ale
zależy od wysiłku, jaki pacjent włoży w wykona-
nie natężonego wydechu. Konieczne jest więc od-
powiednie poinstruowanie pacjenta i zapisanie
największej wartości z 3 pomiarów. Wykazano
różnice etniczne w wartościach spirometrycz-
nych, dlatego dla każdego pacjenta powinno się
określić wartości należne FEV
1
i FVC. Przedział
wartości prawidłowych jest szerszy i wartości na-
leżne są mniej wiarygodne u osób młodych (<20
lat) i osób w podeszłym wieku (>70 lat). Ponieważ
wiele chorób płuc może powodować zmniejszenie
FEV
1
, przydatny do oceny ograniczenia przepływu
powietrza w drogach oddechowych jest stosunek
FEV
1
do FVC. Normalnie przekracza on 0,75–0,80,
a u dzieci nawet 0,90. Wartości mniejsze wskazują
na ograniczenie przepływu powietrza.
Pomiary
szczytowego przepływu wyde-
chowego wykonuje się za pomocą miernika szczy-
towego przepływu (tzw. pikflometru); mogą one
stanowić dużą pomoc zarówno w rozpoznaniu, jak
i monitorowaniu astmy. Współczesne modele mier-
ników PEF są stosunkowo niedrogie, przenośne,
wykonane z plastyku i idealnie nadają się do co-
WYTYCZNE
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
dziennych obiektywnych pomiarów ograniczenia
przepływu powietrza w drogach oddechowych
w warunkach domowych. Jednakże pomiary PEF
nie są zamienne z innymi pomiarami czynności
płuc, takimi jak FEV
1
, ani u dorosłych
16
, ani
u dzieci
17
. PEF może niedoszacowywać stopnia
ograniczenia przepływu powietrza, szczególnie
gdy ograniczenie przepływu i pułapka powietrz-
na się powiększają. Ponieważ wartości PEF uzy-
skane za pomocą różnych mierników się różnią
i przedział wartości należnych jest zbyt szeroki,
to wartości PEF powinno się porównywać z naj-
lepszymi wynikami uzyskanymi u danego pacjen-
ta
18
za pomocą tego samego przyrządu. Wartość
najlepszą dla danego pacjenta zwykle uzyskuje się
wtedy, gdy pacjent nie ma objawów lub otrzymuje
pełne leczenie; jest to wartość referencyjna do mo-
nitorowania efektów zmian w leczeniu.
Do uzyskania wiarygodnych pomiarów PEF
konieczne jest dokładne poinstruowanie pacjen-
ta, ponieważ wynik pomiaru zależy od tego, jaki
wysiłek pacjent włoży w wykonanie natężonego
wydechu. Najczęściej PEF mierzy się rano zaraz
po wstaniu z łóżka, przed przyjęciem leków, kiedy
wartości zwykle są najmniejsze, oraz wieczorem
przed udaniem się na spoczynek, kiedy wartości
zwykle są większe. Jedną z metod opisywania do-
bowej zmienności PEF jest jego amplituda (różni-
ca między wartością maksymalną i wartością mi-
nimalną w danym dniu), wyrażona jako odsetek
średniej wartości PEF w ciągu dnia i uśredniona
dla okresu 1–2 tygodni.
19
Inną metodą przedsta-
wiania zmienności PEF jest minimalna wartość
poranna PEF przed inhalacją leku rozszerzają-
cego oskrzela w ciągu jednego tygodnia wyra-
żona jako odsetek ostatniej wartości najlepszej
(minimum % maksimum) (
ryc. 2-2).
19
Sugeruje
się, że ta druga metoda jest najlepszym wskaź-
nikiem PEF do oceny zmienności obturacji dróg
oddechowych w praktyce klinicznej, ponieważ
wymaga wykonywania pomiarów tylko raz dzien-
nie, koreluje lepiej niż jakikolwiek inny wskaźnik
z nadreaktywnością oskrzeli i polega na prostym
obliczeniu.
Monitorowanie PEF jest cenne w podgrupie
chorych na astmę i może być pomocne:
1)
do potwierdzenia rozpoznania astmy.
Chociaż spirometria jest preferowaną meto-
dą dokumentowania ograniczenia przepływu
powietrza w drogach oddechowych, to zwięk-
szenie PEF po inhalacji leku rozszerzającego
oskrzela o 60 l/min (lub 20% lub więcej warto-
ści PEF przed inhalacją leku rozszerzającego
oskrzela)
20
lub zmienność dobowa PEF wyno-
rozpoczęcie leczenia glikokortykosteroidami wziewnymi
tygodnie leczenia glikokortykosteroidami wziewnymi
PEF (l/min)
0
-1
0
1
2
3
4
5
6
7
8
9
10
100
200
300
400
500
600
700
800
310/700
= 44%
500/710
= 70%
620/720
= 86%
Ryc. 2-2. Pomiar zmien-
ności PEF. (Wykres PEF
27-letniego mężczyz-
ny z długotrwałą, źle
kontrolowaną astmą,
przed leczeniem gli-
kokortykosteroidami
wziewnymi i po roz-
poczęciu leczenia. Po
rozpoczęciu leczenia
wartości PEF wzrosły,
a zmienność PEF się
zmniejszyła, co wi-
dać jako zwiększenie
min%max (najmniejsza
poranna wartość PEF/
wartość maksymalna
PEF [%]) w ciągu tygo-
dnia.

WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
sząca >20% (>10% przy 2 pomiarach dzien-
nie
21
) sugeruje rozpoznanie astmy.
2)
do poprawy kontroli astmy, szczególnie
u chorych słabo odczuwających obja-
wy.
10
Programy leczenia astmy obejmujące
samodzielne monitorowanie objawów lub PEF
w celu wczesnego leczenia zaostrzeń wykazały
lepsze wyniki.
22
Łatwiej jest odróżnić odpo-
wiedź na leczenie na podstawie karty, na której
zapisuje się PEF niż na podstawie dzienniczka
z odnotowywanymi wartościami PEF, pod wa-
runkiem że stale używa się tej samej karty.
23
3)
do wykrycia środowiskowych (w tym
zawodowych) przyczyn objawów astma-
tycznych. W tym celu pacjent monitoruje
PEF codziennie lub kilka razy każdego dnia
w okresie podejrzewanego narażenia na czyn-
niki ryzyka w domu lub w miejscu pracy, lub
podczas wysiłku fizycznego bądź innych ak-
tywności, które mogą wywoływać objawy oraz
w okresach bez narażenia.
Pomiary reaktywności dróg oddechowych
U pacjentów z objawami astmatycznymi, ale pra-
widłową czynnością płuc, pomiary reaktywności
dróg oddechowych na metacholinę, histaminę,
mannitol lub obciążenie wysiłkiem fizycznym
mogą pomóc rozpoznać astmę.
24
Pomiary re-
aktywności dróg oddechowych odzwierciedlają
„wrażliwość” dróg oddechowych na czynniki, któ-
re wywołują objawy astmy, niekiedy zwane czyn-
nikami wyzwalającymi, a wynik badania zwykle
wyraża się stężeniem (lub dawką) prowokującym
agonisty powodującym określone zmniejszenie
(często o 20%) FEV
1
(
ryc. 2-3). Badania te są
czułe w rozpoznaniu astmy, ale mają ograniczoną
swoistość.
25
Oznacza to, że ujemny wynik badania
może być pomocny w wykluczeniu rozpoznania
astmy przewlekłej u pacjenta, który nie przyjmuje
glikokortykosteroidów wziewnych, ale wynik do-
datni nie zawsze oznacza, że pacjent ma astmę.
26
Jest tak dlatego, że nadreaktywność oskrzeli opi-
sano też u chorych na alergiczny nieżyt nosa
27
oraz u chorych z ograniczeniem przepływu po-
wietrza w drogach oddechowych spowodowanym
innymi chorobami niż astma, takimi jak mukowi-
scydoza,
28
rozstrzenie oskrzeli i przewlekła obtu-
racyjna choroba płuc (POChP)
29
.
Nieinwazyjne markery zapalenia dróg
oddechowych
Zapalenie dróg oddechowych u chorych na ast-
mę można oceniać za pomocą badania plwociny
wykrztuszanej samoistnie lub indukowanej hi-
pertonicznym roztworem NaCl, w kierunku cech
zapalenia eozynofilowego lub neutrofilowego.
30
Jako nieinwazyjne metody oceny zapalenia dróg
oddechowych w astmie proponuje się pomiary
stężenia w powietrzu wydechowym tlenku azotu
(FeNO)
31
i tlenku węgla (FeCO)
32
. U chorych na
astmę (nieprzyjmujących glikokortykosteroidów
wziewnych), w porównaniu z osobami bez astmy,
stężenie FeNO jest zwiększone, ale nie jest to ob-
jaw swoisty dla astmy. Przydatność oceny plwoci-
0
0,03
0,3
2
16
64
20
40
60
histamina (mg/ml)
metacholina (mg/ml)
zmniejszenie FEV
1
(%)
normalna
reaktywność
łagodna AHR
umiarkowana
AHR
ciężka AHR
PC
20
Ryc. 2-3. Pomiar reaktywności dróg
oddechowych. Reaktywność dróg od-
dechowych na wziewną metacholinę
lub histaminę u zdrowych osób i u cho-
rych na astmę z łagodną, umiarkowa-
ną i ciężką nadreaktywnością oskrzeli
(AHR). U chorych na astmę występuje
zwiększona wrażliwość i zwiększona
maksymalna odpowiedź skurczowa
na agonistę. Odpowiedź na agonistę
wyraża się zwykle jako stężenie wy-
wołujące zmniejszenie FEV
1
o 20%
(PC
20
).

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
ny pod kątem liczby eozynofilów i pomiaru FeNO
nie została oceniona w badaniach prospektyw-
nych, niemniej jednak pomiary te ocenia się pod
kątem zastosowania w określaniu optymalnego
leczenia.
33,34
Diagnostyka alergii
Z powodu silnego związku między astmą i alergicz-
nym nieżytem nosa występowanie alergii, chorób
alergicznych, a szczególnie alergicznego nieżytu
nosa zwiększa prawdopodobieństwo rozpoznania
astmy u pacjentów z objawami ze strony układu
oddechowego. Ponadto stwierdzenie alergii u cho-
rych na astmę (na podstawie prób skórnych lub
oznaczenia swoistych IgE w surowicy) może po-
móc zidentyfikować czynniki ryzyka, które wy-
wołują objawy astmy u poszczególnych chorych.
Próba prowokacyjna z użyciem podejrzewanego
alergenu lub czynnika uczulającego może również
pomóc w ustaleniu przyczyny choroby, zwłaszcza
w warunkach narażenia zawodowego, ale nie zale-
ca się rutynowego wykonywania tego badania, po-
nieważ rzadko jest przydatne w ustaleniu rozpo-
znania, wymaga znacznego doświadczenia i może
wywołać skurcz oskrzeli zagrażający życiu.
35
Podstawową metodą diagnostyczną wykrywa-
jącą alergię są alergenowe próby skórne. Są one
proste, tanie, bardzo czułe i wykonuje się je szyb-
ko. Jednakże wykonane nieprawidłowo mogą dać
wyniki fałszywie dodatnie lub fałszywie ujem-
ne. Pomiar stężenia swoistego IgE w surowicy
nie przewyższa wiarygodnością wyników prób
skórnych i jest droższy. Głównym ograniczeniem
metod rozpoznawania alergii jest to, że dodatni
wynik niekoniecznie oznacza, iż choroba ma pod-
łoże alergiczne lub że wywołuje astmę, ponieważ
niektóre osoby mają swoiste przeciwciała IgE,
natomiast nie występują u nich objawy podmio-
towe i może nie być związku przyczynowego. Eks-
pozycję na odpowiedni alergen oraz ich związek
z objawami musi potwierdzić wywiad chorobowy.
Ocena stężenia całkowitych IgE w surowicy nie
ma znaczenia w diagnostyce atopii.
Trudności diagnostyczne i rozpoznanie
różnicowe
Rozpoznanie różnicowe u chorych z podejrzeniem
astmy jest odmienne w poszczególnych grupach
wiekowych: niemowlęta, dzieci, młodzi dorośli
i osoby starsze.
Dzieci w wieku 5 lat i młodsze
Rozpoznanie astmy we wczesnym dzieciństwie
jest trudne i opiera się głównie na ocenie obja-
wów podmiotowych i przedmiotowych. Ponieważ
rozpoznanie „astmy” u dziecka ze świszczącym
oddechem ma poważne konsekwencje kliniczne,
trzeba wykluczyć inne przyczyny utrzymującego
się lub nawracającego świszczącego oddechu.
Epizody świszczącego oddechu i kaszlu są bar-
dzo częste nawet u dzieci bez astmy, szczególnie
u tych do 3. roku życia.
36
U dzieci w wieku 5 lat
i młodszych opisano 3 kategorie świszczącego od-
dechu:
1)
przemijające wczesne świsty, z których
dziecko często wyrasta w ciągu pierwszych
3 lat życia. Często są one związane z wcześniac
twem i paleniem tytoniu przez rodziców.
2)
utrzymujące się wczesne świsty (do 3.
rż.). U tych dzieci typowo występują nawraca-
jące epizody świszczącego oddechu związane
z ostrymi zakażeniami wirusowymi układu
oddechowego; dzieci te nie mają cech atopii
37
ani obciążającego wywiadu rodzinnego w kie-
runku atopii. Objawy podmiotowe utrzymują
się u nich zwykle przez okres szkolny i u dużej
części występują jeszcze w wieku 12 lat. Przy-
czyną epizodów świszczącego oddechu u dzieci
do 2. roku życia jest zwykle zakażenie wiru
sem RSV, natomiast u dzieci w wieku 2–5 lat
dominują inne wirusy.
3)
świsty o późnym początku lub astma.
Dzieci te chorują na astmę, która często utrzy-
muje się przez okres dzieciństwa i w wieku
dorosłym.
38,39
Typowo mają one wywiad ato-
powy, często wyprysk oraz zmiany patologicz-
ne w drogach oddechowych charakterystyczne
dla astmy.
Na astmę mocno wskazują następujące ob-
jawy: częste epizody świstów (częściej niż raz
w miesiącu), kaszel lub świsty wywoływane
przez aktywność fizyczną, kaszel występujący
w nocy niezwiązany z zakażeniem wirusowym,
niewystępowanie sezonowej zmienności świstów
oraz utrzymywanie się objawów po 3. roku ży-
cia. Wykazano, że wystąpienie astmy w późnym

WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
dzieciństwie można przewidywać na podstawie
prostego wskaźnika klinicznego, uwzględniające-
go występowanie świstów przez 3. rokiem życia
oraz jednego dużego czynnika ryzyka (astma lub
wyprysk u rodziców) albo 2 z 3 małych czynni-
ków ryzyka (eozynofilia, świszczący oddech bez
przeziębienia, alergiczny nieżyt nosa).
38
Nie wy-
kazano jednak, aby u dzieci zagrożonych leczenie
glikokortykosteroidami wziewnymi wpływało na
rozwój astmy.
40
Trzeba rozważyć i wykluczyć alternatywne
przyczyny nawracających świstów, do których
należą:
1) przewlekłe zapalenie błony śluzowej nosa i za-
tok przynosowych
2) refluks żołądkowoprzełykowy
3) nawracające zakażenia wirusowe dolnych
dróg oddechowych
4) mukowiscydoza
5) dysplazja oskrzelowopłucna
6) gruźlica
7) wady wrodzone powodujące zwężenie dróg od-
dechowych wewnątrz klatki piersiowej
8) aspiracja ciała obcego
9) zespół pierwotnej dyskinezji rzęsek
10) niedobory odporności
11) wrodzona choroba serca.
Wystąpienie objawów w okresie noworodko-
wym (z towarzyszącym zahamowaniem wzra-
stania), wymiotów lub miejscowych płucnych lub
sercowonaczyniowych objawów przedmiotowych
przemawia za alternatywnym rozpoznaniem
i wskazuje na potrzebę dalszych badań diagno-
stycznych.
Przydatną metodą służącą do potwierdzenia
rozpoznania astmy u dzieci w wieku 5 lat i młod-
szych jest próbne leczenie krótko działającymi le-
kami rozszerzającymi oskrzela i glikokortykoste-
roidami wziewnymi. Wyraźna poprawa kliniczna
w czasie leczenia i pogorszenie po jego zaprzesta-
niu potwierdza rozpoznanie astmy. Spirometria
i inne metody diagnostyczne zalecane dla dzieci
starszych i dorosłych, takie jak pomiary nadre-
aktywności dróg oddechowych i oznaczanie mar-
kerów zapalenia dróg oddechowych są trudne,
a niektóre wymagają skomplikowanego sprzę-
tu,
41
co sprawia, że nie nadają się do rutynowe-
go stosowania. Ponadto badania czynnościowe
płuc – zwykle stanowiące podstawę rozpoznania
i monitorowania astmy – są często niewiarygodne
u małych dzieci. Dzieci w wieku 4–5 lat można
nauczyć używania miernika PEF, ale pomiary
muszą być nadzorowane przez rodziców, aby ich
wyniki były wiarygodne.
42
Dzieci starsze i dorośli
Dokładny wywiad i badanie przedmiotowe wraz
z wykazaniem odwracalnej i zmiennej obturacji
dróg oddechowych (najlepiej za pomocą spiro-
metrii) w większości przypadków potwierdzają
rozpoznanie. Rozważenia wymagają następujące
rozpoznania alternatywne:
1) zespół hiperwentylacji i napady paniki
2) obturacja górnych dróg oddechowych i aspira-
cja ciał obcych
43
3) dysfunkcja fałdów głosowych
44
4) inne postaci obturacyjnej choroby płuc, szcze-
gólnie POChP
5) nieobturacyjne choroby płuc (np. rozlana śród-
miąższowa choroba płuc)
6) nieoddechowe przyczyny objawów (np. niewy-
dolność lewokomorowa).
Ponieważ astma jest częstą chorobą, może to-
warzyszyć każdej z wyżej wymienionych chorób,
co utrudnia rozpoznanie, jak również ocenę cięż-
kości i kontroli astmy. Szczególnie dotyczy to sy-
tuacji, kiedy astmie towarzyszy hiperwentylacja,
dysfunkcja fałdów głosowych lub POChP. Dokład-
na ocena i leczenie zarówno astmy, jak i choroby
współistniejącej, są często konieczne do ustalenia
udziału każdej z nich w objawach występujących
u pacjenta.
Osoby w podeszłym wieku
Nierozpoznana astma jest częstą przyczyną ule-
czalnych objawów ze strony układu oddechowego
u osób w podeszłym wieku, a częste występowanie
chorób współistniejących utrudnia rozpoznanie.
Świszczący oddech, duszność i kaszel powodowa-
ne przez niewydolność lewokomorową nazywa
się niekiedy „astmą sercową”, ale jest to mylą-
ce określenie i należy go unikać. Występowanie
nasilonych objawów podczas wysiłku fizycznego
i w nocy może dodatkowo utrudnić rozpoznanie,
ponieważ objawy te występują zarówno w astmie,
jak i w niewydolności lewokomorowej. W tej gru-
pie wiekowej często stosuje się β-blokery, nawet

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
miejscowo (w leczeniu jaskry). Dokładny wywiad
i badanie przedmiotowe, w połączeniu z EKG i ra-
diogramem klatki piersiowej, zwykle wyjaśniają
wątpliwości. U osób w podeszłym wieku szcze-
gólnie trudne jest rozróżnienie astmy i POChP;
może to wymagać próbnego leczenia lekami roz-
szerzającymi oskrzela lub glikokortykosteroidami
(doustnymi lub wziewnymi).
Leczenie astmy oraz ocena i osiągnięcie kon-
troli choroby u osób w podeszłym wieku utrud-
nia szereg czynników: słabe odczuwanie objawów
przez chorych, akceptacja duszności jako „nor-
malnej” w starszym wieku i obniżone oczekiwa-
nia co do mobilności i aktywności.
Astma zawodowa
Astma zawodowa często pozostaje nierozpozna-
na. Z powodu skrytego początku astmę zawo-
dową często bierze się za przewlekłe zapalenie
oskrzeli lub POChP i nie stosuje żadnego leczenia
albo leczy się niewłaściwie. Podejrzenie powinno
nasunąć pojawienie się nowych objawów, takich
jak nieżyt nosa, kaszel lub świszczący oddech,
szczególnie u osób niepalących tytoniu. Wykrycie
astmy zawodowej wymaga zebrania systematycz-
nego wywiadu dotyczącego historii pracy zawo-
dowej i narażeń. Do rozpoznania konieczne jest
stwierdzenie narażenia zawodowego na znane lub
podejrzewane czynniki uczulające, niewystępo-
wania objawów astmy przed zatrudnieniem lub
ewidentnego pogorszenia astmy po rozpoczęciu
pracy. Związek między występowaniem objawów
i pobytem w miejscu pracy (poprawa objawów
poza miejscem pracy i ich nasilenie po powrocie
do pracy) może być pomocny w ustaleniu powią-
zania między podejrzewanymi czynnikami uczu-
lającymi i astmą.
45
Ponieważ leczenie astmy zawodowej często
wymaga zmiany pracy przez chorego, rozpozna-
nie takie ma istotne implikacje społecznoeko-
nomiczne i ważne jest jego obiektywne potwier-
dzenie. Można to uzyskać, wykonując swoistą
oskrzelową próbę prowokacyjną,
46
aczkolwiek
niewiele jest ośrodków mających wyposażenie ko-
nieczne do przeprowadzenia takich badań. Inną
metodą jest monitorowanie PEF co najmniej
4 razy dziennie przez 2 tygodnie, kiedy pacjent
pracuje i przez podobny okres pobytu poza miej-
scem pracy.
4750
Coraz powszechniejsza świado-
mość, że astma zawodowa może się utrzymywać
lub ciągle pogarszać, nawet po ustaniu naraże-
nia na szkodliwy czynnik,
51
podkreśla potrzebę
wczesnego rozpoznania, by umożliwić przerwanie
ekspozycji i zastosowanie leczenia farmakologicz-
nego. Więcej informacji na temat wykrywania
astmy zawodowej zawierają odnośne wytyczne
oparte na danych naukowych.
52
Odróżnienie astmy od POChP
Zarówno astma, jak i POChP są ważnymi prze-
wlekłymi obturacyjnymi chorobami dróg odde-
chowych, w których toczy się zapalenie. POChP
cechuje się ograniczeniem przepływu powietrza
w drogach oddechowych, które nie jest w pełni
odwracalne, zwykle postępuje i wiąże się z niepra-
widłową odpowiedzią zapalną płuc na szkodliwe
cząstki lub gazy. U chorych na astmę narażonych
na szkodliwe czynniki (szczególnie palenie pa-
pierosów) może się rozwinąć trwałe ograniczenie
przepływu powietrza w drogach oddechowych
i zapalenie mieszane – podobne jak w astmie
i w POChP. A zatem, chociaż astmę zwykle można
odróżnić od POChP, to u niektórych osób z prze-
wlekłymi objawami oddechowymi i utrwalonym
zwężeniem dróg oddechowych bywa to trudne.
Dostępny jest kwestionariusz oparty na objawach,
służący do różnicowania POChP i astmy w pod-
stawowej opiece zdrowotnej.
53,54
Klasyfikacja astmy
Klasyfikacja etiologiczna
Podejmowano liczne próby podziału astmy na
podstawie jej etiologii, szczególnie ze względu
na uczulające czynniki środowiskowe. Jednakże
możliwość takiej klasyfikacji jest ograniczona, po-
nieważ u części chorych nie stwierdza się środowi-
skowego czynnika etiologicznego. Mimo to próba
zidentyfikowania środowiskowej przyczyny ast-
my (np. astmy zawodowej) powinna być składo-
wą wstępnej oceny klinicznej chorych, ponieważ
umożliwia zalecenie unikania narażenia. Rozpo-
znanie alergii jako przyczyny astmy zwykle przy-
nosi niewielkie korzyści, ponieważ rzadko udaje
się wykryć pojedynczy czynnik sprawczy.
WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
9
Klasyfikacja na podstawie ciężkości astmy
W poprzednich dokumentach GINA klasyfiko-
wano astmę na podstawie jej ciężkości, ocenia-
nej z uwzględnieniem nasilenia objawów pod-
miotowych, ograniczenia przepływu powietrza
w drogach oddechowych i zmienności parame-
trów czynności płuc. Wyróżniano 4 kategorie
– astmę sporadyczną, przewlekłą lekką, przewle-
kłą umiarkowaną i przewlekłą ciężką (
ryc. 2-4).
Klasyfikacja astmy na podstawie ciężkości jest
przydatna, gdy podejmuje się decyzję odnośnie
do leczenia przy pierwszej ocenie chorego. Trze-
ba pamiętać jednak, że ciężkość astmy obejmuje
zarówno ciężkość samej choroby, jak i odpowiedź
na leczenie.
45
Zatem astma z początkowymi cięż-
kimi objawami i zwężeniem dróg oddechowych
może zostać sklasyfikowana jako astma przewle-
kła ciężka podczas pierwszej wizyty u lekarza, ale
jeśli zareaguje w pełni na leczenie, wówczas może
być sklasyfikowana jako astma przewlekła umiar-
kowana. Ponadto ciężkość nie jest niezmienną ce-
chą poszczególnych chorych na astmę, lecz może
się zmieniać z upływem miesięcy lub lat.
W świetle tych rozważań nie zaleca się już wy-
korzystywania do podejmowania bieżących decyzji
terapeutycznych klasyfikacji astmy na podstawie
jej ciężkości, podanej na
rycinie 2-4, która jest
oparta bardziej na opinii ekspertów niż na danych
naukowych. Może ona natomiast nadal być przy-
datna do badań przekrojowych w celu scharak-
teryzowania grupy chorych na astmę, którzy nie
przyjmują glikokortykosteroidów wziewnych, jak
również w procesie selekcji pacjentów do badań
nad astmą. Głównym ograniczeniem tej klasyfi-
kacji jest mała wartość w przewidywaniu, jakie
leczenie będzie potrzebne i jaka może być odpo-
wiedź pacjenta. Do tych celów bardziej przydatna
może być okresowa ocena kontroli astmy.
Kontrola astmy
Kontrolę astmy można zdefiniować w różnoraki
sposób. Ogólnie rzecz biorąc, określenie „kontro-
la” może wskazywać na prewencję choroby lub
nawet jej wyleczenie. Jednakże w astmie, w której
obecnie nie jest to realne, kontrola odnosi się do
opanowania objawów choroby. Najlepiej, by od-
nosiła się ona nie tylko do objawów klinicznych,
ale również do laboratoryjnych markerów zapa-
lenia i patofizjologicznych cech choroby. Istnieją
dowody na to, że zmniejszenie zapalenia poprzez
stosowanie leczenia kontrolującego przebieg cho-
roby pozwala osiągnąć kontrolę kliniczną, ale ze
względu na koszt lub ograniczoną dostępność
badań, takich jak biopsja wewnątrzoskrzelowa
oraz oznaczanie liczby eozynofilów w plwocinie
i stężenia tlenku azotu w powietrzu wydycha
nym,
3034
zaleca się, by leczenie miało na celu
kontrolę objawów klinicznych choroby, w tym za-
burzeń czynności płuc.
Rycina 2-5 przedstawia
charakterystykę astmy kontrolowanej, częściowo
kontrolowanej i niekontrolowanej. Jest to robo-
Ryc. 2-4. Klasyfikacja ciężkości astmy
na podstawie obrazu klinicznego
przed leczeniem
astma sporadyczna
objawy rzadziej niż raz w tygodniu
zaostrzenia krótkotrwałe
objawy nocne nie częściej niż 2 razy w miesiącu
FEV
1
lub PEF ≥80% wartości należnej
zmienność PEF lub FEV
1
<20%
astma przewlekła lekka
objawy częściej niż 1 raz w tygodniu, ale rzadziej niż 1 raz
dziennie
zaostrzenia mogą zaburzać sen i utrudniać dzienną
aktywność
objawy nocne częściej niż 2 razy w miesiącu
FEV
1
lub PEF ≥80% wartości należnej
zmienność PEF lub FEV
1
<20–30%
astma przewlekła umiarkowana
objawy występują codziennie
zaostrzenia mogą zaburzać sen i utrudniać dzienną
aktywność
objawy nocne częściej niż raz w tygodniu
konieczność inhalacji krótko działającego
β
2
-mimetyku codziennie
FEV
1
lub PEF 60–80% wartości należnej
zmienność PEF lub FEV
1
>30%
astma przewlekła ciężka
objawy występują codziennie
częste zaostrzenia
częste objawy nocne
ograniczenie aktywności fizycznej
FEV
1
lub PEF ≤60% wartości należnej
zmienność PEF lub FEV
1
>30%

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
cza, jeszcze niezweryfikowana propozycja oparta
na aktualnych poglądach.
Pełną kontrolę astmy na ogół się uzyskuje, sto-
sując leczenie, którego celem powinno być osiąg-
nięcie i utrzymanie kontroli astmy przez dłuższy
czas
55
i jednocześnie pamiętanie o bezpieczeń-
stwie, potencjalnych skutkach niepożądanych
oraz koszcie leczenia koniecznego do osiągnięcia
tego celu.
W sprawdzonych metodach oceny kontro-
li klinicznej astmy punktuje się cele leczenia
jako zmienne ciągłe i uzyskuje wartości liczbo-
we wyróżniające poszczególne poziomy kontroli.
Przykładami sprawdzonych narzędzi są: Asth-
ma Control Test (ACT) (http://www.asthma-
control.com)
56
, Asthma Control Questionnaire
(ACQ) (www. http://www.qoltech.co.uk/Asthma1.
htm)
57
, Asthma Therapy Assesment Questionna-
ire (ATAQ) (www. http://www.ataqinstrument.
com)
58
oraz Asthma Control Scoring System
59
.
Nie każdy z tych instrumentów obejmuje pomia-
ry czynności płuc. Są one promowane nie tylko
do wykorzystania w badaniach naukowych, ale
również w opiece nad pacjentami, nawet w wa-
runkach podstawowej opieki zdrowotnej. Niektó-
re, nadające się do samodzielnego zastosowania
przez pacjentów, są dostępne w wielu językach
w internecie i w formie wydrukowanej, i mogą
być użyte przez pacjentów przed wizytą u lekarza
lub w trakcie takiej wizyty. Narzędzia te stwarza-
ją możliwość lepszej oceny kontroli astmy, dostar-
czając powtarzalnego obiektywnego wskaźnika,
który można odnotowywać (z tygodnia na tydzień
lub z miesiąca na miesiąc); odzwierciedla on po-
prawę komunikacji między pacjentem i lekarzem.
Ich wartość w praktyce klinicznej, w przeciwień-
stwie do badań naukowych, wymaga jeszcze udo-
wodnienia, ale wyjaśni się w najbliższych latach.
Piśmiennictwo
1. Levy M.L., Fletcher M., Price D.B., Hausen T., Halbert R.J., Yawn B.P.: International
Primary Care Respiratory Group (IPCRG) Guidelines: diagnosis of respiratory diseases
in primary care. Prim. Care Respir. J., 2006; 15: 20–34
2. Yssel H., Abbal C., Pene J., Bousquet J.: The role of IgE in asthma. Clin. Exp. Allergy,
1998; 28 (suppl. 5): 104–109
3. Corrao W.M., Braman S.S., Irwin R.S.: Chronic cough as the sole presenting manifes-
tation of bronchial asthma. N. Engl. J. Med., 1979; 300: 633–637
4. Gibson P.G., Fujimura M., Niimi A.: Eosinophilic bronchitis: clinical manifestations
and implications for treatment. Thorax, 2002; 57: 178–182
5. Gibson P.G., Dolovich J., Denburg J., Ramsdale E.H., Hargreave F.E.: Chronic cough:
eosinophilic bronchitis without asthma. Lancet, 1989; 1: 1346–1348
6. Irwin R.S., Boulet L.P., Cloutier M.M., Fuller R., Gold P.M., Hoffstein V., et al.: Managing
cough as a defense mechanism and as a symptom. A consensus panel report of
the American College of Chest Physicians. Chest, 1998; 114 (2 suppl. Managing):
133S–181S
7. Randolph C.: Exercise-induced asthma: update on pathophysiology, clinical diagno-
sis, and treatment. Curr. Probl. Pediatr., 1997; 27: 53–77
8. Tan W.C., Tan C.H., Teoh P.C.: The role of climatic conditions and histamine release
in exercise-induced bronchoconstriction. Ann. Acad. Med. Singapore, 1985; 14:
465–469
9. Anderson S.D.: Exercise-induced asthma in children: a marker of airway inflamma-
tion. Med. J. Aust., 2002; 177 (suppl.): S61–S63
10. Killian K.J., Watson R., Otis J., St Amand T.A., O’Byrne P.M.: Symptom perception
during acute bronchoconstriction. Am. J. Respir. Crit. Care Med., 2000; 162 (2 Pt 1):
490–496
11. Kerstjens H.A., Brand P.L., de Jong P.M., Koeter G.H., Postma D.S.: Influence of treat-
ment on peak expiratory flow and its relation to airway hyperresponsiveness and
symptoms. The Dutch CNSLD Study Group. Thorax, 1994; 49: 1109–1115
12. Brand P.L., Duiverman E.J., Waalkens H.J., van Essen-Zandvliet E.E., Kerrebijn K.F.:
Peak flow variation in childhood asthma: correlation with symptoms, airways ob-
Ryc. 2-5. Stopnie kontroli astmy
Kryterium
Kontrolowana
(wszystkie kryteria
spełnione)
Częściowo kontrolowana
(≥1 kryterium spełnione
w ≥1 tyg.)
Niekontrolowana
objawy dzienne
nie występują
(
≤2/tyg.)
>2/tyg.
≥3 kryteria astmy częściowo
kontrolowanej spełnione
w którymkolwiek tygodniu
ograniczenie aktywności
życiowej
nie ma
jakiekolwiek
objawy nocne, przebudzenia
nie występują
jakiekolwiek
potrzeba leczenia doraźnego
(ratunkowego)
nigdy (
≤2/tyg.)
>2/tyg.
czynność płuc (PEF lub FEV
)
a
prawidłowa
<80% wn. lub wm. (jeśli jest znana)
zaostrzenia
nie występują
≥1/rok
b
1 w którymkolwiek tygodniu
c
a
Czynność płuc nie jest wiarygodnym kryterium u dzieci w wieku
≤5 lat.
b
Po każdym zaostrzeniu powinno się niezwłocznie ocenić leczenie podtrzymujące w celu upewnienia się, czy jest wystarczające.
c
Każdy tydzień z zaostrzeniem astmy uznaje się za tydzień z astmą niekontrolowaną.
wm. – wartość maksymalna dla chorego, wn. – wartość należna

WYTYCZNE
Rozdział 2. Rozpoznanie i klasyfikacja
struction, and hyperresponsiveness during long-term treatment with inhaled cortico-
steroids. Dutch CNSLD Study Group. Thorax, 1999; 54: 103–107
13. Pellegrino R., Viegi G., Brusasco V., Crapo R.O., Burgos F., Casaburi R., et al.:
Interpretative strategies for lung function tests. Eur. Respir. J., 2005; 26: 948–968
14. Standardization of Spirometry, 1994 Update. American Thoracic Society. Am. J.
Respir. Crit. Care Med., 1995; 152: 1107–1136
15. Standardized lung function testing. Official statement of the European Respiratory
Society. Eur. Respir. J. Suppl., 1993; 16: 1–100
16. Sawyer G., Miles J., Lewis S., Fitzharris P., Pearce N., Beasley R.: Classification of
asthma severity: should the international guidelines be changed? Clin. Exp. Allergy,
1998; 28: 1565–1570
17. Eid N., Yandell B., Howell L., Eddy M., Sheikh S.: Can peak expiratory flow predict
airflow obstruction in children with asthma? Pediatrics, 2000; 105: 354–358
18. Reddel H.K., Marks G.B., Jenkins C.R.: When can personal best peak flow be deter-
mined for asthma action plans? Thorax, 2004; 59: 922–924
19. Reddel H.K., Salome C.M., Peat J.K., Woolcock A.J.: Which index of peak expiratory
flow is most useful in the management of stable asthma? Am. J. Respir. Crit. Care
Med., 1995; 151: 1320–1325
20. Dekker F.W., Schrier A.C., Sterk P.J., Dijkman J.H.: Validity of peak expiratory flow
measurement in assessing reversibility of airflow obstruction. Thorax, 1992; 47:
162–166
21. Boezen H.M., Schouten J.P., Postma D.S., Rijcken B.: Distribution of peak expiratory
flow variability by age, gender and smoking habits in a random population sample
aged 20–70 yrs. Eur. Respir. J., 1994; 7: 1814–1820
22. Gibson P.G., Powell H.: Written action plans for asthma: an evidence-based review of
the key components. Thorax, 2004; 59: 94–99
23. Reddel H.K., Vincent S.D., Civitico J.: The need for standardisation of peak flow
charts. Thorax, 2005; 60: 164–167
24. Cockcroft D.W.: Bronchoprovocation methods: direct challenges. Clin. Rev. Allergy
Immunol., 2003; 24: 19–26
25. Cockcroft D.W., Murdock K.Y., Berscheid B.A., Gore B.P.: Sensitivity and specificity
of histamine PC20 determination in a random selection of young college students.
J. Allergy Clin. Immunol., 1992; 89 (1 Pt 1): 23–30
26. Boulet L.P.: Asymptomatic airway hyperresponsiveness: a curiosity or an opportunity
to prevent asthma? Am. J. Respir. Crit. Care Med., 2003; 167: 371–378
27. Ramsdale E.H., Morris M.M., Roberts R.S., Hargreave F.E.: Asymptomatic bronchial
hyperresponsiveness in rhinitis. J. Allergy Clin. Immunol., 1985; 75: 573–577
28. van Haren E.H., Lammers J.W., Festen J., Heijerman H.G., Groot C.A., van Herwaarden
C.L.: The effects of the inhaled corticosteroid budesonide on lung function and bron-
chial hyperresponsiveness in adult patients with cystic fibrosis. Respir. Med., 1995;
89: 209–214
29. Ramsdale E.H., Morris M.M., Roberts R.S., Hargreave F.E.: Bronchial responsiveness
to methacholine in chronic bronchitis: relationship to airflow obstruction and cold air
responsiveness. Thorax, 1984; 39: 912–918
30. Pizzichini M.M., Popov T.A., Efthimiadis A., Hussack P., Evans S., Pizzichini E., et al.:
Spontaneous and induced sputum to measure indices of airway inflammation in
asthma. Am. J. Respir. Crit. Care Med., 1996; 154 (4 Pt 1): 866–869
31. Kharitonov S., Alving K., Barnes P.J.: Exhaled and nasal nitric oxide measurements:
recommendations. The European Respiratory Society Task Force. Eur. Respir. J., 1997;
10: 1683–1693
32. Horvath I., Barnes P.J.: Exhaled monoxides in asymptomatic atopic subjects. Clin. Exp.
Allergy, 1999; 29: 1276–1280
33. Green R.H., Brightling C.E., McKenna S., Hargadon B., Parker D., Bradding P., et al.:
Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial.
Lancet, 2002; 360: 1715–1721
34. Smith A.D., Cowan J.O., Brassett K.P., Herbison G.P., Taylor D.R.: Use of exhaled nitric
oxide measurements to guide treatment in chronic asthma. N. Engl. J. Med., 2005;
352: 2163–2173
35. Hoeppner V.H., Murdock K.Y., Kooner S., Cockcroft D.W.: Severe acute „occupational
asthma” caused by accidental allergen exposure in an allergen challenge laboratory.
Ann. Allergy, 1985; 55: 36–37
36. Wilson N.M.: Wheezy bronchitis revisited. Arch. Dis. Child., 1989; 64: 1194–1199
37. Martinez F.D.: Respiratory syncytial virus bronchiolitis and the pathogenesis of child-
hood asthma. Pediatr. Infect. Dis. J., 2003; 22 (2 suppl.): S76–S82
38. Castro-Rodriguez J.A., Holberg C.J., Wright A.L., Martinez F.D.: A clinical index to
define risk of asthma in young children with recurrent wheezing. Am. J. Respir. Crit.
Care Med., 2000; 162 (4 Pt 1): 1403–1406
39. Sears M.R., Greene J.M., Willan A.R., Wiecek E.M., Taylor D.R., Flannery E.M., et
al.: A longitudinal, population-based, cohort study of childhood asthma followed to
adulthood. N. Engl. J. Med., 2003; 349: 1414–1422
40. Guilbert T.W., Morgan W.J., Zeiger R.S., Mauger D.T., Boehmer S.J., Szefler S.J., et
al.: Long-term inhaled corticosteroids in preschool children at high risk for asthma.
N. Engl. J. Med., 2006; 354: 1985–1997
41. Frey U., Stocks J., Sly P., Bates J.: Specification for signal processing and data han-
dling used for infant pulmonary function testing. ERS/ATS Task Force on Standards for
Infant Respiratory Function Testing. European Respiratory Society/American Thoracic
Society. Eur. Respir. J., 2000; 16: 1016–1022
42. Sly P.D., Cahill P., Willet K., Burton P.: Accuracy of mini peak flow meters in indicating
changes in lung function in children with asthma. BMJ, 1994; 308: 572–574
43. Mok Q., Piesowicz A.T.: Foreign body aspiration mimicking asthma. Intensive Care
Med., 1993; 19: 240–241
44. Place R., Morrison A., Arce E.: Vocal cord dysfunction. J. Adolesc. Health, 2000; 27:
125–129
45. Tarlo S.M., Liss G.M.: Occupational asthma: an approach to diagnosis and manage-
ment. CMAJ, 2003; 168: 867–871
46. Tarlo S.M.: Laboratory challenge testing for occupational asthma. J. Allergy Clin.
Immunol., 2003; 111: 692–694
47. Chan-Yeung M., Desjardins A.: Bronchial hyperresponsiveness and level of exposure
in occupational asthma due to western red cedar (Thuja plicata). Serial observa-
tions before and after development of symptoms. Am. Rev. Respir. Dis., 1992; 146:
1606–1609
48. Cote J., Kennedy S., Chan-Yeung M.: Sensitivity and specificity of PC20 and peak
expiratory flow rate in cedar asthma. J. Allergy Clin. Immunol., 1990; 85: 592–598
49. Vandenplas O., Malo J.L.: Inhalation challenges with agents causing occupational
asthma. Eur. Respir. J., 1997; 10: 2612–2629
50. Bright P., Burge P.S.: Occupational lung disease. 8. The diagnosis of occupational
asthma from serial measurements of lung function at and away from work. Thorax,
1996; 51: 857–863
51. Chan-Yeung M., MacLean L., Paggiaro P.L.: Follow-up study of 232 patients with
occupational asthma caused by western red cedar (Thuja plicata). J. Allergy Clin.
Immunol., 1987; 79: 792–796
52. Nicholson P.J., Cullinan P., Taylor A.J., Burge P.S., Boyle C.: Evidence based guidelines
for the prevention, identification, and management of occupational asthma. Occup.
Environ. Med., 2005; 62: 290–299
53. Price D.B., Tinkelman D.G., Halbert R.J., Nordyke R.J., Isonaka S., Nonikov D., et al.:
Symptom-based questionnaire for identifying COPD in smokers. Respiration, 2006;
73: 285–295
54. Tinkelman D.G., Price D.B., Nordyke R.J., Halbert R.J., Isonaka S., Nonikov D., et
al.: Symptom-based questionnaire for differentiating COPD and asthma. Respiration,
2006; 73 (3): 296–305
55. Bateman E.D., Boushey H.A., Bousquet J., Busse W.W., Clark T.J., Pauwels R.A., et
al.: Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma
ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
56. Nathan R.A., Sorkness C.A., Kosinski M., Schatz M., Li J.T., Marcus P., et al.:
Development of the asthma control test: a survey for assessing asthma control. J.
Allergy Clin. Immunol., 2004; 113: 59–65
57. Juniper E.F., Buist A.S., Cox F.M., Ferrie P.J., King D.R.: Validation of a standardized
version of the Asthma Quality of Life Questionnaire. Chest, 1999; 115: 1265–1270
58. Vollmer W.M., Markson L.E., O’Connor E., Sanocki L.L., Fitterman L., Berger M., et al.:
Association of asthma control with health care utilization and quality of life. Am. J.
Respir. Crit. Care Med., 1999; 160 (5 Pt 1): 1647–1652
59. Boulet L.P., Boulet V., Milot J.: How should we quantify asthma control? A proposal.
Chest, 2002; 122: 2217–2223

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Rozdział 3. Leki
przeciwastmatyczne
Wprowadzenie
Celem leczenia astmy jest osiągnięcie i utrzyma-
nie kontroli klinicznej. Leki przeciwastmatyczne
można podzielić na leki kontrolujące i leki doraź-
ne. Leki kontrolujące przyjmuje się codziennie,
przewlekle w celu utrzymania klinicznej kontroli
astmy, głównie dzięki ich działaniu przeciwzapal-
nemu. Do tej grupy należą glikokortykosteroidy
podawane wziewnie lub ogólnoustrojowo, leki
przeciwleukotrienowe, długo działające β
2
-mime-
tyki wziewne w połączeniu z glikokortykosteroi-
dami wziewnymi, teofilina w postaci o przedłużo-
nym uwalnianiu, kromony, przeciwciała antyIgE
i inne leki „oszczędzające” steroidy stosowane
ogólnoustrojowo. Obecnie najskuteczniejszymi
z dostępnych leków kontrolujących są glikokorty-
kosteroidy wziewne. Leki doraźne są przyjmowa-
ne w razie potrzeby w celu szybkiego zniesienia
skurczu oskrzeli i jego objawów podmiotowych.
Do tej grupy należą: szybko działające β
2
-mimety-
ki wziewne, wziewne leki przeciwcholinergiczne,
krótko działające preparaty teofiliny oraz krótko
działające β
2
-mimetyki doustne.
Leki przeciwastmatyczne u dorosłych
Drogi podawania leków
Leki przeciwastmatyczne u dorosłych można po-
dawać różnymi drogami – wziewnie, doustnie lub
pozajelitowo (we wstrzyknięciach podskórnych,
domięśniowych lub dożylnych). Główna przewaga
terapii wziewnej polega na tym, że leki docierają
bezpośrednio do dróg oddechowych, dzięki cze-
mu uzyskuje się większe stężenie miejscowe przy
znacznie mniejszym ryzyku ogólnoustrojowych
skutków ubocznych.
Wziewne leki przeciwastmatyczne są dostępne
w inhalatorach ciśnieniowych z dozownikiem (me-
tered-dosed inhalers – MDI), MDI wyzwalanych
wdechem, inhalatorów proszkowych (dry powder
inhalers – DPI), inhalatorów „miękkiego” aero-
zolu (soft mist inhalers); mogą być też podawane
za pomocą nebulizatora*. Urządzenia do inhala-
cji różnią się skutecznością dostarczania leku do
dolnych dróg oddechowych, która zależy od typu
urządzenia, preparatu leku, wielkości wytwarza-
nych cząstek, prędkości aerozolu (jeśli dotyczy)
oraz łatwości posługiwania się urządzeniem przez
większość pacjentów. Preferencje każdego chore-
go, wygoda, łatwość używania mogą wpływać nie
tylko na skuteczność dostarczania leków, ale rów-
nież na przestrzeganie stosowania leczenia przez
chorego i długoterminową kontrolę astmy.
Używanie MDI ciśnieniowych (pMDI) wyma-
ga przeszkolenia pacjenta i nabycia przez nie-
go umiejętności koordynacji wyzwolenia dawki
z inhalatora i wdechu. Leki w tych urządzeniach
mogą tworzyć zawiesinę w nośniku freonowym
Główne punkty
n
Leki stosowane w leczeniu astmy można podzie-
lić na leki kontrolujące przebieg choroby i leki do-
raźne. Leki kontrolujące przyjmuje się codziennie,
przewlekle w celu utrzymania klinicznej kontroli
astmy, głównie dzięki ich działaniu przeciwzapal-
nemu. Leki doraźne przyjmuje się w razie potrze-
by w celu szybkiego zniesienia skurczu oskrzeli
i jego objawów podmiotowych.
n
Leki przeciwastmatyczne można podawać różny-
mi drogami – wziewnie, doustnie lub we wstrzyk-
nięciach. Główną przewagą leczenia wziewnego
jest to, że leki dostarcza się bezpośrednio do dróg
oddechowych i dzięki temu uzyskuje większe stę-
żenie miejscowe przy znacznie mniejszym ryzyku
ogólnoustrojowych skutków ubocznych.
n
Najskuteczniejszymi z obecnie dostępnych leków
kontrolujących przebieg astmy są glikokortyko-
steroidy wziewne.
n
Lekami z wyboru do znoszenia skurczu oskrzeli
i zapobiegania skurczowi oskrzeli wywoływane-
mu przez wysiłek fizyczny zarówno u dorosłych,
jak i u dzieci we wszystkich grupach wiekowych
są szybko działające β
2
-mimetyki wziewne.
n
Zwiększenie zużycia leków doraźnych, zwłaszcza
w ciągu dnia, sygnalizuje pogarszanie się kontroli
astmy i wskazuje na potrzebę zweryfikowania le-
czenia.
* Informacje na temat różnych dostępnych inhalatorów
można znaleźć na stronie internetowej GINA (http://www.
ginasthma.org)

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
(chlorofluorocarbons – CFC) lub roztwór w hy-
drofluoroalkanach (HFA). W przypadku pMDI
zawierających CFC stosowanie spejsera poprawia
dostarczanie leku, zwiększa depozycję leku w płu-
cach i może zmniejszać miejscowe i ogólnoustro-
jowe skutki uboczne.
1
Jednakże inhalatory z CFC
są wycofywane z rynku z powodu wpływu CFC
na warstwę ozonu w atmosferze i zastępowane
przez inhalatory, w których nośnikiem jest HFA.
W przypadku pMDI zawierających leki rozszerza-
jące oskrzela zamiana inhalatora zawierającego
CFC na inhalator z HFA nie powoduje zmiany
skuteczności przy stosowaniu tych samych dawek
nominalnych.
2
Jednakże w przypadku niektórych
glikokortykosteroidów w inhalatorach z HFA jako
nośnikiem cząteczki aerozolu są mniejsze, co po-
woduje mniejszą depozycję w jamie ustnej (co się
wiąże z rzadszym występowaniem skutków ubocz-
nych w obrębie jamy ustnej) i tym samym większą
depozycję w płucach. Może to prowadzić do więk-
szej skuteczności ogólnoustrojowej przy równo-
ważnych dawkach wyzwalanych z inhalatora, ale
również do większej ogólnoustrojowej ekspozycji
na dany lek i zwiększenia ryzyka skutków ubocz-
nych.
35
Lekarzom radzi się zapoznanie z ulotka-
mi dołączanymi do opakowań każdego leku w celu
potwierdzenia równoważności zalecanych dawek
względem aktualnie stosowanych leków. Niektóre
z takich porównań podano na
rycinie 3-1.
pMDI mogą być stosowane przez chorych na
astmę o różnym stopniu ciężkości, w tym tak-
że w okresach zaostrzeń. Inhalatory, w których
uwolnienie dawki leku odbywa się pod wpływem
wdechu, mogą być pomocne u chorych mających
trudności z koordynacją wyzwolenia dawki i wy-
konania wdechu, konieczną do używania pMDI.
6
Inhalatory „miękkiego” aerozolu wymagają
mniejszej koordynacji. Inhalatory proszkowe są
na ogół łatwiejsze w użyciu, ale wymagają pew-
nego minimalnego przepływu wdechowego i ich
stosowanie może być trudne dla niektórych cho-
rych. DPI różnią się pod względem frakcji dawki
wyzwalanej z dozownika i dostarczanej do płuc.
W przypadku niektórych leków może zaistnieć
konieczność dostosowania dawki, gdy zamienia
się MDI na DPI.
7
Aerozole wytwarzane przez ne-
bulizatory rzadko są wskazane do leczenia astmy
przewlekłej u dorosłych.
8
Ryc. 3-1. Oszacowane równoważne dawki dobowe glikokortykosteroidów wziewnych dla dorosłych
a
Lek
Dawka mała (μg)
Dawka średnia (μg)
Dawka duża (μg)
b
beklometazonu dipropionian
200–500
>500–1000
>1000–2000
budezonid
c
200–400
>400–800
>800–1600
cyklezonid
c
80–160
>160–320
>320–1280
flunizolid
500–1000
>1000–2000
>2000
flutikazon
100–250
>250–500
>500–1000
mometazonu pirośluzan
c
200–400
>400–800
>800–1200
triamcynolonu acetonid
400–1000
>1000–2000
>2000
a
Porównania oparte na danych dotyczących skuteczności.
b
Pacjentów, u których się przewiduje stosowanie dużych dawek (z wyjątkiem krótkotrwałego stosowania) należy skierować do
lekarza specjalisty, aby rozważył alternatywne leczenie kilkoma lekami kontrolującymi przebieg choroby. Maksymalne zalecane
dawki są ustalone arbitralnie, ale przy przedłużonym stosowaniu wiążą się ze zwiększonym ryzykiem ogólnoustrojowych
objawów ubocznych.
c
Zatwierdzone podawanie raz dziennie u chorych na astmę lekką.
Uwagi
Najważniejszym czynnikiem decydującym o właściwym dawkowaniu jest ocena przez lekarza odpowiedzi na leczenie. Lekarz
musi tę odpowiedź monitorować na podstawie parametrów klinicznych i odpowiednio modyfikować dawkowanie.
Po osiągnięciu kontroli astmy dawkę leku powinno się stopniowo zmniejszać do dawki minimalnej koniecznej do utrzymania
kontroli choroby, dzięki czemu zmniejsza się ryzyko wystąpienia skutków niepożądanych.
Określenie małej, średniej i dużej dawki podano w miarę możliwości na podstawie zaleceń producentów. Pewne wykazanie
zależności między dawką a odpowiedzią jest rzadko dostępne. Dlatego też podstawową zasadą jest ustalenie u każdego
chorego najmniejszej dawki zapewniającej kontrolę choroby, ponieważ większe dawki mogą nie być wcale bardziej skuteczne,
ale mogą być związane z większym ryzykiem działań niepożądanych.
Preparaty zawierające freony zostały wycofane z rynku, dlatego lekarz musi dokładnie przeczytać ulotkę dołączoną do
preparatu zawierającego nośnik hydrofluoroalkanowy, aby ustalić właściwą równoważną dawkę.

WYTYCZNE
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Leki kontrolujące
Glikokortykosteroidy wziewne*
Rola w leczeniu astmy
Glikokortykosteroidy wziewne są obecnie najsku-
teczniejszymi lekami przeciwzapalnymi do stoso-
wania w astmie przewlekłej. Badania wykazały
ich skuteczność w zmniejszaniu objawów astmy
9
,
poprawie jakości życia
9
i czynności płuc
9
, zmniej-
szaniu nadreaktywności dróg oddechowych
10
,
kontroli zapalenia w drogach oddechowych,
11
zmniejszaniu częstości i ciężkości zaostrzeń
12
oraz zmniejszaniu umieralności z powodu astmy
13
.
Nie powodują one jednak wyleczenia astmy, i gdy
zaprzestanie się ich stosowania, następuje pogor-
szenie kontroli klinicznej w ciągu następnych kil-
ku tygodni lub miesięcy u części chorych.
14,15
Glikokortykosteroidy wziewne różnią się pod
względem siły działania i biodostępności, ale
ponieważ krzywa zależności dawkaodpowiedź
w astmie jest stosunkowo płaska, tylko nieliczne
badania potwierdziły kliniczne znaczenie tych
różnic. Na
rycinie 3-1 wymieniono przybliżone
dawki równoważne różnych glikokortykostero-
idów wziewnych na podstawie dostępnego piś-
miennictwa na temat skuteczności, ale wyodręb-
nienie kategorii dawek nie oznacza, że dla każde-
go leku wykazano wyraźną zależność odpowiedzi
od dawki.
Skuteczność niektórych leków zmienia się
w przypadku przyjmowania z różnych inhala
torów.
16
Większość korzyści ze stosowania gliko
kortykosteroidów wziewnych uzyskuje się u doro-
słych przy stosunkowo małych dawkach, równo-
ważnych 400 μg budezonidu dziennie.
17
Zwiększa-
nie dawki przynosi niewiele dodatkowych korzyści
pod względem kontroli astmy, natomiast zwiększa
ryzyko skutków ubocznych.
17,18
Jednakże istnie-
je wyraźna zmienność osobnicza w odpowiedzi
na glikokortykosteroidy wziewne i ze względu na
to oraz na częste nieprzestrzeganie zaleceń do-
tyczących przyjmowania glikokortykosteroidów
wziewnych przez pacjentów – wielu z nich wyma-
ga stosowania większych dawek w celu osiągnię-
cia pełnych korzyści terapeutycznych. Ponieważ
palenie tytoniu zmniejsza wrażliwość na glikokor-
tykosteroidy wziewne, u chorych nadal palących
tytoń mogą być konieczne dawki większe.
W celu osiągnięcia klinicznej kontroli astmy
preferuje się dodanie drugiego leku kontrolują-
cego z innej grupy, a nie zwiększanie dawki gli-
kokortykosteroidu wziewnego. Istnieje jednak
wyraźny związek między dawką glikokortyko-
steroidu wziewnego a zapobieganiem ciężkim
zaostrzeniom astmy.
12
Dlatego niektórzy chorzy
z ciężką astmą mogą odnosić korzyści z przewle-
kłego leczenia glikokortykosteroidami wziewnymi
w większych dawkach.
Skutki uboczne
Miejscowe skutki niepożądane związane ze stoso-
waniem glikokortykosteroidów wziewnych obej-
mują kandydozę jamy ustnej i gardła, chrypkę
i niekiedy kaszel wskutek podrażnienia górnych
dróg oddechowych.
W przypadku pMDI częstość występowania
tych objawów można zmniejszyć, używając spej-
serów.
1
Płukanie jamy ustnej (przepłukanie wodą
jamy ustnej i gardła i wyplucie) po inhalacji może
zmniejszyć częstość występowania kandydozy
jamy ustnej. Stosowanie proleków, które ulegają
aktywacji w płucach, a nie w gardle (np. cykle-
zonidu)
19
, oraz nowych preparatów i urządzeń
zmniejszających depozycję leku w jamie ustnej
i gardle może ograniczyć występowanie takich
skutków, bez potrzeby stosowania spejserów lub
płukania jamy ustnej.
Glikokortykosteroidy podawane wziewnie są
wchłaniane z płuc, co odpowiada za ich ogólno-
ustrojową dostępność biologiczną. Ryzyko wy-
stąpienia ogólnoustrojowych skutków niepożąda-
nych w wyniku stosowania glikokortykosteroidu
wziewnego zależy od jego dawki i siły działania,
typu inhalatora, biodostępności ogólnoustrojowej,
efektu pierwszego przejścia (przemiany w nieak-
tywne metabolity) w wątrobie i okresu półtrwa-
nia części dawki wchłoniętej do krążenia (z płuc
i prawdopodobnie z przewodu pokarmowego).
20
Z tych powodów skutki ogólnoustrojowe po
szczególnych glikokortykosteroidów wziewnych
się różnią. Kilka badań porównawczych wyka
zało, że cyklezonid, budezonid i propionian flu-
tikazonu w równoważnych dawkach wywierają
* W tym rozdziale zalecenia dotyczące dawek glikokortykoste
roidów wziewnych podano jako „μg/d budezonidu lub równo-
ważna dawka innego glikokortykosteroidu wziewnego”, ponie
waż jest to standardowy sposób wykorzystywany w większości
publikacji z badań klinicznych z zastosowaniem tych leków.

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
mniejsze efekty ogólnoustrojowe.
2023
Aktualne
dane wskazują, że u dorosłych skutki ogólno-
ustrojowe glikokortykosteroidów wziewnych
w dawkach odpowiadających ≤400 µg budezonidu
na dobę nie stanowią problemu.
Do ogólnoustrojowych skutków ubocznych
przewlekłego leczenia glikokortykosteroidami
wziewnymi w dużych dawkach należą: łatwe po-
wstawanie wylewów skórnych,
24
supresja kory
nadnerczy
1,20
i zmniejszenie gęstości mineral-
nej kości
25,26
. Stosowanie glikokortykosteroidów
wziewnych wiąże się również z rozwojem zaćmy
27
i jaskry w badaniach przekrojowych
28,29
, ale
w badaniach prospektywnych nie potwierdzono
częstszego występowania zaćmy podtorebkowej
tylnej
3032
. Jedna trudność w określeniu znacze-
nia klinicznego tych skutków niepożądanych po-
lega na rozróżnieniu wpływu dużych dawek gli-
kokortykosteroidów wziewnych od skutków krót-
kotrwałego stosowania glikokortykosteroidów do
ustnych przez chorych na astmę ciężką. Nie ma
danych, które wskazywałyby, że stosowanie gli-
kokortykosteroidów wziewnych zwiększa ryzyko
zakażeń płuc, w tym gruźlicy, i leki te nie są prze-
ciwwskazane u chorych z czynną gruźlicą
33
.
Leki przeciwleukotrienowe
Rola w leczeniu astmy
Do leków przeciwleukotrienowych należą anta-
goniści receptora leukotrienów cysteinylowych
typu 1 (CysLT1) (montelukast, pranlukast i za-
firlukast) i inhibitor 5lipooksygenazy (zileuton).
Badania kliniczne wykazały, że leki przeciwleuko-
trienowe powodują niewielkie i zmienne rozsze-
rzenie oskrzeli, zmniejszają objawy podmiotowe,
w tym kaszel,
34
poprawiają czynność płuc oraz
zmniejszają zapalenie dróg oddechowych i czę-
stość zaostrzeń astmy
3537
. Można je stosować
jako leki alternatywne u dorosłych z astmą prze-
wlekłą lekką
3840
i u niektórych chorych na astmę
aspirynową dobrze odpowiadających na leki prze-
ciwleukotrienowe
41
. Jednakże leki przeciwleuko-
trienowe stosowane jako jedyny lek kontrolujący
przebieg astmy są na ogół mniej skuteczne niż gli-
kokortykosteroidy wziewne w małych dawkach,
i u chorych już przyjmujących glikokortykostero-
idy wziewne nie mogą zastąpić tych ostatnich bez
ryzyka utraty kontroli astmy.
42,43
Dodanie leku
przeciwleukotrienowego może zmniejszyć po-
trzebną dawkę glikokortykosteroidu wziewnego
u chorego z astmą umiarkowaną lub ciężką
44
i po-
prawić kontrolę astmy u chorych, u których gli-
kokortykosteroidy wziewne w małych lub dużych
dawkach nie są wystarczająco skuteczne
43,4547
.
Poza jednym badaniem, które wykazało równo-
ważność w zapobieganiu zaostrzeniom
48
, kilka
badań wykazało, że leki przeciwleukotrienowe są
mniej skuteczne od długo działających β
2
-mimety-
ków wziewnych w terapii skojarzonej
4951
.
Skutki uboczne
Leki przeciwleukotrienowe są dobrze tolerowa-
ne i dotychczas opisano nieliczne skutki uboczne
swoiste dla tej grupy. Zileuton powoduje uszko-
dzenie wątroby i w czasie leczenia tym lekiem
zaleca się monitorowanie wskaźników wątrobo-
wych. Opisywany związek stosowania leków prze-
ciwleukotrienowych z występowaniem zespołu
Churga i Strauss jest prawdopodobnie w dużej
mierze wynikiem zmniejszenia dawek glikokor-
tykosteroidów ogólnoustrojowych lub wziewnych
i „odsłonięcia” choroby, ale nie można w pełni wy-
kluczyć związku przyczynowoskutkowego u nie-
których chorych.
5254
Długo działające β
2
-mimetyki wziewne
Rola w leczeniu astmy
Długo działających β
2
-mimetyków wziewnych, ta-
kich jak formoterol i salmeterol, nie powinno się
stosować w monoterapii astmy, ponieważ – jak się
okazuje – leki te nie wpływają na zapalenie dróg
oddechowych w astmie. Są one najskuteczniejsze,
gdy stosuje się je w skojarzeniu z glikokortykoste-
roidami wziewnymi,
55,56
i takie leczenie skojarzo-
ne jest preferowane, gdy sam glikokortykosteroid
wziewny w średniej dawce nie zapewnia kontroli
astmy. Dodanie długo działającego β
2
-mimetyku
wziewnego do glikokortykosteroidu wziewnego
powoduje poprawę w zakresie objawów, zmniej-
szenie objawów nocnych, poprawę czynności
płuc, zmniejszenie zużycia szybko działających
β
2
-mimetyków wziewnych
5759
oraz zmniejszenie
częstości zaostrzeń
12,5762
, a także zapewnia uzy-
skanie klinicznej kontroli astmy u większej liczby
chorych i szybciej oraz przy mniejszej dawce gli-
kokortykosteroidu wziewnego niż sam glikokor-
tykosteroid wziewny
63
.

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Większa skuteczność leczenia skojarzonego
pociągnęła za sobą opracowanie inhalatorów za-
wierających 2 leki – glikokortykosteroid i długo
działający β
2
-mimetyk (propionian flutikazonu
z salmeterolem albo budezonid z formoterolem).
Badania z grupą kontrolną wykazały, że stosowa-
nie tych leków z jednego inhalatora jest równie
skuteczne jak ich stosowanie z oddzielnych in-
halatorów.
64,65
Stosowanie inhalatorów zawiera-
jących oba te leki jest wygodniejsze dla chorych,
może sprzyjać przestrzeganiu zaleceń
66
i zapew-
nia, że chory otrzymuje zawsze długo działający
β
2
-mimetyk z glikokortykosteroidem. Ponadto in-
halatory zawierające formoterol i budezonid moż-
na stosować zarówno w leczeniu przewlekłym,
jak i doraźnie. Oba leki przyjmowane w razie po-
trzeby przyczyniają się do większej ochrony przed
ciężkimi zaostrzeniami u chorych otrzymujących
leczenie skojarzone w celu podtrzymania kontro-
li astmy
67
i zapewniają poprawę kontroli astmy
przy stosowaniu stosunkowo małych dawek
6770
.
Długo działające β
2
mimetyki można również
stosować w celu zapobiegania skurczowi oskrzeli
wywoływanemu przez wysiłek fizyczny; w tej sy-
tuacji mogą one zapewniać dłuższą ochronę niż
szybko działające β
2
-mimetyki wziewne.
71
Salme-
terol i formoterol zapewniają rozszerzenie oskrzeli
i ochronę przed skurczem trwające równie długo,
ale istnieją różnice farmakologiczne między tymi
lekami. Formoterol działa szybciej niż salmete-
rol
72,73
, dzięki czemu może się nadawać do doraź-
nego znoszenia objawów, jak i do zapobiegania ich
wystąpieniu
68
.
Skutki uboczne
Długo działające β
2
mimetyki wziewne rzadziej
powodują ogólnoustrojowe skutki niepożądane,
takie jak pobudzenie układu sercowonaczynio-
wego, drżenie mięśni szkieletowych i hipokalie-
mia, w porównaniu z lekami doustnymi. Regu-
larne stosowanie szybko działających β
2
-mimety-
ków, zarówno tych krótko działających, jak i długo
działających, może prowadzić do względnej opor-
ności na te leki.
74
Dane wskazują na możliwe
zwiększenie ryzyka zgonów związanych z astmą
w wyniku stosowania salmeterolu w małej grupie
chorych,
75
co skłoniło doradców amerykańskiego
Urzędu ds. Żywności i Leków (FDA)* i Health
Canada** do stwierdzenia, że długo działające
β
2
mimetyki wziewne nie nadają się do zastąpienia
glikokortykosteroidów wziewnych lub doustnych
i powinny być stosowane wyłącznie w połączeniu
z glikokortykosteroidem wziewnym w odpowied-
niej dawce ustalonej przez lekarza. Wykazano, że
przebieg astmy u chorych z nietypowym genoty-
pem dla receptora adrenergicznego β (zastąpienie
argininy glicyną w pozycji 16 polipeptydu) może
się pogarszać w wyniku regularnego stosowania
salmeterolu, niezależnie od równoczesnego stoso-
wania glikokortykosteroidów wziewnych.
76
Teofilina
Rola w leczeniu astmy
Teofilina jest lekiem rozszerzającym oskrzela,
a stosowana w mniejszej dawce wykazuje słabe
właściwości przeciwzapalne.
77-79
Jest dostępna
w postaci o przedłużonym uwalnianiu, którą moż-
na stosować 1 lub 2 razy dziennie. Nie ma danych
na temat względnej skuteczności teofiliny jako
leku kontrolującego przebieg choroby, stosowane-
go przewlekle. Jednakże efekty teofiliny w posta-
ci o przedłużonym uwalnianiu, stosowanej jako
pierwszy lek kontrolujący, są niewielkie.
80
Lek
ten może przynieść korzyści w terapii skojarzonej
u chorych, u których same glikokortykosteroi-
dy wziewne nie zapewniają kontroli astmy.
8183
U takich chorych odstawienie teofiliny w postaci
o przedłużonym uwalnianiu wiązało się z pogor-
szeniem kontroli astmy.
84
W terapii skojarzonej
teofilina jest mniej skuteczna niż długo działające
β
2
-mimetyki wziewne.
85,86
Skutki uboczne
Skutki uboczne teofiliny, szczególnie przy sto-
sowaniu większych dawek (≥10 mg/kg mc./d), są
istotne i ograniczają przydatność leku. Można
je zmniejszyć poprzez staranne dobranie dawki
i monitorowanie; na ogół zmniejszają się lub cał-
kowicie ustępują w miarę stosowania leku. Skutki
niepożądane to objawy ze strony przewodu pokar-
mowego, luźne stolce, zaburzenia rytmu serca,
drgawki, a nawet zgon. Najczęstszymi wcześnie
występującymi objawami ubocznymi są nudno-
ści i wymioty. Zaleca się monitorowanie, jeśli le-
* http://www.fda.gov/cder/drug/infopage/LABA/default.htm
** http://www.hc-sc.gc.ca/ahc-asc/media/advisories-avis/2

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
czenie rozpoczyna się dużą dawką teofiliny, jeśli
u chorego wystąpiły skutki niepożądane podczas
stosowania teofiliny w typowej dawce, jeśli nie
zostały osiągnięte oczekiwane cele terapeutyczne,
a także w razie współistnienia stanów, o których
wiadomo, że zmieniają metabolizm teofiliny. Na
przykład choroby przebiegające z gorączką, ciąża
i leczenie przeciwgruźlicze
87
powodują zmniejsze-
nie stężenia teofiliny we krwi, natomiast choroby
wątroby, zastoinowa niewydolność serca i niektó-
re leki – takie jak cymetydyna, niektóre chinolo-
ny i makrolidy – zwiększają ryzyko toksyczności.
Mniejsze dawki teofiliny, przy których obserwuje
się pełne korzyści przeciwzapalne ze stosowania
tego leku
82
rzadziej wywołują skutki uboczne
i u chorych otrzymujących lek w małej dawce nie
ma potrzeby oznaczania stężenia teofiliny w oso-
czu, chyba że się podejrzewa przedawkowanie.
Kromony: kromoglikan sodu i nedokromil
sodu
Rola w leczeniu astmy
Rola kromoglikanu sodu i nedokromilu sodu
w przewlekłym leczeniu astmy u dorosłych jest
ograniczona. Skuteczność tych leków opisano
u chorych na astmę przewlekłą lekką i chorych
ze skurczem oskrzeli wywoływanym przez wysi-
łek fizyczny. Działanie przeciwzapalne jest słabe
i są one mniej skuteczne niż glikokortykosteroid
wziewny w małej dawce.
88
Skutki uboczne
Skutki uboczne występują rzadko; należą do nich
kaszel po inhalacji i ból gardła. Niektórzy chorzy
twierdzą, że smak nedokromilu sodu jest nieprzy-
jemny.
Długo działające
β
2
-mimetyki doustne
Rola w leczeniu astmy
Długo działające β
2
-mimetyki doustne to prepara-
ty o powolnym uwalnianiu takich leków, jak sal-
butamol, terbutalina i bambuterol (prolek prze-
kształcany w ustroju w terbutalinę). Stosuje się je
wyjątkowo, gdy konieczne jest dodatkowe rozsze-
rzenie oskrzeli.
Skutki uboczne
Długo działające β
2
mimetyki doustne częściej wy-
wołują skutki uboczne niż β
2
mimetyki wziewne;
należą do nich pobudzenie układu sercowonaczy-
niowego (tachykardia), niepokój i drżenie mięśni
szkieletowych. Niepożądane reakcje układu ser-
cowonaczyniowego mogą również wystąpić przy
stosowaniu β
2
mimetyków doustnych w połącze-
niu z teofiliną. Regularne stosowanie długo dzia-
łających β
2
-mimetyków doustnych w monoterapii
prawdopodobnie jest szkodliwe, dlatego leki te
trzeba zawsze stosować w połączeniu z glikokor-
tykosteroidami wziewnymi.
Przeciwciała anty-IgE
Rola w leczeniu astmy
Przeciwciała antyIgE (omalizumab) można sto-
sować u chorych ze zwiększonym stężeniem IgE
w surowicy. Aktualne wskazanie stanowi ciężka
astma alergiczna
89
, która nie jest kontrolowa-
na pomimo stosowania glikokortykosteroidów
wziewnych, aczkolwiek intensywność podstawo-
wego leczenia w poszczególnych badaniach kli-
nicznych była różna. O poprawie kontroli astmy
świadczy zmniejszenie objawów, zużycia leków
doraźnych i częstości zaostrzeń.
90,91
Dalsze bada-
nia prawdopodobnie pozwolą dokładniej określić
rolę przeciwciał antyIgE w innych sytuacjach kli-
nicznych.
Skutki uboczne
Jak wykazały badania z udziałem chorych na ast-
mę w wieku 11–50 lat, leczonych glikokortykoste-
roidami (wziewnymi lub doustnymi) i długo dzia-
łającymi β
2
-mimetykami
89
przeciwciała antyIgE
są bezpieczne w leczeniu skojarzonym
9294
.
Glikokortykosteroidy stosowane
ogólnoustrojowo
Rola w leczeniu astmy
Długotrwałe stosowanie glikokortykosteroidu do
ustnego (tzn. dłużej niż 2 tygodnie) może być ko-
nieczne w bardzo źle kontrolowanej astmie, ale
jest ograniczone przez ryzyko istotnych skutków
niepożądanych. Wskaźnik terapeutyczny (stosu-
nek efektów terapeutycznych do efektów ubocz-
nych) przewlekłego leczenia glikokortykosteroi-

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
dami wziewnymi jest zawsze bardziej korzystny
niż przewlekłej kortykoterapii ogólnoustrojowej
w astmie.
95,96
Jeśli zachodzi konieczność długo-
trwałego stosowania glikokortykosteroidów do-
ustnych, trzeba zwracać uwagę na metody ogra-
niczania ogólnoustrojowych skutków ubocznych.
Do leczenia przewlekłego preferuje się preparaty
doustne, a nie pozajelitowe (domięśniowe lub do-
żylne), ze względu na ich mniejszy efekt mine-
ralokortykosteroidowy, stosunkowo krótki okres
półtrwania i słabszy wpływ na mięśnie prążkowa-
ne, jak również na większą elastyczność w daw-
kowaniu, pozwalającą ustalić najmniejszą dawkę
zapewniającą kontrolę astmy.
Skutki uboczne
Ogólnoustrojowe skutki uboczne długotrwałego
doustnego lub pozajelitowego stosowania gliko-
kortykosteroidów to: osteoporoza, nadciśnienie
tętnicze, cukrzyca, supresja osi podwzgórzowo
przysadkowonadnerczowej, otyłość, zaćma, ja-
skra, ścieńczenie skóry prowadzące do rozstępów
skórnych i łatwego powstawania wylewów krwi
do skóry oraz osłabienie mięśni. U chorych na ast-
mę leczonych przewlekle glikokortykosteroidami,
podawanymi ogólnoustrojowo w jakiejkolwiek
formie, powinno się stosować metody zapobiega-
nia osteoporozie (
ryc. 3-2).
97-99
Chociaż zdarza
się to rzadko, odstawienie glikokortykosteroidów
doustnych może ujawnić niewydolność nadnerczy
lub dotychczas nierozpoznaną chorobę, taką jak
zespół Churga i Strauss.
54,100
Zaleca się szcze-
gólną ostrożność i ścisły nadzór medyczny przy
rozważaniu ogólnoustrojowego stosowania gliko-
kortykosteroidów u chorych na astmę ze współ-
istniejącą gruźlicą, zarażeniem pasożytniczym,
osteoporozą, jaskrą, cukrzycą, ciężką depresją
lub wrzodami trawiennymi. Opisano śmiertelne
zakażenia wirusami Herpes u chorych otrzymują-
cych glikokortykosteroidy ogólnoustrojowo nawet
przez krótki czas.
Doustne leki przeciwalergiczne
Rola w leczeniu astmy
W kilku krajach do leczenia łagodnej lub umiar-
kowanej astmy alergicznej wprowadzono doustne
leki przeciwalergiczne: tranilast, rypirynast, ta-
zanolast, emirolast, ozagrel, celatrodast, amlek-
sanoks i ibudilast. Ogólnie rzecz biorąc, ich sku-
teczność przeciwastmatyczna jest niewielka
101
,
konieczne są jednak badania w celu określenia
względnej skuteczności tych leków, zanim będzie
można sformułować zalecenia odnośnie do ich roli
w przewlekłym leczeniu astmy.
Skutki uboczne
Potencjalnym skutkiem ubocznym niektórych
z tych leków jest sedacja.
Inne leki kontrolujące
Rola w leczeniu astmy
Zaproponowano różne metody zmniejszania daw-
ki glikokortykosteroidów doustnych u chorych
na astmę ciężką. Leki te powinno się stosować
wyłącznie u wybranych chorych pod ścisłym nad-
zorem specjalisty w leczeniu astmy, ponieważ ich
potencjalny efekt „oszczędzający” steroidy może
nie przeważyć ryzyka poważnych skutków ubocz-
nych. Dwie metaanalizy, poświęcone efektowi
oszczędzającemu steroidy małych dawek meto-
treksatu, wykazały niewielką korzyść, natomiast
stosunkowo częste występowanie skutków niepo-
żądanych.
102,103
Zmniejszenie skutków ubocznych
kortykoterapii jest prawdopodobnie niewystar-
czające do przeważenia skutków niepożądanych
działania metotreksatu.
104
Wykazano również
skuteczność cyklosporyny
105
i złota
106,107
u nie-
których chorych. Niewielki efekt oszczędzający
steroidy wykazuje troleandomycyna (antybiotyk
makrolidowy) stosowana w połączeniu z metylo-
prednizolonem podawanym ogólnoustrojowo, ale
efekt ten może wynikać z zahamowania metabo-
lizmu glikokortykosteroidu przez makrolid, co
nie zwiększa bezpieczeństwa leczenia. Obecnie
badane są inne efekty długotrwałego stosowania
makrolidów w astmie.
108
Nie zaleca się dożylnego
stosowania immunoglobulin.
109111
Skutki uboczne
Stosowanie makrolidu często się wiąże z występo-
waniem nudności, wymiotów, bólu brzucha, a nie-
kiedy też z uszkodzeniem wątroby. Metotreksat
również powoduje objawy ze strony przewodu
pokarmowego, a rzadko – uszkodzenie wątroby,
rozlaną śródmiąższową chorobę płuc i zaburzenia
hematologiczne; wykazuje też działanie terato-
genne.

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
9
Swoista immunoterapia alergenowa
Rola w leczeniu astmy
Rola immunoterapii swoistej w leczeniu astmy
u dorosłych jest ograniczona. Metoda ta wymaga
zidentyfikowania i zastosowania pojedynczego
alergenu odpowiadającego za objawy astmy u da-
nego chorego. Alergen ten podaje się w stopniowo
zwiększanych dawkach w celu wywołania tole-
rancji. Przegląd systematyczny przeprowadzo-
ny przez Cochrane Collaboration, który objął 75
badań z randomizacją poświęconych porównaniu
Ryc. 3-2. Glikokortykosteroidy a osteoporoza
Osoby chore na astmę przyjmujące glikokortykosteroidy wziewne w dużych dawkach lub glikokortykosteroidy doustne
w jakichkolwiek dawkach są narażone na rozwój osteoporozy i złamania, ale nie jest pewne, czy takim ryzykiem są obciążone
również osoby przyjmujące mniejsze dawki GKS wziewnych
1
. Lekarz powinien rozważyć odpowiednie monitorowanie
pacjentów zagrożonych. Poniżej podsumowano monitorowanie i leczenie u takich chorych, ale dostępne są również bardziej
szczegółowe wytyczne postępowania w osteoporozie posteroidowej
2,3
.
Badania przesiewowe – RTG klatki piersiowej należy oceniać pod kątem złamań kręgów. Kręgi klinowe, kompresja trzonów
i kręgi rybie są równoznaczne ze złamaniami i świadczą o największym zagrożeniu złamaniami w przyszłości.
U mężczyzn mogą być lepszym wskaźnikiem ryzyka niż gęstość mineralna kości (BMD). Pomiar BMD techniką dwuwiązkowej
absorpcjometrii rentgenowskiej (DXA) należy wykonać:
– u każdego chorego na astmę przyjmującego glikokortykosteroid doustny przez ponad 6 miesięcy w średniej dawce
dobowej równoważnej 7,5 mg lub więcej prednizonu lub prednizolonu
– u kobiet po menopauzie przyjmujących prednizon lub prednizolon w dawce >5 mg/d przez >3 miesiące
– u każdego chorego na astmę z przebytym złamaniem kręgu lub innych kości, które mogło być spowodowane
osteoporozą.
Pomiar BMD należy zaproponować również:
– kobietom po menopauzie przyjmującym dipropionian beklometazonu w dawce >2 mg/d lub inny glikokortykosteroid
w dawce równoważnej
– każdemu choremu często (3 razy w roku) otrzymującemu krótkotrwałe leczenie glikokortykosteroidem doustnym w dużej
dawce.
Osteoporozę rozpoznaje się na podstawie pomiaru BMD lędźwiowego odcinka kręgosłupa lub szyjki kości udowej:
– gdy wskaźnik T wynosi <–2,5 (2,5 odchylenia standardowe poniżej średniej wartości u młodych zdrowych osób tej samej
płci, u chorych w wieku 19–69 lat)
– gdy wskaźnik Z wynosi <–1 (1 odchylenie standardowe poniżej wartości należnej dla wieku i płci).
Kontrolne pomiary BMD – należy powtarzać
– co 2 lata u chorych bez osteoporozy w badaniu wstępnym, u których nadal się stosuje glikokortykosteroid doustny
(w sposób opisany powyżej)
– co rok u chorych, u których rozpoznano osteoporozę w badaniu wyjściowym i rozpoczęto jej leczenie
Zapobieganie i leczenie
– zalecenia ogólne obejmują: unikanie palenia tytoniu, regularne ćwiczenia fizyczne, stosowanie glikokortykosteroidu
doustnego w możliwie najmniejszej dawce, odpowiednią zawartość wapnia w diecie
– u kobiet z osteoporozą w ciągu pierwszych 10 lat menopauzy można zalecić stosowanie bisfosfonianów lub hormonalnej
terapii zastępczej
4,5,6
(
jakość danych A)
– u mężczyzn, kobiet przed menopauzą i kobiet ponad 10 lat po menopauzie można zalecić stosowanie bisfosfonianów
7
(
jakość danych A)
Piśmiennictwo
1. Goldstein M.F., Fallon J.J. Jr, Harning R.: Chronic glucocorticoid therapy-induced osteoporosis in patients with obstructive
lung disease. Chest, 1999; 116: 1733–1749
2. Eastell R., Reid D.M., Compston J., Cooper C., Fogelman I., Francis R.M., et al.: A UK Consensus Group on management of
glucocorticoid-induced osteoporosis: an update. J. Intern. Med., 1998; 244: 271–292
3. Sambrook P.N., Diamond T., Ferris L., Fiatarone-Singh M., Flicker L., MacLennan A., et al.: Corticosteroid induced
osteoporosis: guidelines for treatment. Aust. Fam. Physician, 2001; 30: 793–796
4. Rossouw J.E., Anderson G.L., Prentice R.L., LaCroix A.Z., Kooperberg C., Stefanick M.L., et al.: Risks and benefits of estrogen
plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized
controlled trial. JAMA, 2002; 288: 321–333
5. Cauley J.A., Robbins J., Chen Z., Cummings S.R., Jackson R.D., LaCroix A.Z., LeBoff M., Lewis C.E., McGowan J., Neuner J.,
Pettinger M., Stefanick M.L., Wacławski-Wende J., Watts N.B.: Effects of estrogen plus progestin on risk of fracture and bone
mineral density. JAMA, 2003; 290: 1729–1738
6. Brown J.P., Josse R.G.: 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada. CMAJ,
2002; 167: S1–34
7. Homik J., Cranney A., Shea B., Tugwell P., Wells G., Adachi R., et al.: Bisphosphonates for steroid induced osteoporosis.
Cochrane Database Syst. Rev., 2000; CD001347

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
immunoterapii swoistej z placebo, potwierdził
skuteczność tej metody leczenia astmy w zmniej-
szaniu objawów i zużycia leków oraz poprawy
swoistej i nieswoistej nadreaktywności dróg odde-
chowych.
112
Jednak wobec stosunkowo niewielkiego efektu
swoistej immunoterapii alergenowej, w porówna-
niu z innymi metodami leczenia, korzyści te trze-
ba rozpatrywać, uwzględniając ryzyko skutków
niepożądanych i niewygodę związaną z długo-
trwałym leczeniem wstrzyknięciami szczepionki,
w tym także konieczność co najmniej półgodzin-
nej obserwacji po każdym wstrzyknięciu. Zasto-
sowanie immunoterapii swoistej powinno się roz-
ważać dopiero wówczas, gdy ścisłe unikanie czyn-
ników środowiskowych i odpowiednie leczenie
farmakologiczne, w tym glikokortykosteroidami
wziewnymi, nie zapewniły kontroli astmy.
113
Nie
ma badań, w których by porównano immunotera-
pię swoistą z leczeniem farmakologicznym astmy.
Stosowanie immunoterapii z użyciem kilku aler-
genów nie jest uzasadnione.
Skutki uboczne
Stosowanie immunoterapii swoistej może się wią-
zać z wystąpieniem miejscowych i ogólnoustrojo-
wych skutków ubocznych. Reakcje ograniczone
do miejsca wstrzyknięcia mogą być różne – od
niewielkiego bąbla z zaczerwienieniem do dużej,
bolesnej późnej reakcji alergicznej. Do skutków
ogólnoustrojowych należą reakcje anafilaktycz-
ne, które mogą stanowić zagrożenie dla życia,
jak również ciężkie zaostrzenia astmy. U chorych
z ciężką astmą opisywano zgony związane z im-
munoterapią swoistą.
Leki doraźne
Leki doraźne powodują szybkie ustąpienie skur-
czu oskrzeli i jego ostrych objawów.
Szybko działające β
2
-mimetyki wziewne
Rola w leczeniu astmy
Szybko działające β
2
mimetyki wziewne są lekami
z wyboru do znoszenia skurczu oskrzeli w czasie
napadu astmy oraz do zapobiegania skurczowi
oskrzeli wywoływanego przez wysiłek fizyczny.
Do tych leków należą salbutamol, terbutalina,
fenoterol, reproterol i pirbuterol. Formoterol
(β
2
mimetyk długo działający) został zarejestro-
wany do znoszenia objawów astmy, ponieważ
działa szybko, ale powinno się go stosować w tym
celu wyłącznie u chorych przyjmujących regular-
nie, w celu kontroli astmy, glikokortykosteroidy
wziewne.
Szybko działające β
2
-mimetyki wziewne po-
winno się stosować tylko w razie potrzeby, w naj-
mniejszej koniecznej dawce. Wzrost zużycia,
zwłaszcza w ciągu dnia, świadczy o pogorszeniu
kontroli astmy i wskazuje na potrzebę zweryfiko-
wania stosowanego leczenia. Podobnie brak szyb-
kiego i trwałego efektu leczenia β
2
-mimetykiem
w czasie zaostrzenia astmy stanowi wskazanie do
oceny lekarskiej i może wskazywać na potrzebę
krótkotrwałego leczenia glikokortykosteroidem
doustnym.
Skutki uboczne
Doustne stosowanie β
2
-mimetyków w standardo-
wych dawkach wiąże się z częstszym występowa-
niem ogólnoustrojowych skutków niepożądanych,
takich jak drżenie i tachykardia, niż w przypadku
stosowania wziewnego.
Glikokortykosteroidy stosowane
ogólnoustrojowo
Rola w leczeniu astmy
O glikokortykosteroidach stosowanych ogólno-
ustrojowo zwykle nie myśli się jako o lekach do-
raźnych, niemniej jednak odgrywają one ważną
rolę w leczeniu ciężkich zaostrzeń astmy, ponie-
waż zapobiegają ich narastaniu, pozwalają unik-
nąć konieczności przekazania chorego na oddział
pomocy doraźnej i hospitalizacji, zapobiegają
wczesnemu nawrotowi zaostrzenia po leczeniu
doraźnym oraz zmniejszają częstość powikłań.
Główne efekty ogólnoustrojowego zastosowania
glikokortykosteroidów w zaostrzeniu astmy ujaw-
niają się dopiero po upływie 4–6 godzin. Preferuje
się doustną drogę podawania leku, gdyż skutecz-
ność jest taka sama jak przy dożylnym podawaniu
hydrokortyzonu.
114
Typowe krótkotrwałe doust-
ne leczenie glikokortykosteroidem w zaostrzeniu
astmy polega na stosowaniu prednizolonu w daw-
ce 40–50 mg/d
115
przez 5–10 dni, w zależności od
ciężkości zaostrzenia. Po ustąpieniu objawów i po-
wrocie czynności płuc do wartości maksymalnych

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
u danego chorego można odstawić glikokortyko-
steroid doustny lub zmniejszyć jego dawkę, pod
warunkiem utrzymania leczenia glikokortykoste-
roidem wziewnym.
116
Domięśniowe wstrzyknię-
cia glikokortykosteroidów nie mają przewagi nad
krótkotrwałym leczeniem doustnym w zapobiega-
niu nawrotom zaostrzeń.
114,116
Skutki uboczne
Skutki niepożądane krótkotrwałego ogólnoustro-
jowego leczenia glikokortykosteroidem w dużej
dawce występują rzadko; są to: odwracalne zabu-
rzenia metabolizmu glukozy, zwiększenie łaknie-
nia, zatrzymywanie wody w ustroju, przyrost
masy ciała, zaokrąglenie twarzy, zaburzenia na-
stroju, nadciśnienie tętnicze, wrzód trawienny
oraz jałowa martwica głowy kości udowej.
Leki przeciwcholinergiczne
Rola w leczeniu astmy
Do leków przeciwcholinergicznych rozszerzają-
cych oskrzela stosowanych w astmie należą bro-
mek ipratropium i bromek oksytropium. Wziew-
ny bromek ipratropium jest mniej skutecznym
lekiem doraźnym w astmie niż szybko działające
β
2
mimetyki wziewne. Metaanaliza badań z zasto-
sowaniem wziewnego bromku ipratropium w po-
łączeniu z wziewnym β
2
-mimetykiem w napadzie
astmy wykazała, że lek przeciwcholinergiczny
powoduje statystycznie istotną, choć niewielką
poprawę czynności płuc i znamiennie zmniejsza
ryzyko hospitalizacji.
117
Korzyści ze stosowania
bromku ipratropium w leczeniu przewlekłym
astmy nie zostały potwierdzone, chociaż uznaje
się go za alternatywny lek rozszerzający oskrze-
la u chorych, u których występują takie skutki
niepożądane stosowania szybko działających β
2
-
mimetyków, jak tachykardia, zaburzenia rytmu
serca i drżenia.
Skutki uboczne
Inhalacja ipratropium lub oksytropium może spo-
wodować suchość w jamie ustnej i gorzki smak.
Nie ma danych na temat jakiegokolwiek nieko-
rzystnego wpływu na wydzielanie śluzu.
118
Teofilina
Rola w leczeniu astmy
Teofilina w postaci szybko działającej może być
stosowana w celu zniesienia objawów astmy.
119
Rola teofiliny w leczeniu zaostrzeń pozostaje kon-
trowersyjna. Teofilina w postaci krótko działającej
może nie powodować dodatkowego rozszerzenia
oskrzeli ponad efekt uzyskany dzięki stosowaniu
szybko działającego β
2
mimetyku, natomiast może
mieć korzystny wpływ na napęd oddechowy.
Skutki uboczne
Teofilina może wywoływać istotne skutki niepożą-
dane, aczkolwiek na ogół da się ich uniknąć poprzez
odpowiednie dawkowanie leku i monitorowanie.
Nie powinno się podawać teofiliny w postaci krót-
ko działającej chorym przyjmującym przewlekle
preparat teofiliny o przedłużonym uwalnianiu, je-
śli nie ma pewności, że stężenie teofiliny w surowi-
cy jest małe lub gdy nie można go monitorować.
Krótko działające β
2
-mimetyki doustne
Krótko działające β
2
mimetyki doustne można
stosować u nielicznych chorych, którzy nie są
w stanie przyjmować leków wziewnie. Jednakże
stosowanie tych leków wiąże się z częstszym wy-
stępowaniem skutków niepożądanych.
Medycyna komplementarna i alternatywna
Rola medycyny komplementarnej i alternatywnej
w leczeniu astmy u dorosłych jest ograniczona,
ponieważ metody te są niedostatecznie przeba-
dane, a ich skuteczność w większości nieudowod-
niona. Ogólnie rzecz biorąc, metody te nie zostały
zweryfikowane według konwencjonalnych stan-
dardów. Psychoterapeutyczna rola leczącego od-
powiada za część efektu placebo wszystkich me-
tod leczniczych, ale jest traktowana jako integral-
na składowa tzw. podejścia holistycznego przez
osoby uprawiające medycynę komplementarną
i alternatywną, co uniemożliwia przeprowadzenie
dużych, wieloośrodkowych badań z randomizacją,
koniecznych do potwierdzenia skuteczności. Jed-
nak bez takich badań względna skuteczność tych
metod pozostanie nieznana.
120
Do metod medycyny komplementarnej i alter-
natywnej należą: akupunktura, homeopatia, zioło-

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
lecznictwo, stosowanie suplementów diety, medy-
cyna ajurwedyjska, stosowanie jonizatorów, osteo-
patia i chiropraktyka, speleoterapia i inne. Poza
metodami wymienionymi poniżej nie przeprowa-
dzono satysfakcjonujących badań, z których by
można wyciągnąć wnioski na temat skuteczności.
Jedno badanie z grupą kontrolną dotyczące
stosowania chiropraktycznych manipulacji na
kręgosłupie nie wykazało korzyści u chorych na
astmę,
121
a w przeglądzie systematycznym ba-
dań nad homeopatią znaleziono tylko 3 badania
z niejednoznacznymi wynikami. Jedno badanie
z zastosowaniem techniki oddychania Buteyki
wskazywało na niewielkie korzyści, ale później
przeprowadzone badanie porównujące 2 techniki
oddychania o przeciwstawnych efektach fizjolo-
gicznych wykazało podobną poprawę w zakresie
zużycia leków doraźnych i glikokortykosteroidów
wziewnych w obu grupach; sugeruje to, że popra-
wa po zastosowaniu tych metod jest wynikiem
czynników niefizjologicznych.
122
Skutki uboczne
Opisano takie powikłania akupunktury, jak wi-
rusowe zapalenie wątroby typu B, obustronna
odma opłucnowa i oparzenia. Skutki uboczne
innych metod medycyny alternatywnej i komple-
mentarnej są w dużej mierze nieznane. Jednakże
niektóre popularne preparaty ziołowe mogą być
niebezpieczne, czego przykładem jest występowa-
nie choroby zarostowej żył wątrobowych spowo-
dowanej stosowaniem ziela żywokostu. Preparaty
żywokostu są sprzedawane w postaci herbatek
ziołowych i sproszkowanego korzenia, a ich tok-
syczność jest związana z obecnością alkaloidów
pyrolizydynowych.
Leki przeciwastmatyczne u dzieci*
Drogi podawania leków
Podstawę leczenia astmy u dzieci w każdym wie-
ku stanowią leki wziewne. Niemal wszystkie dzie-
ci można nauczyć skutecznego stosowania terapii
wziewnej. Różne grupy wiekowe wymagają sto-
sowania różnego typu inhalatorów, aby leczenie
było skuteczne, tak więc wybór inhalatora musi
być zindywidualizowany. W opisach preparatów
konkretnych leków rzadko podaje się dawkę do-
cierającą do płuc u dzieci; istnieją też znaczne róż-
nice pomiędzy inhalatorami różnego typu. Trzeba
to brać pod uwagę, gdy zamienia się jeden inha-
lator na inny. Ponadto wybierając typ inhalatora,
powinno się uwzględniać skuteczność dostarcza-
nia leku do płuc, koszt, bezpieczeństwo, łatwość
posługiwania się, wygodę i dane na temat jego
stosowania w określonej grupie wiekowej.
123125
Na ogół przedkłada się inhalatory ciśnieniowe
z dozownikiem (MDI) i spejserem nad nebuliza-
tory ze względu na większą wygodę stosowania,
skuteczniejsze dostarczanie leku do płuc, małe
ryzyko skutków ubocznych i mniejszy koszt. Na
podstawie powyższych rozważań opracowano
ogólną strategię wyboru inhalatorów u dzieci,
przedstawioną na
rycinie 3-3.
Spejsery zatrzymują duże cząstki leku, które
normalnie zatrzymałyby się w jamie ustnej i gar-
dle, dzięki czemu zmniejszają wchłanianie leku
w jamie ustnej i przewodzie pokarmowym, a tym
samym ogólnoustrojową dostępność leku. Ma to
istotne znaczenie głównie w przypadku stosowa-
nia glikokortykosteroidów wziewnych podlegają-
cych efektowi pierwszego przejścia (dipropionian
beklometazonu, flunizolid, triamcynolon i budezo-
nid) z ciśnieniowych inhalatorów z dozownikiem.
Stosowanie spejsera zmniejsza również skutki
uboczne w obrębie jamy ustnej i gardła. W czasie
napadów astmy MDI powinno się zawsze używać
ze spejserem, ponieważ w tej sytuacji dziecko czę-
sto nie jest w stanie prawidłowo skoordynować
inhalacji z wyzwoleniem dawki leku z inhalatora.
Preferuje się spejsery z dobrze określoną charak-
terystyką podaży leku. Jeśli takie nie są dostępne,
można stosować spejser wykonany własnoręcznie
(np. z półlitrowej plastykowej butelki po napo-
ju).
126
Dawkowanie leków w nebulizacji jest dość nie-
prezycyjne, kosztowne i czasochłonne; ponadto
nebulizatory wymagają konserwacji. Urządzenia
te są zarezerwowane głównie dla dzieci, które nie
potrafią używać inhalatorów. W ciężkich zaostrze-
niach astmy często używa się nebulizatora, cho-
ciaż MDI ze spejserem jest równie skuteczny.
127
* Zobacz także podrozdział „Leki przeciwastmatyczne
u dorosłych” na początku tego rozdziału, gdzie znajduje się
więcej informacji na temat roli różnych leków w leczeniu ast-
my i ich skutków ubocznych. W tym rozdziale podano tylko
informacje dotyczące wyłącznie dzieci.

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
Leki kontrolujące
Leki kontrolujące przebieg astmy u dzieci to gli-
kokortykosteroidy wziewne i stosowane ogólno-
ustrojowo, leki przeciwleukotrienowe, długo dzia-
łające β
2
-mimetyki wziewne, teofilina, kromony
i długo działające β
2
-mimetyki doustne.
Glikokortykosteroidy wziewne
Rola w leczeniu astmy
Glikokortykosteroidy wziewne są najskuteczniej-
szymi lekami kontrolującymi przebieg astmy i dla-
tego zaleca się ich stosowanie u dzieci w każdym
wieku. Na
rycinie 3-4 podano przybliżone daw-
ki równoważne różnych glikokortykosteroidów
wziewnych podawanych z różnych inhalatorów.
Dzieci po 5. roku życia. Badania nad za-
leżnością odpowiedzi od dawki oraz nad dawko-
waniem u dzieci
128,129
wykazują znaczną i szyb-
ką poprawę kliniczną i czynności płuc w wyniku
stosowania glikokortykosteroidów wziewnych
w małych dawkach (np. 100–200 µg budezonidu
na dobę)
130134
; takie dawki zapewniają dobrą
kontrolę astmy lekkiej u większości chorych
132
.
Niektóre dzieci wymagają większych dawek (400
µg/d) do osiągnięcia optymalnej kontroli astmy
i skutecznego zapobiegania skurczowi oskrzeli
wywoływanemu przez wysiłek fizyczny. W nie-
licznych przypadkach konieczne jest leczenie gli-
kokortykosteroidami wziewnymi w dużych daw-
kach.
133,134
U dzieci po 5. roku życia leczenie
przewlekłe glikokortykosteroidami wziewnymi
zapewnia kontrolę objawów astmy, zmniejsza czę-
stość zaostrzeń i hospitalizacji, poprawia jakość
życia i czynność płuc oraz nareaktywność oskrze-
li i zmniejsza skurcz oskrzeli wywoływany przez
wysiłek fizyczny.
132,135
Kontrola objawów i popra-
wa czynności płuc następuje szybko (po upływie
1–2 tygodni), natomiast dłuższe leczenie (miesią-
ce) i niekiedy stosowanie większych dawek może
być konieczne do osiągnięcia maksymalnej popra-
wy nadreaktywności dróg oddechowych.
135
Po za-
przestaniu kortykoterapii kontrola astmy się po-
garsza w ciągu kilku tygodni lub miesięcy.
135
Dzieci w wieku 5 lat i młodsze. Leczenie
dzieci w wieku 5 lat i młodszych glikokortykoste-
roidami wziewnymi na ogół daje podobne efekty
kliniczne jak u dzieci starszych, ale zależność
między dawką a odpowiedzią jest w tej grupie wie-
kowej słabiej przebadana. Odpowiedź kliniczna
na glikokortykosteroidy wziewne może zależeć od
typu inhalatora i umiejętności dziecka właściwe-
go posługiwania się nim. Budezonid w dawkach
dobowych ≤400 µg lub inny glikokortykosteroid
w dawce równoważnej, przyjmowany wziewnie
z użyciem komory inhalacyjnej (zwanej też przy-
stawką lub spejserem [od ang. spacer]), przynosi
prawie maksymalne korzyści u większości cho-
rych.
137,137
Stosowanie glikokortykosteroidów
wziewnych nie powoduje remisji astmy, a objawy
podmiotowe nawracają po zaprzestaniu lecze-
nia.
138
Korzyści kliniczne z przerywanego stosowa-
nia glikokortykosteroidów ogólnoustrojowo lub
wziewnie u dzieci z nawracającym świszczącym
oddechem wywoływanym przez zakażenia wiru-
sowe są kontrowersyjne. Niektóre badania u star-
szych dzieci wykazały niewielkie korzyści, nato-
miast w badaniu przeprowadzonym u dzieci młod-
szych nie stwierdzono wpływu na występowanie
świszczącego oddechu.
139
Nie ma danych uzasad-
niających przewlekłe stosowanie glikokortykoste-
Ryc. 3-3. Wybór inhalatora u dzieci chorych na astmę
a
Grupa wiekowa
Preferowany typ inhalatora
Urządzenia alternatywne
<4 lat
inhalator ciśnieniowy z dozownikiem i odpowiednim spejserem oraz
maską twarzową
nebulizator z maską twarzową
4–6 lat
inhalator ciśnieniowy z dozownikiem i odpowiednim spejserem
z ustnikiem
nebulizator z maską twarzową
>6 lat
inhalator proszkowy, inhalator ciśnieniowy z dozownikiem
aktywowany wdechem lub inhalator ciśnieniowy z dozownikiem
i spejserem z ustnikiem
nebulizator z ustnikiem
a
na podstawie skuteczności w dostarczaniu leku do płuc, opłacalności oraz bezpieczeństwa i wygody stosowania
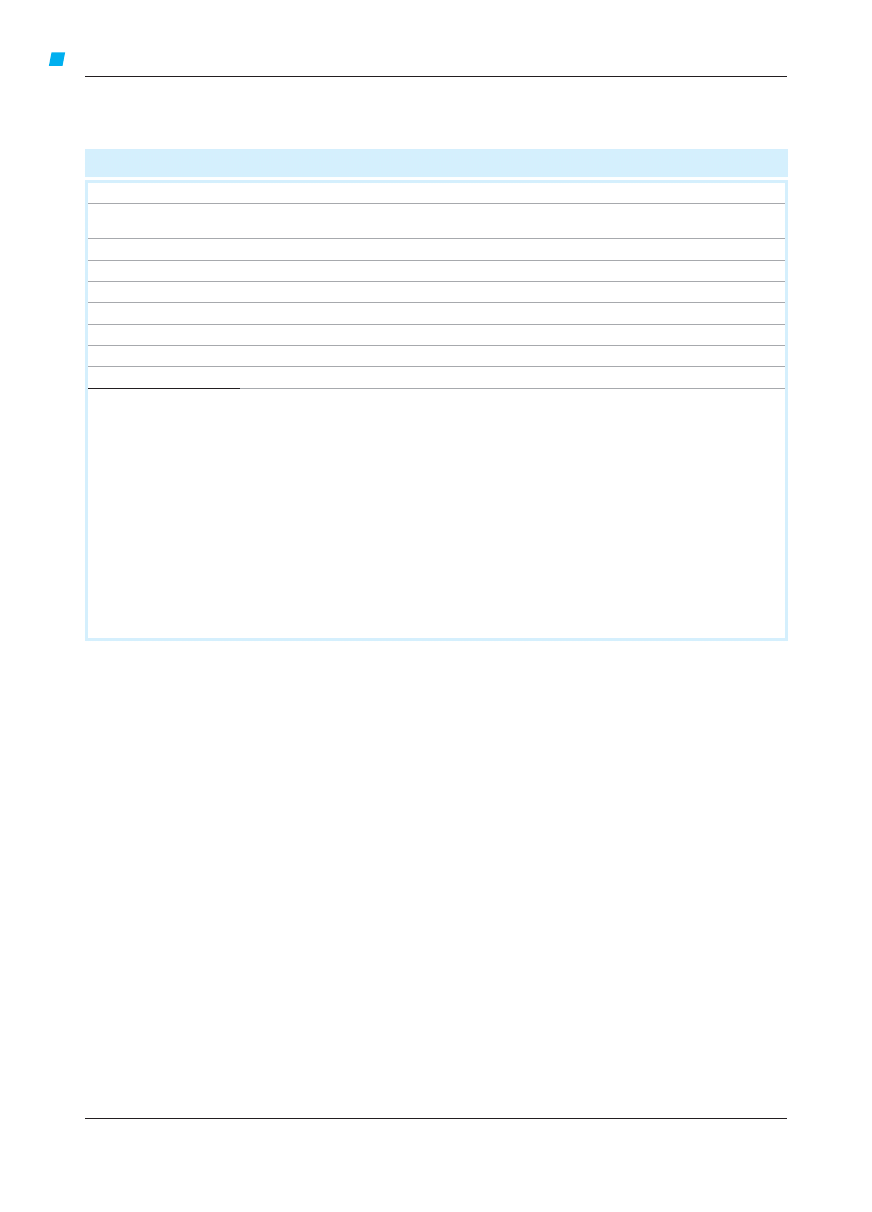
WYTYCZNE
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
roidów wziewnych w małej dawce w celu zapobie-
gania przemijającym wczesnym świstom.
138,139
Skutki uboczne
Większość badań, w których oceniano skutki ogól-
noustrojowe glikokortykosteroidów wziewnych,
dotyczyła dzieci po 5. roku życia.
Wzrastanie. Przy ocenie wpływu glikokorty-
kosteroidów wziewnych na wzrastanie dzieci cho-
rych na astmę ważne jest uwzględnienie poten-
cjalnych czynników zakłócających. Na przykład
u wielu dzieci z astmą przyjmujących glikokor-
tykosteroidy wziewne występuje zahamowanie
tempa wzrastania pod koniec pierwszej dekady
życia.
140
To wolniejsze tempo utrzymuje się do po-
łowy drugiej dekady i wiąże się z opóźnieniem doj-
rzewania. Zwolnienie tempa wzrastania w okre-
sie przed dojrzewaniem przypomina zahamowa-
nie wzrastania. Jednakże zwolnienie wzrastania
w okresie dojrzewania jest również związane
z opóźnieniem dojrzewania szkieletu, tak że wiek
kostny dziecka odpowiada jego wzrostowi.
140,141
Ostatecznie w wieku dorosłym wzrost nie jest niż-
szy, chociaż zostaje osiągnięty później niż normal-
nie. Stosowanie budezonidu wziewnego w dawce
400 µg/d lub innego glikokortykosteroidu w rów-
noważnej dawce w celu uzyskania kontroli astmy
ma mniejszy wpływ na wzrastanie niż niski status
społecznoekonomiczny.
141
Wyniki badań nad wpływem glikokortykoste-
roidów wziewnych na wzrastanie podsumowano
na
rycinie 3-5.
Układ kostny. Potencjalnymi klinicznie
istotnymi skutkami niepożądanymi wpływu gli-
kokortykosteroidów wziewnych na kości u dzie-
ci są osteoporoza i złamania. Przeprowadzono
szereg badań przekrojowych i prospektywnych,
w których oceniano wpływ przewlekłego lecze-
nia glikokortykosteroidami wziewnymi na układ
kostny.
132,135,143149
Wnioski z tych badań podsu-
mowano na
rycinie 3-6.
Oś podwzgórzowo-przysadkowo-nadner-
czowa (PPN). Chociaż istnieją różnice pomiędzy
poszczególnymi glikokortykosteroidami wziew-
Ryc. 3-4. Oszacowane równoważne dawki dobowe glikokortykosteroidów wziewnych dla dzieci
a
Lek
Dawka mała (μg)
Dawka średnia (μg)
Dawka duża (μg)
b
beklometazonu
dipropionian
100–200
>200–400
>400
budezonid
c
100–200
>200–400
>400
budezonid w nebulizacji
250–500
>500–1000
>1000
cyklezonid
c
80–160
>160–320
>320
flunizolid
500–750
>750–1250
>1250
flutikazon
100–200
>200–500
>500
mometazonu pirośluzan
c
100–200
>200–400
>400
triamcynolonu acetonid
400–800
>800–1200
>1200
a
Porównania oparte na danych dotyczących skuteczności.
b
Pacjentów, u których się przewiduje stosowanie dużych dawek (z wyjątkiem krótkotrwałego stosowania) należy skierować do
lekarza specjalisty, aby rozważył alternatywne leczenie kilkoma lekami kontrolującymi przebieg choroby. Maksymalne zalecane
dawki są ustalone arbitralnie, ale przy przedłużonym stosowaniu wiążą się ze zwiększonym ryzykiem ogólnoustrojowych
objawów ubocznych.
c
Zatwierdzone podawanie raz dziennie u chorych na astmę lekką.
Uwagi
Najważniejszym czynnikiem decydującym o właściwym dawkowaniu jest ocena przez lekarza odpowiedzi na leczenie. Lekarz
musi tę odpowiedź monitorować na podstawie parametrów klinicznych i odpowiednio modyfikować dawkowanie.
Po osiągnięciu kontroli astmy dawkę leku powinno się stopniowo zmniejszać do dawki minimalnej koniecznej do utrzymania
kontroli choroby, dzięki czemu zmniejsza się ryzyko wystąpienia skutków niepożądanych.
Określenie małej, średniej i dużej dawki podano w miarę możliwości na podstawie zaleceń producentów. Pewne wykazanie
zależności między dawką a odpowiedzią jest rzadko dostępne. Dlatego też podstawową zasadą jest ustalenie u każdego
chorego najmniejszej dawki zapewniającej kontrolę choroby, ponieważ większe dawki mogą nie być wcale bardziej skuteczne,
ale mogą być związane z większym ryzykiem działań niepożądanych.
Preparaty zawierające freony zostały wycofane z rynku, dlatego lekarz musi dokładnie przeczytać ulotkę dołączoną
do preparatu zawierającego nośnik hydrofluoroalkanowy, aby ustalić właściwą równoważną dawkę.

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
nymi i inhalatorami, to leczenie glikokortykoste-
roidem wziewnym w dawkach odpowiadających
<200 µg budezonidu na dobę nie powoduje istot-
nej supresji osi PPN u dzieci.
135
U dzieci przyj-
mujących większe dawki można wykryć czułymi
metodami niewielkie zmiany czynności tej osi.
148
Kliniczne znaczenie tych obserwacji nie jest zna-
ne, ponieważ w badaniach klinicznych nad stoso-
waniem glikokortykosteroidów wziewnych u dzie-
ci nie opisano ani jednego przypadku przełomu
nadnerczowego. Jednakże przypadki takie opi-
sywano u dzieci leczonych zbyt dużymi dawkami
glikokortykosteroidów wziewnych.
150
Zaćma. Nie stwierdzono częstszego występo-
wania zaćmy u dzieci leczonych glikokortykoste-
roidami wziewnymi.
30,135
Wpływ na ośrodkowy układ nerwowy.
Chociaż pojedyncze opisy przypadków wskazywa-
ły, że leczenie glikokortykosteroidami wziewnymi
może wywoływać nadmierne pobudzenie, agre-
sywność, bezsenność, utratę zahamowań i upo-
śledzenie koncentracji, to w 2 długoterminowych
badaniach z grupą kontrolną z zastosowaniem
budezonidu wziewnego obejmujących łącznie po-
nad 10 000 lat leczenia, nie stwierdzono częstsze-
go występowania takich zaburzeń.
132,135
Kandydoza jamy ustnej, chrypka i wyle-
wy krwi do skóry. Pleśniawka jamy ustnej rzad-
ko stanowi problem u dzieci leczonych glikokor-
tykosteroidami wziewnymi lub podawanymi ogól-
noustrojowo. To powikłanie wydaje się związane
z jednoczesnym stosowaniem antybiotyków, więk-
szymi dawkami dobowymi glikokortykosteroidu,
częstszym dawkowaniem oraz typem inhalatora.
Używanie spejsera zmniejsza częstość występo-
wania kandydozy jamy ustnej.
151
Korzystne jest
również płukanie jamy ustnej.
152
Chrypka lub
inne zauważalne zmiany głosu podczas stosowa-
nia budezonidu występują z podobną częstością
jak podczas stosowania placebo.
30
Stosowanie
budezonidu w przeciętnej dawce dobowej 500 µg
przez 3–6 lat nie wiąże się ze zwiększeniem skłon-
ności do wylewów krwi do skóry.
30
Działania niepożądane na zęby. Leczenie
glikokortykosteroidami wziewnymi nie wiąże
się z częstszym występowaniem próchnicy. Nie-
mniej jednak częstsze ubytki w zębach opisywane
u dzieci z astmą
153
mogą być wynikiem obniżenia
pH w jamie ustnej związanego z inhalowaniem
β
2
-mimetyków
154
.
Inne miejscowe skutki uboczne. Przewle-
kłe stosowanie glikokortykosteroidów wziewnych
nie wiąże się ze zwiększoną zapadalnością na
Ryc. 3-6. Układ kostny a stosowanie
glikokortykosteroidów u dzieci
– podsumowanie
10,143,144
W żadnym badaniu nie stwierdzono statystycznie istotnego
zwiększenia ryzyka złamań u dzieci przyjmujących
glikokortykosteroidy wziewne.
Stosowanie glikokortykosteroidów ogólnoustrojowo
zwiększa ryzyko złamań. Ryzyko złamań wzrasta z liczbą
cykli kortykoterapii; wzrost ten wynosi 32% w przypadku
4-krotnego stosowania takiego leczenia. Stosowanie
glikokortykosteroidów wziewnych zmniejsza potrzebę
zastosowania kortykoterapii ogólnoustrojowej.
Badania prospektywne z grupą kontrolną trwające
2–5 lat oraz szereg badań przekrojowych nie wykazały
niekorzystnego wpływu leczenia glikokortykosteroidami
wziewnymi na gęstość mineralną kości.
Nie przeprowadzono badań prospektywnych, w których
obserwowano by dzieci leczone glikokortykosteroidami
wziewnymi do czasu uzyskania szczytowej gęstości
mineralnej kości.
Ryc. 3-5. Glikokortykosteroidy a wzrastanie
dzieci – podsumowanie
140-142
Astma niekontrolowana lub ciężka wpływa niekorzystnie
na wzrastanie i ostateczny wzrost w wieku dorosłym.
W żadnym badaniu z grupą kontrolną nie wykazano
statystycznie lub klinicznie istotnego niekorzystnego
wpływu glikokortykosteroidów wziewnych w dawce
dobowej 100–200 μg na wzrastanie.
Opóźnienie wzrastania obserwuje się podczas stosowania
wszystkich glikokortykosteroidów wziewnych w dużych
dawkach.
Opóźnienie wzrastania zależało od stosowanej dawki
zarówno w badaniach krótko-, jak i długoterminowych.
Prawdopodobnie istnieją znaczące różnice
w opóźnianiu wzrastania między poszczególnymi
glikokortykosteroidami wziewnymi oraz między różnymi
typami inhalatorów.
Wpływ glikokortykosteroidów wziewnych na opóźnienie
wzrastania wydaje się inny w różnych grupach
wiekowych; dzieci w wieku 4–10 lat są bardziej wrażliwe
niż młodzież.
Spowodowana przez glikokortykosteroidy zmiana
tempa wzrastania w pierwszym roku leczenia jest
prawdopodobnie przejściowa.
Dzieci chore na astmę leczone glikokortykosteroidami
wziewnymi osiągają prawidłowy (przewidywany na
podstawie wzrostu członków rodziny) wzrost w wieku
dorosłym, ale później.

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
zakażenia dolnych dróg oddechowych, w tym na
gruźlicę.
Leki przeciwleukotrienowe
Rola w leczeniu astmy
Dzieci po 5. roku życia. Stosowanie leków prze-
ciwleukotrienowych przynosi korzyści kliniczne
u dzieci po 5. roku życia z astmą o różnej ciężko-
ści
155159
, ale na ogół korzyści te są mniejsze niż
w przypadku stosowania glikokortykosteroidów
wziewnych w małej dawce
160
. Leki przeciwleu-
kotrienowe częściowo chronią przez kilka godzin
przed skurczem oskrzeli wywoływanym przez wy-
siłek fizyczny. Dodane do leczenia u dzieci, u któ-
rych astma nie jest wystarczająco kontrolowana
za pomocą glikokortykosteroidów wziewnych sto-
sowanych w małej dawce, leki przeciwleukotrie-
nowe powodują umiarkowaną poprawę kliniczną,
w tym znamienne zmniejszenie częstości zaost-
rzeń.
161,162
Dzieci w wieku 5 lat i młodsze. Poza efek-
tami opisanymi powyżej
163,164
leki przeciwleuko-
trienowe zmniejszają częstość zaostrzeń astmy
wywołanych przez zakażenia wirusowe u dzieci
w wieku 2–5 lat z astmą sporadyczną w wywia-
dach
164
.
Skutki uboczne
U dzieci przyjmujących leki przeciwleukotrieno-
we nie obserwowano działań niepożądanych.
Długo działające β
2
-mimetyki wziewne
Rola w leczeniu astmy
Długo działające β
2
mimetyki wziewne stosuje
się głównie w leczeniu skojarzonym u dzieci po
5. roku życia, u których astma nie jest wystarcza-
jąco kontrolowana za pomocą glikokortykosteroi-
dów wziewnych stosowanych w średnich dawkach
lub jako lek zapobiegający skurczowi oskrzeli
przed intensywnym wysiłkiem fizycznym. Należy
unikać stosowania długo działających β
2
-mimety-
ków wziewnych w monoterapii.
75
Dzieci po 5. roku życia. Długo działające
β
2
mimetyki wziewne badano głównie w leczeniu
skojarzonym u dzieci po 5. roku życia, u których
astma nie była kontrolowana pomimo stosowania
glikokortykosteroidów wziewnych w małych lub
dużych dawkach. W większości badań stwierdzo-
no znamienną poprawę w zakresie szczytowego
przepływu wydechowego i innych parametrów
czynności płuc.
55,165169
Jednakże wpływ tych
leków na takie wskaźniki jak objawy i potrzeba
stosowania leków doraźnych obserwowano tylko
w około połowie przeprowadzonych badań. Le-
czenie skojarzone z długo działającymi β
2
-mime-
tykami wziewnymi nie zmniejsza częstości zaost-
rzeń.
170
Inhalacja pojedynczej dawki długo dzia-
łającego β
2
-mimetyku wziewnego zapobiega na
kilka godzin skurczowi oskrzeli wywoływanemu
przez wysiłek fizyczny.
171
Przy codziennym stoso-
waniu czas ochrony nieco się skraca,
171
ale i tak
jest dłuższy niż w przypadku stosowania krótko
działających β
2
-mimetyków.
Przedkłada się stosowanie inhalatorów zawie-
rających jednocześnie glikokortykosteroid wziew-
ny i długo działający β
2
-mimetyk wziewny nad
stosowanie tych leków z osobnych inhalatorów.
Inhalatory zawierające oba leki zapewniają, że
długo działający β
2
mimetyk jest zawsze przyjmo-
wany z glikokortykosteroidem.
Dzieci w wieku 5 lat i młodsze. Nie prze-
prowadzono odpowiednich badań w celu oceny
wpływu długo działających β
2
-mimetyków wziew-
nych lub stosowania inhalatorów zawierających
długo działający β
2
-mimetyk wziewny i glikokor-
tykosteroid.
Skutki uboczne
Długo działające β
2
-mimetyki wziewne, nawet
stosowane przewlekle, są dobrze tolerowane przez
dzieci, ale ze względu na sprzeczne doniesienia na
temat ich wpływu na zaostrzenia astmy nie zale-
ca się ich stosowania w przypadku, gdy konieczny
jest więcej niż jeden lek kontrolujący.
170
Długo
działające β
2
mimetyki wziewne powinno się sto-
sować tylko w połączeniu z glikokortykosteroidem
wziewnym w odpowiedniej dawce ustalonej przez
lekarza, najlepiej z inhalatora zawierającego oba
leki.
Teofilina
Rola w leczeniu astmy
Wykazano, że teofilina jest skuteczna w monote-
rapii i w leczeniu skojarzonym z glikokortykoste-
roidami wziewnymi lub doustnymi u dzieci po 5.
roku życia. Jest znamiennie skuteczniejsza niż

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
placebo w kontrolowaniu objawów występujących
w ciągu dnia, jak i objawów nocnych oraz w po-
prawie czynności płuc.
172174
Leczenie przewle-
kłe w niewielkim stopniu chroni przed skurczem
oskrzeli wywoływanym przez wysiłek fizyczny.
175
Leczenie skojarzone z użyciem teofiliny poprawia
kontrolę astmy i zmniejsza dawkę glikokortyko-
steroidu stosowaną przewlekle u dzieci z astmą
ciężką leczonych glikokortykosteroidem wziew-
nym lub doustnym.
176,177
Wyniki kilku badań
przeprowadzonych u dzieci w wieku 5 lat i młod-
szych wskazują na pewne korzyści kliniczne ze
stosowania teofiliny. Jednakże skuteczność teofi-
liny jest mniejsza w porównaniu z glikokortyko-
steroidami wziewnymi w małej dawce, a skutki
uboczne są większe.
Większość danych klinicznych dotyczących
stosowania teofiliny u dzieci uzyskano z badań,
w których stężenie teofiliny w osoczu było utrzy-
mywane w przedziale terapeutycznym 55–110
µmol/l (5–10 µg/ml). Dalsze badania sugerują, że
działanie kontrolujące przebieg astmy może wy-
stępować przy mniejszych stężeniach leku w oso-
czu (odpowiadających dawkom ok. 10 mg/kg/d). Do
stosowania przewlekłego preferuje się preparaty
o przedłużonym uwalnianiu, ponieważ można je
podawać 2 razy dziennie. Preferuje się preparaty
o przedłużonym uwalnianiu, które mają przewi-
dywalny profil wchłaniania i pełną biodostępność
niezależnie od spożycia posiłku. Różnice osobnicze
w eliminacji teofiliny z ustroju mogą być 10krot-
ne. U dzieci bez chorób współistniejących nie ma
potrzeby oznaczania stężenia teofiliny w osoczu,
jeśli dawka nie przekracza 10 mg/kg/d. Jednakże
w przypadku stosowania większych dawek lub
jednoczesnego stosowania leków zwiększających
stężenie teofiliny w osoczu, powinno się oznaczać
stężenie teofiliny 2 godziny przed podaniem na-
stępnej dawki, po osiągnięciu stanu stacjonarnego
(po 3 dniach stosowania leku).
Skutki uboczne
Najczęstszymi skutkami ubocznymi stosowania
teofiliny są: utrata łaknienia, nudności, wymio-
ty i ból głowy.
178
Mogą również wystąpić takie
objawy jak: niewielkie pobudzenie ośrodkowego
układu nerwowego, kołatanie serca, tachykardia,
zaburzenia rytmu serca, ból brzucha, biegunka
i rzadko krwawienie z żołądka. Te skutki ubocz-
ne obserwuje się głównie przy stosowaniu dawek
>10 mg/kg/d. Ryzyko działań niepożądanych jest
mniejsze, gdy leczenie rozpoczyna się dawką do-
bową około 5 mg/kg, którą następnie stopniowo
się zwiększa do 10 mg/kg. Ciężkie przedawkowa-
nie teofiliny może być śmiertelne.
Kromony: kromoglikan sodu i nedokromil
sodu
Rola w leczeniu astmy
Kromoglikan sodu i nedokromil sodu odgrywa-
ją niewielką rolę w przewlekłym leczeniu astmy
u dzieci. Jedna metaanaliza wykazała, że prze-
wlekłe stosowanie kromoglikanu sodu nie ma
przewagi nad placebo w leczeniu astmy u dzie-
ci.
179
Inna metaanaliza potwierdziła przewagę
glikokortykosteroidów wziewnych stosowanych
w małej dawce nad kromoglikanem sodu w ast-
mie przewlekłej, ale ponieważ w badaniach tych
nie było grupy kontrolnej, w której stosowano by
placebo, nie można na ich podstawie wnioskować
o skuteczności kromoglikanu sodu; nie stwierdzo-
no też różnic między kromoglikanem i nedokro-
milem pod względem bezpieczeństwa.
180
Wykazano, że nedokromil sodu zmniejsza czę-
stość zaostrzeń, ale jego wpływ na inne parametry
kontroli astmy nie jest większy niż placebo.
135
Po-
jedyncza dawka kromoglikanu sodu lub nedokro-
milu sodu zmniejsza skurcz oskrzeli wywoływany
przez wysiłek fizyczny lub zimne powietrze.
181
Badania nad stosowaniem tych leków u dzieci
w wieku 5 lat i młodszych są nieliczne, a ich wy-
niki – sprzeczne.
Skutki uboczne
U niewielkiego odsetka chorych leczonych kro-
moglikanem sodu występuje kaszel, podrażnienie
gardła i skurcz oskrzeli. Najczęstszymi skutkami
ubocznymi nedokromilu są zły smak, ból głowy
i nudności.
182
Długo działające β
2
-mimetyki doustne
Leczenie długo działającym β
2
-mimetykiem do-
ustnym, takim jak salbutamol, terbutalina lub
bambuterol w postaci preparatów o powolnym
uwalnianiu zmniejsza objawy nocne astmy.
183,184
Nie poleca się jednak stosowania tych leków ze

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
względu na ich potencjalne działania uboczne, ta-
kie jak pobudzenie układu sercowonaczyniowego,
niepokój, drżenie mięśni szkieletowych. Jeśli się
je stosuje, powinno się indywidualizować dawko-
wanie i monitorować efekt terapeutyczny w celu
ograniczenia skutków ubocznych.
185
Długo dzia-
łające β
2
-mimetyki doustne w niewielkim stopniu,
jeśli w ogóle, chronią przed skurczem oskrzeli wy-
woływanym przez wysiłek fizyczny.
Glikokortykosteroidy stosowane
ogólnoustrojowo
Ze względu na skutki uboczne długotrwałego sto-
sowania leczenie glikokortykosteroidami doust-
nymi u dzieci z astmą powinno się zarezerwować
dla ciężkich zaostrzeń wywoływanych przez zaka-
żenie wirusowe lub inne czynniki.
Leki doraźne
Szybko działające β
2
-mimetyki wziewne
i krótko działające β
2
-mimetyki doustne
Rola w leczeniu astmy
Szybko działające β
2
mimetyki wziewne są naj-
skuteczniejszymi z dostępnych leków rozszerzeją-
cych oskrzela i dlatego preferuje się je w leczeniu
napadów astmy u dzieci w każdym wieku. Wziew-
ne podanie leku powoduje szybsze rozszerzenie
oskrzeli przy mniejszej dawce i mniejszych skut-
kach ubocznych, w porównaniu z podaniem do-
ustnym lub dożylnym.
186
Ponadto terapia wziew-
na chroni przed skurczem oskrzeli wywoływanym
przez wysiłek fizyczny i inne czynniki, a efekt ten
utrzymuje się przez 30 minut do 2 godzin (długo
działające β
2
mimetyki zapewniają dłużej trwają-
cą ochronę).
187
Nie obserwuje się takiego efektu
po ogólnoustrojowym podaniu leku.
188
Leczenie
doustne rzadko jest potrzebne i jest zarezerwowa-
ne głównie dla małych dzieci, które nie potrafią
inhalować leków.
Skutki uboczne
Najczęściej zgłaszanymi dolegliwościami związa-
nymi ze stosowaniem β
2
mimetyków w dużych
dawkach u dzieci są drżenie mięśni szkieleto-
wych, ból głowy, kołatanie serca i niewielkie po-
budzenie. Dolegliwości te występują częściej, gdy
lek podaje się ogólnoustrojowo, i ustępują w miarę
jego stosowania.
189
Leki przeciwcholinergiczne
Rola w leczeniu astmy
Nie zaleca się stosowania wziewnych leków prze-
ciwcholinergicznych w przewlekłym leczeniu ast-
my u dzieci.
190
Piśmiennictwo
1. Brown P.H., Greening A.P., Crompton G.K.: Large volume spacer devices and the influ-
ence of high dose beclomethasone dipropionate on hypothalamo-pituitary-adrenal
axis function. Thorax, 1993; 48: 233–238
2. Dolovich M.: New delivery systems and propellants. Can. Respir. J., 1999; 6 (3):
290–295
3. Leach C.L., Davidson P.J., Boudreau R.J.: Improved airway targeting with the CFC-free
HFA-beclomethasone metered-dose inhaler compared with CFC-beclomethasone.
Eur. Respir. J., 1998; 12: 1346–1353
4. Harrison L.I., Soria I., Cline A.C., Ekholm B.P.: Pharmacokinetic differences between
chlorofluorocarbon and chlorofluorocarbon-free metered dose inhalers of beclo-
methasone dipropionate in adult asthmatics. J. Pharm. Pharmacol., 1999; 51: 1235–
1240
5. Juniper E.F., Price D.B., Stampone P.A., Creemers J.P., Mol S.J., Fireman P.: Clinically
important improvements in asthmaspecific quality of life, but no difference in con-
ventional clinical indexes in patients changed from conventional beclomethasone
dipropionate to approximately half the dose of extrafine beclomethasone dipropio-
nate. Chest, 2002; 121: 1824–1832
6. Langley P.C.: The technology of metered-dose inhalers and treatment costs in asth-
ma: a retrospective study of breath actuation versus traditional press-and-breathe
inhalers. Clin. Ther., 1999; 21: 236–253
7. Newman S.P.: A comparison of lung deposition patterns between different asthma
inhalers. J. Aerosol. Med., 1995; 8 (suppl. 3): 21S–26S
8. Newman S.P.: Inhaler treatment options in COPD. Eur. Respir. Rev., 2005; 14: 102–108
9. Juniper E.F., Kline P.A., Vanzieleghem M.A., Ramsdale E.H., O’Byrne P.M., Hargreave
F.E.: Effect of long-term treatment with an inhaled corticosteroid (budesonide) on
airway hyper-responsiveness and clinical asthma in nonsteroid-dependent asthmat-
ics. Am. Rev. Respir. Dis., 1990; 142: 832–836
10. Long-term effects of budesonide or nedocromil in children with asthma. The
Childhood Asthma Management Program Research Group. N. Engl. J. Med., 2000;
343: 1054–1063
11. Jeffery P.K., Godfrey R.W., Adelroth E., Nelson F., Rogers A., Johansson S.A.: Effects of
treatment on airway inflammation and thickening of basement membrane reticular
collagen in asthma. A quantitative light and electron microscopic study. Am. Rev.
Respir. Dis., 1992; 145 (4 Pt 1): 890–899
12. Pauwels R.A., Lofdahl C.G., Postma D.S., Tattersfield A.E., O’Byrne P., Barnes P.J.,
et al.: Effect of inhaled formoterol and budesonide on exacerbations of asthma.
Formoterol and Corticosteroids Establishing Therapy (FACET) International Study
Group. N. Engl. J. Med., 1997; 337: 1405–1411
13. Suissa S., Ernst P., Benayoun S., Baltzan M., Cai B.: Low-dose inhaled corticosteroids
and the prevention of death from asthma. N. Engl. J. Med., 2000; 343: 332–336
14. Waalkens H.J., Van Essen-Zandvliet E.E., Hughes M.D., Gerritsen J., Duiverman
E.J., Knol K., et al.: Cessation of long-term treatment with inhaled corticosteroid
(budesonide) in children with asthma results in deterioration. The Dutch CNSLD
Study Group. Am. Rev. Respir. Dis., 1993; 148: 1252–1257
15. Jayasiri B., Perera C.: Successful withdrawal of inhaled corticosteroids in childhood
asthma. Respirology, 2005; 10: 385–388
16. National Asthma Education and Prevention Program. Guidelines for the diagno-
sis and management of asthma. Bethesda, MD, National Heart, Lung, and Blood
Institute. National Institutes of Health, 1997
17. Powell H., Gibson P.G.: Inhaled corticosteroid doses in asthma: an evidence-based
approach. Med. J. Aust., 2003; 178: 223–225
18. Szefler S.J., Martin R.J., King T.S., Boushey H.A., Cherniack R.M., Chinchilli V.M., et
al.: Significant variability in response to inhaled corticosteroids for persistent asthma.
J. Allergy Clin. Immunol., 2002; 109: 410–418
19. Lipworth B.J., Kaliner M.A., LaForce C.F., Baker J.W., Kaiser H.B., Amin D., et al.:
Effect of ciclesonide and fluticasone on hypothalamic-pituitary-adrenal axis function
in adults with mildto-moderate persistent asthma. Ann. Allergy Asthma Immunol.,
2005; 94: 465–472

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
9
20. Lipworth B.J.: Systemic adverse effects of inhaled corticosteroid therapy: a systematic
review and meta-analysis. Arch. Intern. Med., 1999; 159: 941–955
21. Barnes P.J.: Efficacy of inhaled corticosteroids in asthma. J. Allergy Clin. Immunol.,
1998; 102 (4 Pt 1): 531–538
22. Kamada A.K., Szefler S.J., Martin R.J., Boushey H.A., Chinchilli V.M., Drazen J.M.,
et al.: Issues in the use of inhaled glucocorticoids. The Asthma Clinical Research
Network. Am. J. Respir. Crit. Care Med., 1996; 153 (6 Pt 1): 1739–1748
23. Lee D.K., Bates C.E., Currie G.P., Cowan L.M., McFarlane L.C., Lipworth B.J.: Effects
of high-dose inhaled fluticasone propionate on the hypothalamic-pituitary-adrenal
axis in asthmatic patients with severely impaired lung function. Ann. Allergy Asthma
Immunol., 2004; 93: 253–258
24. Mak V.H., Melchor R., Spiro S.G.: Easy bruising as a side-effect of inhaled corticoste-
roids. Eur. Respir. J., 1992; 5: 1068–1074
25. Effect of inhaled triamcinolone on the decline in pulmonary function in chronic ob-
structive pulmonary disease. N. Engl. J. Med., 2000; 343: 1902–1909
26. Pauwels R.A., Yernault J.C., Demedts M.G., Geusens P.: Safety and efficacy of flutica-
sone and beclomethasone in moderate to severe asthma. Belgian Multicenter Study
Group. Am. J. Respir. Crit. Care Med., 1998; 157 (3 Pt 1): 827–832
27. Ernst P., Baltzan M., Deschenes J., Suissa S.: Low-dose inhaled and nasal corticoste-
roid use and the risk of cataracts. Eur. Respir. J., 2006; 27: 1168–1174
28. Garbe E., LeLorier J., Boivin J.F., Suissa S.: Inhaled and nasal glucocorticoids and the
risks of ocular hypertension or openangle glaucoma. JAMA, 1997; 277: 722–727
29. Cumming R.G., Mitchell P., Leeder S.R.: Use of inhaled corticosteroids and the risk of
cataracts. N. Engl. J. Med., 1997; 337: 8–14
30. Agertoft L., Larsen F.E., Pedersen S.: Posterior subcapsular cataracts, bruises and
hoarseness in children with asthma receiving long-term treatment with inhaled
budesonide. Eur. Respir. J., 1998; 12: 130–135
31. Toogood J.H., Markov A.E., Baskerville J., Dyson C.: Association of ocular cata-
racts with inhaled and oral steroid therapy during long-term treatment of asthma.
J. Allergy Clin. Immunol., 1993; 91: 571–579
32. Simons F.E., Persaud M.P., Gillespie C.A., Cheang M., Shuckett E.P.: Absence of pos-
terior subcapsular cataracts in young patients treated with inhaled glucocorticoids.
Lancet, 1993; 342: 776–778
33. Bahceciler N.N., Nuhoglu Y., Nursoy M.A., Kodalli N., Barlan I.B., Basaran M.M.:
Inhaled corticosteroid therapy is safe in tuberculin-positive asthmatic children.
Pediatr. Infect. Dis. J., 2000; 19: 215–218
34. Dicpinigaitis P.V., Dobkin J.B., Reichel J.: Antitussive effect of the leukotriene receptor
antagonist zafirlukast in subjects with cough-variant asthma. J. Asthma, 2002; 39:
291–297
35. Lipworth B.J.: Leukotriene-receptor antagonists. Lancet, 1999; 353: 57–62
36. Drazen J.M., Israel E., O’Byrne P.M.: Treatment of asthma with drugs modifying the
leukotriene pathway. N. Engl. J. Med., 1999; 340: 197–206
37. Barnes N.C., Miller C.J.: Effect of leukotriene receptor antagonist therapy on the risk
of asthma exacerbations in patients with mild to moderate asthma: an integrated
analysis of zafirlukast trials. Thorax, 2000; 55: 478–483
38. Noonan M.J., Chervinsky P., Brandon M., Zhang J., Kundu S., McBurney J., et al.:
Montelukast, a potent leukotriene receptor antagonist, causes dose-related improve-
ments in chronic asthma. Montelukast Asthma Study Group. Eur. Respir. J., 1998; 11:
1232–1239
39. Reiss T.F., Chervinsky P., Dockhorn R.J., Shingo S., Seidenberg B., Edwards T.B.:
Montelukast, a once-daily leukotriene receptor antagonist, in the treatment of
chronic asthma: a multicenter, randomized, double-blind trial. Montelukast Clinical
Research Study Group. Arch. Intern. Med., 1998; 158: 1213–1220
40. Leff J.A., Busse W.W., Pearlman D., Bronsky E.A., Kemp J., Hendeles L., et al.:
Montelukast, a leukotriene-receptor antagonist, for the treatment of mild asthma
and exerciseinduced bronchoconstriction. N. Engl. J. Med., 1998; 339: 147–152
41. Dahlen B., Nizankowska E., Szczeklik A., Zetterstrom O., Bochenek G., Kumlin M.,
et al.: Benefits from adding the 5-lipoxygenase inhibitor zileuton to conventional
therapy in aspirin-intolerant asthmatics. Am. J. Respir. Crit. Care Med., 1998; 157 (4
Pt 1): 1187–1194
42. Bleecker E.R., Welch M.J., Weinstein S.F., Kalberg C., Johnson M., Edwards L., et al.:
Low-dose inhaled fluticasone propionate versus oral zafirlukast in the treatment of
persistent asthma. J. Allergy Clin. Immunol., 2000; 105 (6 Pt 1): 1123–1129
43. Laviolette M., Malmstrom K., Lu S., Chervinsky P., Pujet J.C., Peszek I., et al.:
Montelukast added to inhaled beclomethasone in treatment of asthma. Montelukast/
Beclomethasone Additivity Group. Am. J. Respir. Crit. Care Med., 1999; 160: 1862–
1868
44. Lofdahl C.G., Reiss T.F., Leff J.A., Israel E., Noonan M.J., Finn A.F., et al.: Randomised,
placebo controlled trial of effect of a leukotriene receptor antagonist, montelukast,
on tapering inhaled corticosteroids in asthmatic patients. BMJ, 1999; 319: 87–90
45. Virchow J.C., Prasse A., Naya I., Summerton L., Harris A.: Zafirlukast improves asthma
control in patients receiving highdose inhaled corticosteroids. Am. J. Respir. Crit. Care
Med., 2000; 162 (2 Pt 1): 578–585
46. Price D.B., Hernandez D., Magyar P., Fiterman J., Beeh K.M., James I.G., et al.:
Randomised controlled trial of montelukast plus inhaled budesonide versus double
dose inhaled budesonide in adult patients with asthma. Thorax, 2003; 58: 211–216
47. Vaquerizo M.J., Casan P., Castillo J., Perpina M., Sanchis J., Sobradillo V., et al.: Effect
of montelukast added to inhaled budesonide on control of mild to moderate asthma.
Thorax, 2003; 58: 204–210
48. Bjermer L., Bisgaard H., Bousquet J., Fabbri L.M., Greening A.P., Haahtela T., et al.:
Montelukast and fluticasone compared with salmeterol and fluticasone in protecting
against asthma exacerbation in adults: one year, double blind, randomised, com-
parative trial. BMJ, 2003; 327: 891
49. Nelson H.S., Busse W.W., Kerwin E., Church N., Emmett A., Rickard K., et al.:
Fluticasone propionate/salmeterol combination provides more effective asthma con-
trol than low-dose inhaled corticosteroid plus montelukast. J. Allergy Clin. Immunol.,
2000; 106: 1088–1095
50. Fish J.E., Israel E., Murray J.J., Emmett A., Boone R., Yancey S.W., et al.: Salmeterol
powder provides significantly better benefit than montelukast in asthmatic patients
receiving concomitant inhaled corticosteroid therapy. Chest, 2001; 120: 423–430
51. Ringdal N., Eliraz A., Pruzinec R., Weber H.H., Mulder P.G., Akveld M., et al.: The
salmeterol/fluticasone combination is more effective than fluticasone plus oral mon-
telukast in asthma. Respir. Med., 2003; 97: 234–241
52. Wechsler M.E., Finn D., Gunawardena D., Westlake R., Barker A., Haranath S.P., et al.:
Churg-Strauss syndrome in patients receiving montelukast as treatment for asthma.
Chest, 2000; 117: 708–713
53. Wechsler M.E., Pauwels R., Drazen J.M.: Leukotriene modifiers and Churg-Strauss
syndrome: adverse effect or response to corticosteroid withdrawal? Drug Saf., 1999;
21: 241–251
54. Harrold L.R., Andrade S.E., Go A.S., Buist A.S., Eisner M., Vollmer W.M., et al.:
Incidence of Churg-Strauss syndrome in asthma drug users: a population-based per-
spective. J. Rheumatol., 2005; 32: 1076–1080
55. Lemanske R.F. Jr, Sorkness C.A., Mauger E.A., Lazarus S.C., Boushey H.A., Fahy J.V., et
al.: Inhaled corticosteroid reduction and elimination in patients with persistent asthma
receiving salmeterol: a randomized controlled trial. JAMA, 2001; 285: 2594–2603
56. Lazarus S.C., Boushey H.A., Fahy J.V., Chinchilli V.M., Lemanske R.F. Jr, Sorkness C.A.,
et al.: Long-acting beta2-agonist monotherapy vs continued therapy with inhaled
corticosteroids in patients with persistent asthma: a randomized controlled trial.
JAMA, 2001; 285: 2583–2593
57. Pearlman D.S., Chervinsky P., LaForce C., Seltzer J.M., Southern D.L., Kemp J.P., et
al.: A comparison of salmeterol with albuterol in the treatment of mild-to-moderate
asthma. N. Engl. J. Med., 1992; 327: 1420–1425
58. Kesten S., Chapman K.R., Broder I., Cartier A., Hyland R.H., Knight A., et al.: A three-
month comparison of twice daily inhaled formoterol versus four times daily inhaled
albuterol in the management of stable asthma. Am. Rev. Respir. Dis., 1991; 144 (3 Pt
1): 622–625
59. Wenzel S.E., Lumry W., Manning M., Kalberg C., Cox F., Emmett A., et al.: Efficacy,
safety, and effects on quality of life of salmeterol versus albuterol in patients with mild
to moderate persistent asthma. Ann. Allergy Asthma Immunol., 1998; 80: 463–470
60. Shrewsbury S., Pyke S., Britton M.: Meta-analysis of increased dose of inhaled ste-
roid or addition of salmeterol in symptomatic asthma (MIASMA). BMJ, 2000; 320:
1368–1373
61. Woolcock A., Lundback B., Ringdal N., Jacques L.A.: Comparison of addition of sal-
meterol to inhaled steroids with doubling of the dose of inhaled steroids. Am. J.
Respir. Crit. Care Med., 1996; 153: 1481–1488
62. Greening A.P., Ind P.W., Northfield M., Shaw G.: Added salmeterol versus higher-dose
corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid.
Allen & Hanburys Limited UK Study Group. Lancet, 1994; 344: 219–224
63. Bateman E.D., Boushey H.A., Bousquet J., Busse W.W., Clark T.J., Pauwels R.A., et
al.: Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma
ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
64. Lalloo U.G., Malolepszy J., Kozma D., Krofta K., Ankerst J., Johansen B., et al.:
Budesonide and formoterol in a single inhaler improves asthma control compared
with increasing the dose of corticosteroid in adults with mild-to-moderate asthma.
Chest, 2003; 123: 1480–1487
65. Kips J.C., O’Connor B.J., Inman M.D., Svensson K., Pauwels R.A., O’Byrne P.M.: A long-
term study of the antiinflammatory effect of low-dose budesonide plus formoterol
versus high-dose budesonide in asthma. Am. J. Respir. Crit. Care Med., 2000; 161 (3
Pt 1): 996–1001
66. Stoloff S.W., Stempel D.A., Meyer J., Stanford R.H., Carranza Rosenzweig J.R.:
Improved refill persistence with fluticasone propionate and salmeterol in a single
inhaler compared with other controller therapies. J. Allergy Clin. Immunol., 2004;
113: 245–251
67. Rabe K.F., Pizzichini E., Stallberg B., Romero S., Balanzat A.M., Atienza T., et al.:
Budesonide/formoterol in a single inhaler for maintenance and relief in mild-to-mod-
erate asthma: a randomized, double-blind trial. Chest, 2006; 129: 246–256
68. O’Byrne P.M., Bisgaard H., Godard P.P., Pistolesi M., Palmqvist M., Zhu Y., et al.:
Budesonide/formoterol combination therapy as both maintenance and reliever medi-
cation in asthma. Am. J. Respir. Crit. Care Med., 2005; 171: 129–136
69. Scicchitano R., Aalbers R., Ukena D., Manjra A., Fouquert L., Centanni S., et al.:
Efficacy and safety of budesonide/formoterol single inhaler therapy versus a higher
dose of budesonide in moderate to severe asthma. Curr. Med. Res. Opin., 2004; 20:
1403–1418
70. Vogelmeier C., D’Urzo A., Pauwels R., Merino J.M., Jaspal M., Boutet S., et al.:
Budesonide/formoterol maintenance and reliever therapy: an effective asthma treat-
ment option? Eur. Respir. J., 2005; 26: 819–828

WYTYCZNE
60
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
71. Nelson J.A., Strauss L., Skowronski M., Ciufo R., Novak R., McFadden E.R. Jr: Effect of
long-term salmeterol treatment on exercise-induced asthma. N. Engl. J. Med., 1998;
339: 141–146
72. Palmqvist M., Persson G., Lazer L., Rosenborg J., Larsson P., Lotvall J.: Inhaled dry-
powder formoterol and salmeterol in asthmatic patients: onset of action, duration of
effect and potency. Eur. Respir. J., 1997; 10: 2484–2489
73. van Noord J.A., Smeets J.J., Raaijmakers J.A., Bommer A.M., Maesen F.P.: Salmeterol
versus formoterol in patients with moderately severe asthma: onset and duration of
action. Eur. Respir. J., 1996; 9: 1684–1688
74. Newnham D.M., McDevitt D.G., Lipworth B.J.: Bronchodilator subsensitivity after
chronic dosing with eformoterol in patients with asthma. Am. J. Med., 1994; 97:
29–37
75. Nelson H.S., Weiss S.T., Bleecker E.R., Yancey S.W., Dorinsky P.M.: The Salmeterol
Multicenter Asthma Research Trial: a comparison of usual pharmacotherapy for
asthma or usual pharmacotherapy plus salmeterol. Chest, 2006; 129: 15–26
76. Wechsler M.E., Lehman E., Lazarus S.C., Lemanske R.F. Jr, Boushey H.A., Deykin A.,
et al.: beta-Adrenergic receptor polymorphisms and response to salmeterol. Am. J.
Respir. Crit. Care Med., 2006; 173: 519–526
77. Sullivan P., Bekir S., Jaffar Z., Page C., Jeffery P., Costello J.: Anti-inflammatory effects
of low-dose oral theophylline in atopic asthma. Lancet, 1994; 343: 1006–1008
78. Kidney J., Dominguez M., Taylor P.M., Rose M., Chung K.F., Barnes P.J.:
Immunomodulation by theophylline in asthma. Demonstration by withdrawal of
therapy. Am. J. Respir. Crit. Care Med., 1995; 151: 1907–1914
79. Barnes P.J.: Theophylline: new perspectives for an old drug. Am. J. Respir. Crit. Care
Med., 2003; 167: 813–818
80. Dahl R., Larsen B.B., Venge P.: Effect of long-term treatment with inhaled budesonide
or theophylline on lung function, airway reactivity and asthma symptoms. Respir.
Med., 2002; 96: 432–438
81. Rivington R.N., Boulet L.P., Cote J., Kreisman H., Small D.I., Alexander M., et al.:
Efficacy of Uniphyl, salbutamol, and their combination in asthmatic patients on high-
dose inhaled steroids. Am. J. Respir. Crit. Care Med., 1995; 151 (2 Pt 1): 325–332
82. Evans D.J., Taylor D.A., Zetterstrom O., Chung K.F., O’Connor B.J., Barnes P.J.: A com-
parison of low-dose inhaled budesonide plus theophylline and high-dose inhaled
budesonide for moderate asthma. N. Engl. J. Med., 1997; 337: 1412–1418
83. Ukena D., Harnest U., Sakalauskas R., Magyar P., Vetter N., Steffen H., et al.:
Comparison of addition of theophylline to inhaled steroid with doubling of the dose
of inhaled steroid in asthma. Eur. Respir. J., 1997; 10: 2754–2760
84. Baba K., Sakakibara A., Yagi T., Niwa S., Hattori T., Koishikawa I., et al.: Effects of
theophylline withdrawal in well-controlled asthmatics treated with inhaled cortico-
steroid. J. Asthma, 2001; 38: 615–624
85. Davies B., Brooks G., Devoy M.: The efficacy and safety of salmeterol compared
to theophylline: meta-analysis of nine controlled studies. Respir. Med., 1998; 92:
256–263
86. Wilson A.J., Gibson P.G., Coughlan J.: Long acting beta-agonists versus theophylline
for maintenance treatment of asthma. Cochrane Database Syst. Rev., 2000: 2
87. Ahn H.C., Lee Y.C.: The clearance of theophylline is increased during the initial period
of tuberculosis treatment. Int. J. Tuberc. Lung Dis., 2003; 7: 587–591
88. Szefler S.J., Nelson H.S.: Alternative agents for anti-inflammatory treatment of asth-
ma. J. Allergy Clin. Immunol., 1998; 102 (4 Pt 2): S23–S35
89. Humbert M., Beasley R., Ayres J., Slavin R., Hebert J., Bousquet J., et al.: Benefits of
omalizumab as add-on therapy in patients with severe persistent asthma who are
inadequately controlled despite best available therapy (GINA 2002 step 4 treatment):
INNOVATE. Allergy, 2005; 60: 309–316
90. Milgrom H., Fick R.B. Jr, Su J.Q., Reimann J.D., Bush R.K., Watrous M.L., et al.:
Treatment of allergic asthma with monoclonal anti-IgE antibody. rhuMAb-E25 Study
Group. N. Engl. J. Med., 1999; 341: 1966–1973
91. Busse W., Corren J., Lanier B.Q., McAlary M., Fowler-Taylor A., Cioppa G.D., et al.:
Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treat-
ment of severe allergic asthma. J. Allergy Clin. Immunol., 2001; 108: 184–190
92. Bousquet J., Wenzel S., Holgate S., Lumry W., Freeman P., Fox H.: Predicting response
to omalizumab, an anti-IgE antibody, in patients with allergic asthma. Chest, 2004;
125: 1378–1386
93. Holgate S.T., Chuchalin A.G., Hebert J., Lotvall J., Persson G.B., Chung K.F., et al.:
Efficacy and safety of a recombinant antiimmunoglobulin E antibody (omalizumab)
in severe allergic asthma. Clin. Exp. Allergy, 2004; 34: 632–638
94. Djukanovic R., Wilson S.J., Kraft M., Jarjour N.N., Steel M., Chung K.F., et al.: Effects
of treatment with anti-immunoglobulin E antibody omalizumab on airway inflamma-
tion in allergic asthma. Am. J. Respir. Crit. Care Med., 2004; 170: 583–593
95. Mash B., Bheekie A., Jones P.W.: Inhaled vs oral steroids for adults with chronic
asthma. Cochrane Database Syst. Rev., 2000: 2
96. Toogood J.H., Baskerville J., Jennings B., Lefcoe N.M., Johansson S.A.: Bioequivalent
doses of budesonide and prednisone in moderate and severe asthma. J. Allergy Clin.
Immunol., 1989; 84 (5 Pt 1): 688–700
97. Recommendations for the prevention and treatment of glucocorticoid-induced osteo-
porosis. American College of Rheumatology Task Force on Osteoporosis Guidelines.
Arthritis Rheum., 1996; 39: 1791–1801
98. Campbell I.A., Douglas J.G., Francis R.M., Prescott R.J., Reid D.M.: Five year study
of etidronate and/or calcium as prevention and treatment for osteoporosis and frac-
tures in patients with asthma receiving long term oral and/or inhaled glucocorticoids.
Thorax, 2004; 59: 761–768
99. Eastell R., Reid D.M., Compston J., Cooper C., Fogelman I., Francis R.M., et al.: A UK
Consensus Group on management of glucocorticoid-induced osteoporosis: an up-
date. J. Intern. Med., 1998; 244: 271–292
100. Guillevin L., Pagnoux C., Mouthon L.: Churg-strauss syndrome. Semin. Respir. Crit.
Care Med., 2004; 25: 535–545
101. Kurosawa M.: Anti-allergic drug use in Japan – the rationale and the clinical out-
come. Clin. Exp. Allergy, 1994; 24: 299–306
102. Aaron S.D., Dales R.E., Pham B.: Management of steroiddependent asthma with
methotrexate: a meta-analysis of randomized clinical trials. Respir. Med., 1998; 92:
1059–1065
103. Marin M.G.: Low-dose methotrexate spares steroid usage in steroid-dependent asth-
matic patients: a meta-analysis. Chest, 1997; 112: 29–33
104. Davies H., Olson L., Gibson P.: Methotrexate as a steroid sparing agent for asthma in
adults. Cochrane Database Syst. Rev., 2000: 2
105. Lock S.H., Kay A.B., Barnes N.C.: Double-blind, placebo-controlled study of cyclospo-
rin A as a corticosteroid-sparing agent in corticosteroid-dependent asthma. Am. J.
Respir. Crit. Care Med., 1996; 153: 509–514
106. Bernstein I.L., Bernstein D.I., Dubb J.W., Faiferman I., Wallin B.: A placebo-controlled
multicenter study of auranofin in the treatment of patients with corticosteroid-depen-
dent asthma. Auranofin Multicenter Drug Trial. J. Allergy Clin. Immunol., 1996; 98:
317–324
107. Nierop G., Gijzel W.P., Bel E.H., Zwinderman A.H., Dijkman J.H.: Auranofin in the
treatment of steroid dependent asthma: a double blind study. Thorax, 1992; 47:
349–354
108. Richeldi L., Ferrara G., Fabbri L., Lasserson T., Gibson P.: Macrolides for chronic asth-
ma. Cochrane Database Syst. Rev., 2005 (3): CD002997
109. Kishiyama J.L., Valacer D., Cunningham-Rundles C., Sperber K., Richmond G.W.,
Abramson S., et al.: A multicenter, randomized, double-blind, placebo-controlled trial
of high-dose intravenous immunoglobulin for oral corticosteroid-dependent asthma.
Clin. Immunol., 1999; 91: 126–133
110. Salmun L.M., Barlan I., Wolf H.M., Eibl M., Twarog F.J., Geha R.S., et al.: Effect of
intravenous immunoglobulin on steroid consumption in patients with severe asthma:
a double-blind, placebo-controlled, randomized trial. J. Allergy Clin. Immunol., 1999;
103 (5 Pt 1): 810–815
111. Jakobsson T., Croner S., Kjellman N.I., Pettersson A., Vassella C., Bjorksten B.: Slight
steroid-sparing effect of intravenous immunoglobulin in children and adolescents
with moderately severe bronchial asthma. Allergy, 1994; 49: 413–420
112. Abramson M.J., Puy R.M., Weiner J.M.: Allergen immunotherapy for asthma.
Cochrane Database Syst. Rev., 2003 (4): CD001186
113. Bousquet J., Lockey R., Malling H.J., Alvarez-Cuesta E., Canonica G.W., Chapman
M.D., et al.: Allergen immunotherapy: therapeutic vaccines for allergic diseases.
World Health Organization. American academy of Allergy, Asthma and Immunology.
Ann. Allergy Asthma Immunol., 1998; 81 (5 Pt 1): 401–405
114. Harrison B.D., Stokes T.C., Hart G.J., Vaughan D.A., Ali N.J., Robinson A.A.: Need for
intravenous hydrocortisone in addition to oral prednisolone in patients admitted to
hospital with severe asthma without ventilatory failure. Lancet, 1986; 1: 181–184
115. Rowe B.H., Edmonds M.L., Spooner C.H., Diner B., Camargo C.A., Jr: Corticosteroid
therapy for acute asthma. Respir. Med., 2004; 98: 275–284
116. O’Driscoll B.R., Kalra S., Wilson M., Pickering C.A., Carroll K.B., Woodcock A.A.:
Double-blind trial of steroid tapering in acute asthma. Lancet, 1993; 341: 324–327
117. Rodrigo G., Rodrigo C., Burschtin O.: A meta-analysis of the effects of ipratropium
bromide in adults with acute asthma. Am. J. Med., 1999; 107: 363–370
118. Tamaoki J., Chiyotani A., Tagaya E., Sakai N., Konno K.: Effect of long term treatment
with oxitropium bromide on airway secretion in chronic bronchitis and diffuse pan-
bronchiolitis. Thorax, 1994; 49: 545–548
119. Weinberger M., Hendeles L.: Theophylline in asthma. N. Engl. J. Med., 1996; 334:
1380–1388
120. Hondras M.A., Linde K., Jones A.P.: Manual therapy for asthma. Cochrane Database
Syst. Rev., 2005 (2): CD001002
121. Balon J.W., Mior S.A.: Chiropractic care in asthma and allergy. Ann. Allergy Asthma
Immunol., 2004; 93 (2 suppl. 1): S55–S60
122. Slater J.W., Zechnich A.D., Haxby D.G.: Second-generation antihistamines: a com-
parative review. Drugs, 1999; 57: 31–47
123. Bisgaard H.: Delivery of inhaled medication to children. J. Asthma, 1997; 34: 443–467
124. Pedersen S.: Inhalers and nebulizers: which to choose and why. Respir. Med., 1996;
90: 69–77
125. Dolovich M.B., Ahrens R.C., Hess D.R., Anderson P., Dhand R., Rau J.L., et al.: Device
selection and outcomes of aerosol therapy: Evidence-based guidelines: American
College of Chest Physicians/American College of Asthma, Allergy, and Immunology.
Chest, 2005; 127: 335–371
126. Zar H.J., Weinberg E.G., Binns H.J., Gallie F., Mann M.D.: Lung deposition of aerosol
– a comparison of different spacers. Arch. Dis. Child., 2000; 82: 495–498
127. Cates C.J., Crilly J.A., Rowe B.H.: Holding chambers (spacers) versus nebulisers for
beta-agonist treatment of acute asthma. Cochrane Database Syst. Rev., 2006 (2):
CD000052

WYTYCZNE
Rozdział 3. Leki przeciwastmatyczne
6
128. Shapiro G., Bronsky E.A., LaForce C.F., Mendelson L., Pearlman D., Schwartz R.H., et
al.: Dose-related efficacy of budesonide administered via a dry powder inhaler in the
treatment of children with moderate to severe persistent asthma. J. Pediatr., 1998;
132: 976–982
129. Agertoft L., Pedersen S.: A randomized, double-blind dose reduction study to com-
pare the minimal effective dose of budesonide Turbuhaler and fluticasone propionate
Diskhaler. J. Allergy Clin. Immunol., 1997; 99 (6 Pt 1): 773–780
130. Pedersen S., O’Byrne P.: A comparison of the efficacy and safety of inhaled corticoste-
roids in asthma. Allergy, 1997; 52: 1–34
131. Adams N.P., Bestall J.B., Malouf R., Lasserson T.J., Jones P.W.: Inhaled beclometha-
sone versus placebo for chronic asthma. Cochrane Database Syst. Rev., 2005 (1):
CD002738
132. Pauwels R.A., Pedersen S., Busse W.W., Tan W.C., Chen Y.Z., Ohlsson S.V., et al.: Early
intervention with budesonide in mild persistent asthma: a randomised, double-blind
trial. Lancet, 2003; 361: 1071–1076
133. Adams N.P., Bestall J.C., Jones P.W., Lasserson T.J., Griffiths B., Cates C.: Inhaled
fluticasone at different doses for chronic asthma in adults and children. Cochrane
Database Syst. Rev., 2005 (3): CD003534
134. Powell H., Gibson P.G.: High dose versus low dose inhaled corticosteroid as initial
starting dose for asthma in adults and children. Cochrane Database Syst. Rev., 2004
(2): CD004109
135. The Childhood Asthma Managment Program Research Group. Long term effects of
budesonide or nedocromil in children with asthma. N. Engl. J. Med., 2000; 343:
1054–1063
136. Nielsen K.G., Bisgaard H.: The effect of inhaled budesonide on symptoms, lung func-
tion, and cold air and methacholine responsiveness in 2- to 5-year-old asthmatic
children. Am. J. Respir. Crit. Care Med., 2000; 162 (4 Pt 1): 1500–1506
137. Roorda R.J., Mezei G., Bisgaard H., Maden C.: Response of preschool children with
asthma symptoms to fluticasone propionate. J. Allergy Clin. Immunol., 2001; 108:
540–546
138. Guilbert T.W., Morgan W.J., Zeiger R.S., Mauger D.T., Boehmer S.J., Szefler S.J., et
al.: Long-term inhaled corticosteroids in preschool children at high risk for asthma.
N. Engl. J. Med., 2006; 354: 1985–1997
139. Bisgaard H., Hermansen M.N., Loland L., Halkjaer L.B., Buchvald F.: Intermittent in-
haled corticosteroids in infants with episodic wheezing. N. Engl. J. Med., 2006; 354:
1998–2005
140. Pedersen S.: Do inhaled corticosteroids inhibit growth in children? Am. J. Respir. Crit.
Care Med., 2001; 164: 521–535
141. Agertoft L., Pedersen S.: Effect of long-term treatment with inhaled budesonide on
adult height in children with asthma. N. Engl. J. Med., 2000; 343: 1064–1069
142. Sharek P.J., Bergman D.A.: Beclomethasone for asthma in children: effects on linear
growth. Cochrane Database Syst. Rev., 2000: 2
143. Agertoft L., Pedersen S.: Bone mineral density in children with asthma receiving long-
term treatment with inhaled budesonide. Am. J. Respir. Crit. Care Med., 1998; 157:
178–183
144. Hopp R.J., Degan J.A., Biven R.E., Kinberg K., Gallagher G.C.: Longitudinal assess-
ment of bone mineral density in children with chronic asthma. Ann. Allergy Asthma
Immunol., 1995; 75: 143–148
145. Schlienger R.G., Jick S.S., Meier C.R.: Inhaled corticosteroids and the risk of fractures
in children and adolescents. Pediatrics, 2004; 114: 469–473
146. van Staa T.P., Bishop N., Leufkens H.G., Cooper C.: Are inhaled corticosteroids as-
sociated with an increased risk of fracture in children? Osteoporos. Int., 2004; 15:
785–791
147. van Staa T.P., Cooper C., Leufkens H.G., Bishop N.: Children and the risk of fractures
caused by oral corticosteroids. J. Bone Miner. Res., 2003; 18: 913–918
148. Kemp J.P., Osur S., Shrewsbury S.B., Herje N.E., Duke S.P., Harding S.M., et al.:
Potential effects of fluticasone propionate on bone mineral density in patients with
asthma: a 2-year randomized, double-blind, placebo-controlled trial. Mayo Clin.
Proc., 2004; 79: 458–466
149. Roux C., Kolta S., Desfougeres J.L., Minini P., Bidat E.: Long-term safety of flutica-
sone propionate and nedocromil sodium on bone in children with asthma. Pediatrics,
2003; 111 (6 Pt 1): e706–e713
150. Todd G., Dunlop K., McNaboe J., Ryan M.F., Carson D., Shields M.D.: Growth and
adrenal suppression in asthmatic children treated with high-dose fluticasone propio-
nate. Lancet, 1996; 348: 27–29
151. Selroos O., Backman R., Forsen K.O., Lofroos A.B., Niemisto M., Pietinalho A., et al.:
Local side-effects during 4-year treatment with inhaled corticosteroids – a compari-
son between pressurized metered-dose inhalers and Turbuhaler. Allergy, 1994; 49:
888–890
152. Randell T.L., Donaghue K.C., Ambler G.R., Cowell C.T., Fitzgerald D.A., van Asperen
P.P.: Safety of the newer inhaled corticosteroids in childhood asthma. Paediatr .Drugs,
2003; 5: 481–504
153. Shaw L., al-Dlaigan Y.H., Smith A.: Childhood asthma and dental erosion. ASDC J.
Dent. Child., 2000; 67: 102–106, 82
154. Kargul B., Tanboga I., Ergeneli S., Karakoc F., Dagli E.: Inhaler medicament effects
on saliva and plaque pH in asthmatic children. J. Clin. Pediatr. Dent., 1998; 22:
137–140
155. Szefler S.J., Phillips B.R., Martinez F.D., Chinchilli V.M., Lemanske R.F., Strunk R.C., et
al.: Characterization of within-subject responses to fluticasone and montelukast in
childhood asthma. J. Allergy Clin. Immunol., 2005; 115: 233–242
156. Ostrom N.K., Decotiis B.A., Lincourt W.R., Edwards L.D., Hanson K.M., Carranza
Rosenzweig J.R., et al.: Comparative efficacy and safety of low-dose fluticasone pro-
pionate and montelukast in children with persistent asthma. J. Pediatr., 2005; 147:
213–220
157. Garcia Garcia M.L., Wahn U., Gilles L., Swern A., Tozzi C.A., Polos P.: Montelukast,
compared with fluticasone, for control of asthma among 6- to 14-year-old patients
with mild asthma: the MOSAIC study. Pediatrics, 2005; 116: 360–369
158. Ng D., Salvio F., Hicks G.: Anti-leukotriene agents compared to inhaled corticoste-
roids in the management of recurrent and/or chronic asthma in adults and children.
Cochrane Database Syst. Rev., 2004 (2): CD002314
159. Kemp J.P., Dockhorn R.J., Shapiro G.G., Nguyen H.H., Reiss T.F., Seidenberg B.C., et
al.: Montelukast once daily inhibits exerciseinduced bronchoconstriction in 6- to 14-
year-old children with asthma. J. Pediatr., 1998; 133: 424–428
160. Vidal C., Fernandez-Ovide E., Pineiro J., Nunez R., Gonzalez-Quintela A.: Comparison
of montelukast versus budesonide in the treatment of exercise-induced bronchocon-
striction. Ann. Allergy Asthma Immunol., 2001; 86: 655–658
161. Phipatanakul W., Cronin B., Wood R.A., Eggleston P.A., Shih M.C., Song L., et al.:
Effect of environmental intervention on mouse allergen levels in homes of inner-city
Boston children with asthma. Ann. Allergy Asthma Immunol., 2004; 92: 420–425
162. Simons F.E., Villa J.R., Lee B.W., Teper A.M., Lyttle B., Aristizabal G., et al.: Montelukast
added to budesonide in children with persistent asthma: a randomized, double-
blind, crossover study. J. Pediatr., 2001; 138: 694–698
163. Knorr B., Franchi L.M., Bisgaard H., Vermeulen J.H., LeSouef P., Santanello N., et
al.: Montelukast, a leukotriene receptor antagonist, for the treatment of persistent
asthma in children aged 2 to 5 years. Pediatrics, 2001; 108: E48
164. Bisgaard H., Zielen S., Garcia-Garcia M.L., Johnston S.L., Gilles L., Menten J., et al.:
Montelukast reduces asthma exacerbations in 2- to 5-year-old children with intermit-
tent asthma. Am. J. Respir. Crit. Care Med., 2005; 171: 315–322
165. Russell G., Williams D.A., Weller P., Price J.F.: Salmeterol xinafoate in children on high
dose inhaled steroids. Ann. Allergy Asthma Immunol., 1995; 75: 423–428
166. Malone R., LaForce C., Nimmagadda S., Schoaf L., House K., Ellsworth A., et al.: The
safety of twice-daily treatment with fluticasone propionate and salmeterol in pediatric
patients with persistent asthma. Ann. Allergy Asthma Immunol., 2005; 95: 66–71
167. Zimmerman B., D’Urzo A., Berube D.: Efficacy and safety of formoterol Turbuhaler
when added to inhaled corticosteroid treatment in children with asthma. Pediatr.
Pulmonol., 2004; 37: 122–127
168. Meijer G.G., Postma D.S., Mulder P.G., van Aalderen W.M.: Longterm circadian effects
of salmeterol in asthmatic children treated with inhaled corticosteroids. Am. J. Respir.
Crit. Care Med., 1995; 152 (6 Pt 1): 1887–1892
169. Bisgaard H.: Long-acting beta (2)-agonists in management of childhood asthma:
A critical review of the literature. Pediatr. Pulmonol., 2000; 29: 221–234
170. Bisgaard H.: Effect of long-acting beta2 agonists on exacerbation rates of asthma in
children. Pediatr. Pulmonol., 2003; 36: 391–398
171. Simons F.E., Gerstner T.V., Cheang M.S.: Tolerance to the bronchoprotective effect of
salmeterol in adolescents with exercise-induced asthma using concurrent inhaled
glucocorticoid treatment. Pediatrics, 1997; 99: 655–659
172. Katz R.M., Rachelefsky G.S., Siegel S.: The effectiveness of the short- and long-term
use of crystallized theophylline in asthmatic children. J. Pediatr., 1978; 92: 663–667
173. Bierman C.W., Pierson W.E., Shapiro G.G., Furukawa C.T.: Is a uniform round-the-
clock theophylline blood level necessary for optimal asthma therapy in the adoles-
cent patient? Am. J. Med., 1988; 85 (1B): 17–20
174. Pedersen S.: Treatment of nocturnal asthma in children with a single dose of sus-
tained-release theophylline taken after supper. Clin. Allergy, 1985; 15: 79–85
175. Magnussen H., Reuss G., Jorres R.: Methylxanthines inhibit exercise-induced bron-
choconstriction at low serum theophylline concentration and in a dose-dependent
fashion. J. Allergy Clin. Immunol., 1988; 81: 531–537
176. Nassif E.G., Weinberger M., Thompson R., Huntley W.: The value of maintenance
theophylline in steroid-dependent asthma. N. Engl. J. Med., 1981; 304: 71–75
177. Brenner M., Berkowitz R., Marshall N., Strunk R.C.: Need for theophylline in severe
steroid-requiring asthmatics. Clin. Allergy, 1988; 18: 143–150
178. Ellis E.F.: Theophylline toxicity. J. Allergy Clin. Immunol., 1985; 76 (2 Pt 2): 297–301
179. Tasche M.J., Uijen J.H., Bernsen R.M., de Jongste J.C., van Der Wouden J.C.: Inhaled
disodium cromoglycate (DSCG) as maintenance therapy in children with asthma:
a systematic review. Thorax, 2000; 55: 913–920
180. Guevara J.P., Ducharme F.M., Keren R., Nihtianova S., Zorc J.: Inhaled corticosteroids
versus sodium cromoglycate in children and adults with asthma. Cochrane Database
Syst. Rev., 2006 (2): CD003558
181. Spooner C.H., Saunders L.D., Rowe B.H.: Nedocromil sodium for preventing exercise-
induced bronchoconstriction. Cochrane Database Syst. Rev., 2000: 2
182. Armenio L., Baldini G., Bardare M., Boner A., Burgio R., Cavagni G., et al.: Double
blind, placebo controlled study of nedocromil sodium in asthma. Arch. Dis. Child.,
1993; 68: 193–197
183. Kuusela A.L., Marenk M., Sandahl G., Sanderud J., Nikolajev K., Persson B.:
Comparative study using oral solutions of bambuterol once daily or terbutaline

WYTYCZNE
62
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
three times daily in 2-5-year-old children with asthma. Bambuterol Multicentre Study
Group. Pediatr. Pulmonol., 2000; 29: 194–201
184. Zarkovic J.P., Marenk M., Valovirta E., Kuusela A.L., Sandahl G., Persson B., et al.:
One-year safety study with bambuterol once daily and terbutaline three times daily
in 2-12-year-old children with asthma. The Bambuterol Multicentre Study Group.
Pediatr. Pulmonol., 2000; 29: 424–429
185. Lonnerholm G., Foucard T., Lindstrom B.: Oral terbutaline in chronic childhood asth-
ma; effects related to plasma concentrations. Eur. J. Respir. Dis., 1984; 134 (suppl.):
205S–210S
186. Williams S.J., Winner S.J., Clark T.J.: Comparison of inhaled and intravenous terbuta-
line in acute severe asthma. Thorax, 1981; 36: 629–632
187. Dinh Xuan A.T., Lebeau C., Roche R., Ferriere A., Chaussain M.: Inhaled terbutaline
administered via a spacer fully prevents exercise-induced asthma in young asthmatic
subjects: a double-blind, randomized, placebo-controlled study. J. Int. Med. Res.,
1989; 17: 506–513
188. Fuglsang G., Hertz B., Holm E.B.: No protection by oral terbutaline against exer-
cise-induced asthma in children: a dose-response study. Eur. Respir. J., 1993; 6:
527–530
189. Bengtsson B., Fagerstrom P.O.: Extrapulmonary effects of terbutaline during pro-
longed administration. Clin. Pharmacol. Ther., 1982; 31: 726–732
190. McDonald N.J., Bara A.I.: Anticholinergic therapy for chronic asthma in children over
two years of age. Cochrane Database Syst. Rev., 2003 (3): CD003535

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
6
Rozdział 4. Leczenie i prewencja
astmy
Wprowadzenie
Astma wywiera znaczący wpływ na chorych, ich
rodziny i całe społeczeństwo. Astmy nie można
wyleczyć, ale prawidłowe leczenie, obejmujące
partnerską relację między lekarzem a chorym
i jego rodziną, zazwyczaj pozwala osiągnąć kon-
trolę choroby.
Cele skutecznego leczenia astmy to:
1) osiągnięcie i utrzymanie kontroli objawów
2) utrzymanie normalnej aktywności życiowej,
w tym zdolności podejmowania wysiłków fi-
zycznych
3) utrzymanie wydolności układu oddechowego
na poziomie jak najbardziej zbliżonym do pra-
widłowego
4) zapobieganie zaostrzeniom astmy
5) unikanie skutków niepożądanych stosowanych
leków przeciwastmatycznych
6) niedopuszczenie do zgonu z powodu astmy.
Wymienione cele leczenia odzwierciedlają kon-
cepcję astmy jako przewlekłej choroby zapalnej
dróg oddechowych, charakteryzującej się nawra-
cającymi epizodami świszczącego oddechu, dusz-
ności, uczucia ściskania w klatce piersiowej i kasz-
lu. Badania kliniczne wykazały, że astmę można
skutecznie kontrolować, hamując zapalenie, jak
również znosząc skurcz oskrzeli i jego objawy
podmiotowe. Ponadto wczesne wyeliminowanie
narażenia na czynniki uczulające drogi oddecho-
we może poprawić kontrolę astmy i zmniejszyć
zapotrzebowanie na leki. Obserwacje poczynione
w astmie zawodowej wskazują, że długotrwałe
narażenie na czynniki uczulające może prowa-
dzić do nieodwracalnego ograniczenia przepływu
powietrza w drogach oddechowych.
Astmę można leczyć różnymi metodami, zależ-
nie od ich dostępności, preferencji kulturowych
i organizacji systemu opieki zdrowotnej. Zalece-
nia przedstawione w tym rozdziale odzwiercied-
lają aktualną wiedzę na temat astmy. O ile to było
możliwe, oparto je na wynikach badań klinicz-
nych z grupą kontrolną; wiele z tych badań jest
cytowanych w tekście. W przypadku zagadnień,
które nie były przedmiotem badań klinicznych,
zalecenia są oparte na przeglądzie piśmiennictwa,
doświadczeniu klinicznym oraz opinii ekspertów
uczestniczących w tym projekcie.
Zalecenia dotyczące leczenia astmy są przed-
stawione w 5 wzajemnie powiązanych składo-
wych:
1) wypracowanie partnerskiej relacji między pa-
cjentem i lekarzem
2) identyfikacja czynników ryzyka i zmniejszenie
ekspozycji na te czynniki
3) ocena kontroli astmy, leczenie w celu jej osiąg-
nięcia i monitorowanie
4) leczenie zaostrzeń astmy
5) sytuacje szczególne.
Składowa 1: wypracowanie partnerskiej
relacji między pacjentem a lekarzem
Główne punkty
n
Skuteczne leczenie astmy wymaga wypracowania
partnerskiej relacji między osobą z astmą a opie-
kującymi się nią pracownikami opieki zdrowotnej
(oraz z rodzicami lub opiekunami w przypadku
dzieci chorych na astmę).
n
Celem tego partnerstwa jest wytyczone samo-
dzielne postępowanie; oznacza to, że osoba
z astmą nabywa umiejętności kontroli swojej
choroby pod kierunkiem pracowników opieki
zdrowotnej.
n
Partnerska relacja powstaje i umacnia się wtedy,
gdy pacjenci i ich lekarze omawiają i uzgadnia-
ją cele leczenia, opracowują w formie pisemnej
indywidualny plan samodzielnego postępowania
obejmujący samodzielne monitorowanie astmy
i okresowo analizują leczenie i poziom kontroli
astmy.
n
Edukacja powinna być integralną składową każ-
dej interakcji między pracownikami opieki zdro-
wotnej i pacjentami, i dotyczy chorych na astmę
w każdym wieku.
n
Osobisty plan działania w astmie pomaga cho-
remu wprowadzać zmiany do leczenia w odpo-
wiedzi na zmiany poziomu kontroli astmy, na
które wskazują objawy podmiotowe lub wartości
szczytowego przepływu wydechowego, zgodnie
z wcześniej napisanymi wskazówkami.

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Wprowadzenie
Skuteczne leczenie astmy wymaga wypracowania
partnerskiej relacji między osobą z astmą a opie-
kującymi się nią pracownikami opieki zdrowotnej
(oraz z rodzicami lub opiekunami w przypadku
dzieci chorych na astmę). Celem tego partnerstwa
jest umożliwienie chorym na astmę uzyskania
wiedzy, pewności siebie i umiejętności potrzeb-
nych do odegrania ważnej roli w leczeniu choroby.
Partnerska relacja powstaje i umacnia się wtedy,
gdy pacjenci i ich lekarze omawiają i uzgadniają
cele leczenia, opracowują w formie pisemnej indy-
widualny plan samodzielnego postępowania obej-
mujący samodzielne monitorowanie astmy i okre-
sowo analizują leczenie i poziom kontroli astmy
(
ryc. 4.1-1).
Takie podejście nazywa się wytyczonym samo-
dzielnym postępowaniem (guided self-manage-
ment); wykazano, że zmniejsza ono chorobowość
związaną z astmą, zarówno u dorosłych (
jakość
danych A), jak i u dzieci (jakość danych A).
Opracowano liczne schematy takiego postępowa-
nia
110
w różnych warunkach opieki zdrowotnej,
w tym w opiece podstawowej
1,4,6
, w leczeniu szpi-
talnym
2,3,7,10
i na oddziałach pomocy doraźnej
8
oraz dla różnych grup chorych, takich jak kobie-
ty w ciąży
11
, dzieci i młodzież
12,13
i dla populacji
wielorasowych
14
. Niezależność chorego w ramach
wytyczonego samodzielnego postępowania może
być różna – od dokonywania zmian w leczeniu
bez konsultowania się z lekarzem, ale zgodnie
z wcześniej spisanym planem działania, po postę-
powanie zgodne ze spisanym planem działania,
w którym większość istotnych zmian w leczeniu
chory konsultuje ze swoim lekarzem w czasie
zaplanowanych lub nieplanowanych wizyt. Roli
edukacji i strategii samodzielnego postępowania
w leczeniu astmy poświęcono kilka przeglądów
systematycznych przeprowadzonych przez Co-
chrane Collaboration.
13,1518
Edukacja w astmie
Edukacja powinna być integralną częścią wszyst-
kich interakcji między pracownikami opieki zdro-
wotnej a pacjentami, i odnosi się do chorych na
astmę w każdym wieku. W przypadku małych
dzieci będzie dotyczyć ich rodziców i opiekunków,
ale już dzieci w wieku 3 lat można nauczyć pro-
stych umiejętności związanych z leczeniem astmy.
U młodzieży mogą się pojawić szczególne trudno-
ści w przestrzeganiu zaleceń, ale można im pomóc
poprzez edukację grupową, oprócz edukacji przez
pracownika opieki zdrowotnej.
12
Na
rycinie 4.1-2 podano główne cechy i skła-
dowe programu edukacji w astmie. Zakres infor-
macji i nauczania określonych umiejętności może
być różny dla poszczególnych osób, różnić się
też mogą zdolności i chęć chorych do wzięcia na
siebie części odpowiedzialności za leczenie. Tak
więc wszyscy chorzy wymagają pewnych podsta-
wowych informacji i nabycia określonych umie-
jętności, ale w większej części edukacja musi być
zindywidualizowana i prowadzona kilkustopnio-
wo. Konieczne bywa też wsparcie społeczne i psy-
chologiczne w celu podtrzymania pozytywnych
zmian zachowania.
Dobra komunikacja jest niezbędna jako
podstawa późniejszego przestrzegania zaleceń
przez pacjenta
19-22
(
jakość danych B). Kluczo-
we czynniki ułatwiające dobrą komunikację to
23
:
1) sympatyczna postawa (życzliwość, humor
i grzeczność)
2) interaktywny dialog
3) zachęcanie i chwalenie
4) empatia i szybkie rozwiewanie jakichkolwiek
obaw
5) podawanie właściwych (spersonalizowanych)
informacji
Ryc. 4.1-1. Cechy partnerskiej relacji między
lekarzem a pacjentem, niezbędne
do samodzielnego postępowania
chorego
edukacja
wspólne wyznaczenie celów
samodzielne monitorowanie (chorego na astmę należy
nauczyć łączenia oceny kontroli astmy z umiejętną
interpretacją głównych objawów podmiotowych)
regularna ocena kontroli astmy, leczenia i umiejętności
chorego przez pracownika opieki zdrowotnej
plan działania na piśmie (chorego na astmę należy nauczyć,
które leki ma przyjmować regularnie, które w razie
potrzeby i jak ma modyfikować leczenie w odpowiedzi
na pogorszenie kontroli astmy)
samodzielne monitorowanie jest zintegrowane
z pisemnymi wytycznymi dotyczącymi zarówno
długoterminowego leczenia astmy, jak i leczenia
zaostrzeń.

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
6
6) ustalanie wspólnych celów
7) zwrotna informacja i jej analizowanie.
Uczenie pracowników opieki zdrowotnej
mające na celu poprawę ich umiejętności
komunikacji może w wymierny sposób popra-
wiać efekty leczenia, w tym zwiększyć satysfakcję
pacjenta, poprawić jego stan zdrowia i zmniejszyć
zużycie środków opieki zdrowotnej, a te korzyści
można osiągnąć bez wydłużenia czasu kontaktu
z pacjentem.
24
Badania wykazały również, że
pa-
cjentów można nauczyć lepszego korzysta-
nia z konsultacji medycznych. Pacjenci na-
uczeni, w jaki sposób jaśniej podawać informacje
lekarzom, technik poszukiwania informacji oraz
metod sprawdzania rozumienia tego, co słyszą od
lekarza – bardziej przestrzegają zaleceń i uzysku-
ją znacząco lepsze efekty zdrowotne.
25
Pierwsza wizyta lekarska
Na początku osoba z astmą potrzebuje informacji
o chorobie oraz prostych danych na temat dostęp-
nych sposobów leczenia, uzasadnienia poszcze-
gólnych interwencji terapeutycznych zalecanych
przez lekarza oraz strategii unikania czynników
wywołujących objawy astmy. Można pokazać
pacjentowi różnego typu inhalatory i pomóc mu
wybrać najbardziej odpowiedni inhalator. Nie-
które inhalatory i techniki ich używania są zilu-
strowane na stronie internetowej GINA (www.
ginasthma.org). Kryteria wstępnego wyboru in-
halatora obejmują dostępność i koszt, umiejęt
ności pacjenta oraz preferencje lekarza i pacjen-
ta.
2628
Pacjenci powinni mieć możliwość wyraże-
nia swoich oczekiwań odnośnie do swojej choroby
i jej leczenia. Powinno się szczerze wyjaśnić, w ja-
kim stopniu oczekiwania te mogą zostać spełnio-
ne, oraz uzgodnić określone cele leczenia.
Podczas pierwszej wizyty u lekarza informacje
ustne powinny zostać uzupełnione materiałami
drukowanymi
29,30
dotyczącymi astmy i jej leczenia.
Na stronie internetowej GINA (www.ginasthma.
org) znajdują się materiały edukacyjne dla pacjen-
tów, jak również linki do różnych stron interneto-
wych poświęconych astmie. Powinno się zachęcać
pacjenta i jego rodzinę do notowania wszelkich
pytań, które się nasuną po przeczytaniu tych ma-
teriałów lub w wyniku rozmowy z lekarzem, i od-
powiedzieć na nie podczas kolejnej wizyty.
Osobisty plan działania w astmie
Osobisty plan działania w astmie pomaga chorym
wprowadzać zmiany w leczeniu w odpowiedzi na
zmiany poziomu kontroli astmy, na które wskazu-
ją objawy podmiotowe lub wartości szczytowego
przepływu wydechowego, zgodnie z wcześniej na-
pisanymi wskazówkami.
23,31,32
Efekty są najlepsze, gdy interwencja obejmuje
wszystkie następujące składowe: edukację, samo-
dzielne monitorowanie, regularną analizę oraz
wytyczone samodzielne postępowanie z wyko-
rzystaniem napisanego planu działania (
jakość
danych A). Dzięki niej uzyskuje się zmniejszenie
o
1
/
3
–
2
/
3
częstości hospitalizacji, wizyt na oddziale
pomocy doraźnej, niezaplanowanych wizyt u le-
karza z powodu astmy, liczby utraconych dni pra-
cy, jak i częstości przebudzeń w nocy z powodu
Ryc. 4.1-2. Edukacja i partnerska relacja
między pacjentem a lekarzem
Cel: Dostarczyć choremu na astmę, jego rodzinie i innym
opiekunom odpowiednich informacji i szkolenia, aby
mogli się dobrze czuć i modyfikować leczenie zgodnie
z planem opracowanym wspólnie z lekarzem.
Główne składowe:
skupienie się na rozwoju partnerskiej relacji
akceptacja faktu, że jest to proces ciągły
dzielenie się informacjami
pełne przedyskutowanie oczekiwań
wyrażenie lęku i obaw
Dostarczyć określonych informacji, szkolenia i porad
dotyczących:
rozpoznania
różnicy między lekami „doraźnymi” a lekami
„kontrolującymi”
używania inhalatorów
zapobiegania objawom podmiotowym i napadom astmy
objawów sugerujących pogorszenie astmy i działań,
które należy podjąć
monitorowania kontroli astmy
jak i kiedy szukać pomocy medycznej
Pacjent następnie potrzebuje:
planu samodzielnego postępowania, wytyczonego przez
lekarza
regularnej kontroli, modyfikacji planu, nagradzania
i wsparcia

WYTYCZNE
66
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
astmy. Oszacowano, że wdrożenie programu sa-
modzielnego postępowania u 20 pacjentów zapo-
biega 1 hospitalizacji, a skuteczne zrealizowanie
takiego programu przez 8 pacjentów zapobiega
1 wizycie na oddziale pomocy doraźnej.
1618,23
Mniej intensywne interwencje, które obejmują
edukację w zakresie samodzielnego postępowa-
nia, bez napisanego planu działania, są mniej
skuteczne.
15
Efekty są podobne, niezależnie od
tego czy pacjenci sami dostosowują leczenie zgod-
nie z osobistym planem, czy też konsultują zmia-
ny leczenia z lekarzem
15
(
jakość danych B). Tak
więc pacjenci, którzy nie są w stanie podjąć się
wytyczonego samodzielnego postępowania, mogą
odnieść korzyści z udziału w programie regular-
nych konsultacji medycznych.
Przykłady zalecanych planów samodzielnego
postępowania można znaleźć na różnych stro-
nach internetowych (UK National Asthma Cam-
paign Plan, http://www.asthma.org.uk; Interna-
tional Asthma Management Plan „Zone System”,
http://www.nhlbisupport.com/asthma/index.html;
New Zealand „Credit Card” System, http://www.
asthmanz.co.nz).
Przykład zawartości planu działania w astmie
dla pacjentów w celu utrzymania kontroli astmy
podano na
rycinie 4.1-3.
Wizyty kontrolne i ocena
Wizyty kontrolne powinny się odbywać w regu-
larnych odstępach czasu. Podczas tych wizyt od-
powiada się na pytania zadawane przez pacjenta
i analizuje wszelkie problemy z astmą i jej wstęp-
nym leczeniem. Regularnie powinno się oceniać
technikę używania inhalatora i korygować ją, je-
śli jest niewłaściwa.
33
Podczas wizyt kontrolnych
powinno się również sprawdzić, czy pacjent prze-
strzega zaleceń dotyczących przyjmowania leku
i zmniejszenia ekspozycji na czynniki ryzyka.
Regularnie analizuje się również notatki w dzien-
niczku objawów (i gdy jest to właściwe – zanoto-
wane wyniki domowych pomiarów PEF). Po okre-
sie początkowego uczenia się częstość domowych
pomiarów PEF i odnotowywanie objawów zależy
w części od poziomu kontroli astmy. Analizuje
się też spisany plan samodzielnego postępowania
i jego zrozumienie przez pacjenta. Powinno się
przeanalizować informacje edukacyjne i powtó-
rzyć je lub uzupełnić w razie potrzeby.
Ryc. 4.1-3. Przykładowy plan działania
w celu utrzymania kontroli astmy
Twoje stałe leczenie:
1. Codziennie przyjmuj ________
2. Przed wysiłkiem fizycznym przyjmuj ________
Kiedy zwiększyć intensywność leczenia?
Oceń stopień kontroli astmy.
W ciągu ostatniego tygodnia wystąpiły u Ciebie:
objawy dzienne astmy więcej niż 2 razy NIE TAK
ograniczenie aktywności życiowej lub wysiłku
fizycznego z powodu astmy NIE TAK
przebudzenia w nocy z powodu astmy NIE TAK
potrzeba leczenia doraźnego (ratunkowego)
więcej niż 2 razy NIE TAK
jeśli monitorujesz PEF, to był on mniejszy niż____ NIE TAK
Jeśli odpowiedziałeś TAK na 3 lub więcej z tych pytań,
to znaczy, że astma nie jest kontrolowana i możesz
wymagać intensyfikacji leczenia.
Jak zwiększyć intensywność leczenia?
Zwiększ intensywność leczenia w następujący sposób
i codziennie oceniaj poprawę:
__________________________ [Wpisz tutaj leczenie wg
następnego stopnia intensywności]
Utrzymaj to leczenie przez ___________ dni [wpisz liczbę]
Kiedy zadzwonić do lekarza lub przychodni?
Zadzwoń do swojego lekarza lub przychodni: ___________
[podaj telefon]
Jeśli nie ma poprawy po leczeniu w ciągu __________ dni
[wpisz liczbę]
____________________________________________
[miejsce na dodatkowe instrukcje]
Stan nagły lub ciężka utrata kontroli:
jeśli masz ciężką duszność i możesz mówić tylko krótkimi
zdaniami,
jeśli masz ciężki napad astmy i jesteś przerażony,
jeśli potrzebujesz leku doraźnego częściej niż co 4 godziny
i nie ma poprawy.
1. Zastosuj 2–4 wdechy _______________ [lek doraźny]
2. Przyjmij _____ mg _______ [glikokortykosteroid doustny]
3. Szukaj pomocy lekarskiej: idź do ____________;
adres:________________; telefon:_____________
4. Kontynuuj przyjmowanie ___________[lek doraźny]
dopóki nie uzyskasz pomocy medycznej

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
6
Poprawa przestrzegania zaleceń
Badania u dorosłych i dzieci
34
wykazały, że około
50% chorych leczonych przewlekle nie przyjmuje
leków zgodnie z zaleceniami, a przynajmniej nie
zawsze.
Nieprzestrzeganie zaleceń można
określić, unikając pejoratywnego wydźwięku,
jako nieprzyjmowanie przez pacjenta leków w spo-
sób uzgodniony z lekarzem.
Nieprzestrzeganie
zaleceń można wykryć, monitorując realizację
recept, licząc tabletki lub oznaczając leki w ustro-
ju, ale w praktyce klinicznej najlepiej to zrobić,
pytając o leczenie w taki sposób, który uznaje
prawdopodobieństwo niepełnego przestrzegania
zaleceń (np. „ponieważ możemy zaplanować le-
czenie, czy mógłby mi Pan powiedzieć, jak często
rzeczywiście przyjmował lek”). Określone czynni-
ki związane ze stosowanymi lekami i inne odpo-
wiedzialne za nieprzestrzeganie zaleceń wymie-
niono na
rycinie 4.1-4.
Samodzielne postępowanie dzieci
Dzieci z astmą również powinny wiedzieć, jak so-
bie radzić ze swoją chorobą; mogą w tym pomóc ich
rodzice lub inni opiekunowie. Prosta interwencja
edukacyjna (zaplanowana w celu nauczenia sa-
modzielnego postępowania) u dzieci przyjętych
do szpitala z powodu astmy znacząco zmniejszyła
częstość ponownych hospitalizacji i występowania
powikłań.
13
Przegląd systematyczny wykazał, że
programy edukacyjne dotyczące samodzielnego
postępowania w astmie u dzieci i młodzieży pro-
wadziły do poprawy czynności płuc i poczucia sa-
mokontroli oraz zmniejszały absencję w szkole,
liczbę dni z ograniczoną aktywnością i liczbę wi-
zyt na oddziale pomocy doraźnej.
13
Edukacja innych osób
Edukacja całego społeczeństwa na temat astmy
pomaga rozpoznawać objawy astmy i ich następ-
stwa oraz zachęca chorych na astmę do szukania
pomocy medycznej i postępowania zgodnie z ich
programem leczenia. Większa świadomość astmy
prawdopodobnie pomaga również rozwiać błędne
poglądy na temat tej choroby i zmniejszyć uczucie
napiętnowania u chorych.
Szczególne wskazówki dotyczące astmy i lecze-
nia powinny zostać udzielone nauczycielom szkol-
nym i instruktorom wychowania fizycznego; sze-
reg organizacji wydaje materiały służące temu ce-
lowi. Szkoły mogą potrzebować porady w zakresie
poprawy środowiska i jakości powietrza dla dzieci
z astmą.
35
Dostęp do jasnych wskazówek dotyczą-
cych astmy przydaje się również pracodawcom.
Większość zawodów nadaje się równie dobrze dla
chorych na astmę, jak i dla osób bez astmy, ale
mogą zaistnieć pewne okoliczności, w których po-
trzebna jest ostrożność.
Ryc. 4.1-4. Czynniki odpowiedzialne
za nieprzestrzeganie zaleceń
przez pacjentów
czynniki związane z lekami
trudności z używaniem inhalatorów
uciążliwe schematy stosowania leków (np. 4 razy dziennie
lub wiele leków)
skutki uboczne
koszt leków
niechęć do leku
duża odległość do najbliższej apteki
inne czynniki
niezrozumienie lub brak zaleceń lekarza
obawa przed działaniami niepożądanymi
rozczarowanie kontaktami z pracownikami opieki
zdrowotnej
obawy przemilczane lub nieprzedyskutowane z lekarzem
nierealne oczekiwania
nieodpowiedni nadzór, szkolenie lub monitorowanie
złość w związku z chorobą lub koniecznością leczenia
niedocenianie ciężkości choroby
czynniki kulturowe
obawa przed stygmatyzacją
roztargnienie lub beztroska
stosunek do złego stanu zdrowia
przyczyny religijne

WYTYCZNE
68
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Składowa 2: identyfikacja i zmniejszenie
narażenia na czynniki ryzyka
Wprowadzenie
Interwencje farmakologiczne są bardzo skuteczne
w kontrolowaniu objawów podmiotowych i popra-
wie jakości życia u chorych na astmę, niemniej jed-
nak zawsze – jeśli tylko jest to możliwe – powinno
się wdrażać metody zapobiegania rozwojowi ast-
my oraz występowaniu objawów podmiotowych
i zaostrzeń choroby poprzez unikanie narażenia
na czynniki ryzyka lub zmniejszenie tego naraże-
nia – w szczególności dotyczy to narażenia na dym
tytoniowy.
36
Obecnie można zalecić niewiele inter-
wencji w celu zapobiegania astmie, ponieważ roz-
wój tej choroby jest złożony i nie w pełni poznany.
Zagadnienie to jest przedmiotem intensywnych
badań, ale dopóki takie metody nie zostaną opra-
cowane, wysiłki prewencyjne muszą się koncen-
trować głównie na zapobieganiu objawom astmy.
Prewencja astmy
Metody zapobiegania astmie mogą być ukierun-
kowane na zapobieganie uczuleniu na alergeny
(tj. rozwojowi atopii, co prawdopodobnie jest naj-
bardziej wskazane w okresie prenatalnym i przez
krótki czas po urodzeniu) lub zapobieganiu roz-
wojowi astmy u osób uczulonych. Poza zapobie-
ganiem ekspozycji na dym tytoniowy, zarówno in
utero, jak i po urodzeniu, nie ma szeroko akcepto-
wanych interwencji o udowodnionej skuteczności,
które zapobiegałyby rozwojowi astmy.
Uczulenie na alergeny może wystąpić w okre-
sie prenatalnym.
37,38
Aktualnie dostępne dane na
temat krytycznych dawek i czasu ekspozycji na
alergen są niewystarczające, by można było inge-
rować w ten proces i nie można zalecić żadnych
metod zapobiegania alergizacji w okresie prena-
talnym. Jest mało prawdopodobne, aby zalecenie
unikania diet alergizujących kobietom w ciąży
zmniejszyło znacząco ryzyko urodzenia dziecka
z atopią.
39
Ponadto taka dieta może mieć nie-
korzystny wpływ na stan odżywienia matki lub
dziecka.
Rola diety, szczególnie karmienia piersią,
w odniesieniu do rozwoju astmy była intensywnie
badana; ogólnie rzecz biorąc karmienie niemow-
ląt mieszankami z nieprzetworzonego mleka kro-
wiego lub białek sojowych, w porównaniu z kar-
mieniem mlekiem matki, wiązało się z większą
zapadalnością na choroby przebiegające ze świsz-
czącym oddechem we wczesnym dzieciństwie.
40
Karmienie wyłącznie piersią przez pierwsze mie-
siące po urodzeniu wiąże się z rzadszym występo-
waniem astmy w dzieciństwie.
41
Na podstawie „hipotezy higienicznej” astmy,
chociaż jest ona kontrowersyjna, sugeruje się,
że strategie zapobiegania uczuleniu na alergeny
powinny się koncentrować na przekierowaniu
odpowiedzi immunologicznej u niemowląt na nie-
alergiczną (Th1) lub na modulowaniu regulato-
rowych komórek T,
42
ale takie metody pozostają
w obszarze hipotez i wymagają dalszych badań.
Rola probiotyków w zapobieganiu alergii i astmie
również nie jest wyjaśniona.
43
W niektórych ba-
daniach ekspozycja na alergeny kota wiązała się
ze zmniejszeniem ryzyka rozwoju atopii.
44
Narażenie na dym tytoniowy, zarówno w okre-
sie prenatalnym, jak i po urodzeniu, ma wymier-
ne skutki szkodliwe, w tym upośledzenie rozwo-
Główne punkty
n
Interwencje farmakologiczne są bardzo skutecz-
ne w kontrolowaniu objawów podmiotowych
i poprawie jakości życia u chorych na astmę, nie-
mniej jednak zawsze – jeśli tylko jest to możliwe
– powinno się wdrażać metody zapobiegania
rozwojowi astmy oraz występowaniu objawów
podmiotowych i zaostrzeń choroby poprzez uni-
kanie narażenia na czynniki ryzyka lub zmniejsze-
nie tego narażenia – w szczególności dotyczy to
narażenia na dym tytoniowy.
n
Obecnie można zalecić niewiele interwencji
w celu zapobiegania astmie, ponieważ rozwój tej
choroby jest złożony i nie w pełni poznany.
n
Zaostrzenia astmy mogą być wywoływane przez
różne czynniki, niekiedy nazywane czynnikami
wyzwalającymi, do których należą alergeny, za-
każenia wirusowe, zanieczyszczenia powietrza
i leki.
n
Zmniejszenie narażenia chorego na niektóre czyn-
niki ryzyka poprawia kontrolę astmy i zmniejsza
zapotrzebowanie na leki.
n
Wczesne wykrycie zawodowych czynników uczu-
lających i przerwanie dalszego narażenia osoby
uczulonej stanowią ważne aspekty postępowa-
nia w astmie zawodowej.

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
69
ju płuc
45
i zwiększone ryzyko rozwoju choroby
przebiegającej ze świszczącym oddechem w dzie-
ciństwie
46
. Chociaż niewiele jest dowodów na to,
że palenie tytoniu przez matkę w okresie ciąży
zwiększa ryzyko alergizacji u dziecka
47
, to taki
szkodliwy wpływ ma palenie bierne
47,48
. Wpływ
palenia tytoniu przez matkę w okresie prenatal-
nym i po urodzeniu dziecka jest problematycz-
ny.
49
Kobietom w ciąży i rodzicom małych dzieci
powinno się doradzać, by nie palili tytoniu (
ja-
kość danych B).
Gdy dojdzie do alergizacji, teoretycznie nadal
istnieją możliwości zapobiegnięcia rozwojowi ast-
my. Pozostaje do wyjaśnienia, czy blokery recepto-
ra histaminowego H
1
50,51
lub swoista immunote-
rapia alergenowa
52,53
mogą zapobiegać rozwojowi
astmy u dzieci z innymi chorobami atopowymi;
obecnie nie powinno się zalecać tych interwencji
do szerokiego stosowania w praktyce klinicznej.
Zapobieganie objawom i zaostrzeniom
astmy
Zaostrzenia astmy mogą być wywoływane przez
różne czynniki, niekiedy nazywane czynnikami
wyzwalającymi, do których należą alergeny, za-
każenia wirusowe, zanieczyszczenia powietrza
i leki. Zmniejszenie narażenia chorego na nie-
które z tych czynników ryzyka (np. zaprzestanie
palenia tytoniu, zmniejszenie narażenia na dym
tytoniowy [palenie bierne], zmniejszenie lub wy-
eliminowanie narażenia na czynniki zawodowe
wywołujące objawy oraz unikanie pokarmów,
dodatków do żywności i leków wywołujących ob-
jawy) poprawia kontrolę astmy i zmniejsza zapo-
trzebowanie na leki. W przypadku narażenia na
inne czynniki (np. alergeny, zakażenia wirusowe
i zanieczyszczenia powietrza) powinny zostać
podjęte odpowiednie działania, jeśli są wskaza-
ne. Ponieważ wielu chorych na astmę reaguje na
liczne czynniki powszechnie występujące w śro-
dowisku, ich całkowite unikanie jest praktycznie
niemożliwe. Leki podtrzymujące kontrolę astmy
odgrywają tu ważną rolę, ponieważ chorzy często
są mniej wrażliwi na te czynniki ryzyka, gdy ast-
ma jest dobrze kontrolowana.
Alergeny wewnątrz pomieszczeń
W mieszkaniach występuje wiele alergenów,
między innymi roztocze kurzu domowego, aler-
geny zwierząt mających sierść, karaluchów oraz
grzybów. Jednak dane na temat tego, czy środ-
ki stosowane w celu zmniejszenia narażenia na
alergeny w mieszkaniach chorych i zmniejszenia
ekspozycji na alergeny wewnątrz pomieszczeń są
skuteczne w zmniejszaniu objawów astmy – są
sprzeczne.
54,55
Większość pojedynczych inter-
wencji nie pozwala na tyle zmniejszyć obciążenie
alergenowe, aby spowodować kliniczną popra-
wę.
5557
Prawdopodobnie żadna pojedyncza inter-
wencja nie przyniesie wystarczających korzyści,
by była opłacalna. Niemniej jednak u dzieci z ast-
mą atopową mieszkających w miastach zindywi-
dualizowana domowa całościowa interwencja śro-
dowiskowa zmniejszyła ekspozycję na alergeny
występujące wewnątrz pomieszczeń i spowodo-
wała zmniejszenie chorobowości związanej z ast-
mą.
58
Potrzebne są dobrze zaplanowane badania
o większej mocy statystycznej nad złożonymi spo-
sobami redukcji narażenia na alergeny w dużych
grupach chorych.
Roztocze kurzu domowego
Alergia na roztocze kurzu domowego jest po-
wszechnym problemem zdrowotnym.
59
Ponieważ
roztocze żyją i rozmnażają się w różnych miej-
scach domu, ich całkowita eliminacja jest nie-
możliwa (
ryc. 4.2-1). Żadna pojedyncza metoda
nie zmniejszy narażenia na alergeny roztoczy,
więc pojedyncze metody chemiczne i fizyczne ma-
jące zmniejszyć ilość alergenów roztoczy nie są
skuteczne w zmniejszaniu objawów astmy u doro-
słych
55,6062
(
jakość danych A). Jedno badanie
wykazało pewną skuteczność powlekania matera-
cy pokrowcem z materiału nieprzepuszczalnego
dla alergenów w zmniejszaniu nadreaktywności
dróg oddechowych u dzieci
63
(
jakość danych
B). Zaproponowano kompleksowe podejście, obej-
mujące stosowanie metod barierowych, usuwanie
kurzu i likwidowanie potencjalnych środowisk ży-
cia roztoczy, ale skuteczność takiego postępowa-
nia w zmniejszaniu objawów astmy potwierdzono
jedynie w populacjach o niskim statusie ekono-
micznym i ze szczególnym narażeniem środowi-
skowym
58
(
jakość danych B); nie można więc
zalecić szerokiego stosowania takiej metody.

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Zwierzęta mające sierść
Całkowite wyeliminowanie ekspozycji na alerge-
ny zwierząt domowych jest niemożliwe, ponieważ
występują one powszechnie, również poza miesz-
kaniami
64
, na przykład w szkołach
65
, środkach
transportu publicznego, a nawet w budynkach,
w których nie ma kotów
66
. Usunięcie zwierzęcia
z mieszkania ma duże znaczenie, ale może upły-
nąć wiele miesięcy, zanim stężenie nagromadzo-
nego alergenu się zmniejszy
67
. Skuteczność kli-
niczna tych i innych interwencji nie została udo-
wodniona. (
ryc. 4.2-1).
Karaluchy
Metody zmniejszania ekspozycji na alergeny ka
raluchów obejmują: eliminowanie potencjalnych
środowisk ich życia (usuwanie kryjówek karalu-
chów przez uszczelnianie szpar w ścianach i podło-
dze, zmniejszanie wilgotności i dostępu do żywno-
ści), utrudnianie owadom dostępu do mieszkania
(np. przez uszczelnienie drzwi), środki chemiczne
oraz pułapki. Metody te są jednak tylko częściowo
skuteczne w usuwaniu nagromadzonych alerge-
nów
68
(
jakość danych C).
Grzyby
Narażenie na alergeny grzybów wiąże się z wy-
stępowaniem zaostrzeń astmy, a liczbę zarodni-
ków grzybów można najskuteczniej zmniejszyć
poprzez usunięcie lub czyszczenie spleśniałych
przedmiotów.
69
W klimacie tropikalnym i zwrot-
nikowym na skutek zaciekania wody i dużej wil-
gotności grzyby mogą rosnąć na ścianach miesz-
kań. Aby temu zapobiec, ściany należy wyłożyć
kafelkami lub czyścić w miarę potrzeby. W celu
zmniejszenia wilgotności poniżej 50% i usunięcia
dużych zarodników grzybów można stosować kli-
matyzatory i urządzenia wysuszające powietrze.
Jednakże klimatyzowanie pomieszczeń i uszczel-
nianie okien wiąże się również ze zwiększeniem
ilości alergenów grzybów i roztoczy kurzu domo-
wego.
70
Ryc. 4.2-1. Skuteczność metod unikania narażenia na alergeny występujące wewnątrz
pomieszczeń
a
Metoda
Dane na temat wpływu
na stężenie alergenu
Dane na temat poprawy
klinicznej
roztocze kurzu domowego
powleczenie materaca, poduszki i kołdry materiałami
nieprzepuszczalnymi
nieliczne
nie ma ( u dorosłych)
nieliczne (u dzieci)
pranie pościeli w wysokiej temperaturze (55–60
o
C)
nieliczne
nie ma
usunięcie dywanów i wykładzin dywanowych
nieliczne
nie ma
stosowanie środków roztoczobójczych lub kwasu taninowego
słabe
nie ma
zmniejszenie liczby przedmiotów gromadzących kurz
nie ma
nie ma
odkurzacze z filtrem HEPA i pojemnikami na kurz o podwójnej
grubości
słabe
nie ma
usunięcie, pranie w gorącej wodzie lub zamrażanie pluszowych
zabawek
nie ma
nie ma
zwierzęta domowe
pozbycie się kota lub psa z domu
słabe
nie ma
trzymanie zwierzęcia poza sypialniami i miejscami częstego
przebywania domowników
słabe
nie ma
system z filtrem HEPA do oczyszczania powietrza
nieliczne
nie ma
kąpanie zwierzęcia
słabe
nie ma
usunięcie dywanów i wykładzin dywanowych
nie ma
nie ma
odkurzacze z filtrem HEPA i pojemnikami na kurz o podwójnej
grubości
nie ma
nie ma
a
na podstawie: Custovic A., Wijk R.G.: The effectiveness of measures to change indoor environment in the treatment of
allergic rhinitis and asthma: ARIA update (in collaboration with GA(2)LEN). Allergy, 2005; 60 (9): 1112–1115

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
Alergeny środowiska zewnętrznego
Całkowite wyeliminowanie ekspozycji na alerge-
ny środowiska zewnętrznego, takie jak pyłki ro-
ślin i pleśnie, jest niemożliwe. Narażenie można
zmniejszyć, zamykając okna i drzwi oraz pozosta-
jąc w domu, kiedy stężenie pyłków roślin i pleśni
jest największe, oraz w miarę możliwości stosując
klimatyzację. W niektórych krajach informacje na
temat stężenia alergenów środowiska zewnętrz-
nego są przekazywane za pośrednictwem radia,
telewizji i internetu. Wpływ tych metod jest trud-
ny do oceny.
Zanieczyszczenia powietrza wewnątrz
pomieszczeń
Najważniejsze jest unikanie czynnego i biernego
palenia tytoniu. Bierne palenie zwiększa częstość
występowania i ciężkość objawów u dzieci chorych
na astmę. Rodzicom i opiekunom dzieci chorych
na astmę należy zalecić niepalenie tytoniu i zabra-
nianie innym osobom palenia w pokojach, w któ-
rych przebywają dzieci. Poza nasileniem objawów
astmy i powodowaniem długotrwałego upośle
dzenia czynności płuc, czynne palenie papierosów
zmniejsza skuteczność glikokortykosteroidów
wziewnych i podawanych ogólnoustrojowo
71,72
(
jakość danych B). Stąd też trzeba zdecydowa-
nie zachęcać wszystkich chorych na astmę, którzy
palą tytoń, do zaprzestania palenia. Główne zanie-
czyszczenia powietrza wewnątrz pomieszczeń sta-
nowią: tlenek azotu (II) i inne tlenki azotu, tlenek
i dwutlenek węgla, dwutlenek siarki, formaldehyd
i substancje pochodzenia biologicznego (endotok-
syna).
73
Metody kontroli lub zapobiegania ekspo-
zycji na te zanieczyszczenia, takie jak odprowa-
dzanie spalin z pieców na zewnątrz pomieszczeń
i właściwa konserwacja systemów grzewczych, nie
zostały jednak odpowiednio przebadane i mogą
być kosztowne (
jakość danych D).
Zanieczyszczenia powietrza
atmosferycznego
Szereg badań wskazuje, że zanieczyszczenia po-
wietrza atmosferycznego nasilają objawy astmy
74
,
prawdopodobnie wywierając wpływ addytywny
względem narażenia alergenowego
75
. Epidemie
zaostrzeń astmy występują w powiązaniu ze
zwiększonym zanieczyszczeniem powietrza atmo-
sferycznego, co może wynikać z ogólnego wzrostu
stężenia zanieczyszczeń lub ze zwiększenia ilości
określonych alergenów, na które chory jest uczu-
lony.
7678
Większość badań epidemiologicznych
wykazała znamienny związek zanieczyszczeń
powietrza, takich jak ozon, tlenki azotu, kwaś-
ne aerozole i pyły, z występowaniem objawów
lub zaostrzeń astmy. Niekiedy warunki pogodo-
we i atmosferyczne, na przykład burze,
79
sprzy-
jają wystąpieniu zaostrzeń astmy poprzez różne
mechanizmy, takie jak zwiększenie ilości kurzu
i zanieczyszczeń powietrza, aeroalergenów oraz
zmiany temperatury lub wilgotności powietrza.
Unikanie niekorzystnych warunków środo-
wiskowych jest zwykle zbędne w przypadku cho-
rych z dobrze kontrolowaną astmą. U chorych
z astmą trudną kroki podejmowane w czasie
niekorzystnych warunków środowiskowych obej-
mują: unikanie natężonej aktywności fizycznej,
gdy powietrze jest zimne, suche lub bardzo za-
nieczyszczone, unikanie palenia tytoniu i prze-
bywania w zadymionych pomieszczeniach oraz
pozostawanie wewnątrz pomieszczeń, w których
warunki środowiska są kontrolowane.
Narażenia zawodowe
Wczesne wykrycie zawodowych czynników uczu-
lających i przerwanie dalszego narażenia osoby
uczulonej stanowią ważne aspekty postępowania
w astmie zawodowej (
jakość danych B). Gdy
doszło już do uczulenia na alergen zawodowy,
poziom narażenia konieczny do wywołania obja-
wów może być bardzo niski, a zaostrzenia stają
się coraz cięższe. Próby ograniczenia ekspozycji
zawodowej były skuteczne zwłaszcza w warun-
kach przemysłowych, a niektóre silne czynniki
uczulające, takie jak nasiona soi, zostały zastąpio-
ne przez substancje słabiej alergizujące
80
(
jakość
danych B). Zapobieganie uczuleniu na lateks
stało się możliwe dzięki wyprodukowaniu rękawi-
czek hipoalergicznych, które są pozbawione talku
i zawierają mniejszą ilość alergenu
81,82
(
jakość
danych C). Chociaż są one droższe od zwyczaj-
nych rękawiczek, to ich używanie jest opłacalne.

WYTYCZNE
2
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Żywność i dodatki do żywności
Uczulenie na pokarm jest rzadkim czynnikiem za-
ostrzającym astmę i występuje głównie u małych
dzieci. Nie powinno się zalecać unikania określo-
nego pokarmu, dopóki nie udowodni się alergii
(zwykle metodą doustnej próby prowokacyjnej).
83
Gdy alergia na pokarm zostanie wykazana, uni-
kanie alergenu pokarmowego może zmniejszyć
częstość zaostrzeń astmy
84
(
jakość danych D).
Siarczyny (często stosowane środki konserwu-
jące, zawarte w pokarmach i lekach, m.in. wyro-
bach produkowanych z ziemniaków, krewetkach,
suszonych owocach, piwie i winie) mogą wywoły-
wać ciężkie zaostrzenia astmy, co często opisywa-
no, ale prawdopodobieństwo wystąpienia reakcji
zależy od rodzaju pokarmu, ilości i postaci siar-
czynu, wrażliwości chorego i mechanizmu reak-
cji wywoływanej przez siarczyny.
85
Rola innych
substancji pokarmowych, w tym żółtego barwni-
ka tartrazyny, benzoesanu i glutaminianu sodu
w wywoływaniu zaostrzeń astmy jest prawdopo-
dobnie minimalna; potwierdzenie ich znaczenia
wymaga przeprowadzenia podwójnie ślepej próby
prowokacyjnej, zanim wprowadzi się określone
ograniczenia dietetyczne.
Leki
Niektóre leki mogą powodować zaostrzenia ast-
my. Kwas acetylosalicylowy i inne niesteroidowe
leki przeciwzapalne mogą być przyczyną ciężkich
zaostrzeń choroby, a chorzy, którzy mieli napady
astmy po zażyciu leku z tej grupy, nie powinni ich
więcej przyjmować.
86
βblokery w postaci doustnej
lub kropli do oczu mogą nasilać skurcz oskrzeli
(
jakość danych A); jeżeli się je stosuje, to chory
musi być pod ścisłym nadzorem lekarza.
87
Szczepienie przeciwko grypie
Chorym na astmę umiarkowaną lub ciężką należy
zalecać szczepienie przeciwko grypie corocznie
88
lub przynajmniej wtedy gdy zaleca się szczepie-
nie populacji ogólnej. Niemniej jednak prawdo-
podobnie rutynowe szczepienie przeciwko grypie
chorych na astmę dzieci
89
i dorosłych
90
nie chroni
przed zaostrzeniami astmy ani nie poprawia kon-
troli choroby. Inaktywowane szczepionki przeciw-
ko grypie powodują niewiele skutków niepożąda-
nych i można je bezpiecznie podawać dorosłym
i dzieciom w wieku >3 lat chorującym na astmę,
również trudną
91
. Istnieją dane wskazujące na
to, że stosowanie szczepionki donosowej może się
wiązać ze zwiększoną częstością zaostrzeń astmy
u dzieci w wieku <3 lat.
92
Otyłość
Zwiększony wskaźnik masy ciała (BMI) powiąza-
no z częstszym występowaniem astmy, ale mecha-
nizm tego związku nie jest jasny.
93
Wykazano, że
zmniejszenie masy ciała u otyłych chorych na ast-
mę powoduje poprawę w zakresie czynności płuc,
objawów, chorobowości i ogólnego stanu zdrowia
94
(
jakość danych B).
Stres emocjonalny
Stres emocjonalny może wywołać zaostrzenie ast-
my, głównie dlatego że skrajne wyrażanie emocji
(śmiech, płacz, złość lub lęk) niekiedy prowadzi do
hiperwentylacji i hipokapni, a te zaburzenia z ko-
lei mogą wywołać skurcz oskrzeli.
95,96
Podobny
wpływ mają napady paniki, które występują rzad-
ko, ale nie są wyjątkowe u niektórych chorych na
astmę.
97,98
Trzeba jednak pamiętać, że astma nie
jest zaburzeniem głównie psychosomatycznym.
Inne czynniki, które mogą wywoływać
zaostrzenia astmy
Nieżyt nosa, zapalenie zatok przynosowych i poli-
py często są związane z astmą i wymagają leczenia.
U dzieci wykazano, że antybiotykoterapia bakte-
ryjnego zapalenia zatok przynosowych zmniejsza
ciężkość astmy.
99
Zapalenie zatok przynosowych
i astma mogą też po prostu współistnieć. Poza zapa-
leniem zatok przynosowych nie ma danych wska-
zujących na to, że zakażenia bakteryjne wywołują
zaostrzenia astmy. Refluks żołądkowoprzełykowy
może być przyczyną zaostrzenia astmy, zwłaszcza
u dzieci, i astma niekiedy się poprawia po skutecz-
nym leczeniu refluksu.
100,101
Wiele kobiet skarży
się na pogorszenie astmy w okresie miesiączki,
opisywano też zaostrzenia przed miesiączką.
102
Podobnie w okresie ciąży astma może ulegać po-
prawie, pogorszeniu lub się nie zmieniać.
103

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
Składowa 3: Ocena kontroli astmy,
leczenie w celu jej osiągnięcia
i monitorowanie
Wprowadzenie
Cel leczenia astmy – osiągnięcie i utrzymanie kon-
troli klinicznej choroby – można osiągnąć u więk-
szości chorych,
104
stosując leczenie farmakolo-
giczne uzgodnione wspólnie przez pacjenta lub
jego rodzinę i lekarza. Każdemu choremu przypi-
suje się jeden z 5 „stopni leczenia” w zależności
od aktualnego poziomu kontroli astmy i leczenie
dostosowuje się w ciągłym cyklu „napędzanym”
przez zmiany kontroli. Cykl ten obejmuje:
1) ocenę kontroli astmy
2) leczenie w celu uzyskania kontroli astmy
3) monitorowanie w celu utrzymania kontroli
astmy.
W tym podrozdziale cykl ten jest opisany w za-
kresie przewlekłego leczenia astmy. Leczenie za-
ostrzeń opisano w podrozdziale „Składowa 4”.
Ocena kontroli astmy
U każdego pacjenta powinno się ocenić aktualne
leczenie, jego przestrzeganie oraz stopień kontroli
astmy. Uproszczony schemat rozpoznawania kon-
trolowanej, częściowo kontrolowanej i niekontro-
lowanej astmy w danym tygodniu przedstawiono
na
rycinie 4.3-1. Jest to schemat roboczy, opra-
cowany na podstawie aktualnych poglądów, któ-
ry nie został jeszcze zweryfikowany. Opracowano
kilka złożonych wskaźników kontroli (np. Asth-
ma Control Test,
105
Asthma Control Questionna-
ire,
106108
Asthma Therapy Assessment Question-
naire,
109
Asthma Control Scoring System
110
),
które są obecnie sprawdzane w różnych zastoso-
waniach, w tym przez pracowników medycznych
do oceny stopnia kontroli astmy u pacjentów
i przez pacjentów do samodzielnej oceny, zgodnie
z osobistym planem działania. Astma niekontro-
lowana może postępować w kierunku zaostrzenia
i wówczas powinno się niezwłocznie podjąć odpo-
wiednie działania opisane w składowej 4., w celu
odzyskania kontroli.
Leczenie w celu uzyskania kontroli
astmy
Aktualny stopień kontroli astmy u pacjenta
i aktualne leczenie determinują wybór leków. Na
przykład jeśli aktualnie stosowane leczenie nie
zapewnia kontroli astmy, to powinno się je zin-
tensyfikować, aż zostanie osiągnięta kontrola.
Jeśli kontrola utrzymuje się co najmniej przez
3 miesiące, intensywność leczenia można zmniej-
szyć w celu ustalenia najniższego stopnia i dawek
leków utrzymujących kontrolę (p. niżej „Leczenie
w celu utrzymania kontroli astmy”). Jeśli astma
jest częściowo kontrolowana, powinno się rozwa-
żyć zintensyfikowanie leczenia, z uwzględnieniem
dostępności skuteczniejszych metod (np. zwięk-
szenia dawki lub zastosowania dodatkowych le-
ków), bezpieczeństwa i kosztów możliwych opcji
leczenia oraz zadowolenia pacjenta z osiągniętego
stopnia kontroli. Schemat przedstawiony na
ryci-
nie 4.3-2 jest oparty na tych zasadach, ale zakres
Główne punkty
n
Cel leczenia astmy – osiągnięcie i utrzymanie
kontroli klinicznej choroby – można osiągnąć
u większości chorych, stosując leczenie farmako-
logiczne uzgodnione wspólnie przez pacjenta lub
jego rodzinę i lekarza.
n
Leczenie powinno być dostosowywane w sposób
ciągły, zależnie od stopnia kontroli astmy u cho-
rego.
n
Jeśli aktualnie stosowane leczenie nie zapewnia
kontroli astmy, to powinno się je zintensyfiko-
wać, aż zostanie osiągnięta kontrola. Jeśli kon-
trola utrzymuje się co najmniej przez 3 miesiące,
intensywność leczenia można zmniejszyć.
n
U dotychczas nieleczonych chorych na astmę
przewlekłą leczenie należy rozpocząć od stopnia
2 lub, w przypadku nasilonych objawów (astma
niekontrolowana) – od stopnia 3. Dla stopni 2–5
dostępne są różne leki kontrolujące.
n
Na każdym stopniu leczenia powinno się stoso-
wać leki doraźne w celu szybkiego zniesienia ob-
jawów podmiotowych.
n
W celu utrzymania kontroli astmy oraz ustalenia
najniższego stopnia intensywności leczenia i da-
wek leków w celu minimalizacji kosztów i zapew-
nienia maksymalnego bezpieczeństwa – niezbęd-
ne jest ciągłe monitorowanie.

WYTYCZNE
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
i kolejność stosowania leków w różnych sytua-
cjach klinicznych różni się w zależności od lokal-
nej dostępności (determinowanej przez koszty lub
inne czynniki), chęci stosowania i preferencji.
Stopnie leczenia do osiągnięcia kontroli
Większość leków dostępnych dla chorych na ast-
mę, w porównaniu z lekami stosowanymi w innych
chorobach przewlekłych, odznacza się niezwykle
korzystnym wskaźnikiem terapeutycznym. Każ-
dy stopień zawiera alternatywne opcje leczenia
kontrolującego, aczkolwiek ich skuteczność nie
jest identyczna. Stopnie 1–5 zawierają opcje le-
czenia o wzrastającej skuteczności, z wyjątkiem
stopnia 5, w którym o wyborze leku decyduje
dostępność i bezpieczeństwo stosowania. U więk-
szości dotychczas nieleczonych chorych z utrzy-
mującymi się objawami astmy terapię rozpoczyna
się od stopnia 2. Jeśli podczas pierwszego badania
lekarskiego objawy nasuwają podejrzenie bardzo
źle kontrolowanej astmy (
ryc. 4.3-1), leczenie na-
leży rozpocząć od stopnia 3.
Na każdym stopniu leczenia powinno się sto-
sować leki doraźne (
szybko działające leki
rozszerzające oskrzela – krótko lub długo
działające) w celu szybkiego zniesienia objawów
podmiotowych. Jednakże regularne stosowanie
leków znoszących objawy jest jednym z kryteriów
astmy niekontrolowanej i wskazuje, że powinno
się zintensyfikować leczenie kontrolujące choro-
bę. Tak więc zmniejszenie lub wyeliminowanie
zapotrzebowania na leki doraźne jest zarówno
ważnym celem, jak i wskaźnikiem powodzenia
leczenia. W stopniach 2–5 dostępne są różne leki
kontrolujące.
Stopień 1: leki doraźne
Leczenie stopnia 1 za pomocą leku doraźnego
przyjmowanego w razie potrzeby jest zarezerwo-
wane dla dotychczas nieleczonych chorych z rzad-
ko występującymi objawami w ciągu dnia (ka-
szel, świsty, duszność występujące nie częściej niż
2 razy w tygodniu, a jeśli występują w nocy, to
rzadziej), trwającymi krótko (utrzymującymi się
tylko przez kilka godzin), odpowiadającymi ast-
mie kontrolowanej (
ryc. 4.3-1). Pomiędzy napada-
mi astmy chory nie ma objawów, astma nie budzi go
w nocy i czynność płuc jest prawidłowa. Jeśli objawy
występują częściej lub okresowo się nasilają, chory
wymaga, oprócz leczenia doraźnego, regularnego
przyjmowania leków kontrolujących (p. stopień 2
lub wyższy)
111-113
(
jakość danych B).
U większości chorych w stopniu 1 zaleca-
nym lekiem doraźnym jest
szybko działający
β
2
-mimetyk wziewny
114
(
jakość danych A).
Jako alternatywę można rozważyć zastosowanie
wziewnego leku przeciwcholinergicznego, doust-
nego β
2
mimetyku krótko działającego lub krót-
ko działającego preparatu teofiliny, aczkolwiek
działanie tych leków rozwija się wolniej i wiąże
Ryc. 4.3-1. Stopnie kontroli astmy
Kryterium
Kontrolowana
(wszystkie kryteria
spełnione)
Częściowo kontrolowana
(≥1 kryterium spełnione
w ≥1 tyg.)
Niekontrolowana
objawy dzienne
nie występują
(
≤2/tyg.)
>2/tyg.
≥3 kryteria astmy częściowo
kontrolowanej spełnione
w którymkolwiek tygodniu
ograniczenie aktywności
życiowej
nie ma
jakiekolwiek
objawy nocne, przebudzenia
nie występują
jakiekolwiek
potrzeba leczenia doraźnego
(ratunkowego)
nigdy (
≤2/tyg.)
>2/tyg.
czynność płuc (PEF lub FEV
)
a
prawidłowa
<80% wn. lub wm. (jeśli jest znana)
zaostrzenia
nie występują
≥1/rok
b
1 w którymkolwiek tygodniu
c
a
Czynność płuc nie jest wiarygodnym kryterium u dzieci w wieku
≤5 lat.
b
Po każdym zaostrzeniu powinno się niezwłocznie ocenić leczenie podtrzymujące w celu upewnienia się, czy jest wystarczające.
c
Każdy tydzień z zaostrzeniem astmy uznaje się za tydzień z astmą niekontrolowaną.
wm. – wartość maksymalna dla chorego, wn. – wartość należna
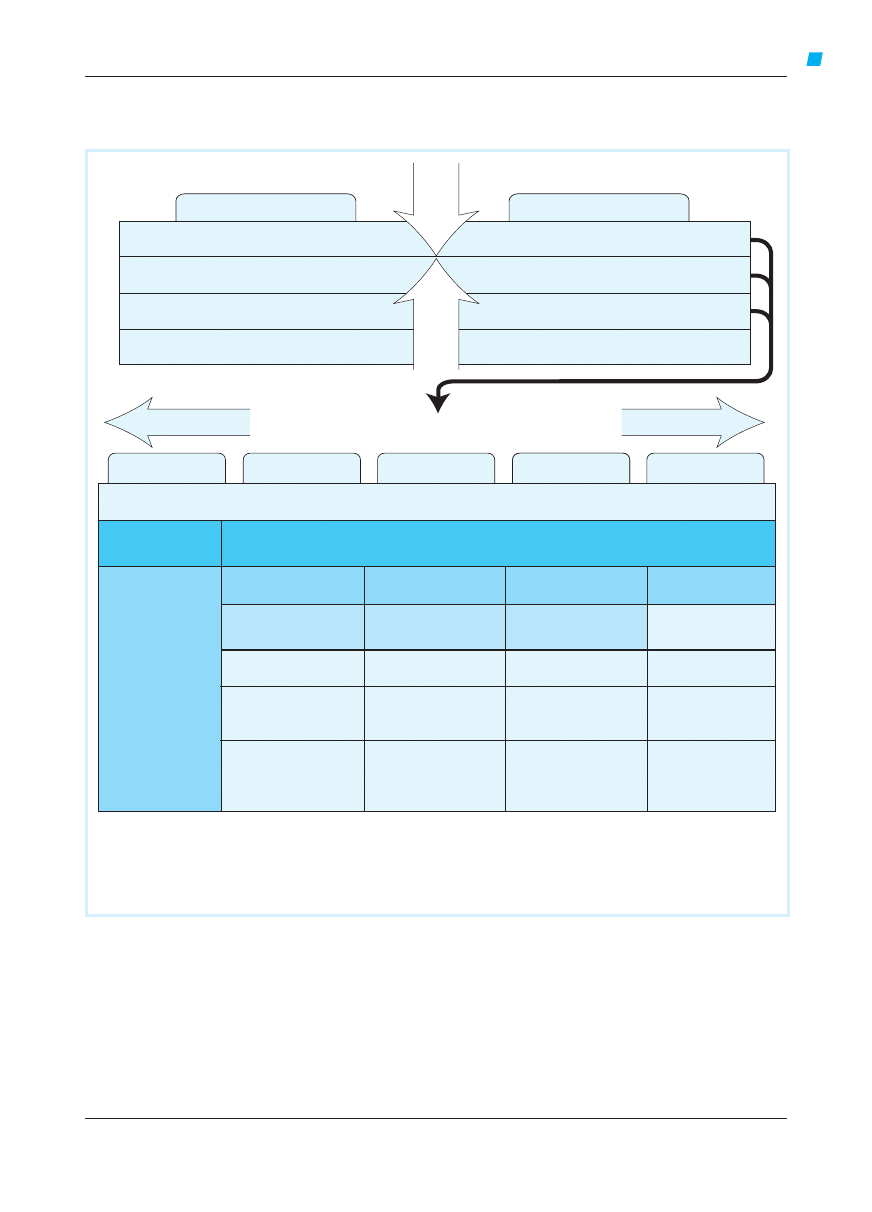
WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
się z większym ryzykiem skutków ubocznych (
ja-
kość danych A).
Skurcz oskrzeli wywoływany przez wysiłek
fizyczny
Aktywność fizyczna jest ważną przyczyną wystę-
powania objawów u większości chorych na astmę,
a u niektórych jest jedyną przyczyną. Powysiłko-
wy skurcz oskrzeli często jednak wskazuje na to,
stopień kontroli astmy
kontrolowana
częściowo kontrolowana
niekontrolowana
zaostrzenie
zmniejsz
intensywność
leczenia
zwiększ
intensywność
leczenia
postępowanie z chorym
kontynuuj leczenie i określ najniższy
stopień zapewniający kontrolę choroby
rozważ intensyfikację leczenia w celu
uzyskania pełnej kontroli
intensyfikuj leczenie aż do uzyskania
kontroli
lecz jak zaostrzenie
zmniejszyć
stopnie intensywności leczenia
zwiększyć
stopień 1
stopień 2
stopień 3
stopień 4
stopień 5
edukacja chorego
kontrola czynników środowiskowych
szybko działający
β
2
-mimetyk
w razie potrzeby
Alternatywne leki doraźne to: wziewne leki przeciwcholinergiczne, krótko działające
β
2
-mimetyki doustne, niektóre LABA,
krótko działające preparaty teofiliny. Nie zaleca się regularnego stosowania krótko i długo działających
β
2
-mimetyków,
jeśli jednocześnie nie stosuje się regularnie GKS wziewnych.
lek przeciwleukotrienowy
a
GKSw w średniej
lub dużej dawce
lek
przeciwleukotrienowy
przeciwciało anty-IgE
GKSw w małej
dawce + lek
przeciwleukotrienowy
teofilina o przedłużonym
uwalnianiu
GKSw w małej
dawce + teofilina
o przedłużonym
uwalnianiu
a
antagonista receptora lub inhibitor syntezy leukotrienów
GKSw – glikokortykosteroid wziewny, LABA –
β
2
-mimetyk długo działający
GKS doustny
(najmniejsza dawka)
GKSw w średniej
lub dużej dawce + LABA
GKSw w małej
dawce + LABA
GKSw
w małej dawce
szybko działający
β
2
-mimetyk w razie potrzeby
wybór leków
kontrolujących
przebieg choroby
wybierz 1
wybierz 1
dodaj 1 lub więcej
dodaj 1 lub oba do
leczenia stopnia 4
Ryc. 4.3-2. Leczenie w zależności od stopnia kontroli astmy – dzieci >5. rż. i dorosłych

WYTYCZNE
6
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
że astma nie jest dobrze kontrolowana, a intensy-
fikacja leczenia kontrolującego na ogół prowadzi
do zmniejszenia objawów wywoływanych przez
wysiłek fizyczny. U chorych, u których poza wystę-
powaniem powysiłkowego skurczu oskrzeli astma
jest dobrze kontrolowana oraz u tych, u których
powysiłkowy skurcz oskrzeli jest jedyną manife-
stacją astmy, zaleca się przyjmowanie przed wy-
siłkiem lub w celu zniesienia objawów w czasie
wysiłku szybko działającego β
2
-mimetyku wziew-
nego (krótko lub długo działającego).
115
Lekami
alternatywnymi są leki przeciwleukotrienowe
116
lub kromony
117
(
jakość danych A). Trening
i odpowiednia rozgrzewka również zmniejszają
częstość występowania i nasilenie powysiłkowego
skurczu oskrzeli
118,119
(
jakość danych B).
Stopień 2: leki doraźne w połączeniu
z 1 lekiem kontrolującym
Leczenie według stopni 2–5 polega na stosowa-
niu leków doraźnych w połączeniu z regularnym
przyjmowaniem leków kontrolujących. W stopniu
2 zalecanym lekiem kontrolującym pierwszego
wyboru u chorych w każdym wieku jest
glikokor-
tykosteroid wziewny w małej dawce
111120
(
jakość danych A). Na rycinie 3-1 przedsta-
wiono równoważne dawki glikokortykosteroidów
wziewnych dla dorosłych, a na
rycinie 3-4 – dla
dzieci w wieku 5 lat i młodszych; niektóre z wy-
mienionych leków można stosować raz dziennie.
Alternatywnymi lekami kontrolującymi są
leki przeciwleukotrienowe
121-123
(
jakość da-
nych A), szczególnie wskazane u chorych, którzy
nie mogą lub nie chcą przyjmować glikokortyko-
steroidów wziewnych lub u których występują
uciążliwe skutki uboczne, takie jak utrzymująca
się chrypka z powodu leczenia glikokortykosteroi-
dem wziewnym, a także u chorych ze współistnie-
jącym alergicznym nieżytem nosa
124,125
(
jakość
danych C).
Dostępne są również inne opcje, ale nie są one
zalecane do rutynowego stosowania jako leki kon-
trolujące pierwszego wyboru na stopniu 2.
Teofi-
lina w postaci o przedłużonym uwalnianiu
wykazuje jedynie słabe działanie przeciwzapalne
i niewielką skuteczność w kontrolowaniu ast-
my
126130
(
jakość danych B) oraz często wywo-
łuje skutki uboczne – od banalnych po niemożli-
we do zniesienia
131,132
.
Kromony (nedokromil
sodu i kromoglikan sodu) mają podobnie małą
skuteczność, chociaż korzystny profil bezpieczeń-
stwa
133136
(
jakość danych A).
Stopień 3: leki doraźne w połączeniu
z 1 lub 2 lekami kontrolującymi
W stopniu 3 zalecanym postępowaniem u młodzie-
ży i dorosłych jest
połączenie glikokortykoste-
roidu wziewnego w małej dawce z wziewnym
β
2
-mimetykiem długo działającym, w jednym
inhalatorze lub oddzielnych inhalatorach
137144
(
jakość danych A). Dzięki addytywnemu efek-
towi takiego połączenia zwykle wystarcza mała
dawka glikokortykosteroidu, którą trzeba zwięk-
szyć tylko wówczas, gdy nie osiągnie się kontroli
choroby w ciągu 3 lub 4 miesięcy leczenia (
jakość
danych A). Wykazano, że długo działający β
2
-
mimetyk – formoterol, który jednocześnie działa
szybko, stosowany sam
145148
lub w połączeniu
w jednym inhalatorze z budezonidem
149,150
jest
równie skuteczny w nagłych zaostrzeniach astmy
jak β
2
mimetyk krótko działający. Jednakże zde-
cydowanie odradza się stosowania tego leku jako
doraźnego w monoterapii, ponieważ zawsze musi
być podawany w połączeniu z glikokortykosteroi-
dem wziewnym.
U wszystkich dzieci, szczególnie w wieku 5 lat
i młodszych, leczenie skojarzone jest słabiej prze-
badane i dodanie długo działającego β
2
-mimety-
ku może nie być tak skuteczne w zmniejszaniu
częstości zaostrzeń, jak zwiększenie dawki gliko-
kortykosteroidu wziewnego.
151153
Interpretacja
wyników niektórych badań jest jednak proble-
matyczna, gdyż nie wszystkie dzieci otrzymywały
jednocześnie glikokortykosteroid wziewny.
152,153
Ryc. 4.3-3. Leczenie w zależności od stopnia
kontroli astmy – dzieci ≤5. rż.
Dostępne piśmiennictwo na temat leczenia astmy u dzieci
w wieku 5 lat i młodszych nie pozwala sformułować
szczegółowych zaleceń. Najlepiej udokumentowanym
sposobem osiągnięcia kontroli astmy w tych grupach
wiekowych jest stosowanie glikokortykosteroidów
wziewnych. W 2. stopniu intensywności jako wstępne
leczenie kontrolujące przebieg choroby zaleca się
glikokortykosteroidy wziewne w małej dawce. Dawki
równoważne glikokortykosteroidów wziewnych (niektóre
można podawać raz dziennie) podano w
rozdziale
(ryc. 3-4).

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
Jeśli się stosuje formoterol z budezonidem
w jednym inhalatorze, można takiego połącze-
nia używać zarówno do leczenia doraźnego, jak
i przewlekłego. Takie postępowanie okazało się
skuteczne w zmniejszaniu częstości zaostrzeń,
poprawie kontroli astmy u dorosłych i młodzieży,
przy stosunkowo małych dawkach leków
154157
(
jakość danych A). Potrzebne są dalsze badania
w celu ustalenia, czy w taki sposób można stoso-
wać inne połączenia leków kontrolujących i leków
doraźnych.
Inną opcją zarówno dla dorosłych, jak i dzie-
ci, ale zalecaną u dzieci
158
, jest
zwiększenie
dawki glikokortykosteroidu wziewnego do
średniej
104,159161
(
jakość danych A). U cho-
rych w każdym wieku przyjmujących glikokor-
tykosteroid wziewny w średniej lub dużej dawce
z inhalatora ciśnieniowego z dozownikiem (MDI)
zaleca się stosowanie spejsera w celu zwiększenia
ilości leku docierającego do dróg oddechowych
oraz zmniejszenia częstości występowania skut-
ków ubocznych w obrębie jamy ustnej i gardła
i wchłaniania ogólnoustrojowego
162164
(
jakość
danych A).
Inną opcją w stopniu 3 jest połączenie gli-
kokortykosteroidu wziewnego w małej dawce
z lekiem przeciwleukotrienowym
165173
(
jakość
danych A). Alternatywnie można rozważyć za-
stosowanie teofiliny w postaci preparatu o prze-
dłużonym uwalnianiu w małej dawce
129
(
jakość
danych B). Opcji tych nie przebadano dostatecz-
nie u dzieci w wieku ≤5 lat.
Stopień 4: leki doraźne w połączeniu z ≥2
lekami kontrolującymi
Wybór leczenia w stopniu 4 zależy od wcześniej-
szych wyborów w stopniach 2 i 3 Jednakże kolej-
ność dodawania leków opiera się – na tyle na ile
jest to możliwe – na danych z badań klinicznych
oceniających ich względną skuteczność. Chorych,
u których nie udaje się uzyskać kontroli astmy po-
mimo leczenia stopnia 3, powinno się
kierować
do specjalisty mającego odpowiednie wie-
dzę i doświadczenie w leczeniu astmy, w celu
zbadania pod kątem innych chorób lub przyczyn
astmy trudnej.
Preferowaną metodą leczenia w stopniu 4 jest
połączenie glikokortykosteroidu wziewne-
go w średniej lub dużej dawce z długo dzia-
łającym β
2
-mimetykiem wziewnym. Jednak
u większości chorych zwiększenie dawki gliko-
kortykosteroidu wziewnego ze średniej do dużej
przynosi stosunkowo niewielką dodatkową ko-
rzyść
104,159161,174
(
jakość danych A), a stosowa-
nie dużych dawek zaleca się tylko na próbę przez
3–6 miesięcy, gdy nie można uzyskać kontroli
astmy za pomocą glikokortykosteroidu wziewne-
go w średniej dawce w połączeniu z długo dzia-
łającym β
2
-mimetykiem i trzecim lekiem kon-
trolującym (np. lekiem przeciwleukotrienowym
lub preparatem teofiliny o przedłużonym uwal-
nianiu)
130,175
(
jakość danych B). Długotrwałe
stosowanie glikokortykosteroidów wziewnych
w dużej dawce wiąże się również ze zwiększonym
ryzykiem skutków niepożądanych. Przy stoso-
waniu dawek średnich i dużych większości gliko-
kortykosteroidów wziewnych, ale nie wszystkich,
konieczne jest dawkowanie 2 razy dziennie
176
(
jakość danych A). W przypadku budezonidu
skuteczność można zwiększyć, podając lek częś-
ciej (4 razy dziennie)
177
(
jakość danych B). (Za-
lecenia dotyczące dawkowania różnych glikokor-
tykosteroidów wziewnych podano na
ryc. 3-1 dla
dorosłych i
ryc. 3-4 dla dzieci w wieku ≤5 lat).
Wykazano, że dodanie
leku przeciwleuko-
trienowego do glikokortykosteroidu wziewnego
stosowanego w średniej lub dużej dawce przynosi
korzyści (
jakość danych A), ale zwykle są one
mniejsze niż uzyskane dzięki dodaniu długo dzia-
łającego β
2
-mimetyku
165168,175,178
(
jakość da-
nych A). Dodanie małej dawki teofiliny w po-
staci o przedłużonym uwalnianiu
130
do gliko-
kortykosteroidu wziewnego w średniej lub dużej
dawce i długo działającego β
2
mimetyku również
może przynieść korzyści (
jakość danych B)
129
.
Stopień 5: leki doraźne w połączeniu
z dodatkowymi lekami kontrolującymi
astmę
Dodanie
glikokortykosteroidów doustnych
do innych leków kontrolujących może być sku-
teczne
179
(
jakość danych D), ale wiąże się z cięż-
kimi skutkami ubocznymi
180
(
jakość danych A)
i powinno być brane pod uwagę tylko wtedy, gdy
astma pozostaje bardzo źle kontrolowana pomimo
leczenia stopnia 4, z ograniczeniem aktywności
życiowej w ciągu dnia i częstymi zaostrzeniami.

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Pacjentów należy poinformować o potencjalnych
skutkach ubocznych i trzeba rozważyć wszystkie
alternatywne sposoby leczenia.
Wykazano, że dodanie
przeciwciała anty-
IgE do innych leków kontrolujących poprawia
kontrolę astmy alergicznej, której nie udało się
osiągnąć, stosując inne leki kontrolujące, w tym
glikokortykosteroidy wziewne w dużej dawce lub
glikokortykosteroidy doustne
181186
(
jakość da-
nych A).
Leczenie w celu utrzymania kontroli
astmy
Gdy się osiągnie kontrolę astmy, niezbędne jest
ciągłe monitorowanie w celu utrzymania kontro-
li i określenia najniższego stopnia i dawek leków
zapewniających najmniejszy koszt i największe
bezpieczeństwo leczenia. Astma jest jednak cho-
robą zmienną, dlatego leczenie trzeba okresowo
dostosowywać w odpowiedzi na utratę kontroli,
na którą wskazują nasilenie się objawów lub wy-
stąpienie zaostrzenia.
Kontrola astmy powinna być monitorowana
przez pracownika opieki zdrowotnej i najlepiej
również przez samego chorego w regularnych
odstępach czasu, według uproszczonego schema-
tu, takiego jak przedstawiony na
rycinie 4.3-1,
lub sprawdzonego złożonego wskaźnika kontro-
li. Częstość wizyt u lekarza zależy od wyjściowej
ciężkości klinicznej choroby, wyszkolenia pacjen-
ta i zaufania, że będzie on uczestniczył w bieżącej
kontroli astmy. Zwykle chorzy zgłaszają się na wi-
zytę kontrolą po upływie 1–3 miesięcy od pierw-
szej wizyty, a potem co 3 miesiące. Po zaostrzeniu
wizyta kontrolna powinna się odbyć w ciągu 2 ty-
godni do miesiąca (
jakość danych D).
Czas trwania i dostosowywanie leczenia
W przypadku większości grup leków kontrolują-
cych poprawa stanu klinicznego występuje w cią-
gu kilku dni od rozpoczęcia leczenia, ale pełny
efekt można zaobserwować dopiero po upływie
3–4 miesięcy.
104,187
W przypadku ciężkiej i długo
niedostatecznie leczonej choroby może to trwać
jeszcze dłużej.
188
Zmniejszenie zapotrzebowania na leki po
osiągnięciu kontroli astmy nie jest w pełni zro-
zumiałe, ale może odzwierciedlać odwrócenie
niektórych konsekwencji przewlekłego zapalenia
w drogach oddechowych. Do uzyskania tej ko-
rzyści mogą być konieczne większe dawki leków
przeciwzapalnych niż do jej utrzymania. Zmniej-
szone zapotrzebowanie na leki może też po prostu
odzwierciedlać samoistną poprawę jako cechę cy-
klicznej historii naturalnej astmy. Rzadko astma
wchodzi w remisję, szczególnie u dzieci w wieku
≤5 lat i w okresie dojrzewania. Jakiekolwiek by-
łoby wytłumaczenie tych zjawisk, u wszystkich
chorych trzeba dążyć do określenia minimalnych
dawek leków kontrolujących astmę, poprzez re-
gularne wizyty kontrolne i zaplanowane redukcje
dawek.
Innym razem leczenie może wymagać in-
tensyfikacji albo z powodu utraty kontroli lub
zagrożenia taką utratą (nawrót objawów) albo
w związku z wystąpieniem nagłego zaostrzenia,
definiowanego jako nagłe lub ciężka utrata kon-
troli wymagająca pilnego leczenia (postępowanie
w zaostrzeniach przedstawiono w podrozdziale
„Składowa 4”).
Zmniejszanie intensywności leczenia
po uzyskaniu kontroli astmy
Dane z badań klinicznych dotyczące optymalnego
czasu, sekwencji i stopnia redukcji dawek leków
w leczeniu astmy są skąpe, więc postępowanie bę-
dzie różne u poszczególnych chorych w zależności
od tego, jakie leki i jakie dawki były konieczne do
osiągnięcia kontroli choroby. Zmian tych najlepiej
dokonywać, uzgadniając je z pacjentem po przed-
stawieniu mu potencjalnych konsekwencji, w tym
nawrotu objawów i zwiększonego ryzyka zaost-
rzenia.
Potrzebne są dalsze badania nad zmniejsza-
niem intensywności leczenia astmy, ale na pod-
stawie aktualnie dostępnych danych można sfor-
mułować pewne zalecenia:
1. Jeśli się stosuje sam glikokortykostero-
id wziewny w średniej lub dużej dawce, można
próbować zmniejszać dawkę o 50% co 3 miesią-
ce
189191
(
jakość danych B).
2. Jeżeli kontrolę astmy osiągnięto, stosując
sam glikokortykosteroid wziewny w małej dawce,
u większości chorych można zmienić dawkowanie
na raz dziennie
192,193
(
jakość danych A).

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
9
3. Jeżeli astma jest kontrolowana dzięki sto-
sowaniu
glikokortykosteroidu wziewnego
w połączeniu z długo działającym β
2
-mi-
metykiem, preferowanym postępowaniem jest
zmniejszanie dawki glikokortykosteroidu wziew-
nego o około 50% i utrzymanie dawki długo dzia-
łającego β
2
-mimetyku
150
(
jakość danych B).
Jeśli kontrola jest utrzymana, powinno się dalej
zmniejszać dawkę glikokortykosteroidu aż do ma-
łej, natomiast długo działający β
2
mimetyk moż-
na odstawić (
jakość danych D). Alternatywnym
postępowaniem jest dawkowanie leków tylko raz
dziennie.
194
Inną możliwość stanowi odstawienie
długo działającego β
2
mimetyku we wcześniej-
szym stopniu i zastąpienie leczenia skojarzonego
monoterapią glikokortykosteroidem wziewnym
w tej samej dawce, jaka była zawarta w inha-
latorze z dwoma lekami. Jednak u niektórych
chorych te alternatywne sposoby postępowania
prowadzą do utraty kontroli astmy
137,150
(
jakość
danych B).
4. Gdy astma jest kontrolowana dzięki sto-
sowaniu
glikokortykosteroidu wziewnego
w połączeniu z innym lekiem kontrolują-
cym niż długo działający β
2
-mimetyk, daw-
kę glikokortykosteroidu wziewnego powinno się
zmniejszyć o 50% aż do małej dawki, następnie
kończy się leczenie skojarzone w sposób opisany
powyżej (
jakość danych D).
5. Leczenie kontrolujące można zakoń-
czyć, jeśli astma pozostaje pod kontrolą przy
stosowaniu najmniejszej dawki leku kontrolują-
cego i objawy nie nawróciły przez rok (
jakość
danych D).
Intensyfikacja leczenia w odpowiedzi
na utratę kontroli astmy
Leczenie wymaga okresowego dostosowywania
w odpowiedzi na pogorszenie kontroli, które można
rozpoznać na podstawie nawrotu lub nasilenia się
objawów.
195
Istnieją następujące opcje leczenia:
1. Szybko działający β
2
-mimetyk o krót-
kim albo długim czasie działania. Powtarza-
nie dawki leku rozszerzającego oskrzela z tej gru-
py zapewnia przejściową poprawę do czasu znik-
nięcia przyczyny nasilenia objawów. Konieczność
takiego leczenia doraźnego przez więcej niż 1 lub
2 dni sygnalizuje potrzebę przeanalizowania i być
może zintensyfikowania leczenia kontrolującego.
2. Glikokortykosteroidy wziewne. Nie wy-
kazano, by przejściowe podwojenie dawki gliko-
kortykosteroidów wziewnych było skuteczne i nie
zaleca się już takiego postępowania
194,196
(
ja-
kość danych A). Wykazano, że u dorosłych cho-
rych z nagłym nasileniem objawów co najmniej
4krotne zwiększenie dawki glikokortykosteroidu
wziewnego jest równie skuteczne jak krótkotrwa-
łe leczenie glikokortykosteroidem doustnym
195
(
jakość danych A). Zwiększoną dawkę powinno
się stosować przez 7–14 dni, ale potrzeba dalszych
badań, zarówno u dorosłych, jak i u dzieci, w celu
wystandaryzowania tego postępowania.
3. Połączenie
glikokortykosteroidu
wziewnego z szybko i długo działającym β
2
-
-mimetykiem (np. formoterolem) w jednym
inhalatorze w celu jednoczesnego znosze-
nia objawów i uzyskania kontroli astmy.
Stosowanie szybko i długo działającego β
2
-mi-
metyku (formoterolu) z glikokortykosteroidem
wziewnym (budezonidem) w jednym inhalatorze,
zarówno w celu kontroli astmy, jak i doraźnego
znoszenia objawów, jest skuteczne w utrzymy-
waniu wysokiego poziomu kontroli astmy oraz
zmniejsza częstość zaostrzeń wymagających sto-
sowania glikokortykosteroidów ogólnoustrojowo
i hospitalizacji
111,156,157,197
(
jakość danych A).
Korzyści w postaci zapobiegania zaostrzeniom
wydają się konsekwencją interwencji na bardzo
wczesnym etapie zagrażającego zaostrzenia. Po-
nieważ badania, w których oceniano skutecz-
ność 2 lub 4krotnego zwiększenia dawek leków
z jednego inhalatora, gdy zaostrzenie już wystą-
piło (trwa ≥2 dni), wykazują pewne korzyści, ale
wyniki nie są zgodne.
195
Ponieważ nie ma badań,
w których stosowano by takie leczenie z użyciem
połączeń leków kontrolujących i leków doraźnych
innych niż budezonid z formoterolem, u chorych
otrzymujących inne leki kontrolujące zaleca się
alternatywne podejście opisane w tym rozdziale.
Takie postępowanie nie zostało przebadane i nie
jest zalecane u dzieci w wieku ≤5 lat.
4. Typowe leczenie nagłego zaostrzenia polega
na stosowaniu β
2
mimetyku w dużych dawkach
i glikokortykosteroidu podawanego doustnie lub
dożylnie (więcej informacji w podrozdziale „Skła-
dowa 4”).
Po leczeniu zaostrzenia astmy na ogół można
podjąć leczenie podtrzymujące na wcześniejszym
poziomie, chyba że zaostrzenie wiązało się ze stop-

WYTYCZNE
80
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
niową utratą kontroli choroby, co wskazuje na to,
iż leczenie przewlekłe było niedostateczne. W ta-
kim przypadku trzeba sprawdzić technikę inha-
lacji i stopniowo intensyfikować leczenie (zwięk-
szenie dawki lub liczby leków kontrolujących).
Astma trudna
U większości chorych na astmę można uzyskać
docelowy poziom kontroli (
ryc. 4.3-1), ale u nie-
których nie udaje się to pomimo najlepszego lecze-
nia.
104
U chorych, u których nie udało się uzyskać
akceptowalnego poziomu kontroli przy leczeniu
stopnia 4 (
leki doraźne w połączeniu z ≥2 le-
kami kontrolującymi), można rozpoznać astmę
trudną.
198
U takich chorych może występować
słaba wrażliwość na glikokortykosteroidy, dla-
tego wymagają oni większych dawek glikokorty-
kosteroidów wziewnych niż rutynowo stosowane
u chorych, których astma łatwo poddaje się kon-
troli. Obecnie nie ma jednak danych uzasadnia-
jących kontynuowanie stosowania glikokortyko-
steroidów wziewnych w dużych dawkach dłużej
niż przez 6 miesięcy w nadziei osiągnięcia lepszej
kontroli astmy. Należy raczej dążyć do optymali-
zacji dawkowania poprzez zmniejszenie dawek do
takich, które zapewniają utrzymanie maksymal-
nego poziomu kontroli.
Ponieważ tylko nieliczni chorzy są całkowicie
oporni na glikokortykosteroidy, leki te stanowią
podstawę leczenia astmy trudnej, natomiast moż-
na i trzeba rozważyć również dodatkowe badania
diagnostyczne i opcje terapeutyczne:
1. Należy potwierdzić rozpoznanie astmy.
W szczególności trzeba wykluczyć POChP, a tak
że wziąć pod uwagę dysfunkcję fałdów głosowych.
2. Należy oceniać i potwierdzać przestrzega-
nie zaleceń dotyczących leczenia. Nieprawidło-
we lub niewłaściwe przyjmowanie leków pozosta-
je najczęstszą przyczyną nieosiągnięcia kontroli
astmy.
3. Należy wziąć pod uwagę palenie tytoniu
obecnie lub w przeszłości i zachęcać do cał-
kowitego zaprzestania palenia. Palenie tytoniu
w przeszłości wiąże się z mniejszym prawdopo-
dobieństwem uzyskania pełnej kontroli astmy, co
jest tylko po części spowodowane utrwaloną ob-
turacją dróg oddechowych. Ponadto skuteczność
wziewnych i doustnych glikokortykosteroidów
u chorych nadal palących tytoń jest mniejsza.
199
Poradnictwo i programy ułatwiające zaprzestanie
palenia powinno się oferować wszystkim chorym
na astmę, którzy palą tytoń.
4. Należy poszukiwać chorób współistnie-
jących, które mogą nasilać astmę. U dużego
odsetka chorych z astmą trudną występuje prze-
wlekłe zapalenie zatok przynosowych, refluks żo-
łądkowoprzełykowy oraz otyłość lub zespół bez-
dechów podczas snu. Trzeba też brać pod uwagę
możliwość występowania zaburzeń psychicznych.
Jeśli się je stwierdzi, należy wdrożyć odpowiednie
leczenie, aczkolwiek nie potwierdzono, czy prowa-
dzi ono do poprawy kontroli astmy.
200
Gdy się rozważy powyższe przyczyny niesku-
teczności leczenia i podejmie odpowiednie kroki
zaradcze, może zaistnieć potrzeba przyjęcia kom-
promisowego poziomu kontroli i przedyskutowa-
nie go z pacjentem w celu uniknięcia daremnego,
zbyt intensywnego leczenia (i związanych z nim
kosztów oraz możliwości wystąpienia działań nie-
pożądanych). Celem jest więc minimalizacja czę-
stości zaostrzeń, potrzeby doraźnych interwencji
medycznych, a jednocześnie osiągnięcie możliwie
najwyższego poziomu kontroli klinicznej przy jak
najmniejszym zaburzeniu aktywności życiowej
i rzadko występujących objawach podmiotowym
w ciągu dnia. U tych chorych z astmą trudną ak-
ceptuje się częste stosowanie leków doraźnych,
jak również pewnego stopnia przewlekłe upośle-
dzenie czynności płuc.
Chociaż niższy poziom kontroli astmy na ogół
wiąże się z większym ryzykiem zaostrzeń, to nie
u wszystkich chorych z przewlekle upośledzoną
czynnością płuc, zmniejszoną aktywnością życio-
wą i objawami astmy w ciągu dnia zaostrzenia
występują częściej. U takich chorych powinno się
stosować leczenie na najniższym poziomie zapew-
niającym korzyści uzyskane dzięki stosowaniu
większych dawek leków. Intensywność leczenia
powinno się zmniejszać ostrożnie i powoli, w od-
stępach nie krótszych niż 3–6 miesięcy, ponieważ
efekt większych dawek leków może się utrzymy-
wać dłużej i stwarzać trudności w ocenie wpływu
redukcji dawek (
jakość danych D). Pomocne
może być skierowanie pacjenta do lekarza spe-
cjalizującego się w leczeniu astmy; chorzy mogą
też odnieść korzyść z określenia fenotypu choroby
(astma alergiczna, aspirynowa, z dominacją eozy-
nofilów).
201
U chorych na astmę alergiczną dobry

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
8
efekt może przynieść zastosowanie przeciwciał
anty-IgE,
183
a leki przeciwleukotrienowe mogą być
pomocne u chorych na astmą aspirynową (u któ-
rych często stwierdza się również eozynofilię)
172
.
Składowa 4: leczenie zaostrzeń astmy
Wprowadzenie
Zaostrzenia astmy (napady astmy) są epizoda-
mi narastającej duszności, kaszlu, świszczącego
oddechu lub uczucia ściskania w klatce piersio-
wej. Często występuje niewydolność oddechowa.
Zaostrzenia charakteryzują się zmniejszeniem
wydechowego przepływu powietrza, co można
określić ilościowo, mierząc PEF lub FEV
1
.
202
Pa-
rametry te są bardziej wiarygodnymi wskaźnika-
mi ciężkości ograniczenia przepływu powietrza
w drogach oddechowych niż nasilenie objawów.
Natomiast stopień nasilenia objawów może być
czulszym zwiastunem rozwijającego się zaostrze-
nia, ponieważ ich narastanie zazwyczaj poprzedza
zmniejszenie PEF.
203
Nieliczni chorzy nie odczu-
wają narastania objawów i mogą mieć znacznie
upośledzoną czynność płuc bez istotnej zmiany
w objawach. Sytuacja taka zdarza się zwłaszcza
u chorych na astmę o dużym zagrożeniu zgonem,
częściej u mężczyzn.
Strategie leczenia zaostrzeń, chociaż moż-
na je uogólnić, najlepiej adaptować i wdrażać na
poziomie lokalnym.
204,205
Ciężkie zaostrzenia
astmy stanowią potencjalne zagrożenie życia,
dlatego ich leczenie wymaga ścisłego nadzoru.
Chorym z ciężkimi zaostrzeniami powinno się
zalecić szybkie skontaktowanie się z lekarzem
lub – w zależności od organizacji lokalnej służby
zdrowia – udanie się do najbliższej przychodni
lub do szpitala zapewniającego leczenie doraźne.
Niezbędne jest ścisłe obiektywne monitorowanie
(PEF) odpowiedzi na leczenie.
Podstawę leczenia zaostrzeń astmy stanowią
– w kolejności stosowania, zależnie od ciężkości
zaostrzenia – powtarzane inhalacje szybko dzia-
łającego β
2
-mimetyku, wczesne zastosowanie gli-
kokortykosteroidów podawanych ogólnoustrojowo
oraz suplementacja tlenu.
202
Celem leczenia jest
jak najszybsze zniesienie ograniczenia przepływu
powietrza przez drogi oddechowe i hipoksemii
oraz zapobieganie nawrotom zaostrzeń.
Chorzy obciążeni dużym ryzykiem zgonu z po-
wodu astmy wymagają natychmiastowej opieki
i powinni szukać pilnej pomocy lekarskiej wcześ-
nie w przebiegu zaostrzenia. Do grupy tej zalicza
się chorych:
1) z przebytym zaostrzeniem astmy zagrażają-
cym życiu, które wymagało intubacji i wenty-
lacji mechanicznej
206
2) którzy byli hospitalizowani lub wymagali
pilnej interwencji lekarskiej z powodu astmy
w ostatnim roku
3) którzy stosują lub niedawno zaprzestali stoso-
wać glikokortykosteroidy doustne
4) którzy nie stosują obecnie glikokortykosteroi-
dów wziewnych
207
5) którzy wymagają częstego stosowania szybko
działającego β
2
mimetyku, zwłaszcza jeśli zu-
żywają miesięcznie więcej niż jedno opakowa-
nie salbutamolu (lub klinicznie równoważną
ilość innego leku)
208
Główne punkty
n
Zaostrzenia astmy (napady astmy) są epizodami
narastającej duszności, kaszlu, świszczącego od-
dechu lub uczucia ściskania w klatce piersiowej.
n
Zaostrzenia charakteryzują się zmniejszeniem
wydechowego przepływu powietrza, co można
określić ilościowo i monitorować, mierząc PEF lub
FEV
1
.
n
Podstawę leczenia zaostrzeń astmy stanowią po-
wtarzane inhalacje szybko działającego β
2
-mime-
tyku, wczesne zastosowanie glikokortykosteroi-
dów podawanych ogólnoustrojowo oraz suple-
mentacja tlenu.
n
Celem leczenia jest jak najszybsze zniesienie ogra-
niczenia przepływu powietrza przez drogi odde-
chowe i hipoksemii oraz zapobieganie nawrotom
zaostrzeń.
n
Ciężkie zaostrzenia astmy stanowią potencjalne
zagrożenie życia, a ich leczenie wymaga ścisłego
nadzoru. Większość chorych z ciężkim zaostrze-
niem astmy powinno się leczyć na oddziałach in-
tensywnej terapii. Chorzy obciążeni dużym ryzy-
kiem zgonu z powodu astmy również wymagają
większej uwagi.
n
Lżejsze zaostrzenia, definiowane jako zmniejsze-
nie PEF o <20%, przebudzenia w nocy z powodu
astmy i zwiększenie zużycia krótko działających β
2
-
-mimetyków, zwykle można leczyć ambulatoryjnie.

WYTYCZNE
82
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
6) z chorobą psychiczną lub problemami psy-
chospołecznymi w wywiadzie, w tym chorych
przyjmujących leki sedatywne
209
7) nieprzestrzegających planu leczenia astmy.
Uzyskanie odpowiedzi na leczenie może po-
trwać. Chorego należy ściśle monitorować, używa-
jąc do tego celu zarówno wskaźników klinicznych,
jak i obiektywnych parametrów. Zintensyfikowa-
ne leczenie powinno się kontynuować do czasu, aż
wskaźniki czynności płuc (PEF lub FEV
1
) powró-
cą do poprzednich najlepszych (idealnie) wartości
lub osiągną plateau; wówczas można podjąć decy-
zję o przyjęciu chorego do szpitala lub wypisaniu
go do domu. Chorzy, których można bezpiecznie
wypisać do domu, odpowiedzą na leczenie w cią-
gu pierwszych 2 godzin; wówczas można podjąć
decyzję co do dalszego postępowania.
Ocena ciężkości zaostrzenia
Ciężkość zaostrzenia (
ryc. 4.4-1) determinuje
leczenie. Podczas leczenia trzeba monitorować
wskaźniki ciężkości, szczególnie PEF (u cho-
rych po 5. rż.), częstotliwość tętna, częstość od-
dechów i wysycenie hemoglobiny krwi tętniczej
tlenem (SaO
2
, mierzone za pomocą pulsoksyme-
tru).
187,210
Postępowanie w warunkach
ambulatoryjnych
Większość chorych z ciężkim zaostrzeniem astmy
powinno się leczyć w warunkach szpitalnych (np.
na oddziale pomocy doraźnej), gdzie możliwe jest
monitorowanie, w tym obiektywne pomiary obtu-
racji dróg oddechowych, SaO
2
i czynności serca.
Lżejsze zaostrzenia – zmniejszenie PEF o <20%,
przebudzenia w nocy z powodu astmy i zwięk-
szenie zużycia krótko działających β
2
-mimety-
ków – zwykle można leczyć ambulatoryjnie. Jeśli
chory odpowiada na zintensyfikowanie leczenia
wziewnym lekiem rozszerzającym oskrzela po kil-
ku pierwszych dawkach, skierowanie do szpitala
nie jest konieczne, ale dalsze leczenie pod nadzo-
rem lekarza podstawowej opieki zdrowotnej może
obejmować stosowanie glikokortykosteroidów po-
dawanych ogólnoustrojowo. Powinno się również
przeprowadzić edukację chorego i przeanalizować
stosowane leczenie przewlekłe.
Leczenie
Leki rozszerzające oskrzela
W przypadku lekkiego lub umiarkowanego zaost-
rzenia powtarzane inhalacje szybko działającego
β
2
mimetyku (2–4 dawek inhalowanych co 20 mi-
nut w ciągu pierwszej godziny) jest zwykle naj-
skuteczniejszym i najbardziej opłacalnym sposo-
bem zniesienia ograniczenia przepływu powietrza
w drogach oddechowych. Po pierwszej godzinie
konieczna dawka β
2
mimetyku zależy od ciężko-
ści zaostrzenia. W lekkich zaostrzeniach wystar-
czą 2–4 dawek inhalowanych co 3 lub 4 godziny;
umiarkowane zaostrzenie wymaga 6–10 dawek co
1–2 godzin. Intensywność leczenia powinno się
zmniejszać w zależności od indywidualnej odpo-
wiedzi chorego; jeśli pacjent nie odpowiada na le-
czenie lub istnieją obawy co do tego, jak zareaguje
– powinien zostać skierowany do szpitala.
Wielu chorych jest w stanie monitorować PEF
samodzielnie po rozpoczęciu zintensyfikowane-
go leczenia rozszerzającego oskrzela. Stosowanie
leku rozszerzającego oskrzela z ciśnieniowego in-
halatora z dozownikiem (MDI), najlepiej ze spej-
serem, powoduje przynajmniej taką samą popra-
wę czynności płuc, jak podawanie takiej samej
dawki leku z nebulizatora.
164,211
W warunkach
gabinetu lekarskiego ta droga dostarczania leku
jest najbardziej opłacalna,
212
pod warunkiem że
pacjent jest w stanie używać MDI. Nie ma potrze-
by stosowania dodatkowych leków, jeśli szybko
działający β
2
mimetyk wziewny powoduje pełną
odpowiedź (PEF wynosi ≥80% wartości należ-
nej lub maksymalnej dla chorego), a odpowiedź
utrzymuje się przez 3–4 godzin.
Glikokortykosteroidy
W leczeniu zaostrzeń astmy powinno się stosować
glikokortykosteroidy doustne (prednizolon 0,5–1
mg/kg/d lub inny glikokortykosteroid w równo-
ważnej dawce), zwłaszcza jeśli zaostrzenie roz-
wija się pomimo rozpoczęcia innego krótkotermi-
nowego leczenia zalecanego w przypadku utraty
kontroli astmy (p. „Intensyfikacja leczenia w od-
powiedzi na utratę kontroli astmy” w podrozdzia-
le „Składowa 3”). Jeśli chory nie odpowiada na
leczenie rozszerzające oskrzela, o czym świadczy
utrzymująca się obturacja dróg oddechowych, za-
leca się szybkie przekazanie chorego do szpitala,
zwłaszcza jeśli należy do grupy dużego ryzyka.

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
8
Ryc. 4.4-1. Klasyfikacja ciężkości zaostrzeń astmy
a
Zaostrzenie
lekkie
umiarkowane
ciężkie
zagrażające zatrzymanie
oddychania
duszność
przy chodzeniu
chory może się położyć
przy mówieniu
niemowlę – płacz cichy,
krótki, trudności
w karmieniu
chory najczęściej siedzi
w spoczynku
niemowę przestaje
jeść
chory przygarbiony,
podparty na rękach
mowa
całymi zdaniami
fragmentami zdań
pojedynczymi
słowami
świadomość
może być pobudzony
zwykle pobudzony
zwykle pobudzony
senny lub splątany
częstość oddechu
zwiększona
zwiększona
>30/min
prawidłowa częstość oddechu u dzieci
wiek
<2 miesięcy
2–12 miesięcy
1–5 lat
6–8 lat
prawidłowa częstość
<60/min
<50/min
<40/min
<30/min
praca dodatkowych
mięśni
oddechowych
i zaciąganie dołka
nadmostkowego
zwykle nie występuje
zwykle występuje
zwykle występuje
paradoksalne ruchy
oddechowe
świsty
umiarkowane, często
tylko pod koniec
wydechu
głośne
zazwyczaj głośne
nie występują
tętno
<100/min
100–120/min
>120/min
bradykardia
prawidłowa częstotliwość rytmu serca u dzieci
2–12 miesięcy
1–2 lat
2–8 lat
<160/min
<120/min
<110/min
tętno paradoksalne
nie występuje
(<10 mm Hg)
może występować
10–25 mm Hg
często
>25 mm Hg
(dorosły); 20–40
mm Hg (dziecko)
brak tętna wskazuje
na zmęczenie mięśni
oddechowych
PEF po wstępnej
dawce leku
rozkurczającego
oskrzela (% wn.
lub wm.)
>80%
60–80%
<60% (<100 l/min
u osoby dorosłej)
lub efekt utrzymuje
się <2 h
PaO
2
(przy
oddychaniu
powietrzem)
lub PaCO
2
prawidłowe; zwykle
badanie to nie jest
konieczne
<45 mm Hg
>60 mm Hg
<45 mm Hg
<60 mm Hg możliwa
sinica
>45 mm Hg; możliwa
niewydolność
oddechowa (p. tekst)
SaO
2
(przy
oddychaniu
powietrzem)
>95%
91–95%
<90%
hiperkapnia (hipowentylacja) rozwija się szybciej u małych dzieci niż u młodzieży i dorosłych
a
Na stopień ciężkości zaostrzenia wskazuje obecność kilku, ale niekoniecznie wszystkich wymienionych parametrów.

WYTYCZNE
8
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Postępowanie na oddziale pomocy
doraźnej
Ciężkie zaostrzenia astmy zagrażają życiu, dla-
tego zwykle najbezpieczniej jest leczyć je na od-
dziale pomocy doraźnej.
Rycina 4.4-2 pokazuje
postępowanie w zaostrzeniach astmy w szpitalu.
Ocena
Rozpoczynając leczenie, należy równocześnie
zebrać krótki wywiad i przeprowadzić badanie
przedmiotowe ukierunkowane na objawy zaost-
rzenia astmy.
Wywiad powinien obejmować: ciężkość obja-
wów, w tym ograniczenie aktywności fizycznej
i zaburzenia snu; aktualnie stosowane leczenie,
w tym dawki leków (i typy urządzeń do inhala-
cji), zwykle stosowane dawki, dawki stosowane
w razie zaostrzenia i odpowiedź chorego (lub jej
brak) na leczenie; czas wystąpienia i przyczynę
aktualnego zaostrzenia; czynniki ryzyka zgonu
z powodu astmy.
W badaniu przedmiotowym powinno się oce-
nić ciężkość zaostrzenia (na podstawie zdolności
chorego do mówienia całymi zdaniami, często-
tliwości tętna, częstości oddechów, pracy dodat-
kowych mięśni oddechowych i innych objawów
wyszczególnionych na
rycinie 4.4-2. Należy
rozpoznać wszelkie czynniki wikłające (np. zapa-
lenie płuc, niedodmę, odmę opłucnową lub odmę
śródpiersiową).
Zdecydowanie zaleca się ocenę czynności płuc
na podstawie PEF lub FEV
1
i wysycenia hemo-
globiny krwi tętniczej tlenem, ponieważ samo
badanie przedmiotowe może nie ujawnić w pełni
ciężkości zaostrzenia, szczególnie stopnia hipo-
ksemii.
213,214
Wyjściowe pomiary PEF lub FEV
1
należy wykonać przed rozpoczęciem leczenia, je-
śli jest to możliwe bez jego opóźnienia. Następnie
powinno się wykonywać pomiary seryjne co pe-
wien czas, aż do uzyskania wyraźnej odpowiedzi
na leczenie.
Należy ściśle monitorować wysycenie hemo-
globiny krwi tętniczej tlenem (SaO
2
), najlepiej za
pomocą pulsoksymetru. Jest to przydatne zwłasz-
cza u dzieci, u których trudno w inny sposób
obiektywnie ocenić czynność płuc. U dzieci SaO
2
powinno wynosić >95%, a wartość <92% jest do-
brym predyktorem konieczności hospitalizacji
210
(
jakość danych C).
U dorosłych nie zaleca się wykonywania ra-
diogramu klatki piersiowej rutynowo, lecz tylko
w sytuacji, gdy się podejrzewa powikłania serco-
wopłucne, u chorych wymagających hospitaliza-
cji, a także w przypadku braku odpowiedzi na le-
czenie u chorego, u którego kliniczne rozpoznanie
odmy opłucnowej może być trudne.
215
Podobnie
u dzieci nie zaleca się wykonywania radiogramu
klatki piersiowej rutynowo, chyba że na podsta-
wie objawów przedmiotowych podejrzewa się cho-
robę miąższu płucnego.
216
Nie zaleca się rutynowego wykonywania ga-
zometrii krwi tętniczej,
216
natomiast należy ją
wykonać u chorych z PEF w przedziale 30–50%
wartości należnej i u chorych bez poprawy po po-
czątkowym leczeniu. Nie należy przerywać poda-
wania tlenu na czas badania. PaO
2
<60 mm Hg
(8 kPa) i prawidłowe lub zwiększone PaCO
2
(zwłaszcza >45 mm Hg [6 kPa]) wskazują na nie-
wydolność oddechową lub ryzyko jej wystąpienia.
Leczenie
Leki wymienione poniżej stosuje się zwykle rów-
nocześnie, aby jak najszybciej opanować zaostrze-
nie astmy.
217
Tlen
W celu osiągnięcia SaO
2
≥90% (u dzieci ≥95%) tlen
podaje się przez kaniule donosowe, przez maskę
lub (rzadko) u niektórych niemowląt przez budkę
tlenową. PaCO
2
może się pogorszyć u niektórych
chorych oddychających 100% tlenem, zwłaszcza
z cięższą obturacją oskrzeli.
218
Zaleca się poda-
wanie tlenu pod kontrolą pulsoksymetrii w celu
osiągnięcia odpowiedniego SaO
2
.
219
Szybko działające
β
2
-mimetyki wziewne
Szybko działające β
2
-mimetyki wziewne powinno
się podawać w regularnych odstępach czasu
220222
(
jakość danych A). Większość leków z tej gru-
py działa krótko, natomiast formoterol – szybko
i długo; wykazano, że jest równie skuteczny przy
podobnej częstości skutków ubocznych, ale jest
znacznie droższy.
148
Takie działanie formoterolu
uzasadnia jego stosowanie w połączeniu z budezo-
nidem wcześnie w przebiegu zaostrzenia astmy
i uspokaja co do bezpieczeństwa leczenia.
W badaniach porównujących lewabuterol z ra-
cemicznym albuterolem (salbutamolem) zarówno
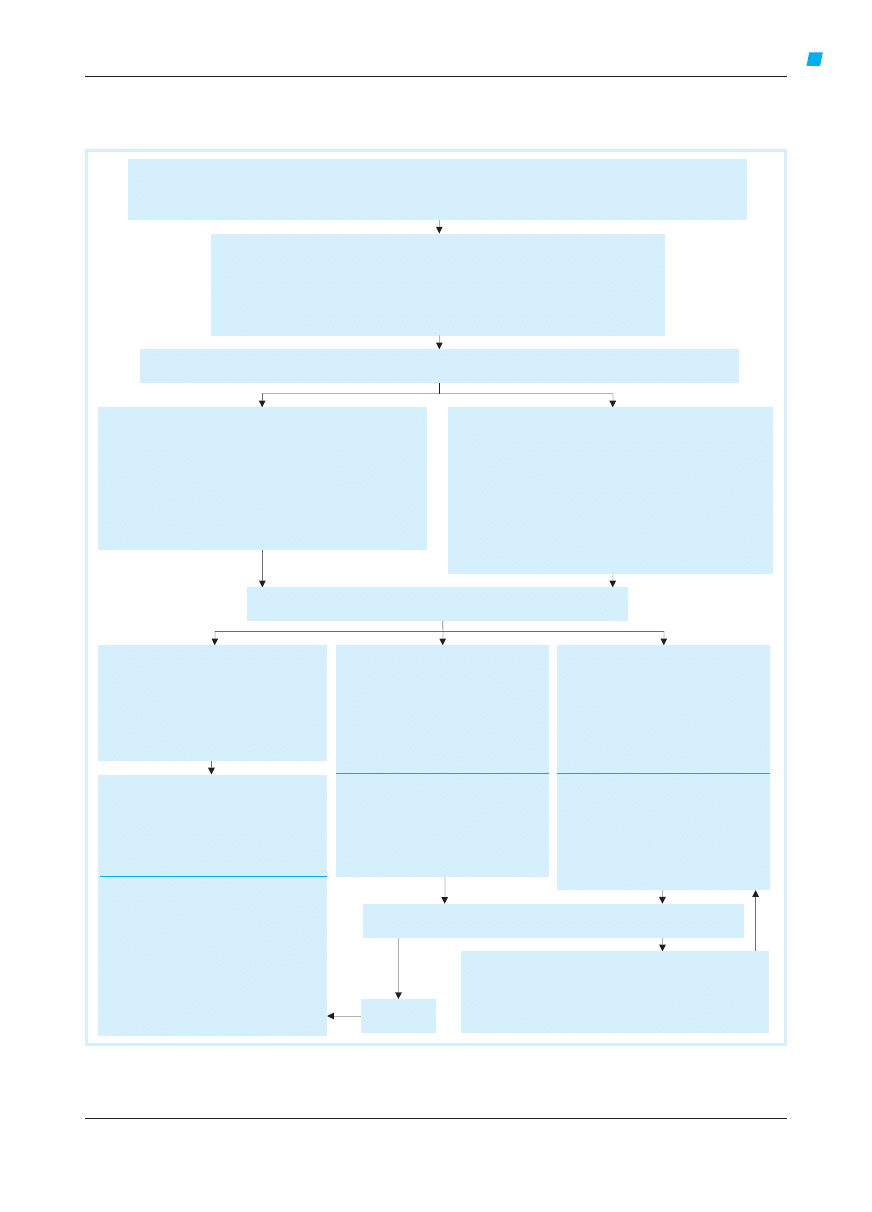
WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
8
wstępna ocena (p. ryc. 4.4-1)
wywiady i badanie przedmiotowe (zmiany osłuchowe, praca dodatkowych mięśni oddechowych, częstotliwość
rytmu serca i oddychania, PEF lub FEV
1
, SaO
2
, gazometria krwi tętniczej u chorych w ciężkim stanie)
leczenie wstępne
– tlen w celu uzyskania SaO
2
≥90% (95% u dzieci)
– szybko działający
β
2
-mimetyk wziewny, w ciągłej nebulizacji przez 1 h
– GKS podawany ogólnoustrojowo, jeżeli nie ma natychmiastowej odpowiedzi
lub chory ostatnio przyjmował GKS p.o., lub zaostrzenie jest ciężkie
– w leczeniu zaostrzeń przeciwwskazane jest stosowanie leków sedatywnych
ponownie oceń stan chorego po 1 h (badanie przedmiotowe, PEF, SaO
2
, inne badania w razie potrzeby)
ponownie oceń stan chorego po 1–2 h
regularna kontrola stanu chorego
poprawa
kryteria napadu umiarkowanego
– PEF 60–80% wn. lub wm.
– badanie przedmiotowe: objawy umiarkowane,
praca dodatkowych mięśni oddechowych
leczenie
– tlen
– inhalacje
β
2
-mimetyku i LPCh co 60 min
– GKS p.o.
– kontynuuj leczenie przez 1–3 h, o ile jest poprawa
dobra odpowiedź w ciągu 1–2 h
– odpowiedź utrzymuje się 60 min
po ostatniej dawce leków
– badanie przedmiotowe prawidłowe,
chory czuje się dobrze
– PEF >70%
– SaO
2
>90% (95% u dzieci)
słaba odpowiedź (p. wyżej)
– przyjąć na OIOM
niecałkowita odpowiedź w ciągu 6–12 h (p. wyżej)
– rozważ przyjęcie na OIOM, jeśli nie ma poprawy
w ciągu 6–12 h
kryteria napadu ciężkiego
– chory należy do grupy dużego ryzyka
– PEF <60 wn. lub wm.
– badanie przedmiotowe: nasilone objawy w spoczynku,
zaciąganie międzyżebrzy
– nie ma poprawy po wstępnym leczeniu
leczenie
– tlen
– inhalacje
β
2
-mimetyku i LPCh
– GKS podawany ogólnoustrojowo
– magnez i.v.
niecałkowita odpowiedź
w ciągu 1–2 h
– czynniki ryzyka astmy
zagrażającej życiu
– badanie przedmiotowe: objawy
lekkie lub umiarkowane
– PEF <60%
– nie ma poprawy SaO
2
przyjąć na oddział szpitalny
– tlen
– inhalacje
β
2
-mimetyku
± LPCh
– GKS podawany ogólnoustrojowo
– magnez i.v.
– monitoruj PEF, SaO
2
, tętno
słaba odpowiedź w ciągu 1–2 h
– czynniki ryzyka astmy
zagrażającej życiu
– badanie przedmiotowe: objawy
ciężkie, senność, splątanie
– PEF <30%
– PCO
2
>45 mm Hg
– PO
2
<60 mm Hg
przyjąć na OIOM
– tlen
– inhalacje
β
2
-mimetyku
± LPCh
– GKS i.v.
– rozważ podanie
β
2
-mimetyku i.v.
– rozważ podanie teofiliny i.v.
– ew. intubacja i sztuczna wentylacja
poprawa: kryteria pozwalające
na wypisanie do domu
– PEF >60% wn. lub wm. i utrzymuje
się na tym poziomie podczas
stosowania leków doustnych lub
wziewnych
leczenie w domu
– kontynuować leczenie
β
2
-mimetykiem wziewnym
– w większości przypadków rozważyć
podanie GKS p.o.
– rozważyć stosowanie leków
z jednego inhalatora
– edukacja chorego: prawidłowe
przyjmowanie leków,
przeanalizowanie planu działania,
regularne badania kontrolne
Ryc. 4.4-2. Zaostrzenia astmy – postępowanie w szpitalu. GKS – glikokortykosteroid, LPCh – lek przeciwcholinergicz-
ny, OIOM – oddział intensywnej opieki medycznej, wm. – wartość maksymalna, wn. – wartość należna

WYTYCZNE
86
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
u dorosłych, jak i u dzieci z zaostrzeniem ast
my
223226
wykazano nieco większy efekt broncho-
dylatacyjny tego pierwszego leku. W dużym ba-
daniu przeprowadzonym u dzieci z zaostrzeniem
astmy
227
i w innym badaniu z udziałem dorosłych
nieleczonych wcześniej glikokortykosteroidami
226
leczenie lewabuterolem w porównaniu z leczeniem
racemicznym salbutamolem, powodowało zmniej-
szenie częstości hospitalizacji, ale czas trwania
hospitalizacji dzieci się nie skrócił
227
.
Wyniki badań, w których porównywano sto-
sowanie β
2
mimetyków w nebulizacji ciągłej lub
przerywanej u chorych z zaostrzeniem astmy, są
sprzeczne. W przeglądzie systematycznym 6 ba-
dań nie stwierdzono znamiennych różnic w roz-
szerzeniu oskrzeli i częstości hospitalizacji między
tymi dwoma sposobami leczenia.
228
Natomiast
u chorych przyjętych do szpitala wykazano w 1 ba
daniu,
229
że stosowanie β-mimetyków w razie po-
trzeby wiązało się ze znamiennie krótszym cza-
sem hospitalizacji, mniejszym zapotrzebowaniem
na stosowanie leków w nebulizacji i rzadszym wy-
stępowaniem kołatania serca, w porównaniu z re-
gularnym inhalowaniem leku co 4 godziny. Ra-
cjonalne podejście do leczenia wziewnego w czasie
zaostrzeń astmy polegałoby więc początkowo na
ciągłej inhalacji leku, a po przyjęciu do szpitala
– na podawaniu β
2
mimetyku doraźnie, w razie
potrzeby. Nie ma danych przemawiających za do-
żylnym stosowaniem β
2
-mimetyków u chorych
z ciężkim zaostrzeniem astmy.
230
Adrenalina
Podskórne lub domięśniowe wstrzyknięcia adre-
naliny mogą być wskazane w leczeniu anafilaksji
i obrzęku naczynioruchowego, ale nie powinno się
jej stosować rutynowo w zaostrzeniach astmy.
Dodatkowe leki rozszerzające oskrzela
Bromek ipratropium. Połączenie w nebulizacji
β
2
-mimetyku z lekiem przeciwcholinergicznym
(bromkiem ipratropium) może spowodować więk-
sze rozszerzenie oskrzeli niż tylko jeden z tych
leków
231
(
jakość danych B); takie leczenie po-
winno się zastosować, zanim się rozważy użycie
metyloksantyn. Wyniki badań wskazują, że lecze-
nie skojarzone wiąże się z mniejszą częstością ho-
spitalizacji
212,232,233
(
jakość danych A) i więk-
szą poprawą PEF i FEV
1
233
(
jakość danych B).
Podobne dane opublikowano w piśmiennictwie
pediatrycznym
212
(
jakość danych A). Jednak
u dzieci przyjętych do szpitala po leczeniu na od-
dziale pomocy doraźnej dołączenie bromku ipra-
tropium w nebulizacji do β
2
-mimetyku w nebuli-
zacji i glikokortykosteroidu stosowanego ogólno-
ustrojowo nie przynosi dodatkowych korzyści.
234
Teofilina. Wobec skuteczności i względnego
bezpieczeństwa stosowania szybko działających
β
2
mimetyków teofilina odgrywa niewielką rolę
w leczeniu zaostrzeń astmy.
235
Stosowanie tego
leku wiąże się z poważnymi i niekiedy śmiertel-
nymi skutkami ubocznymi, szczególnie u cho-
rych przyjmujących przewlekle teofilinę w po-
staci o przedłużonym uwalnianiu, a rozszerzenie
oskrzeli w wyniku działania teofiliny jest u nich
mniejsze niż po przyjęciu β
2
mimetyku. Korzyści
z dodania teofiliny do stosowanego leczenia u do-
rosłych z ciężkim zaostrzeniem astmy nie zostały
wykazane. Natomiast w jednym badaniu u dzieci
z astmą zagrażającą życiu, leczonych intensywnie
β
2
mimetykiem wziewnym i dożylnym, bromkiem
ipratropium podawanym wziewnie oraz glikokor-
tykosteroidem dożylnym, dożylne podawanie me-
tyloksantyny przyniosło dodatkową korzyść.
236
Glikokortykosteroidy stosowane
ogólnoustrojowo
Glikokortykosteroidy stosowane ogólnoustrojowo
przyśpieszają ustąpienie zaostrzenia, dlatego po-
winno się je stosować we wszystkich zaostrze-
niach poza najlżejszymi
237,238
(
jakość danych
A), zwłaszcza gdy:
1) leczenie początkowe szybko działającym β
2
-mi-
metykiem wziewnym nie spowodowało trwałej
poprawy;
2) zaostrzenie rozwinęło się, mimo że chory przyj-
mował glikokortykosteroidy doustnie;
3) podczas poprzednich zaostrzeń chory wymagał
doustnego stosowania glikokortykosteroidów.
Glikokortykosteroidy podawane doustnie są
zazwyczaj tak samo skuteczne jak podawane do-
żylnie, a drogę doustną preferuje się ze względu
na mniejszą inwazyjność i niższy koszt.
239,240
Jeśli wkrótce po doustnym podaniu glikokorty-
kosteroidu u chorego wystąpiły wymioty, należy
jeszcze raz podać równoważną dawkę dożylnie.
U chorych wypisanych z oddziału pomocy do-
raźnej do domu można rozważyć domięśniowe
wstrzyknięcie glikokortykosteroidów,
241
zwłasz-
cza jeśli istnieją obawy, że chory nie będzie prze-
strzegał doustnego przyjmowania leku.

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
8
Poprawy klinicznej można oczekiwać po co
najmniej 4 godzinach od doustnego podania gli-
kokortykosteroidów. Dla chorych hospitalizowa-
nych odpowiednie są dawki dobowe glikokorty-
kosteroidów podawanych ogólnoustrojowo rów
noważne 60–80 mg metyloprednizolonu (w jednej
dawce na dobę) lub 300–400 mg hydrokortyzonu
(w dawkach podzielonych), a w większości przy-
padków prawdopodobnie wystarcza 40 mg mety-
loprednizolonu lub 200 mg hydrokortyzonu
238,242
(
jakość danych B). U dzieci z astmą przewlekłą
lekką, zgłaszających się z zaostrzeniem choroby
odpowiednie będzie zastosowanie glikokortyko-
steroidu doustnie w dawce 1 mg/kg/d.
243
U do-
rosłych leczenie przez 7 dni okazało się równie
skuteczne jak terapia 14dniowa,
244
natomiast
u dzieci za wystarczające uznaje się zazwyczaj
leczenie przez 3–5dni (
jakość danych B). Do-
stępne dane wskazują, że nie ma korzyści ze stop-
niowego zmniejszania dawki doustnego glikokor-
tykosteroidu ani w krótkim czasie,
245
ani w ciągu
kilku tygodni
246
(
jakość danych B).
Glikokortykosteroidy wziewne
Glikokortykosteroidy wziewne są skuteczne w le-
czeniu zaostrzeń astmy. W jednym badaniu stoso-
wanie w zaostrzeniu astmy glikokortykosteroidu
wziewnego w dużej dawce w połączeniu z salbuta-
molem powodowało większe rozszerzenie oskrzeli
niż sam salbutamol
247
(
jakość danych B) i przy-
nosiło większe korzyści niż dodanie glikokortyko-
steroidu podawanego ogólnoustrojowo w zakresie
wszystkich parametrów, w tym hospitalizacji,
zwłaszcza u chorych z cięższymi zaostrzeniami
astmy
248
.
Glikokortykosteroidy wziewne mogą być tak
samo skuteczne, jak glikokortykosteroidy doust-
ne w zapobieganiu nawrotom zaostrzeń.
249,250
U chorych wypisanych z oddziału pomocy doraź-
nej do domu z zaleceniem stosowania prednizo-
nu i budezonidu wziewnego częstość nawrotów
jest mniejsza niż u chorych otrzymujących tylko
prednizon
237
(
jakość danych B). Częstość na-
wrotów przy stosowaniu glikokortykosteroidów
wziewnych w dużych dawkach (2,4 mg budezoni-
du w 4 dawkach podzielonych) jest podobna jak
przy stosowaniu prednizonu doustnie w dawce
40 mg dziennie
251
(
jakość danych A). Koszt
jest istotnym czynnikiem determinującym sto-
sowanie glikokortykosteroidów wziewnych w tak
dużych dawkach i konieczne są dalsze badania
w celu udokumentowania korzyści z takiego le-
czenia, zwłaszcza opłacalności w zaostrzeniach
astmy.
252
Magnez
Nie zaleca się rutynowego stosowania dożylnego
siarczanu magnezu (zwykle pojedynczy wlew 2 g
w ciągu 20 min) w zaostrzeniach astmy, ale nie-
których chorych lek ten może uchronić przed ko-
niecznością przyjęcia do szpitala; do tej grupy nale-
żą: dorośli z FEV
1
25–30% wartości należnej przy
przyjęciu, dorośli i dzieci nieodpowiadający na le
czenie początkowe oraz dzieci, u których FEV
1
nie wzrasta >60% wartości należnej po pierwszej
godzinie leczenia
253,254
(
jakość danych A). Sal-
butamol w nebulizacji z izotonicznym roztworem
siarczanu magnezu przynosi większe korzyści
niż w nebulizacji z 0,9% roztworem NaCl
255,256
(
jakość danych A). Nie przeprowadzono badań
nad zastosowaniem dożylnego siarczanu magne-
zu u małych dzieci.
Leczenie mieszaniną helu i tlenu
Systematyczny przegląd badań, w których oce-
niano efekty stosowania mieszaniny helu i tlenu,
w porównaniu z samym helem, wykazał, że ruty-
nowe stosowanie takiej interwencji nie jest uza-
sadnione. Można ją rozważyć u chorych, którzy
nie odpowiadają na leczenie standardowe.
257
Leki przeciwleukotrienowe
Dane, z których można by wnioskować o roli le-
ków przeciwleukotrienowych w leczeniu zaost-
rzeń astmy, są skąpe.
258
Leki sedatywne
Stosowanie leków sedatywnych w leczeniu zaost-
rzeń astmy jest przeciwwskazane z powodu ich
działania depresyjnego na ośrodek oddechowy.
Badania wykazały związek między stosowaniem
tych leków i zgonami chorych na astmę.
209,259

WYTYCZNE
88
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Wskazania do hospitalizacji lub wypisania
chorego z oddziału pomocy doraźnej
do domu
Kryteria wypisania chorego z oddziału pomocy
doraźnej do domu albo przyjęcia do szpitala zosta-
ły zwięźle omówione i ustalone na drodze uzgod-
nień.
260
Chorzy, u których przed leczeniem FEV
1
lub PEF wynosi <25% wartości należnej lub mak-
symalnej oraz chorzy, u których po leczeniu FEV
1
lub PEF wynosi <40% wartości należnej lub mak-
symalnej – na ogół wymagają hospitalizacji. Cho-
rych z FEV
1
lub PEF w granicach 40–60% warto-
ści należnej lub maksymalnej można wypisać do
domu, jeśli w miejscu zamieszkania chorego jest
możliwość kontroli jego stanu i ma się pewność,
że będzie on przestrzegał zaleceń. Chorych z FEV
1
lub PEF ≥60% wartości należnej lub maksymalnej
na ogół można zwolnić do domu.
Leczenie zaostrzenia astmy na oddziale inten-
sywnej terapii wykracza poza ramy tego doku-
mentu; czytelników odsyłamy do ostatnio opubli-
kowanych wyczerpujących artykułów przeglądo-
wych.
261
Przy wypisywaniu chorego z oddziału pomocy
doraźnej do domu zaleca się następujące działa-
nia:
1) Zalecić przyjmowanie doustnego glikokortyko-
staroidu co najmniej przez 7 dni u dorosłych
lub przez 3–5 dni u dzieci oraz kontynuację le-
czenia rozszerzającego oskrzela.
2) Lek rozszerzający oskrzela można stosować
doraźnie w razie potrzeby, obserwując popra-
wę zarówno w zakresie objawów, jak i obiek-
tywnych wskaźników czynności płuc, aż do
osiągnięcia zużycia szybko działającego β
2
-mi-
metyku wziewnego sprzed zaostrzenia.
3) Zalecić szybkie odstawienie bromku ipratro-
pium, gdyż nie wykazano korzyści z jego stoso-
wania poza początkowym okresem leczenia.
4) Zalecić kontynuację lub rozpoczęcie stosowa-
nia glikokortykosteroidów wziewnych.
5) Sprawdzić technikę wykonywania przez chore-
go inhalacji leków i pomiarów PEF pod kątem
możliwości monitorowania choroby w domu.
Chorzy wypisani z oddziału pomocy doraźnej
osiągają lepsze wyniki leczenia, jeśli otrzyma-
ją miernik PEF i pisemny plan postępowania,
w porównaniu z chorymi bez tych pomocy.
8
6) Zidentyfikować czynniki, które wywołały za-
ostrzenie i wdrożyć postępowanie mające na
celu ich unikanie.
7) Ocenić reakcję chorego na zaostrzenie. Po-
winno się przeanalizować dotychczasowy plan
działania i zaopatrzyć chorego we wskazówki
na piśmie.
8) Przeanalizować leczenie przeciwzapalne w cza-
sie zaostrzenia: czy od razu zwiększono daw-
kowanie, a jeśli pomimo wskazań nie zastoso-
wano glikokortykosteroidów ogólnoustrojowo,
to dlaczego. Rozważyć zaopatrzenie chorego
w glikokortykosteroid doustny na wypadek
kolejnego zaostrzenia.
9) Chorego lub jego rodzinę powinno się poinfor-
mować o konieczności skontaktowania się z le-
karzem rodzinnym lub specjalistą w leczeniu
astmy w ciągu 24 godzin i umówienia na wi-
zytę kontrolną w ciągu kilku dni od wypisania
z oddziału pomocy doraźnej w celu zapewnie-
nia kontynuacji leczenia aż do osiągnięcia wyj-
ściowych parametrów kontroli astmy, w tym
najlepszych wartości parametrów czynności
płuc. Dane z badań prospektywnych wskazują,
że chorzy wypisani z oddziału pomocy doraź-
nej ze skierowaniem do specjalisty w leczeniu
astmy osiągają lepsze wyniki kontroli choroby
niż chorzy wracający pod opiekę lekarzy pod-
stawowej opieki zdrowotnej.
262
Ciężkie zaostrzenia wymagające hospitalizacji
mogą świadczyć o niepowodzeniu planu samo-
dzielnego postępowania pacjenta. Chorzy przyj-
mowani do szpitala mogą być szczególnie skłonni
do słuchania informacji i porad dotyczących ich
choroby. Pracownicy opieki zdrowotnej powinni
wykorzystać tę okazję do sprawdzenia, czy pacjent
rozumie przyczyny zaostrzeń astmy, konieczność
i sposoby unikania czynników wywołujących za-
ostrzenia (w tym niepalenie tytoniu, jeśli dotyczy
to pacjenta), cele leczenia i właściwe stosowanie
leków oraz działania, jakie powinien podjąć w ra-
zie nasilenia objawów lub zmniejszenia PEF
263
(
jakość danych A).
Dla chorych hospitalizowanych należy rozwa-
żyć konsultację specjalistyczną. Po wypisaniu ze
szpitala, gdzie chory był pod ciągłym nadzorem,
powinien być regularnie badany przez następne
tygodnie przez lekarza podstawowej opieki zdro-
wotnej lub specjalistę, do czasu aż wartości pa-
rametrów czynności płuc powrócą do maksymal-

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
89
nych dla chorego. Wprowadzenie bodźców moty-
wacyjnych przynosi poprawę w zakresie wizyt
kontrolnych w podstawowej opiece zdrowotnej,
ale nie wykazano korzystnego wpływu na odległe
wyniki leczenia.
264
Chorzy z zaostrzeniem astmy,
którzy trafili na oddział pomocy doraźnej, stano-
wią grupę, która szczególnie powinna być objęta
programem edukacji w astmie, jeśli taki program
jest dostępny.
Składowa 5: sytuacje szczególne
Specjalnego omówienia wymaga leczenie astmy
w następujących sytuacjach: ciąża, operacja, nie-
żyt nosa i zatok przynosowych oraz polipy nosa,
astma zawodowa, zakażenia układu oddechowe-
go, refluks żołądkowoprzełykowy, astma aspiry-
nowa i anafilaksja.
Ciąża
W okresie ciąży stopień ciężkości astmy często się
zmienia i w związku z tym chore wymagają ścisłej
obserwacji i dostosowania leczenia. W czasie ciąży
u około
1
/
3
kobiet dochodzi do pogorszenia astmy,
u kolejnej
1
/
3
– stopień ciężkości astmy się zmniej-
sza, a u pozostałej
1
/
3
się nie zmienia.
265267
Należy zachować ostrożność przy stosowa-
niu leków w ciąży, ale słabo kontrolowana astma
może mieć niekorzystny wpływ na rozwój płodu
i prowadzić do zwiększonej umieralności około-
porodowej, wcześniactwa i małej masy urodze-
niowej.
266,267
Ogólne rokowanie okołoporodowe
u dzieci urodzonych przez matki chore na astmę
dobrze kontrolowaną jest takie samo jak u dzieci
kobiet niechorujących na astmę.
268
Z tego powo-
du stosowanie leków w celu uzyskania optymal-
nej kontroli astmy jest uzasadnione, nawet jeśli
nie udowodniono jednoznacznie bezpieczeństwa
ich stosowania w okresie ciąży. Prawdopodobnie
większość leków stosowanych w leczeniu astmy
i nieżytu nosa nie wywiera niekorzystnego dzia-
łania na płód. Stosowanie teofiliny (przy odpo-
wiednim monitorowaniu jej stężenia we krwi),
β
2
-mimetyków wziewnych i leków przeciwleuko-
trienowych (montelukastu) nie zwiększa często-
ści występowania wad wrodzonych. Wykazano,
że glikokortykosteroidy wziewne zapobiegają
zaostrzeniom astmy u kobiet w ciąży
269,270
(
ja-
kość danych B). Tak jak w innych sytuacjach
leczenie astmy u kobiet w ciąży powinno się kon-
centrować na opanowaniu objawów i utrzymaniu
prawidłowej czynności płuc.
271
Nagłe zaostrzenia
astmy należy leczyć agresywnie, aby uniknąć
niedotlenienia płodu. Stosuje się szybko działają-
ce β
2
mimetyki w nebulizacji oraz tlen, a niekiedy
konieczne jest także podawanie glikokortykoste-
roidów ogólnoustrojowo.
Na temat bezpieczeństwa stosowanych leków
powinno się rozmawiać ze wszystkimi chorymi,
ale jest to szczególnie ważne w przypadku kobiet
planujących ciążę lub będących w ciąży. Należy
zapewniać kobiety ciężarne, że większe zagroże-
nie dla ich dzieci niesie nieodpowiednia kontrola
astmy niż jej leczenie i podkreślać bezpieczeństwo
dla płodu większości nowoczesnych leków prze-
ciwastmatycznych. Nawet jeśli relacja między
pacjentką i lekarzem jest dobra, to drukowane
informacje na temat astmy w okresie ciąży, takie
jak stanowisko US National Asthma Education
and Prevention Program
272
, dodatkowo uspokoją
obawy przyszłej matki
265,273
.
Operacje
Nadreaktywność oskrzeli, ograniczenie przepływu
powietrza przez drogi oddechowe oraz nadmierne
wydzielanie śluzu predysponują chorych na astmę
do śród i pooperacyjnych powikłań oddechowych.
Prawdopodobieństwo wystąpienia tych powikłań
zależy od ciężkości astmy w momencie operacji,
rodzaju operacji (największe ryzyko stwarzają
zabiegi w obrębie klatki piersiowej i nadbrzusza)
i rodzaju znieczulenia (największe ryzyko niesie
znieczulenie ogólne z intubacją dotchawiczą).
Czynniki te należy ocenić przed zabiegiem i po-
winno się wykonać badanie czynności płuc. Jeśli
jest to możliwe, ocenę taką należy przeprowadzić
na szereg dni przed zabiegiem, aby mieć czas na
zmodyfikowanie leczenia. W szczególności, jeśli
FEV
1
wynosi <80% maksymalnej wartości u cho-
rego, powinno się rozważyć podawanie przez krót-
ki czas glikokortykosteroidu doustnego w celu
zmniejszenia obturacji oskrzeli
274,275
(
jakość
danych C). Ponadto chorzy, którzy otrzymywa-
li glikokortykosteroidy ogólnoustrojowo w ciągu
ostatnich 6 miesięcy, powinni otrzymywać je także
w okresie okołooperacyjnym (100 mg hydrokorty-

WYTYCZNE
90
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
zonu dożylnie co 8 h). Należy je odstawić w ciągu
24 godzin po zabiegu, ponieważ dłuższa kortyko-
terapia ogólnoustrojowa może upośledzać gojenie
się rany
276
(
jakość danych C).
Nieżyt nosa, zapalenie zatok przynosowych
i polipy nosa
U niektórych chorych na astmę choroby górnych
dróg oddechowych mogą mieć wpływ na czynność
dolnych dróg oddechowych. Chociaż mechanizmy
tego zjawiska nie zostały w pełni wyjaśnione to –
podobnie ważną rolę jak w astmie – w patogenezie
nieżytu nosa, zapalenia zatok przynosowych i po-
lipów nosa prawdopodobnie odgrywa zapalenie.
Nieżyt nosa
U większości chorych na astmę stwierdza się nie-
żyt nosa, a 30% chorych z utrzymującym się nie-
żytem nosa ma lub będzie miało astmę.
277,278
Nie-
żyt nosa często poprzedza astmę i jest zarówno
czynnikiem ryzyka rozwoju astmy,
279
jak i wiąże
się ze zwiększoną ciężkością astmy i większym zu-
życiem środków opieki zdrowotnej z powodu ast-
my
280
. Nieżyt nosa i astma mają wiele wspólnych
czynników ryzyka; często są to alergeny występu-
jące wewnątrz pomieszczeń i na zewnątrz, takie
jak alergeny roztoczy kurzu domowego, alergeny
zwierzące, a rzadziej – pyłki roślin wywołujące
reakcję ze strony nosa i oskrzeli,
281,282
zawodowe
czynniki uczulające
283
i czynniki nieswoiste, takie
jak kwas acetylosalicylowy. Z tych powodów grupa
ekspertów tworząca inicjatywę Allergic Rhinitis
and Its Impact on Asthma (ARIA) zaleca, by brać
pod uwagę występowanie astmy u wszystkich
chorych na nieżyt nosa oraz by w planowaniu le-
czenia uwzględniać obie choroby jednocześnie.
284
Zarówno astmę, jak i nieżyt nosa uważa się za
choroby zapalne dróg oddechowych, ale istnieją
między nimi pewne różnice pod względem me-
chanizmów, cech klinicznych i sposobu leczenia.
Zapalenie błonej śluzowej nosa i błony śluzowej
oskrzeli może być podobne, ale obturacja nosa jest
głównie wynikiem przekrwienia błony śluzowej,
a w astmie główną rolę odgrywa skurcz mięśni
gładkich ściany oskrzeli.
285
Leczenie nieżytu nosa może złagodzić przebieg
astmy
286,287
(
jakość danych A). Leki przeciwza-
palne, takie jak glikokortykosteroidy i kromony,
jak również leki przeciwleukotrienowe i leki prze-
ciwcholinergiczne mogą być skuteczne w leczeniu
obu tych chorób. Jednak niektóre leki są skutecz-
ne tylko w nieżycie nosa (np. H
1
-blokery), a inne
– tylko w astmie (np. β-mimetyki)
288
(
jakość da-
nych A). Leczenie współistniejącego nieżytu nosa
glikokortykosteroidami podawanymi donosowo
w niewielkim stopniu poprawia objawy astmy
i zmniejsza jej powikłania, ale nie we wszystkich
badaniach obserwowano takie efekty.
289291
Leki
przeciwleukotrienowe,
125,292
swoista immunote-
rapia alergenowa
284,293
oraz przeciwciała anty
IgE
294,295
są skuteczne w obu tych chorobach (
ja-
kość danych A).
Dodatkowe informacje na ten temat przygo-
towane przez inicjatywę Allergic Rhinitis and Its
Impact on Asthma (ARIA) można znaleźć na stro-
nie internetowej http://www.whiar.com284.
284
Zapalenie zatok przynosowych
Zapalenie zatok przynosowych występuje jako
powikłanie zakażeń górnych dróg oddechowych,
alergicznego nieżytu nosa, polipów nosa i innych
form obturacji nosa. Zarówno ostre, jak i przewle-
kłe zapalenie zatok przynosowych może spowo-
dować zaostrzenie astmy. Wartość diagnostyczna
klinicznych objawów zapalenia zatok przynoso-
wych jest niewielka,
296
dlatego w razie wskazań
zaleca się potwierdzenie rozpoznania za pomo-
cą tomografii komputerowej, jeśli jest dostępna.
U dzieci z podejrzeniem zapalenia błony śluzowej
nosa i zatok przynosowych zaleca się leczenie an-
tybiotykiem przez 10 dni
297
(
jakość danych B).
Powinno się również stosować leki zmniejszające
obrzęk błony śluzowej nosa, takie jak leki obkur-
czające naczynia błony śluzowej podawane miej-
scowo lub glikokortykosteroidy podawane dono-
sowo, a nawet ogólnoustrojowo. Leki te odgrywa-
ją rolę drugoplanową względem głównych leków
przeciwastmatycznych.
279,288
Polipy nosa
Polipy nosa związane z astmą i nieżytem nosa,
a niekiedy z nadwrażliwością na kwas acetylosa-
licylowy
298
spotyka się głównie u chorych po 40.
roku życia. 36–96% chorych z nadwrażliwością na
kwas acetylosalicylowy ma polipy nosa, a 29–70%
chorych z polipami nosa choruje na astmę.
298,299
U dzieci z polipami nosa powinno się przeprowa-
dzić diagnostykę w kierunku mukowiscydozy i ze-
społu dyskinezy rzęsek.

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
9
Polipy nosa dobrze reagują na miejscowe le-
czenie glikokortykosteroidami.
288
Nieliczni cho-
rzy z polipami opornymi na kortykoterapię mogą
odnieść korzyść z leczenia operacyjnego.
Astma zawodowa
Po rozpoznaniu astmy zawodowej ważną składo-
wą leczenia jest całkowite wyeliminowanie eks-
pozycji na czynnik sprawczy.
300302
Astma zawo-
dowa może się utrzymywać nawet przez kilka lat
po wyeliminowaniu narażenia, zwłaszcza u cho-
rych, którzy mieli objawy przez długi czas, zanim
przerwano ekspozycję.
303,304
Utrzymujące się
narażenie może doprowadzić do coraz cięższych
i nawet śmiertelnych zaostrzeń astmy
305
, zmniej-
szenia prawdopodobieństwa późniejszej remisji
i ostatecznie do trwałego upośledzenia czynności
płuc
306
. Leczenie farmakologiczne astmy zawodo-
wej jest takie samo jak innych postaci astmy, ale
nie zastąpi wyeliminowania narażenia na czynnik
sprawczy. Poleca się konsultację chorego ze spe-
cjalistą w dziedzinie leczenia astmy lub medycyny
pracy.
Wytyczne British Educational Research Foun-
dation dotyczące prewencji, rozpoznawania i le-
czenia astmy zawodowej są dostępne na stronie
internetowej http://www.bohrf.org.uk/downloads/
asthevre.pdf.
Zakażenia układu oddechowego
Zakażenia układu oddechowego mają ścisły zwią-
zek z astmą, ponieważ u wielu chorych wywołu-
ją świszczący oddech i nasilają inne objawy.
307
Badania epidemiologiczne wykazały, że drobno-
ustroje nasilające objawy astmy to często wiru-
sy oddechowe
308
, rzadko bakterie
309
. Wirus RSV
jest najczęstszą przyczyną świszczącego oddechu
u niemowląt
45
, natomiast rynowirusy (które wy-
wołują przeziębienie) są głównymi czynnikami
wyzwalającymi świsty i powodującymi pogorsze-
nie astmy u starszych dzieci i dorosłych
310
. Inne
wirusy oddechowe, takie jak wirusy paragrypy,
wirusy grypy, adenowirusy i koronawirusy, rów-
nież zwiększają częstość występowania świszczą-
cego oddechu i nasilają objawy astmy.
311
Poznano szereg mechanizmów tłumaczących
występowanie świszczącego oddechu i nadreak-
tywności oskrzeli w następstwie zakażenia ukła-
du oddechowego, w tym uszkodzenie nabłonka
dróg oddechowych, wytwarzanie swoistych prze-
ciwciał przeciwwirusowych klasy IgE, zwiększo-
ne uwalnianie mediatorów i późna faza reakcji
astmatycznej na antygen wziewny.
312
Istnieją
więc dane wskazujące na to, że zakażenia wiruso-
we „dokładają” się do reakcji zapalnej i sprzyjają
uszkodzeniu dróg oddechowych poprzez nasilenie
zapalenia.
313
Leczenie zaostrzenia astmy wywołanego przez
zakażenie prowadzi się według tych samych za-
sad, które się odnoszą do zaostrzeń o innej przy-
czynie; zaleca się stosowanie szybko działających
β
2
mimetyków wziewnych oraz wczesne włączenie
kortykoterapii doustnej lub co najmniej 4krotne
zwiększenie dawki glikokortykosteroidów wziew-
nych. Ponieważ nasilenie objawów astmy często
utrzymuje się przez kilka tygodni po zakażeniu,
należy przez ten czas kontynuować leczenie prze-
ciwzapalne w celu zapewnienia odpowiedniej kon-
troli choroby.
Rola przewlekłego zakażenia przez Chlamydia
pneumoniae i Mycoplazma pneumoniae w patoge-
nezie astmy lub jej zaostrzeń nie jest jasna.
314
Nie
są też potwierdzone korzyści z leczenia antybioty-
kami makrolidowymi.
315317
Refluks żołądkowo-przełykowy
Związek między nasilonymi objawami astmy,
szczególnie w nocy, a refluksem żołądkowoprze-
łykowym jest ciągle niepewny, chociaż refluks wy-
stępuje niemal 3 razy częściej u chorych na ast-
mę niż w całej populacji.
318,319
Niektórzy z tych
chorych mają również przepuklinę rozworu prze-
łykowego; ponadto stosowanie metyloksantyn
i β
2
mimetyków doustnych sprzyja wystąpieniu
refluksu poprzez rozluźnienie dolnego zwieracza
przełyku.
Najlepszą metodą ustalenia rozpoznania jest
równoczesne monitorowanie pH przełyku i para-
metrów czynności płuc. W celu opanowania ob-
jawów refluksu żołądkowoprzełykowego wska-
zane jest leczenie zachowawcze, które jest często
skuteczne i obejmuje: spożywanie większej liczby
posiłków w ciągu dnia, ale mniej obfitych; unika-
nie jedzenia i picia między posiłkami, a zwłasz-
cza przed snem; unikanie tłustych pokarmów,

WYTYCZNE
92
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
alkoholu, teofiliny i β
2
mimetyków doustnych;
stosowanie inhibitorów pompy protonowej lub
H
2
blokerów; spanie na łóżku z uniesionym pod-
główkiem.
Znaczenie leczenia przeciwrefluksowego dla
kontroli astmy nie jest jednak jasne, ponieważ
nie zawsze powoduje ono poprawę w zakresie
czynności płuc, objawów astmy, objawów noc-
nych lub zmniejszenie zużycia leków przeciwast-
matycznych u chorych na astmę, u których nie
stwierdzono jednoznacznego związku objawów ze
strony układu oddechowego z refluksem żołądko-
woprzełykowym. Część chorych może odnieść ko-
rzyść z takiego leczenia, ale trudno przewidzieć,
u których będzie ono skuteczne.
320
Leczenie operacyjne rezerwuje się dla cho-
rych z ciężkimi objawami i dobrze udokumento-
wanym zapaleniem przełyku, u których leczenie
zachowawcze okazało się nieskuteczne. Zanim
choremu na astmę zaleci się operację, należy wy-
kazać, że refluks rzeczywiście wywołuje objawy
astmy.
321,322
Astma aspirynowa
U 28% dorosłych z astmą, rzadko u dzieci, wystę-
pują zaostrzenia astmy po przyjęciu kwasu acety-
losalicylowego (ASA) lub innych niesteroidowych
leków przeciwzapalnych (NSLPZ). Zespół ten jest
częstszy w astmie ciężkiej.
323
Astma aspirynowa (aspirin induced asthma
– AIA) ma charakterystyczny obraz i przebieg
kliniczny.
324
U większości chorych pierwsze obja-
wy, takie jak naczynioruchowy nieżyt nosa i ob-
fity wyciek wydzieliny z nosa, występują w 3. lub
4. dekadzie życia. Rozwija się przewlekłe ograni-
czenie drożności nosa, a badanie przedmiotowe
często ujawnia polipy nosa. Następnie pojawia się
astma i nadwrażliwość na ASA. Nadwrażliwość
na ASA ma wyjątkowy obraz: w ciągu minut do
1–2 godzin po przyjęciu ASA rozwija się ostry,
często ciężki napad astmy, któremu zwykle to-
warzyszy wyciek wydzieliny z nosa, niedrożność
nosa, podrażnienie spojówek i zaczerwienienie
skóry głowy i szyi. Objawy te mogą być wywoła-
ne przez jedną dawkę ASA lub innego inhibitora
cyklooksygenazy typu 1 (COX1); może wystąpić
gwałtowny skurcz oskrzeli, wstrząs, utrata przy-
tomności, a nawet zatrzymanie odechu.
325,326
W drogach oddechowych osób z AIA stwier-
dza się przewlekłe nasilone zapalenie eozynofi-
lowe, uszkodzenie nabłonka, wytwarzanie cyto-
kin i zwiększoną ekspresję cząsteczek adhezyj-
nych.
327,328
W drogach oddechowych zwiększona
jest również ekspresja interleukiny 5 (IL5), któ-
ra jest zaangażowana w rekrutację i wydłużenie
przeżycia eozynofilów.
328
AIA charakteryzuje
się też zwiększoną aktywacją szlaku leukotrie-
nów cysteinylowych, co można częściowo tłuma-
czyć genetycznym polimorfizmem genu syntazy
LTC4, stwierdzanym u około 70% chorych.
329
Jed-
nakże dokładny mechanizm wyzwalania skurczu
oskrzeli przez ASA pozostaje nieznany.
330
Zdolność inhibitora cyklooksygenazy do wy-
zwalania reakcji zależy od siły hamowania cyklo-
oksygenazy przez dany lek, jak również od osob-
niczej wrażliwości chorego.
329
Charakterystyczny wywiad uważa się za wy-
starczający do zalecenia nieprzyjmowania szko-
dzących leków. Potwierdzenie rozpoznania jest
możliwe wyłącznie na podstawie próby prowo-
kacyjnej z użyciem ASA, ponieważ nie ma odpo-
wiednich testów in vitro. Nie zaleca się wykony-
wania prób prowokacyjnych z ASA w rutynowej
praktyce klinicznej, ze względu na duże ryzyko
potencjalnie śmiertelnych powikłań; próby takie
można przeprowadzać tylko w ośrodkach zapew-
niających resuscytację krążeniowooddechową.
331
Dalsze środki ostrożności to wykonywanie próby
prowokacyjnej wyłącznie u chorych, u których ast-
ma jest w remisji, a FEV
1
przekracza 70% warto-
ści należnej lub maksymalnej dla danego chorego.
Próby prowokacyjne dooskrzelowe (wziewne) lub
donosowe z użyciem aspiryny lizynowej są bez-
pieczniejsze od prób doustnych i mogą być wyko-
nywane w wyspecjalizowanych ośrodkach.
332,333
Nadwrażliwość na ASA i NSLPZ utrzymuje się
do końca życia. Chorzy na AIA powinni unikać
przyjmowania ASA (także preparatów złożonych
zawierających ASA), innych leków hamujących
COX1, a często także soli sodowej bursztynianiu
hydrokortyzonu.
334
Nie zapobiega to jednak pro-
gresji zapalenia dróg oddechowych. Jeśli wskaza-
ne jest zastosowanie NSLZP, można rozważyć po-
danie inhibitora cyklooksygenazy typu 2 (COX2);
konieczny jest jednak właściwy nadzór lekarski
i obserwacja chorego co najmniej przez godzinę po
przyjęciu leku
335
(
jakość danych B). Podstawą
leczenia astmy są glikokortykosteroidy, ale leki

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
9
przeciwleukotrienowe także mogą być pomocne
w uzyskaniu kontroli choroby
332,336
(
jakość da-
nych B). U chorych z astmą i nadwrażliwością na
NSLPZ, którzy wymagają przyjmowania NSLPZ
z innych wskazań medycznych, można przepro-
wadzić desensytyzację w warunkach szpitalnych
pod nadzorem specjalisty.
337
Desensytyzację na
ASA przeprowadza się również w leczeniu AIA,
ale odległe korzyści obserwuje się częściej w za-
kresie objawów ze strony zatok przynosowych niż
dolnych dróg oddechowych. Po desensytyzacji
przyjmowanie ASA w dawce 600–1200 mg/d
u większości chorych na AIA zmniejsza objawy
zapalenia błony śluzowej, zwłaszcza nosa.
332
Chorzy na astmę, zwłaszcza jeśli choroba roz-
winęła się w wieku dorosłym i towarzyszy jej
polipowatość nosa, powinni unikać stosowania
NSLPZ, a zamiast tych leków przyjmować w razie
wskazań paracetamol.
Anafilaksja i astma
Anafilaksja jest stanem zagrożenia życia, który
może przypominać lub wikłać ciężką astmę. Aby
leczenie anafilaksji było skuteczne, konieczne jest
jej wczesne rozpoznanie. Możliwość wystąpienia
anafilaksji należy brać pod uwagę zawsze, gdy
chory otrzymuje leki lub substancje biologiczne,
zwłaszcza we wstrzyknięciach. Udokumentowa-
nymi przyczynami anafilaksji są na przykład:
wyciągi alergenowe stosowane w immunoterapii
swoistej, nietolerancja pokarmowa (orzeszki, ryby,
skorupiaki, jaja, mleko), szczepionki zawierające
wirusy replikowane na zarodkach ptasich, użądle-
nia i ukąszenia przez owady, uczulenie na lateks,
leki (antybiotyki βlaktamowe, ASA i NSLPZ, in-
hibitory konwertazy angiotensyny) oraz wysiłek
fizyczny.
Do objawów anafilaksji należą: zaczerwienie-
nie skóry, świąd, pokrzywka i obrzęk naczynio-
woruchowy; objawy ze strony górnych i dolnych
dróg oddechowych, takie jak stridor, duszność,
świszczący oddech lub bezdech; zawroty głowy lub
utrata przytomności z hipotonią lub bez; objawy
żołądkowojelitowe, takie jak nudności, wymioty,
ból brzucha i biegunka. Anafilaksję wywołaną
przez wysiłek fizyczny, często związaną z alergią
na określony lek lub pokarm, należy różnicować
ze skurczem oskrzeli wywołanym przez wysiłek
fizyczny.
338
Reakcja anafilaktyczna w drogach oddecho-
wych może być odpowiedzialna za nagłe napady
astmy i względną oporność na leczenie dużymi
dawkami β
2
mimetyków u chorych z ciężką ast-
mą.
180
Jeśli istnieje podejrzenie, że u podłoża
napadu astmy leży reakcja anafilaktyczna, to le-
kiem z wyboru do rozszerzenia oskrzeli jest adre-
nalina. Podstawowe znaczenie ma jak najszybsze
podjęcie leczenia, które obejmuje podawanie tle-
nu, adrenaliny (domięśniowo), leków przeciwhi-
staminowych, hydrokortyzonu (dożylnie) oraz
przetaczanie płynów. Zapobieganie anafilaksji
polega na zidentyfikowaniu czynnika sprawcze-
go, poinformowaniu chorego o sposobach jego
unikania oraz nauczeniu chorego samodzielnego
wstrzykiwania sobie adrenaliny z gotowej do uży-
cia strzykawki w razie wystąpienia reakcji anafi-
laktycznej.
339
Piśmiennictwo
1. Charlton I., Charlton G., Broomfield J., Mullee M.A.: Evaluation of peak flow and
symptoms only self management plans for control of asthma in general practice.
BMJ, 1990; 301 (6765): 1355–1359
2. Cote J., Cartier A., Robichaud P., Boutin H., Malo J.L., Rouleau M., et al.: Influence
on asthma morbidity of asthma education programs based on self-management
plans following treatment optimization. Am. J. Respir. Crit. Care Med., 1997; 155:
1509–1514
3. Ignacio-Garcia J.M., Gonzalez-Santos P.: Asthma self-management education pro-
gram by home monitoring of peak expiratory flow. Am. J. Respir. Crit. Care Med.,
1995; 151 (2 Pt 1): 353–359
4. Jones K.P., Mullee M.A., Middleton M., Chapman E., Holgate S.T.: Peak flow based
asthma self-management: a randomised controlled study in general practice. British
Thoracic Society Research Committee. Thorax, 1995; 50: 851–857
5. Lahdensuo A., Haahtela T., Herrala J., Kava T., Kiviranta K., Kuusisto P., et al.:
Randomised comparison of guided self management and traditional treatment of
asthma over one year. BMJ, 1996; 312: 748–752
6. Turner M.O., Taylor D., Bennett R., FitzGerald J.M.: A randomized trial comparing
peak expiratory flow and symptom selfmanagement plans for patients with asthma
attending a primary care clinic. Am. J. Respir. Crit. Care Med., 1998; 157: 540–546
7. Sommaruga M., Spanevello A., Migliori G.B., Neri M., Callegari S., Majani G.: The
effects of a cognitive behavioural intervention in asthmatic patients. Monaldi Arch.
Chest Dis., 1995; 50: 398–402
8. Cowie R.L., Revitt S.G., Underwood M.F., Field S.K.: The effect of a peak flow-based
action plan in the prevention of exacerbations of asthma. Chest, 1997; 112: 1534–
1538
9. Kohler C.L., Davies S.L., Bailey W.C.: How to implement an asthma education pro-
gram. Clin. Chest Med., 1995; 16: 557–565
10. Bailey W.C., Richards J.M. Jr, Brooks C.M., Soong S.J., Windsor R.A., Manzella B.A.:
A randomized trial to improve selfmanagement practices of adults with asthma.
Arch. Intern. Med., 1990; 150: 1664–1668
11. Murphy V.E., Gibson P.G., Talbot P.I., Kessell C.G., Clifton V.L.: Asthma self-manage-
ment skills and the use of asthma education during pregnancy. Eur. Respir. J., 2005;
26: 435–441
12. Shah S., Peat J.K., Mazurski E.J., Wang H., Sindhusake D., Bruce C., et al.: Effect of
peer led programme for asthma education in adolescents: cluster randomised con-
trolled trial. BMJ, 2001; 322: 583–585
13. Guevara J.P., Wolf F.M., Grum C.M., Clark N.M.: Effects of educational interventions
for self management of asthma in children and adolescents: systematic review and
meta-analysis. BMJ, 2003; 326: 1308–1309
14. Griffiths C., Foster G., Barnes N., Eldridge S., Tate H., Begum S., et al.: Specialist nurse
intervention to reduce unscheduled asthma care in a deprived multiethnic area: the
east London randomised controlled trial for high risk asthma (ELECTRA). BMJ, 2004;
328: 144
15. Powell H., Gibson P.G.: Options for self-management education for adults with asth-
ma. Cochrane Database Syst. Rev., 2003 (1): CD004107

WYTYCZNE
9
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
16. Gibson P.G., Powell H., Coughlan J., Wilson A.J., Abramson M., Haywood P., et al.:
Self-management education and regular practitioner review for adults with asthma.
Cochrane Database Syst. Rev., 2003 (1): CD001117
17. Haby M.M., Waters E., Robertson C.F., Gibson P.G., Ducharme F.M.: Interventions for
educating children who have attended the emergency room for asthma. Cochrane
Database Syst. Rev., 2001: 1
18. Gibson P.G., Powell H., Coughlan J., Wilson A.J., Hensley M.J., Abramson M., et
al.: Limited (information only) patient education programs for adults with asthma.
Cochrane Database Syst. Rev., 2002 (2): CD001005
19. Cabana M.D., Slish K.K., Evans D., Mellins R.B., Brown R.W., Lin X., et al.: Impact care
education on patient outcomes. Pediatrics, 2006; 117: 2149–2157
20. Levy M., Bell L.: General practice audit of asthma in childhood. BMJ (Clin. Res. Ed),
1984; 289: 1115–1116
21. Ong L.M., de Haes J.C., Hoos A.M., Lammes F.B.: Doctor-patient communication:
a review of the literature. Soc. Sci. Med., 1995; 40: 903–918
22. Stewart M.A.: Effective physician-patient communication and health outcomes:
a review. CMAJ, 1995; 152: 1423–1433
23. Partridge M.R., Hill S.R.: Enhancing care for people with asthma: the role of com-
munication, education, training and selfmanagement. 1998 World Asthma Meeting
Education and Delivery of Care Working Group. Eur. Respir. J., 2000; 16: 333–348
24. Clark N.M., Gong M., Schork M.A., Kaciroti N., Evans D., Roloff D., et al.: Long-term
effects of asthma education for physicians on patient satisfaction and use of health
services. Eur. Respir. J., 2000; 16: 15–21
25. Cegala D.J., Marinelli T., Post D.: The effects of patient communication skills training
on compliance. Arch. Fam. Med., 2000; 9: 57–64
26. Chapman K.R., Voshaar T.H., Virchow J.C.: Inhaler choice in primary care. Eur. Respir.
Rev., 2005; 14: 117–122
27. Dolovich M.B., Ahrens R.C., Hess D.R., Anderson P., Dhand R., Rau J.L., et al.: Device
selection and outcomes of aerosol therapy: Evidence-based guidelines: American
College of Chest Physicians/American College of Asthma, Allergy, and Immunology.
Chest, 2005; 127: 335–371
28. Voshaar T., App E.M., Berdel D., Buhl R., Fischer J., Gessler T., et al. [Recommendations
for the choice of inhalatory systems for drug prescription]. Pneumologie, 2001; 55:
579–586
29. Meade C.D., McKinney W.P., Barnas G.P.: Educating patients with limited literacy
skills: the effectiveness of printed and videotaped materials about colon cancer. Am.
J. Public Health, 1994; 84: 119–121
30. Houts P.S., Bachrach R., Witmer J.T., Tringali C.A., Bucher J.A., Localio R.A.: Using
pictographs to enhance recall of spoken medical instructions. Patient Educ. Couns,
1998; 35: 83–88
31. Fishwick D., D’Souza W., Beasley R.: The asthma selfmanagement plan system of
care: what does it mean, how is it done, does it work, what models are available,
what do patients want and who needs it? Patient Educ. Couns, 1997; 32 (1 suppl.):
S21–S33
32. Gibson P.G., Powell H.: Written action plans for asthma: an evidence-based review of
the key components. Thorax, 2004; 59: 94–99
33. Newman S.P.: Inhaler treatment options in COPD. Eur. Respir. Rev., 2005; 14: 102–
108
34. Coutts J.A., Gibson N.A., Paton J.Y.: Measuring compliance with inhaled medication
in asthma. Arch. Dis. Child., 1992; 67: 332–333
35. Franchi M., Carrer P.: Indoor air quality in schools: the EFA project. Monaldi Arch.
Chest Dis., 2002; 57: 120–122
36. Arshad S.H.: Primary prevention of asthma and allergy. J. Allergy Clin. Immunol.,
2005; 116: 3–14
37. Bousquet J., Yssel H., Vignola A.M.: Is allergic asthma associated with delayed fetal
maturation or the persistence of conserved fetal genes? Allergy, 2000; 55: 1194–
1197
38. Jones C.A., Holloway J.A., Warner J.O.: Does atopic disease start in foetal life?
Allergy, 2000; 55: 2–10
39. Kramer M.S.: Maternal antigen avoidance during pregnancy for preventing atopic
disease in infants of women at high risk. Cochrane Database Syst. Rev., 2000: 2
40. Friedman N.J., Zeiger R.S.: The role of breast-feeding in the development of allergies
and asthma. J. Allergy Clin. Immunol., 2005; 115: 1238–1248
41. Gdalevich M., Mimouni D., Mimouni M.: Breast-feeding and the risk of bronchial
asthma in childhood: a systematic review with meta-analysis of prospective studies.
J. Pediatr., 2001; 139: 261–266
42. Robinson D.S., Larche M., Durham S.R.: Tregs and allergic disease. J. Clin. Invest.,
2004; 114: 1389–1397
43. Isolauri E., Sutas Y., Kankaanpaa P., Arvilommi H., Salminen S.: Probiotics: effects on
immunity. Am. J. Clin. Nutr., 2001; 73 (2 suppl.): 444S–450S
44. Ownby D.R., Johnson C.C., Peterson E.L.: Exposure to dogs and cats in the first year
of life and risk of allergic sensitization at 6 to 7 years of age. JAMA, 2002; 288:
963–972
45. Martinez F.D., Wright A.L., Taussig L.M., Holberg C.J., Halonen M., Morgan W.J.:
Asthma and wheezing in the first six years of life. The Group Health Medical
Associates. N. Engl. J. Med., 1995; 332: 133–138
46. Dezateux C., Stocks J., Dundas I., Fletcher M.E.: Impaired airway function and wheez-
ing in infancy: the influence of maternal smoking and a genetic predisposition to
asthma. Am. J. Respir. Crit. Care Med., 1999; 159: 403–410
47. Strachan D.P., Cook D.G.: Health effects of passive smoking .5. Parental smoking and
allergic sensitisation in children. Thorax, 1998; 53: 117–123
48. Strachan D.P., Cook D.G.: Health effects of passive smoking. 1. Parental smoking and
lower respiratory illness in infancy and early childhood. Thorax, 1997; 52: 905–914
49. Kulig M., Luck W., Lau S., Niggemann B., Bergmann R., Klettke U., et al.: Effect of pre-
and postnatal tobacco smoke exposure on specific sensitization to food and inhalant
allergens during the first 3 years of life. Multicenter Allergy Study Group, Germany.
Allergy, 1999; 54: 220–228
50. Iikura Y., Naspitz C.K., Mikawa H., Talaricoficho S., Baba M., Sole D., et al.: Prevention
of asthma by ketotifen in infants with atopic dermatitis. Ann. Allergy, 1992; 68:
233–236
51. Allergic factors associated with the development of asthma and the influence of ce-
tirizine in a double-blind, randomised, placebo-controlled trial: first results of ETAC.
Early Treatment of the Atopic Child. Pediatr. Allergy Immunol., 1998; 9: 116–124
52. Johnstone D.E., Dutton A.: The value of hyposensitization therapy for bronchial
asthma in children – a 14-year study. Pediatrics, 1968; 42: 793–802
53. Moller C., Dreborg S., Ferdousi H.A., Halken S., Host A., Jacobsen L., et al.: Pollen
immunotherapy reduces the development of asthma in children with seasonal rhino-
conjunctivitis (the PATstudy). J. Allergy Clin. Immunol., 2002; 109: 251–256
54. Gotzsche P.C., Hammarquist C., Burr M.: House dust mite control measures in the
management of asthma: meta-analysis. BMJ, 1998; 317: 1105–1110
55. Gotzsche P.C., Johansen H.K., Schmidt L.M., Burr M.L.: House dust mite control meas-
ures for asthma. Cochrane Database Syst. Rev., 2004 (4): CD001187
56. Sheffer A.L.: Allergen avoidance to reduce asthma-related morbidity. N. Engl. J.
Med., 2004; 351: 1134–1136
57. Platts-Mills T.A.: Allergen avoidance in the treatment of asthma and rhinitis. N. Engl.
J. Med., 2003; 349: 207–208
58. Morgan W.J., Crain E.F., Gruchalla R.S., O’Connor G.T., Kattan M., Evans R. 3rd, et
al.: Results of a home-based environmental intervention among urban children with
asthma. N. Engl. J. Med., 2004; 351: 1068–1080
59. Platts-Mills T.A., Thomas W.R., Aalberse R.C., Vervloet D., Champman M.D.: Dust
mite allergens and asthma: report of a second international workshop. J. Allergy Clin.
Immunol., 1992; 89: 1046–1060
60. Custovic A., Wijk R.G.: The effectiveness of measures to change the indoor environ-
ment in the treatment of allergic rhinitis and asthma: ARIA update (in collaboration
with GA (2)LEN). Allergy, 2005; 60: 1112–1115
61. Luczynska C., Tredwell E., Smeeton N., Burney P.: A randomized controlled trial of
mite allergen-impermeable bed covers in adult mite-sensitized asthmatics. Clin. Exp.
Allergy, 2003; 33: 1648–1653
62. Woodcock A., Forster L., Matthews E., Martin J., Letley L., Vickers M., et al.: Control
of exposure to mite allergen and allergenimpermeable bed covers for adults with
asthma. N. Engl. J. Med., 2003; 349: 225–236
63. Halken S., Host A., Niklassen U., Hansen L.G., Nielsen F., Pedersen S., et al.: Effect of
mattress and pillow encasings on children with asthma and house dust mite allergy.
J. Allergy Clin. Immunol., 2003; 111: 169–176
64. Custovic A., Green R., Taggart S.C., Smith A., Pickering C.A., Chapman M.D., et al.:
Domestic allergens in public places. II: Dog (Can f1) and cockroach (Bla g 2) allergens
in dust and mite, cat, dog and cockroach allergens in the air in public buildings. Clin.
Exp. Allergy, 1996; 26: 1246–1252
65. Almqvist C., Larsson P.H., Egmar A.C., Hedren M., Malmberg P., Wickman M.: School
as a risk environment for children allergic to cats and a site for transfer of cat allergen
to homes. J. Allergy Clin. Immunol., 1999; 103: 1012–1017
66. Enberg R.N., Shamie S.M., McCullough J., Ownby D.R.: Ubiquitous presence of cat
allergen in cat-free buildings: probable dispersal from human clothing. Ann. Allergy,
1993; 70: 471–474
67. Wood R.A., Chapman M.D., Adkinson N.F. Jr, Eggleston P.A.: The effect of cat removal
on allergen content in household-dust samples. J. Allergy Clin. Immunol., 1989; 83:
730–734
68. Eggleston P.A., Wood R.A., Rand C., Nixon W.J., Chen P.H., Lukk P.: Removal of cock-
roach allergen from inner-city homes. J. Allergy Clin. Immunol., 1999; 104 (4 Pt 1):
842–846
69. Denning D.W., O’Driscoll B.R., Hogaboam C.M., Bowyer P., Niven R.M.: The link be-
tween fungi and severe asthma: a summary of the evidence. Eur. Respir. J., 2006; 27:
615–626
70. Hirsch T., Hering M., Burkner K., Hirsch D., Leupold W., Kerkmann M.L., et al.: House-
dust-mite allergen concentrations (Der f 1) and mold spores in apartment bedrooms
before and after installation of insulated windows and central heating systems.
Allergy, 2000; 55: 79–83
71. Chaudhuri R., Livingston E., McMahon A.D., Thomson L., Borland W., Thomson N.C.:
Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic
asthma. Am. J. Respir. Crit. Care Med., 2003; 168: 1308–1311
72. Chalmers G.W., Macleod K.J., Little S.A., Thomson L.J., McSharry C.P., Thomson N.C.:
Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma.
Thorax, 2002; 57: 226–230
73. Upham J.W., Holt P.G.: Environment and development of atopy. Curr. Opin. Allergy
Clin. Immunol., 2005; 5: 167–172
74. Barnett A.G., Williams G.M., Schwartz J., Neller A.H., Best T.L., Petroeschevsky A.L.,
et al.: Air pollution and child respiratory health: a case-crossover study in Australia
and New Zealand. Am. J. Respir. Crit. Care Med., 2005; 171: 1272–1278

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
9
75. Dales R.E., Cakmak S., Judek S., Dann T., Coates F., Brook J.R., et al.: Influence of
outdoor aeroallergens on hospitalization for asthma in Canada. J. Allergy Clin.
Immunol., 2004; 113: 303–306
76. Anto J.M., Soriano J.B., Sunyer J., Rodrigo M.J., Morell F., Roca J., et al.: Long term
outcome of soybean epidemic asthma after an allergen reduction intervention.
Thorax, 1999; 54: 670–674
77. Chen L.L., Tager I.B., Peden D.B., Christian D.L., Ferrando R.E., Welch B.S., et al.:
Effect of ozone exposure on airway responses to inhaled allergen in asthmatic sub-
jects. Chest, 2004; 125: 2328–2335
78. Marks G.B., Colquhoun J.R., Girgis S.T., Koski M.H., Treloar A.B., Hansen P., et al.:
Thunderstorm outflows preceding epidemics of asthma during spring and summer.
Thorax, 2001; 56: 468–471
79. Newson R., Strachan D., Archibald E., Emberlin J., Hardaker P., Collier C.: Acute asth-
ma epidemics, weather and pollen in England, 1987–1994. Eur. Respir. J., 1998; 11:
694–701
80. Nicholson P.J., Cullinan P., Taylor A.J., Burge P.S., Boyle C.: Evidence based guidelines
for the prevention, identification, and management of occupational asthma. Occup.
Environ. Med., 2005; 62: 290–299
81. Vandenplas O., Delwiche J.P., Depelchin S., Sibille Y., Vande Weyer R., Delaunois L.:
Latex gloves with a lower protein content reduce bronchial reactions in subjects with
occupational asthma caused by latex. Am. J. Respir. Crit. Care Med., 1995; 151(3 Pt
1): 887–891
82. Hunt L.W., Boone-Orke J.L., Fransway A.F., Fremstad C.E., Jones R.T., Swanson M.C.,
et al.: A medical-center-wide, multidisciplinary approach to the problem of natural
rubber latex allergy. J. Occup. Environ. Med., 1996; 38: 765–770
83. Sicherer S.H., Sampson H.A.: 9. Food allergy. J. Allergy Clin. Immunol., 2006; 117
(2 suppl. Mini-Primer): S470–S475
84. Roberts G., Patel N., Levi-Schaffer F., Habibi P., Lack G.: Food allergy as a risk fac-
tor for life-threatening asthma in childhood: a case-controlled study. J. Allergy Clin.
Immunol., 2003; 112: 168–174
85. Taylor S.L., Bush R.K., Selner J.C., Nordlee J.A., Wiener M.B., Holden K., et al.:
Sensitivity to sulfited foods among sulfitesensitive subjects with asthma. J. Allergy
Clin. Immunol., 1988; 81: 1159–1167
86. Szczeklik A., Nizankowska E., Bochenek G., Nagraba K., Mejza F., Swierczynska M.:
Safety of a specific COX-2 inhibitor in aspirin-induced asthma. Clin. Exp. Allergy,
2001; 31: 219–225
87. Covar R.A., Macomber B.A., Szefler S.J.: Medications as asthma triggers. Immunol.
Allergy Clin. North Am., 2005; 25: 169–190
88. Nicholson K.G., Nguyen-Van-Tam J.S., Ahmed A.H., Wiselka M.J., Leese J., Ayres J., et
al.: Randomised placebo-controlled crossover trial on effect of inactivated influenza
vaccine on pulmonary function in asthma. Lancet, 1998; 351: 326–331
89. Bueving H.J., Bernsen R.M., de Jongste J.C., van Suijlekom-Smit L.W., Rimmelzwaan
G.F., Osterhaus A.D., et al.: Influenza vaccination in children with asthma: rand-
omized double-blind placebo-controlled trial. Am. J. Respir. Crit. Care Med., 2004;
169: 488–493
90. Cates C.J., Jefferson T.O., Bara A.I., Rowe B.H.: Vaccines for preventing influenza in
people with asthma. Cochrane Database Syst. Rev., 2004 (2): CD000364
91. The safety of inactivated influenza vaccine in adults and children with asthma.
N. Engl. J. Med., 2001; 345: 1529–1536
92. Bergen R., Black S., Shinefield H., Lewis E., Ray P., Hansen J., et al.: Safety of cold-
adapted live attenuated influenza vaccine in a large cohort of children and adoles-
cents. Pediatr. Infect. Dis. J., 2004; 23: 138–144
93. Tantisira K.G., Litonjua A.A., Weiss S.T., Fuhlbrigge A.L.: Association of body mass
with pulmonary function in the Childhood Asthma Management Program (CAMP).
Thorax, 2003; 58: 1036–1041
94. Stenius-Aarniala B., Poussa T., Kvarnstrom J., Gronlund E.L., Ylikahri M., Mustajoki P.:
Immediate and long term effects of weight reduction in obese people with asthma:
randomised controlled study. BMJ, 2000; 320: 827–832
95. Rietveld S., van Beest I., Everaerd W.: Stress-induced breathlessness in asthma.
Psychol. Med., 1999; 29: 1359–1366
96. Sandberg S., Paton J.Y., Ahola S., McCann D.C., McGuinness D., Hillary C.R., et al.:
The role of acute and chronic stress in asthma attacks in children. Lancet, 2000; 356:
982–987
97. Lehrer P.M., Isenberg S., Hochron S.M.: Asthma and emotion: a review. J. Asthma,
1993; 30: 5–21
98. Nouwen A., Freeston M.H., Labbe R., Boulet L.P.: Psychological factors associated
with emergency room visits among asthmatic patients. Behav. Modif., 1999; 23:
217–233
99. Rachelefsky G.S., Katz R.M., Siegel S.C.: Chronic sinus disease with associated reac-
tive airway disease in children. Pediatrics, 1984; 73: 526–529
100. Harding S.M., Guzzo M.R., Richter J.E.: The prevalence of gastroesophageal reflux in
asthma patients without reflux symptoms. Am. J. Respir. Crit. Care Med., 2000; 162:
34–39
101. Patterson P.E., Harding S.M.: Gastroesophageal reflux disorders and asthma. Curr.
Opin. Pulm. Med., 1999; 5: 63–67
102. Chien S., Mintz S.: Pregnancy and menses. In: Weiss E.B., Stein M., eds: Bronchial
asthma Mechanisms and therapeutics. Boston, Little Brown; 1993: 1085–1098
103. Barron W.M., Leff A.R.: Asthma in pregnancy. Am. Rev. Respir. Dis., 1993; 147:
510–511
104. Bateman E.D., Boushey H.A., Bousquet J., Busse W.W., Clark T.J., Pauwels R.A., et
al.: Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma
ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
105. Nathan R.A., Sorkness C.A., Kosinski M., Schatz M., Li J.T., Marcus P., et al.:
Development of the asthma control test: a survey for assessing asthma control. J.
Allergy Clin. Immunol., 2004; 113: 59–65
106. Juniper E.F., Buist A.S., Cox F.M., Ferrie P.J., King D.R.: Validation of a standardized
version of the Asthma Quality of Life Questionnaire. Chest, 1999; 115: 1265–1270
107. Juniper E.F., Bousquet J., Abetz L., Bateman E.D.: Identifying ‘wellcontrolled’ and
‘not well-controlled’ asthma using the Asthma Control Questionnaire. Respir. Med.,
2005
108. Juniper E.F., Svensson K., Mork A.C., Stahl E.: Measurement properties and interpre-
tation of three shortened versions of the asthma control questionnaire. Respir. Med.,
2005; 99: 553–558
109. Vollmer W.M., Markson L.E., O’Connor E., Sanocki L.L., Fitterman L., Berger M., et al.:
Association of asthma control with health care utilization and quality of life. Am. J.
Respir. Crit. Care Med., 1999; 160 (5 Pt 1): 1647–1652
110. Boulet L.P., Boulet V., Milot J.: How should we quantify asthma control? A proposal.
Chest, 2002; 122: 2217–2223
111. O’Byrne P.M., Barnes P.J., Rodriguez-Roisin R., Runnerstrom E., Sandstrom T.,
Svensson K., et al.: Low dose inhaled budesonide and formoterol in mild persistent
asthma: the OPTIMA randomized trial. Am. J. Respir. Crit. Care Med., 2001; 164 (8 Pt
1): 1392–1397
112. Pauwels R.A., Pedersen S., Busse W.W., Tan W.C., Chen Y.Z., Ohlsson S.V., et al.: Early
intervention with budesonide in mild persistent asthma: a randomised, double-blind
trial. Lancet, 2003; 361: 1071–1076
113. Zeiger R.S., Baker J.W., Kaplan M.S., Pearlman D.S., Schatz M., Bird S., et al.:
Variability of symptoms in mild persistent asthma: baseline data from the MIAMI
study. Respir. Med., 2004; 98: 898–905
114. Using beta 2-stimulants in asthma. Drug Ther. Bull., 1997; 35: 1–4
115. Godfrey S., Bar-Yishay E.: Exercised-induced asthma revisited. Respir. Med., 1993;
87: 331–344
116. Leff J.A., Busse W.W., Pearlman D., Bronsky E.A., Kemp J., Hendeles L., et al.:
Montelukast, a leukotriene-receptor antagonist, for the treatment of mild asthma
and exercise-induced bronchoconstriction. N. Engl. J. Med., 1998; 339: 147–152
117. Spooner C.H., Saunders L.D., Rowe B.H.: Nedocromil sodium for preventing exercise-
induced bronchoconstriction. Cochrane Database Syst. Rev., 2000: 2
118. Reiff D.B., Choudry N.B., Pride N.B., Ind P.W.: The effect of prolonged submaximal
warm-up exercise on exercise-induced asthma. Am. Rev. Respir. Dis., 1989; 139:
479–484
119. Ram F.S., Robinson S.M., Black P.N.: Physical training for asthma. Cochrane Database
Syst. Rev., 2000: 2
120. Adams N.P., Bestall J.B., Malouf R., Lasserson T.J., Jones P.W.: Inhaled beclometha-
sone versus placebo for chronic asthma. Cochrane Database Syst. Rev., 2005 (1):
CD002738
121. Drazen J.M., Israel E., O’Byrne P.M.: Treatment of asthma with drugs modifying the
leukotriene pathway. N. Engl. J. Med., 1999; 340: 197–206
122. Barnes N.C., Miller C.J.: Effect of leukotriene receptor antagonist therapy on the risk
of asthma exacerbations in patients with mild to moderate asthma: an integrated
analysis of zafirlukast trials. Thorax, 2000; 55: 478–483
123. Bleecker E.R., Welch M.J., Weinstein S.F., Kalberg C., Johnson M., Edwards L., et al.:
Low-dose inhaled fluticasone propionate versus oral zafirlukast in the treatment of
persistent asthma. J. Allergy Clin. Immunol., 2000; 105 (6 Pt 1): 1123–1129
124. Wilson A.M., Dempsey O.J., Sims E.J., Lipworth B.J.: A comparison of topical budeso-
nide and oral montelukast in seasonal allergic rhinitis and asthma. Clin. Exp. Allergy,
2001; 31: 616–624
125. Philip G., Nayak A.S., Berger W.E., Leynadier F., Vrijens F., Dass S.B., et al.: The effect
of montelukast on rhinitis symptoms in patients with asthma and seasonal allergic
rhinitis. Curr. Med. Res. Opin., 2004; 20: 1549–1558
126. Dahl R., Larsen B.B., Venge P.: Effect of long-term treatment with inhaled budesonide
or theophylline on lung function, airway reactivity and asthma symptoms. Respir.
Med., 2002; 96: 432–438
127. Kidney J., Dominguez M., Taylor P.M., Rose M., Chung K.F., Barnes P.J.:
Immunomodulation by theophylline in asthma. Demonstration by withdrawal of
therapy. Am. J. Respir. Crit. Care Med., 1995; 151: 1907–1914
128. Sullivan P., Bekir S., Jaffar Z., Page C., Jeffery P., Costello J.: Anti-inflammatory effects
of low-dose oral theophylline in atopic asthma. Lancet, 1994; 343: 1006–1008
129. Evans D.J., Taylor D.A., Zetterstrom O., Chung K.F., O’Connor B.J., Barnes P.J.: A com-
parison of low-dose inhaled budesonide plus theophylline and high-dose inhaled
budesonide for moderate asthma. N. Engl. J. Med., 1997; 337: 1412–1418
130. Rivington R.N., Boulet L.P., Cote J., Kreisman H., Small D.I., Alexander M., et al.:
Efficacy of Uniphyl, salbutamol, and their combination in asthmatic patients on high-
dose inhaled steroids. Am. J. Respir. Crit. Care Med., 1995; 151 (2 Pt 1): 325–332
131. Tsiu S.J., Self T.H., Burns R.: Theophylline toxicity: update. Ann. Allergy, 1990; 64 (2
Pt 2): 241-257

WYTYCZNE
96
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
132. Ellis E.F.: Theophylline toxicity. J. Allergy Clin. Immunol., 1985; 76 (2 Pt 2): 297–301
133. Ostergaard P., Pedersen S.: The effect of inhaled disodium cromoglycate and budeso-
nide on bronchial responsiveness to histamine and exercise in asthmatic children:
a clinical comparison. In: Godfrey S., ed.: Glucocortiocosteroids in childhood asthma.
1987: 55–65
134. Francis R.S., McEnery G.: Disodium cromoglycate compared with beclomethasone
dipropionate in juvenile asthma. Clin. Allergy, 1984; 14: 537–540
135. Tasche M.J., Uijen J.H., Bernsen R.M., de Jongste J.C., van der Wouden J.C.: Inhaled
disodium cromoglycate (DSCG) as maintenance therapy in children with asthma: a
systematic review. Thorax, 2000; 55: 913–920
136. Tasche M.J., van der Wouden J.C., Uijen J.H., Ponsioen B.P., Bernsen R.M., van
Suijlekom-Smit L.W., et al.: Randomised placebocontrolled trial of inhaled sodium
cromoglycate in 1–4-year-old children with moderate asthma. Lancet, 1997; 350:
1060–1064
137. Lemanske R.F. Jr, Sorkness C.A., Mauger E.A., Lazarus S.C., Boushey H.A., Fahy J.V.,
et al.: Inhaled corticosteroid reduction and elimination in patients with persistent
asthma receiving salmeterol: a randomized controlled trial. JAMA, 2001; 285: 2594–
2603
138. Lazarus S.C., Boushey H.A., Fahy J.V., Chinchilli V.M., Lemanske R.F. Jr, Sorkness C.A.,
et al.: Long-acting beta2-agonist monotherapy vs continued therapy with inhaled
corticosteroids in patients with persistent asthma: a randomized controlled trial.
JAMA, 2001; 285: 2583–2593
139. Pearlman D.S., Chervinsky P., LaForce C., Seltzer J.M., Southern D.L., Kemp J.P., et
al.: A comparison of salmeterol with albuterol in the treatment of mild-to-moderate
asthma. N. Engl. J. Med., 1992; 327: 1420–1425
140. Kesten S., Chapman K.R., Broder I., Cartier A., Hyland R.H., Knight A., et al.: A three-
month comparison of twice daily inhaled formoterol versus four times daily inhaled
albuterol in the management of stable asthma. Am. Rev. Respir. Dis., 1991; 144 (3 Pt
1): 622–625
141. Wenzel S.E., Lumry W., Manning M., Kalberg C., Cox F., Emmett A., et al.: Efficacy,
safety, and effects on quality of life of salmeterol versus albuterol in patients with mild
to moderate persistent asthma. Ann. Allergy Asthma Immunol., 1998; 80: 463–470
142. Shrewsbury S., Pyke S., Britton M.: Meta-analysis of increased dose of inhaled ster-
oid or addition of salmeterol in symptomatic asthma (MIASMA). BMJ, 2000; 320:
1368–1373
143. Greening A.P., Ind P.W., Northfield M., Shaw G.: Added salmeterol versus higher-dose
corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid.
Allen & Hanburys Limited UK Study Group. Lancet, 1994; 344: 219–224
144. Woolcock A., Lundback B., Ringdal N., Jacques L.A.: Comparison of addition of salm-
eterol to inhaled steroids with doubling of the dose of inhaled steroids. Am. J. Respir.
Crit. Care Med., 1996; 153: 1481–1488
145. Pauwels R.A., Sears M.R., Campbell M., Villasante C., Huang S., Lindh A., et al.:
Formoterol as relief medication in asthma: a worldwide safety and effectiveness trial.
Eur. Respir. J., 2003; 22: 787–794
146. Ind P.W., Villasante C., Shiner R.J., Pietinalho A., Boszormenyi N.G., Soliman S., et al.:
Safety of formoterol by Turbuhaler as reliever medication compared with terbutaline
in moderate asthma. Eur. Respir. J., 2002; 20: 859–866
147. Tattersfield A.E., Town G.I., Johnell O., Picado C., Aubier M., Braillon P., et al.: Bone
mineral density in subjects with mild asthma randomised to treatment with inhaled
corticosteroids or non-corticosteroid treatment for two years. Thorax, 2001; 56:
272–278
148. Boonsawat W., Charoenratanakul S., Pothirat C., Sawanyawisuth K.,
Seearamroongruang T., Bengtsson T., et al.: Formoterol (OXIS) Turbuhaler as a rescue
therapy compared with salbutamol pMDI plus spacer in patients with acute severe
asthma. Respir. Med., 2003; 97: 1067–1074
149. Balanag V.M., Yunus F., Yang P.C., Jorup C.: Efficacy and safety of budesonide/formot-
erol compared with salbutamol in the treatment of acute asthma. Pulm. Pharmacol.
Ther., 2006; 19: 139–147
150. Bateman E.D., Fairall L., Lombardi D.M., English R.: Budesonide/formoterol and for-
moterol provide similar rapid relief in patients with acute asthma showing refractori-
ness to salbutamol. Respir. Res., 2006; 7: 13
151. Verberne A.A., Frost C., Duiverman E.J., Grol M.H., Kerrebijn K.F.: Addition of sal-
meterol versus doubling the dose of beclomethasone in children with asthma. The
Dutch Asthma Study Group. Am. J. Respir. Crit. Care Med., 1998; 158: 213–219
152. Bisgaard H.: Long-acting beta (2)-agonists in management of childhood asthma: A
critical review of the literature. Pediatr. Pulmonol., 2000; 29: 221–234
153. Bisgaard H.: Effect of long-acting beta2 agonists on exacerbation rates of asthma in
children. Pediatr. Pulmonol., 2003; 36: 391–398
154. O’Byrne P.M., Bisgaard H., Godard P.P., Pistolesi M., Palmqvist M., Zhu Y., et al.:
Budesonide/formoterol combination therapy as both maintenance and reliever medi-
cation in asthma. Am. J. Respir. Crit. Care Med., 2005; 171: 129–136
155. Scicchitano R., Aalbers R., Ukena D., Manjra A., Fouquert L., Centanni S., et al.:
Efficacy and safety of budesonide/formoterol single inhaler therapy versus a higher
dose of budesonide in moderate to severe asthma. Curr. Med. Res. Opin., 2004; 20:
1403–1418
156. Rabe K.F., Pizzichini E., Stallberg B., Romero S., Balanzat A.M., Atienza T., et al.:
Budesonide/formoterol in a single inhaler for maintenance and relief in mild-to-mod-
erate asthma: a randomized, double-blind trial. Chest, 2006; 129: 246–256
157. Vogelmeier C., D’Urzo A., Pauwels R., Merino J.M., Jaspal M., Boutet S., et al.:
Budesonide/formoterol maintenance and reliever therapy: an effective asthma treat-
ment option? Eur. Respir. J., 2005; 26: 819–828
158. Ng D., Salvio F., Hicks G.: Anti-leukotriene agents compared to inhaled corticoster-
oids in the management of recurrent and/or chronic asthma in adults and children.
Cochrane Database Syst. Rev., 2004 (2): CD002314
159. Pauwels R.A., Lofdahl C.G., Postma D.S., Tattersfield A.E., O’Byrne P., Barnes P.J.,
et al.: Effect of inhaled formoterol and budesonide on exacerbations of asthma.
Formoterol and Corticosteroids Establishing Therapy (FACET) International Study
Group. N. Engl. J. Med., 1997; 337: 1405–1411
160. Szefler S.J., Martin R.J., King T.S., Boushey H.A., Cherniack R.M., Chinchilli V.M., et
al.: Significant variability in response to inhaled corticosteroids for persistent asthma.
J. Allergy Clin. Immunol., 2002; 109: 410–418
161. Powell H., Gibson P.G.: Inhaled corticosteroid doses in asthma: an evidence-based
approach. Med. J. Aust., 2003; 178: 223–225
162. Brown P.H., Greening A.P., Crompton G.K.: Large volume spacer devices and the influ-
ence of high dose beclomethasone dipropionate on hypothalamo-pituitary-adrenal
axis function. Thorax, 1993; 48: 233–238
163. Cates C.C., Bara A., Crilly J.A., Rowe B.H.: Holding chambers versus nebulisers for
beta-agonist treatment of acute asthma. Cochrane Database Syst. Rev., 2003 (3):
CD000052
164. Turner M.O., Patel A., Ginsburg S., FitzGerald J.M.: Bronchodilator delivery in acute
airflow obstruction: a meta-analysis. Arch. Intern. Med., 1997; 157: 1736–1744
165. Laviolette M., Malmstrom K., Lu S., Chervinsky P., Pujet J.C., Peszek I., et al.:
Montelukast added to inhaled beclomethasone in treatment of asthma. Montelukast/
Beclomethasone Additivity Group. Am. J. Respir. Crit. Care Med., 1999; 160: 1862–
1868
166. Lofdahl C.G., Reiss T.F., Leff J.A., Israel E., Noonan M.J., Finn A.F., et al.: Randomised,
placebo controlled trial of effect of a leukotriene receptor antagonist, montelukast,
on tapering inhaled corticosteroids in asthmatic patients. BMJ, 1999; 319: 87–90
167. Price D.B., Hernandez D., Magyar P., Fiterman J., Beeh K.M., James I.G., et al.:
Randomised controlled trial of montelukast plus inhaled budesonide versus double
dose inhaled budesonide in adult patients with asthma. Thorax, 2003; 58: 211–
216
168. Vaquerizo M.J., Casan P., Castillo J., Perpina M., Sanchis J., Sobradillo V., et al.: Effect
of montelukast added to inhaled budesonide on control of mild to moderate asthma.
Thorax, 2003; 58: 204–210
169. Nelson H.S., Busse W.W., Kerwin E., Church N., Emmett A., Rickard K., et al.:
Fluticasone propionate/salmeterol combination provides more effective asthma con-
trol than low-dose inhaled corticosteroid plus montelukast. J. Allergy Clin. Immunol.,
2000; 106: 1088–1095
170. Fish J.E., Israel E., Murray J.J., Emmett A., Boone R., Yancey S.W., et al.: Salmeterol
powder provides significantly better benefit than montelukast in asthmatic patients
receiving concomitant inhaled corticosteroid therapy. Chest, 2001; 120: 423–430
171. Ringdal N., Eliraz A., Pruzinec R., Weber H.H., Mulder P.G., Akveld M., et al.: The
salmeterol/fluticasone combination is more effective than fluticasone plus oral mon-
telukast in asthma. Respir. Med., 2003; 97: 234–241
172. Dahlen B., Nizankowska E., Szczeklik A., Zetterstrom O., Bochenek G., Kumlin M.,
et al.: Benefits from adding the 5-lipoxygenase inhibitor zileuton to conventional
therapy in aspirin-intolerant asthmatics. Am. J. Respir. Crit. Care Med., 1998; 157 (4
Pt 1): 1187–1194
173. Bjermer L., Bisgaard H., Bousquet J., Fabbri L.M., Greening A.P., Haahtela T., et al.:
Montelukast and fluticasone compared with salmeterol and fluticasone in protecting
against asthma exacerbation in adults: one year, double blind, randomised, com-
parative trial. BMJ, 2003; 327: 891
174. Pedersen S., Hansen O.R.: Budesonide treatment of moderate and severe asthma in
children: a dose-response study. J. Allergy Clin. Immunol., 1995; 95 (1 Pt 1): 29–33
175. Virchow J.C., Prasse A., Naya I., Summerton L., Harris A.: Zafirlukast improves asthma
control in patients receiving highdose inhaled corticosteroids. Am. J. Respir. Crit. Care
Med., 2000; 162 (2 Pt 1): 578–585
176. Malone R., LaForce C., Nimmagadda S., Schoaf L., House K., Ellsworth A., et al.:
The safety of twice-daily treatment with fluticasone propionate and salmeterol in
pediatric patients with persistent asthma. Ann. Allergy Asthma Immunol., 2005; 95:
66–71
177. Toogood J.H., Baskerville J.C., Jennings B., Lefcoe N.M., Johansson S.A.: Influence of
dosing frequency and schedule on the response of chronic asthmatics to the aerosol
steroid, budesonide. J. Allergy Clin. Immunol., 1982; 70: 288–298
178. Tamaoki J., Kondo M., Sakai N., Nakata J., Takemura H., Nagai A., et al.: Leukotriene
antagonist prevents exacerbation of asthma during reduction of high-dose inhaled
corticosteroid. The Tokyo Joshi-Idai Asthma Research Group. Am. J. Respir. Crit. Care
Med., 1997; 155: 1235–1240
179. Mash B., Bheekie A., Jones P.W.: Inhaled vs oral steroids for adults with chronic
asthma. Cochrane Database Syst. Rev., 2000: 2
180. Ayres J.G., Jyothish D., Ninan T.: Brittle asthma. Paediatr. Respir. Rev., 2004; 5: 40–
44
181. Milgrom H., Fick R.B. Jr, Su J.Q., Reimann J.D., Bush R.K., Watrous M.L., et al.:
Treatment of allergic asthma with monoclonal anti-IgE antibody. rhuMAb-E25 Study
Group. N. Engl. J. Med., 1999; 341: 1966–1973

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
9
182. Busse W., Corren J., Lanier B.Q., McAlary M., Fowler-Taylor A., Cioppa G.D., et al.:
Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treat-
ment of severe allergic asthma. J. Allergy Clin. Immunol., 2001; 108: 184–190
183. Humbert M., Beasley R., Ayres J., Slavin R., Hebert J., Bousquet J., et al.: Benefits of
omalizumab as add-on therapy in patients with severe persistent asthma who are
inadequately controlled despite best available therapy (GINA 2002 step 4 treatment):
INNOVATE. Allergy, 2005; 60: 309–316
184. Bousquet J., Wenzel S., Holgate S., Lumry W., Freeman P., Fox H.: Predicting response
to omalizumab, an anti-IgE antibody, in patients with allergic asthma. Chest, 2004;
125: 1378–1386
185. Holgate S.T., Chuchalin A.G., Hebert J., Lotvall J., Persson G.B., Chung K.F., et al.:
Efficacy and safety of a recombinant antiimmunoglobulin E antibody (omalizumab)
in severe allergic asthma. Clin. Exp. Allergy, 2004; 34: 632–638
186. Djukanovic R., Wilson S.J., Kraft M., Jarjour N.N., Steel M., Chung K.F., et al.: Effects
of treatment with anti-immunoglobulin E antibody omalizumab on airway inflamma-
tion in allergic asthma. Am. J. Respir. Crit. Care Med., 2004; 170: 583–593
187. Reddel H., Ware S., Marks G., Salome C., Jenkins C., Woolcock A.: Differences be-
tween asthma exacerbations and poor asthma control. Lancet, 1999; 353: 364–369
188. Sont J.K., Willems L.N., Bel E.H., van Krieken J.H., Vandenbroucke J.P., Sterk P.J.:
Clinical control and histopathologic outcome of asthma when using airway hyper-
responsiveness as an additional guide to long-term treatment. The AMPUL Study
Group. Am. J. Respir. Crit. Care Med., 1999; 159 (4 Pt 1): 1043–1051
189. Hawkins G., McMahon A.D., Twaddle S., Wood S.F., Ford I., Thomson N.C.: Stepping
down inhaled corticosteroids in asthma: randomised controlled trial. BMJ, 2003;
326: 1115
190. Powell H., Gibson P.G.: Initial starting dose of inhaled corticosteroids in adults with
asthma: a systematic review. Thorax, 2004; 59: 1041–1045
191. Powell H., Gibson P.G.: High dose versus low dose inhaled corticosteroid as initial
starting dose for asthma in adults and children. Cochrane Database Syst. Rev., 2004
(2): CD004109
192. Boulet L.P., Drollmann A., Magyar P., Timar M., Knight A., Engelstatter R., et al.:
Comparative efficacy of once-daily ciclesonide and budesonide in the treatment of
persistent asthma. Respir. Med., 2006; 100: 785–794
193. Masoli M., Weatherall M., Holt S., Beasley R.: Budesonide once versus twice-daily
administration: meta-analysis. Respirology, 2004; 9: 528–534
194. FitzGerald J.M., Boulet L.P., Follows R., M.A. CONCEPT: A one year, multi centre, rand-
omized double blind, double-dummy comparison of salmeterol/fluticasone propion-
ate using a stable dosing regimen with formoterol/budesonide using an adjustable
maintenance regimen in adults with persistent asthma. Clinical Therapeutics, 2005;
27: 1–14
195. Reddel H.K., Barnes D.J.: Pharmacological strategies for selfmanagement of asthma
exacerbations. Eur. Respir. J., 2006; 28: 182–199
196. Harrison T.W., Oborne J., Newton S., Tattersfield A.E.: Doubling the dose of inhaled
corticosteroid to prevent asthma exacerbations: randomised controlled trial. Lancet,
2004; 363: 271–275
197. Rabe K.F., Atienza T., Magyar P., Larsson P., Jorup C., Lalloo U.G.: Effect of budesonide
in combination with formoterol for reliever therapy in asthma exacerbations: a ran-
domised controlled, double-blind study. Lancet, 2006; 368: 744–753
198. Wenzel S.: Severe asthma in adults. Am. J. Respir. Crit. Care Med., 2005; 172: 149–
160
199. Thomson N.C., Chaudhuri R., Livingston E.: Asthma and cigarette smoking. Eur.
Respir. J., 2004; 24: 822–833
200. Leggett J.J., Johnston B.T., Mills M., Gamble J., Heaney L.G.: Prevalence of gastro-
esophageal reflux in difficult asthma: relationship to asthma outcome. Chest, 2005;
127: 1227–1231
201. Heaney L.G., Robinson D.S.: Severe asthma treatment: need for characterising pa-
tients. Lancet, 2005; 365: 974–976
202. FitzGerald J.M., Grunfeld A.: Status asthmaticus. In: Lichtenstein L.M., Fauci A.S., eds:
Current therapy in allergy, immunology, and rheumatology. 5th edition. St. Louis,
MO, Mosby, 1996: 63–67
203. Chan-Yeung M., Chang J.H., Manfreda J., Ferguson A., Becker A.: Changes in peak
flow, symptom score, and the use of medications during acute exacerbations of
asthma. Am. J. Respir. Crit. Care Med., 1996; 154 (4 Pt 1): 889–893
204. Beasley R., Miles J., Fishwick D., Leslie H.: Management of asthma in the hospital
emergency department. Br. J. Hosp. Med., 1996; 55: 253–257
205. FitzGerald J.M.: Development and implementation of asthma guidelines. Can. Respir.
J., 1998; 5 (suppl. A): 85S–88S
206. Turner M.O., Noertjojo K., Vedal S., Bai T., Crump S., FitzGerald J.M.: Risk factors for
near-fatal asthma. A case-control study in hospitalized patients with asthma. Am. J.
Respir. Crit. Care Med., 1998; 157 (6 Pt 1): 1804–1809
207. Ernst P., Spitzer W.O., Suissa S., Cockcroft D., Habbick B., Horwitz R.I., et al.: Risk of
fatal and near-fatal asthma in relation to inhaled corticosteroid use. JAMA, 1992;
268: 3462–3464
208. Suissa S., Blais L., Ernst P.: Patterns of increasing beta-agonist use and the risk of fatal
or near-fatal asthma. Eur. Respir. J., 1994; 7: 1602–1609
209. Joseph K.S., Blais L., Ernst P., Suissa S.: Increased morbidity and mortality related to
asthma among asthmatic patients who use major tranquillisers. BMJ, 1996; 312:
79–82
210. Geelhoed G.C., Landau L.I., Le Souef P.N.: Evaluation of SaO2 as a predictor of out-
come in 280 children presenting with acute asthma. Ann. Emerg. Med., 1994; 23:
1236–1241
211. Cates C.J., Rowe B.H.: Holding chambers versus nebulisers for beta-agonist treat-
ment of acute asthma. Cochrane Database Syst. Rev., 2000: 2
212. Plotnick L.H., Ducharme F.M.: Should inhaled anticholinergics be added to beta2 ago-
nists for treating acute childhood and adolescent asthma? A systematic review. BMJ,
1998; 317: 971–977
213. Shim C.S., Williams M.H. Jr: Evaluation of the severity of asthma: patients versus
physicians. Am. J. Med., 1980; 68: 11–13
214. Atta J.A., Nunes M.P., Fonseca-Guedes C.H., Avena L.A., Borgiani M.T., Fiorenza R.F.,
et al.: Patient and physician evaluation of the severity of acute asthma exacerbations.
Braz. J. Med. Biol. Res., 2004; 37: 1321–1330
215. Findley L.J., Sahn S.A.: The value of chest roentgenograms in acute asthma in adults.
Chest, 1981; 80: 535–536
216. Nowak R.M., Tomlanovich M.C., Sarkar D.D., Kvale P.A., Anderson J.A.: Arterial blood
gases and pulmonary function testing in acute bronchial asthma. Predicting patient
outcomes. JAMA, 1983; 249: 2043–2046
217. Cates C., FitzGerald J.M., O’Byrne P.M.: Asthma. Clin. Evidence, 2000; 3: 686–700
218. Chien J.W., Ciufo R., Novak R., Skowronski M., Nelson J., Coreno A., et al.:
Uncontrolled oxygen administration and respiratory failure in acute asthma. Chest,
2000; 117: 728–733
219. Rodrigo G.J., Rodriquez Verde M., Peregalli V., Rodrigo C.: Effects of short-term 28%
and 100% oxygen on PaCO2 and peak expiratory flow rate in acute asthma: a rand-
omized trial. Chest, 2003; 124: 1312–1317
220. Rudnitsky G.S., Eberlein R.S., Schoffstall J.M., Mazur J.E., Spivey W.H.: Comparison
of intermittent and continuously nebulized albuterol for treatment of asthma in an
urban emergency department. Ann. Emerg. Med., 1993; 22: 1842–1846
221. Lin R.Y., Sauter D., Newman T., Sirleaf J., Walters J., Tavakol M.: Continuous versus
intermittent albuterol nebulization in the treatment of acute asthma. Ann. Emerg.
Med., 1993; 22: 1847–1853
222. Reisner C., Kotch A., Dworkin G.: Continuous versus frequent intermittent nebuliza-
tion of albuterol in acute asthma: a randomized, prospective study. Ann. Allergy
Asthma Immunol., 1995; 75: 41–47
223. Gawchik S.M., Saccar C.L., Noonan M., Reasner D.S., DeGraw S.S.: The safety and
efficacy of nebulized levalbuterol compared with racemic albuterol and placebo in
the treatment of asthma in pediatric patients. J. Allergy Clin. Immunol., 1999; 103:
615–621
224. Lotvall J., Palmqvist M., Arvidsson P., Maloney A., Ventresca G.P., Ward J.: The thera-
peutic ratio of R-albuterol is comparable with that of RS-albuterol in asthmatic pa-
tients. J. Allergy Clin. Immunol., 2001; 108: 726–731
225. Milgrom H., Skoner D.P., Bensch G., Kim K.T., Claus R., Baumgartner R.A.: Low-dose
levalbuterol in children with asthma: safety and efficacy in comparison with placebo
and racemic albuterol. J. Allergy Clin. Immunol., 2001; 108: 938–945
226. Nowak R., Emerman C., Hanrahan J.P., Parsey M.V., Hanania N.A., Claus R., et al.:
A comparison of levalbuterol with racemic albuterol in the treatment of acute severe
asthma exacerbations in adults. Am. J. Emerg. Med., 2006; 24: 259–267
227. Carl J.C., Myers T.R., Kirchner H.L., Kercsmar C.M.: Comparison of racemic albuterol
and levalbuterol for treatment of acute asthma. J. Pediatr., 2003; 143: 731–736
228. Rodrigo G.J., Rodrigo C.: Continuous vs intermittent betaagonists in the treatment
of acute adult asthma: a systematic review with meta-analysis. Chest, 2002; 122:
160–165
229. Bradding P., Rushby I., Scullion J., Morgan M.D.: As-required versus regular neb-
ulized salbutamol for the treatment of acute severe asthma. Eur. Respir. J., 1999; 13:
290–294
230. Travers A., Jones A.P., Kelly K., Barker S.J., Camargo C.A., Rowe B.H.: Intravenous
beta2-agonists for acute asthma in the emergency department. Cochrane Database
Syst. Rev., 2001; 2
231. Rodrigo G., Rodrigo C., Burschtin O.: A meta-analysis of the effects of ipratropium
bromide in adults with acute asthma. Am. J. Med., 1999; 107: 363–370
232. Lanes S.F., Garrett J.E., Wentworth C.E. 3rd, Fitzgerald J.M., Karpel J.P.: The effect
of adding ipratropium bromide to salbutamol in the treatment of acute asthma:
a pooled analysis of three trials. Chest, 1998; 114: 365–372
233. Rodrigo G.J., Rodrigo C.: First-line therapy for adult patients with acute asthma re-
ceiving a multiple-dose protocol of ipratropium bromide plus albuterol in the emer-
gency department. Am. J. Respir. Crit. Care Med., 2000; 161: 1862–1868
234. Goggin N., Macarthur C., Parkin P.C.: Randomized trial of the addition of ipratropium
bromide to albuterol and corticosteroid therapy in children hospitalized because of
an acute asthma exacerbation. Arch. Pediatr. Adolesc. Med., 2001; 155: 1329–1334
235. Parameswaran K., Belda J., Rowe B.H.: Addition of intravenous aminophylline to
beta2-agonists in adults with acute asthma. Cochrane Database Syst. Rev., 2000: 4
236. Ream R.S., Loftis L.L., Albers G.M., Becker B.A., Lynch R.E., Mink R.B.: Efficacy of IV
theophylline in children with severe status asthmaticus. Chest, 2001; 119: 1480–
1488
237. Rowe B.H., Bota G.W., Fabris L., Therrien S.A., Milner R.A., Jacono J.: Inhaled budeso-
nide in addition to oral corticosteroids to prevent asthma relapse following discharge
from the emergency department: a randomized controlled trial. JAMA, 1999; 281:
2119–2126

WYTYCZNE
98
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
238. Manser R., Reid D., Abramson M.: Corticosteroids for acute severe asthma in hospi-
talised patients. Cochrane Database Syst. Rev., 2000: 2
239. Ratto D., Alfaro C., Sipsey J., Glovsky M.M., Sharma O.P.: Are intravenous corticoster-
oids required in status asthmaticus? JAMA, 1988; 260: 527–529
240. Harrison B.D., Stokes T.C., Hart G.J., Vaughan D.A., Ali N.J., Robinson A.A.: Need for
intravenous hydrocortisone in addition to oral prednisolone in patients admitted to
hospital with severe asthma without ventilatory failure. Lancet, 1986; 1: 181–184
241. Gries D.M., Moffitt D.R., Pulos E., Carter E.R.: A single dose of intramuscularly ad-
ministered dexamethasone acetate is as effective as oral prednisone to treat asthma
exacerbations in young children. J. Pediatr., 2000; 136: 298–303
242. Rowe B.H., Spooner C., Ducharme F.M., Bretzlaff J.A., Bota G.W.: Early emergency
department treatment of acute asthma with systemic corticosteroids. Cochrane
Database Syst. Rev., 2000: 2
243. Kayani S., Shannon D.C.: Adverse behavioral effects of treatment for acute exacerba-
tion of asthma in children: a comparison of two doses of oral steroids. Chest, 2002;
122: 624–628
244. Hasegawa T., Ishihara K., Takakura S., Fujii H., Nishimura T., Okazaki M., et al.:
Duration of systemic corticosteroids in the treatment of asthma exacerbation; a ran-
domized study. Intern. Med., 2000; 39: 794–797
245. O’Driscoll B.R., Kalra S., Wilson M., Pickering C.A., Carroll K.B., Woodcock A.A.:
Double-blind trial of steroid tapering in acute asthma. Lancet, 1993; 341: 324–327
246. Lederle F.A., Pluhar R.E., Joseph A.M., Niewoehner D.E.: Tapering of corticosteroid
therapy following exacerbation of asthma. A randomized, double-blind, placebo-
controlled trial. Arch. Intern. Med., 1987; 147: 2201–2203
247. Rodrigo G., Rodrigo C.: Inhaled flunisolide for acute severe asthma. Am. J. Respir.
Crit. Care Med., 1998; 157 (3 Pt 1): 698–703
248. Rodrigo G.J.: Comparison of inhaled fluticasone with intravenous hydrocortisone
in the treatment of adult acute asthma. Am. J. Respir. Crit. Care Med., 2005; 171:
1231–1236
249. Lee-Wong M., Dayrit F.M., Kohli A.R., Acquah S., Mayo P.H.: Comparison of high-dose
inhaled flunisolide to systemic corticosteroids in severe adult asthma. Chest, 2002;
122: 1208–1213
250. Nana A., Youngchaiyud P., Charoenratanakul S., Boe J., Lofdahl C.G., Selroos O., et
al.: High-dose inhaled budesonide may substitute for oral therapy after an acute
asthma attack. J. Asthma, 1998; 35: 647–655
251. FitzGerald J.M., Becker A., Chung K., Lee J.: Randomized, controlled, multi center
study to compare double does versus maintenance does of inhaled corticosteorids
(ICS) during asthma exacerbations. For the Canadian Asthma Exacerbation Study
Group. Am. J. Respir. Crit. Care Med., 2000
252. Edmonds M.L., Camargo C.A., Saunders L.D., Brenner B.E., Rowe B.H.: Inhaled ster-
oids in acute asthma following emergency department discharge (Cochrane review).
Cochrane Database Syst Rev 2000: 3
253. Rowe B.H., Bretzlaff J.A., Bourdon C., Bota G.W., Camargo C.A. Jr: Magnesium sulfate
for treating exacerbations of acute asthma in the emergency department. Cochrane
Database Syst. Rev., 2000: 2
254. FitzGerald J.M.: Magnesium sulfate is effective for severe acute asthma treated in the
emergency department. West. J. Med., 2000; 172: 96
255. Blitz M., Blitz S., Beasely R., Diner B., Hughes R., Knopp J., et al.: Inhaled magnesium
sulfate in the treatment of acute asthma. Cochrane Database Syst. Rev., 2005 (4):
CD003898
256. Blitz M., Blitz S., Hughes R., Diner B., Beasley R., Knopp J., et al.: Aerosolized magne-
sium sulfate for acute asthma: a systematic review. Chest, 2005; 128: 337–344
257. Rodrigo G.J., Rodrigo C., Pollack C.V., Rowe B.: Use of heliumoxygen mixtures in the
treatment of acute asthma: a systematic review. Chest, 2003; 123: 891–896
258. Silverman R.A., Nowak R.M., Korenblat P.E., Skobeloff E., Chen Y., Bonuccelli C.M., et
al.: Zafirlukast treatment for acute asthma: evaluation in a randomized, double-blind,
multicenter trial. Chest, 2004; 126: 1480–1489
259. FitzGerald J.M., Macklem P.: Fatal asthma. Annu. Rev. Med., 1996; 47: 161–168
260. Grunfeld A., Fitzgerald J.M.: Discharge considerations in acute asthma. Can. Respir.
J., 1996; 3: 322–324
261. Rodrigo G.J., Rodrigo C., Hall J.B.: Acute asthma in adults: a review. Chest, 2004;
125: 1081–1102
262. Zeiger R.S., Heller S., Mellon M.H., Wald J., Falkoff R., Schatz M.: Facilitated referral to
asthma specialist reduces relapses in asthma emergency room visits. J. Allergy Clin.
Immunol., 1991; 87: 1160–1168
263. Gibson P.G., Coughlan J., Wilson A.J., Abramson M., Bauman A., Hensley M.J., et al.:
Self-management education and regular practitioner review for adults with asthma.
Cochrane Database Syst. Rev., 2000; (2): CD001117
264. Baren J.M., Boudreaux E.D., Brenner B.E., Cydulka R.K., Rowe B.H., Clark S., et al.:
Randomized controlled trial of emergency department interventions to improve pri-
mary care follow-up for patients with acute asthma. Chest, 2006; 129: 257–265
265. Schatz M., Harden K., Forsythe A., Chilingar L., Hoffman C., Sperling W., et al.: The
course of asthma during pregnancy, post partum, and with successive pregnancies:
a prospective analysis. J. Allergy Clin. Immunol., 1988; 81: 509–517
266. Schatz M.: Interrelationships between asthma and pregnancy: a literature review.
J. Allergy Clin. Immunol., 1999; 103 (2 Pt 2): S330–S336
267. Demissie K., Breckenridge M.B., Rhoads G.G.: Infant and maternal outcomes in the
pregnancies of asthmatic women. Am. J. Respir. Crit. Care Med., 1998; 158: 1091–
1095
268. Schatz M., Zeiger R.S., Hoffman C.P., Harden K., Forsythe A., Chilingar L., et al.:
Perinatal outcomes in the pregnancies of asthmatic women: a prospective controlled
analysis. Am. J. Respir. Crit. Care Med., 1995; 151: 1170–1174
269. National Asthma Education Program. Report of the working group on asthma and
pregnancy: management of asthma during preganacy. Bethesda, MD: National
Heart, Lung, and Blood Institute. National Institutes of Health; 1993. Report No.: NIH
Publication Number 93–3279A
270. Wendel P.J., Ramin S.M., Barnett-Hamm C., Rowe T.F., Cunningham F.G.: Asthma
treatment in pregnancy: a randomized controlled study. Am. J. Obstet. Gynecol.,
1996; 175: 150–154
271. Murphy V.E., Gibson P.G., Smith R., Clifton V.L.: Asthma during pregnancy: mecha-
nisms and treatment implications. Eur. Respir. J., 2005; 25: 731–750
272. NAEPP expert panel report. Managing asthma during pregnancy: recommendations
for pharmacologic treatment-2004 update. J. Allergy Clin. Immunol., 2005; 115:
34–46
273. Schatz M., Zeiger R.S., Harden K.M., Hoffman C.P., Forsythe A.B., Chilingar L.M., et
al.: The safety of inhaled beta-agonist bronchodilators during pregnancy. J. Allergy
Clin. Immunol., 1988; 82: 686–695
274. Fung D.L.: Emergency anesthesia for asthma patients. Clin. Rev. Allergy, 1985; 3:
127–141
275. Kingston H.G., Hirshman C.A.: Perioperative management of the patient with asth-
ma. Anesth. Analg., 1984; 63: 844–855
276. Oh S.H., Patterson R.: Surgery in corticosteroid-dependent asthmatics. J. Allergy Clin.
Immunol., 1974; 53: 345–351
277. Leynaert B., Bousquet J., Neukirch C., Liard R., Neukirch F.: Perennial rhinitis: an in-
dependent risk factor for asthma in nonatopic subjects: results from the European
Community Respiratory Health Survey. J. Allergy Clin. Immunol., 1999; 104 (2 Pt 1):
301–304
278. Sibbald B., Rink E.: Epidemiology of seasonal and perennial rhinitis: clinical presenta-
tion and medical history. Thorax, 1991; 46: 895–901
279. Settipane R.J., Hagy G.W., Settipane G.A.: Long-term risk factors for developing
asthma and allergic rhinitis: a 23-year follow-up study of college students. Allergy
Proc., 1994; 15: 21–25
280. Price D., Zhang Q., Kocevar V.S., Yin D.D., Thomas M.: Effect of a concomitant di-
agnosis of allergic rhinitis on asthma-related health care use by adults. Clin. Exp.
Allergy, 2005; 35: 282–287
281. Sears M.R., Herbison G.P., Holdaway M.D., Hewitt C.J., Flannery E.M., Silva P.A.: The
relative risks of sensitivity to grass pollen, house dust mite and cat dander in the
development of childhood asthma. Clin. Exp. Allergy, 1989; 19: 419–424
282. Shibasaki M., Hori T., Shimizu T., Isoyama S., Takeda K., Takita H.: Relationship be-
tween asthma and seasonal allergic rhinitis in schoolchildren. Ann. Allergy, 1990; 65:
489–495
283. Malo J.L., Lemiere C., Desjardins A., Cartier A.: Prevalence and intensity of rhinoc-
onjunctivitis in subjects with occupational asthma. Eur. Respir. J., 1997; 10: 1513–
1515
284. Bousquet J., Van Cauwenberge P., Khaltaev N.: Allergic rhinitis and its impact on
asthma. J. Allergy Clin. Immunol., 2001; 108 (5 suppl.): S147–S334
285. Bentley A.M., Jacobson M.R., Cumberworth V., Barkans J.R., Moqbel R., Schwartz
L.B., et al.: Immunohistology of the nasal mucosa in seasonal allergic rhinitis: in-
creases in activated eosinophils and epithelial mast cells. J. Allergy Clin. Immunol.,
1992; 89: 877–883
286. Pauwels R.: Influence of treatment on the nose and/or the lungs. Clin. Exp. Allergy,
1998; 28 (suppl. 2): 37S–40S
287. Adams R.J., Fuhlbrigge A.L., Finkelstein J.A., Weiss S.T.: Intranasal steroids and the
risk of emergency department visits for asthma. J. Allergy Clin. Immunol., 2002; 109:
636–642
288. Dykewicz M.S., Fineman S.: Executive Summary of Joint Task Force Practice Parameters
on Diagnosis and Management of Rhinitis. Ann. Allergy Asthma Immunol., 1998; 81
(5 Pt 2): 463–468
289. Taramarcaz P., Gibson P.G.: Intranasal corticosteroids for asthma control in peo-
ple with coexisting asthma and rhinitis. Cochrane Database Syst. Rev., 2003 (4):
CD003570
290. Dahl R., Nielsen L.P., Kips J., Foresi A., Cauwenberge P., Tudoric N., et al.: Intranasal
and inhaled fluticasone propionate for pollen-induced rhinitis and asthma. Allergy,
2005; 60: 875–881
291. Corren J., Manning B.E., Thompson S.F., Hennessy S., Strom B.L.: Rhinitis therapy
and the prevention of hospital care for asthma: a case-control study. J. Allergy Clin.
Immunol., 2004; 113: 415–419
292. Wilson A.M., O’Byrne P.M., Parameswaran K.: Leukotriene receptor antagonists for
allergic rhinitis: a systematic review and meta-analysis. Am. J. Med., 2004; 116:
338–344
293. Abramson M.J., Puy R.M., Weiner J.M.: Allergen immunotherapy for asthma.
Cochrane Database Syst. Rev., 2003 (4): CD001186
294. Vignola A.M., Humbert M., Bousquet J., Boulet L.P., Hedgecock S., Blogg M., et
al.: Efficacy and tolerability of anti-immunoglobulin E therapy with omalizumab in
patients with concomitant allergic asthma and persistent allergic rhinitis: SOLAR.
Allergy, 2004; 59: 709–717
295. Kopp M.V., Brauburger J., Riedinger F., Beischer D., Ihorst G., Kamin W., et al.: The
effect of anti-IgE treatment on in vitro leukotriene release in children with seasonal
allergic rhinitis. J. Allergy Clin. Immunol., 2002; 110: 728–735

WYTYCZNE
Rozdział 4. Leczenie i prewencja astmy
99
296. Rossi O.V., Pirila T., Laitinen J., Huhti E.: Sinus aspirates and radiographic abnormali-
ties in severe attacks of asthma. Int. Arch. Allergy Immunol., 1994; 103: 209–213
297. Morris P.: Antibiotics for persistent nasal discharge (rhinosinusitis) in children
(Cochrane review). Cochrane Database Syst. Rev., 2000: 3
298. Larsen K.: The clinical relationship of nasal polyps to asthma. Allergy Asthma Proc.,
1996; 17: 243–249
299. Lamblin C., Tillie-Leblond I., Darras J., Dubrulle F., Chevalier D., Cardot E., et al.:
Sequential evaluation of pulmonary function and bronchial hyperresponsiveness in
patients with nasal polyposis: a prospective study. Am. J. Respir. Crit. Care Med.,
1997; 155: 99–103
300. Bernstein I.L., Chan-Yeung M., Malo J.L., Bernstein D.I.: Definition and classification
of asthma. In: Bernstein I.L., Chan-Yeung M., Malo J.L., Bernstein D.I., eds: Asthma in
the workplace. New York, Marcel Dekker, 1999: 1–4
301. Chan-Yeung M., Desjardins A.: Bronchial hyperresponsiveness and level of exposure
in occupational asthma due to western red cedar (Thuja plicata). Serial observa-
tions before and after development of symptoms. Am. Rev. Respir. Dis., 1992; 146:
1606–1609
302. Bernstein D.I., Cohn J.R.: Guidelines for the diagnosis and evaluation of occupational
immunologic lung disease: preface. J. Allergy Clin. Immunol., 1989; 84 (5 Pt 2):
791–793
303. Mapp C.E., Corona P.C., De Marzo N., Fabbri L.: Persistent asthma due to isocyanates.
A follow-up study of subjects with occupational asthma due to toluene diisocyanate
(TDI). Am. Rev. Respir. Dis., 1988; 137: 1326–1329
304. Lin F.J., Dimich-Ward H., Chan-Yeung M.: Longitudinal decline in lung function in
patients with occupational asthma due to western red cedar. Occup. Environ. Med.,
1996; 53: 753–756
305. Fabbri L.M., Danieli D., Crescioli S., Bevilacqua P., Meli S., Saetta M., et al.: Fatal
asthma in a subject sensitized to toluene diisocyanate. Am. Rev. Respir. Dis., 1988;
137: 1494–1498
306. Malo J.L.: Compensation for occupational asthma in Quebec. Chest, 1990; 98 (5
suppl.): 236S–239S
307. Gern J.E., Lemanske R.F. Jr: Infectious triggers of pediatric asthma. Pediatr. Clin. North
Am., 2003; 50: 555–575, vi
308. Busse W.W.: The role of respiratory viruses in asthma. In: Holgate S., ed.: Asthma:
physiology, immunopharmcology and treatment. London, Academic Press, 1993:
345–352
309. Kraft M.: The role of bacterial infections in asthma. Clin. Chest Med., 2000; 21:
301–313
310. Grunberg K., Sterk P.J.: Rhinovirus infections: induction and modulation of airways
inflammation in asthma. Clin. Exp. Allergy, 1999; 29 (suppl. 2): 65S–73S
311. Johnston S.L.: Viruses and asthma. Allergy, 1998; 53: 922–932
312. Weiss S.T., Tager I.B., Munoz A., Speizer F.E.: The relationship of respiratory infections
in early childhood to the occurrence of increased levels of bronchial responsiveness
and atopy. Am. Rev. Respir. Dis., 1985; 131: 573–578
313. Busse W.W.: Respiratory infections: their role in airway responsiveness and the
pathogenesis of asthma. J. Allergy Clin. Immunol., 1990; 85: 671–683
314. Hansbro P.M., Beagley K.W., Horvat J.C., Gibson P.G.: Role of atypical bacterial infec-
tion of the lung in predisposition/protection of asthma. Pharmacol. Ther., 2004; 101:
193–210
315. Richeldi L., Ferrara G., Fabbri L.M., Gibson P.G.: Macrolides for chronic asthma.
Cochrane Database Syst. Rev., 2002 (1): CD002997
316. Richeldi L., Ferrara G., Fabbri L., Lasserson T., Gibson P.: Macrolides for chronic asth-
ma. Cochrane Database Syst. Rev., 2005 (3): CD002997
317. Johnston S.L., Blasi F., Black P.N., Martin R.J., Farrell D.J., Nieman R.B.: The effect of
telithromycin in acute exacerbations of asthma. N. Engl. J. Med., 2006; 354: 1589–
1600
318. Harding S.M.: Acid reflux and asthma. Curr. Opin. Pulm. Med., 2003; 9: 42–45
319. Sontag S.J.: Why do the published data fail to clarify the relationship between gas-
troesophageal reflux and asthma? Am. J. Med., 2000; 108 (suppl. 4A): 159–169S
320. Gibson P.G., Henry R.L., Coughlan J.L.: Gastro-oesophageal reflux treatment for
asthma in adults and children. Cochrane Database Syst. Rev., 2000, 2
321. Barish C.F., Wu W.C., Castell D.O.: Respiratory complications of gastroesophageal
reflux. Arch. Intern. Med., 1985; 145: 1882–1888
322. Nelson H.S.: Is gastroesophageal reflux worsening your patients with asthma.
J. Resp. Dis., 1990; 11: 827–844
323. Szczeklik A., Stevenson D.D.: Aspirin-induced asthma: advances in pathogenesis,
diagnosis, and management. J. Allergy Clin. Immunol., 2003; 111: 913–921
324. Szczeklik A., Nizankowska E., Duplaga M.: Natural history of aspirin-induced asthma.
AIANE Investigators. European Network on Aspirin-Induced Asthma. Eur. Respir. J.,
2000; 16: 432–436
325. Szczeklik A., Sanak M., Nizankowska-Mogilnicka E., Kielbasa B.: Aspirin intolerance
and the cyclooxygenase-leukotriene pathways. Curr. Opin. Pulm. Med., 2004; 10:
51–56
326. Stevenson D.D.: Diagnosis, prevention, and treatment of adverse reactions to aspirin
and nonsteroidal anti-inflammatory drugs. J. Allergy Clin. Immunol., 1984; 74 (4 Pt
2): 617–622
327. Nasser S.M., Pfister R., Christie P.E., Sousa A.R., Barker J., Schmitz-Schumann M., et
al.: Inflammatory cell populations in bronchial biopsies from aspirin-sensitive asth-
matic subjects. Am. J. Respir. Crit. Care Med., 1996; 153: 90–96
328. Sampson A.P., Cowburn A.S., Sladek K., Adamek L., Nizankowska E., Szczeklik A.,
et al.: Profound overexpression of leukotriene C4 synthase in bronchial biopsies
from aspirin-intolerant asthmatic patients. Int. Arch. Allergy Immunol., 1997; 113:
355–357
329. Szczeklik A., Sanak M.: Genetic mechanisms in aspirin-induced asthma. Am. J. Respir.
Crit. Care Med., 2000; 161 (2 Pt 2): S142–S146
330. Slepian I.K., Mathews K.P., McLean J.A.: Aspirin-sensitive asthma. Chest, 1985; 87:
386–391
331. Nizankowska E., Bestynska-Krypel A., Cmiel A., Szczeklik A.: Oral and bronchial rovo-
cation tests with aspirin for diagnosis of aspirin-induced asthma. Eur. Respir. J., 2000;
15: 863–869
332. Szczeklik A., Stevenson D.D.: Aspirin-induced asthma: advances in pathogenesis and
management. J. Allergy Clin. Immunol., 1999; 104: 5–13
333. Milewski M., Mastalerz L., Nizankowska E., Szczeklik A.: Nasal provocation test with
lysine-aspirin for diagnosis of aspirinsensitive asthma. J. Allergy Clin. Immunol.,
1998; 101: 581–586
334. Szczeklik A., Nizankowska E., Czerniawska-Mysik G., Sek S.: Hydrocortisone and
airflow impairment in aspirin-induced asthma. J. Allergy Clin. Immunol., 1985; 76:
530–536
335. Dahlen S.E., Malmstrom K., Nizankowska E., Dahlen B., Kuna P., Kowalski M., et al.:
Improvement of aspirin-intolerant asthma by montelukast, a leukotriene antagonist:
a randomized, doubleblind, placebo-controlled trial. Am. J. Respir. Crit. Care Med.,
2002; 165: 9–14
336. Drazen J.M.: Asthma therapy with agents preventing leukotriene synthesis or action.
Proc. Assoc. Am. Physicians, 1999; 111: 547–559
337. Pleskow W.W., Stevenson D.D., Mathison D.A., Simon R.A., Schatz M., Zeiger R.S.:
Aspirin desensitization in aspirin-sensitive asthmatic patients: clinical manifestations
and characterization of the refractory period. J. Allergy Clin. Immunol., 1982; 69
(1 Pt 1): 11–19
338. Sheffer A.L., Austen K.F.: Exercise-induced anaphylaxis. J. Allergy Clin. Immunol.,
1980; 66: 106–111
339. The diagnosis and management of anaphylaxis. Joint Task Force on Practice
Parameters, American Academy of Allergy, Asthma and Immunology, American
College of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma
and Immunology. J. Allergy Clin. Immunol., 1998; 101 (6 Pt 2): S465–S528

WYTYCZNE
00
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
Rozdział 5. Wdrażanie
wytycznych postępowania
w astmie w systemach opieki
zdrowotnej
Wprowadzenie
Wykazano w różnych warunkach, że opieka nad
chorymi zgodna z wytycznymi postępowania
w astmie opartymi na danych naukowych daje lep-
sze wyniki. Wytyczne opracowuje się w taki spo-
sób, aby wszyscy członkowie zespołu opiekującego
się chorymi znali cele leczenia i różne sposoby ich
osiągnięcia. Wytyczne wyznaczają standardy opie-
ki klinicznej, mogą służyć jako podstawa do oceny
jakości opieki i ustalania wynagrodzenia, a także
jako materiał wyjściowy do edukacji pracowników
medycznych i pacjentów.
Jednak aby spowodować zmiany w praktyce
medycznej i poprawę wyników opieki nad pa-
cjentami, wytyczne oparte na danych naukowych
muszą zostać wdrożone i rozpowszechnione na
poziomie krajowym i lokalnym. Rozpowszechnia-
nie obejmuje edukację lekarzy w celu zwiększenia
świadomości problemu, wiedzy na dany temat
i zrozumienia zaleceń wytycznych. Rozpowszech-
nianie stanowi część procesu wdrażania wytycz-
nych, który polega na przełożeniu wytycznych
opartych na danych naukowych na wskazówki
do codziennej praktyki w celu uzyskania popra-
wy opieki nad pacjentami. Wdrażanie wytycznych
stwarza trudności na całym świecie. Bariery we
wdrażaniu wytycznych są bardzo różne: od słabej
infrastruktury, przez co leki nie docierają do od-
ległych zakątków kraju, po czynniki kulturowe,
które sprawiają, że pacjenci niechętnie przyjmują
przepisane leki (np. leki wziewne), oraz ignorowa-
nie wytycznych przez lekarzy. Istotną przeszkodą
w skutecznym przełożeniu wytycznych postępo-
wania w astmie na praktykę kliniczną jest ograni-
czony dostęp do tanich leków, zwłaszcza dla cho-
rych w krajach słabiej rozwiniętych, gdzie koszt
leczenia jest duży w porównaniu z przychodami
i zasobami.
Strategie wdrażania wytycznych
Wdrażanie wytycznych postępowania w astmie
powinno się rozpocząć od ustalenia celów i opra-
cowania strategii leczenia astmy, przy współpra-
cy różnych grup zajmujących się astmą, w tym
personelu opieki podstawowej i specjalistycznej,
urzędników zdrowia publicznego, pacjentów
i ich stowarzyszeń oraz całego społeczeństwa.
Cele i strategie wdrażania wytycznych będą róż-
ne w poszczególnych krajach, a nawet w obrębie
jednego kraju, z powodów ekonomicznych, kultu-
rowych i środowiskowych. Zagadnienia wspólne
przedstawiono na
rycinie 5-1.
Kolejnym etapem jest adaptacja wytycznych
do lokalnego użytku przez zespoły pracowników
podstawowej i specjalistycznej opieki medycznej.
W wielu krajach o niskim lub średnim dochodzie
nie traktuje się astmy jako wysokiego priorytetu
zdrowotnego, ponieważ inne, częstsze choroby
układu oddechowego, takie jak gruźlica i zapale-
nia płuc, są ważniejsze dla zdrowia publicznego.
1
Dlatego też praktyczne wytyczne postępowania
w astmie do wdrażania w krajach ubogich powinny
uwzględniać prosty algorytm różnicowania nieza-
kaźnych i zakaźnych chorób układu oddechowe-
go, proste obiektywne pomiary pomocne w roz-
poznaniu i leczeniu, takie jak zmienność PEF
2
,
Główne punkty
n
Aby spowodować zmiany w praktyce medycznej
i poprawę wyników opieki nad pacjentami, wy-
tyczne oparte na danych naukowych muszą zo-
stać wdrożone i rozpowszechnione na poziomie
krajowym i lokalnym.
n
Wdrażanie wytycznych postępowania w ast-
mie powinno obejmować wiele różnych grup
zawodowych i inne zainteresowane osoby oraz
uwzględniać lokalne uwarunkowania kulturowe
i ekonomiczne.
n
Ważną częścią procesu wdrażania wytycznych
jest określenie sposobów oceny efektywności i ja-
kości opieki.
n
Osoby zaangażowane w adaptację i wdrażanie
wytycznych postępowania w astmie muszą znać
koszty i opłacalność różnych zaleceń dotyczących
opieki nad chorymi.
n
GINA opracowała liczne materiały i programy
mające pomóc we wdrażaniu i rozpowszechnia-
niu wytycznych.

WYTYCZNE
Rozdział 5. Wdrażanie wytycznych postępowania w astmie...
0
dostępne leki zalecane do uzyskania kontroli ast-
my niezwiązane z dużym ryzykiem działań niepo-
żądanych, prosty schemat rozpoznawania astmy
ciężkiej oraz proste postępowanie diagnostyczne
i lecznicze odpowiednie do infrastruktury i ogra-
niczonych środków.
Następnie zaadaptowane wytyczne muszą być
szeroko rozpowszechnione różnymi kanałami
i w różnej postaci. Można to zrobić, na przykład
publikując je w fachowych czasopismach, ogłasza-
jąc na wielospecjalistycznych sympozjach, war-
sztatach i konferencjach z udziałem krajowych
i lokalnych ekspertów oraz angażując środki ma-
sowego przekazu do zwiększenia świadomości
głównych zagadnień dotyczących astmy w spo-
łeczeństwie.
3
Najskuteczniejsze interwencje pod
względem poprawy praktyki medycznej mają cha-
rakter wielowymiarowy i interaktywny.
4,5
Niewie-
le jednak wiadomo na temat ich opłacalności.
6
W niektórych krajach wdrażanie wytycznych
postępowania w astmie odbywa się na poziomie
krajowym we współpracy z ministerstwem zdro-
wia. Jako modelowy może służyć program wdra-
żania wytycznych realizowany w Finlandii, który
poprawił wyniki leczenia chorych; jest to długo-
terminowa, całościowa, wielowymiarowa inicja-
tywa w zakresie zdrowia publicznego, z dobrze
określonymi celami wdrażania wytycznych postę-
powania w astmie.
7,8
Programy w zakresie zdrowia publicznego an-
gażujące wiele różnych grup – w tym towarzystwa
medyczne, pracowników opieki zdrowotnej, grupy
wsparcia chorych, rząd i sektor prywatny – wdro-
żono w Australii (Australian National Asthma
Campaign,
http://www.nationalasthma.org.au)
i USA (National Asthma Education and Preven-
tion Program, http://www.nhlbi.nih.gov).
Ważną częścią procesu wdrażania wytycz-
nych jest określenie sposobów oceny efektywno-
ści i jakości opieki. Ocena ta obejmuje śledzenie
tradycyjnych parametrów epidemiologicznych,
takich jak chorobowość i umieralność, jak rów-
nież ocenę procesu wdrażania i efektów wytycz-
nych w różnych sektorach systemu opieki zdro-
wotnej. W każdym kraju powinno się określić
minimalny zestaw danych do oceny efektów zdro-
wotnych. Istnieją różne narzędzia, które pozwa-
lają w sposób powtarzalny i obiektywny oceniać
chorobowość związaną z astmą lub kontrolę ast-
my (np. Asthma Control Test
9
, Asthma Control
Questionnaire
1012
, Asthma Therapy Assessment
Questionnaire
13
). Wyniki takiej oceny powinno
się odnotowywać podczas każdej wizyty pacjenta;
w ten sposób dokumentuje się długoterminową
odpowiedź kliniczną pacjenta na leczenie. Bezpo-
średnia informacja zwrotna daje szereg korzyści:
dzięki temu pacjent i lekarz uświadamiają sobie
satysfakcjonującą i niesatysfakcjonującą kontrolę
astmy; informacja ta stanowi punkt odniesienia
do oceny pogarszania się astmy; jest też wskaź-
nikiem zmian w kontroli astmy w odpowiedzi na
modyfikacje leczenia. Sposób dostarczania zwrot-
Ryc. 5-1. Problemy do uwzględnienia
w implementacji wytycznych
postępowania w astmie na szczeblu
krajowym lub lokalnym
Jaka jest skala problemu astmy w całym kraju lub regionie?
Jak zostaną podzielone zadania pomiędzy poszczególne
podmioty zajmujące się opieką zdrowotną (lekarzy
i pielęgniarki, opieką szpitalną i podstawową opieką
zdrowotną)?
W jaki sposób opieka medyczna zostanie powiązana
z lokalnymi jednostkami służby zdrowia i inicjatywami
edukacyjnymi?
Jakie są najważniejsze (w kraju lub regionie) i możliwe
do wyeliminowania czynniki, których usunięcie pomoże
zapobiegać rozwojowi astmy lub występowaniu
zaostrzeń u chorych?
Które utrwalone obiegowe opinie na temat astmy i jej
leczenia, a także czynniki kulturowe będą wymagały
specjalnej uwagi?
Jakie leczenie obecnie się stosuje?
W jakim stopniu leki i opieka medyczna są dostępne i czy
chorych na nie stać?
Czy są dostępne inne leki, wystarczająco tanie i stabilne
w lokalnych warunkach klimatycznych?
Czy można ustalić standard w zakresie stosowanych
urządzeń do inhalacji i leków tak, aby zmniejszyć
problemy z ich ceną, przechowywaniem i dostępnością?
Kto będzie zapewniał leczenie stanów nagłych?
Które grupy w populacji są szczególnie narażone na
zachorowanie (np. mieszkańcy zatłoczonych centrów
miast, niezamożni, młodzież, mniejszości narodowe)?
Kto może pomóc w edukacji (pracownicy społeczni
zajmujący się ochroną zdrowia, osoby zajmujące się
promocją zdrowia, wyszkoleni edukatorzy obecnie
pracujący w innych programach, grupy samopomocy)?
Kto będzie odpowiedzialny za edukację pracowników
opieki zdrowotnej?
Kto będzie odpowiedzialny za edukację chorych?
W jaki sposób można włączyć edukację i leczenie chorych
na astmę do innych programów (np. ochrony zdrowia
dzieci)?

WYTYCZNE
02
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
nej informacji o określonych efektach klinicznych
uzyskiwanych przez lekarza u jego pacjentów
może być ważny dla lekarzy w podstawowej opie-
ce zdrowotnej, którzy leczą wiele chorób oprócz
astmy i nie można od nich oczekiwać, by znali
szczegółowo wytyczne i postępowali z pacjentami
zgodnie z tymi wytycznymi.
Wartość ekonomiczna interwencji
i wdrażanie wytycznych postępowania
w astmie
Koszty stanowią istotną barierę w dostarczaniu
optymalnej, opartej na danych naukowych opieki
zdrowotnej niemal w każdym kraju, chociaż ich
wpływ na dostęp pacjentów do leczenia bardzo
się różni zarówno między krajami, jak i w danym
kraju. Urzędnicy odpowiedzialni za opiekę zdro-
wotną podejmują na poziomie ogólnokrajowym
lub lokalnym decyzje dotyczące dostępności i alo-
kacji środków na opiekę nad chorymi na astmę,
rozważając bilans kosztów i efektów klinicznych
(korzyści i szkodliwości), często w odniesieniu
do konkurujących potrzeb zdrowia publicznego.
Koszty leczenia trzeba także jasno przedstawiać
podczas każdej wizyty pacjenta u lekarza, aby
nie stały się barierą w osiągnięciu kontroli ast-
my. Tak więc osoby zaangażowane w adaptację
i wdrażanie wytycznych postępowania w astmie
muszą znać koszty i opłacalność różnych zaleceń
dotyczących opieki nad chorymi. W związku z tym
poniżej krótko omówiono ocenę opłacalności w le-
czeniu astmy.
Wykorzystanie i koszt zasobów opieki
zdrowotnej
Od 35% do 50% wydatków medycznych zwią-
zanych z astmą jest następstwem leczenia za-
ostrzeń,
14
które przez większość są uważane za
przejaw niepowodzenia terapii. Hospitalizacja,
wizyty na oddziale ratunkowym lub niezapla-
nowane wizyty w przychodni oraz stosowanie
leków ratunkowych składają się na większość
kosztów leczenia związanych z zaostrzeniami.
W badaniach klinicznych dotyczących leczenia
astmy zaostrzenia charakteryzuje się zwyczajo-
wo poprzez zużycie zasobów opieki zdrowotnej,
samo lub w połączeniu z danymi co do objawów
i czynności płuc, zwłaszcza gdy głównym punk-
tem końcowym badania jest zmniejszenie często-
ści zaostrzeń lub czas do wystąpienia zaostrzenia.
Rutynowe zbieranie danych na temat zużycia
zasobów opieki zdrowotnej może się odbywać
poprzez wykorzystanie raportów sporządzonych
przez chorego lub osobę opiekującą się chorym.
W niektórych okolicznościach takie raporty mogą
być zastąpione przez generowane automatycznie
dane z dokumentacji medycznej i faktur, które są
bardziej wiarygodne.
13,15
Kompleksowe definicje astmy mogą obejmować
jedną lub więcej pozycji dotyczących zużycia zaso-
bów opieki zdrowotnej.
16,17
Zużycie tych zasobów
określa w dokładny i wiarygodny sposób zaostrze-
nie lub jego leczenie. Wiele złożonych wskaźni-
ków kontroli astmy stosowanych w publikacjach
naukowych zawierało hospitalizacje i dane na
temat leczenia ratunkowego, tj. niezaplanowane
lub pilne wizyty lekarskie, stosowanie β
2
-mimety-
ków w nebulizacji lub glikokortykosteroidów do-
ustnych. Chociaż uwzględnienie zużycia zasobów
opieki zdrowotnej jest niezbędne w pragmatycz-
nej definicji kontroli astmy, to dotychczas nie ma
odpowiedzi na pytanie, które z wielu możliwych
opcji opieki zdrowotnej (pojedyncze czy kombina-
cja kilku) mogą się przyczynić do akceptowalne-
go zdefiniowania kontroli i jakie wartości można
uważać za akceptowalną kontrolę.
Do badań oceniających wpływ wdrażania wy-
tycznych i konkretnych interwencji w astmie na
koszty opieki konieczne jest uzyskanie danych na
temat kosztów wdrażania (np. kosztów związa-
nych z rozpowszechnieniem i publikacją wytycz-
nych, kosztów edukacji personelu medycznego),
zapobiegawczego stosowania leków, diagnostycz-
nych i kontrolnych spirometrii, stosowania sprzę-
tu (spejserów, mierników PEF) i rutynowych
wizyt w gabinecie lekarskim, w celu uzupełnie-
nia danych dotyczących leczenia zaostrzeń. Te
wszystkie dane razem dają pełny obraz wykorzy-
stania zasobów opieki zdrowotnej. Dane te można
uzyskać w podobny sposób, wykorzystując samo-
dzielne raporty pacjentów lub z automatycznych
baz danych.
Kiedy zbierze się dane na temat zużycia za-
sobów opieki zdrowotnej, można ocenić koszty
poprzez przypisanie do zużytych zasobów cen
jednostkowych w lokalnej walucie. Ceny jednost-
kowe pochodzą zwykle z raportów rządowych,

WYTYCZNE
Rozdział 5. Wdrażanie wytycznych postępowania w astmie...
0
kontrolnych raportów lokalnych płatników, fak-
tur, baz danych dotyczących odszkodowań i histo-
rii chorób pacjentów.
Ocena czasu podróży chorego i opiekuna oraz
czasu oczekiwania na wizytę lekarską, jak rów-
nież ocena nieobecności w szkole lub pracy stano-
wią dodatkowe, ważne metody pomiaru następstw
astmy. Te pośrednie koszty astmy są znaczne,
oceniane na około 50% wydatków związanych
z chorobą.
14
Nie ma jednak wystandaryzowa-
nych, sprawdzonych i dopasowanych do konkret-
nych uwarunkowań kulturowych instrumentów
pozwalających oceniać te wskaźniki w różnych
populacjach.
Określenie ekonomicznej wartości
interwencji w astmie
Analizy ekonomiczne wymagają wyboru 3 głów-
nych parametrów oceny – oszacowania korzy-
ści zdrowotnych, ryzyka i kosztów związanych
z leczeniem. Te parametry można określić bezpo-
średnio na podstawie badań klinicznych lub w ba-
daniach z użyciem modelowania. Lokalne wyma-
gania wobec analiz ekonomicznych określają wy-
bór sposobu pomiaru korzyści zdrowotnych. Jeśli
decyzja ma być rozpatrywana na poziomie makro,
na przykład włączenie nowego rodzaju leczenia do
programu opieki zdrowotnej finansowanego przez
państwo lub do pakietu świadczeń objętych ubez-
pieczeniem – to analizy ekonomiczne wymagają
zastosowania wspólnej miary, takiej jak zyskane
lata życia, poprawa jakości życia mierzona za po-
mocą ogólnych profili zdrowotnych czy zyskane
lata życia z poprawką na jakość życia (quality ad-
justed life years – QALY).
18
Te parametry pomaga-
ją w porównaniach współczynników koszty/efek-
tywność pomiędzy różnymi stanami chorobowymi
i populacjami chorych. Jednakże QALY są trudne
do zmierzenia w astmie, zwłaszcza u dzieci, dla
których nie ma wystandaryzowanych metod po-
miaru preferencji. Niektórzy zalecają zastosowa-
nie w mianowniku analiz ekonomicznych miar
klinicznych, takich jak liczba dni bez objawów lub
kontrola astmy.
19
Ujednolicona definicja kontroli
astmy znacznie poprawiłaby przyjęcie analiz eko-
nomicznych niewykorzystujących QALY wśród
osób zainteresowanych ich projektowaniem i za-
stosowaniem.
Zasoby służące rozpowszechnianiu
i wdrażaniu wytycznych GINA
Materiały edukacyjne oparte na dokumencie
„Światowa strategia rozpoznawania, leczenia
i prewencji astmy” są dostępne w wielu formach,
łącznie z podręcznymi przewodnikami dla per-
sonelu opieki zdrowotnej oraz dla chorych i ich
rodzin. Są one dostępne na stronie internetowej
programu GINA (http://ginasthma.org). Co roku
Rada Naukowa programu GINA sprawdza kry-
tycznie ocenione piśmiennictwo na temat rozpo-
znawania, leczenia i prewencji astmy i uaktualnia
różne dokumenty programu GINA. Raport Grupy
Roboczej programu GINA
20
jest podstawą planu
strategii implementacyjnych.
Inne działania wspomagające wdrażanie zale-
ceń dotyczących rozpoznawania, leczenia i pre-
wencji astmy poprzez program GINA wymieniono
poniżej.
Strona internetowa GINA
(http://ginasthma.org)
Internet tworzy kanał dostępu, przekazywania
i wymiany informacji oraz pozwala na ogólno-
światowe rozpowszechnianie informacji medycz-
nej. Chociaż nadal nie jest powszechnie dostępny,
szczególnie w krajach biednych, istnieje ogólno-
światowa tendencja do zwiększania wykorzysta-
nia internetu w edukacji medycznej chorych na
astmę i opiekujących się nimi pracowników opieki
zdrowotnej. Zatem, aby ułatwić międzynarodową
komunikację z personelem medycznym, eksperta-
mi polityki zdrowotnej, chorymi i ich rodzinami,
program GINA od 1995 roku utrzymuje stronę
internetową w celu zapewnienia dostępu do doku-
mentów wytycznych GINA i materiałów eduka-
cyjnych dla chorych i społeczeństwa, jak również
aktualizacji działań i informacji o współpracują-
cych grupach i kontaktach na całym świecie.
Światowy Dzień Astmy
Zapoczątkowany w 1998 roku i obchodzony
w pierwszy wtorek maja, Światowy Dzień Astmy
organizuje program GINA we współpracy ze zor-
ganizowanymi grupami przedstawicieli ochrony
zdrowia i osobami prowadzącymi edukację cho-
rych na astmę na całym świecie. Działania zwią-
zane z Światowym Dniem Astmy skupiają się na
rozpowszechnianiu informacji na temat astmy

WYTYCZNE
0
MEDYCYNA PRAKTYCZNA – WYDANIE SPECJALNE 1/2007
w społeczeństwie, wśród personelu ochrony me-
dycznego i urzędników instytucji rządowych. Dzia-
łania te sprzyjają uznaniu znaczenia astmy na po-
ziomie lokalnym, krajowym i międzynarodowym,
z korzyścią dla chorych na astmę i ich bliskich.
Obejmują one wydarzenia sportowe, spotkania
osób chorych na astmę i ich rodzin z personelem
medycznym, spotkania z lokalnymi urzędnikami
zajmującymi się sprawami zdrowia w celu omó-
wienia postępów w leczeniu astmy, a także relacje
w prasie, radiu i telewizji. Informacje na temat
Światowego Dnia Astmy można znaleźć na stro-
nie internetowej GINA.
Inicjatywy regionalne
W celu zbadania tworzenia sieci mających uła-
twiać wdrażanie wytycznych wprowadzono w ży
cie dwie pilotażowe inicjatywy w Ameryce Środ-
kowej i w regionie Morza Śródziemnego. W każ-
dym państwie w tych regionach powołano lidera
GINA, który będzie nadzorował współpracę mię-
dzy GINA i lokalnymi grupami oraz nada wy-
tycznym GINA formę ułatwiającą ich stosowanie
przez pracowników opieki zdrowotnej i chorych
w danym regionie.
Zgromadzenie GINA
W celu zmaksymalizowania wzajemnych kontak-
tów między osobami na całym świecie zajmują-
cymi się leczeniem chorych na astmę powołano
w styczniu 2005 roku Zgromadzenie GINA. Zgro-
madzenie to stanowi forum dialogu między tymi
pracownikami opieki zdrowotnej, a także ułatwia
wymianę informacji na temat postępów nauko-
wych oraz wdrażania programów edukacyjnych,
leczniczych i profilaktycznych.
Ogólnoświatowe Przymierze Przeciwko
Przewlekłym Chorobom Układu Oddechowego
(Global Alliance Against Chronic Respiratory
Diseases – GARD)
GINA jest organizacją partnerską GARD – inicja-
tywy Światowej Organizacji Zdrowia (http://www.
who.int/respiratory/gard/en/). Celem GARD jest
ułatwianie współpracy programów rządowych
z pozarządowymi programami dotyczącymi prze-
wlekłych chorób układu oddechowego, co zapewni
bardziej efektywne wykorzystanie zasobów oraz
pozwoli uniknąć powtarzania tych samych dzia-
łań. Organizacje uczestniczące w GARD stworzą
kompleksowe, ogólnoświatowe podejście do zapo-
biegania i kontroli przewlekłych chorób układu
oddechowego, ze szczególnym naciskiem na sytu-
ację w krajach rozwijających się. Do celów GARD
należą strategie zdobywania tanich leków za po-
średnictwem Asthma Drug Facility (http://www.
GlobalADF.org); aktywnie rozwija je Międzynaro-
dowa Unia Przeciwko Gruźlicy i Chorobom Płuc
(International Union Against Tuberculosis and
Lung Diseases – IUATLD).
Piśmiennictwo
1. Stewart A.W., Mitchell E.A., Pearce N., Strachan D.P., Weilandon S.K.: The relation-
ship of per capita gross national product to the prevalence of symptoms of asthma
and other atopic diseases in children (ISAAC). Int. J. Epidemiol., 2001; 30: 173–179
2. Higgins B.G., Britton J.R., Chinn S., Cooper S., Burney P.G., Tattersfield A.E.:
Comparison of bronchial reactivity and peak expiratory flow variability measure-
ments for epidemiologic studies. Am. Rev. Respir. Dis., 1992; 145: 588–593
3. Partridge M.R., Harrison B.D., Rudolph M., Bellamy D., Silverman M.: The British
Asthma Guidelines – their production, dissemination and implementation. British
Asthma Guidelines Co-ordinating Committee. Respir. Med., 1998; 92: 1046–1052
4. Davis D.A., Thomson M.A., Oxman A.D., Haynes R.B.: Changing physician perfor-
mance. A systematic review of the effect of continuing medical education strategies.
JAMA, 1995; 274: 700–705
5. Bero L.A., Grilli R., Grimshaw J.M., Harvey E., Oxman A.D., Thomson M.A.: Closing
the gap between research and practice: an overview of systematic reviews of inter-
ventions to promote the implementation of research findings. The Cochrane Effective
Practice and Organization of Care Review Group. BMJ, 1998; 317: 465–468
6. Sullivan S.D., Lee T.A., Blough D.K., Finkelstein J.A., Lozano P., Inui T.S., et al.:
A multisite randomized trial of the effects of physician education and organizational
change in chronic asthma care: cost-effectiveness analysis of the Pediatric Asthma
Care Patient Outcomes Research Team II (PAC-PORT II). Arch. Pediatr. Adolesc. Med.,
2005; 159: 428–434
7. Haahtela T., Klaukka T., Koskela K., Erhola M., Laitinen L.A.: Asthma programme
in Finland: a community problem needs community solutions. Thorax, 2001; 56:
806–814
8. Haahtela T., Tuomisto L.E., Pietinalho A., Klaukka T., Erhola M., Kaila M., et al.: A 10
year asthma programme in Finland: major change for the better. Thorax, 2006; 61:
663–670
9. Nathan R.A., Sorkness C.A., Kosinski M., Schatz M., Li J.T., Marcus P., et al.:
Development of the asthma control test: a survey for assessing asthma control. J.
Allergy Clin. Immunol., 2004; 113: 59–65
10. Juniper E.F., Buist A.S., Cox F.M., Ferrie P.J., King D.R.: Validation of a standardized
version of the Asthma Quality of Life Questionnaire. Chest, 1999; 115: 1265–1270
11. Juniper E.F., Bousquet J., Abetz L., Bateman E.D.: Identifying ‘wellcontrolled’ and ‘not
well-controlled’ asthma using the Asthma Control Questionnaire. Respir. Med., 2005
12. Juniper E.F., Svensson K., Mork A.C., Stahl E.: Measurement properties and interpre-
tation of three shortened versions of the asthma control questionnaire. Respir. Med.,
2005; 99: 553–558
13. Vollmer W.M., Markson L.E., O’Connor E., Sanocki L.L., Fitterman L., Berger M., et al.:
Association of asthma control with health care utilization and quality of life. Am. J.
Respir. Crit. Care Med., 1999; 160 (5 Pt 1): 1647–1652
14. Weiss K.B., Sullivan S.D.: The health economics of asthma and rhinitis. I. Assessing
the economic impact. J. Allergy Clin. Immunol., 2001; 107: 3–8
15. Vollmer W.M., Markson L.E., O’Connor E., Frazier E.A., Berger M., Buist A.S.:
Association of asthma control with health care utilization: a prospective evaluation.
Am. J. Respir. Crit. Care Med., 2002; 165: 195–199
16. Global strategy for asthma management and prevention (updated 2005): Global
Initiative for Asthma (GINA). URL: http://www.ginasthma.org; 2005
17. Bateman E.D., Boushey H.A., Bousquet J., Busse W.W., Clark T.J., Pauwels R.A., et
al.: Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma
ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
18. Price M.J., Briggs A.H.: Development of an economic model to assess the cost ef-
fectiveness of asthma management strategies. Pharmacoeconomics, 2002; 20:
183–194
19. Sullivan S., Elixhauser A., Buist A.S., Luce B.R., Eisenberg J., Weiss K.B.: National
Asthma Education and Prevention Program working group report on the cost effec-
tiveness of asthma care. Am. J. Respir. Crit. Care Med., 1996; 154 (3 Pt 2): S84–S95
20. Global Initiative for asthma: Dissemination and Implementation of asthma guidelines
Report. Available from http://wwwginasthmaorg 2002

Wyszukiwarka
Podobne podstrony:
GINA raport
Pedagogika ekologiczna z uwzględnieniem tez raportów ekologicznych
czemu faceci gina mlodo www prezentacje org
Prezentacja Raport
bph pbk raport roczny 2001
No Home, No Homeland raport
Dzieci recesji Raport UNICEF
Pełnia szczęścia raport
DiW 3 raport lifting
Centrum Zielonych technologii raport
06 Raporty finansowe
Lab 3 Draft forms raport
1 Sprawko, Raport wytrzymałość 1b stal sila
Formularze i raporty
Raport 398, Fizyka jądrowa, Dozymetria
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
więcej podobnych podstron