
BUDOWA ENZYMÓW.
BUDOWA ENZYMÓW.
OGÓLNE INFORMACJE
OGÓLNE INFORMACJE
O ENZYMACH.
O ENZYMACH.
Rysunek tytułowy w: L. Stryer. 2003. Biochemia.
Rozdział 8
Monika Kurpas
Grupa AUT2
Biotechnologia

ENZYMY JAKO BIAŁKA
ENZYMY JAKO BIAŁKA
duża masa
duża masa
cząsteczkowa
cząsteczkowa
obecność
obecność
łańcuchów
łańcuchów
polipeptydowyc
polipeptydowyc
h
h
skład
skład
aminokwasowy
aminokwasowy
enzymów taki
enzymów taki
sam jak innych
sam jak innych
białek
białek
http://g.pwn.pl/f/img/h/d88i6602.jpg
Struktura trzeciorzędowa
hemoglobiny

ENZYMY JAKO
ENZYMY JAKO
KATALIZATORY
KATALIZATORY
enzymy są katalizatorami, które
enzymy są katalizatorami, które
zmieniają szybkość reakcji, same
zmieniają szybkość reakcji, same
nie ulegając zmianie
nie ulegając zmianie
enzymy są wysoce specyficzne
enzymy są wysoce specyficzne
aktywność enzymów może być
aktywność enzymów może być
regulowana
regulowana

ENZYMY JAKO
ENZYMY JAKO
KATALIZATORY c.d.
KATALIZATORY c.d.
Istotą działania enzymów jest
Istotą działania enzymów jest
katalizowanie reakcji przez
katalizowanie reakcji przez
stabilizację stanów przejściowych,
stabilizację stanów przejściowych,
które na drogach reakcji są
które na drogach reakcji są
stanami o najwyższej energii.
stanami o najwyższej energii.
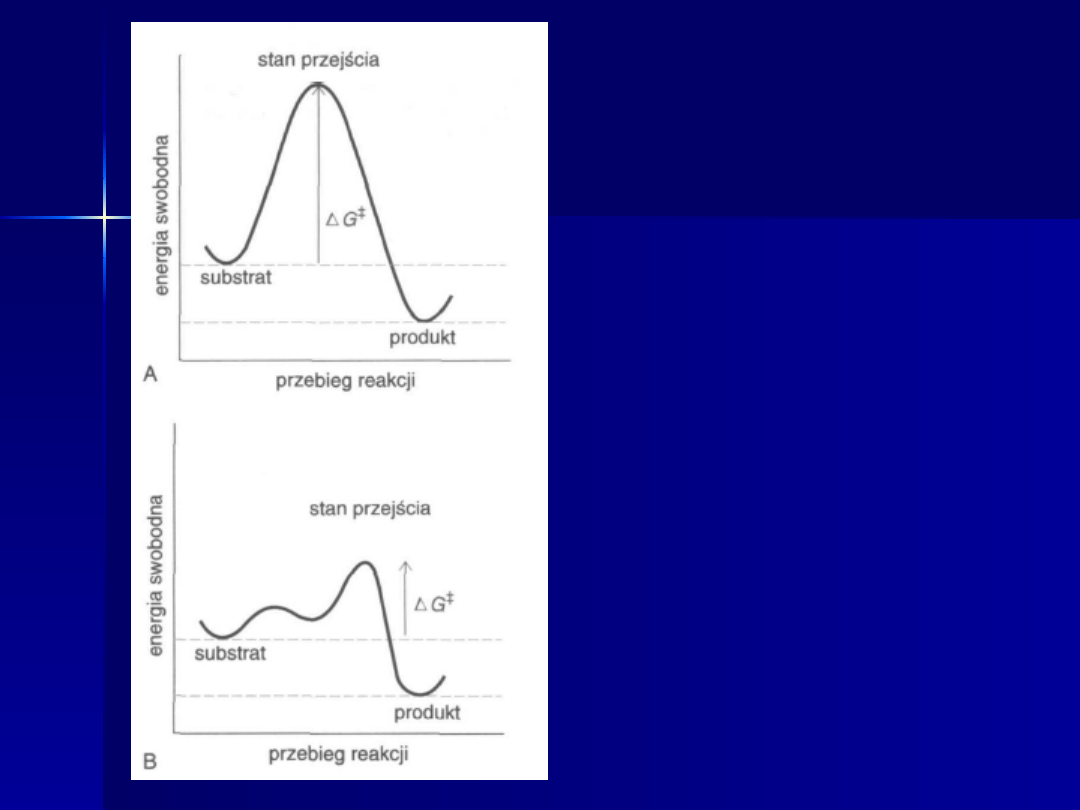
Wpływ enzymów
Wpływ enzymów
na stan
na stan
przejściowy
przejściowy
reakcji
reakcji
Porównanie
Porównanie
profilu swobodnej
profilu swobodnej
energii reakcji
energii reakcji
niekatalizowanej
niekatalizowanej
(A) i
(A) i
katalizowanej (B)
katalizowanej (B)
przez enzymy
przez enzymy
Rys. 8-7. w: L. Stryer. 2003. Biochemia.

Regulacja aktywności
Regulacja aktywności
katalitycznej enzymów
katalitycznej enzymów
enzym katalizujący pierwszy etap
enzym katalizujący pierwszy etap
szlaku biosyntetycznego jest
szlaku biosyntetycznego jest
zazwyczaj hamowany produktem
zazwyczaj hamowany produktem
końcowym tego szlaku
końcowym tego szlaku
kontrola białek regulacyjnych
kontrola białek regulacyjnych
modyfikacja kowalencyjna
modyfikacja kowalencyjna

INHIBICJA ENZYMÓW
INHIBICJA ENZYMÓW
Inhibicja aktywności
Inhibicja aktywności
enzymatycznej przez specyficzne
enzymatycznej przez specyficzne
małe cząsteczki oraz jony ma
małe cząsteczki oraz jony ma
istotne znaczenie, służąc jako
istotne znaczenie, służąc jako
główny mechanizm kontroli w
główny mechanizm kontroli w
układach biologicznych. Inhibicja
układach biologicznych. Inhibicja
enzymu może być procesem
enzymu może być procesem
odwracalnym lub nieodwracalnym.
odwracalnym lub nieodwracalnym.

Typy inhibicji
Typy inhibicji
odwracalnej
odwracalnej
kompetencyjna
kompetencyjna
- inhibitor jest podobny
- inhibitor jest podobny
do substratu i wiąże się w miejscu
do substratu i wiąże się w miejscu
aktywnym enzymu, zapobiegając
aktywnym enzymu, zapobiegając
wiązaniu substratu z tym miejscem
wiązaniu substratu z tym miejscem
niekompetencyjna
niekompetencyjna
– inhibitor i substrat
– inhibitor i substrat
mogą się równocześnie wiązać z
mogą się równocześnie wiązać z
cząsteczką enzymu. Działanie inhibitora
cząsteczką enzymu. Działanie inhibitora
niekompetencyjnego polega na
niekompetencyjnego polega na
zmniejszeniu liczby obrotów enzymu, nie
zmniejszeniu liczby obrotów enzymu, nie
zaś na zmniejszeniu liczby cząsteczek
zaś na zmniejszeniu liczby cząsteczek
enzymu wiążących substrat
enzymu wiążących substrat
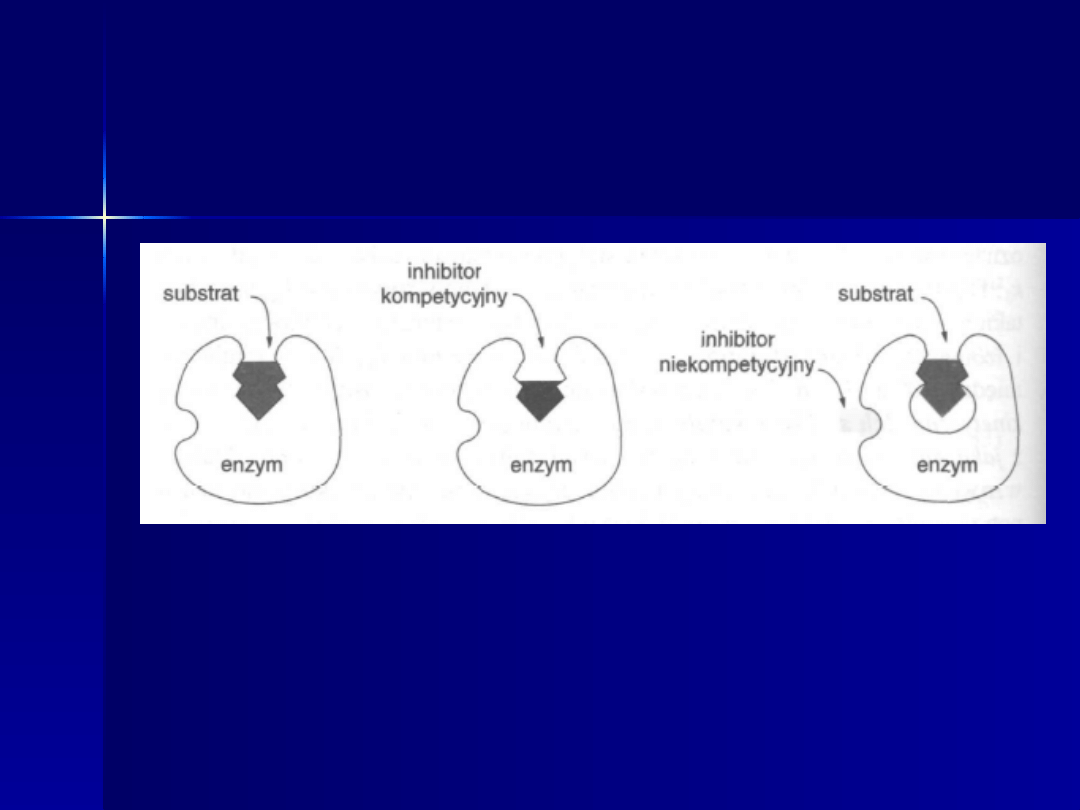
Typy inhibicji
Typy inhibicji
odwracalnej c.d.
odwracalnej c.d.
Inhibitor kompetencyjny (w środku)
Inhibitor kompetencyjny (w środku)
zapobiega wiązaniu substratu
zapobiega wiązaniu substratu
Inhibitor niekompetencyjny (z prawej)
Inhibitor niekompetencyjny (z prawej)
nie zapobiega wiązaniu substratu
nie zapobiega wiązaniu substratu
Rys. 8-19. w: L. Stryer. 2003. Biochemia

MIEJSCE AKTYWNE
MIEJSCE AKTYWNE
Miejsce aktywne enzymu
Miejsce aktywne enzymu
to
to
obszar, który wiąże substraty (i
obszar, który wiąże substraty (i
grupę prostetyczną, jeżeli taka
grupę prostetyczną, jeżeli taka
występuje) oraz dostarcza reszt
występuje) oraz dostarcza reszt
aminokwasowych biorących
aminokwasowych biorących
bezpośredni udział w tworzeniu i
bezpośredni udział w tworzeniu i
zrywaniu wiązań. Te reszty nazywa
zrywaniu wiązań. Te reszty nazywa
się
się
grupami katalitycznymi
grupami katalitycznymi
enzymu
enzymu
.
.

Cechy wspólne miejsc
Cechy wspólne miejsc
aktywnych enzymów
aktywnych enzymów
miejsce aktywne zajmuje stosunkowo małą część
miejsce aktywne zajmuje stosunkowo małą część
całkowitej objętości cząsteczki enzymu
całkowitej objętości cząsteczki enzymu
miejsce aktywne jest układem przestrzennym
miejsce aktywne jest układem przestrzennym
złożonym z grup chemicznych, leżących w
złożonym z grup chemicznych, leżących w
różnych pozycjach liniowej sekwencji
różnych pozycjach liniowej sekwencji
aminokwasów
aminokwasów
w połączeniach substratów z enzymami biorą
w połączeniach substratów z enzymami biorą
udział stosunkowo słabe siły wiązania
udział stosunkowo słabe siły wiązania
miejsca aktywne są zagłębieniami lub
miejsca aktywne są zagłębieniami lub
szczelinami
szczelinami
specyficzność wiązania zależy od precyzyjnie
specyficzność wiązania zależy od precyzyjnie
określonego ułożenia w miejscu aktywnym.
określonego ułożenia w miejscu aktywnym.

Substrat jest wiązany w
Substrat jest wiązany w
miejscu aktywnym przez
miejscu aktywnym przez
liczne słabe siły:
liczne słabe siły:
oddziaływania elektrostatyczne
oddziaływania elektrostatyczne
wiązania wodorowe
wiązania wodorowe
siły van der Waalsa
siły van der Waalsa
oddziaływania hydrofobowe
oddziaływania hydrofobowe
w pewnych przypadkach:
w pewnych przypadkach:
odwracalne wiązania
odwracalne wiązania
kowalencyjne
kowalencyjne

MIEJSCE AKTYWNE
MIEJSCE AKTYWNE
Modele wyjaśniające sposób, w jaki
Modele wyjaśniające sposób, w jaki
enzym wiąże swój substrat:
enzym wiąże swój substrat:
model zamka i klucza (E. Fischer;
model zamka i klucza (E. Fischer;
1984)
1984)
model dopasowania
model dopasowania
indukowanego
indukowanego
(D. E. Koshland, Jr; 1958)
(D. E. Koshland, Jr; 1958)
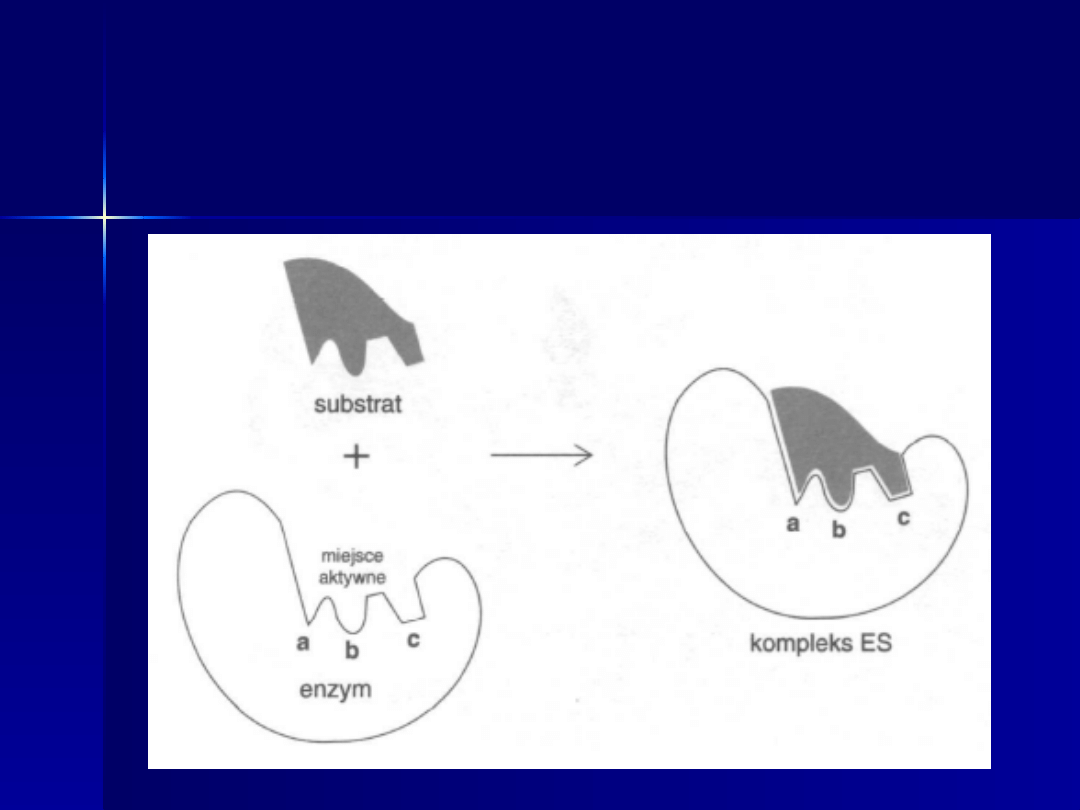
Model zamka i klucza
Model zamka i klucza
Rys. 8-13. w: L. Stryer. 2003. Biochemia.
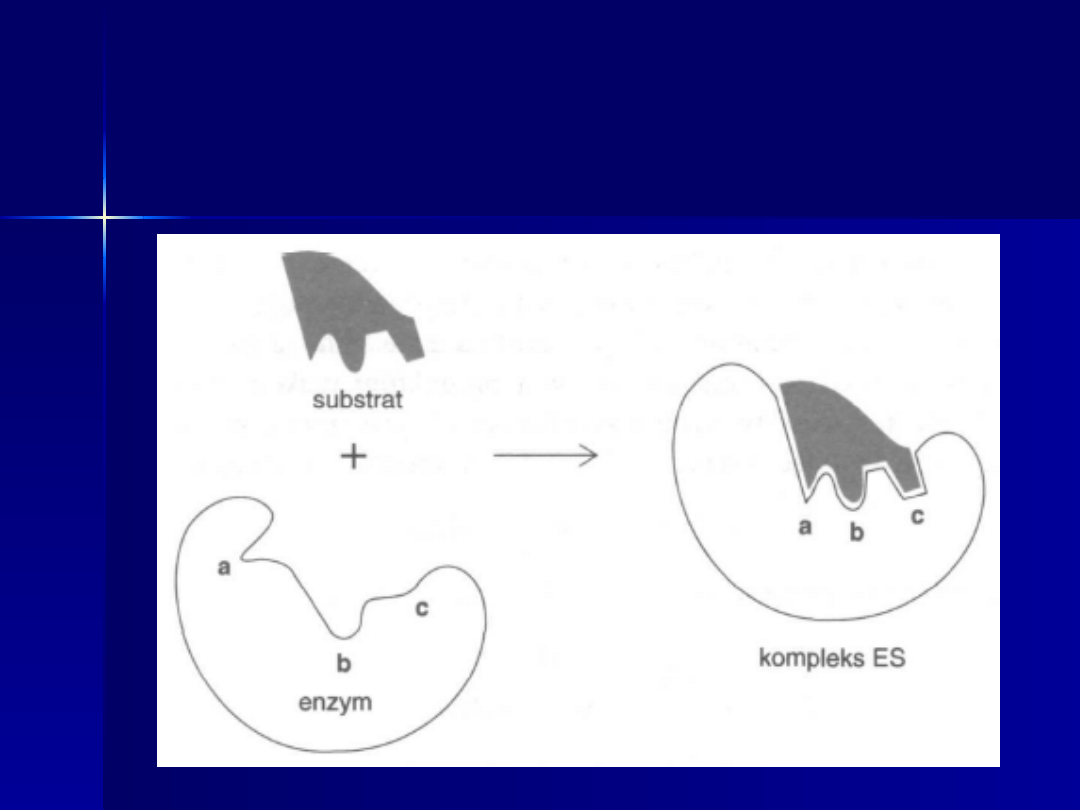
Model dopasowania
Model dopasowania
indukowanego
indukowanego
Rys. 8-14. w: L. Stryer. 2003. Biochemia

SPECYFICZNOŚĆ
SPECYFICZNOŚĆ
SUBSTRATOWA
SUBSTRATOWA
O specyficzności substratowej
O specyficzności substratowej
enzymu decydują właściwości i
enzymu decydują właściwości i
przestrzenne ułożenie reszt
przestrzenne ułożenie reszt
aminokwasów tworzących miejsce
aminokwasów tworzących miejsce
aktywne.
aktywne.

KLASYFIKACJA
KLASYFIKACJA
ENZYMÓW
ENZYMÓW
Enzymy dzieli się na sześć głównych
Enzymy dzieli się na sześć głównych
grup, z których każda dzieli się na
grup, z których każda dzieli się na
pewną liczbę podklas, a te z kolei na
pewną liczbę podklas, a te z kolei na
podpodklasy zgodnie z charakterem
podpodklasy zgodnie z charakterem
katalizowanych reakcji. Każdy
katalizowanych reakcji. Każdy
enzym ma charakterystyczny
enzym ma charakterystyczny
numer klasyfikacyjny w systemie
numer klasyfikacyjny w systemie
nazewnictwa enzymów składający
nazewnictwa enzymów składający
się z czterech liczb.
się z czterech liczb.

Międzynarodowa
Międzynarodowa
klasyfikacja enzymów
klasyfikacja enzymów
Tabela 1 w:
B.D. Hames and N.M. Hooper. 1999, 2002. Krótkie wykłady –
B.D. Hames and N.M. Hooper. 1999, 2002. Krótkie wykłady –
biochemia. Rozdział C1.
biochemia. Rozdział C1.

HOLOENZYM,
HOLOENZYM,
APOENZYM I
APOENZYM I
KOFAKTOR
KOFAKTOR
Pewne enzymy, aby funkcjonować,
Pewne enzymy, aby funkcjonować,
wymagają obecności kofaktorów -
wymagają obecności kofaktorów -
małych jednostek niebiałkowych.
małych jednostek niebiałkowych.
Kofaktorami
Kofaktorami
mogą być nieorganiczne
mogą być nieorganiczne
jony lub złożone cząsteczki organiczne,
jony lub złożone cząsteczki organiczne,
nazywane koenzymami.
nazywane koenzymami.
Holoenzym
Holoenzym
jest katalitycznie aktywną
jest katalitycznie aktywną
formą enzymu z jego kofaktorem,
formą enzymu z jego kofaktorem,
natomiast
natomiast
apoenzym
apoenzym
to tylko sama
to tylko sama
jego część białkowa.
jego część białkowa.

KOENZYMY
KOENZYMY
Koenzymy
Koenzymy
są to związki organiczne,
są to związki organiczne,
przeważnie pochodne fosforanowe,
przeważnie pochodne fosforanowe,
luźno związane z białkiem lub tworzące
luźno związane z białkiem lub tworzące
kowalencyjnie dołączoną
kowalencyjnie dołączoną
grupę
grupę
prostetyczną
prostetyczną
. Funkcja koenzymu
. Funkcja koenzymu
wyraża się udziałem w katalizowanej
wyraża się udziałem w katalizowanej
reakcji – przenoszenie pewnych
reakcji – przenoszenie pewnych
określonych atomów, elektronów lub
określonych atomów, elektronów lub
grup chemicznych ze stosownego
grup chemicznych ze stosownego
donatora na odpowiedni akceptor.
donatora na odpowiedni akceptor.

GRUPY PROSTETYCZNE
GRUPY PROSTETYCZNE
Grupami prostetycznymi
Grupami prostetycznymi
mogą
mogą
być: reszta kwasu fosforowego,
być: reszta kwasu fosforowego,
grupy cukrowe, flawiny, związki
grupy cukrowe, flawiny, związki
hemu, nukleotydy lub
hemu, nukleotydy lub
karotenowce. Przeważnie grupa
karotenowce. Przeważnie grupa
prostetyczna ma związek z
prostetyczna ma związek z
czynnością katalityczną.
czynnością katalityczną.

OZNACZANIE
OZNACZANIE
ENZYMÓW
ENZYMÓW
Oznaczanie enzymu polega na pomiarze
Oznaczanie enzymu polega na pomiarze
przemiany substratu w produkt w warunkach
przemiany substratu w produkt w warunkach
obecności kofaktorów i w określonym pH oraz
obecności kofaktorów i w określonym pH oraz
temperaturze, w których enzym jest optymalnie
temperaturze, w których enzym jest optymalnie
aktywny. Używa się dużych stężeń substratu,
aktywny. Używa się dużych stężeń substratu,
przez co początkowa szybkość reakcji jest
przez co początkowa szybkość reakcji jest
proporcjonalna do stężenia enzymu. Mierzy się
proporcjonalna do stężenia enzymu. Mierzy się
albo szybkość powstawania produktu albo
albo szybkość powstawania produktu albo
szybkość zużywania substratu, często posługując
szybkość zużywania substratu, często posługując
się zmianami absorbancji mierzonymi
się zmianami absorbancji mierzonymi
spektrofotometrycznie. Do monitorowanie reakcji
spektrofotometrycznie. Do monitorowanie reakcji
enzymatycznej często używa się zredukowanego
enzymatycznej często używa się zredukowanego
dinukleotydu nikotynoamidoadeninowego (NADH)
dinukleotydu nikotynoamidoadeninowego (NADH)
oraz zredukowanego fosforanu dinukleotydu
oraz zredukowanego fosforanu dinukleotydu
nikotynoamidoadeninowego (NADPH), które
nikotynoamidoadeninowego (NADPH), które
absorbują światło przy 340 nm.
absorbują światło przy 340 nm.

POMIAR POŁĄCZONYCH
POMIAR POŁĄCZONYCH
REAKCJI
REAKCJI
ENZYMATYCZNYCH
ENZYMATYCZNYCH
Jeśli ani substrat, ani produkt reakcji
Jeśli ani substrat, ani produkt reakcji
katalizowanej enzymatycznie nie
katalizowanej enzymatycznie nie
absorbuje światła przy dostępnej dla
absorbuje światła przy dostępnej dla
pomiarów długości fali, enzym można
pomiarów długości fali, enzym można
oznaczyć wiążąc reakcję z reakcją
oznaczyć wiążąc reakcję z reakcją
katalizowaną przez inny enzym, w której
katalizowaną przez inny enzym, w której
występują zmiany absorbancji. Ten drugi
występują zmiany absorbancji. Ten drugi
enzym musi być użyty w nadmiarze,
enzym musi być użyty w nadmiarze,
przez co etapem ograniczającym w takim
przez co etapem ograniczającym w takim
połączonym pomiarze jest działanie
połączonym pomiarze jest działanie
pierwszego enzymu.
pierwszego enzymu.

IZOENZYMY
IZOENZYMY
Izoenzymy są różnymi formami
Izoenzymy są różnymi formami
danego enzymu, które katalizują
danego enzymu, które katalizują
tę samą reakcję, ale wykazują
tę samą reakcję, ale wykazują
odmienne właściwości fizyczne
odmienne właściwości fizyczne
lub kinetyczne.
lub kinetyczne.

Bibliografia
Bibliografia
B.D. Hames and N.M. Hooper.
B.D. Hames and N.M. Hooper.
1999, 2002. Krótkie wykłady –
1999, 2002. Krótkie wykłady –
biochemia.
biochemia.
Zespół pod red. Edwarda
Zespół pod red. Edwarda
Szczeklika. 1974. Enzymologia
Szczeklika. 1974. Enzymologia
kliniczna.
kliniczna.
L. Stryer. 2003. Biochemia.
L. Stryer. 2003. Biochemia.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Monika Kurpas gr AUT2 Budowa enzymów Ogólne informacje o enzymach
Budowa komputera, Ogólne informacje o budowie i zasadzie działania komputera
Państwa Ogólne informacje
Budowa enzymów ściąga
Ogólne informacje na temat systemu tachografów cyfrowych
Ogólne informacje o giełdzie, Ekonomia i zarządzanie
Atopowe zapalenie skóry ogólne informacje
ogólne informacje o renesansie
Ogólne informacje o Biblii
Wyklad - 25.XI.09, Studia, Ogólne, Informatyka
MMS - ogolne inform. i dawkowanie
Wyklad - 14.X.09, Studia, Ogólne, Informatyka
Wyklad 1 Ogolne informacje ZIMA 20112012
Ogólne informacje na temat zasad tworzenia dokumentacji technicznej z badań doświadczalnych
BIOMECHANIKA, Biomech.sprawozdanie nr2, Monika Grabowska gr
BIOMECHANIKA, Biomech.sprawozdanie nr3, Monika Grabowska gr
Aksjologia ogólne informacje, Aksjologia
więcej podobnych podstron