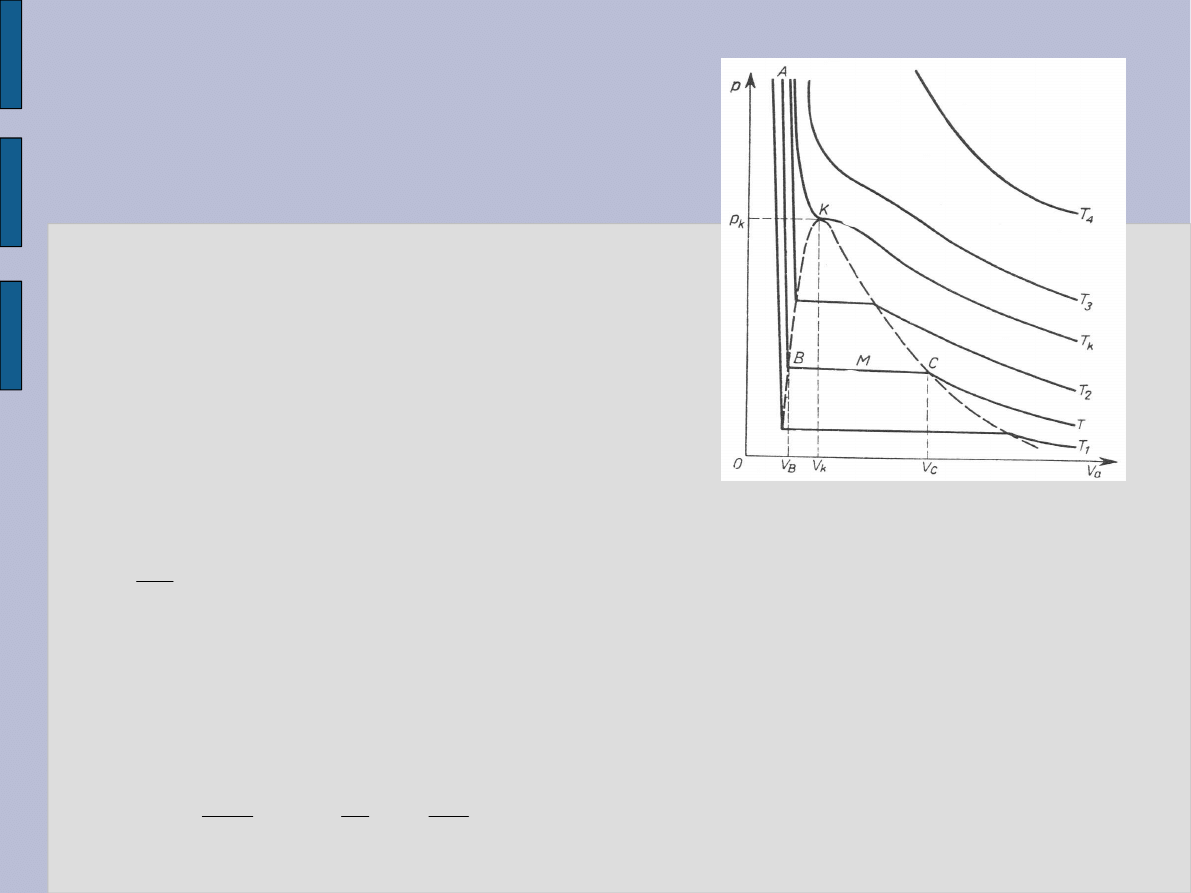
Izotermy gazów
rzeczywistych
Andrews badał zależność p od V
0
dla
CO
2
przy sprężaniu izotermicznym
.
1
2
3
4
T
T
T
T
T
T
k
T
k
– temperatura krytyczna.
Dla T < T
k
:
AB – ciecz,
CT – gaz,
BC - ciecz i gaz.
Takie zachowanie się gazów
przewiduje równania van der Waalsa.
,
)
(
2
RT
b
V
V
a
p
Równanie van der Waalsa dla 1 mola
gazu
(1)
(2
)
(3
)
można wyrazić w
postaci:
(4)
Stąd
.
0
)
(
2
3
ab
aV
V
RT
pb
pV
.
0
2
3
p
ab
V
p
a
V
p
RT
b
V
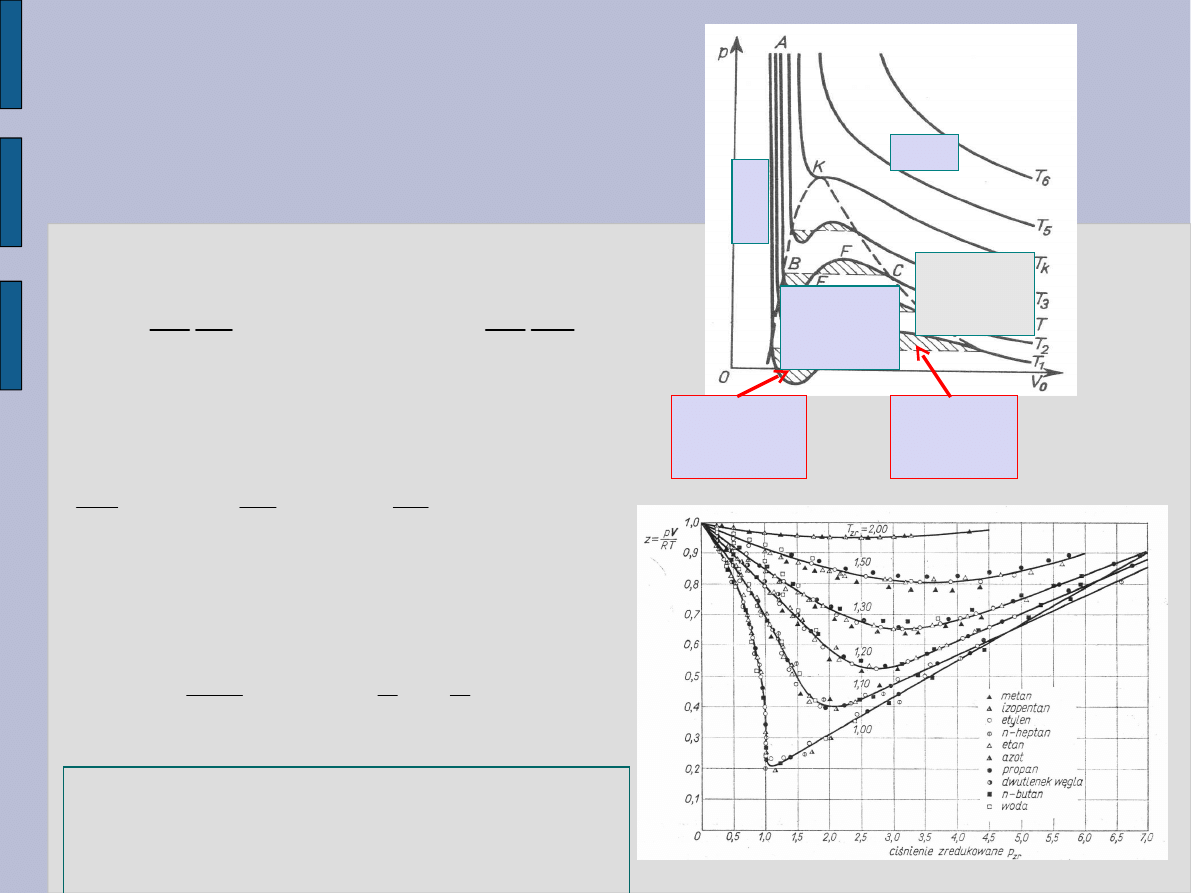
Równanie (4) ma 1-3 pierwiastki
rzeczywiste dla określonych p i T, które
można otrzymać po porównaniu z
równaniem
.
0
3
3
0
)
(
3
2
2
3
3
k
k
k
k
V
V
V
V
V
V
V
V
(5)
Wtedy otrzymujemy
.
27
8
,
3
,
27
1
2
bR
a
T
b
V
b
a
p
k
k
k
(6)
Jeżeli
.
3
8
3
1
3
2
zr
zr
zr
zr
T
V
V
p
,
,
,
zr
k
zr
k
zr
k
T
T
T
V
V
V
p
p
p
to mamy zredukowane
równanie van der Waalsa
Zredukowane równanie van der
Waalsa opisuje zachowanie się
różnych gazów rzeczywistych
identycznie.
(7)
(8)
C
ie
cz
Gaz
Para nie-
nasycon
a
Para
nasycon
a
Ciecz
prze-
chłodzona
Para
prze-
sycona
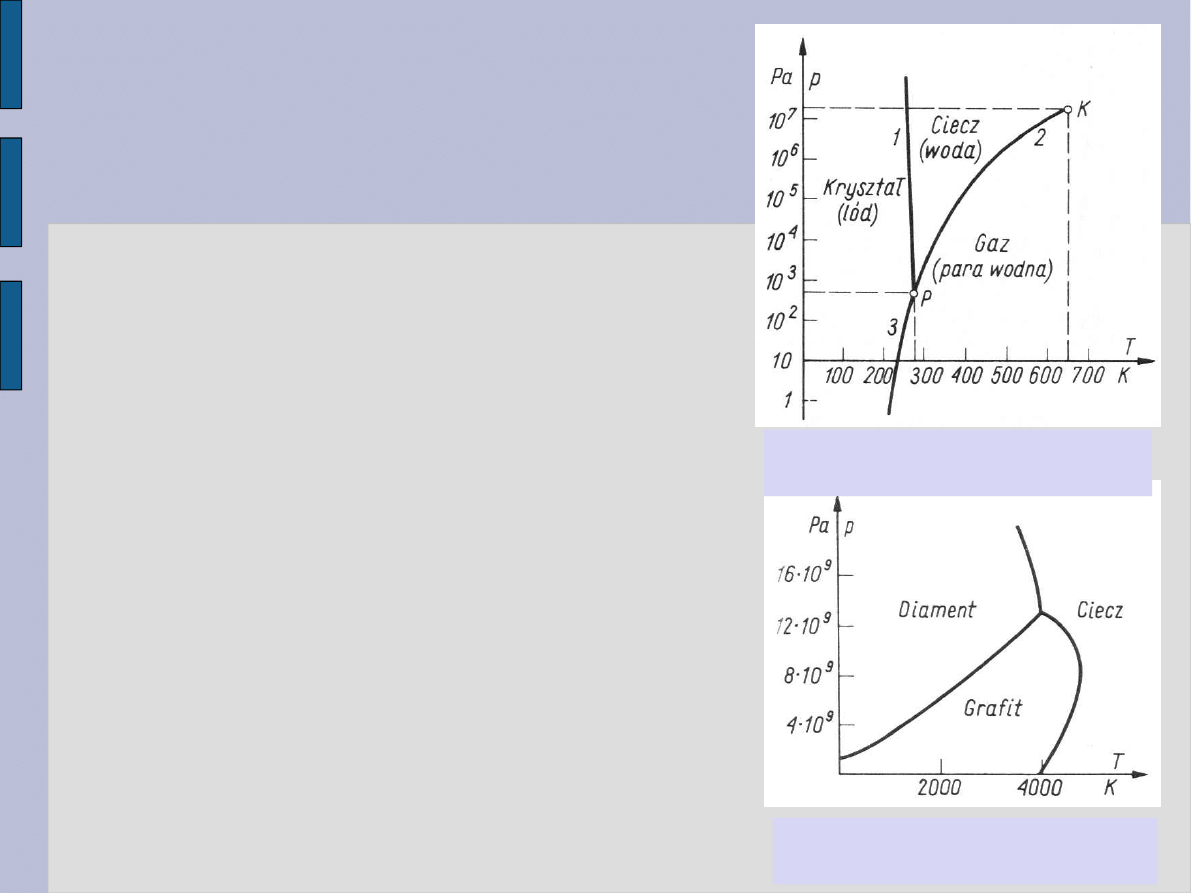
Przejście fazowe
Zmiana stanu skupienia w zależności
od warunków zewnętrznych.
Przykład wody:
Krzywa 1:
Zależność ciśnienia zewnętrznego od
temperatury lodu.
Krzywa 2:
Zależność ciśnienia pary nad
powierzchnią cieczy od temperatury.
Krzywa 3:
Zależność ciśnienia pary nad
powierzchnią lodu od temperatury.
Równowaga faz w punktach leżących
na krzywych 1, 2 i 3.
Punkt P – punkt potrójny.
Punkt K – punkt krytyczny.
Wykres równowagi faz dla
wody.
Wykres równowagi faz dla
węgla.
Document Outline
Wyszukiwarka
Podobne podstrony:
gazy rzeczywiste01
gazy rzeczywiste
Pary I Gazy Rzeczywiste
w6 Gazy rzeczywiste, ciecze, cia│a sta│e ľ ppt
gazy rzeczywiste01
,pytania na obronę inż,gazy doskonałe półdoskonałe i rzeczywiste
Gazy doskonałe i rzeczywiste. Lotność, Technologia Chemiczna AGH, inne, Chemia fizyczna
Organy wladzy Rzeczypospolitej Polskiej sejm i senat
W7 WZNACNIACZ OPERACYJNY RZECZYWISTY
122 Organy wladzy Rzeczypospolitej sady i trybunalyid 13886 ppt
17 Rodzaje rzeczyid 17346 ppt
Gdy marzenia stają się rzeczywistością Etnografia wykopalisk archeologicznych
5 Obiegi rzeczywiste
Zrozumieć Naturę Rzeczywistości
Tajemnice księżyca, W ஜ DZIEJE ZIEMI I ŚWIATA, ●txt RZECZY DZIWNE
więcej podobnych podstron