
Rośliny oddziałują na siebie w
sposób bezpośredni konkurując o
środowiskowe czynniki wzrostowe.
Pośrednie oddziaływanie w wyniku
którego roślina – donor (dawca)
wydziela do środowiska substancje
chemiczne wpływając negatywnie
lub korzystnie na rozwój roślin
sąsiadujących
(akceptorów
–
biorców) nazywane jest allelopatią
(z gr. - allelon (wzajemny) i
pathos (cierpienie)).

Chociaż
wzajemne
oddziaływania
pomiędzy
roślinami
są
znane
i
obserwowane od wieków to, jednak
dopiero Hans Molish w 1937 r. zdefiniował
to
zjawisko,
wprowadzając
pojęcie
allelopatii. Termin ten określa interakcje
występujące w układach: rośliny-rośliny,
rośliny-mikroorganizmy
oraz
mikroorganizmy-mikroorganizmy.
Wydzielanie związków allelopatycznych do
środowiska może odbywać się na różnej
drodze:

• 1) ewaporacja - uwalnianie lotnych
substancji głownie olejków eterycznych,
które mogą być pobierane przez tkanki
sąsiadujących roślin bezpośrednio z
atmosfery,
ale
również
z
powierzchniowych warstw gleby (dostając
się do roztworu glebowego)
• 2) eksudacja (ługowanie) - wymywanie
przez wodę z opadów atmosferycznych,
wodę irygacyjną lub rosę z powierzchni
roślin takich związków, jak np.: glikozydy,
alkaloidy,
flawonoidy,
czy
kwasy
organiczne

• 3) wydzielanie allelozwiązków przez system
korzeniowy
do
środowiska
glebowego
(eksudacja)
• 4) rozkład obumarłych resztek roślinnych.
•
• Zatem
istnieją
dwie
główne
drogi
oddziaływań:
• 1) bezpośrednia - wydzieliny gazowe lub
płynne nadziemnych części roślin (liście,
kwiaty i nasiona) działające bezpośrednio na
sąsiednie rośliny, bakterie lub grzyby,
• 2) pośrednia, po przedostaniu się do gleby
jako wydzieliny korzeniowe.

• W 1955 r. Kelsey Grammer zaproponował
4 określenia dla rozróżnienia inhibitorów,
czyli
związków
chemicznych
powodujących
zahamowanie
bądź
spowolnienie
reakcji
chemicznej,
stwierdzonych w allelopatii:
• 1)
Antybiotyki
-
penicylina,
streptomycyna,
chloramfenikol,
gentamycyna,
neomycyna.
Działają
bakteriostatycznie lub bakteriobójczo,
zaburzając syntezę białek, kwasów
nukleinowych, składników ściany i błony
komórkowej bakterii.

2. Marazminy, (gr. marasmós –
gaśnięcie, uwiąd) - hormony
wzrostowe roślin, śluzy, enzymy: kwas
fuzariozy, cytrynowy, szczawiowy i in.
substancje organiczne wydzielane
przez drobnoustroje (amoniak,
aldehyd) działające niekorzystnie na
rośliny wyższe powodując w efekcie
szybkie ich więdnięcie na skutek
zaburzeń w gospodarce wodnej.

3) Koliny, związki chemiczne: lotne
(etylen, olejki eteryczne, alkohole i in.),
płynne (alkaloidy, glikozydy i in.) oraz
stałe (np. garbniki), produkowane
przez
rośliny
wyższe
powodują
zaburzenia wzrostu oraz rozwoju
innych roślin wyższych.

4). Fitoncydy (gr. phytón = roślina + łac.
caedo - zabijany) - (atmowitaminy,
fitoaleksyny) związki, substancje, ciała
lotne wytwarzane przez rośliny żywe w
liściach, kwiatach, nasionach i korzeniach.
Mają one właściwości bakterio-, grzybo- i
pierwotniakobójcze, bądź hamują rozwój
mikroorganizmów.
Fitoncydy
Allicyna
(czosnek), alkaloidy (np. chinina lub
emetyna), glikozydy Wytwarzane są przez
rośliny wyższe, powodują zahamowanie
wzrostu i zaburzają procesy metaboliczne
mikroorganizmów.

Oddziaływanie wydzielin zależy także od ich stężenia.
Duże stężenie może hamować rozwój roślin uprawnych,
małe natomiast może stymulować, a nawet przyczyniać
się do wzrostu plonu.
Związki allelopatyczne (allelopatiny) są produktami
metabolizmu wtórnego rośliny-donora, które po
dostaniu się do środowiska oddziałują na znajdujące się
w sąsiedztwie rośliny-akceptory. Działanie allelopatin
ujawnia się na wszystkich poziomach organizacji
żywego
organizmu:
od
fizjologicznego
przez
komórkowy,
po
molekularny.
Pod
względem
chemicznym allelopatiny obejmują one różnorodne
związki organiczne. Są wśród nich występujące w formie
gazowej terpeny: α-pinen, β -pinen, kamfen, cyneol
obecne np. w tkankach bylic (rośliny z rodzaju
Artemisia), jak też skomplikowane, wielopieroecieniowe
seskwiterpenoidy- heliannany np. heliannuole, laktony
seskwiterpenów np. annuolid F ze słonecznika
(Helianthus annuus).

• Blastokoliny
• Przejawem ewolucyjnego przystosowania się roślin
do warunków siedliska jest obecność w ich
nasionach lub owocach, związków o charakterze
regulatorów
kiełkowania.
Substancje
takie
zidentyfikowano w owocach wielu gatunków, w
tym
należących
do
rodziny
Poaceae
(Wiechlinowate, trawy). Występują one głównie w
okrywie
owocowo-nasiennej
ziarniaków
oraz
pojawiają się podczas kiełkowania. Wiele z nich
może wykazywać właściwości allelopatyczne
wpływając ujemnie lub dodatnio na kiełkujące
nasiona i siewki we wczesnym ich stadium
wzrostu.
Substancje
te,
w
obrębie
kolin
wytwarzanych przez rośliny wyższe i oddziałujące
na inną roślinę wyższą, sklasyfikowano jako
blastokoliny. Pojęcie to pochodzi od greckich słów:
blastaněin – kiełkować i cholyein – przeszkadzać.

• Pozytywny lub negatywny wpływ
substancji blastokolinowych zależy z
jednej strony od składu chemicznego
i ilości wydzielanych kolin, z drugiej
zaś od właściwości fizjologicznych
kiełkujących nasion.
• W
ekosystemach
wzajemne
oddziaływania roślin rozpoczynają się
już w momencie kiełkowania nasion i
trwają później przez okres ich
wzrostu i rozwoju w zbiorowisku.

• Dowiedziono, że sąsiedztwo ziarniaków
kłosówki wełnistej wpływa ujemnie na
kiełkowanie nasion kostrzewy łąkowej i
życicy trwałej. Kiełkujące nasiona traw
wpływają dodatnio na kiełkowanie nasion
komonicy, która z kolei wpływa ujemnie na
ich
kiełkowanie.
Wykazano
również
inhibicyjne oddziaływanie traw wobec roślin
motylkowatych. Stwierdzono również, że
wyciągi
wodne
z
nasion
życicy
wielokwiatowej
hamowały
kiełkowanie
lucerna nerkowatej i koniczyny białej.
• Bardziej czułym biotestem niż kiełkowanie
nasion jest ocena wzrostu i rozwoju roślin
(długość systemu korzeniowego i koleoptyla,
wysokość siewek, czy sucha masa roślin).

Korzystna allelopatia występuje między
wydzielinami
perzu
(przy
małym
zachwaszczeniu) a plonowaniem ziemniaków,
o czym może świadczyć popularne w rejonie
Wielkopolskie przysłowie ludowe, które mówi
że „tam gdzie pyrz, to i pyra tysz”. Z kolei
gryka i gorczyca zawierająca różnorodne
substancje aktywne hamuje rozwój perzu.
Otrzymane z niej wyciągi redukują wzrost
roślin perzu, hamują gromadzenie biomasy
we wszystkich jego częściach nadziemnych i
podziemnych,
obniżają
fotosyntezę
i
zawartość
wody
w
roślinie
pomimo
hamowania parowania.

• Wnioskować więc można, że wyciągi z gryki
uszkadzają pobieranie wody przez system
korzeniowy
tego
uciążliwego
chwastu.
Agresywność perzu właściwego (Agropyron
repens) wynika nie tylko z konkurencji, ale ma
również podłoże chemiczne. W wydzielinach
korzeniowych tej rośliny zidentyfikowano szereg
allelopatin,
m.in.
kwasy:
wanilinowy,
4-
hydrocynamonowy, ferulowy, protokatechusowy,
syringowy, a także kwasy hydroksamowe np.
DIBOA
(2,4-dihydroksy-1,4(2H)benzoksazyn-3-
on), dla których obserwowano najwyższą
aktywność allelopatyczną.
• Wykazano
inhibicyjny
wpływ
wodnych
ekstraktów z łodyg gryki na kiełkowanie sałaty.

• ETYLEN
• Badania dotyczące wpływu egzogennego etylenu
prowadzone były ba nasionach wielu gatunków roślin.
Stwierdzono, że etylen stymuluje kiełkowanie nasion
orzecha ziemnego, koniczyny i rzepienia, a więc
nasion wymagających dojrzewania posprzątanego
podczas
suchego
przechowywania.
Etylen
przyspiesza też ustępowanie spoczynku nasion
jabłoni, czyli nasion wymagających stratyfikacji.
Znane są również przykłady indukcji kiełkowania
przez etylen nasion znajdujących się we wtórnym
spoczynku, np. nasion sałaty. Etylen przyspiesza
kiełkowanie
nasion
szarłatu
ogrodowego.
Na
podstawie
doświadczeń
przeprowadzonych
na
nasionach łobody z wykorzystaniem egzogennego
etylenu wykazano, że hormon ten działa podczas
dwóch stadiów: w stadium indukcji kiełkowania oraz
inicjacji wzrostu korzenia zarodkowego.

Badania z wykorzystaniem egzogennego
etylenu wykazały, że hormon ten może
odwracać inhibicję kiełkowania nasion.
Etylen odwracał inhibicję kiełkowania
nasion orzecha włoskiego wywołana przez
ABA. Hormon też odwracał inhibicję
kiełkowania zarodków wyizolowanych z
częściowo
stratyfikowanych
nasion
jabłoni,
wywołaną
obecnością
ABA.
Dotychczas niezbędność działania etylenu
endogennego
wykazano
w
doświadczeniach z nasionami tylko 3-ch
gatunków roślin.

Etylen jest zaangażowany w wiele aspektów rozwoju roślin
począwszy od kiełkowania do starzenia. Po raz pierwszy wpływ
etylenu opisał u grochu Neljbulov w 1901 roku i został
nazwany potrójną odpowiedzią, która polegała na zgrubieniu
hypokotylu, inhibicji wzrostu korzenia hypokotyla oraz
nadmiernym wygięciu siewek w ciemności. Rośliny są
organizmami statycznymi (nie przemieszczają się) toteż
reaguja na zmieniające się czynniki środiwska zmianami
kształtu, długości i średnicy organów. W wielu przypadkach
etylen
był
zaangażowany
w
proces
dyferencjacji
(różnicowania) w tym różnicowanie i śmierć komórek. Wpływ
etylenu na elongację komórek może być bazą do roli tego
fitohormonu w kiełkowaniu. Receptory wrażliwe na etylenu i
ścieżka transdukcji sygnału są dobrze poznane. Wiadomo, że
są one ściśle uzależnione od aspektu biologii komórki i
metabolizmu. Transdukcja sygnalna etylenu polega między
innymi na wiązaniu etylenu do rodziny receptorów, których
aktywność modyfikowana jest przez ten hormon. Receptory
etylenu tworzą rodzinę histydynowych kinaz białkowych: ETR
1, ETR 2, ERS 1, EIN 4 i ERS 2. Te receptory wchodzą w
interakcję z innymi białkami regulacyjnymi.

Badania przeprowadzone na nasionach
rzodkiewnika jak również innych gatunków
wykazały antagonistyczny efekt etylenu i
ABA – fitohormonu hamującego kiełkowanie.
Dowiedziano, że mutanty o zwiększonej
wrażliwości na ABA miały allele niewrażliwe
na etylen. Etylen przyspieszał kiełkowanie, a
dodatek norbornadienu – inhibitora syntezy
etylenu hamował kiełkowanie. Promocję
kiełkowania nasion przez etylen można
wytłumaczyć na podstawie stymulacji przez
etylenaktywności degradacyjnych enzymów,
co wykazano u wielu gatunków.

U Arabidopsis etylen, podobnie jak prekursor
tego fitohormonu ACC ma znaczący wpływ na
rozwój korzenia: hamuje elongację i promuje
ekspansję radiacyjną (zwiększa średnicę).
Traktowanie etylenem i ACC jest efektywne w
indukcji włośników korzeniowych.
Sugeruje
się,
że
pierwotną
przyczyną
zahamowania przez etylen elongacji korzeni są
zaburzenia metabolizmu ściany komórkowej.
Etylen wpływa na rozmieszczenie i formowanie
innych niż celuloza polisacharydów w ścianie
lub też wpływa na sekrecję oraz aktywność
białek ściany komórkowej.

• Biosynteza etylenu przebiega w kilku
etapach. Substratem jest metionina, która
jest przekształcana w S-adenozylometioninę
(SAM) przez enzym o nazwie syntaza SAM.
Następnie SAM jest przekształcana w kwas 1-
aminocyklopropano-1-karboksylowy
(ACC)
przez
syntazę
ACC
(ACS),
natomiast
metionina jest regenerowana w cyklu Yanga
(patrz schemat obok). Ostatnim etapem jest
konwersja ACC do etylenu przez oksydazę
ACC (ACO), gdzie ACC jest utleniany przy
udziale oksydazy ACC do etylenu oraz
dwutlenku węgla i cyjanowodoru
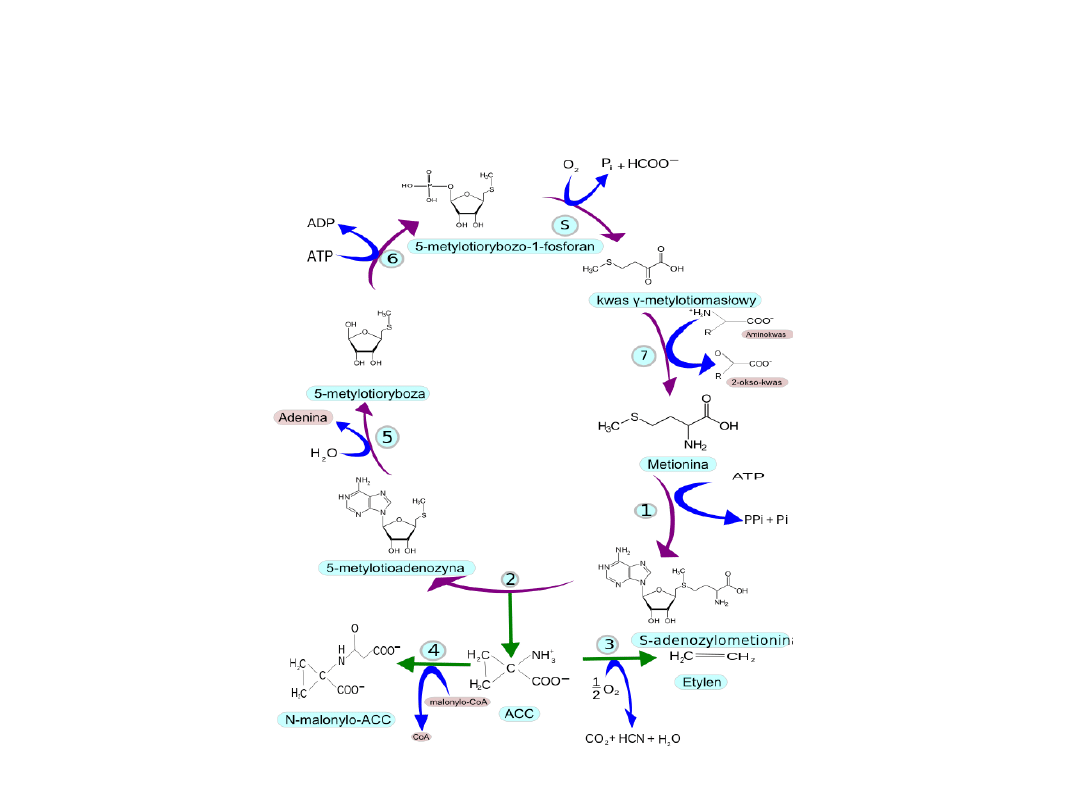
BIOSYNTEZA ETYLENU– syntaza SAM, 2 – syntaza ACC, 3 – Oksydaza ACC,
4 – ACC N-malonylotransferaza, 5 – nuklozydaza metyliotioadenozyny, 6 –
kinaza metylotiorybozy, S – reakcja spontaniczna, 7 – transaminaza, ACC
– kwas 1-aminocyklopropano-1-karboksylowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Bezpośrednie oddziaływanie na dziecko na terenie terapii zajęciowej
andrus, Likwidacja zrobow, Bezpośredni wpływ na wybór sposobu likwidacji zrobów ma rodzaj skał strop
14 fitochrom, Czynniki zewnętrzne oddziaływujące na wzrost roślin:
andrus, 1 sciaga podziemka, Bezpośredni wpływ na wybór sposobu likwidacji zrobów ma rodzaj skał stro
Określenie sposobów oddziaływania na negocjatora
Agnieszka Wacnik Galindowie i Krzyżacy oddziaływania na lokalną roślinność w rejonie Miłek i Staświ
Przywodztwo i procesy oddzialywania na pracownikow
Borowiki duszone, różne różnośći, Grzyby na wiele sposobow ═══════════════
Proces inwestycyjny a decyzja środowiskowa, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Ocena
śledzie na kilka sposobów, Przepisy
Ocena oddziaływania na środowisko
Automotywacja na 101 sposobów
Rzoporzadz-RM-w sprawie przedsiewz oddzialyw na srodow-kryteria do raportow, Budownictwo, Prawo
Flaczki z boczniaków, różne różnośći, Grzyby na wiele sposobow ═══════════════
Grzyby kiszone, różne różnośći, Grzyby na wiele sposobow ═══════════════
FRYTKI Z KURCZAKA, drób na różne sposoby
więcej podobnych podstron