
Chemia ogólna i
nieorganiczna

Tematy zajęć
Podstawowe prawa i pojęcia chemiczne.
Symbole i wzory chemiczne.
Budowa materii. Teoria atomistyczna
Daltona. Promieniotwórczość naturalna.
Model atomu Rutheforda. Widma
atomowe. Dualistyczny charakter materii.
Układ okresowy pierwiastków.
Konfiguracja elektronowa atomów.
Budowa cząsteczek. Wiązania chemiczne.

Tematy zajęć
Reakcje chemiczne. Kryteria podziału.
Kinetyka reakcji chemicznych. Szybkość
reakcji. Prawo działania mas. Reguła
przekory.
Roztwory. Dysocjacja elektrolityczna.
Teoria Arrheniusa. Stała i stopień
dysocjacji. Iloczyn jonowy wody.
Wykładnik stężenia jonów hydroniowych
i wodorotlenowych. Iloczyn
rozpuszczalności. Hydroliza.

Tematy zajęć
Wybrane pierwiastki bloku s, ich
związki, otrzymywanie i zastosowanie.
Wybrane pierwiastki bloku d, ich
związki, otrzymywanie i zastosowanie.
Wybrane pierwiastki bloku p, ich
związki, otrzymywanie i zastosowanie.

Literatura podstawowa
Barycka J., Skudlarski K., Podstawy chemii,
Wydawnictwo Politechniki Wrocławskiej,
Wrocław, 2002
Drapała T., Chemia ogólna i nieorganiczna,
PWN, Warszawa, 2009
Lee J. D., Zwięzła chemia nieorganiczna,
PWN, Warszawa, 1999
Jones L., Atkins P., Chemia ogólna.
Cząsteczki, materia, reakcje., PWN,
Warszawa, 2006

Literatura podstawowa
Znamierowska T., Szuszkiewicz W.,
Beran T., Ćwiczenia z chemii ogólnej i
analitycznej, Skrypty UE, Wrocław,
2009
Znamierowska T., Zadania z chemii
ogólnej i analitycznej, Skrypty UE,
Wrocław, 2006

Literatura uzupełniająca
Pajdowski L., Chemia ogólna, PWN,
Warszawa, 1999
Bielański A., Chemia ogólna i
nieorganiczna, PWN, Warszawa, 2002

Terminy zajęć
wtorek: 13.15 – 14.45
15.00 – 16.30

Zaliczenie przedmiotu
egzamin: 60%
prace kontrolne: 40%
termin egzaminu: letnia sesja
egzaminacyjna 12-28.06.2013

Zaliczenia na laboratorium
kartkówki:
›
zapis reakcji chemicznych, nazewnictwo związków,
amfoteryczność
›
dobór współczynników w reakcjach redoks
›
zapis reakcji hydrolizy, reakcje hydrolizy z wytrąceniem
osadu, odczyny wodnych roztworów soli, nazewnictwo
związków kompleksowych
›
równowagi zachodzące w wodnym roztworze CuCl
2
›
zapis reakcji pozwalających zidentyfikować wybrane
kationy, reakcje charakterystyczne wybranych kationów
kolokwium z obliczeń
aktywność na zajęciach: posługiwanie się sprzętem
laboratoryjnym, znajomość zasad bezpieczeństwa i
higieny pracy w laboratorium chemicznym,
aktywny udział w ćwiczeniach rachunkowych

Prowadzący
dr inż. Alicja Stankiewicz: pok. 115,
konsultacje poniedziałek 9.30-12.00
dr Ewa Radomińska
dr inż. Dagmara Piotrowska
dr Szymon Bandrowski
mgr Zofia Jagoda

Podstawowe prawa i pojęcia
chemiczne. Symbole i wzory
chemiczne.
Definicja pierwiastka chemicznego.
Prawo zachowania masy.
Prawo stałych stosunków wagowych.
Prawo wielokrotnych stosunków wagowych.
Prawo stosunków objętościowych.
Prawo Avogadro.
Masa atomowa i cząsteczkowa.
Mol.
Masa molowa.
Wartościowość.
Symbole chemiczne.
Rodzaje wzorów chemicznych.

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Chemia
nauka badająca naturę i własności
substancji, a zwłaszcza przemiany
zachodzące między tymi substancjami.
Zajmuje się także rozmaitymi
własnościami substancji wynikającymi
bezpośrednio z ich budowy atomowej.

„inteligentny” polimer

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo Boyle’a
W stałej temperaturze objętość
danej masy gazu jest odwrotnie
proporcjonalna do jego ciśnienia.
pV=const

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Pierwiastek chemiczny
Zbiór atomów, których jądra mają
taką samą liczbę protonów.

RO
BE
RT
BO
YLE
(16
27-
169
1)
definicja pierwiastka chemicznego
chemiczna analiza jakościowa
prawo Boyle’a

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo zachowania masy
w układzie zamkniętym suma
masy i energii jest wielkością stałą
przed i po reakcji.
Suma mas produktów jest równa sumie mas
substratów biorących udział w reakcji.

prawo zachowania masy
nomenklatura chemiczna
A
N
T
O
IN
E
L
A
V
O
IS
IE
R
(
1
7
4
3
-1
7
9
4
)
М
и
х
а
ии
л
В
а
си
ил
ь
е
в
и
ч
Л
о
м
о
н
ои
со
в
(
1
7
1
1
-1
7
6
5
)

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo stałych stosunków
wagowych
Pierwiastki, tworząc związki
chemiczne, łączą się ze sobą w
stałych, ściśle określonych stosunkach
wagowych.

Jo
se
p
h
P
ro
u
st
(
1
7
5
4
-1
8
2
6
)
C
la
u
d
e
L
o
u
is
B
e
rt
h
o
lle
t
(1
7
4
8
-1
8
2
2
)
prawo stałych stosunków wagowych
związki niestechiometryczne

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo wielokrotnych stosunków
wagowych
Jeżeli dwa pierwiastki tworzą kilka
związków chemicznych, to w związkach
tych, masy jednego z nich łączące się z tą
samą masą drugiego mają się do siebie
jak proste liczby naturalne.

Jo
h
n
D
a
lt
o
n
(
1
7
6
6
-1
8
4
4
)
teoria atomistyczna
daltonizm
meteorologia

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo stosunków objętościowych
W reakcji między gazami objętości
substratów i produktów gazowych
mieszane w tych samych warunkach
temperatury i ciśnienia mają się do
siebie jak niewielkie liczby całkowite.

Jo
se
p
h
L
o
u
is
G
a
y-
Lu
ss
a
c
(1
7
7
8
–1
8
5
0
)
konstruktor balonu
współodkrywca boru

Podstawowe prawa i pojęcia chemiczne. Symbole i wzory
chemiczne.
Prawo Avogadro
W tych samych warunkach
fizycznych, to jest w tej samej
temperaturze i pod takim samym
ciśnieniem, w równych objętościach
różnych gazów znajduje się taka sama
liczba cząsteczek
mol gazu w warunkach normalnych (0°C, 1013 hPa) zajmuje 22,4 dm
3

Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto (1776-1856)

Masa atomowa:
bezwzględna
wyrażona w jednostkach masy
względna
wyrażona w unitach (u)
Masa cząsteczkowa
masa cząsteczkowa stanowi sumę mas
atomowych pierwiastków wchodzących w skład
jednej cząsteczki związku chemicznego, czy
wieloatomowych cząsteczek pierwiastków,
uwzględniającą krotność występujących w niej
atomów.

Mol
jest to taka ilość substancji, która zawiera
taką liczbę atomów, cząsteczek, jonów
bądź innych cząsteczek materialnych, ile
atomów znajduje się w 12 g węgla .

Masa molowa
wyraża masę jednego mola molekuł
(atomów, cząsteczek, jonów).
Jest równa liczbowo masie atomowej
lub cząsteczkowej danej substancji.
Wyrażona jest w .
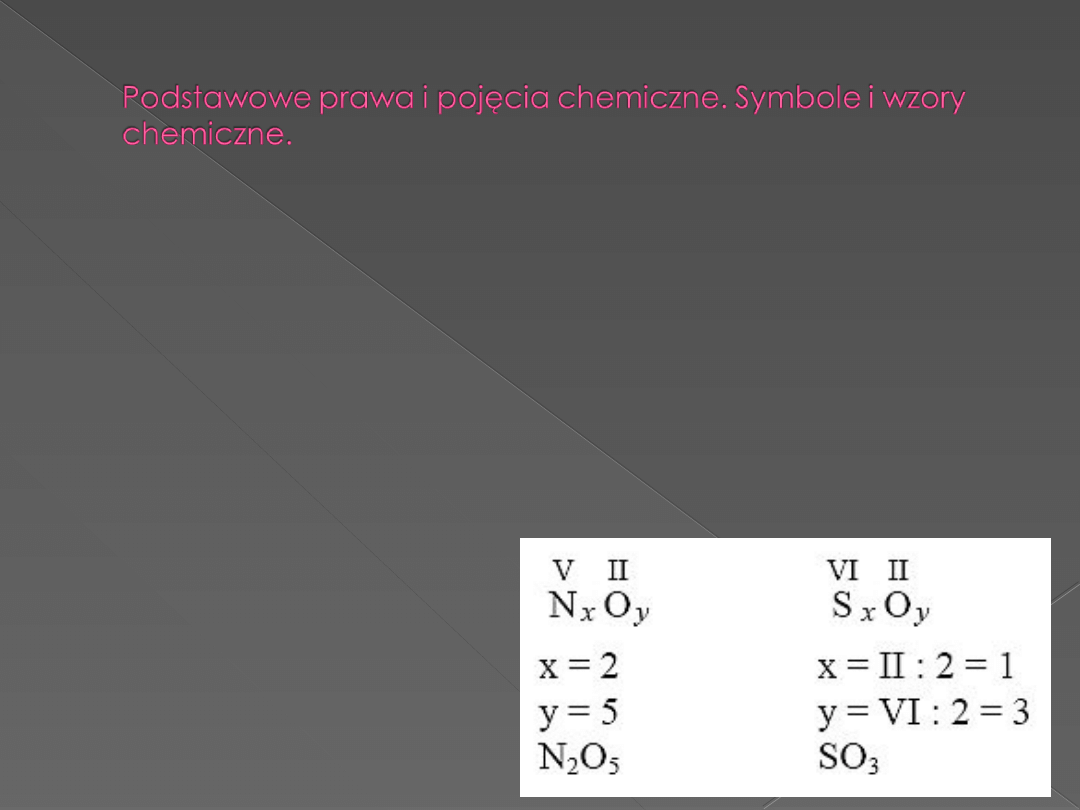
Wartościowość
Zdolność atomu danego
pierwiastka do przyłączania lub
podstawiania określonej liczby
atomów innych pierwiastków.

Symbol pierwiastka chemicznego
umowny, międzynarodowy skrót złożony z
pierwszej lub z pierwszej i jednej z
dalszych liter nazwy pierwiastka.

JÖN
S
JAC
OB
BE
RZ
ELI
US
(17
79-
184
8)
symbole chemiczne
izomeria
pierwiastki: krzem, selen, cer, tor
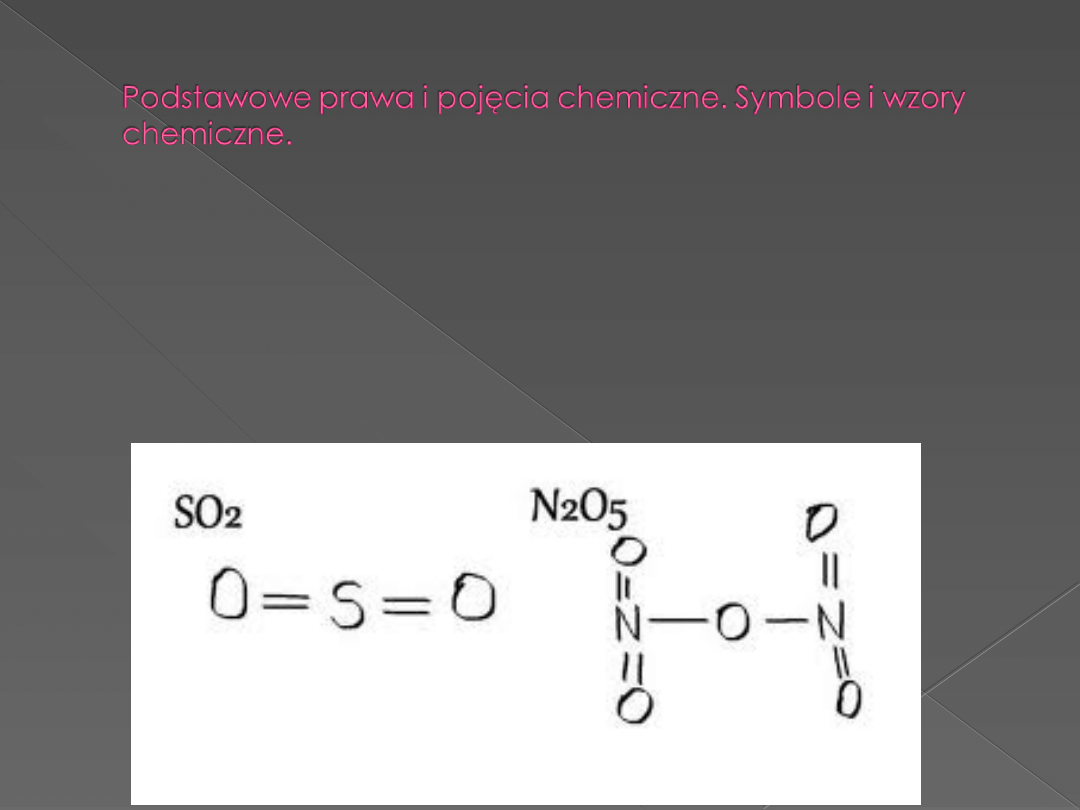
Rodzaje wzorów chemicznych:
wzór sumaryczny
wzór strukturalny (kreskowy)
Document Outline
- Slide 1
- Tematy zajęć
- Tematy zajęć
- Tematy zajęć
- Literatura podstawowa
- Literatura podstawowa
- Literatura uzupełniająca
- Terminy zajęć
- Zaliczenie przedmiotu
- Zaliczenia na laboratorium
- Prowadzący
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Robert Boyle (1627-1691)
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Jöns Jacob Berzelius (1779-1848)
- Slide 35
Wyszukiwarka
Podobne podstrony:
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Wykład 6 Weglowce CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
Wykład 10 Pierwiastki -d i -f elektronowe CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
2 chemiaogolna wyklad 290909, Wykład Chemia ogólna i nieorganiczna prof
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
praktyczny z soli, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
Kompleksy i elektrochemia notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z
więcej podobnych podstron