Wyznaczanie stosunku C /C
p
v
metodą Clement-Desormes
Ćwiczenie nr 52
Fizyka – laboratorium
Arkadiusz Bednarz
79326
1imd L1 (Grupa: 1)





































































































































































































































































































































































































































































































































































































































































































































Spis treści:
1. Zarys teoretyczny
2. Cel
e i
l p
i rze
rz b
e ie
b g
ie ć
w
ć icz
ic e
z n
e ia
3. Oblic
l z
ic e
z n
e ia
i
a i
z
i e
z s
e ta
s w
ta ien
ie ie
ie wyników
4. Wnioski
1. Zarys teoretyczny
Ciepło właściwe – cie
i pł
p o
ł
o po
p t
o rze
r bn
b e
n
e do
d
o zwiększe
s ni
n a temperatury cia
i ła o
o j
e
j dn
d o
n s
o t
s kow
o ej
e masie o jedną
jednostkę
gdzie
∆Q – dostarczone ciepło;
m – masa ciała;
∆T – przyrost temperatury.
To
T
o s
a
s mo
o ciepł
p o
o wła
ł śc
ś i
c we możn
o
a
żn zdefiniować również dla chłodzenia. W uk u ładzi
d e S
I jednostką ciepła
właściwego jest dżul przez kilog o ra
r m i przez kelwin:
Ci
C epł
p o
ł
o właś
a c
ś iwe
w j
es
e t
s wi
w el
e koś
o c
ś ią
i cha
h ra
r kter
e y
r st
s yczną
zn dl
d a
l
a da
d ne
n j
e
j su
s b
u s
b t
s an
a c
n j
c i
j w da
d n
a e
n j
e
j tem
e pe
p ra
r tur
u ze
r
(jest st
s ał
a ą mater
e i
r ał
a ow
o ą)
ą .
) Mo
M że
o zależeć od
o
d tempe
p ra
r tur
u y
r , dl
d at
a ego
o pr
p e
r c
e yzyjni
n e
i j
e s
j zy
s
jest
s wzór
zó
r zapi
p sa
s n
a y
n w
postaci różniczkowej
Przemiana izobaryczna − pr
p o
r c
o es
e
s te
t rm
r od
o y
d na
n miczny
zn , podczas którego ciśnienie uk u ładu
d
u ni
n e ul
u ega
zmiani
n e, na
n t
a om
o iast
s po
p zo
o
s
zo t
s a
t łe
ł pa
p ra
r metry
r term
r od
o y
d na
n miczne czynnika mogą si
s ę zmieni
n ać
a . Procesy
izob
zo a
b ry
r czne
zn mogą zacho
h d
o zi
d ć zaró
r w
ó no
n
o w sp
s o
p s
o ó
s b
ó
b od
o w
d r
w a
r c
a alny
n , j
ak i n
i
n eo
e d
o w
d ra
r c
a aln
l y
n . Odw
d ra
r cal
a ny
n pr
p o
r c
o e
c s
s
izob
zo a
b ry
r czny
zn pr
p ze
r ds
d t
s awia n
a
n
a wykre
r si
s e krzy
r
wa zwana
n izobarą. Praca wykon
o a
n na
n pr
p ze
r z uk
u ład
d (l
( ub
u
b na
n d
d
uk
u łade
d m)
) w od
o w
d ra
r cal
a ny
n m pr
p o
r c
o es
e i
s e
i izob
zo a
b r
a y
r czny
zn m jest
s r
ó
r w
ó na
n ubytkowi (lub
przyrostowi) entalpii uk
u ładu
d .
u W
W szc
s zegól
ó no
n ś
o c
ś i
c , gdy
d jed
e y
d ny
n wkład
d do
d
o pr
p a
r cy st
s ano
n w
o i pr
p a
r c
a a
ob
o j
b ęt
ę oś
o c
ś i
c ow
o a (
p
( o
p l
o egaj
a ąc
ą a na
n zmiani
n e ob
o j
b ęt
ę oś
o c
ś i u
k
u ładu)
u ,
) j
est
s on
o a
n wyra
r żon
żo a
n wzor
zo e
r m:
gdzie
W – praca wykon
o a
n na
n pr
p ze
r z uk
u ład,
d
p – ciśnienie,
∆V – wzrost objętości uk
u ład
a u
d .
u




























































































































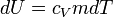





























































































































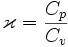





































































































Dla gazu
zu do
d s
o k
s on
o a
n łego przemiana izobaryczna spełnia zależność: V – objętość,
T – temperatura.
Przemiana izochoryczna – pr
p o
r c
o e
c s
s t
erm
r od
o y
d na
n miczny zacho
h d
o zą
d cy pr
p zy
r
st
s ałej
e o
b
o j
b ę
j t
ę oś
o c
ś i
c (V
( =
con
o s
n t
s )
t .
)
Opr
p ó
r c
ó z ob
o j
b ęt
ę oś
o c
ś i ws
w zy
s
st
s kie po
p zo
o
s
zo t
s ał
a e pa
p r
a a
r metry
r ter
e m
r od
o y
d na
n miczne
zn mogą si
s ę zmieni
n ać.
Pod
Po c
d zas
s pr
p ze
r miany
n izoc
zo ho
h r
o y
r czne
zn j ni
n e j
e
j st
s wykon
o ywana
n praca, uk
u ład
d może
o wymieni
n ać e
ne
n r
e g
r ię z
ot
o oc
o zeni
n e
i m tylko
o w wyni
n ku ciepl
p ne
n go
o pr
p ze
r pł
p ywu
u ene
n rg
r ii. Z pi
p er
e w
r sze
s j
ze zasa
s d
a y
d term
r od
o y
d na
n miki wynika,
że całe ciepło do
d p
o r
p o
r w
o a
w dzo
d
n
zo e
n lub
u
b od
o p
d ro
r w
o a
w dzo
d
n
zo e
n z gazu w pr
p o
r c
o es
e i
s e
i izoc
zo ho
h r
o y
r czny
zn m j
est
s zuży
zu
wane
n na
n
po
p w
o iększe
s ni
n e l
ub
u
b po
p m
o ni
n ej
e s
j ze
s ni
n e j
e
j go energii wewnętrznej: δQ = dU.
Przekształcając wzór na cie
i p
e ł
p o
o wła
ł śc
ś i
c we otrzymujemy:
gdzie m jest masą gazu.
W
W izoc
zo ho
h r
o y
r czne
zn j
j pr
p ze
r miani
n e
i st
s a
t łej
e masy gazu, ciśn
ś i
n eni
n e
i wywiera
r ne
n na
n śc
ś ian
a k
n i na
n cz
c yni
n a j
es
e t
s wpr
p o
r s
o t
s
proporcjonalne do temperatury.
gdzie:
p – ciśnienie
T – temperatura
Wykładnik adiabaty w ter
e m
r od
o yna
n mice – bezwymiarowa wielkość równa st s os
o u
s n
u k
n ow
o i ciepła
właściwego w pr
p ze
r miani
n e i
zo
i
b
zo a
b ry
r czne
zn j do ciepła właściwego w pr
p ze
r miani
n e i
zoc
zo ho
h r
o y
r czne
zn j. Występuje
jako parametr w pr
p a
r wi
w e Poi
Po s
i s
s o
s n
o a
n opisującym przemianę adiabatyczną gazu zu do
d s
o k
s ona
n łego.
Wy
W kładn
d i
n k adi
d aba
b ty na
n zywany
n je
j st
s r
ó
r w
ó ni
n eż wsp
s ó
p ł
ó c
ł zynni
n kiem w ró
r w
ó na
n ni
n u
u Poi
Po ss
s o
s n
o a
n lub
u kappą, od
na
n zwy gre
r ckiej
e li
l te
t ry
r , któr
ó ą
r
ą j
est
s na
n j
a c
j zęśc
ś i
c ej
e
j ozn
o
a
zn czany
n .
Zgodnie z definicją
gdzie:
– wykładn
d i
n k adi
d a
i ba
b t
a y,
– ciep
e ł
p o
o wł
w aśc
ś iwe w przemianie izobarycznej,
– ciep
e ł
p o
o wł
w aśc
ś iwe w przemianie izochorycznej.
Zamiast
s ci
c epł
p a wła
ł śc
ś i
c wego
o może tu
u by
b ć uży
u
te ciepł
p o
ł
o mol
o o
l w
o e, po
p n
o i
n ewa
w ż dl
d a da
d ne
n j
e
j
su
s b
u s
b t
s anc
n j
c i
j r
ó
r żn
ó
i
żn ą s
i
s ę
i on
o e
n o
o s
t
s ał
a y czynn
n i
n k.

































































































































Równanie Clapeyrona, rów
ó na
w
n
na i
n e st
s a
t nu
a
ga
g zu
a
dos
do ko
s
na
ko
ł
na ego
g to równanie stanu op
o i
p su
s j
u ą
j ce
c związek
po
p m
o iędz
d y tempe
p ra
r tur
u ą
r , ci
c śn
ś i
n eni
n em i ob
o j
b ęt
ę oś
o c
ś ią
i gazu doskonałego, a w sp
s o
p s
o ó
s b
ó
b pr
p zy
r
bl
b iżon
żo y
n
opisujący gazy rzeczywiste. Sfo
Sf r
o m
r uł
u ow
o ane
n zos
zo t
s ał
a o
o w 1
8
1 3
8 4
3
4 ro
r k
o u
u pr
p ze
r z Be
B no
n î
o t
î a Cl
C a
l pe
p yro
r n
o a
n . Prawo to
można wyrazić wzorem
gdzie:
p – ciśnienie
V – objętość
n – liczba moli gazu
zu (b
( ę
b dą
d ca
c miarą
r li
l czby
zb cząst
s eczek (i
( l
i oś
o c
ś i
c )
) r
o
r zw
o
ażane
n go gazu)
zu
T – temperatura (b
( e
b zwzględn
d a
n ),
) T [K] = t [°C] + 273,15
R – uniwersalna st
s a
t ła
a gazow
zo a: R = NAkB, gdzie: NA – stała Avogadra (l ( i
l czba
zb Avog
o adr
d a
r )
a ,
) kB –
stała Boltzmanna, R = 8,
8 31
3 4
1 J/(mol·K)
Ró
R w
ó na
n ni
n e t
o
o j
e
j st
s wypr
p o
r w
o ad
a za
d ne
n na
n po
p d
o s
d t
s a
t wie zało
ł że
o ń:
ń
1. gaz składa
d si
s ę z po
p r
o u
r s
u za
s j
za ący
c ch
h si
s ę cząst
s eczek;
2. cząst
s eczki zde
zd rza
r j
za ą s
i
s ę
ę ze so
s b
o ą
b or
o a
r z ze śc
ś iank
n ami na
n czyni
n a w
któr
ó y
r m si
s ę zna
zn j
a du
d j
u ą
j ;
ą
3. br
b a
r k od
o d
d zi
d aływań
ń między
d
cząst
s eczkow
o ych
h w gazie, z wyjątkiem od
o p
d y
p cha
h ni
n a
i w mom
o enc
n ie
zde
zd rze
r ń
ń cząst
s ec
e zek;
4. ob
o j
b ęt
ę oś
o ć
ś
ć (r
( o
r zm
o
iary
r )
) cząst
s ecze
c k jest
s po
p m
o ij
i ana
n ;
5. zde
zd rze
r ni
n a cząst
s eczek są
s doskonale sprężyste;
Ró
R w
ó na
n ni
n e t
o,
o mimo
o że wypro
r w
o adzo
d
n
zo e
n w ra
r mach
h wyide
d ali
l zow
zo ane
n go
o mod
o e
d lu,
u do
d b
o r
b ze
r op
o i
p su
s j
u e
j
większość substancji gazow
zo ych w obszarze ciśnień do ok. 100 atmosfer i t empe
p ra
r tur
u y
r do
d
o 30
3 0
0 –
400 °C
° ,
C or
o a
r z w tempe
p ra
r tu
t r
u ze
r tro
r c
o hę
h wi
w ększe
s j
ze od
o
d t
empe
p ra
r tur
u y
r sk
s ra
r pl
p an
a i
n a
a gazu.
zu
2. Cel
e i
l p
i rze
rz b
e ie
b g
ie ć
w
ć icz
ic e
z n
e ia
Cel ćwiczenia:
•
Pra
Pr ktyczne
zn zapo
p zn
o
a
zn ni
n e si
s ę z
pr
p ze
r bi
b egiem pr
p ze
r mian
n gazow
zo ych.
h
•
Zapoznanie się z metod
o ą
d wyzna
zn czani
n a st
s os
o u
s n
u k
n u
u C /C .
p
v
•
Wy
W zna
zn czeni
n e st
s os
o u
s n
u k
n u
u κ=
κ C
/C dla powierza.
p
v
Przebieg ćwiczenia:
•
Zamkną
n ć kra
r n
n wylot
o ow
o y. Przy
Pr
po
p moc
o y po
p mpki rę
r czne
zn j
e
j wtło
ł c
o zyć do
d
o zbi
zb or
o n
r i
n ka po
p w
o ietr
t ze
r
ut
u rzy
r
muj
u ąc
ą na
n dc
d iś
i n
ś i
n e
i ni
n e
i dwu
d
d
wu zi
d est
s u
u kil
i ku
u milimetró
r w
ó sł
s up
u a
p c
ie
i czy w mano
n metrze
r .
•
Prze
Pr z od
o p
d o
p w
o iedn
d i
n ob
o r
b ó
r t
ó kur
u k
r a zawor
o u
r
u od
o ł
d ączyć po
p m
o pk
p ę od
o
d zbior
o n
r i
n ka, po
p zo
o
s
zo t
s a
t wiaj
a ą
j c
je
j dn
d o
n c
o ześn
ś i
n e
i zamkni
n ęty kra
r n
n wylot
o ow
o y. Odc
d zekać kilka minu
n t
u na
n us
u t
s al
a eni
n e s
i
s ę
i tempe
p ra
r t
a ur
u y
r w
zbi
zb or
o n
r i
n ku
u i n
o
n t
o ow
o ać
a ró
r żn
ó
i
żn cę
c po
p zi
o om
o ów
ó cieczy w mano
n m
o etrze
r .
•
Otwor
o zy
r
ć kra
r n
n wylot
o ow
o y na pr
p ze
r cią
i g kilku
u se
s kun
u d
n
d i po
p
o wyró
r w
ó na
n ni
n u
u si
s ę c
iśn
ś i
n en
e i
n a
a g
azu
zu w
zbi
zb or
o n
r i
n ku
u z ciśn
ś i
n eni
n em zewnę
n trzn
r
y
zn m zamkną
n ć go
o po
p n
o o
n wn
o
i
wn e.
•
Po pewnym czasie (5-8
8 minu
n t
u )
) od
o c
d zytać ró
r żn
ó
i
żn c
i e po
p zi
o om
o ów
ó cieczy w mano
n metrze
r .
•
Cy
C kl po
p m
o iaró
r w
ó po
p w
o tór
ó zy
r
ć 10
1
0 –krotnie.
•
Na podstawie uzyskanych
h da
d ny
n ch
h wyzna
zn czyć wart
r oś
o ć
ś
ć κ dla każde
żd go
o cyklu
u po
p m
o iaró
r w
ó , a
na
n st
s ę
t pn
p i
n e
i ob
o l
b ic
i zyć wart
r oś
o ć
ś ś
r
ś e
r dn
d i
n ą t
ej
e
j wiel
e koś
o c
ś i.
i
•
Dla j
e
j dn
d e
n go
o cyklu
u po
p m
o iaró
r w
ó
wyzna
zn czyć bł
b ąd
d maksy
s malny
n . Pos
Po ł
s u
ł g
u uj
u ą
j c si
s ę metod
o ą
d
ą Stud
u e
d nt
n a
ok
o re
r śl
ś ić
i pr
p ze
r dzi
d ał na
n wart
r oś
o ć
ś rze
r czywist
s ą κ z poziomem ufności 0,95.
3. Obliczenia i zestawienie wyników Pomiar
h1 [mm] ±1 [mm]
h2 [mm] ±1 [mm]
h3 [mm] ±1 [mm]
К = ℎ1/ℎ3
1
132
39
93
1,4194
2
131
38
93
1,4086
3
129
38
91
1,4176
4
133
39
94
1,4149
5
130
38
92
1,4130
6
132
39
93
1,4194
7
134
39
95
1,4105
8
128
37
91
1,4066
9
130
38
92
1,4130
10
133
39
94
1,4149
Średnia
131,2
38,4
92,8
1,4138
Tabela 1: Pomiary i zestawienie wyników h3 = h1 – h2 – różnica wysokości (mianownik we wzorze na K w metodzie Clementa-Desormesa) Przykładowe obliczenia dla pomiaru nr 1.
ℎଷ = ℎଵ − ℎଶ = 132 − 39 = 93 [݉݉]
ℎ1
132
Кଵ =
=
= 1,4194
ℎ3
93
Wyznaczanie wartości średniej dla wielkości h1, h2 i h3, zostało dokonane metodą średniej arytmetycznej.
Przykład zastosowania ukażę na obliczaniu wartości średniej dla К.
Кଵ + Кଶ + Кଷ + Кସ + Кହ + К + К + К଼ + Кଽ + Кଵ
К =
݊
gdzie:
n = 10 liczba pomiarów
1,4194 + 1,4086 + 1,4176 + 1,4149 + 1,4130
К =
10
1,4194 + 1,4105 + 1,4066 + 1,4130 + 1,4149 + 1,4138
14,1379
+
=
= 1,4138
10
10
Obliczanie błędu pomiaru dla wyznaczania współczynnika adiabaty К rachunkiem pochodnej
,
logarytmicznej:
∆ℎ1 = ∆ℎ2 = 1 [݉݉] - błąd pomiaru wysokości słupka oleju
∆ℎ3 = ∆ℎ1 + ∆ℎ2 = 1 + 1 = 2[݉݉]
∆ℎ3
1
∆ К = ܭ ∗ ൬∆ℎ1 +
൰ = 1,4138 ∗ ൬ 1 +
൰ = 1,4138 ∗ ሺ0,00762 + 0,01077ሻ
ℎ1
ℎ3
131,2
92,8
= 1,4138 ∗ 0,01839 = 0,02599
К = 1,4138 ± 0,02599
Określanie przedziału na wartość rzeczywistą К
ܵሺКሻ = ඨ
1
݊
∗ (К − К)ଶ
(݊ − 1)
ଵ
= ඨ 1 ∗ ሺሺ1,4138 − 1,4194ሻଶ + ሺ1,4138 − 1,4086ሻଶ + ⋯ + ሺ1,4138 − 1,4130ሻଶ + ሺ1,4138 − 1,4149ሻଶሻ
90
= ඨ0,0001692 = ඥ1,88028 ∗ 10ି = 0,00137
90
Dla ߙ = 0,95; ݐఈ = 2,252 ሺݖ ݐܾ݈ܽ݅ܿ ݓݏółܿݖݕ݊݊݅݇óݓ ܵݐݑ݀݁݊ݐܽ − ܨ݅ݏℎ݁ݎܽሻ
∆ К = ݐఈ ∗ ܵሺКሻ = 2,252 ∗ 0,00137 = 0,0031
К = 1,4138 ± 0,0031
Zestawienie wyników
a) Współczynnik adiabaty wraz w błędem (metoda pochodnej logarytmicznej) К = 1,4138 ± 0,02599
∆ К = 1,84%
b) Współczynnik adiabaty wraz z błędem (metoda Studenta-Fishera) К = 1,4138 ± 0,0031
∆ К = 0,22%
4. Wnioski
Ćwiczenie zostało przeprowadzone poprawnie. Powodem początkowych nieudanych prób pomiarów była nieszczelność układu. Otrzymany współczynnik adiabaty jest zbliżonym do rzeczywistego dla powietrza suchego. Według otrzymanych wyników, dochodzę do wniosku, że przy założeniach błędu obliczonego metodą Studenta-Fishera, błąd nie przekracza 0,3%. Jako, że obliczaliśmy błąd maksymalny, za wielkość prawidłową przyjmuję błąd obliczony metodą pochodnej logarytmicznej, w której błąd nie przekracza 2 %.
Wyszukiwarka
Podobne podstrony:
F 52 Rozkład stałej Planca, dc, GPF, Fizyka lab, STARE, GOTOWE SPRAWOZDANIA Z FIZ, GOTOE SPRAWOZDANI
fizy2 sprawozdanie5, MIBM WIP PW, fizyka 2, laborki fiza(2), 52-Badanie promieniowania rentgenowskie
cw 52, Towaroznawstwo SGGW, Rok I, Semestr I, fizyka, Fizyka, Fizyka, Sprawozdania
Ćwiczenie nr 52, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr52
52 sprawozdanie, LEŚNICTWO SGGW, fizyka
F CW 52, Sprawozdanie z ˙w. nr 51
sprawozdania z fizyki, 52, 08
W 4 S 52(APP 2)KOLORY I SYMBOLE
2 definicje i sprawozdawczośćid 19489 ppt
PROCES PLANOWANIA BADANIA SPRAWOZDAN FINANSOWYC H
W 11 Sprawozdania
Wymogi, cechy i zadania sprawozdawczośći finansowej
Analiza sprawozdan finansowych w BGZ SA
W3 Sprawozdawczosc
1 Sprawozdanie techniczne
Karta sprawozdania cw 10
eksploracja lab03, Lista sprawozdaniowych bazy danych
więcej podobnych podstron


