Wyznaczanie krzywej Michaelisa
Do wyznaczenia krzywej i stałej Michaelisa musimy zbadać wpływ stężenia substratu na szybkość reakcji. Obserwacji będziemy dokonywac na reakcji hydrolizy sacharozy, która będzie katalizowania przez inwertazę. (Inwertaza należy do hydrolaz rozszczepiających wiązania glikozydowe)
Czynności:
Przygotowujemy probówki; oznaczamy je odpowiednimi indexami z tabel a i b; oraz przygotowujemy w nich roztwory o takim składzie jak w tabelach a i b
Probówki dla próby ślepej (S) i dla czasu t=0:
SA |
0.2cm3 0.1M sacharozy 3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH 0.2cm3 buf octanowego |
A0 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH 0.2cm3 0.1M sacharozy 0,2cm3 enzymu |
SB |
0.2cm3 0.1M sacharozy 3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH 0.2cm3 buf octanowego |
B0 |
3.5cm3 odcz. Nelsona 0.1cm3 0.05M NaOH 0.2cm3 0.1M sacharozy 0,2cm3 enzymu |
Sc |
0.2cm3 0.1M sacharozy 3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH 0.2cm3 buf octanowego |
C0 |
3.5cm3 odcz. Nelsona 0.1cm3 0.025M NaOH 0.2cm3 0.1M sacharozy 0,2cm3 enzymu |
Probówki dla właściwego doświadczenia
A |
3cm3 0,1M sacharoza 3cm3 enzymu |
A5 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
A10 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
A15 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
A30 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
B |
3cm3 0,05M sacharoza 3cm3 enzymu |
B5 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
B10 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
B15 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
B30 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
C |
3cm3 0,025M sacharoza 3cm3 enzymu |
C5 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
C10 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
C15 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
C30 |
3.5cm3 odcz. Nelsona 0.1cm3 0.1M NaOH |
Gotujemy ślepą próbę przez 20 w wrzącej łaźni wodnej. Mierzymy absorbancje dla λ=520 nm :
SA |
0,071 |
A0 |
0,002 |
SB |
0,063 |
B0 |
0,009 |
Sc |
0,059 |
C0 |
0,016 |
Probówki A, B, C wstawiamy do łaźni wodnej o temp 37°C i po 5, 10, 15 i 30 minutach od rozpoczęcia reakcji przenosimy po 1cm3 do odpowiednich probówek z pkt 1b index dolny oznacza czas w minutach
Następnie probówki z pkt gotujemy w wrzącej łaźni wodnej przez 20 min
Z każdej probówki z pkt 4 przenosimy do odpowiednie ponumerowanych probówek zawierających po 10cm3 wody destylowanej
Mierzymy absorbancję na spekolu dla λ=520 nm
A5 |
0,215 |
A10 |
0,193 |
A15 |
0,251 |
A30 |
0,756 |
B5 |
0,250 |
B10 |
0,366 |
B15 |
0,510 |
B30 |
0,838 |
C5 |
0,148 |
C10 |
0,280 |
C15 |
0,316 |
C30 |
0,546 |
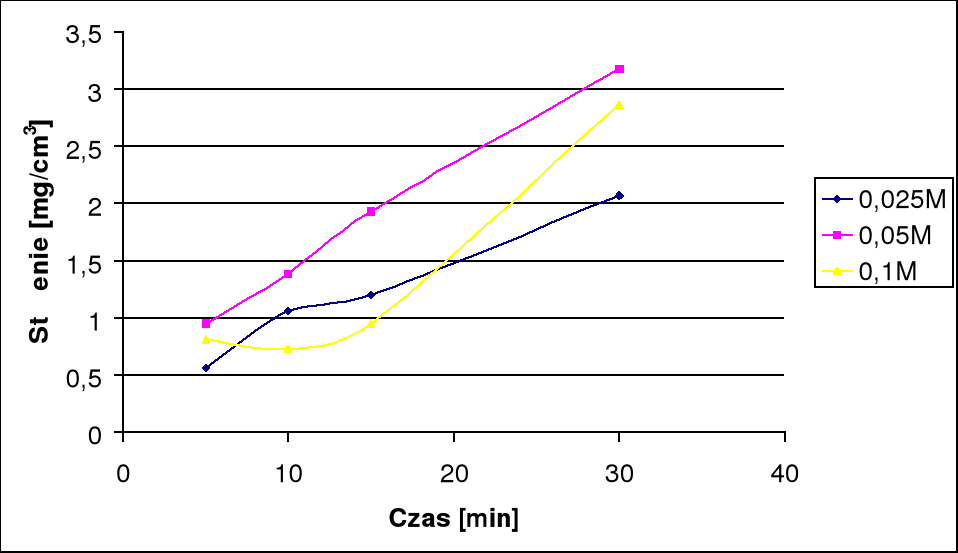
Po odczytaniu z krzywej wzorcowej otrzymano odpowiednie stężenia w mg/cm3
A5 |
0,814 |
A10 |
0,731 |
A15 |
0,951 |
A30 |
2,864 |
B5 |
0,947 |
B10 |
1,386 |
B15 |
1,932 |
B30 |
3,174 |
C5 |
0,561 |
C10 |
1,061 |
C15 |
1,197 |
C30 |
2,068 |
Dokonujemy obliczeń trzymając się toku rozumowania zawartego w skrypcie, korzystając z programu Excel:
Ten wykres przedstawia metodę wyliczania prędkości początkowego etapu reakcji. Pokazuje także jakie błędy wystąpiły w rzeczywistych pomiarach.
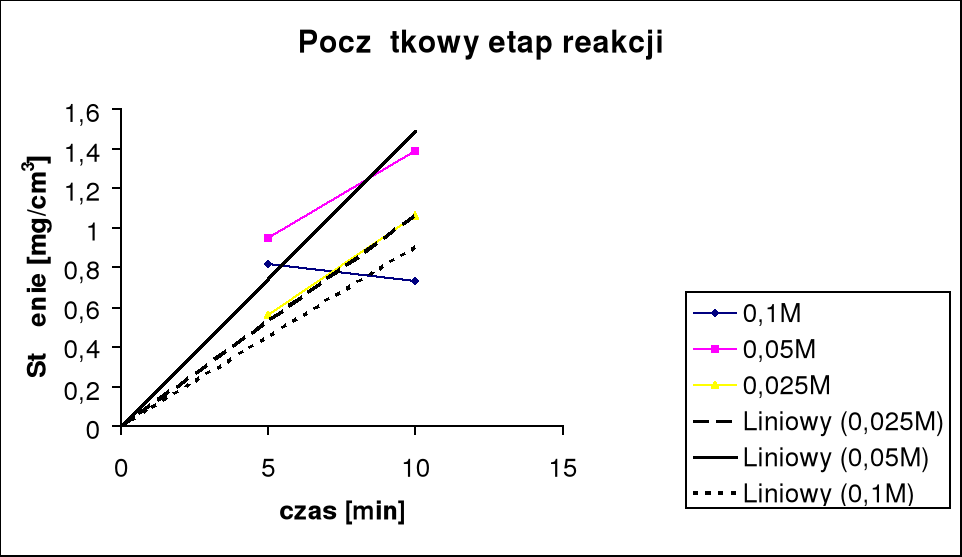
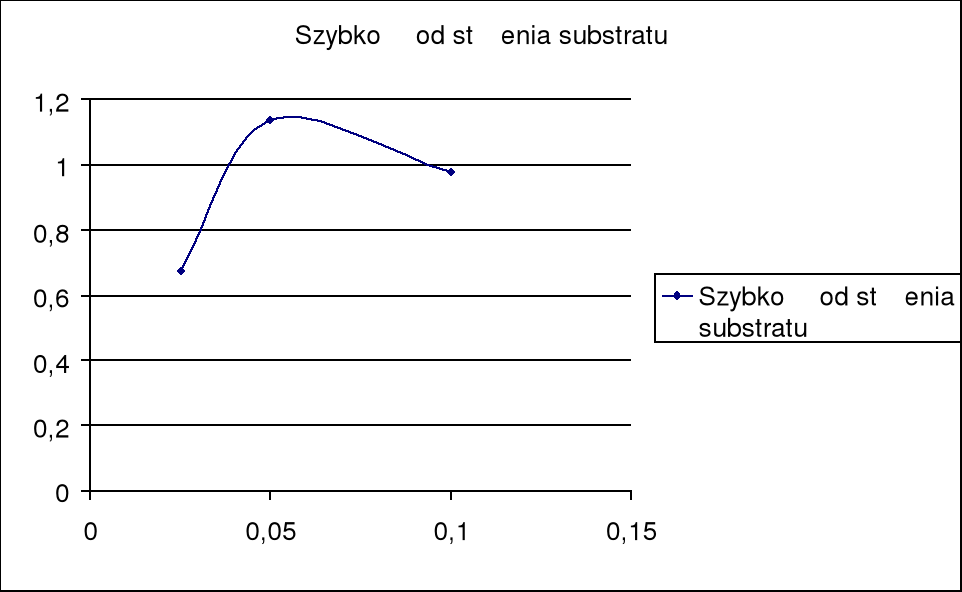
Wyznaczamy prędkość początkowego etapu reakcji korzystąc z właściwości iż będzie ona równa tg kąta stycznej do początkowej części wykresu, obliczenia przedstawia tabela
stężenie [M] |
0,1 |
0,05 |
0,025 |
tg [mg/min] |
0,977 |
1,136 |
0,673 |
|
|
|
|
1/S |
10 |
20 |
40 |
|
|
|
|
1/V |
1,023541 |
0,880282 |
1,485884 |
Część druga tabeli zawiera, odwrotności danych, niezbędne do sporządzenia wykresu Lineawera - Burka. Po sporządzeniu wykresu, z powstałych punktów interpolujemy prostą (przy pomocy odpowiedniej funkcji programu Excel). Odczytujemy (lub obliczamy) z wykresu punkt przecięcia prostej z osią X. Stałą Michaelisa Mentiem wyliczymy ze wzoru
![]()
Z wyliczeń stała wynosi KM=0,0242
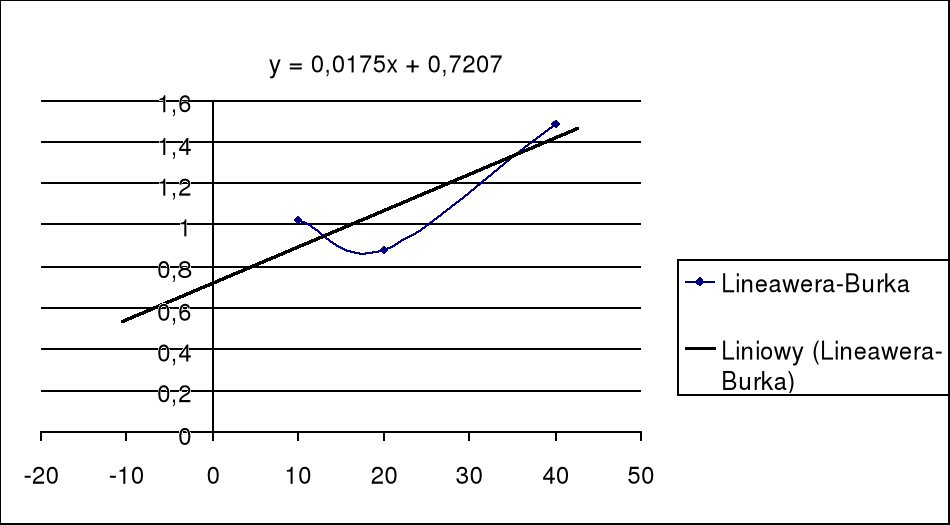
z wykresu odczytujemy iż KM= 0,0242
Wyznaczanie krzywej Michaelisa gr I i gr II
3
Wyszukiwarka
Podobne podstrony:
1Strona tytułowa na laborki, Automatyka i Robotyka, Semestr 2, Mechanika, sprawka, sprawozdania, Wyz
sprawka fizyka, Wyznaczanie prędkości dźwięku w powietrzu, nr
sprawka fizyka, Wyznaczanie promienia krzywizny soczewki za pomocą pierścieni Newtona
sprawka fizyka, Wyznaczanie stałej Plancka i pracy wyjścia na podstawie zjawiska fotoelektrycznego.,
sprawka fizyka ~$0 Wyznaczanie stałej Plancka i pracy wyjścia na podstawie zjawiska fotoelektr
sprawka fizyka, Wyznaczanie ogniskowych soczewek ze wzoru soczewkowego oraz metodą Bessela., nr
sprawka fizyka, Wyznaczanie długości fali świetlnej za pomocą pierścieni Newtona., nr
Bialka sprawko, Biochemia
SprawkoA B, biochemia laboratorium, Biochemia - sprawozdania inne
sprawko biochemia - 1, BIOLOGIA UJ, BIOCHEMIA WBBiB
Bialka sprawko, BIOCHEMIA
aminokwasy i białka sprawko, biochemia
sprawko z biochemi cukrowce, Biochemia, BIOCHEMIA Z DC++
sprawko biochemia kwasy nukleinowe, Biochemia, BIOCHEMIA Z DC++
sprawka biochemia Sprawozdanie 3
sprawka biochemia sprawozdanie PSII(1)
więcej podobnych podstron