Wstęp teoretyczny
Adsorpcja chemiczna zachodzi pod wpływem wiązań chemicznych, które cechuje duże ciepło adsorpcji oraz trudne usuwanie jednocząsteczkowych warstw chemisorbowanych.
Adsorpcja fizyczna uwarunkowana jest siłami Van der Waalsa, charakteryzując się niewielkim ciepłem adsorpcji, odwracalnością procesu i tworzeniem się w odpowiednich warunkach ciśnienia i temperatury warstw adsorpcyjnych o grubości średnic adsorbowanych cząstek.
Równanie izotermy adsorpcji Freunlicha
![]()
gdzie :
x - masa substancji zaadsorbowanej
m - masa adsorbenta
![]()
- adsorpcja właściwa
c - stężenie równowagowe substancji w fazie objętościowej
K i n - stałe charakterystyczne dla danego układu w danej temperaturze
![]()
Powierzchnię właściwą adsorbentu obliczamy ze wzoru :
![]()
gdzie:
nMAX - liczba moli zaadsorbowanej substancji przy całkowitym pokryciu powierzchni adsorbentu
NA - liczba Avogadro
S - powierzchnia zajmowana przez zaadsorbowaną cząsteczkę
Wykonanie ćwiczenia
Na początku musieliśmy przygotować odpowiednie roztwory kwasu octowego CH3COOH o następujących stężeniach:
Próbka 1 - 0,25 ![]()
Próbka 2 - 0,2 ![]()
Próbka 3 - 0,15 ![]()
Próbka 4 - 0,1 ![]()
Próbka 5 - 0,05 ![]()
Następnie do trzech pierwszych próbek dodaliśmy po 10 ml CH3COOH, a do dwóch następnych po 25 ml roztworu kwasu miareczkując 0,1 molowych roztworem NaOH otrzymując wyniki:
Nr próbki |
Stężenie CH3COOH |
Objętość próbki [cm3] |
Objętość r-ru NaOH zmiareczkowanego [cm3] |
1 |
0,25 |
10 |
22,8 |
2 |
0,2 |
10 |
22,5 |
3 |
0,15 |
10 |
15,4 |
4 |
0,10 |
25 |
15 |
5 |
0,05 |
25 |
10,7 |
Następnie do 5 kolbek ze szlifem korkowym odważyliśmy około 2g węgla aktywnego.
Następnie do każdej kolbki, w której znajdował się węgiel aktywny wlaliśmy 50 ml kwasu CH3COOH (0,25; 0,20; 0,15; 0,1; 0,05 mola). Potrząsaliśmy kolbki przez około 20 minut. Następnie przesączyliśmy przez bibułę, miareczkowaliśmy go 0,1 molowym roztworem NaOH w obecności fenoloftaleiny
Nr próbki |
Stężenie CH3COOH |
Objętość próbki [cm3] |
Objętość r-ru NaOH zmiareczkowanego [cm3] |
1 |
0,25 |
50 |
78,1 |
2 |
0,2 |
50 |
56,7 |
3 |
0,15 |
50 |
38,7 |
4 |
0,10 |
50 |
20,3 |
5 |
0,05 |
50 |
15,5 |
Opracowanie wyników
Obliczamy stężenie kwasu przed i po adsorpcji na węglu aktywnym
przed adsorpcją dla próbki 1:
![]()
![]()
po adsorpcji dla próbki 1:
![]()
=0,156 ![]()
Następnie obliczamy różnicę pomiędzy stężeniami kwasu octowego przed i po adsorpcji, dzięki czemu uzyskujemy ilość kwasu octowego zaadsorbowaną na węglu aktywnym.
![]()
=0,228-0,156 = 0,072 ![]()
w przeliczeniu na gramy :
x=0,043 g
Następnie obliczam stosunek masy roztworu zaadsorbowanego do masy adsorbenta
![]()
=0,022
logarytm z tego stosunku
![]()
= -1,67
logarytm ze stężenia
![]()
= -0,81
Wyniki obliczeń znajdują się w tabeli poniżej
nr próbki |
c |
c1 |
x [g] |
|
|
|
masa adsorbera [g] |
1 |
0,228 |
0,1562 |
0,043 |
0,022 |
-1,67 |
-0,81 |
2 |
2 |
0,225 |
0,1134 |
0,067 |
0,033 |
-1,48 |
-0,95 |
2 |
3 |
0,154 |
0,0774 |
0,046 |
0,023 |
-1,64 |
-1,11 |
2 |
4 |
0,06 |
0,0406 |
0,012 |
0,006 |
-2,24 |
-1,39 |
2 |
5 |
0,0428 |
0,031 |
0,007 |
0,004 |
-2,45 |
-1,51 |
2 |
Prosta regresji:
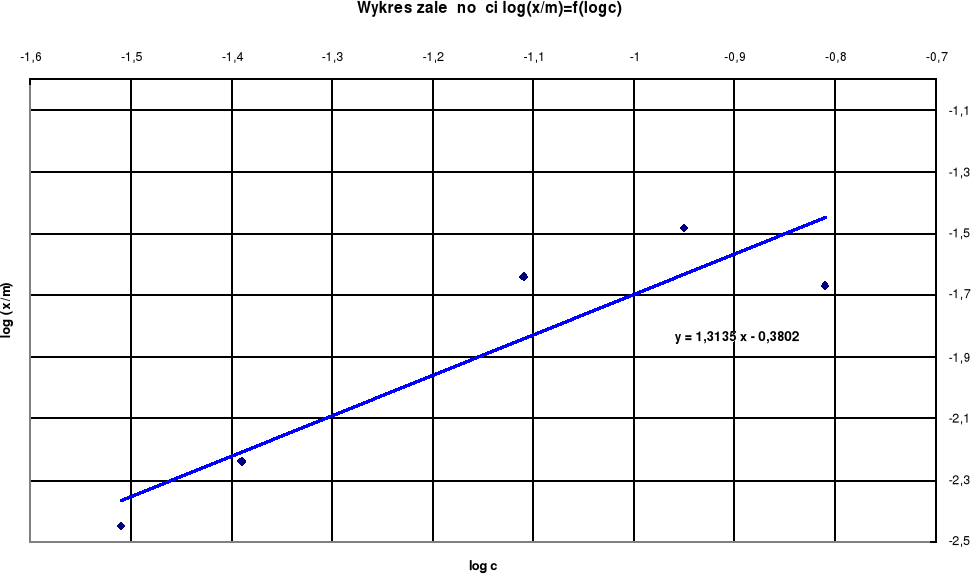
y = 1,3135 x - 0,3802
czyli:
a= 1,3135
b= - 0,3802
Stała K według wyprowadzenia:
![]()
![]()
![]()
![]()
(-0,642)]
log K= -0,826
K=0,149
Wnioski
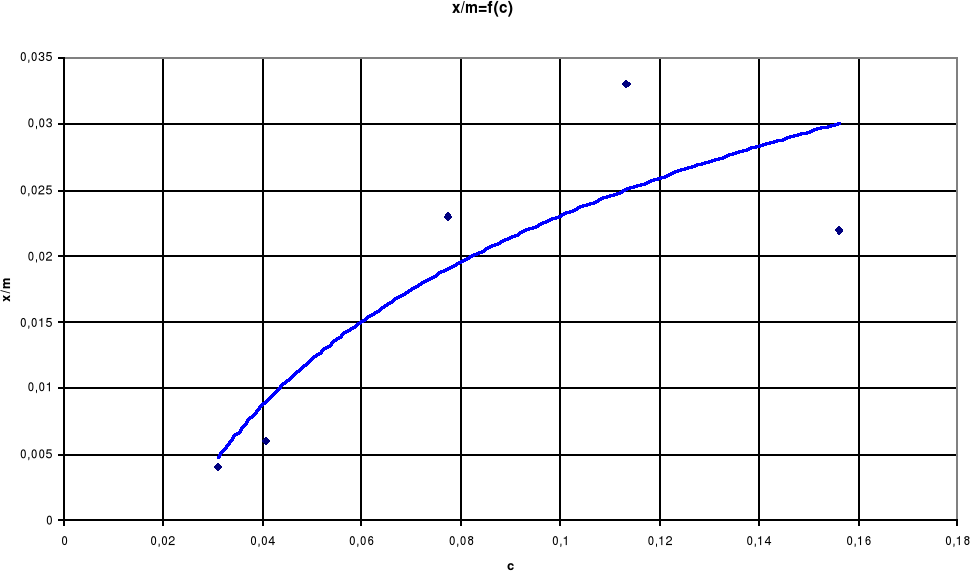
Jak widać na wykresie zależności log(x/m)=f(log c) wraz ze wzrostem stężenia kwasu octowego wzrasta adsorpcja na węglu aktywnym, czyli wzrost stężenia ma istotny wpływ na adsorpcję.
Błędy które mogliśmy popełnić podczas wykonywania ćwiczenia:
Podczas odmierzania węgla aktywnego mogliśmy niedokładnie odważyć potrzebną ilość błąd może wynikać z niedokładności wagi lub z naszego błędu ponieważ sprawiało nam trudność odmierzenie dokładnie 2 g wartości te wahały się w granicach 1,98-2.02 g.
Następnie odmierzaliśmy po 50cm3 CH3COOH o różnych stężeniach mogliśmy niedokładnie odmierzyć potrzebną ilość, kolbki mogły być zanieczyszczone mogły zawierać wodę po ich wcześniejszym myciu przez poprzednią grupę laboratoryjną .
Podczas miareczkowania mogliśmy popełnić bardzo duży błąd ponieważ nawet jedna kropla roztworu NaOH powodowała zmianę zabarwienia próbki. (roztwór fenoloftaleiny mógł być stary i mógł przez to nie posiadać swoich właściwości)
Następnie przesączaliśmy przez bibułę mieszaninę roztworu CH3COOH i węgla aktywnego roztwór mógł się zanieczyścić substancjami znajdującymi się na lejkach, pozostałościami znajdującymi się w kolbkach po naszym wcześniejszym miareczkowaniu.
Aby wyznaczyć parametry a i b równania skorzystaliśmy z metody najmniejszych kwadratów. Dla naszych danych otrzymaliśmy układ równań:
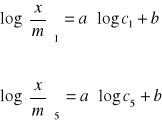
Każde równanie pomnożyliśmy przez współczynnik przy niewiadomych otrzymując po zsumowaniu układ równań normalnych:
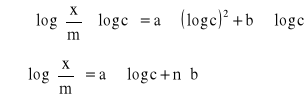
Po rozwiązaniu układu równań otrzymaliśmy:
![]()
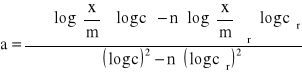
![]()
Podstawiając do równań (14) i (15) odpowiednie dane otrzymujemy parametry:
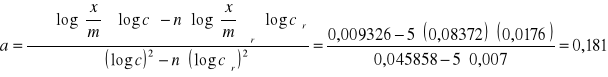
![]()
Podstawiając do równania (11) a i b mamy:
y = 0,181x + 0,00243
Wyszukiwarka
Podobne podstrony:
6a Filtracja, Adsorpcja
wykład 6a Trauma zmiany społecznej 1989
Wykład 6a(3)
Cwi 6a PR Lesiu
Adsorpcyjne oczyszczanie wody i ścieków
28fizyczna, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
Sprawko - ćw 6a, Politechnika Poznańska, Lab. Pomiary Wielkości Mechanicznych
6a
6a Ird a
6a
Adsorpcja, Energetyka, Chemia
Klucz odpowiedzi do testu - Wokół zegara i kalendarza 6a, gimnazjum i podstawówka, gimnazjum, polak,
adsorpcja zestaw ziolo, sem 1, Kataliza (magdapliki), EGZ
Adsorpcja jodu na wŕglu, technologia chemiczna, chemia fizyczna, srawozdania
więcej podobnych podstron