CIEPŁO
Wstęp
Pojęcie ciepła wiąże się nieodłącznie z pojęciem temperatury. Procesy związane z ciepłem są przedmiotem badań działów fizyki nazywanych fizyką cząsteczkową lub fizyką statystyczną oraz termodynamiką.
Termodynamika stosuje metodę opisu fenomenologiczną, opartą bezpośrednio na danych doświadczalnych i bada jedynie makroskopowe zjawiska, nie interesując się ich obrazem mikroskopowym. Podstawą termodynamiki są zasady termodynamiki.
Fizyka cząsteczkowa bada budowę i własności materii; posługuje się pojęciami teorii kinetyczno - molekularnej i stosuje opis statystyczny ruchu zbioru dużej liczby drobin.
Termodynamika i fizyka statystyczna uzupełniają się wzajemnie, wiążą ze sobą wielkości (obrazy) - makroskopowe i mikroskopowe procesów cieplnych.
Dynamika procesów cieplnych jest bardzo skomplikowana, stąd też wszystkie ilościowe rozważania termodynamiki dotyczą stanów równowagi układów i procesów odwracalnych.
Przez stan równowagi termodynamicznej (cieplnej) rozumiemy taki stan, w którym układ może pozostawać dowolnie długo a wszystkie parametry stanu (np. ciśnienie, objętość, temperatura, ......) mają określone wartości i nie ulegają zmianie.
Przez proces odwracalny, in. nazywany przemianą równowagową lub kwazistatyczną rozumie się taki proces, który składa się z ciągłego zbioru kolejnych stanów równowagi. Realne przemiany mogą być uważane za odwracalne, jeśli zachodzą dostatecznie powoli.
Jednym z podstawowych pojęć termodynamicznych jest wielkość zw. energią wewnętrzną ciała, zwykle oznaczana U . Jest to całkowita energia, jaką posiada ciało (kinetyczna i potencjalna oddziaływań wewnętrznych) z wyłączeniem energii kinetycznej i potencjalnej ciała wynikających z oddziaływań zewnętrznych pól.
Energia wewnętrzna - mówimy - jest funkcją stanu układu, tzn. ma zawsze tę samą wartość w danym stanie, niezależnie od „historii” układu.
Temperatura
Temperatura jest jednym z tzw. parametrów stanu i jest także funkcją stanu. Dwa ciała mają tę samą temperaturę, jeśli między nimi nie ma przekazywania ciepła.
Do określenia temperatury stosuje się powszechnie termometry, które są w sposób umowny skalowane. Używane są różne skale termometryczne. Najbardziej rozpowszechnione jest stosowanie skali Celsjusza, która polega na przyjęciu, że:
w warunkach ciśnienia 1 atm - temperatura topnienia lodu wynosi 0 0C, a wrzenia wody 100 0C,
wybrana tzw. cecha termometryczna (np. rozszerzalność objętościowa rtęci) zależy liniowo od temperatury.
W podobny sposób skalowane termometry, w szczególności dla różnych zakresów temperatur, zależą od własności użytych ciał termometrycznych i dlatego mogą posiadać de facto różne skale termometryczne.
II zasada termodynamiki pozwoliła dopiero zbudować skalę , która nie posiada wspomnianej wady. Nosi ona nazwę bezwzględnej termodynamicznej skali temperatur .
Jednostką temperatury bezwzględnej jest 1 K (kelwin) = 1 0C.
Pomiędzy skalą Kelwina i skalą Celsjusza zachodzi związek
T = t +273,15
gdzie: T - temperatura w skali bezwzględnej; t - w skali Celsjusza.
Równanie stanu gazu doskonałego
Najprostszą do opisu termodynamicznego formą materii jest jej stan gazowy. Badania przeprowadzone dla różnych gazów pokazują jednak, że ich zachowanie w zależności od temperatury i ciśnienia są nieco różne, przy czym praktycznie brak różnic występuje dla gazów dostatecznie rozrzedzonych. Dlatego w termodynamice wprowadzono pojęcie tzw. gazu doskonałego o cechach charakterystycznych dla gazów rozrzedzonych o niewielkich gęstościach.
Doświadczenia pokazują, że dla ustalonej ilości (tej samej liczby drobin) takich gazów jest spełnione równanie
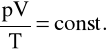
gdzie: p - ciśnienie gazu, V - jego objętość, T - jego temperatura.
W szczególności (prawo Avogadro) 1 mol każdego gazu zawiera zawsze tę samą liczbę drobin NA =6,022 x 1023 i zajmuje te samą objętość Vm zw. objętością molową. Stąd wynika, że dla 1 mola, stała występująca w podanym wzorze posiada określoną wartość; stałą tę przyjęto oznaczać symbolem R i z danych doświadczalnych wynika jej wartość
R = 8,31 J/(mol K)
Tak więc równanie wyżej podane, dla 1 mola może być przepisane w postaci
pVm = RT
a dla 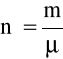
moli ( m - masa rozpatrywanego gazu; ![]()
- jest masą 1 mola gazu, czyli masą cząsteczkową wyrażoną w jednostkach masy)
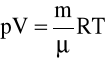
Zazwyczaj w takiej formie zapisu równanie opisujące zachowanie mocno rozrzedzonych gazów jest nazywane równaniem stanu gazu doskonałego.
Równanie to można zapisać także w innej postaci, wprowadzając stałą
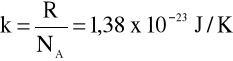
nazywaną stałą Boltzmanna.
Otrzymujemy
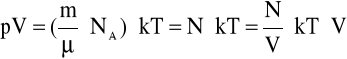
a stąd
p = n k T
gdzie: 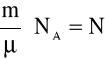
jest liczbą cząsteczek rozpatrywanego gazu o masie m,
zaś 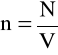
liczbą drobin na jednostkę objętości, czyli koncentracją gazu.
Prosty związek między T i pozostałymi parametrami gazu doskonałego pozwala przyjąć go jako substancję termometryczną i otrzymać termometr o idealnie liniowej skali temperatur.
Opis ciepła
Ciepło dostarczone do układu, lub przekazane od układu wiąże się ze zmianami temperatury. Ilość ciepła potrzebna do zmiany temperatury ciała o wartość jednostkową jest wielkością charakterystyczną dla danego ciała i nosi nazwę pojemności cieplnej tego ciała. Z tego określenia wynika wzór definicyjny pojemności cieplnej ciała
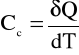
wyrażanej w jednostce J/K.
Uwzględniając definicję ciepła właściwego substancji c - ilość ciepła potrzebna do zmiany o jednostkę temperatury jednostki masy danej substancji - jeśli masa substancji wynosi m , to zachodzi oczywista relacja
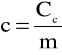
przy czym ciepło właściwe wyrażamy w jednostkach J/(kg K).
W termodynamice najczęściej stosowaną jednostką ilości materii jest 1 mol; w związku z tym definiuje się pojęcie ciepła molowego C jako ilości ciepła, potrzebną do zmiany temperatury o jednostkę dla 1 mola substancji.
Ponieważ masa 1 mola jest równa masie cząsteczkowej/atomowej ![]()
wyrażonej w jednostkach masy, wynika stąd prosty związek
![]()
Ciepło molowe jest wyrażane w jednostkach J/(mol K).
Ilość ciepła dostarczoną do układu n' moli substancji obliczamy więc, stosując wzór
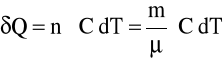
gdzie m - jest masą danej substancji.
- 5 -
1-ciepło i temperatura