Lekcja
Temat: Energia w przemianach gazowych.
1. Cząsteczki gazu doskonałego oddziałują z sobą jedynie w momentach zderzeń. Dlatego można uznać, że ich energia potencjalna wzajemnych oddziaływań jest równa zero, a co za tym idzie energia wewnętrzna gazu jest właściwie sumą tylko energii kinetycznych cząsteczek.
2. Przemiana izotermiczna.
W czasie przemiany izotermicznej nie zmienia się temperatura gazu, a więc nie zmienia się też średnia energia kinetyczna cząsteczek gazu, a więc nie będzie zmieniać się także energia wewnętrzna gazu (ΔU = 0).
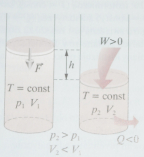
a) izotermiczne sprężanie gazu
I zasadę termodynamiki (ΔU= W+Q) można dla tej przemiany zapisać następująco:
0 = W + Q
↓
W = -Q
Podczas izotermicznego sprężania gaz oddaje do otoczenia ciepło
równe co do wartości pracy wykonanej przy jego sprężaniu.
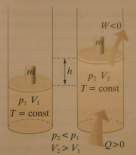
b) izotermiczne rozprężanie gazu
I zasadę termodynamiki można dla tej przemiany zapisać następująco:
0 = W + Q
↓
Q = -W
Podczas izotermicznego rozprężania gaz pobiera z otoczenia ciepło
równe co do wartości pracy wykonanej podczas rozprężania.
3. Przemiana izochoryczna.
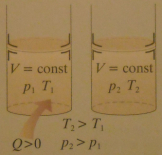
Podczas przemiany izochorycznej nie zmienia się objętość gazu, a więc nie jest wykonywana praca (W = 0)
I zasadę termodynamiki dla tej przemiany można zapisać następująco:
ΔU = Q
Z zapisu tego wynika, że:
Podczas przemiany izochorycznej energia wewnętrzna gazu rośnie
o wartość ciepła dostarczonego do gazu w czasie jego ogrzewania,
zaś w czasie oziębiania maleje o wartość ciepła oddanego do otoczenia.
Ilość ciepła dostarczonego do gazu w czasie izochorycznego ogrzewania można obliczyć za pomocą wzoru:
gdzie:
- ciepło molowe gazu przy stałej objętości
n - liczba moli gazu
ΔT - zmiana temperatury gazu
Ciepło molowe przy stałej objętości jest to wielkość, która określa, ile ciepła należy dostarczyć, aby ogrzać 1 mol gazu o 1K nie zmieniając jego objętości.
[J/(mol.K)]
4. Przemiana izobaryczna.
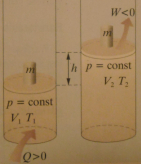
a) ogrzewanie izobaryczne
Na skutek dostarczenia ciepła gaz rozszerza się
i wykonuje pracę, jednocześnie rośnie temperatura gazu. Zatem I zasadę termodynamiki można zapisać następująco:
ΔU = Q - W
↓
Q = ΔU + W
Ilość ciepła dostarczonego do gazu w czasie izobarycznego ogrzewania można obliczyć za pomocą wzoru:
gdzie:
- ciepło molowe gazu przy stałym ciśnieniu
n - liczba moli gazu
ΔT - zmiana temperatury gazu
Ciepło molowe przy stałym ciśnieniu jest to wielkość, która określa, ile ciepła należy dostarczyć, aby ogrzać 1 mol gazu o 1K nie zmieniając jego ciśnienia.
[J/(mol.K)]
Ciepło molowe przy stałym ciśnieniu jest większe od ciepła molowego przy stałej objętości, ponieważ gaz ma się ogrzać o 1 K i dodatkowo wykonać pewną pracę rozprężając się, a więc musimy dostarczyć mu wtedy więcej energii.
Zależność między tymi ciepłami jest następująca:
Wartość pracy wykonanej przez gaz w czasie izobarycznego ogrzewania jest liczbowo równa polu powierzchni pod wykresem przemiany w układzie (p,V).
Można ją obliczyć za pomocą wzoru:
W = p . ΔV
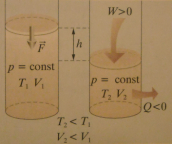
b) oziębianie izobaryczne
Kiedy gaz oddaje ciepło do otoczenia maleje jego temperatura (ΔU<0) i objętość - gaz ulega sprężeniu (W>0).
Zatem I zasadę termodynamiki można zapisać następująco:
-ΔU = -Q + W → W= Q - ΔU
5. Przemiana adiabatyczna
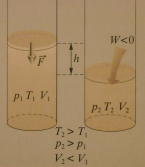
a) sprężanie adiabatyczne
W czasie przemiany adiabatycznej gaz nie wymienia ciepła z otoczeniem, a więc Q = 0.
I zasadę termodynamiki dla tej przemiany można zapisać następująco:
ΔU = W
Przyrost energii wewnętrznej gazu równy jest wartości pracy wykonanej nad gazem podczas jego sprężania.
b)rozprężanie adiabatyczne
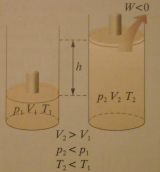
I zasadę termodynamiki dla tej przemiany można zapisać następująco:
-ΔU = -W
Energia wewnętrzna gazu maleje o wartość wykonanej przez gaz pracy w czasie rozprężania.
Wyszukiwarka
Podobne podstrony:
Energia wewnętrzna gazowych produktów wybuchu
1?danie przemian energii mechanicznej
Ciepło i przemiany energii
(Grupa A)Przemiany energii w zjawiskach cieplnych (Zamkor)-ściąga, spr z fizyki 2gim
OII05 Badanie przemian energii Nieznany
Badanie przemian energii mechanicznej na równi pochyłej POPRAWIONE (2)
1-10-ŻYWIENIE- do wysłania, Zapotrzebowanie człowieka na energię jest wyznaczone poziomem przemiany
III05 Badanie przemian energii Nieznany
19 Istota przemiany energii w materii ozywionej
Przemiany Energetyczne I Żródła Energii, Fotowoltaika1, Fotowoltaika
STR1, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia pradu
Przemiany energii wewnętrznej ciał, Różne Spr(1)(4)
STR2, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia pradu
Pomiar mocy, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energi
03elektr, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, 0.3 - moc i energia p
Żywienie, 01ŻYWIENIE- WSTĘP, Zapotrzebowanie człowieka na energię jest wyznaczone poziomem przemiany
Fizyka [ ruch, energia, moment] [ 1] [ 2] [ 3], fizyka11, Ruch postępowy- odcinek łączący dwa dowoln
więcej podobnych podstron