TOMOGRAFIA POZYTONOWA
POSITRON EMISSION TOMOGRAPHY (PET)
ANIHILACJA POZYTONÓW
Zjawisko anihilacji pozytonów
W roku 1930 P.A.M.Dirac przewidział istnienie pozytonu, natomiast w 1932 r. J.Anderson wykrył pozytony w promieniowaniu kosmicznym. Następnie J.Curie i F.Joliot stwierdzili, że pozytony są emitowane przez niektóre jądra w procesie rozpadu promieniotwórczego.
Masa pozytonu równa się masie elektronu :
a ładunek elektryczny równy jest co do wartości bezwzględnej ładunkowi elektronu :
Spin i moment magnetyczny pozytonu i elektronu mają te same wartości równe s=1/2 i ၭ = ၭB, z tym, że moment magnetyczny pozytonu jest równoległy do jego spinu, a moment magnetyczny elektronu antyrównoległy.
Jeżeli pozyton zderzy się ze swobodnym elektronem to wówczas następuje anihilacja tych cząstek z jednoczesną emisją parzystej lub nieparzystej liczby kwantów gamma:
e+ + e- = 2 n ၧ
e+ + e- = (2n + 1) ၧ
gdzie n - liczba całkowita;
n = 1,2,3....
Ślad pozytonu kosmicznego o energii 69 MeV otrzymany przez Andersona w komorze Wilsona: w środku komory znajduje się płyta ołowiana o grubości 6 mm, średnica komory 16,5 cm, pole magnetyczne o natężeniu 15 kGs.
Tory pary pozyton-elektron otrzymanej w komorze Wilsona przez naświetlanie promieniami g o energii 17,6 MeV płytki ołowianej o grubości 0,33 mm, pole magnetyczne o natężeniu 2,5 kGs.
Ślady pary elektronowej (negatonu i pozytonu) i elektronu odrzutu (fotografia stereoskopowa)
Jak się okazuje w wyniku anihilacji swobodnej pary e+ e- z największym prawdopodobieństwem następuje emisja dwóch lub trzech kwantów gamma. Obliczone zostały przekroje czynne anihilacji dwu- i trójkwantowej wynoszące odpowiednio:
gdzie:
r0 = e2/ mc2 = 2.8 10-15
- klasyczny promień elektronu;
c = 3 x 108 m/ - prędkość światła;
ၡ = 1 / 137 - stała struktury subtelnej;
v - prędkość elektronu
Z - liczba atomowa.
Powyższe wzory odnoszą się do pozytonów, których prędkość jest dużo mniejsza od prędkości światła . Stosunek przekrojów czynnych anihilacji 3ၧ i 2ၧ wynosi:
Powyższy wynik wskazuje, że w przypadku anihilacji pozytonów poprzez zderzenia z elektronami swobodnymi, spośród 373 pozytonów aż 372 anihiluje dwukwantowo a jeden trójkwantowo.
W ośrodkach, w których anihilacja jest swobodna zdecydowanie przeważa proces anihilacji dwukwantowej.
Wyznaczono wartości czasów życia pozytonów swobodnych w próżni i tak dla anihilacji dwukwantowej i dla anihilacji trójkwantowej :
ၴ2ၧ = 4.5 x 10-10 s
ၴ3ၧ = 1.7 x 10-7 s
Oprócz anihilacji swobodnej może istnieć także anihilacja pozytonu z elektronem w stanie związanym. Następuje ona wtedy, gdy pozyton utworzy z elektronem atom wodoropodobny zwany pozytem Ps .
Istnienie pozytu teoretycznie przewidział w 1934 r. S.Moharovic, a eksperymentalnie stwierdził istnienie pozytu w 1951 r. M.Deutsh. Z przeprowadzonych badań i obliczeń wynika, że pozyt jest analogiem atomu wodoru, w którym rolę protonu odgrywa pozyton.
Energia wiązania pozytu, jego promień i masa opisane są z zadowalającym przybliżeniem, w/g teorii budowy atomu Bohra.
Energia wiązania pozytu jest dwukrotnie mniejsza niż wodoru. Natomiast promień borowski pozytu jest dwukrotnie większy niż atomu wodoru.
Jeżeli mamy do czynienia z oddziaływaniem powolnych pozytonów z elektronami, kiedy moment orbitalny l=0, oraz w zależności od tego czy spiny obu cząstek są równoległe czy antyrównoległe mamy do czynienia ze stanem tripletowym 3S1 (dla którego całkowity mement będący sumą momentu orbitalnego i spinowego J=1) lub singletowego 1S0 (dla którego całkowity moment J=0).
Parytet ładunkowy układu pozyton - elektron Pc równa się:
Pc = Pi Pl Pၤ
gdzie :
Pi - parytet wewnętrzny,
Pl - parytet przestrzenny,
Pၤ - parytet spinowy.
wodór pozyt
Masa zredukowana: ≈ me me/2
Promień Bohra: 0,53Å 1,06Å
Energia jonizacji: 13,6 eV 6,8 eV
Dla układu cząstka - antycząstka parytet wewnętrzny Pi = -1, parytet przestrzenny Pl = (-1)l, parytet spinowy Pၤ = -(-1) ၤ . W związku z tym dla stanu tripletowego parytet ładunkowy Pc będzie:
a dla stanu singletowego:
Ponieważ parytet ładunkowy n fotonów wynosi Pc=(-1)n zatem z zasady zachowania parytetu wynika, że anihilacja ze stanu tripletowego 3S1 zachodzi na nieparzystą liczbę kwantów gamma (najbardziej prawdopodobna 3ၧ ), natomiast dla stanu singletowego 1S0 na parzystą liczbę kwantów gamma (najbardziej prawdopodobna 2ၧ ).
Ze względu na to, że mamy różne ustawienia spinów pary e+e- wyróżniamy dwie odmiany pozytu: parapozyt p-Ps o antyrównoległym ustawieniu spinów (stan 1S0) oraz ortopozyt o-Ps o równoległym ustawieniu spinów (stan 3S1) .
Anihilacja parapozytu (a) i ortopozytu (b)
Całkowity momement pędu ortopozytu J=1, przy czym są możliwe trzy sposoby realizacji tego stanu : a mianowicie dla magnetycznej liczby kwantowej m=0, m=+1, m=-1. Dla parapozytu, gdzie całkowity moment pędu J=0, możliwy jest tylko jeden przypadek dla m=0. Z tego wynika, że w procesie tworzenia się pozytu w 75% powstaje ortopozyt, a w 25% parapozyt.
Obliczono teoretyczne wartości stałych rozpadu i czasów życia pozytonów ze stanów związanych o-Ps i p-Ps.
Dla p-Ps stała rozpadu wyraża się wzorem :
gdzie:
ၴs - średni czas życia p-Ps;
ၙႽ(0Ⴝ - gęstość funkcji falowej elektronu w obszarze zajmowanym przez pozyton w stanie podstawowym (n=1).;
r0 - klasyczny promień elektronu; c - prędkość światła.
Dla o-Ps:
gdzie:
ၴt- średni czas życia o-Ps;
ၡ- stała struktury subtelnej;
ၬs- stała rozpadu p-Ps.
Otrzymane stąd wartości stałych rozpadu i średnich czasów życia wynoszą odpowiednio:
wartości te są w dobrej zgodności z danymi doświadczalnymi dla wielu substancji .
Gdy orientacja spinów elektronu i pozytonu jest antyrównoległa to z zasady zachowania energii, pędu i parzystości następuje emisja parzystej liczby kwantów o energii: 0,51 MeV każdy:
przy czym najbardziej prawdopodobna jest anihilacja dwukwantowa:
Gdy orientacja spinów elektronu i pozytonu jest równoległa to zasady zachowania są spełnione tylko w przypadku emisji nieparzystej liczby kwantów zgodnie ze wzorem:
przy czym najbardziej prawdopodobna jest anihilacja trójkwantowa:
Anihilacja w której powstałby jeden kwant jest możliwa jedynie w obecności trzeciego ciała przejmującego pęd odwrotny:
W 1949 r. A.Ore opracował teorię opisującą oddziaływanie pozytonów z gazami.
Jednakże model Ore dotyczący oddziaływania pozytonów z gazami nie może być w pełni stosowany w przypadku oddziaływania pozytonów z ciałami stałymi i cieczami.
Dla tych substancji poprawny model przedstawił w 1974 r. O.E.Mogensen.
Stwierdził on, że pozyton wytraca ostatnie 100-200 eV swojej energii na jonizację atomów ośrodka, przy czym wytworzone elektrony posiadają energię rzędu 10-50 eV.
Elektrony te termalizując się (czyli wytracając swoją energię) przebywają pewną drogę w ośrodku.
Mogensen założył, że pozyton przy wytracaniu ostatnich 10-50 eV swojej energii przebywa drogę tego samego rzędu i wtedy może nastąpić reakcja tworzenia pozytu z jednym z uwolnionych elektronów towarzyszących niejako pozytonowi.
Z poprzednich obliczeń (parytetu parzystości i momentów pędu) wynikało, że w przypadku utworzenia pozytu prawdopodobieństwo powstania ortopozytu trzykrotnie przewyższa prawdopodobieństwo powstania parapozytu.
Jednakże liczne oddziaływania pozytu z materią powodują, że stosunek liczby atomów o-Ps do liczby atomów p-Ps w momencie anihilacji może być różny od trzech.
Procesy prowadzące do zmiany tego stosunku nazywa się procesami gaszenia pozytu .
Podstawowym procesem gaszącym jest proces "pick-off". Polega on na tym, że pozyton związany z elektronem (w atomie pozytu) nie anihiluje z tym elektronem, lecz z jednym z elektronów otoczenia.
Następuje tutaj zerwanie wiązania pozytu i natychmiastowa anihilacja pozytonu z elektronem wywołującym to zerwanie. Ze względu na krótki czas życia parapozytu, proces "pick-off" dotyczy głównie ortopozytu.
Anihilacja ortopozytu poprzez proces "pick-off" prowadzi zwykle do emisji dwóch kwantów gamma, jako że anihilacji pozytonu z elektronem wywołującym ten proces jest anihilacją swobodną.
Proces pick-off
Konsekwencją wystąpienia procesu "pick-off" jest skróceniem o-Ps. Polega on na tym, że pozyton związany z elektronem (w atomie pozytu) nie anihiluje z czasem życia
o-Ps.
Przyjmuje się zgodnie z pomiarami czasu życia pozytonów, że anihilacja o-Ps poprzez proces "pick-off" nastąpi po czasie około 10-9 s.
Istnieje szereg dalszych procesów gaszących pozyt, które jednak nie występują w przypadku stosowania PET :
konwersja wewnętrzna i zewnętrzna występujące przy oddziaływaniu na próbkę silnymi polami magnetycznymi i elektromagnetycznymi i paramagnetykami oraz szereg reakcji chemicznych jak: utlenianie, reakcje wymiany i przyłączania.
Ze względu na bardzo skomplikowany charakter anihilacji tych procesów, należy je rozpatrywać dla indywidualnych przypadków. Mogą tworzyć się pewne straty pośrednie, prowadzące w konsekwencji do rozpadu poprzez proces "pick-off".
Czasy życia pozytonów ၴ w próbce są bezpośrednio związane z koncentracją elektronów ne dostępnych dla danego typu anihilacji (anihilacji swobodnej, anihilacji parapozytu czy anihilacji gaszenia ortopozytu), następującym wzorem:
gdzie:
ne - koncentracja elektronów dostępnych dla danego typu anihilacji,
r - klasyczny promień elektronów,
c - prędkość światła,
ၴ - składowa czasu życia pozytonów danego typu anihilacji.
Na22 Ⴎ Ne22 + ၢ+ + ၮe
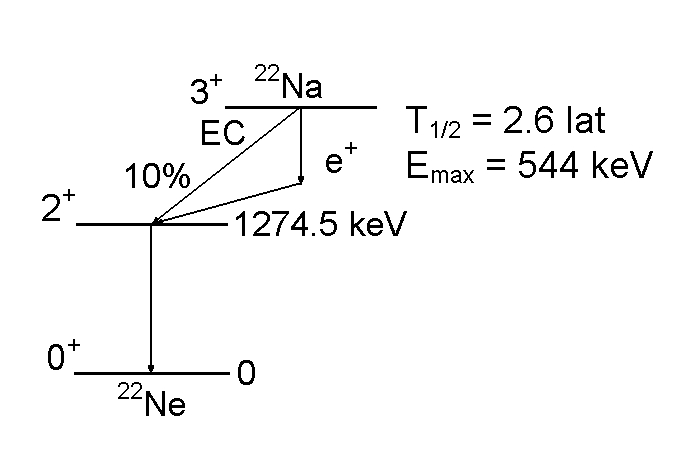
Tomografia pozytonowa
Podstawy teoretyczne
Emisyjna tomografia pozytonowa
Rozwój tomografii komputerowej w medycynie zapoczątkowały prace Cormacka, który wykazał, że znajomość projekcji liniowych (f) funkcji g na wybranej płaszczyźnie z = const:
fj(r) = ňL ds g(x,y), (1)
pozwala odtworzyć funkcję g, jeżeli prześwietlimy badany obiekt pod różnymi kątami.
Kartezjański układ współrzędnych (x,y,z) opisuje badany obiekt, (r, j) to współrzędne biegunowe związane z ruchomym układem aparaturowym, a ds jest przyrostem długości wzdłuż linii całkowania L = L(r, j).
Ponieważ prawdopodobieństwo emisji n kwantów gamma jest proporcjonalne do (1/137)n, najbardziej prawdopodobna jest anihilacja dwukwantowa, zachodząca dla cząstek o spinach antyrównoległych.
Zgodnie z zasadą zachowania pędu, wypadkowy pęd powstających fotonów wynosi p, przy czym wartość bezwzględna pędu każdego fotonu równa jest:
mc + p/2,
gdzie
c - to prędkość światła,
m - masa elektronu (pozytonu),
p - sumaryczny pęd anihilującej pary pozyton - elektron.
Ponieważ pozyton w chwili anihilacji jest stermalizowany, wartość pędu p jest zaniedbywalna w stosunku do pędu pojedynczego fotonu i w efekcie otrzymujemy dwa fotony rozchodzące się prawie antyrównolegle.
W związku z tym, jeżeli liczniki rejestrujące liczbę powstających kwantów gamma usytuujemy antyrównolegle oraz w pobliżu badanego obiektu, otrzymamy liczbę zliczeń f dla wszystkich aktów anihilacji, jakie zaszły na danej linii L (równanie(1)), a odtwarzając funkcje g, uzyskamy mapy badanych narządów.
Jeżeli jednak liczniki te będą rozsunięte na znaczne odległości, to będziemy mogli mierzyć odchylenie kwantów gamma od współliniowości, będące miarą pędu p anihilujących elektronów.
W tym przypadku funkcję g(x,y) w równaniu (1) należy zastąpić funkcją r(p) opisującą prawdopodobieństwo tego, że anihilująca para elektron-pozyton ma pęd p.
fj(r) = ňL ds g(x,y),
Dla materiałów o charakterze metalicznym metoda anihilacji pozytonów pozwala wyznaczyć nie tylko powierzchnię Fermiego, ale również badać składowe Umklapp funkcji falowej elektronu.
Istotną zaletą tej metody badawczej jest to, że można śledzić zmiany struktury elektronowej pod wpływem dowolnych warunków zewnętrznych (np. temperatury, ciśnienia).
Tego typu informacji nie można otrzymać przy użyciu powszechnie stosowanych magnetycznych metod określania struktury elektronowej (np. efekt de Haasa-van Alphena).
Efekt De Haasa—van Alphena
W silnym polu magnetycznym stany gazu elektronów swobodnych nie przedstawiają fal płaskich, a energii nie można już przedstawić prostym wzorem :
Ek= k^2/2m.
Szereg właściwości fizycznych metali ulega znacznej zmianie pod wpływem pola magnetycznego. Efekt de Haasa—van Alphena polega na oscylacjach momentu magnetycznego zachodzących w funkcji natężenia pola magnetycznego. Za silne pole uważamy takie pole, pod wpływem którego elektron, zanim ulegnie zderzeniu, wykona więcej niż jedno okrążenie na orbicie spiralnej, tzn. ၷcၴ ှ l, gdzie ၷc jest częstością cyklotronową.
W praktyce w przypadku pól, jakie zazwyczaj spotyka się w warunkach laboratoryjnych, w celu spełnienia tych warunków konieczne jest stosowanie niskich temperatur i użycie czystych próbek. Efekt de Haasa—van Alphena powstaje wskutek periodycznych zmian całkowitej energii elektronu zachodzących w funkcji statycznego pola magnetycznego. Powyższa zmiana energii objawia się w doświadczeniu jako periodyczna zmiana momentu magnetycznego metalu.
Stwarza to możliwości wielokrotnego diagnozowania pacjenta - nie tylko lokalizacji i źródła choroby, ale również efektywności leczenia.
Tomografia pozytonowa to badania przepływu krwi przez określone narządy, metabolizmu niektórych substancji (zużycie tlenu, glukozy, leków itd.) bądź ekspresji niektórych receptorów.
Ma tę przewagę nad RTG i NMR, że umożliwia badanie czynnościowe narządów, co można wykorzystać zarówno w obserwacjach stanów fizjologii, jak i patologii.
Badania fizjologii, gdzie wykorzystuje się ścisłe powiązania między aktywnością neuronalną, zużyciem energii i miejscowym przepływem krwi, dotyczą w szczególności określenia funkcji prawidłowego mózgu, m.in. procesów spostrzegania, słuchania, myślenia i percepcji obrazów.
Do badania stanów patologicznych metodę PET wykorzystuje się przede wszystkim w neurologii, neurochirurgii, psychiatrii, kardiologii i onkologii.
W dziedzinie neurologii pozwala ona zróżnicować przyczyny otępienia będącego objawem wielu chorób, np. choroby Alzheimera, otępienia wieloogniskowego, a także pseudodemencji.
Badanie PET ma duże znaczenie w określeniu ognisk epileptycznych, co decyduje o kwalifikacji pacjentów do zabiegu operacyjnego, jak również umożliwia precyzyjne wykonanie operacji neurochirurgicznych.
Kolejna grupa schorzeń to choroby neurologiczne związane z zaburzeniami ruchu - m.in. choroba Parkinsona, choroba Huntingtona, choroba Wilsona.
W przypadku schizofrenii można z kolei określić biochemiczne zmiany w mózgu.
Dla oszacowania wydolności mięśnia sercowego bada się metabolizm kwasów tłuszczowych w tym organie, a dla lokalizacji zawału - miejscowy przepływ krwi.
W dziedzinie onkologii (wykorzystując fakt, że zmiana metabolizmu glukozy jest zależna od złośliwości nowotworu) można odróżnić zmianę łagodną od złośliwej, określić stopień złośliwości nowotworu, jak również oszacować efektywność leczenia bez oczekiwania na redukcję wielkości guza.
Informacje na temat metody PET i możliwości jej stosowania przedstawione zostaną w dalszych częściach wykładu.
Reasumując: Emisyjna Tomografia Pozytonowa w skrócie PET (positron emission tomography) polega na wstrzykiwaniu pacjentowi promieniotwórczego izotopu wysyłającego promieniowanie beta plus czyli pozytony (dodatnie elektrony), co prowadzi do anihilacji i emisji fotonów, wykrywanej w kolejnych warstwach..
W badaniu korzysta się z pierwiastków, wbudowanych do określonych cząsteczek, na przykład cukry, które poszczególne tkanki zużywają w różnym tempie.
Izotopy rozpadając się, są źródłem pozytonów, które w wyniku spotkania z elektronami anihilują, dając parę fotonów o energii 511 keV każdy, rozbiegających się w przeciwne strony.
Jeżeli dwa umieszczone naprzeciwko siebie fotopowielacze jednocześnie rejestrują fotony, to wyznaczają one prostą przecinającą komórkę, w której nastąpiła emisja.
Komputer zbierający dane tworzy mapę intensywności powstawania pozytonów.
Obserwowany rozkład emisji pozwala ustalić tempo zużywania tych molekuł przez poszczególne komórki, co jest miarą ich metabolizmu.
Nadmierny metabolizm może wskazywać na nowotworowe przerzuty, choroby neurologiczne, jak choroba Alzheimera, a także pozwala a także pozwala obserwować różnice w aktywności neuronów podczas pracy mózgu.
W Polsce znajdują się dwa tomografy pozytonowe: w Centrum Onkologii w Bydgoszczy i Centrum Onkologii w Gliwicach
Pozytonowy tomograf emisyjny
Badanie przy użyciu emisyjnej tomografii pozytonowej
Detekcja i rekonstrukcja obrazu w PET
Technika tomografii emisji pozytonów (PET) jest nowym i dynamicznie rozwijającym się narzędziem medycyny nuklearnej pozwalającym obrazować metaboliczne zmiany narządów i tkanek.
Metoda ta posługuje się radioizotopami β+ promieniotwór-czymi takimi jak: 11C, 15^O, 13^N, 18^F, 82^Rb, 68^Ga. Najpowszechniej stosowany ze względu na czas połowicznego rozpadu (108 min) jest izotop 18F produkowany akceleratorowo.
Tory detekcyjne dla wszystkich radioizotopów są jednakowe, gdyż rejestrujemy fotony o tej samej energii 511 keV.
Podczas przemiany β+ z jądra izotopu znakującego farmaceutyk emitowany jest pozyton i neutrino elektronowe.
Podczas gdy neutrino przechodzi przez ciało pacjenta bez oddziaływania, pozyton w tkance pacjenta przebywa drogę ok. 3 mm (zależną od energii uzyskanej w rozpadzie) do miejsca anihilacji z elektronem ośrodka.
W wyniku tego zjawiska masa elektronu i pozytonu zostaje zamieniona na dwa fotony - promieniowania anihilacyjnego (rzadziej trzy) rozchodzące się pod kątem 180º, z których każdy unosi energię równą 511 keV. Gdy dwa fotony anihilacyjne zostaną zarejestrowane w koincydencji (równoczesna rejestracja fotonów przez dwa naprzeciwległe detektory) miejsce anihilacji zostaje zlokalizowane jako punkt leżący na linii koincydencyjnej zwanej linią zdarzenia (LOR ang. line of response).
Geometria pomiarowa obrazująca lokalizację detektorów wokół ciała pacjenta oraz źródła kalibracji transmisyjnej 137Cs.
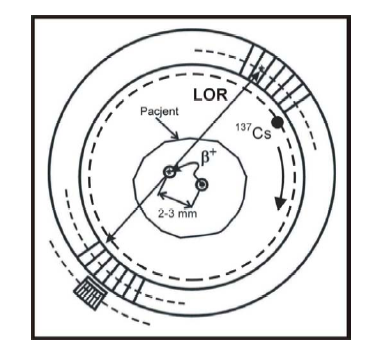
Rejestracja tych fotonów w przedziale 12 ns przyjmowana jest obecnie jako koincydencja rzeczywista.
Ta dyskryminacja czasowa wraz z dyskryminacją energetyczną rejestrowanych fotonów pozwala na pominięcie kolimacji przestrzennej i w znacznym stopniu eliminuje koincydencje przypadkowe.
Fakt, że pozytony od miejsca zgromadzenia radiofarma-ceutyku do miejsca anihilacji przebywają pewną drogę swobodną oraz że fotony anihilacyjne nie zawsze emitowane są pod kątem 180^0, lecz z dopuszczalną różnicą 0.5±0.01 (związane jest to z zachowaniem resztkowego pędu pozytonu) powoduje pogorszenie przestrzennej zdolności rozdzielczej.
Na wielkość tą wynoszącą około 3 mm (dla 18F) ma również wpływ niezbędna wielkość detektora konieczna do zdeponowania wysokiej energii fotonów.
Detektory promieniowania. Wymagania.
Detektorami wykorzystywanymi w kamerach PET są głównie detektory scyntylacyjne.
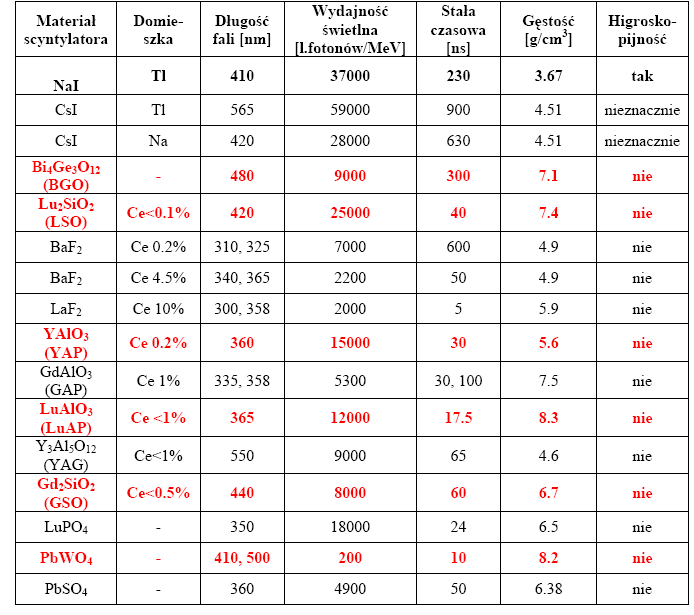
Współczesne, komercyjnie dostępne kamery PET bazują na detektorach scyntylacyjnych z użyciem kryształu Bi4Ge3O12 (BGO). Jest to kryształ o dużej gęstości właściwej (dobrze absorbujący energię), odporny mechanicznie i o relatywnie niskiej cenie, lecz charakteryzuje się długim czasem zaniku impulsu swietlnego oraz niską wydajnością świetlną.
Poszukiwania materiału optymalnego na scyntylator prowadzone są przez kilka organizacji np.: CERN, UCLA związanych głównie z fizyką wysokich energii.
Kryteriami w poszukiwaniu scyntylatorów są: wydajność świetlna, czas zaniku wyświecania, średnia droga oddziaływania pozytonu z kryształem, stosunek fotoelektronów do rozproszenia comptonowskiego, gęstość materiału, jego koszt oraz koszt wyhodowania kryształu.
Biorąc pod uwagę te techniczne aspekty najatrakcyjniejszymi wydają się być w kolejności: LSO, BGO, GSO, NaJ(Tl), PbSO4, BaF2. Obiecującymi są kryształy bazujące na lutecie: Lu2SiO2 (LSO) czy też LuAlO3 (LuAP).
Mimo, że drugi kryształ nie znalazł się pośród wymienionych jako optymalny do kamer PET, należy wspomnieć, że z początkiem 2000 roku rozpoczął się program rozwoju technologii kryształu LuAP o różnym poziomie domieszkowania cerem.
Jego wydajność świetlna jest dwukrotnie mniejsza od LSO ale pozwala na uzyskanie energetycznej zdolności rozdzielczej tak dobrej jak dla LSO (rzędu 10%). Ponadto jest on gęstszy o 10% a stała czasowa zaniku impulsu jest dwukrotnie mniejsza.
Wiele publikacji wskazuje na zainteresowanie kryształami PWO (PbWO4) o doskonale poznanych parametrach i niskiej cenie ze względu na masową produkcję dla potrzeb fizyki wysokich energii.
Scyntylator ten ma konkurencyjną gęstość właściwą, doskonałe własności czasowe. Jedynie jego wydajność świetlna jest o dwa rzędy wielkości mniejsza od LSO i wymaga polepszenia poprzez zastosowanie odpowiednich domieszek tak, aby można było wdrożyć go do zastosowań w PET.
Najważniejsze parametry kryształów
Z detektorów półprzewodnikowych największe szanse w rywalizacji ze scyntylatorami w zakresie zastosowań do PET mają związki: TeCd i TeZnCd (telurki kadmowe i telurki kadmowo cynkowe) ze względu na dużą energetyczną zdolność rozdzielczą (2% FWHM), możliwość wyhodowania dobrych jakościowo, dużych monokryształów oraz ich możliwość zastosowania w temperaturach pokojowych..
Jednakże ze względu na mniejszą gęstość właściwą, aby osiągnąć tą samą wydajność fotopiku jaką uzyskuje się w kryształach BGO przy grubości 3 cm, grubość tych materiałów powinna wynosić co najmniej 6 cm.
Drugim ograniczeniem jest zbyt duży czas rozdzielczy tych detektorów rzędu 1µs, podczas gdy kwalifikacja zdarzenia prawdziwego detekcji dopuszcza różnicę czasu rejestracji fotonów do kilku nanosekund
Własności systemów PET
Typowy skaner PET składa się z detektorów scyntylacyjnych ułożonych w wielu pierścieniach. Taka geometria pomiarów pozwala na równoczesne zebranie danych z wielu płaszczyzn obrazowych.
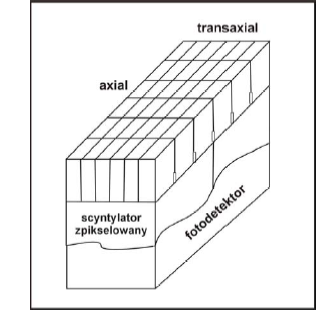
Pojedynczy blok detektorowy ponacinany jest w celu ograniczenia dyfuzji światła a przez to umożliwienie uzyskania pozycjoczułej detekcji, tworząc matrycę 6x6 (GE) lub 7x8 (Siemens) detektorów.
Impulsy światła pochodzące z pojedynczych scyntylatorów zbierane są zwykle przez 4 fotopowielacze (lub fotopowielacz o 4 polach) umieszczonych z tyłu bloku. Identyfikację scyntylatora, który zarejestrował foton, przeprowadza się analizując ilość światła dochodzącą do poszczególnych fotopowielaczy.
Blok 6x6 detektorów BGO (GE).
Wymiary pojedynczego scyntylatora: 8.4mm (axial), 4mm (transaxial).
Wewnętrzna średnica pierścienia 80-90 cm.
Poprzeczne pole widzenia (FOV) 50 cm.
Podłużne pole widzenia (AFOV) 15-25cm.
Liczba pierścieni 18-32 Liczba pól obrazowych 35-63.
Liczba detektorów na pierścień 600-800.
Wymiar detektora 3x6x30 mm 4x8x30 mm.
Blok 6x6 detektorów BGO (GE). Wymiary pojedynczego scyntylatora: 8.4mm (axial), 4mm (transaxial).
Ogólne gabaryty i dane konstrukcyjne kamery PET .
Współczesne skanery PET są przystosowane do obrazowania 3D poprzez usunięcie przegród separujących pomiędzy scyntylatorami rozszerzając pole widzenia do wszystkich pierścieni i podnosząc liczbę zliczeń. Powoduje to jednak pogorszenie stosunku sygnału do szumu.
W celu poprawy jego wartości zawęża się czas koincydencji oraz dyskryminuje się scyntylacje leżące poza głównym fotopikiem. W obrazowaniu koincydencje rejestrowane są w obrębie tego samego pierścienia, dopuszczalne jednakże są koincydencje w pierścieniach sąsiadujących.
Problemem w obrazowaniu jest promieniowanie rozproszone, które stanowi 40-60% rejestrowanych koincydencji. Rozproszone fotony dodają się do szumu w obrazie PET pogarszając kontrast szczególnie w obszarach o dużym gromadzeniu znacznika np.: mózg, wątroba, pęcherz.
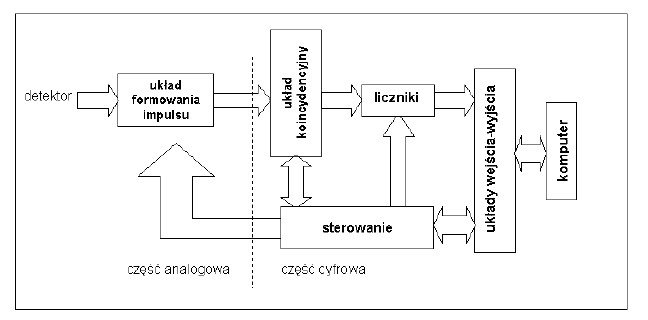
Schemat blokowy układu elektroniki "front-end", część analogowa: przedwzmacniacz, układ kształtujący, dyskryminator amplitudy
Korekcja osłabienia fotonów.
W celu określenia współczynnika osłabienia fotonów anihilacyjnych w ciele pacjenta (w wyniku zjawisk - absorbcji fotoelektrycznej i rozproszenia Comptona) używa się zewnętrzne źródło pojedynczych fotonów - 137Cs o energii: 662 keV (T1/2=30.1 lat), które rotuje wokół pacjenta.
Współczynnik ten określany jest wzdłuż każdej linii koincydencyjnej (LOR). Wykorzystanie izotopu Cs jako źródła transmisyjnego znacznie skraca czas trwania skanów transmisyjnych.
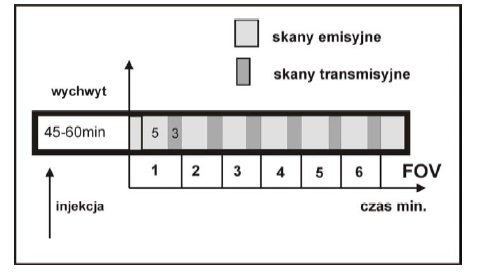
Powoduje to podział czasu badania pacjenta pomiędzy sekwencją transmisyjną (3 min.) od źródła 137Cs oraz emisyjną (5 min.) fotonów z anihilacji e- i e+ z obrazowanej tkanki.
Podział czasu badania pacjenta pomiędzy sekwencją transmisyjną (3 min.) od źródła 137Cs oraz emisyjną (5 min.) fotonów z anihilacji e- e+ z obrazowanej tkanki
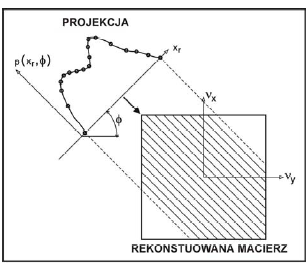
Najczęściej używaną metodą rekonstrukcji obrazu oprócz metod iteracyjnych i całkowitej transformacji Fouriera jest metoda analityczna wykorzystująca algorytm wstecznej projekcji BP (ang. backprojection).
Polega ona na tym, że wszystkim pixelom dającym wkład do danej projekcji przypisujemy wartości równe projekcji. Procedurę tą przeprowadza się dla wszystkich kątów φ uzyskując obraz sumacyjny.
Rekonstrukcja obrazu metodą wstecznej projekcji wymaga użycia projekcji 1D poddanych filtracji. Algorytm łączący te dwa ważne kroki rekonstrukcji obrazu to filtrowana projekcja wsteczna FBP (filtered backprojection).
Po poddaniu odwrotnej transformacie Fouriera wstecznie zrzutowanych filtrowanych profili uzyskujemy macierz obrazującą rozkład 2D znacznika.
W obrazowaniu 3D spotykamy się z nadmiarem danych (już zbiór danych 2D jest wystarczający do rekonstrukcji obrazu rozkładu znacznika f(x,y,z)).
Jednak należy pamiętać, że celem użycia nadmiarowych projekcji danych (kąt θ0 - kąt między płaszczyzną prostopadłą do długiej osi ciała pacjenta a kierunkiem zdarzenia) jest redukcja szumu statystycznego w rekonstrukcji obiektu.
Rozkład f(x,y,z) jest superpozycją transformat Fouriera na projekcjach poddanych filtracji przy wszystkich kątach φ i θ.
Zasada rekonstrukcji metodą filtrowanej wstecznej projekcji FBP
Podsumowanie
Badanie PET umożliwia lokalizację zmian funkcjonalnych w ciele pacjenta.
Dobrze ugruntowane jest stosowanie radiofaramaceutyku fluorodeoksyglukozy (18FDG), dla którego przestrzenna zdolność rozdzielcza wynosi około 3mm.
Nanosekundowa technika detekcji koincydencji oraz wysokowydajne ciężkie scyntylatory o krótkim czasie świecenia wraz z układami scalonymi elektroniki front-end dostarczają danych pomiarowych o lepszym stosunku sygnału do szumu.
W standardowym protokole skaningu całego ciała, dorosłemu pacjentowi podaje się dożylnie aktywność około 10 mCi (370 MBq). Jest to dawka całkowita: 0.027 mSv/MBq, aktywność ta odpowiada dawce na całe ciało ok. 10 mSv.
Najważniejsze znaczniki pozytonowe, ich otrzymywanie i kontrola jakości
Znacznik promieniotwórczy w konkretnej postaci nazywany jest radiofarmaceutykiem.
“Postacią” może być lek doustny lub parenteralny, jest to dowolny związek chemiczny zawierający izotop promieniotwórczy.
W projektowaniu radiofarmaceutyków uwzględnia się fakt, że wychwyt tkankowy znacznika zależy od jego formy chemicznej, a tę dobiera według spodziewanego mechanizmu wychwytu.
Każdy radiofarmaceutyk dopuszczony do praktyki klinicznej musi spełniać bardzo rygorystyczne normy jakości. Normy te są określone w światowych farmakopeach i okresowo aktualizowane.
Rygoryzm norm wynika z faktu, że od jakości radiofarmaceutyku zależy zarówno wiarygodność diagnozy, jak też bezpieczeństwo pacjenta i jego otoczenia.
Kryteria jakości radiofarmaceutyków obejmują ogólnie przyjęte kryteria jakości analogicznej postaci zwykłych leków, a dodatkowo - specyficzne wymagania dotyczące znacznika.
Kryteria te zostaną podane dalej, tutaj zaś zostanie tylko podkreślone, że od kilku parametrów jakości zależy rozkład znacznika w ciele pacjenta, a stąd czytelność obrazu oraz potencjalne i realne obciążenie radiacyjne pacjenta.
Niektóre parametry jakości wpływają także na stopień radiacyjnego narażenia personelu medycznego.
Najważniejsze znaczniki pozytonowe
Tomografia pozytonowa polega na detekcji fotonów pochodzących z anihilacji par pozyton-elektron.
Najważniejszymi znacznikami pozytonowymi są lekkie izotopy węgla, azotu i tlenu: 11^C, 13^N i 15^O, nazywane niekiedy znacznikami “organicznymi” ze względu na rolę biologiczną wymienionych pierwiastków.
Do tej grupy dochodzi jeszcze “prawie organiczny” fluor 18F, którego stabilny izotop nie występuje wprawdzie w sposób naturalny w organizmach żywych, ale atom fluoru kowalencyjnie związany z atomem węgla w cząsteczce związku organicznego z powodzeniem symuluje niektóre właściwości związanej kowalencyjnie grupy -OH, także wodoru i grupy -CH3.
Właściwości najważniejszych znaczników pozytonowych
Preparatyka radiofarmaceutyków
W procesach wytwarzania radiofarmaceutyków można wyróżnić następujące etapy:
przygotowanie substratów
otrzymanie znacznika (reakcja jądrowa)
wydzielenie znacznika z tarczy
synteza związku znakowanego
preparatyka radiofarmaceutyku
sterylizacja finalna
kontrola jakości “przed” i kontrola jakości “po” wysyłce.
Otrzymywanie znaczników pozytonowych:
Niemal wszystkie znaczniki pozytonowe otrzymuje się w bezpośrednich reakcjach jądrowych, w których stabilne jądra (“tarcze”) są aktywowane (“bombardowane”) cząstkami lżejszymi od tarczy (“pociskami”).
W skali mikroskopowej, końcowym produktem takiego oddziaływania jest jądro promieniotwórcze oraz jedna lub więcej cząstek wyraźnie lżejszych od głównego produktu.
Schemat reakcji jądrowej zapisuje się podobnie jak równanie reakcji chemicznej:
“tarcza” + “pocisk” ® produkt + cząstki wtórne
czyli:
A + x ® B + y1 + y2 + ...,
a najczęściej używanym zapisem jest skrót: A(x, y)B .
W tej konwencji najważniejsze reakcje otrzymywania 11^C, 13^N, 15^O i 18^F zapisuje się jako: 14^N(p,ၡ)11^C, 16^O(p,ၡ)13^N, 14^N(d,n)15^O, 18^O(p,n)18^F. Symbole w nawiasach oznaczają: p - protony, n - neutrony, d - jądra deuteru, ၡ - jądra helu 4^He.
W praktyce realizuje się takie reakcje przy energiach rzędu 10-20 MeV, najczęściej w małych cyklotronach, zaprojektowanych specjalnie na potrzeby produkcji znaczników pozytonowych.
Należy zwrócić uwagę na wieloznaczność słowa “tarcza”, które jest tutaj używane w znaczeniu mikroskopowym (bombardowane jądro) lub makroskopowym (zbiór takich jąder w odpowiedniej postaci chemicznej i stanie skupienia).
Określenia “tarcza” używa się także w znaczeniu całej odrębnej konstrukcji, którą montuje się w cyklotronie w celu poddania działaniu przyspieszonych cząstek.
Postać i skład tarczy w drugim z podanych znaczeń wpływa na czystość radionuklidową, a także na postać chemiczną znacznika. Czystość radionuklidowa produktu może zależeć zarówno od izotopowej jak i chemicznej czystości tarczy.
I tak np, jeżeli woda ciężkotlenowa H218^O, z której ma być otrzymany 18^F w reakcji 18^O(p,n)18^F, nie jest czysta izotopowo, czyli zawiera znaczącą domieszkę wody “zwykłej” H216^O, to w czasie aktywacji protonami oprócz pożądanej reakcji jądrowej zachodzi w niej także reakcja konkurująca, 16^O(p,ၡ)13^N, prowadząca do otrzymania mierzalnych ilości azotu 13^N.
Z kolei, chemiczne zanieczyszczenie tarczy CO2 stabilnym azotem 14^N2, powodowałoby, że w aktywacji deuteronami, oprócz pożądanego 13N, powstającego w reakcji 12^C(d,n)13^N, tworzyłby się również tlen 15^O w reakcji 14^N(d,n)15^O.
W obu przypadkach, aktywności cennych skądinąd znaczników 13^N lub 15^O są tutaj bezużyteczne, natomiast niepotrzebnie podwyższają tło w pracowni izotopowej, zwiększając zagrożenie radiacyjne dla personelu.
Ogólną zasadą w technice jądrowej jest dążenie do maksymalnej czystości tarczy z powodów podanych wyżej, a także dlatego, że niektóre zanieczyszczenia chemiczne tarczy (zwłaszcza gazy resztkowe w tarczy neonowej do produkcji 18^F) “wyłapują” znacznik tak, że staje się on niedostępny jako radiofarmaceutyk.
Z drugiej strony, kontrolowane chemiczne domieszkowanie tarczy może spowodować, że wczesne etapy syntezy związku znakowanego będą zachodzić już w trakcie aktywacji tarczy, co pozwala znacznie skrócić czas preparatyki.
Jest to szczególnie ważne w przypadku związków 11C. Syntezie wygodnych prekursorów radiofarmaceutyku już w tarczy sprzyja fakt, że atomy nowego pierwiastka powstające w wyniku reakcji jądrowej mają silnie zaburzoną strukturę elektronową, a więc występują w bardzo reaktywnych formach chemicznych (atomy gorące).
Reakcje otrzymywania znaczników “organicznych”
Obróbka chemiczna:
Kolejne aspekty kontroli jakości radiofarmaceutyków są “wbudowane” w proces syntezy poprzez jakość użytych do tego chemikaliów oraz przez konstrukcję aparatury.
Reakcje syntezy chemicznej realizuje się zazwyczaj w komercyjnych, zdalnie sterowanych aparatach do syntez, gdzie prowadzone są następujące procesy jednostkowe:
- wydzielenie znacznika z tarczy (czystego lub w formie prekursora do dalszej syntezy)
- synteza związku znakowanego (często w kilku etapach)
- preparatyka żądanej postaci farmakopealnej.
Syntezatory umieszczane są w boksach osłonnych. Z powodu ograniczonej możliwości obserwacji przez wzierniki boksów, wszystkie nowoczesne syntezatory mają komputerowy system wizualizacji i kontroli przebiegu syntezy.
Każdy kolejny proces jednostkowy jest odwzorowany na ekranie komputera i weryfikowany przez pomiar aktywności znacznika w istotnym punkcie syntezy (odbieralniku, reaktorze, kolumnie chromatograficznej itp.). Pozostałe etapy kontroli jakości odbywają się poza syntezatorem.
Czystość biologiczna, czyli sterylność i apyrogenność.
To kryterium dotyczy radiofarmaceutyku jako całości, czyli związku znakowanego i wszystkich substancji pomocniczych. Jest to chyba jedyny parametr jakości radiofarmaceutyków, który nie ma bezpośredniego wpływu na wiarygodność diagnozy metodą tomografii pozytonowej, natomiast ma zasadnicze znaczenie dla zdrowia pacjenta.
Ponieważ praktycznie wszystkie radiofarmaceutyki pozytonowe są podawane pozajelitowo, kryterium ich czystości biologicznej jest takie samo, jak dla wszystkich innych leków parenteralnych.
Często spotyka się pytanie: czy radiofarmaceutyk nie sterylizuje się sam swoim własnym promieniowaniem?
Otóż nie, gdyż dawka promieniowania zapewniająca skuteczną sterylizację byłaby szkodliwa dla pacjenta. Tak więc, wiele radiofarmaceutyków sterylizuje się termicznie w pojemnikach finalnych, a gdy z przyczyn czasowych lub z powodu nietrwałości chemicznej związku jest to niemożliwe, używa się filtrów bakteryjnych o średnicy porów 0,22ၭ.
W tym ostatnim przypadku wymagana jest koniecznie praca w sterylnej atmosferze (w komorach z laminarnym przepływem powietrza) oraz bezwarunkowe stosowanie sterylnych substratów i narzędzi.
Czystość radiochemiczna
Czystość radiochemiczną znacznika określa się jako stosunek aktywności jego nominalnej formy chemicznej do aktywności wszystkich form znacznika w radiofarmaceutyku. Uważa się, że wielkość ta powinna wynosić powyżej 95%, najlepiej 98-99%.
Przyczyną obniżonej czystości radiochemicznej może być np. hydroliza, izomeryzacja albo rozkład związku znakowanego.
Są to oczywiście zjawiska niepożądane, gdyż zanieczyszczenia radiochemiczne, z reguły wychwytywane tkankowo inaczej niż substancja główna, mogą zniekształcać obraz tomograficzny.
Obecność niektórych form radiochemicznych może też prowadzić do zbytniego obciążenia radiacyjnego narządów krytycznych.
Czystość chemiczna
Przez czystość chemiczną rozumie się nieprzekroczenie maksymalnego dopuszczalnego stężenia śladowych niepromieniotwórczych domieszek chemicznych w preparacie radiofarmaceutyku. Może tu chodzić zarówno o domieszki organiczne, jak też nieorganiczne.
Normy farmakopealne określają dokładnie dopuszczalne stężenia śladowych zanieczyszczeń metalicznych w wodzie do injekcji i w preparatach parenteralnych.
Najostrzejsze normy dotyczą toksycznych metali ciężkich: Pb, Hg, Cd, As, nieco szerszy margines dopuszczalnych stężeń zostawia się dla jonów innych metali, np. Mn, Cr, Fe, Zn.
Jeśli chodzi o toksyczne zanieczyszczenia organiczne, to ich rodzaj i dopuszczalne stężenia są określane w indywidualnych monografiach farmakopealnych. Na przykład dla 18FDG syntetyzowanej metodą addycji nukleofilowej określa się dopuszczalne stężenia śladów ciekłego wymieniacza jonów 18F- - kryptofixu oraz rozpuszczalnika - acetonitrylu .
“Wbudowanie” czystości chemicznej w preparatykę radiofarmaceutyku polega przede wszystkim na przygotowywaniu wszystkich potrzebnych roztworów wodnych przy użyciu wody do injekcji o gwarantowanej czystości oraz na stosowaniu odpowiednich metod chromatografii preparatywnej.
Czystość izotopowa
Ogólnie, pojęcie czystości izotopowej może dotyczyć zarówno izotopów stabilnych jak też promieniotwórczych, a o czystości izotopowej tarcz dla reakcji jądrowych mówiono już wcześniej.
W przypadku radiofarmaceutyków parametr ten określa proporcję liczby jąder znacznika i jego izotopów stabilnych, występujących w tej samej postaci chemicznej.
Widać to dobrze na przykładzie związków 11C, gdzie może chodzić o czystość izotopową znacznika w 11CO2, czyli relację liczb cząsteczek 11CO2, 12CO2 i 13CO2 w mieszaninie gazów, albo np. o liczbę cząsteczek
2-[^11C]guanidyny w relacji do liczby cząsteczek guanidyny C4H4N2, która w pozycji “2” ma stabilne izotopy węgla.
Na ogół dąży się do tego, aby znacznik w radiofarmaceutyku był “beznośnikowy” (ang.: carrier-free), czyli wolny od swoich izotopów stabilnych. Byłaby to sytuacja idealna z punktu widzenia konkurencji różnych izotopów o miejsca wychwytu tkankowego. Jednakże, “beznośnikowy” oznacza: “obecny w ilościach submikrowagowych”.
Substancje w takich ilościach nie tylko są wybiórczo wychwytywane w tkankach, ale także łatwo adsorbują się na różnych częściach aparatury chemicznej, skąd czasami trudno je odzyskać.
Aby zapobiec wynikającym stąd stratom aktywności, znaczniki pozytonowe często celowo rozcieńcza się izotopowo na najwcześniejszym etapie syntezy związku znakowanego.
Tak rozcieńczony znacznik nazywa się po angielsku carrier added (“z dodatkiem nośnika”).
Celowe rozcieńczenie izotopowe stosuje się z zasady przy produkcji 18F z neonu: do tarczy dodaje się niewielką domieszkę stabilnego fluoru, który konkuruje z 18F o centra adsorpcji na ściankach. Otrzymywany w ten sposób znacznik ma nukleofilową postać F2, a ściślej - 19F18F.
Aktywność całkowita i aktywność właściwa
Aktywność nuklidu promieniotwórczego jest definiowana jako liczba rozpadów jądrowych na jednostkę czasu. W układzie SI jednostką aktywności jest bekerel (Bq), czyli 1 rozpad na sekundę.
Starą, często jeszcze używaną jednostką jest kiur (Ci) czyli : 3,7 x 1010 Bq (37 GBq).
Protokoły diagnostyczne określają, jaka aktywność całkowita może i powinna być użyta w badaniu tomograficznym.
Całkowitą aktywność porcji radiofarmaceutyku wysyłanej do kliniki kalibruje się na dany dzień i godzinę za pomocą wycechowanej komory jonizacyjnej.
Czystość radionuklidowa
Przez czystość radionuklidową rozumie się proporcję aktywności znacznika do aktywności innych nuklidów promieniotwórczych w preparacie.
Jest to pojęcie mylone czasami z pojęciem czystości izotopowej, ale proszę zwrócić uwagę, że w przypadku czystości izotopowej zawsze chodzi o izotopy jednego pierwiastka, które mogą a nie muszą być promieniotwórcze, natomiast w przypadku czystości radionuklidowej interesujemy się wszystkimi izotopami promieniotwórczymi obecnymi w danej postaci radiofarmaceutyku.
Idealną sytuacją jest 100%-owa czystość radionuklidowa.
Kontaminanty radionuklidowe muszą być eliminowane z radiofarmaceutyku, gdyż:
-zwiększają obciążenie radiacyjne organizmu pacjenta
stwarzają dodatkowe zagrożenie radiacyjne dla personelu medycznego
-niepotrzebnie obciążają układ detekcyjny
-mogą powodować artefakty w obrazie PET.
Jedną z metod usuwania kontaminantów jest po prostu “wystudzenie” preparatu (ang. cooling down), czyli odczekanie, aż krótkotrwałe zanieczyszczenia ulegną rozpadowi.
Drugim sposobem, realnym gdy kontaminanty są izotopami różnych pierwiastków, są chemiczne metody rozdziału.
Jednakże, żadna z tych dróg nie jest korzystna w przypadku bardzokrótkożyciowych “organicznych” znaczników pozytonowych, bo wiąże się z dużymi stratami użytecznej aktywności.
Poza tym, nawet jeżeli usunięcie obcych radionuklidów jest względnie łatwe i szybkie, to konieczność wykonania takiej pracy niepotrzebnie zwiększa narażenie radiacyjne personelu.
Czystość radionuklidową sprawdza się za pomocą spektrometrii gamma, która pozwala zidentyfikować poszczególne nuklidy na podstawie ich charakterystycznych emisji fotonów (anihilacja 511 keV).
Retrospektywna kontrola jakości radiofar-maceutyków.
Bardzo często zdarza się tak, że ze względu na ubytek aktywności znacznika, radiofarmaceutyk pozytonowy musi być podany pacjentowi zanim zostaną zakończone wszystkie procedury analityczne.
W takich właśnie razach wykonuje się retrospektywną kontrolę jakości, której poddaje się próbkę radiofarmaceutyku pobraną z tej samej szarży produkcyjnej, a więc otrzymaną i sterylizowaną w tych samych warunkach.
Zakłada się, że przy odpowiednim pobraniu próbki, wszystkie jej parametry będą identyczne z parametrami radiofarma-ceutyku użytego w klinice, a więc, że wyniki analiz będą reprezentatywne dla preparatu podanego pacjentom.
Podsumowanie
Otrzymywanie radiofarmaceutyków znakowanych emiterami pozytonów jest złożoną sekwencją przygotowań, wieloetapowej preparatyki oraz procedur kontroli jakości.
Warunkiem koniecznym zapewnienia wymaganej jakości produktów jest stosowanie substratów o odpowiedniej jakości oraz ścisłe przestrzeganie odpowiedniego postępowania.
Infrastruktura
Rys historyczny a perspektywy
Dzisiejsze metody otrzymywania i kontroli jakości radiofarmaceutyków są efektem dorobku fizyki i chemii jądrowej oraz innych nauk, zapoczątkowanego kilkadziesiąt lat temu.
Na przykład, pierwsze dane fizyczne dla prowadzonych dziś rutynowo reakcji jądrowych datują się z pierwszej połowy XX wieku.
Z kolei w dziedzinie chemii, najbardziej dynamiczny rozwój metod syntezy radiofarmaceutyków pozytonowych, zwłaszcza związków znakowanych węglem 11C, przypadł na przełom lat 1970-1980.
Niezależnie, w ciągu wielu lat rozwijały się techniki detekcji promieniowania, metody chemii analitycznej oraz technologia tarcz.
Wbrew wcześniejszym oczekiwaniom, nie chemia związków węgla 11C odegrała największą rolę w rozwoju tomografii pozytonowej.
Obecnie kliniczną praktykę PET zdominował 18F - znacznik “organiczny” o najdłuższym okresie półrozpadu, a w szczególności jego związek - 2-[18F]-2-fluoro-deoksyglukoza.
Współczesne prace badawcze związane z otrzymywaniem i kontrolą jakości znaczników dla tomografii pozytonowej idą w wielu kierunkach.
Badania z pogranicza biologii i chemii dążą do projektowania nowych radiofarmaceutyków, zwłaszcza adresowanych do konkretnych receptorów.
Przez wiele lat, mimo wysiłków, a nawet niewątpliwych (czasem niedocenianych) osiągnięć poszczególnych osób i całych grup badawczych, Polska nie była w stanie wypracować, a tym bardziej wdrożyć, własnych oryginalnych technologii współpracujących z PET.
Również przez wiele lat nie było nikogo stać na wprowadzenie gotowych rozwiązań tomografii pozytonowej do praktyki klinicznej.
Od jakiegoś czasu tomografia pozytonowa jest propagowana przez wszystkie polskie towarzystwa naukowe związane z techniką jądrową, a polskie uczelnie medyczne od lat prowadzą kursy medycyny nuklearnej, których programy obejmują przynajmniej podstawowe zagadnienia dotyczące PET.
Cyklotrony do produkcji znaczników pozytonowych
Do wytwarzania radionuklidów (w tym znaczników stosowanych w tomografii pozytonowej - PET) nadaje się w zasadzie każdy akcelerator przyspieszający protony, deuterony i cząstki α (He) w zakresie energii 10-40 MeV, przy prądzie wiązki jonów rzędu 20 µA. 42Powyższe warunki spełniają akceleratory typu cyklotron.
Dlatego od połowy lat 70-tych różne firmy na świecie rozpoczęły opracowywać cyklotrony z przeznaczeniem do produkcji izotopów promieniotwórczych.
Ostatnia generacja tych cyklotronów jest bardzo „zwarta” (ang.: „compact”): małe wymiary, stosunkowa prostota w budowie i obsłudze, niskie koszty eksploatacji, duża niezawodność.
CYKLOTRON
Cząstki przyspieszane: protony, deuterony
Energia wiązki: 10 - 18 MeV
Prąd wiązki - do 50 mA
Tarcze: gazowe, ciekłe
Osłony radiacyjne
Instalacja
Cyklotron RDS 111
przyspieszanie protonów
energia protonów 11 MeV
produkcja 18F (opcjonalnie 11C, 13N, 15O)
Osłony przed promieniowaniem (RDS 111)
Materiał |
Warstwa 10-krotnie osłabiająca [cm] |
|
|
Gamma |
neutrony |
Beton |
38 |
43 |
Polietylen |
80 |
24 |
Ołów |
5 |
- |
Osłony cyklotronu RDS 111
Budowa modułowa
Beton z domieszkami: polietylen, ołów, związki boru - zawartość wodoru
~ 90% wody
Elementy ołowiane
Elementy wykonane z polietylenu
Wyniki pomiarów dozymetrycznych
Sterownia cyklotronu: ~ 1 mSv/h
Laboratorium produkcji radiofarmaceutyków 0.4 mSv/h
Pokój aplikacji (pacjent po podaniu 500 MBq) ~ 100 mSv/h
Wyniki pomiarów dozymetrycznych
Pozycjonowanie pacjenta 70 mSv/h
Sterownia PET/CT 0.5 mSv/h
Pacjent - dawka/badanie Pacjent dorosły :
Aktywność podana 500 MBq
Dawka efektywna - 10 mSv
Narządy krytyczne: pęcherz - 80 mSv, serce - 30 mSv
Pacjent - dawka/badanie dziecko
Wiek dziecka |
5 lat |
10 lat |
Dawka efektywna |
12.5 mSv |
12 mSv |
Dawka (pęcherz) |
80 mSv |
90 mSv |
Dawka (serce) |
50 mSv |
40 mSv |
A Firmy, które w ostatnich dziesięcioleciach produkowały małe cyklotrony, w tym medyczne (niektóre do zainstalowania w klinikach):
Scanditronix (teraz General Electric) - Szwecja, Cyklotrony serii MC32 NI,
The Cyclotron Corporation (TCC) - USA, Cyklotrony serii CP 42 (42 MeV),
Computer Technology and Imaging (CTI) - USA, Cyklotrony serii RDS 111 i RDS 112,
EBCO Technologies z Instytutem TRIUMF (Vancouver) - Kanada, Cyklotrony serii TR13, TR 19/8, TR30,
Firma japońsko-francuska (SUMITOMO - CGR MeV), Cyklotrony serii 480 SHI,
Izotopy można wytwarzać w cyklotronie na wiązce wewnętrznej, tj. w komorze akceleracyjnej, z możliwością wariacji energii w pełnym zakresie, oraz na wiązce zewnętrznej, tj. wyprowadzonej z komory, najczęściej przy stałej energii przyspieszonych cząstek.
Zastosowanie w „zwartych” cyklotronach źródeł jonów produkujących ujemne jony H- i D- umożliwiło wyprowadzenie wiązki na zewnątrz praktycznie bez strat (niski poziom radiacji cyklotronu).
Krakowski cyklotron AIC-144, chociaż nie należy do najnowszej generacji, stwarza dobrą perspektywę produkowania szerokiej gamy radionuklidów medycznych, w tym oczywiście też znaczników pozytonowych.
Główne parametry cyklotronu AIC-144
Średnica nabiegunników 144 cm
Struktura magnetyczna 4 sektory o kącie spirali od 450 do 540
Średnie pole magnetyczne 8,5 do 18 kGs
Prąd uzwojenia głównego 0 ÷ 700 A
Liczba cewek korekcyjnych (koncentrycznych) 20
Liczba cewek azymutalnych 4
Zakres prądów zasilających cewki ± 400 A
Ilość duantów 1 (α = 1800 )
Częstotliwość generatora w.cz. 10÷27 MHz
Moc generatora 120 kW
Maksymalne napięcie na duancie 50 kV
System ekstrakcji wiązki - metoda precesji orbit: 3 deflektory 3 pasywne kanały magnetyczne 4 cewki harmoniczne
Efektywny współczynnik ekstrakcji około 70%
Źródło jonów wewnętrzne,
Współczynnik akceleracji k = 60
Zakresy energii cząstek:
Protony: 20 ÷ 60 MeV
Deuterony: 15 ÷ 30 MeV
Cząstki α: 30 ÷ 60 MeV
23
2,1
4,15 dni
124I
3,1
3,6
122I
2,5
53
94mTc
0,6
109,7
18F
1,7
2,03
15O
1,2
9,96
13N
1,0
20,38
11C
Emax +, MeV
t1/2, min.
Nuklid
18F19F
natNe g, 90,51%20Ne+0,1%19F2
20Ne(d, )18F
F2 (18F19F)
18O g, wzbogacenie: 95%18O
18F-
H218O c, wzbogacenie: 95%18O
18O(p,n)18F
18F
15O16O
99%natN2 + 1% 16O2
14N(d,n)15O
15O
13NO3-,13NO2-
H216O ciecz, 99,762%16O
16O(p, )13N
13NH3
12CH4 gaz
13N2
12CO2 gaz
12C(d,n)13N
13N
11CO, 11CO2
14N (O2)
H11CN, 11CH4
natN2 gaz, 99,6%14N (0,1-5%H2)
14N(p, )11C
11C
Produkt
Tarcza
Reakcja
Nuklid
Wyszukiwarka
Podobne podstrony:
Tomografia pozytonowa 2
TOMOGRAFIA POZYTONOWA 1
Pozytonowa Tomografia Emisyjna, biofizyka
Pozytonowa emisyjna tomografia komputerowa (PET) 97 03
Pozytonowa tomografia komputerowa pet, radiologia
PET pozytonowa tomografia emisyjna
Pozytonowa Tomografia Emisyjna, biofizyka
Pozytonowa emisyjna tomografia komputerowa (PET) 97 03
Pozytonowa tomografia emisy
PROMIENIOWANIE JONIZUJACE I POZYTONOWA EMISYJNA TOMOGRAFIA KOMPUTEROWA
Positron emission tomography slides
TOMOGRAFIA KOMPUTEROW1, V rok, Radiologia
TOMOGRAF, WYKLAD3, Pojęcia wstępne
TOMOGRAFIA KOMPUTEROWA
tomografia MRI
Zasada działania emisyjnego tomografu komputerowego
Tomografia magnetyczno- rezonansowa, Pielęgniarstwo licencjat cm umk, I rok, Radiologia
10 Podstawowa matematyka rekonstrukcji tomograficznych
więcej podobnych podstron