|
OTRZYMYWANIE I BADANIE WŁASNOŚCI KWASÓW KARBOKSYLOWYCH.
|
WWNiG |
|
|
|
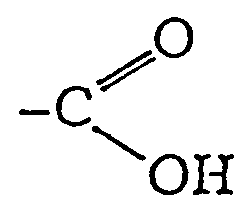
Kwasy monokarboksylowe:
Posiadają jednowartościową grupę która składa się z grupy karbonylowej i grupy hydroksylowej
Węgiel grupy karboksylowej może być połączony z rodnikiem alkilowym lub arylowym
Nomenklatura
Nazewnictwo zwyczajowe związane jest z pochodzeniem kwasów np. kwas mrówkowy, octowy, masłowy.
W nomenklaturze systematycznej nazwy kwasów tworzy się od węglowodorów o tej samej liczbie atomów węgla przez dodanie końcówki -owy.
![]()
kwas mrówkowy -kwas metanowy ![]()
kwas octowy kwas ctanowy
Podział kwasów Karboksylowych:
1) ze względu na budowę rodnika wyróżnia się kwasy;
alifatyczne: nasycone i nienasycone;
cykloalifatyczne
aromatyczne
2. ze względu na ilość grup karboksylowych: monokarboksylowe, dikarboksylowe, trikarboksylowc itd.
^
Otrzymywanie
1. Utlenianie alkoholi I-rzędowych i aldehydów.
Kwasy karboksylowe otrzymuje się w wyniku utleniania alkoholi I-rzędowych lub aldehydów
2. Utlenianie alkenów.
R-CH=CH-R + 2O2 → 2R-COOH
3. Hydroliza estrów i amidów.
Właściwości fizyczne:
Pierwsze trzy kwasy w szeregu homologicznym alifatycznych kwasów monokarboksylowych są cieczami, mieszają się z wodą w każdym stosunku, odznaczają się ostrymi, przenikliwymi zapachami. Kwasy zawierające w cząsteczkach 4-9 atomów węgla w wodzie są słabo rozpuszczalne, mają ostre, nieprzyjemne zapachy. Kwasy powyżej dziesięciu węgli w cząsteczce są przeważnie ciałami stałymi.
Własności kwasu octowego.
Wśród kwasów alkanowych najszersze zastosowanie ma kwas octowy. Jest on produkowany na bardzo dużą skalę, przez utlenianie aldehydu octowego. W przemyśle chemicznym służy do produkcji tworzyw sztucznych, rozpuszczalników oraz wiclu związków będących półproduktami do syntezy bardziej złożonych substancji, takich jak leki, środki ochrony roślin itp. Ma on również duże zastosowanie w gospodarstwie domowym. Jego 6 lub 10% roztwór wodny nosi nazwę octu i służy do wyrobu marynat oraz jako przyprawa.
Wykonanie oznaczenia:
1. Utlenianie alkoholu etylowego do kwasu octowego
Przyrządy: łaźnia wodna, kolbka okrągłodenna o poj. 50cm3, pipeta.
Odczynniki: dwuchromian potasowy- 0,5g kwas siarkowy stężony - 2cm3, rozcieńczony roztwór alkoholi etylowego 20% -1,5 cm3
Do kolbki okrągłodennej wsypujecie naważkę 0,5g dwuchromianu potasowego i wlewamy 2cm3 stężonego kwasu siarkowego, a następnie ostrożnie wkraplamy pipetą 20% alkohol etylowy. Otrzymany roztwór bardzo ostrożnie ogrzewamy na łaźni wodnej przez okres 10-15 minut. Następnie trzymając u wylotu wilgotny papierek lakmusowy należy sprawdzić zmianę barwy oraz zapach ulatniającej się pary. Mieszanina stałego dwuchromianu potasowego ze stężonym kwasem siarkowym ma znacznie silniejsze właściwości utleniające niż roztwór stosowany do otrzymywania aldehydu octowego.
C2H5OH+2O= CH3-COOH+2H2O
Wydzielający się tlen atomowy w tym przypadku utlenia alkohol etylowy do kwasu octowego
Wnioski:- papierek zabarwia się na kolor różowy co świadczy o zasadowym charakterze substancji wyjściowej
2. Otrzymywanie kwasu octowego z octanu sodowego
Przyrządy: palnik, statyw, łapa półokrągła, łącznik, probówki, rurka szklana, korek.
Odczynniki: octan sodowy- 4 g, stężony kwas siarkowy -2 cm3,
Do probówki z 4 g octanu sodowego wlewamy 2 cm3 stężonego kwasu siarkowego i zatykamy ją korkiem z wygiętą rurką pod kątem prostym. Po umocowaniu probówki w statywie wylot rurki odprowadzającej umieszczamy w pustej probówce, która spełnia role, odbieralnika . Następnie mieszaninę octanu sodowego z kwasem siarkowym ogrzewamy płomieniem palnika. Część otrzymanego produktu, po rozcieńczeniu wodą badamy papierkiem lakmusowym, a pozostałą część wiórkami magnezowymi.
Kwas siarkowy jest kwasem silniejszym, trudniej lotnym od kwasu octowego i dlatego wypiera go z jego soli:
Kwasy organiczne rozpuszczalne w wodzie, podobnie jak kwasy mineralne, barwią lakmus na różowo i reagują z niektórymi metalami.
Wnioski: w reakcja z magnezem zachodzi bardzo burzliwie z wydzielaniem się gazu.
3. Hydroliza octanu sodowego
Przyrządy: palnik, probówka, Odczynniki: octan sodowy - 2g, fenoloftaleina.
Octan sodowy należy rozpuścić w probówce w małej ilości wody i następnie ogrzewać w płomieniu palnika. Do otrzymanego roztworu dodajemy kilka kropli fenoloftaleiny i zwracamy uwagę na zmianę barwy.
Octan sodowy jest solą słabego kwasu i mocnej zasady, dlatego ulega hydrolizie
Hydrolizę można przyspieszyć przez ogrzewanie
CH3COONa + H2O = CH3COOH + NaOH
Wnioski - papierek zabarwia się na różowo co świadczy o zasadowym charakterze r-ru.
4. Reakcja kwasu octowego z wodorotlenkiem sodu
Przyrządy: probówka, palnik, szczypce Odczynniki: 5 % roztwór wodorotlenku sodu, fenoloftaleina, 10%, roztwór kwasu octowego.
Do 2 cm3 roztworu wodorotlenku sodowego należy dodać kilka kropli fenoloftaleiny, a następnie wkraplać 10% roztwór kwasu octowego. "Należy zaobserwować zmianę barwy wskaźnika.
Kwas octowy reaguje w typowy sposób z aktywnymi wodorotlenkami tworząc sole, zwane octanami.
Wnioski: na początku pojawia się róż, który się odbarwia.
5. Reakcja węglanu sodu z kwasem octowym
Przyrządy: probówka Odczynniki: l g węglanu sodu,. 10 % roztwór kwasu octowego.
Do probówki odmierzyć 2 cm310% kwasu octowego, a następnie dodać l g węglanu sodu.
Zaobserwować zachodzącą reakcję.
Wnioski: W przeprowadzonym doświadczeniu wytrącił się osad- reakcja przebiegała burzliwie z wydzielaniem CO2
Wyszukiwarka
Podobne podstrony:
1h af a5danie+zwrotu+koszt d3w+badania+rachunkowo 8cci+sp d3 a3ki 2NGGKEZF4QLCRK5AGA4OFPRROSIFPII7PM
WZORY KWAS D3W
6.4. Otrzymywanie i badanie serów
2 Otrzymywanie i badanie wlasc Nieznany (2)
OTRZYMYWANIE I BADANIE WŁAŚCIWOŚCI NANOKOMPOZYTÓW POLIOKSYMETYLEN (POM) ORGANOFILIZOWANY MONTMORYLON
Kwasy karboksylowe otrzymywanie
otrzymywanie i reakcje kwasow karboksylowych
KWASY, Otrzymywanie kwas˙w
otrzym KWASY KARBOKSYLOWE2
otrzymywanie kwas w nukleinowyc Nieznany
07 Otrzymywanie i metody badania związków koordynacyjnychid 6732 ppt
OTRZYMYWANIE AMIDOW Z KWASOW KARBOKSYLOWYCH, Materiały, Chemiczne, Chemia organiczna
otrzymywanie-i-reakcje-kwasow karboksylowych
zwi a5zek+alkoholu+i+narkotyk d3w+z+przest capczo 8cci a5+nieletnic1 3U6BYEK75RMYJ2P2CTBI6NXUSGXGY2Z
2k1 af a5danie+uznania+warto 8cci+bilansowej+udzia a3 d3w KLQHDZMA4PLKUGPEPJBSWOND5XE3JYYXC4L4PQY
więcej podobnych podstron